
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •Где м(х) – мольная масса вещества х, fэкв.(х) – фактор эквивалентности вещества х.
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •Тема 2 «растворы» лекция №3 «общие свойства растворов»
- •1 Классификация систем, состоящих из двух и более веществ
- •2 Способы выражения состава растворов
- •1) Массовая доля (ω) – отношение массы растворенного вещества к массе раствора
- •3) Равномерное распределение сольватов (гидратов) в растворителе. Является следствием диффузии и требует затраты энергии.
- •4 Растворимость
- •4.1 Растворимость газов в жидкостях. Закон Генри
- •4.2 Растворимость твердых веществ в воде
- •Лекция № 4 «растворы неэлектролитов»
- •1 Свойства растворов неэлектролитов
- •1.1 Закон Рауля
- •2) Растворенное вещество – нелетучее и не диссоциирующее на ионы.
- •1.2 Криоскопический и эбуллиоскопический законы Рауля
- •- Криоскопический закон, - эбуллиоскопический закон,
- •2 Осмос
- •3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
- •Лекция № 5 «растворы электролитов»
- •1.2 Диссоциация слабых электролитов
- •2 Закон разбавления Оствальда
- •3 PH водных растворов
- •3.1 Ионное произведение воды
- •Ионно-обменные и окислительно-восстановительные реакции
- •Лекция № 6
- •«Ионно-обменные реакции»
- •3) Образование осадков
- •4) Образование комплексных соединений
- •3 Гетерогенные равновесия в растворах электролитов.
- •Лекция № 7 «Гидролиз солей»
- •1 Общие представления о гидролизе
- •2 Различные случаи гидролиза
- •1) Гидролиз соли образованной слабым основанием и сильной кислотой
- •4) Гидролиз солей, образованных многозарядными катионами и анионами
- •5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
- •5 Смещение равновесия при гидролизе
- •5.1 Влияние добавок различных веществ на гидролиз
- •5.2 Влияние температуры на смещение гидролиза
- •5.3 Влияние концентрации гидролизующейся соли
- •Лекция № 8 «окислительно-восстановительные реакции»
- •1 Основные понятия
- •5 Взаимодействие металлов с водой, кислотами и щелочами
- •Электрохимические процессы
- •Лекция №9
- •«Гальванические элементы»
- •1 Электродный потенциал на границе металл – раствор
- •2 Принцип работы гальванического элемента
- •3 Водородный электрод сравнения. Электрохимический ряд
- •4 Уравнение Нернста
- •96500 Кл/моль),
- •5 Элементы
- •Лекция № 10 «электролиз»
- •3 Количественные расчёты в электролизе
- •4 Аккумуляторы
- •1) Свинцовый аккумулятор
- •2) Кадмиево-никелевый аккумулятор (кн)
- •3) Железо-никелевый аккумулятор (жн)
- •Лекция № 11 «коррозия и защита металлов от коррозии»
- •2.2 Гальванокоррозия
- •1) Гальванокоррозия чугуна в нейтральной среде:
- •2) Гальванокоррозия чугуна в кислой среде:
- •3) Контактная коррозия железа и меди в нейтральной среде.
- •2.3 Электрокоррозия
- •3 Способы защиты металлов от коррозии
- •3.1 Изолирование металлов от внешней среды
- •1) Гальванокоррозия оцинкованного железа в нейтральной среде
- •2) Гальванокоррозия луженого железа в кислой среде
- •3.2 Изменение состава коррозионной среды
- •3.3 Рациональное конструирование
- •3.4 Электрохимические способы защиты от коррозии
- •1) Протекторная защита.
- •2) Катодная защита.
- •Тема 5 основные закономерности протекания химических процессв лекция № 12
- •1 Энергетика химических процессов.
- •2 Закон Гесса
- •Разберем данный вопрос на примере образования из простых веществ углекислого газа. Данное превращение можно провести по реакции
- •Или через промежуточный продукт (со) в две реакции:
- •1) Реакция горения этана выражается термохимическим уравнением
- •2) Рассчитать количество тепла, необходимое для испарения 1 м3 воды.
- •9.3 Энтропия
- •9.4 Энергия Гиббса
- •Лекция № 13
- •Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •1 Скорость реакции
- •1. История развития учения о строении атома
- •1.1. Модель атома по резерфорду
- •1.2. Модель атома по бору
- •1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
- •2) Двигаясь по стационарным орбитам, электрон не излучает энергию.
- •1) Была неприменима для описания спектров атомов более сложных, чем водород;
- •2) Не могла объяснить различной интенсивности спектральных линий в спектре даже атома водорода.
- •1.3. Современные представления об атоме
- •2. Квантово–механическая модель атома
- •2.1. Квантовые числа
- •2.4. Соответствие электронных формул элементов и положением их в периодической таблице
- •3. Периодический закон и периодическая таблица д.И.Менделеева
- •3.1. Периодический закон
- •3.2.Периодическая таблица д.И.Менделеева
- •3.3 Периодичность изменения свойств элементов в периодической таблице
- •3.3.1 Радиусы атомов в периодах радиусы атомов по мере увеличения заряда ядра уменьшаются вследствие увеличения электростатического взаимодействия электронов с ядром.
- •3.3. 6 Прогнозирование свойств элементов по положению в периодической таблице
- •Лекция № 15 «Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный – один атом (донор) предоставляет электронную пару, а второй (акцептор) – свободную орбиталь.
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1.Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •5. Строение гидридов элементов II-периода
- •«Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный –
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1. Ковалентная связь – это связь между двумя атомами посредством общей электронной пары.
- •4.2. Ионная связь – это связь между противоположно заряженными ионами.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •Химия элементов
- •Лекция № 16
- •«Свойства s-элементов»
- •1. Щелочные металлы
- •2. Бериллий, магний и щелочноземельные металлы
- •3. Химические свойства s-элементов
- •4. Физико–химические свойства водорода и гелия
- •5. Физико–химические свойства воды
- •5.2. Физические свойства воды
- •5.3. Химические свойства воды
- •Лекция № 17 «жесткость воды»
- •1. Общие понятия
- •3. Единица измерения жесткости
- •4. Водоподготовка
- •5. Водоумягчение
- •1.3. Алюминий
- •1.4. Индий. Галлий. Таллий
- •2.1. Электронное строение и общая характеристика
- •2.2. Углерод и его соединения
- •2.3. Кремний
- •2.4. Германий. Олово. Свинец
- •Лекция № 19 «свойства р-элементов
- •V и VI групп»
- •1.1. Электронное строение и общая характеристика
- •1.2. Азот
- •1.3. Фосфор
- •1.4. Мышьяк, сурьма, висмут
- •2.1. Введение
- •2.2. Кислород
- •2.3. Сера
- •2.4. Сравнение свойств водородных соединений р-элементов VI группы
- •2.5. Селен. Теллур
- •Лекция № 20
- •1.1. Электронное строение и общая характеристика VII группы (галогены)
- •Галогены проявляют нечетные валентности
- •1.2 Физические свойства галогенов
- •1.3 Химические свойства галогенов
- •1.4 Водородные соединения галогенов
- •1 .5 Кислородсодержащие соединения галогенов
- •1.6 Применение галогенов
- •1.7 Положение в периодической таблице и общая характеристика р-элементов VIII группы
- •Лекция № 21
- •1. Определение комплексных соединений
- •1) Диссоциация сульфатов калия и алюминия
- •2) Дисоциация двойной соли – алюмокалиевых квасцов
- •3)Диссоциация комплексного соединения
- •2. Состав комплексных соединений
- •1) Комплексный ион – [Fe(сn)6]-3,
- •Примеры состава комплексных соединений
- •3. Номенклатура комплексных соединений
- •[Pt(nh3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
- •4. Диссоциация комплексных соединений
- •5. Реакции с участием комплексных соединений
- •5.1. Образование комплексных соединений
- •5.2. Преход от одного комплексного соединения к другому
- •5.3 Разрушение комплексного соединения
- •Лекция № 22
- •Введение
- •1.1. Физические свойства
- •1.2. Химические свойства
- •Вопрос № 3 Составьте уравнения реакций, протекающих при осуществлении следующих превращений Cu→Cu(no3)2→Cu(oh)2 →CuSo4.
- •Лекция № 23
- •Лекция № 24
- •2.1 Элементы триады железа
- •2.2 Платиновые металлы
- •Лекция 25 «органические соединения» введение
- •1) Замещения атомов водорода по связям с с–н,
- •2) Разрыва связей с–с.
- •1.2. Непредельные (ненасыщенные) углеводороды
- •Ацетилен с2н2, или сн±сн
- •2. Карбоциклические
- •2.1. Предельные циклические углеводороды
- •2.2. Ароматические углеводороды
- •3. Клыссы органических соединений
- •3.1. Галогенпроизводные
- •3.2. Спирты и фенолы
- •3.3. Простые эфиры
- •3.4. Альдегиды и кетоны
- •3.5. Карбоновые кислоты
- •3.6. Сложные эфиры карбоновых кислот. Жиры
- •3.7. Амины
- •3.8. Аминокислоты и белки
- •Лекция № 26 «полимеры» Введение
- •3.Поликонденсеционные полимеры
- •4. Структура и состояния полимеров
- •Лекция № 27 «рабочие вещества низкотемпературной техники» Введение
- •1 Моль co2 – 6·1023 молекул co2 – 44г – 22,4л(н.У.).
- •1. Хладагенты неорганического происхождения
- •1.1. Номенклатура неорганических хладагентов
- •1.2. Физические и химические свойства неорганических хладагентов
- •2. Хладагенты органического происхождения (углеводороды)
- •2.1. Строение и номенклатура
- •2.2. Физические и химические свойства
- •3. Хладагенты органического происхождения (галогенпроизводные)
- •3.2.Цепные реакции(пределы взрываемости, разрушение озонового слоя)
3.7. Амины
Эти органические соединения являются производными аммиака.

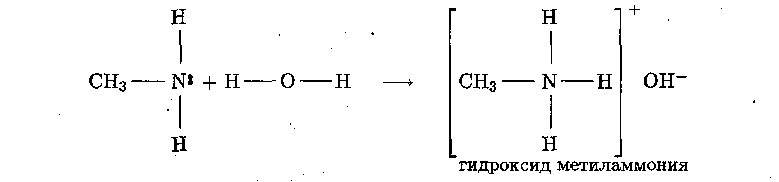
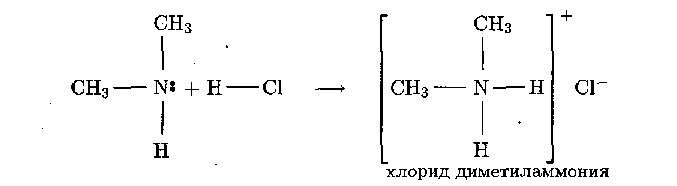
Амины представляют собой органические основания.
3.8. Аминокислоты и белки
Аминокислоты — соединения со смешанными функциональными группами, в которых содержатся аминогруппы — NH2 и карбоксильные группы — СООН.
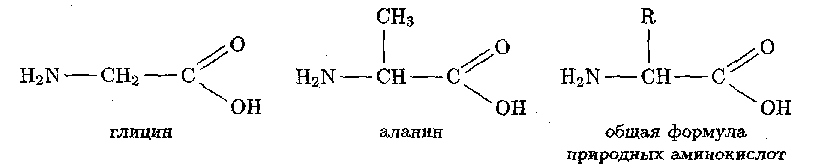
Аминокислоты — амфотерные соединения-, они образуют соли с основаниями (за счет карбоксильной группы) и с кислотами (за счет аминогруппы).
Из молекул аминокислот строятся молекулы белков, которые при гидролизе распадаются, образуя смеси аминокислот.
Белки — природные высокомолекулярные азотсодержащие органические соединения. Они играют первостепенную роль во всех жизненных процессах, являются носителями жизни.
В состав белков входят углерод, водород, кислород, азот и часто сера, фосфор, железо. Молекулярные массы, белков очень
разнообразны — от 1500 до нескольких миллионов.

В молекулах белков многократно повторяются группы атомов СО NH—; их называют амидными, или в химии белков — пептидны ми группами. Соответственно белки относят к природным высокомолекулярным полиамидам или полипептидам.
Все многообразие белков образовано 20 различными аминокислотами; при этом для каждого белка строго специфичной является последовательность, в которой остатки входящих в его состав аминокислот соединяются друг с другом. Найдены методы выяснения этой последовательности; в результате уже точно установлено строение ряда белков. И самым замечательным достижением в этой области явилось осуществление синтеза из аминокислот простейших белков: как уже указывалось, в 50—60-х годах XX века синтетически получен гормон инсулин.
Лекция № 26 «полимеры» Введение
Полимер — вещество, состоящее из многократно повторяющихся одинаковых составных звеньев.
Мономер — исходное вещество, участвующее в образовании составных звеньев полимера.
Степень полимеризации (n) — число элементарных составных звеньев (СЗ).
Обобщенная формула полимера записывается

Пластмассы — сложные композиции на базе полимера в которые вводят различные наполнители и добавки, придающие полимерам необходимые свойства.
1. КЛАССИФИКАЦИЯ ПОЛИМЕРОВ
По типу молекул и элементов:
1) неорганические,
2) органические,
3) элементоорганические полимеры.
По происхождению полимеры бывают:
1) природные — встречаются в природе. Например — натуральный каучук, крахмал, целлюлоза, белки.
2) модифицированные — измененные природные полимеры.
Например — резина, ацетатный шелк.
3) синтетические — полученные методом химического синтеза.
По характеру соединения составных звеньев:
1) линейные,
2) разветвленные,
3) лестничные,
4) трехмерные сшитые,
5) и их видоизменения (см. рис. 31.1).
По отношению к нагреванию:
1) термопластичные,
2) термореактивные.
По типу химической реакции, используемой для получения, различают полимеры:
1) полимеризационные.
Полимеризация – реакция образования полимера за счет двойных или тройных связей мономера.
2)поликонденсационные.
Поликонденсация – реакция образования полимера за счет выделения низкомолекулярных веществ (воды, аммиака, галогенводорода и др.) при соединении мономеров.
2. Полимеризационные полимеры
К полимеризационным относятся полимеры, получаемые реакцией полимеризации. Полиэтилен представляет собой полимер, образующийся при полимеризации этилена:
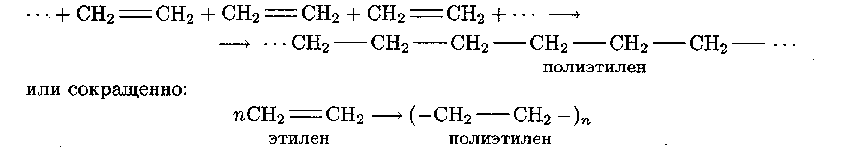
В зависимости от условий полимеризации различают три вида полиэтилена: полиэтилен высокого, среднего и низкого давления.
Полиэтилен высокого давления получают при сжатии его до 150—250 МПа при 150—250 °С. Этот полиэтилен имеет наименьшую среднюю молекулярную массу макромолекулы (около 35000) и наименьшие значения плотности, температуры размягчения. Его прочность на растяжение в 2 раза меньше соответствующей прочности остальных двух видов полиэтилена.
Полиэтилен среднего и низкого давления получают соответственно при более низком давлении, но в присутствии каталазаторов. Молекулярная масса их выше от 50000 до 800000, температурой размягчения 130 °С. Они обладает более высокой прочностью и химической стойкостью.
Для контакта с пищевыми продуктами допускается только полиэтилен высокого давления, так как он не содержит катализатор.
К недостаткам полиэтилена относятся: низкая теплопроводность, высокий температурный коэффициент объемного расширения, плохие механические свойства, недостаточная стойкость к свету, бензолу, бензину.
Полипропилен — полимер пропилена:

В зависимости от условий полимеризации получают полипропилен, различающийся по структуре макромолекул, а следовательно, и по свойствам. Отличается от полиэтилена более высокой температурой плавления и более высокой прочностью. Например, полипропилен с молекулярной массой выше 80000 размягчается при 174—175 °С. Его теплостойкость, стойкость к истиранию и поверхностная прочность значительно выше, чем у полиэтилена. Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее применяют в производстве канатов, рыболовных сетей и др. Пленки из полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию.
Основной недостаток полипропилена — низкая морозостойкость, поэтому рекомендуемая температура эксплуатации изделий из полипропилена находится в интервале от — -15 до +100 °С.
Полистирол образуется при полимеризации стирола:

Применяется как органическое стекло, для изготовления промышленных товаров (пуговиц, гребней и т. п.), в качестве электроизолятора.
Чистый полистирол быстро «стареет», имеет склонность к растрескиванию, характеризуется невысокой термической стойкостью, низкой прочностью и плохой бензостойкостью. Широкое применение находят сополимеры стирола с другими мономерами.
Поливинилхлорид (полихлорвинил):

Это эластичная белая масса, очень стойкая к действию кислот и щелочей. Хорошо растворяется в дихлорэтане и др. органических растворителях. Высокое содержание хлора обеспечивает полимеру пониженную горючесть.
Поливинилхлорид хорошо совмещается с многими органическими соединениями — пластификаторами, придающими полимеру пластичность. Полимер, не содержащий пластификатора, называется винипластом, а содержащий до 40% (масс.) пластификатора — пластикатом.
Широко используется для футеровки труб и сосудов в химической промышленности. Применяется для изоляции электрических проводов, изготовления искусственной кожи, линолеума, непромокаемых плащей.
Основными недостатками винипласта являются невысокая теплостойкость, низкая ударопрочность. С увеличением содержания пластификатора повышается морозостойкость материала, но понижается его механическая прочность, ухудшаются диэлектрические свойства.
Полиакрилаты и полиакрилонитрил.

Из них изготовляют листы прочного и легкого органического стекла.
Из полиакрилонитрила получают нитрон (или орлон) — синтетическое волокно.
Каучуки — эластичные материалы, из которых путем специальной обработки получают резину.
Натуральный (природный) каучук является полимером изопрена:

двойная связь возникает на новом месте — между атомами углерода 2 и 3.
Природный каучук содержится в млечном соке каучуконосных растений, главным образом, тропических (например, бразильского дерева гевея). Другой природный продукт — гуттаперча — также является полимером изопрена, но с иной конфигурацией молекул.
Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации — вводят в него серу и затем нагревают. Вулканизованный каучук называется резиной.
При вулканизации сера присоединяется к двойным связям макромолекул каучука и «сшивает» их, образуя дисульфидные «мостики».


Кроме полибутадиенового каучука, широко применяются сополимерные каучуки — продукты совместной полимеризации (сополимеризации) бутадиена с другими непредельными соединениями
.
