- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •Где м(х) – мольная масса вещества х, fэкв.(х) – фактор эквивалентности вещества х.
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •Тема 2 «растворы» лекция №3 «общие свойства растворов»
- •1 Классификация систем, состоящих из двух и более веществ
- •2 Способы выражения состава растворов
- •1) Массовая доля (ω) – отношение массы растворенного вещества к массе раствора
- •3) Равномерное распределение сольватов (гидратов) в растворителе. Является следствием диффузии и требует затраты энергии.
- •4 Растворимость
- •4.1 Растворимость газов в жидкостях. Закон Генри
- •4.2 Растворимость твердых веществ в воде
- •Лекция № 4 «растворы неэлектролитов»
- •1 Свойства растворов неэлектролитов
- •1.1 Закон Рауля
- •2) Растворенное вещество – нелетучее и не диссоциирующее на ионы.
- •1.2 Криоскопический и эбуллиоскопический законы Рауля
- •- Криоскопический закон, - эбуллиоскопический закон,
- •2 Осмос
- •3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
- •Лекция № 5 «растворы электролитов»
- •1.2 Диссоциация слабых электролитов
- •2 Закон разбавления Оствальда
- •3 PH водных растворов
- •3.1 Ионное произведение воды
- •Ионно-обменные и окислительно-восстановительные реакции
- •Лекция № 6
- •«Ионно-обменные реакции»
- •3) Образование осадков
- •4) Образование комплексных соединений
- •3 Гетерогенные равновесия в растворах электролитов.
- •Лекция № 7 «Гидролиз солей»
- •1 Общие представления о гидролизе
- •2 Различные случаи гидролиза
- •1) Гидролиз соли образованной слабым основанием и сильной кислотой
- •4) Гидролиз солей, образованных многозарядными катионами и анионами
- •5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
- •5 Смещение равновесия при гидролизе
- •5.1 Влияние добавок различных веществ на гидролиз
- •5.2 Влияние температуры на смещение гидролиза
- •5.3 Влияние концентрации гидролизующейся соли
- •Лекция № 8 «окислительно-восстановительные реакции»
- •1 Основные понятия
- •5 Взаимодействие металлов с водой, кислотами и щелочами
- •Электрохимические процессы
- •Лекция №9
- •«Гальванические элементы»
- •1 Электродный потенциал на границе металл – раствор
- •2 Принцип работы гальванического элемента
- •3 Водородный электрод сравнения. Электрохимический ряд
- •4 Уравнение Нернста
- •96500 Кл/моль),
- •5 Элементы
- •Лекция № 10 «электролиз»
- •3 Количественные расчёты в электролизе
- •4 Аккумуляторы
- •1) Свинцовый аккумулятор
- •2) Кадмиево-никелевый аккумулятор (кн)
- •3) Железо-никелевый аккумулятор (жн)
- •Лекция № 11 «коррозия и защита металлов от коррозии»
- •2.2 Гальванокоррозия
- •1) Гальванокоррозия чугуна в нейтральной среде:
- •2) Гальванокоррозия чугуна в кислой среде:
- •3) Контактная коррозия железа и меди в нейтральной среде.
- •2.3 Электрокоррозия
- •3 Способы защиты металлов от коррозии
- •3.1 Изолирование металлов от внешней среды
- •1) Гальванокоррозия оцинкованного железа в нейтральной среде
- •2) Гальванокоррозия луженого железа в кислой среде
- •3.2 Изменение состава коррозионной среды
- •3.3 Рациональное конструирование
- •3.4 Электрохимические способы защиты от коррозии
- •1) Протекторная защита.
- •2) Катодная защита.
- •Тема 5 основные закономерности протекания химических процессв лекция № 12
- •1 Энергетика химических процессов.
- •2 Закон Гесса
- •Разберем данный вопрос на примере образования из простых веществ углекислого газа. Данное превращение можно провести по реакции
- •Или через промежуточный продукт (со) в две реакции:
- •1) Реакция горения этана выражается термохимическим уравнением
- •2) Рассчитать количество тепла, необходимое для испарения 1 м3 воды.
- •9.3 Энтропия
- •9.4 Энергия Гиббса
- •Лекция № 13
- •Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •1 Скорость реакции
- •1. История развития учения о строении атома
- •1.1. Модель атома по резерфорду
- •1.2. Модель атома по бору
- •1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
- •2) Двигаясь по стационарным орбитам, электрон не излучает энергию.
- •1) Была неприменима для описания спектров атомов более сложных, чем водород;
- •2) Не могла объяснить различной интенсивности спектральных линий в спектре даже атома водорода.
- •1.3. Современные представления об атоме
- •2. Квантово–механическая модель атома
- •2.1. Квантовые числа
- •2.4. Соответствие электронных формул элементов и положением их в периодической таблице
- •3. Периодический закон и периодическая таблица д.И.Менделеева
- •3.1. Периодический закон
- •3.2.Периодическая таблица д.И.Менделеева
- •3.3 Периодичность изменения свойств элементов в периодической таблице
- •3.3.1 Радиусы атомов в периодах радиусы атомов по мере увеличения заряда ядра уменьшаются вследствие увеличения электростатического взаимодействия электронов с ядром.
- •3.3. 6 Прогнозирование свойств элементов по положению в периодической таблице
- •Лекция № 15 «Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный – один атом (донор) предоставляет электронную пару, а второй (акцептор) – свободную орбиталь.
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1.Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •5. Строение гидридов элементов II-периода
- •«Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный –
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1. Ковалентная связь – это связь между двумя атомами посредством общей электронной пары.
- •4.2. Ионная связь – это связь между противоположно заряженными ионами.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •Химия элементов
- •Лекция № 16
- •«Свойства s-элементов»
- •1. Щелочные металлы
- •2. Бериллий, магний и щелочноземельные металлы
- •3. Химические свойства s-элементов
- •4. Физико–химические свойства водорода и гелия
- •5. Физико–химические свойства воды
- •5.2. Физические свойства воды
- •5.3. Химические свойства воды
- •Лекция № 17 «жесткость воды»
- •1. Общие понятия
- •3. Единица измерения жесткости
- •4. Водоподготовка
- •5. Водоумягчение
- •1.3. Алюминий
- •1.4. Индий. Галлий. Таллий
- •2.1. Электронное строение и общая характеристика
- •2.2. Углерод и его соединения
- •2.3. Кремний
- •2.4. Германий. Олово. Свинец
- •Лекция № 19 «свойства р-элементов
- •V и VI групп»
- •1.1. Электронное строение и общая характеристика
- •1.2. Азот
- •1.3. Фосфор
- •1.4. Мышьяк, сурьма, висмут
- •2.1. Введение
- •2.2. Кислород
- •2.3. Сера
- •2.4. Сравнение свойств водородных соединений р-элементов VI группы
- •2.5. Селен. Теллур
- •Лекция № 20
- •1.1. Электронное строение и общая характеристика VII группы (галогены)
- •Галогены проявляют нечетные валентности
- •1.2 Физические свойства галогенов
- •1.3 Химические свойства галогенов
- •1.4 Водородные соединения галогенов
- •1 .5 Кислородсодержащие соединения галогенов
- •1.6 Применение галогенов
- •1.7 Положение в периодической таблице и общая характеристика р-элементов VIII группы
- •Лекция № 21
- •1. Определение комплексных соединений
- •1) Диссоциация сульфатов калия и алюминия
- •2) Дисоциация двойной соли – алюмокалиевых квасцов
- •3)Диссоциация комплексного соединения
- •2. Состав комплексных соединений
- •1) Комплексный ион – [Fe(сn)6]-3,
- •Примеры состава комплексных соединений
- •3. Номенклатура комплексных соединений
- •[Pt(nh3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
- •4. Диссоциация комплексных соединений
- •5. Реакции с участием комплексных соединений
- •5.1. Образование комплексных соединений
- •5.2. Преход от одного комплексного соединения к другому
- •5.3 Разрушение комплексного соединения
- •Лекция № 22
- •Введение
- •1.1. Физические свойства
- •1.2. Химические свойства
- •Вопрос № 3 Составьте уравнения реакций, протекающих при осуществлении следующих превращений Cu→Cu(no3)2→Cu(oh)2 →CuSo4.
- •Лекция № 23
- •Лекция № 24
- •2.1 Элементы триады железа
- •2.2 Платиновые металлы
- •Лекция 25 «органические соединения» введение
- •1) Замещения атомов водорода по связям с с–н,
- •2) Разрыва связей с–с.
- •1.2. Непредельные (ненасыщенные) углеводороды
- •Ацетилен с2н2, или сн±сн
- •2. Карбоциклические
- •2.1. Предельные циклические углеводороды
- •2.2. Ароматические углеводороды
- •3. Клыссы органических соединений
- •3.1. Галогенпроизводные
- •3.2. Спирты и фенолы
- •3.3. Простые эфиры
- •3.4. Альдегиды и кетоны
- •3.5. Карбоновые кислоты
- •3.6. Сложные эфиры карбоновых кислот. Жиры
- •3.7. Амины
- •3.8. Аминокислоты и белки
- •Лекция № 26 «полимеры» Введение
- •3.Поликонденсеционные полимеры
- •4. Структура и состояния полимеров
- •Лекция № 27 «рабочие вещества низкотемпературной техники» Введение
- •1 Моль co2 – 6·1023 молекул co2 – 44г – 22,4л(н.У.).
- •1. Хладагенты неорганического происхождения
- •1.1. Номенклатура неорганических хладагентов
- •1.2. Физические и химические свойства неорганических хладагентов
- •2. Хладагенты органического происхождения (углеводороды)
- •2.1. Строение и номенклатура
- •2.2. Физические и химические свойства
- •3. Хладагенты органического происхождения (галогенпроизводные)
- •3.2.Цепные реакции(пределы взрываемости, разрушение озонового слоя)
Лекция № 13
«ХИМИЧЕСКАЯ КИНЕTИКА»
Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
1 Скорость реакции
Скорость
химической реакции
– это
изменение концентрации (![]() C)
реагирующих веществ за единицу времени(
C)
реагирующих веществ за единицу времени(![]() t)
t)
Vср
= ±![]() с/
с/![]() t.
t.
Знак «+» ставится, если скорость контролируется по образующемуся продукту, а знак «–» — по расходу исходного вещества.
П о
результатам измерений концентраций во
времени строят так называемые кинетические
кривые.
о
результатам измерений концентраций во
времени строят так называемые кинетические
кривые.
Например, в ходе реакции А ® В концентрация исходного вещества А уменьшается, а продукта реакции В – увеличивается и кинетическая кривая имеет вид(рисунок 1).

Рисунок 1 Кинетические кривые расходования исходного вещества А и образования продукта реакции В
В зависимости от количества фаз все системы и протекающие в них реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе. Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода, является гомогенной так как все вещества находятся в газообразном состоянии
Cl2(г) + H2(г) = 2HCl(г).
Гетерогенные реакции протекают на поверхности раздела фаз. Примером гетерогенной реакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз)
С(к) + О2(г) = СО2(г).
2 Факторы, влияющие на скорость химических реакций
Основные факторы, влияющие на скорость реакции:
1) Природа реагирующих веществ,
2) Концентрация реагирующих веществ,
3) Температура,
4) Наличие посторонних веществ.
2.1 Природа реагирующих веществ
С увеличением концентрации скорость реакции возрастает, так как чаще происходят столкновения молекул реагирующих веществ. Количественно эта зависимость определяется законом действующих масс.
Закон действующих масс (1867г.) — скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для гомогенной реакции mА + пВ = С
уравнение скорости реакции имеет вид

Входящая в уравнение константа скорости К — это скорость реакции при концентрациях реагирующих веществ равных единице.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Напишем выражение закона действующих масс для следующих реакций:
1) N2(г) + 3H2(г) = 2NH3(г);
2) 2C(к) + O2(г) = 2CO(г).
Решение
1) Данная система являться гомогенной, поэтому в формулу закона действующих масс будут входить концентрации всех компонентов:
u=[N2]·[H2]3;
2) Данная система являться гетерогенной, поэтому в формулу закона действующих масс будут входить концентрации только газообразных веществ
u=[О2].
2.2 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса
Правило Вант-Гоффа.
При
повышении температуры скорость
большинства химических реакций
существенно увеличивается, причем для
гомогенных реакций при нагревании на
каждые десять градусов скорость реакции
возрастает в 2÷4 раза. В соответствие с
правилом Вант-Гоффа для каждой реакции
можно применять так называемый
температурный коэффициент
![]() ,
который показывает, во сколько раз
возрастает констакта скорости реакции
при повышении температуры на 100 С. В
математической форме это имеет вид
,
который показывает, во сколько раз
возрастает констакта скорости реакции
при повышении температуры на 100 С. В
математической форме это имеет вид

Зная температурный коэффициент можно по приведенной ниже формуле рассчитать изменение скорости реакции при увеличении температуры от t1 до t2
 ,
,
где
ut2
и ut1
- скорости реакции при температурах t2
и t1 соответственно;
![]() -
температурный коэффициент скорости
данной реакции.
-
температурный коэффициент скорости
данной реакции.
Например, если температурный коэффициент реакция γ = 2, то при увеличении температуры на 100 градусов скорость реакции должна увеличиться: V398/V298 = 210 = 1024 раза.
Правило Вант-Гоффа применимо только в узком интервале температур.
Уравнение Аррениуса.
При увеличении
температуры скорость реакции увеличивается
в значительно большей степени в сравнении
с увеличением скорости движения
реагирующих частиц. Причина сильного
влияния температуры на скорость
заключается в первую очередь в увеличении доли активных (реакционноспособных)
частиц.
увеличении доли активных (реакционноспособных)
частиц.
В молекулярно-кинетической теории газов распределение частиц по значениям энергии в зависимости от температуры описывается так называемой Гаусовской кривой, общий вид которой для трех различных температур приведен на рисунке 2.
Рисунок 2 Распределение частиц по кинетической энергии при различных температурах:
где Т1 , Т2 и Т3 значения температур, при этом Т1 < Т2 < Т3,
Е1, Е2 и Е3 – наиболее вероятные значения энергии при температурах соответственно Т1, Т2 и Т3,
Еа – энергия активации.
Общее число частиц в системе (N) равно площади под кривой. Общее число частиц с энергией большей, чем Еа – равно заштрихованной площади.
Из рисунка 2 видно, что при увеличении температуры распределение частиц по энергии меняется так, что увеличивается доля частиц с более высокой энергией. Таким образом важным понятием для химической реакции является энергия активации.
Энергию активации – это энергия которой должны обладать частицы, чтобы взаимодействие их привело к химической реакции. Энергия активации выражается в кДж/моль. Для реакций, протекающих с заметной скоростью, энергия активации не превышает 50кДж/моль (для реакций ионного обмена Ea » 0); если Ea > 100 кДж/моль, то скорость реакции неизмеримо мала.
В 1889 г. С.Аррениус привел уравнение зависимости константу скорости химической реакции от температуры:
k = Ae – Ea/RT
где, A – предэкспотенциальный множитель, зависящий от природы реагирующих веществ;
R –газовая постоянная = 8,314 Дж/(моль ∙ К);
Ea – энергия активации
Из уравнения Аррениуса следует, что чем выше энергия активации, тем в большей степени необходимо повышать температуру для поддержания необходимой скорости реакции
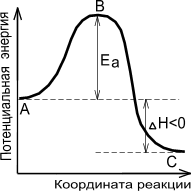
На рисунке 3 показана зависимость изменения потенциальной энергии реагирующей системы от пути протекания реакции. Из приведенного рисунка видно, что для экзотермической реакции (идущей с выделением теплоты) убыль активных молекул восполняется за счет энергии, выделяющейся в ходе реакции. В случае эндотермической реакции для поддержания необходимой скорости реакции требуется подвод тепла.
|
|
|
|
Экзотермическая реакция |
Эндотермическая реакция |
Рисунок 10.3 Энергетическая диаграмма химической реакции
А - реагенты,
В - активированный комплекс (переходное состояние),
С - продукты.
2.4 Влияние посторонних веществ
Посторонние вещества в зависимости от оказываемого воздействия могут ускорять реакции – катализаторы или замедлять – ингибиторы.
Катализаторы – это вещества ускоряющие химические реакции, но сами после реакции остаются в неизменном виде.
Считается, что катализатор изменяет путь реакции, проводя ее через промежуточные стадии с меньшими значениями энергий активации (рисунок 4).

Рисунок 4 Изменение пути химической реакции в присутствии катализатора:
1 – путь реакции без катализатора; 2 – путь реакции с катализатором;
А, В – исходные вещества, К – катализатор, АК, АВК – «активированные комплексы», АК – промежуточный продукт, Р – конечный продукт.
Схему реакции без катализа между веществами А и В с образованием продукт D можно представить в следующем виде
А + В = D,
а в присутствии катализатора К путь реакции меняется
A + B + K ® AK + B ®AKB ® D + K.
Гомогенный и гетерогенный катализ различаются по фазовому состоянию реагентов и катализатора. Если катализатор образует единую фазу с реагентами, то это гомогенный катализ. Если катализ протекает на границе раздела фаз – то это гетерогенный катализ.
Особенность катализатора является селективность, т.е. способность ускорять только определенные реакции. Высокой селективностью обладают биокатализаторы, это катализаторы реакций, протекающих в живых системах.
Ингибиторы – это вещества замедляющие реакцию.На практике иногда необходимо замедлять реакции (коррозия металлов и др.) это достигается введением в реакционную систему ингибиторов. Например, нитрита натрия, хромата и дихромата калия снижают скорость коррозии металлов.
Промоторы – вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами.
Каталитические яды – посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы мышьяка, фосфора вызывают быструю потерю активности катализатором V2O5 при контактном способе получения H2SO4.
3 Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратной реакции. Большинство химических реакций являются обратимыми.
В качестве примера проанализируем крайне важную для промышленности обратимую реакцию синтеза аммиака из азота и водорода:
прямая реакция – 2N2 + 3H2 → 2NH3,
обратная реакция – 2NH3 → N2 + 3H2,
обратимая реакция – 2N2 + 3H2 « 2NH3.
Прямая и обратная реакции являются отдельными реакциями с соответствующими им кинетическими уравнениями, предэкспотециальными множителями, энергиями активаций и т.д
Важной количественной характеристикой обратимых реакций является константа равновесия, которая определяется при достижении системой химического равновесия – состояния при котором скорости прямой и обратной реакций равны. Примеры применения закона действующих масс (з.д.м.).
Выведем константу равновесия на примере реакции синтеза аммиака.
Кинетическое уравнение прямой реакции N2+3H2 → 2NH3 имеет вид
Vпр = Кпр [N2][H2]3.
Кинетическое уравнение обратной реакции 2NH3→ N2 + 3H2 имеет вид
Vобр = Кобр[NH3]2.
В состоянии химического равновесия Vпр = Vобр.
Подставляя в условие химического равновесия выражения скоростей прямой и обратной реакций получаем следующее равенство
Кпр [N2][H2]3 = Кобр[NH3]2.
После преобразования получаем
 .
.
4 Принцип Ле-Шателье
Если на систему, находящуюся в состоянии химического равновесия, оказывается какое-либо внешнее воздействие, то равновесие в результате протекающих в системе процессов сместится таким образом, что оказанное воздействие уменьшится.
4.1 Влияние изменения концентраций на равновесие
При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расходования этого вещества, а при её уменьшении – в сторону образования этого вещества.
Пример 1. Если в равновесную систему 2N2 + 3H2 « 2NH3
добавить N2 или H2, то в соответствии с принципом Ле–Шателье для уменьшения концентраций данных веществ, равновесие должно сместится вправо, выход NH3 увеличится. При увеличении концентрации NH3 равновесие соответственно сместится влево.
4.2 Влияние изменения давления на равновесие
Давление в замкнутой реакционной системе обусловлено наличием в ней газообразных веществ: чем их больше, тем больше давление. Поэтому изменение внешнего давления повлияет на равновесие только в тех случаях, когда в нем участвуют газообразные вещества, причем количество их в прямой и обратной реакциях разное.
Если в системе, находящейся в состоянии химического равновесия увеличить давление, то преимущественно будет протекать реакция, в результате которой уменьшается количество газообразных веществ; при уменьшении давления преимущественно протекает реакция, в результате которой увеличивается количество газообразных продуктов.
Пример 1. Можно ли изменением давления увеличить выход продуктов в реакции CO2(г) + H2(г) « CO(г) + H2O(г).
Решение: Реакционная смесь включает газообразные реагенты, но количество их в реакции не меняется: из одного моля CO2(г) и одного моля H2(г) получаются по одному молю CO(г) и H2O(г). По этой причине изменение давления на состояние равновесия не влияет.
Пример 2. Как изменятся равновесные концентрации реагентов при увеличении давления в системе N2 + 3H2 « 2NH3?
Из уравнения реакции видно, что из 4 моль газа исходных продуктов образуется 2 моль газа продуктов реакции. Таким образом при увеличении давления равновесие сместится прямой реакции, так как она приводит к уменьшению давления.
4.3 Влияние изменения температуры на химическое равновесие
Большинство химических реакций протекают с выделением или поглощением тепла. В первом случае температура смеси увеличивается, во втором – уменьшается.
Если реакционную смесь, находящуюся в состоянии химического равновесия, нагреть, то в соответствии с принципом Ле Шателье должна протекать преимущественно реакция, в результате которой тепло будет поглощаться, т.е. эндотермическая реакция; при охлаждении смеси должна протекать преимущественно реакция, в результате которой тепло будет выделяться, т.е. эндотермическая реакция.
Если в системе, находящейся в состоянии химического равновесия, увеличить температуру, то равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
Пример:
2N2
+ 3H2
«
2NH3,
![]() H0
= – 92 кДж
H0
= – 92 кДж
Реакция экзотермическая, поэтому при увеличении температуры равновесие сдвигается влево, а при понижении температуры – вправо.
Из этого следует, что для увеличения выхода аммиака температуру необходимо понижать. На практике выдерживают температуру 500 0С, так как при более низкой температуре резко снижается скорость прямой реакции.
Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции
Принцип Ле Шателье универсален, так как применим не только к чисто химическим процессам, но и к физико-химическим явлениям, таким, как кристаллизация, растворение, кипение, фазовые превращения в твердых телах.
ТЕМА 6
СТРОЕНИЕ ВЕЩЕСТВА
ЛЕКЦИЯ № 14
«СТРОЕНИЕ АТОМА.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА
Д.И. МЕНДЕЛЕЕВА»
Понятие «атом»(неделимый) было введено древнегреческими философами в 500–200 гг. до н.э
До конца XIX века полагали, что атом – простейшая неделимая частица. Первые предположения о сложности строения атома появились при изучении естественной радиоактивности, электрохимических явлений, катодных лучей и др. явлений. Позже было установлено, что радиоактивность представляют собой поток частиц: α – ядра He2+, β – электроны и γ – рентгеновское излучение.