
- •Глава XVII развитие теории квантов. Атом резерфорда – бора
- •Развитие теории квантов а. Эйнштейном
- •Открытие атомного ядра
- •Теория атома Нильса Бора
- •Опыты Франка и Герца
- •Развитие квантовой теории атома
- •Открытие характеристического рентгеновского излучения
- •Успехи и трудности теории Бора - Зоммерфельда
- •Принцип соответствия
- •Открытие спина электрона
- •Опыты Штерна и Герлаха
- •Принцип Паули
- •Глава XVIII создание квантовой механики
- •Гипотеза де Бройля
- •Возникновение квантовой статистики
- •Матричная механика Гейзенберга
- •Введение в квантовую механику линейных операторов
- •Волновая механика Шредингера
- •Статистическая интерпретация волновой функции
- •Открытие дифракции электронов
- •Развитие интерпретации квантовой механики
- •Дискуссия Бора с Эйнштейном
- •Глава XIX развитие ядерной физики и физики элементарных частиц в первой половине XX столетия
- •Открытие изотопов
- •Открытие протона
- •Гипотеза протонно-электронного строения ядер
- •Гипотеза нейтрино
- •Открытие нейтрона
- •Протонно-нейтронная модель атомного ядра
- •Открытие сильных взаимодействий
- •Создание первых ускорителей
- •Первые эксперименты по нуклон-нуклонному рассеянию
- •Гипотеза зарядовой независимости ядерных сил
- •Зарождение квантовой теории электромагнитного поля
- •Открытие релятивистского волнового уравнения для электрона
- •Открытие позитрона
- •Теория -распада Ферми
- •Мезонная теория ядерных сил
- •Открытие мезонов
- •Дальнейшее развитие ядерной физики
- •Развитие модельных представлений о строении ядер
- •Развитие представлений об источниках энергии излучения звезд
- •Открытие деления ядер
- •Осуществление цепной реакции деления ядер
- •Открытие мезонов
- •Разработка оболочечной и обобщенной моделей ядра
- •Развитие квантовой электродинамики
- •Открытие к-мезонов и гиперонов
- •Физики и физико-химики лауреаты Нобелевской премии
Д
Принцип соответствия
ля решения подобных вопросов в 1918
году Бор использовал принцип соответствия,
который первоначально иногда называли
принципом аналогии. Несмотря на
неприменимость классической физики к
внутриатомным процессам, она вполне
корректно объясняет физические явления
в макроскопической области, а также, в
ряде случаев, и в микроскопической:
движение заряженных частиц в электрическом
и магнитном полях, тепловое движение
атомов и молекул в газе и др. Поэтому
можно считать установленным, что
классическая теория «макроскопически
корректна», т.е. она правильно описывает
физические явления в том предельном
случае, когда квантовые скачки пренебрежимо
малы. В этих случаях предсказания
квантовой и классической теорий должны
совпадать.
Сначала Бор сформулировал
принцип соответствия для простейшего
случая атома водорода. Пусть электрон
находится на стационарной орбите с
главным квантовым числом n.
Движение электрона по орбите в теории
Бора-Зоммерфельда описывается классической
физикой. С ее точки зрения электрон
совершает периодическое движение по
орбите радиусом
![]() ,
обладая при этом моментом импульса
,
обладая при этом моментом импульса
![]() .
Комбинируя эти две формулы, можно
вычислить частоту обращения электрона:
.
Комбинируя эти две формулы, можно
вычислить частоту обращения электрона:
![]() .
(17.18)
.
(17.18)
Согласно классической электродинамике, частота испускаемого электромагнитного излучения должна равняться и ее обертонам: 2, 3, и т.д. При этом интенсивность излучения на различных частотах определяется коэффициентами разложения движения электрона в ряд Фурье:
![]() .
.
С точки зрения теории
Бора-Зоммерфельда электрон излучает
при переходе с n-ой
орбиты на другую, характеризующуюся
меньшим значением квантового числа
![]() .
Частота излучения при этом составляет
.
Частота излучения при этом составляет
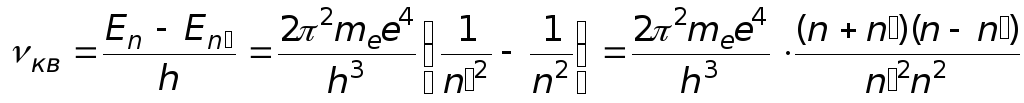 .
.
В случае больших
значений n
и
![]() ,
если разность
,
если разность
![]() мала, то
мала, то
![]() .
(17.19)
.
(17.19)
Таким образом, при
![]() 1, 2, 3 и т.д. частоты излучения совпадают
с обертонами классической частоты
(17.18).
1, 2, 3 и т.д. частоты излучения совпадают
с обертонами классической частоты
(17.18).
Бор
предположил, что вероятности переходов
электрона с n-ой
орбиты на нижележащие, как и в классической
теории, определяются коэффициентами
![]() при классических гармониках, что
позволяет сделать вывод об интенсивности
излучения на различных частотах. Более
того, Бор считал, что и в случае малых
значений главного квантового числа n,
когда частоту
при классических гармониках, что
позволяет сделать вывод об интенсивности
излучения на различных частотах. Более
того, Бор считал, что и в случае малых
значений главного квантового числа n,
когда частоту
![]() даже приближенно нельзя считать равной
какой-либо из классических частот,
все-таки можно установить соответствие
между конкретными значениями классических
и квантовых частот таким образом, чтобы
коэффициенты
даже приближенно нельзя считать равной
какой-либо из классических частот,
все-таки можно установить соответствие
между конкретными значениями классических
и квантовых частот таким образом, чтобы
коэффициенты
![]() определяли вероятности соответствующих
квантовых переходов, а значит, и
интенсивности соответствующих
спектральных линий. Бор не пытался
объяснить существование такого
соответствия между классическим и
квантовым описанием. Принцип соответствия
следовало принять как факт, так же, как
и основные постулаты Бора. Использование
принципа соответствия позволило, в
частности, установить правило отбора
для квантовых чисел
определяли вероятности соответствующих
квантовых переходов, а значит, и
интенсивности соответствующих
спектральных линий. Бор не пытался
объяснить существование такого
соответствия между классическим и
квантовым описанием. Принцип соответствия
следовало принять как факт, так же, как
и основные постулаты Бора. Использование
принципа соответствия позволило, в
частности, установить правило отбора
для квантовых чисел
![]() и m.
Оказалось, что k
при квантовых переходах может изменяться
лишь на 1, а для
магнитного квантового числа m
существует правило m
0, 1,
поэтому не все спектральные линии,
ожидаемые согласно вычислениям
Зоммерфельда, имеют место в действительности
в случае нормального эффекта Зеемана.
и m.
Оказалось, что k
при квантовых переходах может изменяться
лишь на 1, а для
магнитного квантового числа m
существует правило m
0, 1,
поэтому не все спектральные линии,
ожидаемые согласно вычислениям
Зоммерфельда, имеют место в действительности
в случае нормального эффекта Зеемана.
Опираясь на периодическую систему Менделеева и идею Дж. Дж. Томсона о том, что электроны в атоме делятся на группы, располагающиеся отдельными слоями, Бор и другие ученые развили полуэмпирическую теорию строения многоэлектронных атомов. К этому времени уже было известно, что заряд ядра равен Ze, где Z – порядковый номер элемента в таблице Менделеева. Электронейтральность атома в целом означала, что число электронов в атоме равно Z. По Бору, атом водорода содержит один электрон с квантовыми числами n = 1 и k = 1. Исходя из соображений о свойствах гелия, Бор предположил, что оба электрона в атоме гелия характеризуются теми же значениями квантовых чисел, что и в атоме водорода. Следующие восемь элементов с лития по неон, согласно Бору, образуются при последовательном заполнении электронами L-оболочки, характеризующейся значением главного квантового числа n = 2; при этом для лития и бериллия k = 1, а для остальных элементов с бора по неон k = 2.
В 1920
году Зоммерфельд, изучая мультиплетный
характер спектров щелочных металлов,
ввел для характеристики состояний атома
в целом новое квантовое число j.
Оно определяло момент импульса всего
атома. Кроме того, вместо азимутального
числа
![]() было введено орбитальное квантовое
число l
= k
– 1
и установлено, что l
и j для
атома с одним валентным электроном
связаны соотношением
было введено орбитальное квантовое
число l
= k
– 1
и установлено, что l
и j для
атома с одним валентным электроном
связаны соотношением
![]() .
При этом в случае l
= 0 полный момент импульса атома
оказывался отличным от нуля, так как
квантовое число j
получалось равным ½.
.
При этом в случае l
= 0 полный момент импульса атома
оказывался отличным от нуля, так как
квантовое число j
получалось равным ½.
