
- •Глава 3 Блохин а.В.
- •Глава 3. Второй закон термодинамики и его приложения.
- •3.1. Самопроизвольные и несамопроизвольные процессы.
- •3.2. Второй закон термодинамики. Энтропия.
- •3.3. Энтропия как функции состояния.
- •3.4. Абсолютная температура. Температурные шкалы.
- •3.5. Вычисление изменения энтропии в различных процессах.
- •3.5.1. Вычисление изменения энтропии в изотермических процессах.
- •3.5.2. Вычисление изменения энтропии при нагревании.
- •3.5.3. Вычисление изменения энтропии идеального газа.
- •3.5.4. Изменение энтропии при смешении идеальных газов в изобарно-изотермическом процессе.
- •3.5.5. Вычисление изменения энтропии в необратимых процессах.
- •3.6. Внутреннее давление, закон Джоуля. Выражение для разности изобарной и изохорной теплоемкостей вещества через термодинамические коэффициенты.
- •3.7. Постулат Планка. Абсолютное значение энтропии.
3.5.3. Вычисление изменения энтропии идеального газа.
Для обратимого процесса простой системы справедливо:
![]() ,
а
,
а
![]() ,
,
поэтому
![]() (3.31)
(3.31)
(фундаментальное уравнение термодинамики).
Объединенное уравнение первого и второго законов термодинамики (3.31) для равновесных процессов можно записать как
![]() .
.
Для идеального газа фундаментальное уравнение принимает вид
![]() ,
,
![]() . (3.32)
. (3.32)
После интегрирования (3.32) при условии СV = const, получим
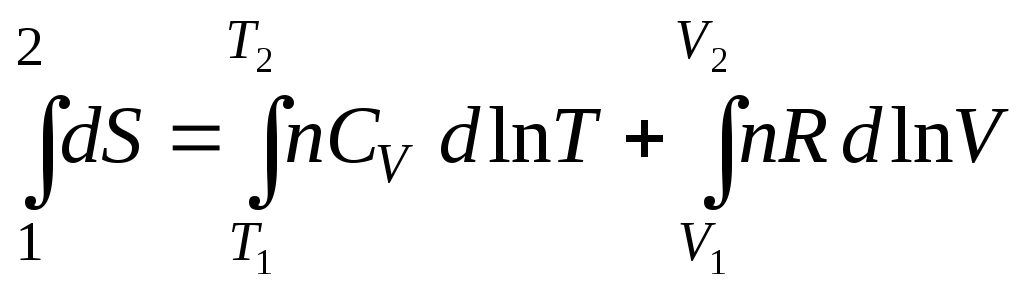 ,
,
![]() . (3.33)
. (3.33)
Так как
![]() ,
,
то изменение энтропии ΔS можно представить в виде функции давления и объема:
![]() ,
,
![]() (3.34)
(3.34)
Так как
![]() ,
,
то изменение энтропии ΔS можно представить в виде функции температуры и давления:
![]() ,
,
![]() (3.35)
(3.35)
При изотермическом расширении идеального газа (Т = const) из уравнений (3.33) и (3.35) получаем:
![]() (3.36)
(3.36)
то есть при изотермическом расширении идеального газа энтропия увеличивается.
При нагревании идеального газа в изохорных или изобарных условиях энтропия также увеличивается:
![]() , (3.37)
, (3.37)
![]() . (3.38)
. (3.38)
Помимо вычисления изменения энтропии, важно определить значение энтропии S для одного моля идеального газа. Соответствующую формулу получим, исходя из уравнения (3.35) для 1 моля газа:
![]() .
.
Примем, что Р1 = Ро (стандартное давление) и Т1 = 1 К, тогда
![]() , (3.40)
, (3.40)
где
![]() – стандартная энтропия идеального газа
при T = 1 К,
которую называют
энтропийной
постоянной идеального газа и обозначают
S′.
– стандартная энтропия идеального газа
при T = 1 К,
которую называют
энтропийной
постоянной идеального газа и обозначают
S′.
Индексы 2 в уравнении (3.40) можно отбросить, а само уравнение записать в виде
![]() , (3.41)
, (3.41)
где
![]() – относительное давление.
– относительное давление.
Стоящие под знаком логарифмов в уравнении (3.41) величины безразмерны. Энтропийная постоянная газа S′ может быть вычислена по молекулярным данным методами статистической термодинамики.
3.5.4. Изменение энтропии при смешении идеальных газов в изобарно-изотермическом процессе.
В смеси идеальные газы не взаимодействуют друг с другом и энтропия смеси идеальных газов будет равна сумме энтропий этих газов, когда каждый из них в отдельности занимает при температуре смеси тот же объем, что и вся смесь (теорема Гиббса). Если смешиваются n1 моль первого газа, занимавшего объем V1 при давлении Р, с n2 моль второго газа, занимавшего объем V2 при том же давлении Р, при постоянной температуре и общем давлении Р, то изменение энтропии при смешении ∆mixS (подстрочный индекс от mixing – смешение) складывается из изменения энтропии каждого газа при его изотермическом расширении от объема V1 (V2) до объема V1 + V2. При этом парциальное давление каждого газа изменяется от Р до Рi = P∙xi (закон Дальтона для смеси идеальных газов, поскольку исходное давление каждого из газов равно конечному давлению смеси Р = Рсмеси), где хi – мольная доля данного газа в смеси.
Изменение энтропии как функции состояния в результате смешения двух газов будет равно разности
![]() ,
,
где Sсмеси – энтропия смеси газов, а Sисход – сумма энтропий газов до смешения. Энтропия газов до смешения Sисход в соответствии с уравнением (3.41) будет равна
![]() , (3.42)
, (3.42)
а энтропия смеси газов –
![]() ,
,
![]() , (3.43)
, (3.43)
где
![]() – относительное парциальное давление
данного газа в смеси.
– относительное парциальное давление
данного газа в смеси.
Тогда энтропия смешения газов будет определяться соотношением
![]() (3.44)
(3.44)
Изменение энтропии при образовании 1 моль смеси идеальных газов будет равно
![]() (3.45)
(3.45)
Согласно (3.45) ∆mixS > 0, так как хi < 1 и lnхi < 0. Если смешивается n идеальных газов при Т, Р = const, то энтропия смешения в расчете на 1 моль смеси будет равна
![]() . (3.46)
. (3.46)
Следует обратить внимание, что энтропия газа при Т = const изменяется, если только изменяется его парциальное давление.
Уравнение для расчета энтропии смешения можно также легко получить как сумму изменений энтропий каждого газа при их изотермическом расширении до объема смеси:
![]() . (3.47)
. (3.47)
Из уравнения (3.47) следует, что возрастание энтропии при смешении двух идеальных газов зависит только от количества молей газов, но не зависит от их природы. В предельном случае, когда смешивается один и тот же газ, разделенный перегородкой на две части, увеличения энтропии, согласно (3.47), не должно происходить, так как парциальное давление газа не меняется и никакого термодинамического процесса не происходит. Таким образом, смешение двух идентичных газов нельзя рассматривать как предельный случай смешения двух различных газов. При переходе от образования смеси сколь угодно близких (различимых) газов к смеси одинаковых (неразличимых) газов ∆mixS испытывает скачок. Это утверждение получило название парадокса Гиббса.
