
- •Глава 3 Блохин а.В.
- •Глава 3. Второй закон термодинамики и его приложения.
- •3.1. Самопроизвольные и несамопроизвольные процессы.
- •3.2. Второй закон термодинамики. Энтропия.
- •3.3. Энтропия как функции состояния.
- •3.4. Абсолютная температура. Температурные шкалы.
- •3.5. Вычисление изменения энтропии в различных процессах.
- •3.5.1. Вычисление изменения энтропии в изотермических процессах.
- •3.5.2. Вычисление изменения энтропии при нагревании.
- •3.5.3. Вычисление изменения энтропии идеального газа.
- •3.5.4. Изменение энтропии при смешении идеальных газов в изобарно-изотермическом процессе.
- •3.5.5. Вычисление изменения энтропии в необратимых процессах.
- •3.6. Внутреннее давление, закон Джоуля. Выражение для разности изобарной и изохорной теплоемкостей вещества через термодинамические коэффициенты.
- •3.7. Постулат Планка. Абсолютное значение энтропии.
3.3. Энтропия как функции состояния.
Понятие об энтропии можно ввести термодинамически, если связывать рассеивание энергии с количеством теплоты, поступившей в систему, или статистически, если придерживаться точки зрения, что рассеивание энергии среди компонентов системы может быть вычислено.
Энтропия (от греческого entropia – поворот, превращение) – понятие, впервые введенное в термодинамике для определения меры необратимости рассеивания энергии. В статистической физике энтропия – мера вероятности осуществления какого-либо макроскопического состояния.
В термодинамике понятие «энтропия» введено Р. Клаузиусом в 1865 году. Клаузиус показал, что процесс превращения теплоты в работу подчиняется второму закону термодинамики, который можно сформулировать строго математически, если ввести новую функцию состояния – энтропию S. Энтропия была введена на основе доказательства теоремы Карно о независимости термического КПД обратимого цикла Карно от природы рабочего тела. Здесь напомним, что КПД тепловой машины при работе по обратимому циклу определяется выражением (3.1), которое можно записать в таком виде
![]() . (3.6)
. (3.6)
По принятой в термодинамике системе знаков Q2 < 0, поэтому уравнение (3.6) можно записать
![]() . (3.7)
. (3.7)
Для элементарного цикла Карно, осуществляемого между температурами Т1 и Т2, получим
![]() .
.
Величину δQ/T называют приведенной теплотой. Любой обратимый цикл можно заменить бесконечно большим числом бесконечно малых (элементарных) циклов Карно. Суммирование этих циклов дает
![]() .
.
Если i → ∞, то суммирование превращается в интеграл по замкнутому контуру
![]() , (3.8)
, (3.8)
т.е. алгебраическая сумма приведенных теплот любого обратимого кругового процесса равна нулю. Но если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции состояния системы. Итак,
![]() ,
,
где S – функция состояния системы – энтропия.
Приведенные рассуждения применимы к любому веществу и к любому обратимому циклу. Поэтому каждая система в любом ее состоянии имеет определенное значение энтропии.
Можно рассуждать и так: для простой системы, совершающей только работу расширения, справедливо:
![]() .
.
Если система – 1 моль идеального газа, то
![]() ,
,
![]() .
.
Если T и V – независимые параметры, то можно найти перекрестные проиводные и убедиться в том, что они равны:
![]() ,
,
Следовательно, для идеального газа приведенная теплота
![]()
обладает свойствами полного дифференциала и, значит, энтропия есть функция состояния. Распространение последнего выражения на все системы можно рассматривать как второй закон термодинамики.
Далее, разность энтропий системы в двух произвольных состояниях 1 и 2 равна
![]() . (3.9)
. (3.9)
Интегрирование ведется вдоль пути любого обратимого процесса, связывающего состояния 1 и 2, при этом приращение энтропии ∆S не зависит от пути интегрирования.
Таким образом, существует однозначная функция состояния S – энтропия, которая при обратимых адиабатических процессах (Q = 0) остается постоянной. Процессы, в которых энтропия остается постоянной, называются изоэнтропийными.
Для необратимых процессов интеграл от приведенной теплоты δQ/T по замкнутому контуру отрицателен
![]() . (3.10)
. (3.10)
Тогда справедливо, что
![]() , (3.11)
, (3.11)
поэтому энтропия адиабатически изолированной системы при необратимых процессах может только возрастать. Таким образом, энтропия определяет характер процессов в адиабатических условиях: возможны только такие процессы, при которых энтропия либо остается неизменной (обратимые процессы), либо возрастает (необратимые процессы). При этом не обязательно, чтобы возрастала энтропия каждого из тел, участвующих в процессе. Увеличивается общая сумма энтропий участвующих в процессе тел:
![]() .
.
В общем виде второй закон термодинамики записывается
![]() , (3.12)
, (3.12)
где знак равенства относится к обратимым процессам, а знак неравенства – к необратимым процессам.
Напомним, что в обратимых процессах система выполняет максимальную работу, а потерянная работа в реальных процессах всегда больше нуля:
![]() . (3.13)
. (3.13)
Из закона сохранения энергии следует, что энергетический эквивалент «потерянной» работы не может исчезнуть совсем. Опыт показывает, что «потерянная» работа чаще всего переходит в теплоту. Тогда в балансе теплоты и работы при необратимых процессах следует учитывать дополнительный внутренний источник теплоты:
![]() (3.14)
(3.14)
Величину δQ* называют некомпенсированной теплотой независимо от физической природы работы. Переход потерянной работы в теплоту – это особеность теплоты как микроскопически неупорядоченной формы передачи энергии. Поэтому строго неравенство (3.12) следует записывать так:
![]() , (3.15)
, (3.15)
где δQe – теплота, которой система обменивается с окружающей средой.
Особенность теплообмена при необратимых процессах состоит в появлении нового источника теплоты – некомпенсированной теплоты. Уравнение баланса энтропии можно выразить равенством
![]() , (3.16)
, (3.16)
или
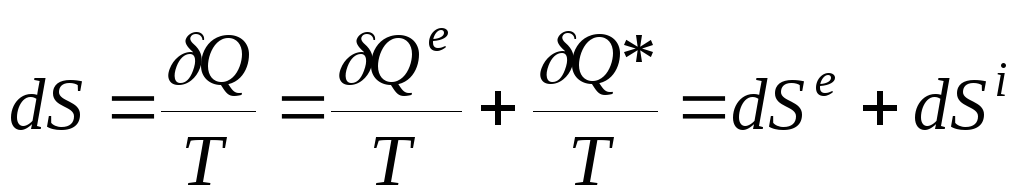 , (3.17)
, (3.17)
где вклад dSe связан с переносом тепла извне (из окружающей среды), а вклад dSi обусловлен необратимыми изменениями внутри системы:
dS i > 0 для необратимых процессов и dS i = 0 для обратимых процессов.
Статистическая физика связывает энтропию с вероятностью осуществления данного макроскопического состояния системы. Энтропия определяется через логарифм статистического веса Ω (термодинамическая вероятность) данного равновесного состояния:
![]() , (3.18)
, (3.18)
где Ω(ε,N) – число квантовомеханических уровней энергии в узком интервале энергии Δε вблизи значения энергии ε системы из N частиц; в классической статистической физике Ω – величина объема в фазовом пространстве системы при заданных ε и N. Впервые связь энтропии с вероятностью состояния системы установил Л. Больцман в 1872 году: возрастание энтропии системы обусловлено ее переходом из менее вероятного состояния в более вероятное. Изолированная система эволюционирует в направлении наиболее вероятного распределения энергии по отдельным подсистемам.
