
- •Научные основы современных сталеплавильных процессов
- •Посвящается в.И. Явойскому
- •Глава 1
- •Глава 2
- •2.1 Кинетика гетерогенных высокотемпературных процессов и методы выявления их ведущего звена
- •2.2 Исследование процессов окислительного рафинирования имеющих место в производстве стали
- •2.3 Условия протекания окислительного рафинирования в сталеплавильных агрегатах
- •2.4 Реакция окисления углерода
- •Внутридиффузионный режим лимитирования процесса
- •2.7 Окислительные процессы в многокомпонентных расплавах на основе железа
- •2.10 Окисление серы
- •2.11 Деванадация
- •2.13 Современные представления о ходе процессов окислительного рафинирования расплавов на основе железа
- •Окислительное рафинирование в условиях современных сталеплавильных агрегатов
- •2.15 Характеристика и газодинамика кислородных струй сталеплавильных агрегатов
- •Форма и геометрические размеры реакционной зоны
- •Глава 3.
- •3.1 Общие положения
- •3.2 Маcсоперенос примеси в экстрагирующей фазе
- •3.3 Сера в металле и его десульфурация
- •3.4 Кинетика процесса десульфурации металла
- •3.5 Кинетика десульфурации металла за счет твердых тел (порошкообразными десульфураторами)
- •Глава 4. Раскисление стали и неметаллические включения.
- •4.1 Кислород в стали и ее раскисление
- •4.2 Термодинамика раскисления
- •4.3 Кинетика осадочного раскисления
- •4.4 Плавление и растворение в металле вводимых раскислителей
- •4.5 Взаимодействие растворенного в металле кислорода с введенным в него раскислителем
- •4.6 Образование зародышей новой фазы продуктов раскисления в объеме жидкого металла
- •4.7 Рост образовавшихся продуктов раскисления
- •4.8 Удаление продуктов раскисления из сферы протекания этой реакции
- •4.9 Переход включений из металла в шлак или другие контактирующие фазы
- •4.10 Неметаллические включения в готовом металле
- •Глава 5 газы в стали
- •5.1 Взаимодействие азота и водорода с расплавленным и охлаждающимися сплавами железа
- •5.2 Термодинамика взаимодействия азота с расплавами на основе железа
- •5.3 Методы изучения взаимодействия азота с металлами
- •5.4 Кинетика растворения азота в железе и его сплавах
- •Глава 6 поведение водорода в сплавах на основе железа
- •6.1 Некоторые особенности взаимодействия водорода
- •Со сплавами на основе железа
- •6.2 Природа газообразного водорода и взаимодействие его с металлами
- •6.3 Термодинамика сорбирования водорода расплавленными и твердыми сплавами железа
- •6.4 Кинетика растворения и выделения водорода из расплавов на основе железа
- •6.5 Состояние водорода в готовой стали его влияние на механические свойства стали и распределение водорода в металле
- •6.6 Поведение водорода при выплавке металла и при его внепечной обработке
- •Глава 7 основы обработки стали в ковше
- •7.1 "Внеагрегатная" или "ковшевая" обработка стали
- •7.2 Вакуумирование металла
- •7.3 Применение инертных газов
- •Заключение
- •Библиографический список
- •Оглавление
- •Научные основы современных сталеплавильных процессов
3.3 Сера в металле и его десульфурация
Растворимость серы в жидком железе практически не ограничена. В расплаве сера образует с железом ионные группировки S2- и Fe2+, близкие по химическому составу к сульфиду железа FeS. Возможно, что не вся сера в железном расплаве ионизирована и часть ее находится в атомарном (несвязанном) состоянии.
Размеры
(радиусы) атомов серы (![]() =0,105
нм), а тем более ее ионов (
=0,105
нм), а тем более ее ионов (![]() =0,174
нм) слишком велики для образования
твердых растворов внедрения в железе,
поэтому при кристаллизации сплавов
железа происходит резкое сокращение
растворимости серы, продолжающееся и
при дальнейшем понижении температуры
и в особенности при аллотропическом
превращении и –
(рис.
22). Как
известно, именно это скачкообразное
изменение растворимости серы является
основной причиной возникновения пороков
в сталях, содержащих [S]>0,040,05
% при их горячей пластической обработке.
=0,174
нм) слишком велики для образования
твердых растворов внедрения в железе,
поэтому при кристаллизации сплавов
железа происходит резкое сокращение
растворимости серы, продолжающееся и
при дальнейшем понижении температуры
и в особенности при аллотропическом
превращении и –
(рис.
22). Как
известно, именно это скачкообразное
изменение растворимости серы является
основной причиной возникновения пороков
в сталях, содержащих [S]>0,040,05
% при их горячей пластической обработке.

Растворимость серы в расплавленном железе изменяется в зависимости от концентрации других его примесей. Об этом наиболее удобно судить по изменению активности серы и по соответствующему изменению параметра взаимодействия серы с этими примесными элементами. Увеличение коэффициента активности серы S и параметра взаимодействия первого порядка того или иного элемента и серы.
![]()
означают
уменьшение растворимости серы при
данных условиях и, наоборот, уменьшение
S
и отрицательное значение
![]() означают удаление раствора серы от
насыщения ей металла и рост растворимости
серы.
означают удаление раствора серы от
насыщения ей металла и рост растворимости
серы.
Из диаграммы (рис. 23) и сводки значений параметров взаимодействия серы и других элементов, растворенных в расплавленном железе (при I600 °C) [32], видно, что только углерод и кремний значительно уменьшают растворимость серы в расплавах на основе железа.
Таблица 4 – Значения параметров взаимодействия первого порядка для растворов серы и некоторых других компонентов расплавов на основе железа при 1600 °С [32].
|
Элемент |
Al |
C |
Cr |
Ce |
Mn |
O |
P |
Si |
Ti |
V |
Zr |
|
|
0,035 |
0,11 |
-0,011 |
0,914 |
-0,02 |
-0,27 |
-0,29 |
0,064 |
-0,072 |
-0,016 |
-0,052 |
При понижении температуры жидких расплавов на основе железа происходит некоторое понижение растворимости серы, хотя влияние концентрации самой серы на ее активность при понижении температуры несколько уменьшается:
![]() (96)
(96)
В целом это изменение весьма незначительно по сравнений со скачком растворимости серы, наблюдаемым при кристаллизации сплава и превращениях Feж→Feδ и Feδ→Feγ.
 При
дальнейшем понижении температуры в
областях Feγ
и Feα.
происходит дальнейшее существенное
уменьшение растворимости серы в железе,
что является причиной выделения ее в
отдельную фазу, т.е. образования
"послекристаллизационных" или
"четвертичных", иногда
ультрамикроскопических включений FeS.
При
дальнейшем понижении температуры в
областях Feγ
и Feα.
происходит дальнейшее существенное
уменьшение растворимости серы в железе,
что является причиной выделения ее в
отдельную фазу, т.е. образования
"послекристаллизационных" или
"четвертичных", иногда
ультрамикроскопических включений FeS.
Понижение
значений S
и отрицательные значения параметров
взаимодействия первого порядка
![]() для металлов связаны с образованием
или более прочных, по сравнению с FeS,
сульфидов. Термодинамические данные
об образовании сульфидов некоторых
металлов, имеющие значение для производства
стали приведены в таблице 5.
для металлов связаны с образованием
или более прочных, по сравнению с FeS,
сульфидов. Термодинамические данные
об образовании сульфидов некоторых
металлов, имеющие значение для производства
стали приведены в таблице 5.
Сера является одним из наиболее поверхностно-активных элементов в расплавленном железе, а также в чугунах и практически во всех расплавленных сталях. Как уже отмечалось, максимум величины адсорбции серы в жидком железе и во многих расплавах на его основе колеблется в зависимости от температуры и состава расплава в пределах объемного содержания серы в металле 0,040,07 %.
Таблица 5 – Стандартные изменения энтальпии и энтропии при образовании некоторых сульфидов
|
Параметры |
Температура, °К |
H°, кДж/моль |
S°, кДж/моль, °К |
|
Feγ+1/2S2газ=FeSж |
1500-1655 |
-113,45 |
-0,026 |
|
Feδ+1/2S2газ=FeSж |
1655-1809 |
-111,77 |
-0,025 |
|
Feж+1/2S2газ=FeSж |
1809-2000 |
-125,46 |
-0,033 |
|
Caж+1/2S2газ=CaSт |
1500-1765 |
-525,6 |
-0,108 |
|
Caгаз+1/2S2газ=CaSт |
1765-200 |
-702,9 |
-0,193 |
|
Mgгаз+1/2S2газ=MgSт |
1500-2000 |
-554,7 |
-0,198 |
|
Mnж+1/2S2газ=MnSж |
1516-1803 |
-289,7 |
-0,080 |
|
2Alж+3/2S2газ=Al2S3т |
1500-2000 |
-688,2 |
-0,325 |
|
Mnж+1/2S2газ=MnSж |
1803-2000 |
-264,1 |
-0,066 |
По расчетам С.И. Попеля [57], концентрация серы в моноатомном поверхностном слое в этом случае приближается к ее концентрации в сульфиде железа, т.е. превосходит объемную концентрацию серы почти на три порядка. Именно этим объясняют переход некоторой доли серы в результате ее окисления до SO2 при диспергировании металла в реакционной зоне кислородных конвертеров, т.е. в условиях весьма существенного избытка кислорода.
Этим примером практически исчерпывается экстрагирование серы в газовую фазу, т.к. ее окисление в компактном объеме металла и испарение серы имеют совершенно ничтожное значение. Например, парциальное давление паров серы в равновесии с ее раствором в расплавленном железе ничтожно, его можно определить уравнением:
![]() =3760/Т+0,535 (97)
=3760/Т+0,535 (97)
т.е.
при 1800 К
![]() =231
Па.
=231
Па.
Напротив, поглощение серы из газовой фазы плавящимся или уже расплавленным металлом термодинамически весьма возможно и часто имеет место, например, при мартеновском способе производства стали в случае использования для отопления печи виды топлива, содержащие серу – в частности сернистые мазуты, коксодоменные газовые смеси и т.п. [45, 82, 83].
В процессе очищения металла от серы ведущую роль во всех современных металлургических агрегатах, несомненно, играют шлаки. В зависимости от их химического состава и физических свойств удаление серы из металла шлаком может иметь различную природу.
Экстрагирование серы из металла в шлак в той же форме ее существования, в которой она находится в металле, без каких-либо изменений этой формы. В полном смысле слова, такое экстрагирование; представляет собой переход серы в соответствии с "законом распределения" и выравнивания химических потенциалов серы в металле и шлаке. Это имеет место, например, при мартеновской или электроплавке на кислом поду [101, 102]. Как отмечалось ранее, в металле содержащем менее 0,20-0,50% марганца, сера находится в основном в виде FeS и в форме бедных MnS расплавов FeS-MnS. В этом виде она и переходит в шлак.
Однако, растворимость серы в кислом железистом шлаке очень невелика, десятые и сотые доли процента [102]. Поэтому при правке в кисловых агрегатах процесс [FeS](FeS) практического значения не имеет. Но при наличии в металле марганца и замены в шлаке некоторой части FеO на MnO ситуация несколько изменяется: в металле группировки FeS заменяются более сложными сульфидными расплавами (FeS)(MnS), температура плавления которых повышается по мере увеличения в них содержания MnS и в этом же направлении уменьшается их растворимость в металле (рис. 24). В то же время повышение (МпО) в шлаках, очевидно, несколько повышает растворимость в них серы. Поэтому наблюдаемый, неравновесный коэффициент распределения серы при плавках в кислых агрегатах и при составах шлаков близких к насыщению их кремнеземом, (S) /[S]=S колеблется в пределах 0,8-25 [103]. Учитывая поддающуюся оценке и очень зависящую от температуры и соотношения (FeS)/(MnS) растворимость в жидком металле группировок Fe-Mn-S можно считать, что и в присутствии марганца имеет место переход серы из металла в шлак без изменения формы ее существования.
Ранее, когда дефицит марганца в СССP не ощущался так остро, его широко применяли в сталеплавильном производстве в качестве десульфуратора.
Переход серы из металла в практически нерастворимые в нем, но хорошо растворимые в шлаке сульфиды и извлечение последних в шлак.
К числу элементов, образующих такие
сульфиды, относятся прежде всего
щелочноземельные металлы – Са,
Mg,
Ba,
Sr.
Сложность использования щелочноземельных
металлов в качестве десульфураторов
связана с их весьма высокой испаряемостью.
числу элементов, образующих такие
сульфиды, относятся прежде всего
щелочноземельные металлы – Са,
Mg,
Ba,
Sr.
Сложность использования щелочноземельных
металлов в качестве десульфураторов
связана с их весьма высокой испаряемостью.
Например, упругость пара магния уже при 600 °С составляет 170Па и 0,018 мПа при 1000 °С [80].
Поэтому растворимость щелочноземельных элементов в жидком железе и в расплавах на его основе весьма ограничена. Например, по данным [105] при давлении паров щелочноземельных металлов около 10 Па их растворимость характеризуется данными, приведенными в таблице 6.
Таблица 6 – Характеристика растворимости щелочноземельных элементов
|
Элемент |
Парциальная молярная теплота растворения, кДж/моль |
Растворимость при 1600 С (в % по массе) |
|
Mg |
79 |
0,8-1,2 |
|
Ca |
130 |
0,040-0,056 |
|
Sr |
1840 |
0,003 |
|
Ba |
213 |
0,005 |
В этой работе было такие установлено существенное влияние отдельных компонентов сплавов железа на растворимость в них щелочноземельных металлов (см. табл. 7), где приведены значения параметров взаимодействия этих элементов с кальцием и магнием.
Таблица 7 – Параметры взаимодействия элементов
с кальцием и магнием
|
Элемент |
|
|
|
|
|
Ni |
0,017 |
-7,25-10,7 |
-6,2 |
-0,019 |
|
Si |
-0,049 |
-8,0-10,7 |
+0,06 |
+0,004 |
|
Al |
-0,029 |
-7,5 |
-1,39 |
+0,003 |
|
C |
-0,206 |
|
-1,39 |
+0,0009 |
|
Cr |
– |
– |
+0,178 |
+0,004 |
Отрицательные
значения параметров взаимодействия
первого порядка
![]() характеризуют понижение активности
кальция – например, в присутствии
углерода или кремния и, соответственно,
увеличения его растворимости в расплаве.
характеризуют понижение активности
кальция – например, в присутствии
углерода или кремния и, соответственно,
увеличения его растворимости в расплаве.
По целому ряду обстоятельств, применение щелочноземельных элементов как десульфураторов передельных чугунов значительно эффективнее, чем использование их в качестве десульфураторов сталей:
а) Прежде всего активность серы в чугунах значительно повышена по сравнению с ее активностью в сталях при постоянной ее концентрации. Это обусловлено высокой концентрацией углерода в чугунах и несколько повышенной концентрацией в них кремния (рис. 29).
б) Упругость паров щелочноземельных элементов над чугунами и соответственно скорость их испарения из чугунов значительно ниже вследствие пониженной примерно на 250-300 °С по сравнению с расплавленной сталью температурой десульфурируемых передельных чугунов. Это означает, что время пребывания щелочноземельных элементов в растворе в несвязанном, свободном состоянии несколько больше и, при ограниченных скоростях массопереноса серы, оно определяет более полное протекание реакций [Mg]+[S]=(MgS) или [Ca]+[S]=(CaS).
в) Величина изменения изобарно-изотермического потенциала окисления всех щелочноземельных металлов, находящихся в элементарном состоянии, значительно более отрицательна, чем при образовании ими сульфидов [61]. В связи с этим как на термодинамическую возможность, так и на кинетику процесса десульфурации положительное влияние оказывает весьма низкая активность кислорода в чугунах – обычно 0,003-0,006. При столь низких активностях кислорода значения G для обоих сравниваемых процессов сближаются.
г) Время пребывания Са или Mg в растворе в чугуне весьма ограничено. Относительно мало также и время пребывания в нем практически нерастворимых в чугунах сульфидов MgS или CaS. Поэтому значительная доля этих сульфидов выносится на поверхность контакта чугун-шлак за счет конвективных потоков чугуна находясь еще в молекулярно-дисперсном состоянии и переходит в шлак благодаря их высокой растворимости в последнем: kS=(S)/[S]. Часть образующихся сульфидов, зависящая от условий процесса десульфураци, успевает в процессе своего всплывания образовать соответствующие включения, которые иногда наблюдаются при металлографических исследованиях чугунов. При выдержке их в контакте с поглощающими серу шлаками такие включения также быстро ассимилируются шлаком.
Для успешной десульфурации чугунов основная задача металлургов состоит в обеспечении по возможности большей скорости ассимиляции вводимых щелочноземельных элементов металлическим расплавом и, таким образом, опережение их потери в газовую фазу. Это достигается при увеличении поверхности контакта чугуна и вводимых щелочноземельных элементов путем применения, например, магниевой стружки, порошкообразного магния, "магкон".
В США широко применяют карбид кальция, силицид кальция и цианамид кальция, производимых таким образом, что они защищены от гидратации при хранении, но распадаются на мелкие куски при вводе их в контакт с жидким чугуном.
В последние десятилетия в металлургии стали применяются значительно менее, чем кальций и магний распространенные в природе, но также весьма активные по отношению к сере, такие щелочноземельные элементы как барий и стронций и некоторые редкоземельные металлы – церий, ланктан, неодим, празеодим, иттрий. Сульфиды всех этих элементов значительно прочнее, чем сульфид железа, и практически нерастворимы в жидком металле. Однако рассмотрение десульфурирующего влияния этих элементов целесообразно привести в главе, посвященной "облагораживающей" обработке стали перед ее разливкой или даже в процессе кристаллизации, т.е. процессам уже не связанным с экстрагирующим влиянием шлака.
Химические взаимодействия шлаков и металла и серо-поглотительная способность шлаков.
 Практика
производства стали в основных
сталеплавильных агрегатах показывает
постепенное понижение концентрации
серы в металле и некоторое повышение
ее концентрации в шлаке – даже в те
периоды плавки, когда нельзя ожидать
образования нерастворимых в металле
сульфидов за счет взаимодействия атомов
растворенных в жидкой ванне металлов
и серы.
Практика
производства стали в основных
сталеплавильных агрегатах показывает
постепенное понижение концентрации
серы в металле и некоторое повышение
ее концентрации в шлаке – даже в те
периоды плавки, когда нельзя ожидать
образования нерастворимых в металле
сульфидов за счет взаимодействия атомов
растворенных в жидкой ванне металлов
и серы.
В период использования молекулярной гипотезы строения шлаков это объясняли за счет протекания реакций:
[FeS]+(CaO)=(CaS)+(FeO) или [FeS]+(MnO)=(MnS)+(FeO) или [FeS]+(MgO)=(MgS)+(FeO).
Эти реакции изучались многими исследователями. При этом было твердо установлено, что роль шлаков как десульфурирующей фазы значительно возрастает:
а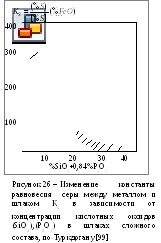 ) По
мере увеличения основности шлака,
выражаемой в той или иной форме, с учетом
концентраций основных оксидов (в первую
очередь СаО)
и за счет снижения содержания кислотных
оксидов (в основном SiO2).
) По
мере увеличения основности шлака,
выражаемой в той или иной форме, с учетом
концентраций основных оксидов (в первую
очередь СаО)
и за счет снижения содержания кислотных
оксидов (в основном SiO2).
б) Даже наиболее вероятная из перечисленных выше реакций реакция [FeS]+(CaO)= (CaS) + (FeO) не описывает полностью процесс перехода серы в шлак [55], он более сложен. Поэтому считалось более надежным изучать влияние тех или иных факторов не на константу равновесия этой реакции или двух других, а на условный коэффициент распределения серы между шлаком и металлом:
 S=(S)
/[S].
Это оказалось справедливым не только
по отношению к производственным условиям,
но также по отношению к лабораторным
плавкам, проведенным в довольно строгих
условиях [99], рис. 25, 26.
S=(S)
/[S].
Это оказалось справедливым не только
по отношению к производственным условиям,
но также по отношению к лабораторным
плавкам, проведенным в довольно строгих
условиях [99], рис. 25, 26.
в) В подавляющем большинстве работ была твердо установлена зависимость условного коэффициента распределения серы – S от содержания оксидов железа в шлаке и концентрации кислорода в металле (рис.27). Последователи "молекулярной теории" природы металлургических шлаков [113] считали, что процессы экстрагирования серы из металла шлаками и раскисления стали
органически взаимосвязаны. Они изображали этот сложный процесс системой уравнений – например, в случае десулъфурации чугунов известково-глиноземистым шлаком: [MeS](MeS); (MeS)+(CaO)=(CaS)+(MeO) и (MeO)+[C]= =[Me]+{CO}. Несомненным достоинством этой схемы является ее пригодность для экспериментальной проверки хода процесса десульфурации – например, по объему выделенной СО или по изменению исходной концентрации углерода в металле, что хорошо видно из рисунков (28, 29, 30). Таким образом, в настоящее время общепризнанна связь процессов десульфурации и раскисления металлов [106, 107, 114].
П рактика
промышленного использования сталей
показала, что в ряде конкретных условий
их службы эксплуатационные свойства
металла тем выше, чем ниже концентрация
серы в стали. На этом основании создалось
направление производства сталей с
весьма низким содержанием серы (в
особенности при плавке в дуговых печах).
Если в обычных условиях содержание серы
в "качественных" сталях менее
0,020-0,030 % считалось нормальным (и было
даже утверждено ГОСТами СССP), то в
настоящее время часто ставится задача
производства стали с содержанием серы
0,005-0,006 %, а иногда даже 0,001-0,003 %. В отдельных
случаях это оправдано необходимостью
производства крупных слитков и,
следовательно, учета ликвидации серы,
или же условиями непрерывной разливки
и связью склонности металла литых
заготовок к обра-зованию "горячих"
трещин при повышении содержания в нем
серы.
рактика
промышленного использования сталей
показала, что в ряде конкретных условий
их службы эксплуатационные свойства
металла тем выше, чем ниже концентрация
серы в стали. На этом основании создалось
направление производства сталей с
весьма низким содержанием серы (в
особенности при плавке в дуговых печах).
Если в обычных условиях содержание серы
в "качественных" сталях менее
0,020-0,030 % считалось нормальным (и было
даже утверждено ГОСТами СССP), то в
настоящее время часто ставится задача
производства стали с содержанием серы
0,005-0,006 %, а иногда даже 0,001-0,003 %. В отдельных
случаях это оправдано необходимостью
производства крупных слитков и,
следовательно, учета ликвидации серы,
или же условиями непрерывной разливки
и связью склонности металла литых
заготовок к обра-зованию "горячих"
трещин при повышении содержания в нем
серы.

В общем, в последние 40-50 лет развитие металлургии стали поставило ряд новых задач перед теорией десульфурации металла. Ионная теория строения шлаков показала, что переход серы из металла в шлак возможен:
1 )
по схеме Feж+[S]=Fe2++S2-,
имеющей основное значение для слабокислых
и невысоко основных и маложелезистых
шлаков; или
)
по схеме Feж+[S]=Fe2++S2-,
имеющей основное значение для слабокислых
и невысоко основных и маложелезистых
шлаков; или
2) по схеме [S]+O2-=S2-+[O], которая показывает и объясняет взаимосвязь между процессами и десулъфурации металла и его раскисления.
Схема 2 имеет особое значение для десульфурации металла высокоосновными шлаками. Константа равновесия этой реакции была вычислена в первом приближении через концентрации реагирующих компонентов [107]:
lgkS=lg([S](O2-))/([O](S2-))=(6500/T)–2,625; (98)
G=–124,57+0,050T кДж/моль. (99)
В настоящее время, благодаря работам В.А. Кожеурова, А.Г. Пономаренко и др. имеется возможность расчета активностей ионов в шлаках и некоторого уточнения уравнений (98) и (99).
Еще
Чипманом и др. [104, 107, 108] было установлено,
что при температурах и парциальных
давлениях в газовой фазе
![]() ,
обычных для плавки в основных мартеновских
печах на поверхности контакта газовой
фазы и шлака в известной мере возможен
процесс:
,
обычных для плавки в основных мартеновских
печах на поверхности контакта газовой
фазы и шлака в известной мере возможен
процесс:
![]() .
Более поздние исследования [109,110] показали
применимость этого процесса и к условиям
электроплавки, в соответствии с чем
сера может находиться в шлаке как в
сульфидной форме (в виде ионов S6+),
так и в сульфатном виде (в форме ионов
S2-).
Соотношение между активностями этих
ионов определяется окислительным
потенциалом газовой фазы и, в равновесных
условиях, химическим потенциалом
кислорода в шлаке (концентрацией оксидов
железа в шлаке, его основностью) [81].
Таким образом, при очень низких парциальных
давлениях кислорода (
.
Более поздние исследования [109,110] показали
применимость этого процесса и к условиям
электроплавки, в соответствии с чем
сера может находиться в шлаке как в
сульфидной форме (в виде ионов S6+),
так и в сульфатном виде (в форме ионов
S2-).
Соотношение между активностями этих
ионов определяется окислительным
потенциалом газовой фазы и, в равновесных
условиях, химическим потенциалом
кислорода в шлаке (концентрацией оксидов
железа в шлаке, его основностью) [81].
Таким образом, при очень низких парциальных
давлениях кислорода (![]() 1
Па) распределение серы между газовой
фазой и шлаком активно протекает по так
называемой сульфидной схеме:
1
Па) распределение серы между газовой
фазой и шлаком активно протекает по так
называемой сульфидной схеме:
1/2S2газ+(О2-)=О2газ+(S2-), т.е:
![]() , (100)
, (100)
При
более высоких парциальных давлениях
кислорода (![]() 10
Па) распределение серы происходит по
сульфатной схеме:
10
Па) распределение серы происходит по
сульфатной схеме:
1/2S2газ+3/2O2газ+(O2-)=![]() ;
;
![]() . (101)
. (101)
Сульфидная емкость шлаков была количественно оценена в работе [115], авторы которой для достижения низкого потенциала кислорода в газовой фазе и для контроля в ней потенциала серы применили смеси СО, СО2 и SO2. В работе [116] сульфидная емкость силикатных, преимущественно низкоосновных и кислых шлаков, упрощенно определялась по (см. уравнение 100) уравнению
![]() , (102)
, (102)
ч то
позволило авторам выполнить широкие
экспериментальные определения CS
при 1550 °С. Они показали, что даже в шлаках
системы FeO,
MnO,
SiO2,
близких к насыщению кремнеземом, lgCS
составляет 2-2,5 (рис. 31). Сульфидная емкость
шлаков имеет существенное значение,
например, при основной мартеновской
плавке в случае отопления печи
серосодержащими видами топлива.
то
позволило авторам выполнить широкие
экспериментальные определения CS
при 1550 °С. Они показали, что даже в шлаках
системы FeO,
MnO,
SiO2,
близких к насыщению кремнеземом, lgCS
составляет 2-2,5 (рис. 31). Сульфидная емкость
шлаков имеет существенное значение,
например, при основной мартеновской
плавке в случае отопления печи
серосодержащими видами топлива.
Сульфатная схема распределения серы между газовой фазой и шлаком имеет гораздо меньшее практическое значение. Поэтому решающую роль в десульфурации металла почти всегда играет переход серы из металла в шлак в форме сульфидов, а следовательно, поглотительная способность СS или емкость шлака по отношению к ионам S2-. В связи с этим определенный интерес представляет процесс 1/2S2газ+(O2-) =1/2O2газ+S2- и характеризующая его равновесие константа k1:
![]() ,
откуда
,
откуда
![]() ,
или
,
или
![]() , (103)
, (103)
![]()
![]() – активность ионов кислорода в шлаке.
– активность ионов кислорода в шлаке.
В
соответствии с теорией совершенных
ионных растворов
![]() характеризует (численно равняясь
концентрации свободных ионов О2-
за вычетом тех ионов кислорода, которые
вошли в состав сложных анионов
характеризует (численно равняясь
концентрации свободных ионов О2-
за вычетом тех ионов кислорода, которые
вошли в состав сложных анионов
![]() и т.д.) основность шлака. Ее приближенно
можно заменить суммой молярных долей
основных оксидов(Nосн).
и т.д.) основность шлака. Ее приближенно
можно заменить суммой молярных долей
основных оксидов(Nосн).
В
работе [81] приведен график зависимости
величины
![]() от
от
![]() (при постоянных температурах). Величину
(при постоянных температурах). Величину
![]() авторы, аналогично [115] и [116] называют
сульфидной емкостью шлака, которая
характеризует его способность поглощать
серу из газовой фазы различного состава
(с переменными значениями
авторы, аналогично [115] и [116] называют
сульфидной емкостью шлака, которая
характеризует его способность поглощать
серу из газовой фазы различного состава
(с переменными значениями
![]() и
и
![]() ).
Между сульфидной емкостью шлака и
величиной равновесного распределения
серы между шлаком и металлом при каждой
данной температуре имеется вполне
определенная связь.
).
Между сульфидной емкостью шлака и
величиной равновесного распределения
серы между шлаком и металлом при каждой
данной температуре имеется вполне
определенная связь.
