
- •Валентные состояния атомов углерода.Образование связей.
- •Оценка распределения электронной плотности в молекулах орг в-в. Способы передачи электронного влдияния атомов.
- •Реагенты, субстраты, свободные радикалы, электрофилы и нуклеофилы. Класасификация орг реакций.
- •Структурная и пространственная изомерия орг в-в.
- •Алканы и алкены. Сравнение. Сравнительная характеристика углеводородов.
- •Электронное строение бензола. Хим св-ва. Механизм реакции se.
- •Влияние ориентантов 1 и 2 рода на протекание реакций sе.
- •Альдегиды и кетоны.
Алканы и алкены. Сравнение. Сравнительная характеристика углеводородов.
|
характеристика |
Алканы |
Алкены |
|
1. Общая формула. |
Сn H2n+2 |
Cn H2n |
|
2. Тип гибридизации |
sp3 |
sp2 |
|
3. Отличительный признак. |
Одинарные связи |
Одна двойная связь |
|
4. Типы связи. |
σ |
σ и π |
|
5. Нахождение в природе. |
нефть, газ |
Нет |
|
6. Типы изомерии. |
Углеродного скелета |
Углеродного скелета, положения двойной связи, геометрическая (цис,транс), межклассовая. |
|
7. Химические свойства. |
Замещение, окисление, отщепление, разрушение цепи (крекинг, изомеризация) |
Присоединение, полимеризация, окисление. |
1.Алканы – ациклические предельные УВ линейного или разветвленного строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2, где n – число атомов углерода.
Алкены - ациклические непредельные УВ, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
2.Алканы. Каждый атом С в алканах находится в состоянии sp3-гибридизации и обр-т 4 σ- связи С-С и С-Н,углы м\у кот-ми равны 109,50.
Алкены.Атомы углерода при двойной связи находятся в состоянии sр2-гибридизации. Три σ-связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу. π-связь образована при перекрывании негибридных 2р-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Такое «боковое» перекрывание менее эффективно, чем осевое, и, следовательно, π-связь является менее прочной, чем σ-связь.
Физические св-ва.
При нормальных условиях первые четыре члена гомологического ряда алканов (Сг—С4) — газы без цвета и запаха. Алканы неразветвленного строения от С5 до С17 — бесцветные жидкости с характерным запахом бензина. Алканы, начиная с С18, — твердые вещества белого цвета, жирные на ощупь. По мере увеличения числа атомов углерода в цепи,е. с увеличением молекулярной массы, возрастают температуры кипения, плавления и плотность алканов. Все предельные углеводороды практически нерастворимы в воде, но растворяются в неполярных органических растворителях (бензол, тетрахлорме- тан). Жидкие и твердые алканы легко смешиваются друг с другом.
При обычных условиях алкены С2—С4 — это газообразные вещества без цвета и запаха, С5—С15 — бесцветные жидкости, начиная с С16 — твердые вещества. Алкены нерастворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси. По сравнению с алканами с тем же числом атомов углерода, алкены обладают немного более низкими температурами кипения и плавления.
7. Алканы. В обычных усл-х алканы инертны. Условия: высокая темпер-ра,кат, давление и облучение. Т.к. ковалентные связи в алканах неполярные/малополярные, то чаще всего при хим реак пр-т гомолитический разрыв таких связей. Наиб харак-ми для алканов яв-ся реак радикального замещения SR.
Алкены. Хим св-ва опр-ся наличием у алкенов двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами,поэтому многие реакции протекают по мех-му электрофильного присоединения, АЕ.
1.Галогенирование.
СН4 + Cl2 → CH3Cl + HCl
Хлорметан
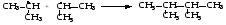
Механизм реакции хлорирования пропана.

Инициирование: появ-е в зоне реакции свободных радикалов. Под действ-м световой энергии гомолитически разруш-ся связь в мол-ле Cl:Cl на 2 атома хлора с неспаренными электронами (свободные радикалы) ·Cl:

Рост цепи: cвободные радикалы хлора, взаимод-я с мол-ми УВ, порождают новые радикалы и развивают цепь превращений:


Обрыв цепи:Радикалы,соед-сь др с др, обр-т мол-лы и обрывают цепь превращ-й:
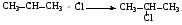


СН2=СН2 + Br2 = CH2-CH2
Br Br
Обесцвечивают бромную воду – качественная реакция на =.
2.Гидрогалогенирование (только для алкенов). При взаимодействии алкенов с галогеноводородами (HCI, НВг) образуются алкилгалогениды:
СН3-СН=СН2 + НВг→ СНз-СНВг-СНз.
3.Нитрование (алканы):
C6H14 + HO – NO2 → C6H13NO2 + H2О
нитрогексан
4.Сульфирование (алканы и алкены):
C4H10 + H2SO4 → C4H9 – SO2 – OH + H2O
Бутилсульфокислота
СН3-СН=СН3 + H2SO4 = CH3-CH-CH3
OSO3H
5.Сульфохлорирование (алканы).
R – Н + Cl2 + SO2 → R – SO2 – Cl + HCl
6. Гидратация. При взаимод алкенов с водой в присутствии минеральных кислот (серной, фосфорной) обр-ся спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН→СНз-СН (ОН)-СН3.
7.Гидрирование (алкены). Пропен – пропан.
8.Окисление.
При высокой температуре УВ воспламеняются и горят, причем пр-т полное разрушение органической молекулы, ведущее к образованию углекислого газа и воды.
СН4 + 2 О2 → СО2 + 2Н2О + 880кДж
при средних температурах, когда окисление протекает довольно энергично, но не приводит к воспламенению. Оказалось, что и в этом случае происходит частичное расщепление молекул углеводородов с образованием кислородсодержащих веществ, главным образом органических кислот.
СН4 → СН3ОН
СН3 – СН3 → СН3 – СН2ОН + СН3ОН + СН3 – СОН + СН3СООН
этанол метанол этаналь уксусная
кислота
Качественная реакция на алкены – обесцвечивание розового р-ра перманганата калия: 3СН2=СН2 + 2KMnO4 + 4H2O = 3СН2-СН2 + 2KOH + 2MnO2
ОН ОН этиленгликоль
Обесцвечивание кислого р-ра перманганата приводит к получ-ю орг карб к-т:
CH3-CH=CH-CH2-CH3 = CH3-COOH + CH3-CH2-COOH
9. Полимеризация. nCH2=CHR → (-CH2-CHR-)n,
где R — Н, СНз, Cl, C 6H5 и т.д. Молекулу CH2=CHR называют мономером, полученное соед-е — полимером, число п — степенью полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид др.
10. Крекинг. Это процесс гомолитического разрыва связей С—С, который протекает при нагревании органического вещества без доступа воздуха в присутствии катализатора или без него. При крекинге высших алканов углеродная цепочка рвется пополам с образованием алкана и алкена:
СН3—-СН2-СН2-СН2- СН2- CH3→ СН3—СН2—СН3 + СН2=СН—СН3.
гексан пропен пропан
