
- •1.Строение атома. Модели строения атома. Строение атома по Бору. Представления о квантовой механике.
- •2. Химическая связь. Природа и механизм образования химической связи. Метод валентных связей.
- •4.Кинетика химических процессов. Скорость химических реакций гомо- и гетерогенных систем. Влияние различных факторов на скорость химических реакций. Основной закон кинетики и правило Вант-Гоффа.
- •5. Химическое равновесие. Обратимые и необратимые химические реакции. Химическое равновесие в газовой фазе и условия его смещения (на примере хлороводорода и аммиака). Принцип Ле Шателье.
- •6. Комплексные соединения. Координационная теория Вернера. Номенклатура. Классификация. Устойчивость комплексных соединений. Константа нестойкости.
- •8. Концентрация растворов. Способы выражения концентрации растворов.
- •14. Квантово - механическая модель атома. Атомные орбитали. Квантовые числа.
- •20. Благородные газы.
- •21. Азот и его соединения.
2. Химическая связь. Природа и механизм образования химической связи. Метод валентных связей.
Химическая связь- переход вещества из атомарного состояния в молекулярное.
Происходит взаимодействие между положит и отрицат зарядом. Воз-т в основ за счет валент электронов. в наст время известны: ковалент полярная, неполярная, ионная, металлическая, водородная связь – при ее образовании происходит межмолекулярное взаимодействие эти межмолекулярные силы включают в себя 3 составляющие:
1. диполь-дипольное взаимодействие- при сближении полярных молекул, они ориентированы т.о., что положит сторона одного диполя была ориентирована к отрицат стороне др диполя.
2. индукционное взаимодействие- диполи взаимодействуют с неполярными молекулами превращая их в индукционные диполи (наведенные).
3. дисперсионное притяжение- в любой молекуле возникают флуктации (колебания Эл/плотности) в рез-те чего появ-ся мгновенные диполи, к-рые в свою очередь индуцир мгновенные диполи у сосед молекул.
.Мех-мы образ-я ковал св
обменный – образов ковалент св за счет электр одного атома и др электр второго атома
Н· + ·Н → Н−Н или Н · · Н
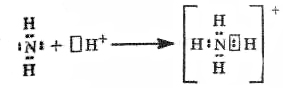
2)донорно-акцепторный – частица у кот есть свобод электрон- донор; частица у кот есть свобод орбиталь - акцептор. Атом азота связан с каждым атомом водорода общей электр парой одна из кот образована по донорно –акцептор мех-му.
Метод валентных связей 1927г. Гейтлери (Лондон). В м-де ВС предполагается, что атомы в мол-лах сохр-ют свою индивидуальность. Положения:
1)хим св между двумя атомами возн-ет как рез-т перекрывания атом орбиталей с образов-ем электр пар
2) атомы, вступ-щие в хим св обмениваются между собой электронами с образов-ем связующей пары
3)согласно пр-пу Паули св может образ-ся при взаим-е электронов с антипараллельными спинами
4)характер хим св определяется типом перекрывания атом орбиталей
Способ-ть атома присоед-ть или замещ-ть опред число др атомов с образ хим св наз валентностью
Ионная св Ион – положит или отриц заряжен частица, кот превращ в атомы в рез-те отдачи или присоед-и электронов. Ион св образ-ся между металлами и неметаллами, легче всего щелоч и щелочно-земел металлами и галогенами, т.е. типичные соединения с ион св галогениды щелоч металлов (NaCL,KBr)
Механизм образов ион св – за счет электростатического притяжения между двумя противоположно заряж ионами, образ-ся в рез-те перехода электронов. Между образ ионами действуют силы электростат притяж-я, поэт возник хим св. Чем меньше размеры ионов и чем меньше их заряд, тем сильнее у них электростатическое поле и прочнее хим св. Ион св обладает насыщаемостью и направляемостью. В об условиях ионные соед-я кристалл в-ва, а весь кристалл гигантская мол-ла хорошо раств в воде, легко диссоц.
В тв состоянии не проводят эл ток. При попытке деформации 1 слой ионов будет двигаться относительно др, тогда одноименно заряж ионы начнут отталкиваться и поэт разм
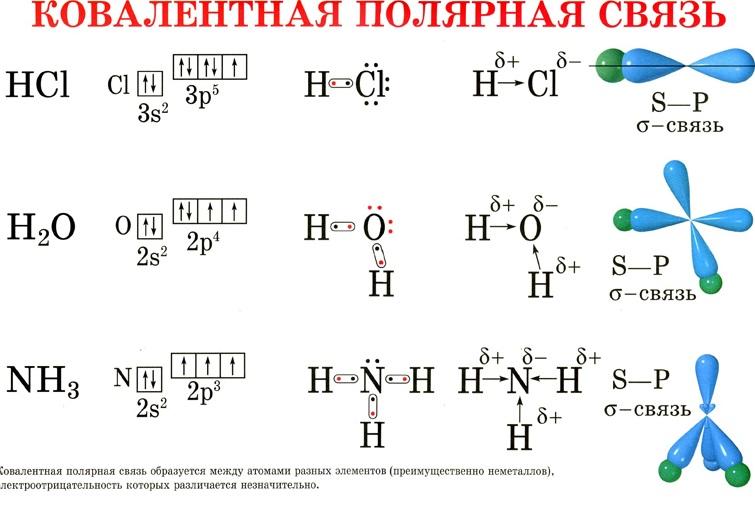
Ковалентная связь образуется двумя электронами с противоп направленными спинами. Ков св бывает полярной (образ между атомами разных хим эл-ов, смещ-ся в сторону более электроотриц атома – NH3, CH4) и неполярной (образ атомами одних и тех же хим эл-ов, хар-на для неметаллов – CL2,N2,O2,H2)
Атом Н им 1s1 эл об, внеш энергет уровень у него не завершен. Для его завершен не хватает 1 электр. При сближении атомов Н сила притяж-я растет. Атомы притягив-ся др к др.Атомы сближ-ся пока силы притяж-я = силы отталкивания. Эл об-ки перекрыв-ся электр, кот двиг-ся в поле одного ядра и в поле др. Об-ка на некот время будет заполнена. Характер-ся длиной, насыщ (могут обр-ся в огран кол-ве), энергией, направлен.
Сходства: ионная св возникает из ковалентной предельной односторонней поляризацией (смещением) общей электрон пары. Энергия, длина, полярность, порядок и валентный угол
Различия: ионная св в отличии от ковалент характеризуется ненаправленностью и ненасыщаемостью. В-ва с ионной связью растворяются в полярных растворителях (вода, спирт), а не полярные в неполярных (бензол, хлороформ).
Металлическая связь- связь между положит ионами в кристаллах Ме, осущ за счет притяжения электронов, свободно перемещ по кристаллу.
Водородная связь- связь м/д положит заряжен атомом водорода одной молекулы и отриц заряж атомом др молекулы.
Ван-дер-ваальсовая связь- межмолек взаимод, взаимод за счет наведенных дипольных моментов.
3.Параметры химической связи. Сходства и различия ковалентной и ионной связи.
Химический связь – явления взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающих частиц, которое сопровождается уменьшением полной энергии систем. Параметры химической связи: химическая связь осуществляется s- и p-электронами внешнего и d-электронами предвнешего слоя.
Это связь характеризуется следующими параметрами:
1.Длина связи – межъядерное расстояние между двумя химически связынными атомами.
2. Валентным углом – угол между воображаемыми линиями, проходящими через центры химически связанных атомов.
3. Энергия связи – количество энергии, затрачиваемой на ее разрыв в газообразном состояни.
4. Направленность связи – АО пространственно ориентированы, то перекрывание Эл/облаков происходит по опред направл , что и обуславливает направл ковалентной связи. (хар-но только для ковалентной связи)
σ- связь перекрывание идет по линии, к-рые соед ценры атомных орбиталей ( s+s, p+p, s+p). Π связь- перекрывание по 2 сторонам линии, к-рые соед центры снизу и сверху (p+p, d+p)
5. Насыщаемость связи – способность атомов участвовать в образовании ограниченного числа ковалентных связей (огран число электронов, к-рые нах-ся во внеш оболочке атомов) хар- на только для ковалентной связи.
6. Полярность – смещение общей Эл/пары. H: Cl
7. Кратность (порядок) связи- число общих Эл/пар. Кр= Nсв-Nразр/2. кратность связи м.б. целым или дробным числом.
Химическая связь между атомами, возникающую путем обобществления электронов с образованием общих электронных пар, называют ковалентной.
Обменный механизм, например, реализуется при образовании химической связи в молекуле водорода Н2. Электронная плотность возникает за счет перекрывания s-орбиталей каждого атома, содержащих по одному неспаренному электрону.
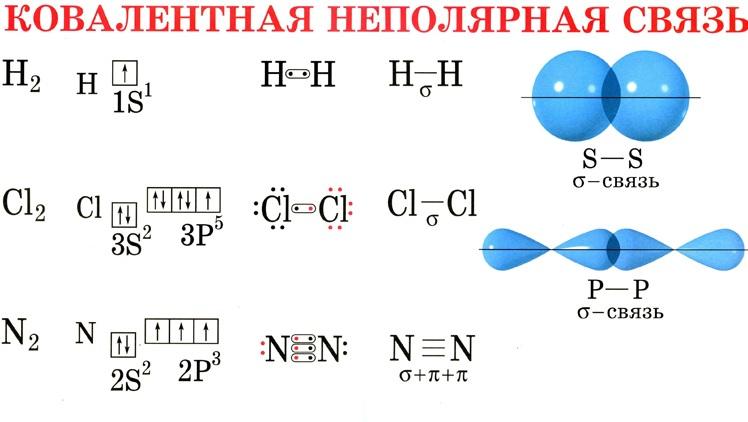
В приведенных примерах к.с. связаны атомы одного и того же элемента, т.е. атомы с одинаковой электроотрицательностью. Электронная плотность связи в равной мере принадлежит обоим атомам. К.с., образующуюся между атомами с одинаковыми электроотрицательностью, наз-ют неполярной.
Электроны с образованием ковалентной связи могут атомы с различной электроотрицательностью. Х .с. в молекуле аммиака образуется за счет перекрывания s-орбитали атомов водорода и р-обриталей атомов азота, содержащих неспаренные электроны. Атомы азота значительно электроотрицательно, чем водород, поэтому в большей степени притягивает к себе общ. электронные пары. К.с. м/у атомами с различными электроотрицательностью наз-ют полярной.
Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной. В молекуле аммиака каждый атом завершил свою электронную оболочку до конфигурации блогародного газа: азат приобрел 8 электронов, водород- по 2. У азата имеется неподеленная пара электронов, за счет которой он может образовать четвертую хим.связь. В качестве такой частиц катион водорода. Атом азота-донор, катион водорода –акцептор.
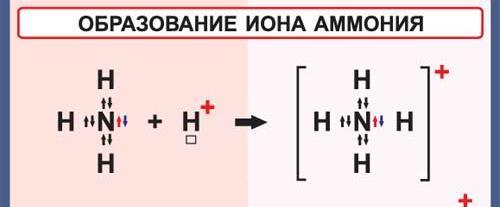
Такой механизм наз-ся донорно-акцепторный.
Химическая связь м/у катионами и анионами, обусловленная их взаимными притяжения ми, наз-ся ионной.

Сходства: ионная св возникает из ковалентной предельной односторонней поляризацией (смещением) общей электрон пары. Энергия, длина, полярность, порядок и валентный угол
Различия: Ионная связь, в отличие от ковалентной, ненаправлена и ненасыщаема. Ионы можно представить в виде заряженных сфер, силовые поля которых равномерно распространяются в пространстве. Поэтому ион может притягивать к себе ион противоположного знака в любом направлении - отсюда ненаправленность связи. Взаимодействие друг с другом двух ионов не компенсирует силовые поля полностью, остается способность притягивать ионы в других направлениях - отсюда ненасыщаемость. Ионные соединения обладают рядом отличительных особенностей.
Ионные соединения в твердом состоянии образуют кристаллы, в которых закономерно расположены в пространстве (+) и (-) ионы.
Ионные соединения обладают повышенной температурой кипения и плавления.
В расплавленном состоянии обладают электропроводностью (и в растворах тоже).
Хорошо растворяются в полярных растворителях, например, в воде.
