
- •1. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •2. Гетерогенный катализ: основные стадии, энергетический профиль
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Фотохимические реакции. Примеры. Законы фотохимии. Квантовый выход.
- •1. Исходные постулаты термодинамики. Термические и калорические уравнения состояния
- •2. Основные приближенные методы химической кинетики: квазиравновесное и квазистационарное приближения. Условия применимости, энергетические кривые.
- •1. Коллигативные свойства растворов (электролиты и неэлектролиты)
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики
- •1. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье
- •2. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости
- •1. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •2. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •1. Электродвижущая сила (эдс), ее связь с термодинамическими величинами. Типы электрохимических ячеек.
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации.
- •1. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •2. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •1. Третий закон термодинамики. Абсолютная энтропия.
- •2. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •1. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •1. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для обратимых реакций первого порядка.
- •1. Обратимые реакции:
- •2. Параллельные реакции:
- •3. Последовательные реакции:
- •1. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для параллельных реакций первого порядка. Термодинамический и кинетический контроль.
- •1. Обратимые реакции:
- •2. Параллельные реакции
- •1. Вычисление абсолютной энтропии из экспериментальных данных.
- •2. Гетерогенные системы. Фазовый состав. Условия фазового равновесия. Правило фаз Гиббса.
- •1. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •2. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •1. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •2. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •1. Объединение 1-ого и 2-ого законов. Фундаментальные уравнения Гиббса для закрытых и открытых систем. Энергии Гельмгольца и Гиббса. Термодинамические потенциалы.
- •2. Осмос. Осмотическое давление. Уравнение Вант-Гоффа и область его применимости
- •1. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора
- •2. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа
- •1. Энтальпия и 1-й закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость
- •2. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Эдс и ее связь с термодинамическими функциями.
- •1. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях
- •2. Простейшая схема ферментативного катализа и ее кинетический анализ. Формула Михаэлиса-Ментен
- •1. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса
- •2. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними
- •1. Зависимость энтальпии и энтропии индивидуального вещества от температуры и давления
- •2. Связь кинетических и термодинамических величин на примере обратимых элементарных реакции 1-го порядка
- •1. Уравнения изотермы, изохоры и изобары реакции
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации
- •1. Уравнения Гиббса-Гельмгольца. Соотношения Максвелла. Связь калорического и термического уравнения состояния
- •2. Растворы. Способы выражения химического состава и связь между ними
- •1. Закон Гесса. Энтальпия образования. Термохимические циклы. Энтальпия химической связи.
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики: закон действующих масс, принцип независимости химических реакций, принцип лимитирующей стадии
- •1. Связь константы равновесия с изменением стандартных термодинамических величин в реакции. Закон действующих масс для гетерогенных реакций и реакций в растворах
- •2. Коллигативные свойства растворов. Осмос. Формула Вант-Гоффа. Криоскопия и эбуллиоскопия
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Дисперсные системы и их классификация. Поверхностное натяжение и его проявление. Смачивание. Поверхностно-активные вещества и механизм его действия
- •1. Количество вещества как внешний параметр открытой системы. Диффузионный контакт между системами. Химический потенциал.
- •2. Зависимость константы равновесия от температуры и давления
- •1. Фундаментальное уравнение Гиббса в переменных p и t. Критерии самопроизвольности процесса и равновесия
- •2. Изотерма, изобара и изостера адсорбции. Уравнение Ленгмюра. Простейшие модельные представления в теории адсорбции.
1. Электродвижущая сила (эдс), ее связь с термодинамическими величинами. Типы электрохимических ячеек.
В химических цепях источником электрической энергии является энергия Гиббса протекающей в системе окислительно-восстановительной («токообразующей») химической реакции. Реакции окисления и восстановления («полуреакции») в гальваническом элементе протекают на разных электродах, т.е. пространственно разделены. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, – катодом. Электроны, образовавшиеся в процессе окисления на аноде, перемещаются по внешней цепи к катоду, на котором они участвуют в процессе восстановления.
Электрохимическая цепь называется правильно разомкнутой, если на ее концах находятся одинаковые металлы. Разность потенциалов на концах правильно разомкнутой цепи называется электродвижущей силой.
Если гальванический элемент работает обратимо при постоянных температуре и давлении, то его ЭДС однозначно связана с ΔG протекающей в нем химической реакции. В этих условиях уменьшение энергии Гиббса равно полезной работе, которую может совершить система, т е. электрической работе, которую может совершить гальванический элемент:
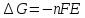
где n – число электронов, участвующих в реакции, F – постоянная Фарадея, E – ЭДС элемента.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля–Якоби):
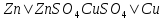
или
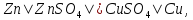
где
сплошная вертикальная линия | обозначает
границу раздела между разными фазами,
пунктирная вертикальная линия
 – границу между разными растворами, а
двойная сплошная вертикальная линия
|| – солевой мостик. Гальванический
элемент принято записывать так, чтобы
анод находился слева.
– границу между разными растворами, а
двойная сплошная вертикальная линия
|| – солевой мостик. Гальванический
элемент принято записывать так, чтобы
анод находился слева.
Электродные реакции обычно записывают как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый
электрод:
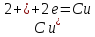
Левый
электрод:
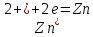
Общая
реакция:
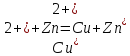 .
.
ЭДС элемента равна разности потенциалов правого и левого электродов:
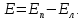
Если
ЭДС элемента положительна, то реакция
протекает самопроизвольно, поскольку
для этой реакции
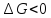 .
Если ЭДС элемента отрицательна, то
самопроизвольно протекает обратная
реакция.
.
Если ЭДС элемента отрицательна, то
самопроизвольно протекает обратная
реакция.
• гальванические элементы (источники тока одноразового действия; после расходования реагентов становятся неработоспособными)
• аккумуляторы (можно использовать многократно, при пропускании постоянного тока от внешнего источника происходит регенерация израсходованных реагентов (зарядка аккумулятора))
• топливные элементы (способны непрерывно работать в течение длительного времени, пока к электродам подводятся реагенты)
2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
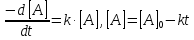
где [A] – концентрация исходного вещества.
Реакции 1-го порядка. В реакциях типа A → B скорость прямо пропорциональна концентрации:
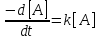
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a – x(t), где x(t) – концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции первого порядка и его решение имеют вид:
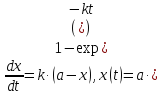
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:

Время,
за которое распадается половина вещества
A, называют периодом полураспада
τ1/2. Он определяется уравнением
x(τ1/2) = a/2 и равен
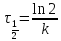
Реакции 2-го порядка. В реакциях типа A + B → D + … скорость прямо пропорциональна произведению концентраций:
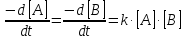
Начальные концентрации веществ: [A]0 = a, [B]0 = b; текущие концентрации: [A] = a – x(t), [B] = b – x(t). При решении этого уравнения различают два случая.
1. Одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
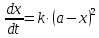
Решение этого уравнения записывают в различных формах:
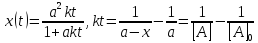
Период
полураспада веществ A и B одинаков и
равен:
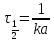
Примеры: газофазное разложение иодоводорода 2HI → H2 + I2, разложение оксида азота 2NO2 → 2NO + O2.
2. Начальные концентрации веществ A и B различны: a ≠ b. Кинетическое уравнение имеет вид:
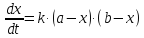
Решение этого уравнения можно записать следующим образом:
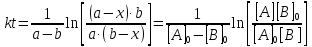
Периоды полураспада веществ A и B различны: τ1/2 (A) ≠ τ1/2 (B) .
Реакции n-го порядка nA → D + … С учетом стехиометрического коэффициента, кинетическое уравнение имеет вид:

а его решение выглядит следующим образом:
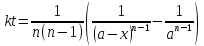
Период полураспада вещества A обратно пропорционален (n – 1)-й степени начальной концентрации:
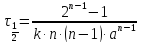
Билет 8.
