
- •Введение
- •1.Охрана окружающей среды от вредных выбросов и способы их подавления
- •1.1 Характеристика выбросов от тэс и котельных и проблема охраны окружающей среды.
- •Обезвреживание вредных выбросов
- •Постановка задачи исследования
- •2. Основы рабочего процесса в противоточном полом скруббере-абсорбере
- •2.1 Процессы взаимодействия твердых частиц с каплями жидкости
- •2.2. Повышение степени очистки от диоксида серы при использовании щелочных свойств золы.
- •Процессы, происходящие в жидкой фазе.
Процессы, происходящие в жидкой фазе.
Процессы происходящие в газовой фазе в аппаратах мокрой очистки достаточно подробно описаны в литературе /1, 21, 24, 25 и др./. Поэтому в данном разделе особое внимание будет уделено описанию процессов, протекающих в жидкой фазе, так как в большинстве интересующих нас случаев они являются определяющими с точки зрения улавливания вредных компонентов из дымовых газов.
При растворении двуокиси серы в воде, часть растворенного газа вступает в реакцию с молекулами растворителя - воды с образованием неустойчивой сернистой кислоты, которая в водном растворе частично может диссоциировать на ионы /21, 22/:
SO2+H2O
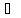 H2SO3
H2SO3
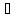 H++HSO3-
H++HSO3-
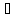 H++SO32-
(2.2.9)
H++SO32-
(2.2.9)
Обратимый характер поглощения SO2 водой ограничивает ее растворимость. Поглощенная двуокись серы присутствует в растворе в виде физически растворенной двуокиси серы, не диссоциированной сернистой кислоты и ионов HSO3- и SO32-. В отсутствии других химически активных поглотителей двуокиси серы в воде, эти четыре вида серы, перешедших в раствор и будут определять степень извлечения SO2 из газовой фазы. Содержание ионов HSO3- и SO32- в значительной степени будет зависеть от температуры и водородного показателя раствора рН. Если водородный показатель не превышает 5, то согласно /21, 22/, вторая степень диссоциации сернистой кислоты отсутствует, тогда общая концентрация всех видов двуокиси серы в растворе будет равна:
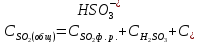 ,
(2.2.10)
,
(2.2.10)
Если водородный показатель не превышает 7, то необходимо учитывать вторую степень диссоциации сернистой кислоты. Общее содержание всех модификаций двуокиси серы тогда определяется как:
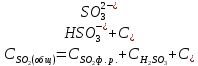 (2.2.11)
(2.2.11)
где
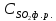 - концентрация
физически растворенной двуокиси серы;
- концентрация
физически растворенной двуокиси серы;
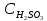 – концентрация
недиссоциированной сернистой кислоты;
– концентрация
недиссоциированной сернистой кислоты;
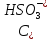 - концентрация
ионов, продиссоциировавших по первой
ступени;
- концентрация
ионов, продиссоциировавших по первой
ступени;
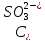 - концентрация
ионов, продиссоциировавших по второй
ступени.
- концентрация
ионов, продиссоциировавших по второй
ступени.
Следует
заметить, что при рН ≤ 5 дополнительную
концетрацию ионов водорода, возникших
вследствие диссоциации сернистой
кислоты
по
первой ступени, можно определить:
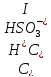 .
.
Суммарную концентрацию ионов водорода, определяющую рН раствора можно найти как:
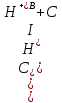 (2.2.12)
(2.2.12)
где
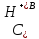 - концентрация
ионов водорода в отсутствие диссоциации
сернистой кислоты.
- концентрация
ионов водорода в отсутствие диссоциации
сернистой кислоты.
Таким образом, на основе теории электролитической диссоциации, согласно /22/, выражение для расчета общей концентрации всех видов двуокиси серы в водном растворе при рН ≤ 5 можно пред ставить в виде:
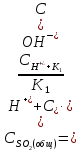 (2.2.13)
(2.2.13)
где
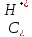 - суммарная
концентрация ионов водорода, моль/л,
определяется из выражения
- суммарная
концентрация ионов водорода, моль/л,
определяется из выражения
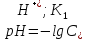 – константа диссоциации H2SO3
по первой ступени, моль/л.
– константа диссоциации H2SO3
по первой ступени, моль/л.
Во втором случае, при рН ≤ 7 следует учитывать вторую ступень диссоциации сернистой кислоты, вследствие которой общая концентрация ионов водорода в растворе увеличится:
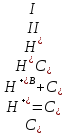 (2.2.14)
(2.2.14)
Общая концентрация всех модификаций двуокиси серы в растворе тогда будет:
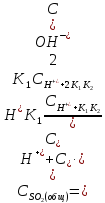 ,
(2.2.15)
,
(2.2.15)
где К2 - константа второй ступени диссоциации сернистой кислоты, моль-л.
В случае, когда рН>7, то водный раствор будет щелочным и процессы, происходящие при абсорбции таким раствором следует рассматривать с учетом химических реакций.
При
растворении двуокиси серы в водном
растворе, содержащим
поглотители
(основания, соли кислот, основных солей
и др.) в орошающей воде кроме ионов
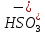 ,
,
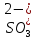 ,
H+
и OH-,
могут присутствовать ионы металлов
Me+(в
данном случае преимущественно Сa2+),
анионы
кислот А-(
,
H+
и OH-,
могут присутствовать ионы металлов
Me+(в
данном случае преимущественно Сa2+),
анионы
кислот А-(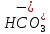
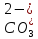 обуславливающие
щелочность раствора). При этом следует
иметь ввиду, что содержание ионов кальция
Ca2+
можно
определить по общему содержанию щелочных
ионов (OH-,
обуславливающие
щелочность раствора). При этом следует
иметь ввиду, что содержание ионов кальция
Ca2+
можно
определить по общему содержанию щелочных
ионов (OH-,
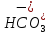 ,
,
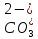 ).
Общее содержание связанной и несвязанной
двуокиси серы в таком растворе, согласно
указаниям /22/, можно принять равным:
).
Общее содержание связанной и несвязанной
двуокиси серы в таком растворе, согласно
указаниям /22/, можно принять равным:
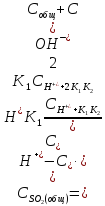 (2.2.16)
(2.2.16)
