
Весна 16 курс 3 ОрТОР / Теория АД / ТАДСтарков / Термодинамика и теплопередача Никифоров А.И.-1
.pdf81
υ2
в) L = pdυ ;
υ1
S2
г) ∆s1-2 = ds = s2 – s1.
S1
5. Определяют закон распределения энергии (α) для данного процесса по формуле α = ∆U/q.
Все величины, указанные в п. 2 и 4, могут быть найдены как аналитически по уравнениям, так и графически с помощью рабочей «p–υ» диаграммы и тепловой «T–s» диаграммы. Поэтому любой расчет процесса всегда сопровождается графическим построением процесса в этих координатах.
3.2. Изохорный процесс: определение, осуществление,
исследование
Термодинамический процесс, протекающий при постоянном объеме
(удельном объеме) рабочего тела, называется изохорным (от греч. изос —
«равный» и хора — «пространство»).
Вавиационной технике процессы, близкие к изохорным, протекают:
в кислородной и воздушных системах воздушного судна при изменении высоты полета;
в отдельных элементах конструкции самолетов и вертолетов: в
пневматиках колес, в амортизационных стойках, в бортовых баллонах со сжатыми газами при изменении температуры окружающей среды;
в камерах сгорания поршневых двигателей.
82
3.2.1.Исследование изохорного процесса
1.Условие протекания процесса и есть уравнение процесса
|
|
υ = const. |
(3.1) |
||||
Используя уравнение состояния идеального газа, получим уравнение |
|||||||
изохорного процесса через параметры состояния |
|
||||||
p = |
R |
T = (const)T или p = f (T). |
(3.2) |
||||
|
|||||||
|
υ |
|
|
|
|
||
2. Очевидно (см. уравнение (3.2)), что давление в изохорном процессе |
|||||||
изменяется прямопропорционально абсолютной температуре: |
|
||||||
|
|
|
p1 |
|
T1 |
. |
(3.3) |
|
|
|
|
|
|||
|
|
|
p2 |
|
T2 |
|
|
3. Графическое построение процесса.
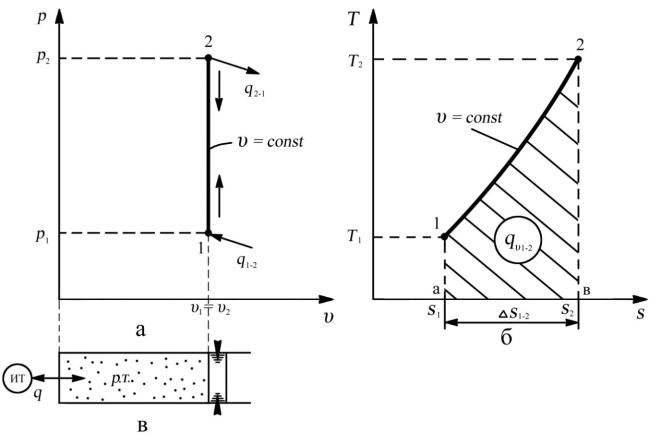
Рис. 3.1. Изохорный процесс: а — рабочая диаграмма; б — тепловая диаграмма;
в — осуществление процесса

83
4. Определение величин, входящих в первый закон термодинамики.
|
|
T2 |
|
А. |
qυ = |
CdT = Cυ (T2 – T1); |
(3.4) |
|
|
T1 |
|
|
|
T2 |
|
Б. |
∆Uυ = CυdT = C (T2 – T1); |
(3.5) |
|
|
|
T1 |
|
|
|
υ2 |
|
В. |
Lυ = |
pdυ = p (υ2 – υ1) = 0, |
(3.6) |
|
|
υ1 |
|
так как υ2 = υ1, то есть газом в изохорном процессе работа не совершается.
Таким образом, в изохорном процессе согласно первому закону термодинамики вся теплота, подводимая к рабочему телу, расходуется только на увеличение внутренней энергии (увеличение температуры), при этом происходит увеличение давления в соответствии с уравнением (3.3). При отводе теплоты внутренняя энергия рабочего тела уменьшается, соответственно уменьшаются температура и давление. Поэтому для изохорного процесса первый закон термодинамики будет иметь следующий вид:
qυ = ∆Uυ = Cυ∆T . (3.7)
Используя графическое построение изохорного процесса в тепловой «T–s»
диаграмме (рис. 3.1, б), определим количество теплоты qυ1-2, участвующей в изохорном процессе. Площадь под линией изохорного процесса в тепловой
«T–s» диаграмме дает количество тепла qυ1-2. Если кривизна линии 1–2 не очень значительна (что бывает при небольшом изменении температуры), то приближенно можно считать, что площадь под кривой 1–2 равна площади прямолинейной трапеции а12в:
пл. а12в = a1 в2 ав .
2
Заменяя длины отрезков а1 и в2 значениями температур, а отрезка ав — изменением энтропии, получим приближенную формулу для вычисления количества теплоты:
|
84 |
|
|
|
qυ 1-2 |
= |
T1 T2 |
s1 2 . |
(3.8) |
|
||||
|
2 |
|
|
|
Или из первого закона термодинамики и определения энтропии имеем: |
||||
qυ 1-2 |
= ∆U = T ∆s1-2 . |
(3.9) |
||
Знак количества теплоты определяется знаком изменения энтропии. Если
∆s1-2 > 0, то это значит, что теплота подводится и qυ 1-2 > 0. Если ∆s1-2 < 0, то теплота отводится и qυ 1-2 < 0.
Г. Определим изменение энтропии для изохорного процесса, используя
аналитическое выражение первого закона термодинамики (2.43):
dU = T ds – pdυ.
Так как для изохорного процесса υ = const и учитывая, что dυ = 0, dU = CυdT,
имеем CυdT = Tds и получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
ds = Cυ |
dT |
. |
|
|
|
|
(3.10) |
|||||
|
T |
|
|
|
||||||||
Для того чтобы найти изменение энтропии ∆s1-2 |
при конечном изменении |
|||||||||||
температуры T , проинтегрируем выражение (3.10): |
|
|
|
|
||||||||
2 |
T2 |
dT |
|
|
|
|
|
|
||||
ds Сυ |
. |
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
1 |
T1 |
|
T |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
При интегрировании считаем, что Cυ не зависит от T и окончательно |
||||||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
p2 |
|
p2 |
|
||
∆s1-2 = s2 – s1 = Cυ ln |
|
|
= Cυ ln |
|
= Cυ·2,3 lg |
|
. |
(3.11) |
||||
T |
|
p |
p |
|||||||||
|
1 |
1 |
1 |
|
|
|||||||
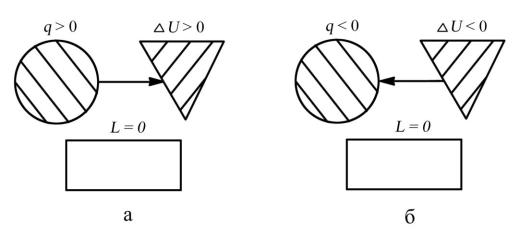
5. Распределение энергии в изохорном процессе изобразим в виде схем, |
||||||||||||
представленных на рис. 3.2, а и 3.2, |
б. Коэффициент распределения энергии |
|||||||||||
α = ∆U/q = 1. |
|
|
|
|
|
|
|
|
|
|
|
|
85
Рис. 3.2. Распределение энергии в изохорном процессе: а — при подводе теплоты к рабочему телу (процесс 1–2); б — при отводе теплоты от рабочего тела (процесс 2–1)
3.3. Изобарный процесс: определение, осуществление исследование
Термодинамический процесс, протекающий при постоянном давлении рабочего тела, называется изобарным (от греч. изос — «равный» и барос —
«тяжесть»).
Примером процесса, близкого к изобарному, является процесс подвода теплоты к рабочему телу в камерах сгорания авиационных ГТД.
3.3.1. Исследование изобарного процесса |
|
||
1. Условие протекания процесса и есть уравнение процесса: |
|
||
|
|
p = const. |
(3.12) |
Используя уравнение состояния идеального газа, получим уравнение |
|||
изобарного процесса через параметры состояния: |
|
||
υ = |
R |
T = (const) T , или υ = f(T) . |
(3.13) |
|
|||
|
p |
|
|
2. Очевидно (см. уравнение (3.13)), что удельный объем в изобарном процессе изменяется пропорционально абсолютной температуре:
86
υ1 |
|
T1 |
. |
(3.14) |
|
|
|||
υ2 |
|
T2 |
|
|
Если подводить теплоту к рабочему телу, его удельный объем (υ) и
температура (Т) возрастают, а давление (р) останется неизменным (р = const).
Физически это объясняется тем, что уменьшение числа молекул, приходящихся на единицу площади поверхности, вызванное ростом удельного объема,
компенсируется увеличением силы ударов каждой молекулы, обусловленным увеличением температуры (энергии) молекул.
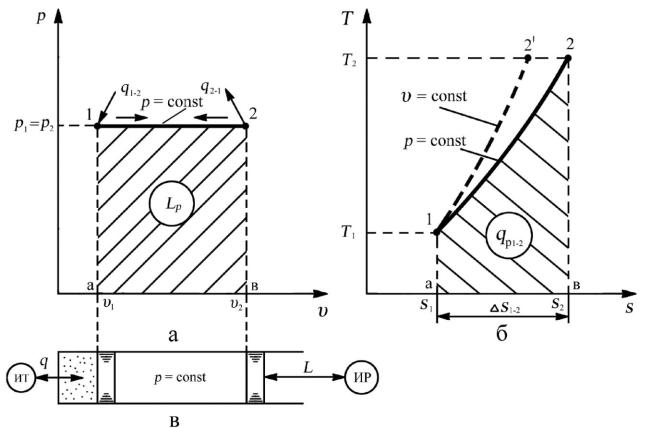
3. Графическое построение процесса.
Рис. 3.3. Изобарный процесс: а — рабочая диаграмма; б — тепловая диаграмма;
в — осуществление процесса
87
4. Определение величин, входящих в первый закон термодинамики.
|
|
T2 |
|
А. |
qp = |
CdT = Cp (T2 – T1); |
(3.15) |
|
|
T1 |
|
|
|
T2 |
|
Б. |
∆Up = CυdT = Cυ (T2 – T1); |
(3.16) |
|
|
|
T1 |
|
|
|
υ2 |
|
В. Lp = |
pdυ = p (υ2 – υ1) = R (T2 – T1). |
(3.17) |
|
|
|
υ1 |
|
Всоответствии с формулой (3.17) работа расширения — сжатия совпадает
сработой проталкивания. Следовательно, в открытой ТДС работа L
расходуется на перемещение газа из области высокого давления в область низкого давления в процессе расширения. Такой процесс происходит в камере сгорания ГТД.
Таким образом, теплота, подводимая к рабочему телу в изобарном процессе, расходуется на увеличение внутренней энергии рабочего тела и совершения работы против внешних сил:
qp = ∆Up + Lp . (3.18)
Теплота qp 1-2, участвующая в изобарном процессе, определяется из тепловой диаграммы (рис. 3.2, б). Площадь под линией процесса в тепловой
«T–s» диаграмме дает qp 1-2:
qp 1-2 = пл. а12в ≈ |
a1 в2 |
ав = |
T1 T2 |
s1 2 . |
(3.19) |
|
2 |
2 |
|||||
|
|
|
|
Г. Определим изменение энтропии для изобарного процесса, используя аналитическое выражение первого закона термодинамики через энтальпию
(2.44):
qp 1-2 = T ds = di + υdp. |
|
Так как для изобарного процесса p = const и учитывая, |
что dp = 0, |
получаем: |
|
qp 1-2 = Tds = di = СpdT . |
(3.20) |
88
Из уравнения (3.20) следует, что вся теплота, подведенная к рабочему телу,
идет на изменение энтальпии.
2 |
T2 |
dT |
|
|
Проинтегрируем выражение (3.20) => ds Cp |
и определим |
|||
T |
||||
1 |
T1 |
|
||
|
|
|||
изменение энтропии ∆s1-2 при конечном изменении температуры Т. При интегрировании считаем, что Сp не зависит от Т. Окончательно получаем:
∆s1-2 = s2 – s1 = C ln |
T2 |
= Cp ln |
υ2 |
= Cp·2,3 lg |
Т |
2 |
. |
(3.21) |
||||||||||
|
|
|||||||||||||||||
T |
υ |
Т |
|
|||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
5. Распределение энергии количественно оценивает коэффициент |
|
|||||||||||||||||
U |
|
Сυ (T2 T1) |
|
Сυ |
|
|
1 |
|
|
|
|
|
||||||
α = q |
|
|
|
|
|
|
|
. |
|
|
(3.22) |
|||||||
С |
p |
(T T ) |
С |
p |
k |
|
|
|||||||||||
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|||
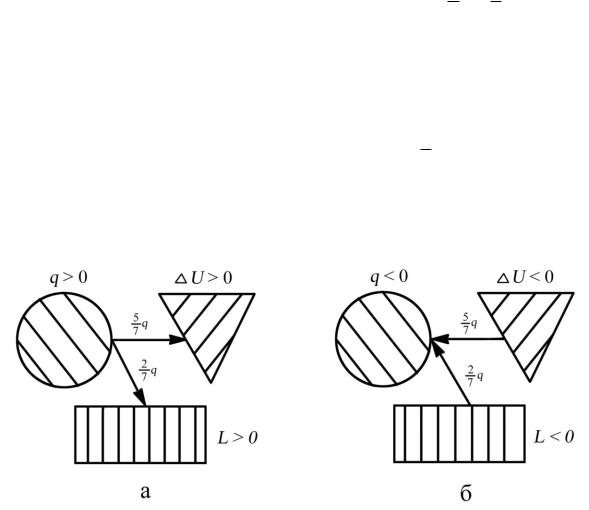
Для воздуха k = 1,41, поэтому из (3.22) имеем: ∆U = k1 q 75 q . Согласно первому закону термодинамики это означает, что из подведенного тепла q в
изобарном процессе бόльшая часть ( |
5 |
q ) расходуется на изменение |
|
7 |
|||
|
|
2
внутренней энергии рабочего тела, а меньшая часть ( 7 q ) — на совершение работы против внешних сил (рис. 3.4, а и 3.4, б).
Рис. 3.4. Распределение энергии в изобарном процессе: а — при подводе теплоты к рабочему телу (процесс 1–2); б — при отводе теплоты от рабочего тела (процесс 2–1)
89
Сравнение графиков изохорного и изобарного процессов в тепловой «T–s»
диаграмме (рис. 3.3, б) позволяет заметить их внешнее сходство, поэтому важно уметь различать, каким образом эти две зависимости υ = const (линия 1–2') и p = const (линия 1–2) располагаются относительно друг друга при одинаковых начальных параметрах рабочего тела. Изохора в тепловой «T–s» диаграмме будет круче, чем изобара в тех же координатах, по той причине, что подведенное тепло в изохорном процессе идет только на увеличение внутренней энергии рабочего тела. Естественно, повышение температуры рабочего тела происходит более интенсивно, чем в изобарном процессе, в
котором часть подведенного тепла идет на совершение работы.
3.4. Изотермический процесс: определение, осуществление, исследование
Термодинамический процесс, протекающий при постоянной температуре рабочего тела, называется изотермическим (от греч. изос — «равный»; терме
— «тепло», «жар»). Примером изотермического процесса может служить процесс сжатия воздуха в компрессоре ГТД при условии, что в него производится впрыск легкоиспаряющейся жидкости. В компрессоре жидкость испаряется за счет теплоты, выделившейся при сжатии воздуха. Тем самым обеспечивается постоянство температуры. Такой способ иногда используется для увеличения тяги (мощности) ГТД.
3.4.1.Исследование изотермического процесса
1.Условие протекания и есть уравнение процесса:
T = const. |
(3.23) |
Поскольку T = const, значит dT = 0, а |
dq ≠ 0, то теплоемкость |
изотермического процесса CT = dq/dT = ± ∞. |
|
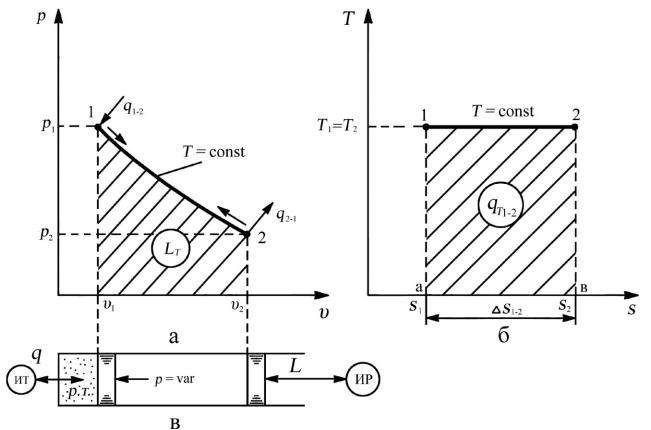
90
Воспользовавшись условием протекания процесса и уравнением состояния идеального газа (pυ = RT), получим уравнение изотермического процесса через параметры состояния:
pυ = p1υ1 = p2υ2 = const. |
(3.24) |
||||
2. Из уравнения (3.24) очевидно, что давление в изотермическом процессе |
|||||
изменяется обратно пропорционально изменению удельного объема: |
|
||||
|
p2 |
υ1 |
. |
(3.25) |
|
|
p1 |
|
υ2 |
||
|
|
|
|
||
3. Графическое построение процесса.
Рис. 3.5. Изотермический процесс: а — рабочая диаграмма; б — тепловая диаграмма; в —
осуществление процесса
