
Весна 16 курс 3 ОрТОР / Теория АД / ТАДСтарков / Термодинамика и теплопередача Никифоров А.И.-1
.pdf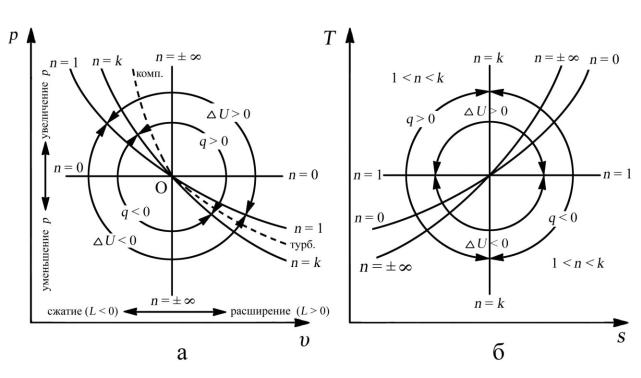
101
|
|
|
|
|
|
lg |
|
p1 |
|
||||
|
p |
n lg |
υ |
|
|
|
p |
2 |
|
|
|
|
|
lg |
1 |
2 |
, |
то есть n = |
|
|
|
|
|
. |
(3.50) |
||
p |
υ |
lg |
|
υ2 |
|||||||||
|
2 |
|
1 |
|
|
|
υ1 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Для каждого из реальных необратимых процессов значения показателей политропы лежат в тех диапазонах, которые определяются расположением кривой реального процесса. Так, в реальном компрессоре кривая процесса сжатия (линия О–комп., см. рис. 3.10. ) располагается между адиабатой (n = k) и
изохорой (n = ± ∞). Следовательно, теоретически показатель политропы процесса сжатия в компрессоре nкомп. (k < n комп < ∞) ненамного превышает показатель адиабаты k.
Рис. 3.10. Области политропных процессов: а — в «p–υ» координатах;
б — в «T–s» координатах
102
Обработка показателей многих компрессоров показывает, что
nкомп = 1,46—1,47 > kвозд = 1,41.
В реальной газовой турбине кривая процесса расширения линия О—турб. (см. рис. 3.10) лежит между адиабатой (n = k) и изохорой (n = 1), и теоретически k < nтурб. < 1. Но практически показатель политропы процесса расширения в турбине nтурб. гораздо ближе к показателю адиабаты и составляет
nтурб. = 1,27—1,29 < kг ; для продуктов сгорания kг = 1,33.
3. Определение величин, входящих в первый закон термодинамики:
а) qn = Сn(T2 – T1), |
(3.51) |
||||
где Сn — теплоемкость газа в политропном процессе; |
|
||||
б) –∆U = Cυ(T2 – T1); |
(3.52) |
||||
в) Ln = |
1 |
|
R(T1 T2 ) . |
(3.53) |
|
|
|
||||
n 1 |
|||||
|
|
|
|||
Это уравнение аналогично соответствующему уравнению для адиабатного процесса и отличается от него только значением показателя политропы n.
Найдем формулу для вычисления Сn в произвольном политропном процессе. Для этого подставим в уравнение первого закона термодинамики величины qn, ∆U, Ln их аналитическое выражение. В результате получим:
qn = ∆U + Ln ;
Сn∆T = Cυ∆T + |
|
R T |
|
|||||
|
|
; |
|
|
|
|||
|
1 n |
|
||||||
|
R |
|
|
n k |
|
|||
Сn = Cυ + |
|
, или |
Сn = Cυ |
|
. |
(3.54) |
||
1 n |
n 1 |
|||||||
Это выражение показывает, что если считать теплоемкость Cυ не зависящей от температуры, то Сn для идеального газа в политропном процессе будет постоянна, и ее можно всегда найти, зная Cυ, R и n.
4. Каждому политропному процессу соответствует свое распределение энергии. Поскольку таких процессов множество, исследовать их все не представляется возможным. Однако качественное суждение о характере

103
распределения энергии в любом политропном процессе можно сделать,
рассмотрев его расположение по отношению к известным нам процессам:
изохорному, изобарному, изотермическому и адиабатному (рис. 3.10), которые являются частными случаями политропных процессов. Уравнение каждого из них можно представить в виде pυn = const со своим значением показателя политропы.
Действительно, при n = 0 уравнение политропы получает вид: pυ0 = p·1 = const, или p = const (изобарный процесс).
Изобарный процесс (n = 0) делит область политропных процессов на две части. Процессы, графики которых расположены выше изобары, происходят с увеличением давления, ниже изобары — с уменьшением давления.
При n = 1 уравнение политропы описывает изотермический процесс: pυ1 = pυ = const.
Изотермический процесс разделяет все процессы на две группы.
Политропы, расположенные выше изотермы, соответствуют процессам,
которые сопровождаются увеличением внутренней энергии (повышением температуры), ниже изотермы — уменьшением внутренней энергии
(понижением температуры).
При n = k политропы совпадают с адиабатой: pυk = const.
Адиабатный процесс (n = k) делит все политропные процессы на две группы. Если политропа расположена выше адиабаты, ей соответствует процесс, который протекает с подводом теплоты (q > 0) к рабочему телу, а если ниже адиабаты, то с отводом теплоты (q < 0) от рабочего тела.
При n = ± ∞ (при очень больших абсолютных значениях n) уравнение политропы преобразуется в уравнение изохоры. Извлекая корень степени n из уравнения политропы, получим
1
n pυn pnυ const .
pυn pnυ const .

104
При n → ± ∞ величина 1 0 ; p 1 1 , следовательно, при n = ± ∞ n n
получаем υ = const.
Изохорный процесс (n = ± ∞) разделяет всю область политропных процессов на две части. Политропы, расположенные справа от изохоры,
соответствуют процессам, которые осуществляются с увеличением объема;
следовательно, газом при этом совершается работа расширения против внешних сил (L > 0). Если политропы расположены слева от изохоры, то такой процесс происходит с уменьшением объема. При этом внешние силы совершают над газом работу (L < 0), сжимая его.
Таким образом, если известны показатель политропы и характер или график процесса, то можно определить, при каких условиях он может осуществляться: с подводом или отводом теплоты; с увеличением или уменьшением внутренней энергии; с совершением механической работы рабочим телом или внешними силами над рабочим телом.
Покажем области политропных процессов в зависимости от показателя политропы в координатах «p–υ» и «T–s».
3.8. Энтальпийная «i–s» диаграмма («i–s» координаты)
Недостатком диаграмм, построенных в «T–s» координатах, является необходимость вычислять площади отдельных участков диаграммы при определении теплоты q и работы L процесса, изменения внутренней энергии ∆u
и энтальпии ∆i газа. Этого недостатка лишены диаграммы состояния,
построенные в «i–s» координатах (энтальпия — энтропия), где величины q, L,
∆u, ∆i определяются по отрезкам прямых. Данная особенность «i–s» координат упрощает анализ и расчет термодинамических процессов.
Рассмотрим протекание основных процессов с идеальными газами в «i–s»
координатах (рис. 3.11).
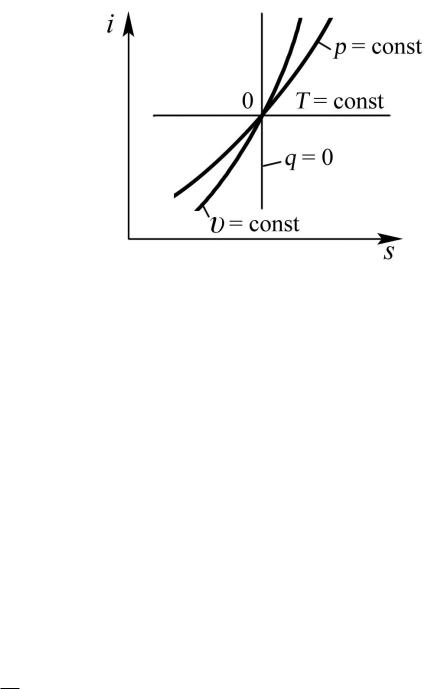
105
Рис. 3.11. Изображение основных термодинамических процессов в «i–s» координатах
Обратимый адиабатный процесс изображается в «i–s» координатах, как и
в «T–s» координатах, прямой вертикальной линией (s = const).
Изотермический процесс. Для идеального газа |
|||||
|
di = СpdT, |
|
(3.55) |
||
поэтому |
|
|
|
|
|
|
i |
T |
|
|
|
|
|
|
Сp |
. |
|
|
|
||||
|
s |
s |
|
|
|
|
|
T |
|
T |
|
|
|
|
|
T |
|
Поскольку в изотермическом процессе |
|
= 0, то в случае идеального |
|||
|
|
|
|
s T |
|
i
газа = 0. Следовательно, изотерма идеального газа в «i–s» координатах
s T
представляет собой горизонтальную прямую. |
|
Изобарный процесс. Здесъ |
|
dq = Tds = СpdT = di. |
(3.56) |
Изобара представляет собой кривую линию, тангенс угла наклона касательной к которой
|
106 |
|
|
|
|
|
|
|
|
i |
|
|
|
tg p |
|
|
|
|
T. |
(3.57) |
|
|
|||||
|
|
s p |
|
|
||
Так как в изобарном процессе с |
ростом энтальпии |
увеличивается |
||||
температура газа Т, то возрастает и γр. Следовательно, изобара обращена выпуклостью к оси абсцисс.
Изохорный процесс. По аналогии с изобарным процессом можно записать
dq = Tds = СυdT = |
di |
, |
||||
|
||||||
k |
||||||
отсюда |
|
|
|
|
|
|
|
|
i |
|
|
|
|
tg υ |
|
|
|
kT ktg p . |
||
|
||||||
|
|
s υ |
|
|
|
|
(3.58)
(3.57)
Следовательно, изохора так же, как и изобара, представляет собой кривую линию, обращенную выпуклостью к оси абсцисс. Взаимное расположение изобары и изохоры в «i–s» координатах (рис. 3.11) аналогично с их расположением в «T–s» координатах.
С помощью «i–s» диаграммы нетрудно определить основные термодинамические величины. Зная положение точек начала 1 и конца 2 процесса, непосредственно из диаграммы определяются параметры газа в этих
точках p1, T1, υ1, p2, T2, υ2 и величины
∆i = i2 – i1 и ∆s = s2 – s1 .
Изменение внутренней энергии найдемпо формуле
∆u = ∆i – (p2υ2 – p1υ1).
Величины теплоты и работы зависят от типа процесса и определяются следующим образом:
в изобарном процессе q = ∆i, L = q – ∆u;
в изохорном працессе q = ∆u;
в изотермическом процессе q = T∆s, L = q;
в адиабатном процессе L = – ∆u.
Особое значение «i–s» диаграммы имеют в расчетах термодинамических
процессов с реальными газами, у которых значительно меняются теплоемкость
и другие свойства, что затрудняет использование аналитических формул.

107
Примеры решения задач
Задача 3.1
Баллон с азотом емкостью 40 литров вносят с улицы, где температура –30 °С, в
помещение с температурой +20 °С. Какое давление будет в баллоне и сколько азот воспримет теплоты, если его температура сравняется с температурой помещения?
Первоначальное давление в баллоне 98·105 Па. Теплоемкость азота считать постоянной и равной Cυ = 742 Дж/(кг·К).
Решение
При нагревании баллона его объем практически не изменится (υ = const),
следовательно, происходит изохорный процесс. Применяя формулу (3.3), определим давление в баллоне при температуре 20 °С:
|
T2 |
273 |
20 |
||
p2 = p1 |
|
= 98·105· |
|
|
= 118·105 Па. |
T |
273 |
30 |
|||
1 |
|
|
|
|
|
Проверим правильность получения размерности давления
К
Па· К = Па.
По уравнению состояния (1.10) найдем массу азота в баллоне, имея в виду, что 1 литр =
10-3 м3:
|
|
|
|
|
|
|
|
p V |
|
98 105 40 10 3 |
|
|
|
|
|
|
|
|
m = |
1 |
1 |
|
= 5,43 кг, |
||
|
|
|
|
|
|
R |
T |
297 243 |
||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
N2 |
1 |
|
|
|
где R |
R |
|
Rун |
|
8314 |
= 297 Дж/(кг·К) — газовая постоянная азота |
||||||
|
|
|
||||||||||
N2 |
|
|
N |
|
28 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(см. формулу 1.14), или ее значение может быть взято из справочных таблиц.
Проверим правильность получения размерности газовой постоянной и массы азота.
Универсальная газовая постоянная по величине одинакова для всех газов и имеет величину и размерность Rун = 8314 Дж/(кмоль·К), а масса одного киломоля азота N2 = 28
кг/кмоль. Таким образом, размерность газовой постоянной азота
Дж/(кмоль К) |
Дж/(кг К) , |
|
кг/кмоль |
||
|
а размерность массы азота

|
|
108 |
|
Па м3 |
(Н / м2 ) м3 |
||
|
|
|
= кг. |
Дж/(кг К) К |
(Н м)/(кг К) К |
||
Теперь определим теплоту, воспринимаемую азотом при его нагреве от –30 °С до +20 °С:
Q = mCυ(T2 – T1) = 5,43·742· (293 – 243) = 201,45 кДж.
Размерность теплоты, воспринимаемой азотом,:
кг |
кДж |
К кДж . |
|
(кг К) |
|||
|
|
Задача 3.2
Воздух сжимается в поршневом компрессоре от 1·105 Па до 7·105 Па. Начальная температура воздуха 300 К, объѐм цилиндра 1,5 литра. Как изменяется температура и объем воздуха, если сжатие производится: а) по адиабате; б) по изотерме; в) по политропе с показателем политропы n = 1,2?
Решение
Адиабатное сжатие
Показатель адиабаты для воздуха определяется по формуле (2.28) или может быть взят из справочных таблиц:
k = Сp 1005 1,4 . Cυ 718
Используя зависимости (3.34) и (3.39), между параметрами в адиабатном процессе находим искомые значения объема и температуры воздуха в конце адиабатного сжатия:
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
||
|
|
p1 |
|
k |
|
|
|
1 10 |
5 |
|
1,4 |
|
|
|
|
|
|
|
|
-3 |
|
|
|
|
|
|
-3 |
3 |
|||
V2 |
= V1 |
|
|
= 1,5·10 |
|
|
7 10 |
5 |
|
= 0,376·10 |
|
м = 0,376 л; |
|||
|
|
p2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
k 1 |
|
|
|
1,4 1 |
|
|||
|
p2 |
k |
|
|
7 10 |
5 |
|
1,4 |
|
|
||
|
|
|
|
|
|
|
||||||
T2 |
= T1 |
p |
|
= 300 |
1 105 |
|
= 528 К. |
|||||
|
|
1 |
|
|
|
|
|
|
||||
Изотермическое сжатие
Температура в конце процесса сжатия равна температуре в начале процесса по условию протекания изотермического процесса, поэтому
T2 = T1 = 300 К.
Объем в конце процесса сжатия определяется по уравнению (3.25):
|
|
109 |
|
|
|
p |
|
1 105 |
|
1 |
= 1,5·10-3· |
|
= 0,214·10-3 м3 = 0,214 л. |
|
V2 = V1 |
|
|
||
p2 |
7 105 |
|||
Политропное сжатие
Искомые параметры воздуха в конце политропного процесса сжатия находим по
формулам (3.49) и (3.47):
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
|
|
|
|
|
|
1,2 1 |
|
|
|
||||
|
|
|
|
|
|
p2 |
n |
|
|
|
7 10 |
5 |
|
1,2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
T2 |
= T1 |
p |
|
|
|
= 300 |
1 105 |
|
= 416 К; |
|||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||||
|
|
p1 |
|
|
n |
|
|
|
|
|
|
|
1 10 |
5 |
|
|
1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-3 |
|
|
|
|
|
|
|
|
|
|
|
-3 |
3 |
||||||
V2 |
= V1 |
p2 |
|
= 1,5·10 |
|
|
|
7 10 |
5 |
|
= 0,297·10 |
|
м = 0,297 л. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Задача 3.3
Один килограмм воздуха сжимается адиабатно от начальной температуры t1 = 20 °C и
давления p1 = 2·105 Па до давления p2 = 16·105 Па. Нужно определить температуру в конце сжатия, конечный объем и работу, затраченную на сжатие. Для воздуха принять: k = 1,4; R =
287 Дж/(кг·К).
Решение
Из соотношения параметров в адиабатном процессе (3.39) определим температуру в конце процесса сжатия:
|
|
|
|
k 1 |
|
|
|
1,4 1 |
|
|||
|
p2 |
k |
|
|
16 10 |
5 |
|
1,4 |
|
|
||
|
|
|
|
|
|
|
||||||
T2 |
= T1 |
p |
|
= 293 |
2 105 |
|
= 532 К. |
|||||
|
|
1 |
|
|
|
|
|
|
||||
Из уравнения состояния (1.11) находим конечный объем 1 кг (υ2) воздуха:
|
RT |
|
287 532 |
|
υ2 = |
2 |
|
= 0,095 м3/кг. |
|
p |
16 105 |
|||
|
2 |
|
|
|
Работу, затраченную на сжатие воздуха, находим по формуле (3.43):
Lад. сж. = |
1 |
|
R(T1 T2 ) |
287 |
|
(293 532) = – 171 482 Дж/кг. |
|
k 1 |
1,4 1 |
||||||
|
|
|
|||||
Знак «минус» в полученном результате означает, что адиабатная работа сжатия воздуха совершена внешними силами над воздухом.
110
Задача 3.4
Определить показатель политропы процесса сжатия азота, если давление повышается от 1·105 Па до 8·105 Па, а температура — от 293 до 450 К. Значение газовой постоянной азота определено в задаче 3.1.
Решение
Удельные объемы азота в начале и в конце процесса сжатия находим по уравнению
состояния (1.11):
|
RT1 |
|
297 293 |
3 |
|||
υ1 = |
p |
1 |
105 |
|
= 0,87 м /кг; |
||
|
|||||||
|
1 |
|
|
|
|
|
|
|
RT2 |
|
297 450 |
3 |
||
υ2 = |
p |
8 |
105 |
= 0,167 м /кг. |
||
|
||||||
|
2 |
|
|
|
|
|
Значение показателя политропы определяется из соотношения (3.50):
|
lg |
|
p2 |
|
|
lg |
8 105 |
|
|
|
|
|||
|
|
p1 |
|
|
1 105 |
|
|
0,903 |
1,26. |
|||||
n = |
|
υ1 |
|
|
|
|
|
|
||||||
|
|
|
|
|
0,87 |
|
|
|
0,716 |
|
||||
|
lg |
|
|
|
lg |
|
|
|
|
|||||
|
|
υ2 |
|
|
0,167 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
