
- •6. Какой объем газов (дм3, н. У.) выделяется при полном термическом разложении 4,26 г нитрата алюминия согласно уравнению реакции:
- •0,582 Г меди растворили в азотной кислоте, полученную соль разложили, в результате получили 0,728 г оксида меди. Вычислить эквивалент меди.
- •7. При разложении 40 г kMnO4, содержащего 21% термически устойчивых примесей, получено 37,44 г твердого остатка. Определите массы веществ в твердом остатке.
- •26. К раствору, содержащему 9,66 г карбоната калия, по каплям прибавили раствор, содержащий 6,3 г азотной кислоты. Определите массы полученных продуктов.
- •33. В разбавленный азотной кислоте растворено 128 г меди. Какая масса hno3 (в расчете на 100%-ную) была израсходована на окисление и какая масса на солеобразование?
- •41. После прокаливания 25 г Cu(no3)2 масса твердого остатка составила 22,84 г. Определите объем (дм3, н. У.) кислорода, выделившегося при прокаливании.
- •48. При полном разложении смеси нитрата и нитрита аммония при нагревании до 150°с получена смесь газов объемом 5,824 дм3 (н. У.) с dh2 19,538. Найдите ω(nh4no2) в исходной смеси.
- •3. Относительная плотность паров по кислороду продукта взаимодействия избытка бромной воды с алкеном 6,75. Какова формула алкена?
- •7. Алкен присоединяет 24,3 г hBr. При взаимодействии продукта с избытком водного раствора щелочи с выходом 60% получен спирт массой 10,8 г. Что это за алкен?
3. Относительная плотность паров по кислороду продукта взаимодействия избытка бромной воды с алкеном 6,75. Какова формула алкена?
M(CnH2nBr2) = 6,75*32 = 216 г/моль
M(CnH2n) = 216 – 2*80 = 56 = 14n
n = 4
Ответ: C4H8
7. Алкен присоединяет 24,3 г hBr. При взаимодействии продукта с избытком водного раствора щелочи с выходом 60% получен спирт массой 10,8 г. Что это за алкен?
CnH2n + HBr = CnH2n+1Br
CnH2n+1Br + KOH(H2O) = CnH2n+1OH + KBr
m(CnH2n+1OH) = 10,8/0,6 = 18 г
n(CnH2n+1OH) = n(HBr) = 24,3/81 = 0,3 моль
M(CnH2n+1OH) = 18/0,3 = 60 г/моль
12n + 2n + 1 + 17 = 60
14n = 42
n = 3
Ответ: C3H6 - пропен
22. Оксид углерода (IV) объемом 836 см3 (н. у.) пропускали над раскаленным углем массой 0,105 г и затем полученную смесь газов – над раскаленным CuO массой 1,4 г. Какой объем раствора с ω(HNO3) = 20% (ρ = 1,12 г/см3) нужен для полного растворения твердого продукта реакции?
n(CO2) = 0,836/22,4 = 0,03732 моль
n(C) = 0,105/12 = 0,00875 моль
C + CO2 = 2CO
C – в недостатке. Образуется 0,00875*2 = 0,0175 моль CO. Остается 0,03732 – 0,00875 = 0,02857 моль CO2.
n(CuO) = 1,4/80 = 0,0175 моль
CuO + CO2 → ×
CuO + CO = Cu + CO2
n(Cu) = n(CuO) = n(CO) = 0,0175 моль
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
n(HNO3) = (8/3)n(Cu) = 0,0467 моль
m(HNO3) = 0,0467*63 = 2,94 г
m(HNO3, 20%) = 2,94*100/20 = 14,7 г
V(HNO3, 20%) = 14,7/1,12 = 13,125 мл
Ответ: 13,125 мл
20. Газ, полученный при прокаливании 8,0 г фосфорита с избытком угля и песка, пропущен при нагревании над 12,0 г CuO. Полученная при этом смесь веществ была обработана 87,7 см3 раствора с ω(H2SO4) = 19,6% (ρ = 1,147 г/см3), в результате массовая доля кислоты снизилась до 14,1%. Найдите ω(Ca3(PO4)2) во взятом образце фосфорита.
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 4P↑ + 10CO↑
CuO + CO = Cu + CO2
P + H2SO4 (разб) → ×
CO2 + H2SO4 (разб) → ×
Cu + H2SO4 (разб.) → ×
CuO + H2SO4 = CuSO4 + H2O (CO в недостатке)
m(H2SO4) = 87,7*1,147*0,196 = 19,716 г
0,141 = (19,716 – 98*n(CuO))/(87,7*1,147 + 80n(CuO))
14,183 + 11,28n(CuO) = 19,716 – 98n(CuO)
109,28n(CuO) = 5,533
n(CuO) = 0,05 моль
n(CO) = n(CuO нач.) – n(CuO) = 12/80 – 0,05 = 0,1 моль
n(Ca3(PO4)2) = n(CO)/5 = 0,02 моль
m(Ca3(PO4)2) = 0,02*310 = 6,2 г
ω(Ca3(PO4)2) = (6,2/8)*100% = 77,5%
Ответ: 77,5%
17. Газ, полученный при сжигании 5,6 дм3 (н. у.) смеси этана и пропана, относительная плотность которой по водороду равна 19,9, пропустили в 160 г раствора с массовой долей NaOH 20%. Чему равны массы всех веществ в конечном растворе?
C2H6 + 3,5O2 = 2CO2 + 3H2O
C3H8 + 5O2 = 3CO2 + 4H2O
Пусть этана x моль, а пропана y моль. Тогда: x + y = 5,6/22,4 = 0,25
M(смеси) = 19,9*2 = 39,8 г/моль
 30x
+ 44y
= 0,25*39,8 = 9,95
30x
+ 44y
= 0,25*39,8 = 9,95
x + y = 0,25
30x + 44y = 9,95
x = 0,25 – y
7,5 – 30y + 44y = 9,95
y = 0,175
x = 0,075
n(CO2) = 2x + 3y = 0,15 + 0,525 = 0,675 моль
n(NaOH) = 160*0,2/40 = 0,8 моль
2NaOH + CO2 = Na2CO3
Образуется 0,8/2 = 0,4 моль Na2CO3, остается 0,675 – 0,4 = 0,275 моль CO2
Na2CO3 + CO2 + H2O = 2NaHCO3
Образуется 2*0,275 = 0,55 моль NaHCO3. Остается 0,4 – 0,275 = 0,125 моль Na2CO3.
m(NaHCO3) = 0,55*84 = 46,2 г
m(Na2CO3) = 0,125*106 = 13,25 г
Ответ: 46,2 г NaHCO3, 13,25 г Na2CO3
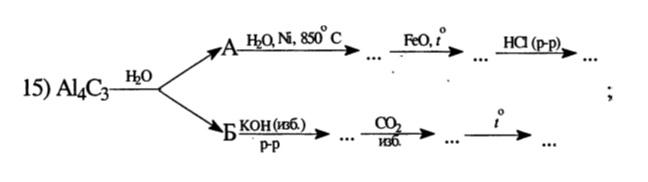
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑
A – CH4, Б – Al(OH)3
CH4 + H2O (Ni, 850°С) = CO + 3H2
FeO + H2 = Fe + H2O
Fe + 2HCl = FeCl2 + H2↑
Al(OH)3 + KOH = K[Al(OH)4]
K[Al(OH)4] + CO2 = Al(OH)3↓ + KHCO3
2Al(OH)3 = Al2O3 + 3H2O↑

C + 2H2SO4 (конц.) = CO2↑ + 2SO2↑ + 2H2O
A – SO2, Б – CO2
SO2 + 2H2S = 3S↓ + 2H2O
S + Al = Al2S3
CO2 + Ba(OH)2 = BaCO3↓ + H2O
BaCO3 + CO2 + H2O = Ba(HCO3)2
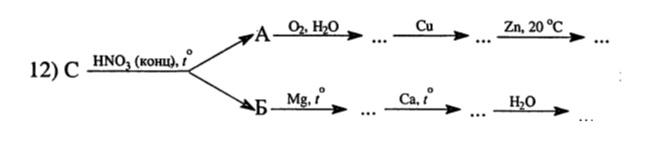
C + 4HNO3 (конц, гор.) = CO2↑ + 4NO2↑ + 2H2O
A – NO2, Б – CO2
4NO2 + O2 + 2H2O = 4HNO3
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
(3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O)
Cu(NO3)2 + Zn = Zn(NO3)2 + Cu↓
2Mg + CO2 = C + 2MgO
Ca + 2C = CaC2
CaC2 + 2H2O = Ca(OH)2↓ + C2H2↑
37. Какую массу KOH нужно добавить к раствору H3PO4 массой 500 г (ω = 49%), чтобы массовые доли средней соли и гидрофосфата калия стали равными?
H3PO4 + 3KOH = K3PO4 + 3H2O
H3PO4 + 2KOH = K2HPO4 + 2H2O
H3PO4 расходуется полностью.
n(H3PO4) = 500*0,49/98 = 2,5 моль
 Пусть
x
моль KOH
образует фостфат, а y
моль KOH
– гидрофосфат калия. Тогда:
Пусть
x
моль KOH
образует фостфат, а y
моль KOH
– гидрофосфат калия. Тогда:
(1/3)x + (½)y = 2,5
(1/3)x*212 = (½)y*174
2x + 3y = 15
2x*212 = 3y*174
x = y*3*174/(2*212) = 261y/212
522y/212 + 636y/212 = 3180/212
y = 3180/1158 = 2,75
x = 3,38
m(KOH) = 56*(x + y) = 343,3 г
Ответ: 343,3 г
23. В какой массе раствора с ω(H3PO4) = 62% нужно растворить при кипячении весь P2O5, полученный при сжигании 3,1 г фосфора, чтобы получить раствор с ω(H3PO4) = 71%?
2P + (5/2)O2 = P2O5
n(P2O5) = (½)n(P) = 0,5*3,1/31 = 0,05 моль
m(P2O5) = 0,05*142 = 7,1 г
P2O5 + 3H2O = 2H3PO4
m(H3PO4 из P2O5) = 2*0,05*98 = 9,8 г
m(H3PO4 из 62% р-ра) = 0,62x
x – масса 62% р-ра
0,71 = (0,62x + 9,8)/(x + 7,1)
0,71x + 5,041 = 0,62x + 9,8
0,09x = 4,759
x = 52,9
Ответ: 52,9 г
13. Продукт, полученный при взаимодействии красного фосфора и бертолетовой соли, растворили при нагревании в 400 см3 раствора с ω(H3PO4) = 85% (ρ = 1,7 г/см3), при этом массовая доля кислоты стала равной 94,4 %. Найдите массы израсходованных красного фосфора и хлората калия.
6P + 5KClO3 = 3P2O5 + 5KCl
P2O5 + 3H2O = 2H3PO4
n(P2O5) = x моль
0,944 = (2x*98 + 0,85*400*1,7)/(400*1,7 + 142x)
641,92 + 134,048x = 196x + 578
63,92 = 61,952x
x = 1,03
n(P) = 2x = 2,06 моль
n(KClO3) = (5/3)x = 1,72 моль
m(P) = 2,06*31 = 63,9 г
m(KClO3) = 1,72*122,5 = 210,7 г
Ответ: m(P) = 63,9 г, m(KClO3) = 210,7 г
55. На растворение металла понадобилось 52,17 см3 раствора азотной кислоты (ω = 13,48%, ρ = 1,075 г/см3). В полученном растворе массовая доля нитрата металла (II) 17,63%. При растворении выделился газ с DN2 1,071. Установите металл.
M(газа) = 1,071*28 = 30 г/моль
Беря в расчет, что этот газа выделился при растворении металла в азотной кислоте, устанавливаем, что газ – это NO.
Металл окислился от 0 до +2 (отдал 2 электрона), а азот восстановился с +5 до +2 (принял 3 электрона). Значит, в уравнении реакции перед металлом и нитратом металла (II) будет стоять коэффициент 3, а у NO – 2. У HNO3, соответственно, 3*2 + 2 = 8. То есть на растворение 3 молей металла необходимо 8 молей разбавленной азотной кислоты.
3Me + 8HNO3 = 3Me(NO3)2 + 2NO + 4H2O
n(HNO3) = 52,17*1,075*0,1348/63 = 0,12 моль
n(Me) = (3/8)*0,12 = 0,045 моль
n(Me(NO3)2) = n(Me) = 0,045 моль
m(р-ра после р-ния) = 52,17*1,075 + m(Me) – m(NO) = 52,17*1,075 + 0,045*M(Me) – 0,03*30 = 56,08275 + 0,045M(Me) – 0,9 = 55,18275 + 0,045M(Me)
m(Me(NO3)2) = 0,1763*m(р-ра после р-ния)
M(Me(NO3)2) = M(Me) + 124 = m(Me(NO3)2)/n(Me(NO3)2) = 0,1763*(1226,3 + M(Me))
0,8237M(Me) = 92,2
M(Me) = 112 г/моль – кадмий
Ответ: Cd
