
- •Взаимодействие ионизирующего излучения с веществом
- •Величина лпэ в кэВ/мкм зависит от плотности вещества.
- •Относительная биологическая эффективность различных видов излучений
- •Физико-химические основы биологического действия ионизирующего излучения. Защита от ионизирующих излучений
- •Ионизационные потери
- •Тормозное и черенковское излучения
- •Прямое и косвенное действие излучений на мишени в клетках
- •Первичные продукты радиолиза воды и их взаимодействие с биомолекулами
- •Дифференциальное уравнение гармонического колебания.
- •Уравнение для смещения, скорости и ускорения колеблющейся точки.
- •Энергия при гармоническом колебании.
- •Таким образом, полная энергия гармонического колебания оказывается постоянной в отсутствие сил трения. Сложение гармонических колебаний, направленных по одной прямой.
- •Сложное колебание и его гармонический спектр.
- •Сложение взаимно-перпендикулярных колебаний.
- •Затухающие колебания.
- •Уравнение волны.
- •Эффект доплера.
- •Акустика.
- •Природа звука.
- •Характеристики слухового ощущения и их связь с физическими характеристиками звука.
- •Физические основы звуковых методов исследования в клинике.
- •Голография
- •Дифракция света. Дифракция на щели в параллельных лучах.
- •Дифракция решётки. Дифракционный спектр.
- •Дозиметрия ионизирующего излучения. Поглощенная и экспозиционная дозы. Мощность дозы. Связь мощности дозы и активности. Дозиметрические приборы.
- •Внесистемная – рад
- •Детекторы ионизирующего излучения. Ионизационные камеры.
- •Газоразрядные счетчики. Фотографические сцинтилляционные,
- •Полупроводниковые и черенковские детекторы.
- •Авторадиография.
- •Импульсный сигнал и его параметры.
- •Генераторы импульсных (релаксационных) электрических колебаний. Мультивибратор. Блокинг-генератор.
- •Дифференцирующая и интегрирующая цепи: принципиальная схема, зависимость формы выходного импульса от длительности входного и постоянной времени цепи.
- •Физиотерапевтические аппараты низкочастотной терапии. Электронные стимуляторы для физиологических исследований и для лечебных целей. Типы и устройство кардиостимуляторов.
- •Дефибрилляторы.
- •Магнитные моменты электрона, атома и молекулы.
- •Магнитные свойства вещества.
- •Аппарат терапии переменным магнитным полем.
- •Физические основы магнитокардиографии.
- •Мембранные потенциалы и их ионная природа.
- •Диффузия. Пассивный перенос неэлектолитов через биомембраны, уравнение Рика. Транспорт неэлектролитов через мембраны путем простой и облегченной (в комплексе с переносчиком) диффузии.
- •Механические свойства биологических тканей.
- •Вязкоупругие, упруговязкие и вязкопластичные
- •Системы. Механические свойства мышц, костей,
- •Кровеносных сосудов, лёгких
- •Задачи, объекты и методы биомеханики.
- •Биомеханика опорно-двигательной системы человека. Биомеханические аспекты остеогенеза.
- •Эргометрия. Механические свойства тканей организма.
- •Микроскоп. Формула для увеличения.
- •Разрешающая способность. Значение апертурного угла. Формула для предела разрешения.
- •Ультрафиолетовый микроскоп.
- •Иммерсионные системы.
- •Полезное увеличение.
- •Специальные приемы микроскопии:
- •Основные характеристики ядер атомов.
- •Радиоактивность. Основной закон радиоактивного распада. Активность.
- •Ядерные реакции. Методы получения радионуклидов.
- •Пассивный и активный транспорт веществ
- •Лиганд - малая молекула (ион, гормон, лекарственный препарат и др.). Второй этап работы фермента - гидролиз атф. При этом происходит образование энзим - фосфатного комплекса (е-р).
- •Перенос кальция из области меньшей (1-4 х 10-3 м) в область больших концентраций (1-10 х 10-3 м) - это и есть та работа, которую совершает Са - транспортная атФаза в мышечных клетках.
- •Проницаемость.
- •Поляризация света.
- •Поляризация при двойном лучепреломлении. Поляризационные устройства.
- •Вращение плоскости поляризации (оптическая активность).
- •Дисперсия оптической активности. Использование поляризованного
- •Света в медико-биологических исследованиях: поляриметрия
- •(Сахариметрия), спектрополяриметрия, поляризационный микроскоп.
- •Прохождение тока через ткани организма. Удельное сопротивление биологических тканей жидкостей при постоянном токе.
- •Первичное действие постоянного тока на ткани организма.
- •Гальванизация.
- •Лечебный электрофорез.
- •Прохождение тока через ткани организма. Удельное сопротивление биологических тканей жидкостей при постоянном токе.
- •Первичное действие постоянного тока на ткани организма.
- •Гальванизация.
- •Лечебный электрофорез.
- •1. Механические волны, их виды и скорость распространения.
- •Уравнение волны.
- •Акустика. Природа звука. Физические характеристики звука. Тоны и шумы.
- •Физические характеристики звука. Тоны и шумы.
- •Характеристики слухового ощущения и их связь с физическими характеристиками звука.
- •Понятие о звукопроводящей и звуковоспринимающей системах уха человека. Физика слуха.
- •Поглощение и отражение звуковых волн. Реверберация.
- •Физические основы звуковых методов исследования в клинике.
- •2. Механические колебания: гармонические, затухающие и вынужденные колебания.
- •Дифференциальное уравнение гармонического колебания.
- •Энергия при гармоническом колебании.
- •Затухающие колебания.
- •Вынужденные колебания. Резонанс.
- •Автоколебания.
- •Разложение колебаний в гармонический спектр. Применение гармонического анализа для обработки диагностических данных. Сложение гармонических колебаний, направленных по одной прямой.
- •Сложное колебание и его гармонический спектр.
- •Сложение взаимно-перпендикулярных колебаний.
- •Ультразвук. Методы получения и регистрации.
- •Источники и приемники акустических колебаний и ультразвука.
- •Физические основы действия ультразвуковых волн на вещество. Низкочастотный и высокочастотный ультразвук.
- •Физические основы применения ультразвуковых волн в медицине Ультразвуковая диагностика. Хирургическое и терапевтическое применение ультразвука.
- •Эффект Доплера и его применение для неинвазивного измерения скорости кровотока.
- •Инфразвук, особенности его распространения. Физические основы действия инфразвука на биологические системы.
- •Вибрации, их физические характеристики
- •Ударные волны.
- •Модель Вольтера
- •Модель, представляющая сердечно-сосудистую систему как электрическую цепь. Чисто резистивная модель
- •1.1.2.5. Модели электрической активности сердца
- •1. Основные понятия гидродинамики. Условие неразрывности струи
- •Уравнение Бернулли.
- •Внутреннее трение (вязкость) жидкости. Формула Ньютона.
- •Ньютоновские и неньютоновские жидкости.
- •Методы определения вязкости жидкости.
- •Реологические свойства крови, плазмы и сыворотки. Факторы, влияющие на вязкость крови в организме.
- •Фотоэффект.
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
Структурной и функциональной единицей живого организма является клетка. Ей присущи все основные жизненные функции. Клетка обменивается с окружающей средой и веществом, и энергией, и информацией.
Энергия питательных веществ, поступающих в клетку, расходуется на совершение различного вида работ в ней, на выполнение ею разнообразных функций.
Все эти разнообразные функции клетки тесно связаны с ее структурой, с ее строением. Изучение структуры клетки, точнее ее ультраструктуры, позволяет лучше понять и выяснить функциональные возможности клетки.
Напомним в общих чертах, что любая клетка состоит из окруженной плазматической (клеточной) мембраной цитоплазмы, в которой находятся ядро клетки, органеллы и различные включения. К органеллам клетки относятся митохондрии, лизосомы, рибосомы, аппарат Гольджи, эндоплазматический ретикулум. Все они, в том числе и ядро клетки, тоже имеют мембраны, и основная цель данного параграфа состоит в ознакомлении с современными представлениями о структуре и функциях биологических мембран.
Роль мембран в строении и функционировании клетки чрезвычайно велика. Как заметил Бернал Д. “только после образования мембраны вокруг клетки мы действительно имеем то, что с полным правом может быть названо организмом”. Именно через мембраны происходит обмен веществ в организме. Нарушение структуры мембран ведет к нарушению их функции и, следовательно, к нарушению функциональных состояний организма в целом. Нарушение функций биологических мембран является причиной многих заболеваний.
Строение биологических мембран.
Несмотря на большое разнообразие клеток и организмов в природе, строение и многие функции биологических мембран во многом одинаковы, что и позволяет нам рассматривать их основные свойства безотносительно к виду клеток.
Строение биологических мембран изучается уже более 80 лет. Еще в 1902 году Овертоном была выдвинута первая модель мембраны в виде тонкого слоя липидов. С тех пор представления о строении мембран постоянно усложнялись, совершенствовались, дополнялись и к настоящему времени они существенно отличаются от той первой простейшей модели Овертона. Однако и по современным представлениям основу, матрицу любой биологической мембраны составляет липидный бислой. Каковы же физические свойства липидов и липидного слоя?
Мембранные липиды - это низкомолекулярные вещества, близкие по своим свойствам и жирам. Характерная особенность любой липидной молекулы состоит в том, что она построена из двух физически разных частей: из головки, составляющей примерно четверть длины молекулы и двух длинных неполярных хвостов. Хвосты представляют собой длинные цепи жирных кислот, которые могут быть как насыщенными, так и ненасыщенными. Головки липидов тоже могут иметь разное строение, но для липидов биомембран наиболее характерны производные сахаров и фосфорной кислоты - в соответствии с этим различают глико- и фосфо-липиды.
В качестве примера на рис. 10 приведена структура фосфатидилхолина (лецитина).
Рис. 10.
Верхний хвост - насыщенная кислота, которая, как правило, имеет транс-конформацию: С С
/ \ / \ /
С С
внизу - ненасыщенная жирная кислота, - имеющая двойную гош-конформацию: С С ==== С
/ \ / \ /
С====С С
Головки липидов либо заряжены отрицательно, либо электрически нейтральны, но имеют неравный нулю дипольный момент. Положительно заряженных головок нет и это играет очень важную роль в формировании всего электрического заряда мембраны и в ее функционировании. Поскольку головки липидов полярны, то они хорошо взаимодействуют с полярными растворителями, в частности с водой, поэтому головки называют гидрофильной частью липида. Хвосты, наоборот, не взаимодействуют с водой, - они гидрофобны, но они хорошо взаимодействуют с неполярными веществами и растворителями.
Эти свойства липидов приводят к тому, что они одинаково плохо растворяются и в полярных растворителях (вода) - мешает хвост, и в неполярных (масло) - мешает головка. Если липиды поместить на поверхность воды, то они все станут на “голову” - и вверх хвостами. В масле же картина будет обратной.
Так как вода является основным, универсальным растворителем в биологических системах (цитоплазма, например, на 95% состоит из воды), то нас интересует, как будут вести себя липиды, помещенные “внутрь” воды.
Оказывается, что в этом случае они тоже стремятся быть всегда направленными полярными головками в сторону воды, а неполярными хвостами - внутрь.
При этом могут образовываться различные пространственные структуры липидов. При малых концентрациях липидов сначала образуются мицеллы, а при более высокой концентрации образуются липосомы, или везикулы -”пузырьки”. Наконец, при некоторой концентрации липидов мицеллы слипаются и образуют плоский бимолекулярный слой - липидный бислой (рис. 11).
Рис. 11.
Толщина такого липидного бислоя не превышает 67 нм. Липидные бислои достаточной протяженности стремятся замкнуться сами на себя, чтобы лучше спрятать гидрофобные участки от воды. Так происходит самопроизвольный процесс сборки мембраны, то есть их “самосборка”.
Впоследствии было показано, что липидный бислой мембран окружен с обеих сторон из фибриллярных (нитевидных) белков, а снаружи их - еще и слоем глобулярных белков. Кроме липидов и белков в составе мембран много холестерина. Общая толщина такого “бутерброда” составляет 89 нм: сверху и снизу два “ломтя” белка, а внутри “масло” - липиды. Внутри мембраны возможны поры, общая площадь которых обычно не превышает 1% от всей площади мембраны.
Представленная модель объясняет многие свойства мембран - их эластичность, избирательную проницаемость (хорошую для неполярных, то есть гидрофобных, соединений и плохую для полярных), в связи с чем она долгое время была принята в качестве унитарной, то есть единой модели всех биологических мембран. Однако последние данные свидетельствуют о том, что на самом деле все обстоит несколько сложнее.
Оказалось, что в липидном бислое мембран может быть много белков, встроенных в сам липидный бислой, при этом многие из этих белков пронизывают липидный бислой насквозь.
По словам одного из авторов этой модели, названной жидкостно-мозаичной, мембрана представляется ему в виде липидного моря, в котором плавают белковые айсберги (рис. 12).
Рис. 12.
Соотношение между количеством белков и количеством липидов в мембране неодинаково и зависит от функционального назначения клетки.
Так, в мембране эритроцитов 75% площади занимают липиды, а 25% - белки. Вместе с тем весовое соотношение почти обратное (так как белки значительно тяжелее липидов) - в этой же мембране по весу белков в 2,5 раза больше, чем липидов. В мембране некоторых бактерий содержится белков в 56 раз больше, чем липидов, а в миелиновой мембране, наоборот - белка в 2,6 раза меньше, чем липидов.
Белки, входящие в состав мембран, обычно делят по их положению в мембране на периферические и интегральные (проникающие в мембрану), а по их функциональным характеристикам - на структурные и ферментативные (катализирующие).
Роль белков в функционировании мембраны чрезвычайно велика. Структурные белки участвуют в построении мембран вместе с липидами, взаимодействуют стехиометрически с другими белками, участвуют в транспорте веществ и т.п. Не меньшее, если не большее значение имеют и ферментативные белки, главными их которых являются АТФ - азы (аденозинтрифосфатазы). Кроме них в мембранах отдельных клеток могут находиться и другие ферменты: флавины, питохромы, дегидрогеназы и другие, которые принимают активное участие в метаболизме клеток.
В настоящее время большой интерес представляет изучение информации белков (то есть изменение их пространственной формы, структуры), поскольку предполагается, что такие жизненно важные процессы, как окислительное фосфорилирование, активный транспорт веществ, химические реакции при фотосинтезе, проведение нервного импульса и др. тесно связаны с изменением пространственной укладки атомов, то есть с конформацией полипептидной цепи белковых молекул.
Роль липидов в мембранах тоже не сводится лишь к приданию мембранам определенной физической структуры и низкой проницаемости для полярных веществ. Сейчас установлено, что физическое состояние, главным образом вязкость липидного бислоя самым непосредственным образом влияет на каталитическую активность мембранных ферментов, на проницаемость мембран, а значит, на процессы обмена веществ в клетках.
Чем меньше вязкость липидов, тем обычно лучше идут процессы обмена веществ в клетке. Методом ЭПР - спектроскопии было установлено, что микровязкость липидного слоя в мембране эритроцитов, митохондрий, нервных волокон составляет 30100 м Па, то есть близка к вязкости подсолнечного масла. Это свидетельствует о том, что липидный слой находится там в жидком состоянии.
При многих видах патологий, а также при воздействии биологически активных соединений вязкость мембран изменяется.
Чем выше подвижность хвостов фосфолипидов, тем меньше вязкость мембран, и тем лучше их проницаемость для диффундирующих веществ. Поэтому вязкость бислоя очень важна для всей функциональной деятельности ферментов, находящихся в липидном слое и других.
Вязкость мембраны сильно зависит от агрегатного состояния бислоя (жидкое и твердое), то есть от температуры.
В твердом липидном бислое хвосты фосфолипидов имеют трансконформацию, а в жидком бислое возможны тепловые переходы из транс-конформации в гош-конформацию (транс - гош - переходы).
Переход бислоя из жидкого в твердое состояние сопровождается изменением физической характеристики - теплоемкости. Резкое увеличение (скачок) теплоемкости будет наблюдаться в точке фазового перехода, благодаря чему эту точку определяют методом микрокалориметрии. Суть его состоит в измерении отношения тепла dQ, переданного веществу массой m, к изменению его температуры dT:
dQ = C m dT , (11)
где С - теплоемкость. При переходе через точку фазового перехода Тп вещество переходит из твердого состояния в жидкое. При этом скачком изменяется его теплоемкость С, что приводит к резкому изменению производной dQ/dT в этой точке (рис. 13). Наличие нескольких пиков на таком графике свидетельствует о наличии нескольких температур фазового перехода Тп1, Тп2 и Тп3, и значит о наличии нескольких физически различных групп липидов в изучаемом бислое.
Рис. 13.
Температура фазового перехода существенно зависит от подвижности липидных хвостов. Как правило, чем более ненасыщены их жирно-кислотные хвосты, тем более они подвижны и тем ниже температура их фазового перехода.
Поэтому для липидов с 2-мя насыщенными жирными кислотами Тп > 00С; а для ненасыщенных липидов - Тп < 00С.
Латеральная диффузия.
Рассматривая жидкостно-мозаичную модель мембран, надо всегда иметь в виду, что отдельные молекулы липидного бислоя не “сидят” на одном месте, а непрерывно меняются местами, перемещаясь вдоль слоя, то есть вдоль мембраны с внушительной скоростью в 5 мкм/с. Участвуют в этом движении и белки. Это явление хаотического перемещения молекул липидов и белков вдоль поверхности мембраны называется латеральной (lateral - боковой) диффузией. Скорость латеральной диффузии белков значительно меньше, чем у липидов, кроме того часть пронизывающих мембрану белков оказывается “заякоренной” на внутриклеточные белки и в латеральной диффузии не участвуют.
Кроме латеральной диффузии, возможен также переход липидной молекулы из одного монослоя в другой - этот процесс называют флип-флопом. Однако вероятность флип-флопа в 1010 раз меньше, чем латеральной диффузии.
Мембранные белки и липиды помимо поступательного движения участвуют и во вращательном движении, или, как говорят, - во вращательной диффузии. При этом угловая скорость вращения белков и липидов весьма велика. Например, при нормальных температурах она составляет:
для фосфолипидов - 109 рад/с;
для родопсина - 106 рад/с;
для цитохромоксидазы - 104 рад/с.
Ассиметрия мембран.
Ассиметрия мембран проявляется в том, что внутренние и наружные по отношению к клетке стороны любой биологической мембраны всегда имеют разный липидный и белковый состав. Молекулы углеводов располагаются только на внешней стороне мембраны. Ассиметричная ориентация ферментативных и транспортных белков в мембране приводит к наличию преимущественно направления активного транспорта веществ через мембрану, что играет исключительно важную роль для функционирования клетки в целом.
Взаимодействие ионизирующего излучения с веществом
Одно и то же количество энергии можно сообщить биологическому объекту при облучении различными типами ионизирующих частиц. Поглощенная энергия затрачивается на возбуждение и ионизацию атомов и молекул. В основе конечного радиобиологического эффекта лежат физико-химические превращения возбужденных и ионизированных молекулярных структур. Так как число возбуждений и ионизаций определяется величиной поглощенной дозы излучения, можно было бы ожидать, что различные виды ионизирующих частиц приводят к одному и тому же биологическому эффекту при условии, что объект поглотил одинаковую дозу (т.е. энергию) излучения. В действительности это не так. Поглощение одной и той же дозы излучения приводит к различным эффектам.
Пробег частицы – длина ее пути в веществе до полной остановки.
Критерием
«качества» излучения, эффективности
его биологического действия служит
величина дифференциальной потери
энергии частиц на единицу длины пути
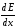 ,
которая получила название «линейная
передача энергии» (ЛПЭ).
,
которая получила название «линейная
передача энергии» (ЛПЭ).
В математических выражениях ЛПЭ обозначается символом L:
L
=
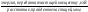
Величина лпэ в кэВ/мкм зависит от плотности вещества.
Величина ЛПЭ – важнейшая радиобиологическая характеристика излучения, показатель его биологической эффективности или «качества»; физическая природа частиц или квантов не сказывается на специфике биологического действия, например, при равных ЛПЭ наблюдают одинаково эффективное подавление размножения клеток как в результате рентгеновского облучения, так и при действии -частиц.
Линейной плотностью ионизации (ЛПИ) называют отношение L/W, где L – ЛПЭ, W – энергия, необходимая для образования одной пары ионов. Точное значение W для тканей неизвестно. Для гадов значение W было измерено многими исследователями, оно составляет около 34 эВ. Для приблизительной оценки плотности ионизации в конденсированных системах обычно используют соотношение:

Чем выше значение ЛПЭ, тем больше энергии оставляет частица на единицу пути, тем плотнее распределены создаваемые его ионы вдоль трека.
На различных биологических объектах было проведено сопоставление эффективности различных типов ионизирующих частиц. Эти эксперименты позволили количественно оценить эффективность различных видов ионизирующих излучений и ввести коэффициенты, которые для каждой конкретной биологической системы называют эффективность данного типа излучения по сравнению с выбранным стандартным излучением. Коэффициент относительной биологической эффективности (ОБЭ) определяется из соотношения:
Для каждой излучаемой системы коэффициент ОБЭ находят путем сопоставления эффектов стандартного и исследуемого излучений, примененных в одинаковой дозе.
Для расчетов различных санитарных норм принимают относительные величины ОБЭ, которые являются усредненными результатами экспериментов на различных системах. Эти величины приведены в таблице:
Относительная биологическая эффективность различных видов излучений
|
Виды излучения |
ОБЭ |
|
Рентгеновские и -лучи до 3 МэВ |
1 |
|
-лучи до 3МэВ |
1 |
|
-лучи |
20 |
|
Протоны и дейтроны (0,5-10Мэв) |
10 |
|
Медленные нейтроны |
3 |
|
Быстрые нейтроны (до 20МэВ) |
10 |
|
Тяжелые ускоренные ионы |
20 |
В таблице представлены результаты количественных измерений ионизирующей способности -частиц и глубины их проникновения в ткани.
|
Энергия -частиц, МэВ |
ЛПЭ, КэВ/мкм |
Длина пробега, МКМ |
Число первичных ионов на 1мкм пути в ткани, пар ионов/мкм |
|
1 |
263,9 |
5,3 |
6207,0 |
|
3 |
134,6 |
16,8 |
2031,0 |
|
6 |
82,01 |
47,0 |
1109,0 |
|
9 |
60,41 |
91,6 |
775,4 |
|
10 |
55,71 |
108,4 |
706,4 |
Длина пробега, потеря энергии и число первичных ионов при прохождении -частиц в тканях плотностью 1г/см3.
Картинка, наблюдаемая при облучении тканей потоком -частиц, отличается от рассмотренной выше прежде всего криволинейной траекторией частиц в веществе. Это связано с равенством масс взаимодействующих частиц: в единичном акте соударения с орбитальным электроном -частица теряет большое количество энергии и изменяет первоначальное направления движения (рисунок).
Истинная и практическая длина пробега электронов в веществе. Путь от А до В – истинная длина пробега, L – практическая длина пробега (проникновения).
Длина пробега -частиц определяется их энергией: при энергии 150 кэВ они проникают в ткань на глубину 278 мкм, а очень быстрые частицы с энергией 50 МэВ – на глубину до 19 см.
Величина ЛПЭ электронов и плотности распределения, генерируемых ими ионов быстро убывает с увеличением скорости частиц (таблица).
|
Энергия электронов, КэВ |
Длина пробега, мкм |
Потеря энергии, КэВ/мкм |
Число первичных ионов на 1мкм/ткани, пар ионов/мкм |
|
0,1 |
0,003 |
33,23 |
1697 |
|
0,2 |
0,006 |
28,71 |
843,1 |
|
0,8 |
0,038 |
14,17 |
285,3 |
|
2,0 |
0,1595 |
7,680 |
127,8 |
|
9,5 |
2,303 |
2,367 |
31,90 |
|
22,5 |
10,51 |
1,233 |
15,06 |
|
45,0 |
35,76 |
0,7255 |
8,452 |
|
90,0 |
118,0 |
0,4462 |
4,986 |
|
150,0 |
278,1 |
0,3278 |
3,567 |
|
450,0 |
1508,5 |
0,2108 |
2,166 |
Длина пробега, потеря энергии и число первичных ионов, вызываемых электронами в ткани плотностью 1 г/см3.
Электронейтральные частицы (нейтроны, рентгеновское и -излучение), обладая высокой проникающей способностью, углубляются в ткани на значительные расстояния. Они формируют большинство ионизаций косвенным путем: фотоны рентгеновского и -излучения – за счет ускоренных электронов, а нейтроны – за счет ядер отдачи. Эти заряженные частицы в основном и осуществляют перенос энергии излучения веществу, вызывая ионизации и возбуждения атомов.
Мягкие рентгеновские лучи (до 100кэВ) поглощаются в поверхностных слоях ткани за счет фотоэффекта. Длина пробега фотоэлектронов не превышает 2 мм, поэтому биологически существенный эффект, связанный с ионизацией атомов и молекул, возникает вблизи места поглощения падающего кванта.
Жесткие рентгеновские и -лучи с энергией фотонов выше 300кэВ поглощаются в основном за счет эффекта Комптона. Максимум их поглощения лежит на глубине нескольких сантиметров.
При облучении тканей нейтронами с энергией 14МэВ 25% поглощенной дозы на глубине 15см создают тяжелые ядра отдачи с ЛПЭ выше 50кэВ/мкм и 70% - протоны отдачи (т.е. ускоренные ядра водорода) с ЛПЭ = 16кэВ/мкм.
