
- •Лекция 3 кислотно-основное равновесие в растворах электролитов
- •3.1 Протолитическая теория кислот и оснований
- •3.2 Кислотно-основное равновесие
- •3.2.1 Типы протолитических реакций
- •2.2.2 Константа кислотности и основности. Расчеты рН
- •Расчет рН
- •Чистая вода
- •Механизм действия
- •3.4. Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
Лекция 3 кислотно-основное равновесие в растворах электролитов
3.1 Протолитическая теория кислот и оснований
3.2 Кислотно-основное равновесие
3.2.1 Типы протолитических реакций
3.2.2 Константа кислотности и основности. Расчеты рН
3.3 Протолитическое равновесие в буферных системах
3.4 Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
3.1 Протолитическая теория кислот и оснований
Равновесия в растворах кислот и оснований выделяют в отдельный вид в связи с резким отличием катиона водорода от всех остальных ионов и необычной важностью реакций с участием в них протона.
В организме человека протекают различные протолитические процессы – реакции ковалентного гидролиза (превращение веществ, составляющих основу в пищеварительном тракте), гидролиз углеводов, расщепление белков, гидролиз триацилглицеринов и т.д.
Первой теоретической концепцией кислот и оснований была теория Аррениуса (1887 г.), в основе которой лежит электролитическая диссоциация (ЭД) кислот и оснований.
Согласно теории ЭД кислота – электролит, диссоциирующий в водных растворах с образованием катиона водорода H+.
Уравнение диссоциации слабой кислоты
![]()
Уравнение диссоциации сильной кислоты
![]()
Основания – электролиты, образующие в водных растворах гидроксид-ионы OH-.
Уравнение диссоциации слабого основания
![]()
Уравнение диссоциации сильного основания
![]()
Вещества, образующие в зависимости от условий в водных растворах ионы H+ и OH-, называют амфотерными.
![]()
Недостатки теории Аррениуса:
Нельзя представить существование катиона водорода в растворе.
Не учитывается влияние растворителя
Все расчеты неверны при переходе к неводным растворителям, т.е. ТЭД применима только для водных растворов.
Эти недостатки были преодолены в теории Н.Бренстеда и Т.Лоури (1923 г.), получившей название протолитической теории.
Теория основана на особенностях иона водорода: протон лишен электронной оболочки, намного (на 5 порядков) меньше других ионов и очень подвижен.
Согласно этой теории кислоты – вещества, способные отдавать протон (доноры протона). Основания – вещества, принимающие протон (акцепторы протона).
Амфолиты – вещества, способные быть и донором, и акцептором протона.
Кислотами, основаниями и амфолитами могут быть как незаряженные, так и заряженные соединения.
|
Кислота |
Основание |
Амфолит |
|
HCl |
Cl- |
|
|
NH4+ |
NH3 |
|
|
H2CO3 |
HCO3- |
|
|
HCO3- |
CO32- | |
|
H3O+ |
H2O |
|
|
H2O |
OH- | |
|
[Al(H2O)6]3+ |
[Al(H2O)5OH]2 + |
|
Обратимые реакции с переносом протона от кислоты к основанию называют кислотно-основными полуреакциями.
Кислота и получившееся при отдаче протона основание составляют сопряженную пару:


Кислота может отдавать протон только в присутствии основания, и наоборот.
Вещества могут проявить кислотные или основные свойства лишь в протолитической реакции, объединяющей две полуреакции.

При этом образуются новая кислота и основание, и «нейтрализации» в смысле исчезновения кислоты или основания нет.

Главная особенность теории Бренстеда – учет роли растворителя в кислотно-основном равновесии, причем растворитель рассматривают как вещество, которое химически реагирует с кислотой или основанием.
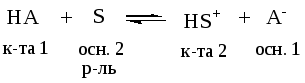
Чем сильнее кислота, тем слабее сопряженное основание.

 HCO3-
HCO3- H2O
H2O