
- •Управляемая самостоятельная работа студентов
- •Содержание
- •Введение
- •1.Биосинез гистидина
- •2.Пути обмена гистидина
- •4.Использование гистидина как радиопротектора и антиоксиданта.
- •4.1 Использование гистидина как радиопротектора
- •4.2 Использование гистидина как антиоксиданта.
- •5.Биосинтез аргинина
- •6.Основные пути обмена аргинина. Биологическое значение
- •Заключение
- •Лист для замечаний Литература
2.Пути обмена гистидина
А - катаболизм гистидина в печени; Б - синтез и инактивация гистамина.
Обмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека.
В печени и коже дезаминирование гистидина катализирует фермент гистидаза. Образующийся уроканат только в печени способен превращаться через ряд стадий в глутамат. Наследственный дефект гистидазы вызывает
накопление гистидина в организме и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Ферменты гистидаза и уроканиназа являются гепатоспецифическими, поэтому их определение используется в клинике для диагностики поражений печени.
Основные функции гистамина
1.Защитная: как медиатор воспаления защищает организм от воздействия агрессивных факторов внешней среды.
2. Является пищеварительным гормоном: стимулирует выделение слюны и желудочного сока
3.Является нейромедиатором, ответственным за регуляцию сна и бодрствования: активирует нервные клетки, противодействует сну.
Дипептиды карнозин и ансерин образуются в мышцах и головном мозге, причем их содержание в скелетных мышцах особенно велико и достигает 100-200 мг\на 100 г. мышечной ткани.
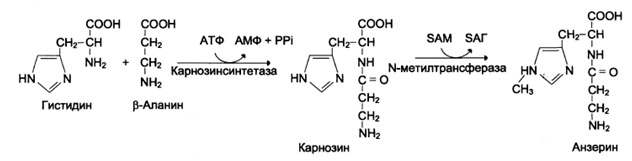
Карнозин был впервые обнаружен русским ученым В.С.Гулевичем в 1900 г., в последующем физиологическое действие гистидиновых дипептидов изучалось российским биохимиком С.Е. Севериным в 60-х годах и исследуется до настоящего времени многими учёными.
Карнозин увеличивает амплитуду сокращения скелетных мышц и активирует работу ионных насосов мышечных клеток, стимулирует АТФ-азную активность миозина. Содержание гистидиновых пептидов в гладкой и сердечной мускулатуре во много раз ниже, чем в скелетной. Они создают до 40% буферной ёмкости быстрых мышц и позволяют накапливать много лактата. Избыток лактата в отсутствие гистидиновых пептидов приводит к ацидозу и контрактуре. Карнозин и анзерин обладают антиоксидантной активностью, ингибируют NO-зависимую гуанилатциклазу, замедляют процессы старения человека, влияя на скорость апоптоза.
4.Использование гистидина как радиопротектора и антиоксиданта.
4.1 Использование гистидина как радиопротектора
РАДИОПРОТЕКТОРЫ — вещества преимущественно синтетического происхождения, введение которых перед облучением в среду с биологическими объектами или в организм животных и человека снижает поражающее действие ионизирующего излучения.
Наиболее распространенные фармпрепараты – радиопротекторы – синтезированы на основе биологических веществ – серосодержащих аминокислот, биогенных аминов (серотонин, гистамин) или комплексонов. Эти биологически активные вещества или их предшественники.
Установлено, что усиленное образование в организме некоторых биогенных аминов (серотонин, гистамин) повышает его радиоустойчивость. На их основе созданы специальные препараты – радиопротекторы, которые рекомендуются для фармакотерапии и фармакопрофилактики радиационных поражений. Предшественниками образования в организме этих биогенных аминов являются аминокислоты – триптофан и гистидин, – повышенное потребление которых может сопровождаться большей радиоустойчивостью.
Средства длительного повышения радиорезистентности организма целесообразно разделить на две основные группы:
1. Средства защиты от «поражающих» доз облучения, куда относятся препараты, обладающие достаточно выраженным противолучевым действием, т. е. способные предупреждать или ослаблять ближайшие последствия внешнего облучения в дозах, вызывающих ОЛБ. Если эти средства используются до облучения, т. е. профилактически, то в литературе их часто обозначают как «радиопротекторы длительного (или пролонгированного) действия».
2.Средства защиты от «субклинических» доз облучения. В эту группу входят препараты, имеющие относительно низкую противолучевую активность, но способные снижать выраженность неблагоприятых (в том числе и отдаленных) последствий облучения в дозах, не вызывающих развития клинических проявлений лучевой патологии.
Для предупреждения неблагоприятных последствий действия «субклинических» доз облучения используются витамины и витамино-аминокислотные комплексы, например, амитетравит и тетрафолевит.
Амитетравит — это препарат, состоящий из аскорбиновой кислоты, рутина, тиамина, пиридоксина, а также аминокислот триптофана и гистидина. Прием амитетравита начинают за 5-7 сут до входа на радиоактивно зараженную местность по 3 табл. 2 раза в день после еды. Курс терапии составляет 2 нед. В перерывах между курсами амитетравита или при его отсутствии применяют тетрафолевит (по 1 табл. 3 раза в сутки после еды в течение 2 нед), который представляет собой поливитаминный препарат, в состав которого входят тиамин, рибофлавин, фолиевая кислота и никотинамид. Прием этих препаратов должен осуществляться в течение всего периода пребывания в условиях повышенного радиационного фона.
