- •«Поджелудочная железа. Инсулин, глюкагон, соматостатин. Диабет 1-го типа (инсулиндефицитный) и диабет 2-го типа (инсулинрезистентный). Причины возникновения, сравнительная характеристика»
- •Содержание
- •1.Введение
- •2. Экзокринная функция поджелудочной железы
- •3. Эндокринная функция поджелудочной железы
- •3.1. Инсулин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •Реакции, связанные с активностью фосфатидилинозитол-3-киназы
- •Реакции, связанные с активацией map-киназного пути
- •Очень быстрые эффекты (секунды)
- •Быстрые эффекты (минуты)
- •Медленные эффекты (минуты-часы)
- •Очень медленные эффекты (часы-сутки)
- •3.2. Глюкагон: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •3.3. Соматостатин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •4. Гипо- и гиперинсулинизм
- •5. Са́харный диабе́т 1-го типа
- •6.Сахарный диабет 2-го типа
- •Заключение
- •Лист для заметок литература
3.2. Глюкагон: химическая природа, регуляция секреции, механизм действия, роль в обмене.
Глюкагон представляет собой гормон полипептидной природы, выделяемый a-клетками поджелудочной железы. Основной функцией этого гормона является поддержание энергетического гомеостаза организма за счет мобилизации эндогенных энергетических ресурсов, этим объясняется его суммарный катаболический эффект.
В состав полипептидной цепи глюкагона входит 29 аминокислотных остатков, его молекулярная масса 4200, в его составе отсутствует цистеин. Глюкагон был синтезирован химическим путем, чем была окончательно подтверждена его химическая структура.
Глюкагон
образуется из препроглюкагона —
пептида-предшественника, состоящего
из 180 аминокислоти
пяти доменов которые подвергаются
раздельному процессингу (Bell et al., 1983). За
N-концевым сигнальным пептидом в молекуле
препроглюкагона следует глицентиноподобный
панкреатический пептид затем идут
аминокислотные последовательности
глюкагона и глюкагоноподобных пептидов
типов 1 и 2. Процессинг препроглюкагона
осуществляется в несколько этапов и
зависит от ткани, в которой он происходит.
В результате из одного и того же
препрогормона в а-клетках островков
поджелудочной железы и в нейроэндокринных
клетках
кишечника
(L-клетках) образуются разные пептиды.
Глицентин, важнейший промежуточный
продукт процессинга, состоит из
N-концевого глицентиноподобного
панкреатического пептида и С-концево-го
глюкагона,
разделенных
между собой двумя остатками аргинина.
Оксинтомодулин состоит из глюкагона и
С-концевого гексапептида, тоже разделенных
между собой двумя остатками аргинина.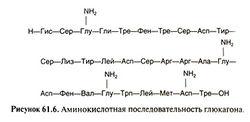
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
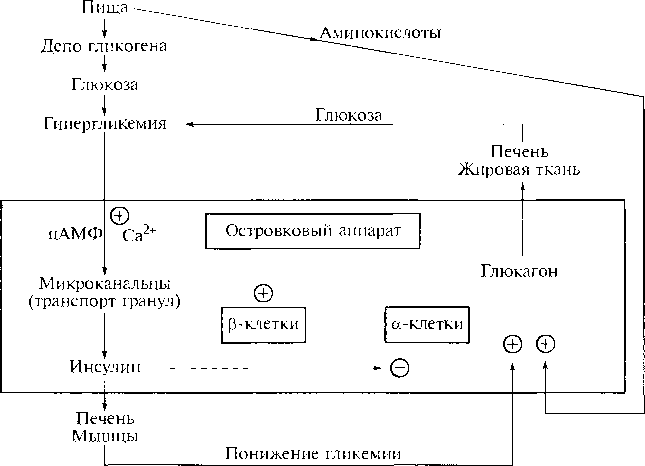
Регулируемым параметром в контуре регуляции секреции глюкагона является концентрация глюкозы. Уменьшение ее в крови стимулирует альфа-клетки, которые увеличивают секрецию гормона, что приводит к росту концентрации глюкозы, которая путем отрицательной обратной связи уменьшает секрецию глюкагона.

Увеличение секреции глюкагона вызывает повышение концентрации аминокислот в крови (особенно аргинина) холецистокинина, катехоламинов, ацетилхолина. Уменьшение секреции глюкагона возникает при увеличении: концентрации глюкозы в крови, инсулина, соматостатина, жирных кислот и кетонов.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ - глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
1
- глюкагон и адреналин взаимодействуют
со специфическими мембранными рецепторами.
Комплекс гормон-рецептор влияет на
конформацию G-белка, вызывая диссоциацию
его на протомеры и замену в α-субъединице
ГДФ на ГТФ; 2 - α-субъединица, связанная
с ГТФ, активирует аденилатциклазу,
катализирующую синтез цАМФ из АТФ; 3 - в
присутствии цАМФ протеинкиназа А
(цАМФ-зависимая) обратимо диссоциирует,
освобождая обладающие каталитической
активностью субъединицы С; 4 - протеинкиназа
А фосфорилирует и активирует киназу
фосфорилазы; 5 - киназа фосфорилазы
фосфорилирует гликогенфосфорилазу,
переводя её в активную форму; 6-протеинкиназа
А фосфорилирует также гликогенсинтазу,
переводя её в неактивное состояние; 7 -
в результате ингибирования гликогенсинтазы
и активации гликогенфосфорилазы гликоген
включается в процесс распада; 8 -
фосфодиэсте-раза катализирует распад
цАМФ и тем самым прерывает действие
гормонального сигнала. Комплекс
ос-субъединица-ГТФ затем распадается,
α-, β- и γ-субъединицы G-белка реассоциируются.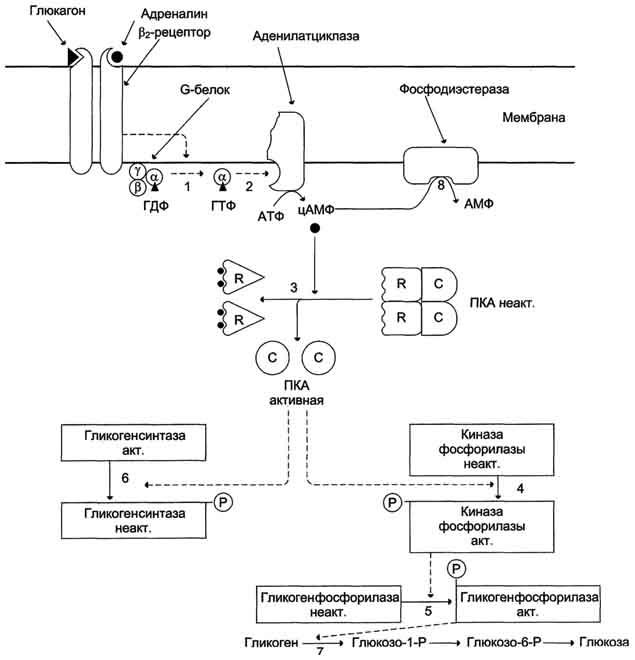
Глюкагон увеличивает содержание глюкозы (способствует гипергликемии) в плазме крови. Этот эффект реализуется несколькими путями.
Стимуляция гликогенолиза. Глюкагон, активируя гликоген фосфорилазу и ингибируя гликоген синтазу в гепатоцитах, приводит к быстрому и выраженному распаду гликогена и освобождению глюкозы в кровь.
Подавление гликолиза. Глюкагон ингибирует ключевые ферменты гликолиза (фосфофруктокиназа, пируваткиназа) в печени, что приводит к содержания глюкозо-6-фосфата в гепатоцитах, его дефосфорилированию и освобождению глюкозы в кровь.
Стимуляция глюконеогенеза. Глюкагон усиливает транспорт АК из крови в гепатоциты и одновременно активирует ключевые ферменты глюконеогенеза (пируваткарбоксилаза. Фруктозо01,6-дифосфатаза), что приводи к содержания глюкозы в цитоплазме клеток и её поступлению в кровь.
Глюкагон способствует образованию кетоновых тел путем стимуляции окисления жирных кислот: ингибирование активности ацетил-КоА-карбоксилазы приводит к ↓ содержания ингибитора карнитин ацилтрансферазы – малонил-КоА, что приводит к усиленному поступлению жирных кислот из цитоплазмы в митохондрии для их β-окисления и превращения в кетокислоты. Другими словами, в отличие от инсулина, глюкагон оказывает кетогенный эффект.