
Довбыш С.А. Химия
.pdfПриложение 7
Термодинамические константы некоторых веществ
Вещество |
∆Н°298, кДж/моль |
S°298, Дж/(моль·К) |
∆G°298,кДж/моль |
А1(к) |
0 |
28,35 |
0 |
А12O3 (к) |
-1676 |
50,92 |
-1582 |
AlCl3 (к) |
-697,4 |
167,0 |
-636,8 |
Br2 (ж) |
0 |
152,21 |
0 |
HBr (г) |
-36,23 |
198,48 |
-53,22 |
С (графит) |
0 |
5,74 |
0 |
СН4 (г) |
-74,86 |
186,19 |
-50,79 |
С2Н2 (г) |
226,8 |
200,8 |
209,2 |
С2Н6 (г) |
-89,7 |
229,5 |
-32,9 |
C6H6 (ж) |
49,04 |
173,2 |
124,5 |
C7H8 (ж) |
50,0 |
320,66 |
122,03 |
C3H6O (г) |
-248,11 |
200,41 |
-155,42 |
C6H5NO2 (ж) |
15,9 |
224,26 |
146,2 |
CH3I (г) |
13,97 |
254,01 |
15,63 |
CH3OH |
-238,6 |
126,8 |
-166,1 |
СО (г) |
-110,52 |
197,54 |
-137,14 |
СO2 (г) |
-393,51 |
213,68 |
-394,38 |
CS2 (г) |
115,3 |
237,8 |
65,1 |
Сl2 (г) |
0 |
222,9 |
0 |
Fе(к) |
0 |
27,15 |
0 |
Fе2O3(к) |
-822,2 |
87,4 |
-740,3 |
Н2(г) |
0 |
130,52 |
0 |
НСl (г) |
-91,8 |
186,8 |
-94,79 |
Н2O (г) |
-241,82 |
188,72 |
-228,61 |
Н2О (ж) |
-285,83 |
70,08 |
-237,24 |
HNO3 (ж) |
-173,0 |
156,16 |
-79,9 |
N2(r) |
0 |
199,9 |
0 |
NH3 (г) |
-46,19 |
192,6 |
-16,71 |
NH4Cl (к) |
-314,2 |
95,8 |
-203,2 |
N2O (г) |
82,0 |
219,9 |
104,1 |
NO (г) |
90,25 |
210,6 |
86,58 |
O2(г) |
0 |
205,04 |
0 |
S02 (г) |
-296,9 |
248,1 |
-300,2 |
SO3 (г) |
-395,2 |
256,33 |
-370,37 |
Тi(к) |
0 |
30,6 |
0 |
TiO2 (к) |
-943,9 |
50,3 |
-888,6 |
I2 (к) |
0 |
116,73 |
0 |
Zn (к) |
0 |
41,59 |
0 |
ZnO (к) |
-349,0 |
43,5 |
-318,19 |
Сr2O3(к) |
- 1141,3 |
81,2 |
- 1059,7 |
Сr(к) |
0 |
33.3 |
0 |
61
|
|
Приложение 8 |
|
|
Названия некоторых кислот и их солей |
||
|
|
|
|
Кислота |
Названия |
||
|
кислоты |
соли |
|
НАlO2 |
метаалюминиевая |
метаалюминаты |
|
Н3АlOз |
ортоалюминиевая |
ортоалюминаты |
|
H2ZnO2 |
цинковая |
цинкаты |
|
Н3ВО3 |
ортоборная |
ортобораты |
|
НВr |
бромоводородная |
бромиды |
|
НСООН |
муравьиная |
формиаты |
|
СН3СООН |
уксусная |
ацетаты |
|
HCN |
циановодородная (синильная) |
цианиды |
|
Н2СО3 |
угольная |
карбонаты |
|
HCI |
хлороводородная (соляная) |
хлориды |
|
HClO |
хлорноватистая |
гипохлориты |
|
НСlO2 |
хлористая |
хлориты |
|
НСlО3 |
хлорноватая |
хлораты |
|
НСlO4 |
хлорная |
перхлораты |
|
НСrО2 |
метахромистая |
метахромиты |
|
Н2СrО4 |
хромовая |
хроматы |
|
Н2Сr2O7 |
дихромовая |
дихроматы |
|
HI |
йодоводородная |
йодиды |
|
НМnО4 |
марганцевая |
перманганаты |
|
Н2МnО4 |
марганцоватая |
манганаты |
|
HNO2 |
азотистая |
нитриты |
|
HNO3 |
азотная |
нитраты |
|
HF |
фтороводородная (плавиковая) |
фториды |
|
НРО3 |
метафосфорная |
метафосфаты |
|
Н3РO2 |
фосфорноватистая |
гипофосфиты |
|
Н3РОз |
фосфористая |
фосфиты |
|
Н3РO4 |
ортофосфорная |
ортофосфаты |
|
H2S |
сероводородная |
сульфиды |
|
HSCN |
роданистая |
роданиды |
|
H2SO3 |
сернистая |
сульфиты |
|
H2SO4 |
серная |
сульфаты |
|
H2S2O3 |
тиосерная |
тиосульфаты |
|
H2SiO3 |
метакремниевая |
метасиликаты |
|
62
Приложение 9
Названия некоторых средних, кислых и основных солей
Формула |
|
Название |
|
|
Средние соли |
(cодержат в своём составе катионы металлов и кислотные остатки) |
||
NaCl |
|
хлорид натрия |
K2SO4 |
|
сульфат калия |
K2CrO4 |
|
хромат калия |
Fe2(SO4)3 |
|
сульфат железа (III) |
(NH4)3PO4 |
|
ортофосфат аммония |
A1(NO3)3 |
|
нитрат алюминия |
|
|
Кислые соли |
(cодержат кислотные остатки с незамещёнными атомами водорода) |
||
NaHCO3 |
|
гидрокарбонат натрия |
K2HPO4 |
|
гидроортофосфат калия |
KH2PO4 |
|
дигидроортофосфат калия |
Ca(HS)2 |
|
гидросульфид кальция |
Fe(HCO3)2 |
|
гидрокарбонат железа (II) |
Ba(H2PO4)2 |
|
дигидроортофосфат бария |
|
|
Основные соли |
|
(cодержат в своём составе гидроксогруппы) |
|
(CaOH)2SO4 |
|
гидроксосульфат кальция |
(CoOH)NO3 |
|
гидроксонитрат кобальта (II) |
FeOHCl |
|
гидроксохлорид железа (II) |
FeOHCl2 |
|
гидроксохлорид железа (III) |
Fe(OH)2Cl |
|
дигидроксохлорид железа (III) |
Fe(OH)2NO3 |
|
дигидроксонитрат железа (III) |
[Fe(OH)2]2SO4 |
|
дигидроксосульфат железа (III) |
(AlOH)2SiO4 |
|
ортосиликат гидроксоалюминия |
63

Металл
Усиление восстановительной активности
Приложение 10
Ряд стандартных электродных потенциалов
|
Катион в растворе |
Стандартный потенциал |
|
|
|
ϕ°, В |
|
Литий |
Li+ |
- 3,045 |
|
Калий |
К+ |
- 2,925 |
|
Барий |
Ва2+ |
- 2,920 |
|
Кальций |
Са2+ |
- 2,866 |
|
Натрий |
Na+ |
- 2,714 |
|
Магний |
Mg2+ |
- 2,363 |
|
Алюминий |
Al3+ |
- 1,662 |
активности |
Цинк |
Zn2+ |
- 0,763 |
|
Титан |
Ti2+ |
- 1,628 |
|
Марганец |
Mn2+ |
- 1,180 |
|
Хром |
Cr2+ |
- 0,913 |
окислительной |
Хром |
Cr3+ |
- 0,744 |
|
Железо |
Fe2+ |
- 0,44 |
|
Кадмий |
Cd2+ |
- 0,403 |
|
Кобальт |
Co2+ |
- 0,277 |
|
Никель |
Ni2+ |
- 0,250 |
|
Олово |
Sn2+ |
- 0,136 |
Усиление |
Свинец |
Pb2+ |
- 0,126 |
|
Железо |
Fe3+ |
- 0,036 |
|
ВОДОРОД |
H+ |
0,00 |
|
Висмут |
Bi3+ |
+ 0,215 |
|
Сурьма |
Sb3+ |
+ 0,24 |
|
Медь |
Cu2+ |
+ 0,337 |
|
Серебро |
Ag+ |
+ 0,799 |
|
Ртуть |
Hg2+ |
+ 0,854 |
|
Платина |
Pt2+ |
+ 1,2 |
|
Золото |
Au3+ |
+ 1,498 |
|
Золото |
Au+ |
+ 1,691 |
|
|
|
|
|
64

Приложение 11
Электролиз растворов: анодные и катодные процессы
Li+ Rb+ K+ Ba2+ Sr2+ Ca2+ |
Mn2+ Zn2+ Cr3+ Fe2+ Fe3+ Cd2+ |
Sb3+Bi3+Cu2+Hg2+Ag+Pd2+ |
|||
Na+ Mg2+ A13+ |
Со2+ Ni2+ Sn2+ Pb2+ |
Pt2+Au3+ |
|
||
На катоде |
|
|
|
|
|
При |
электролизе |
При электролизе рас- |
При электролизе рас- |
||
водных растворов не |
творов восстанавлива- |
творов практически |
|||
восстанавливаются. |
ются |
на катоде |
полностью восстанавли- |
||
На |
катоде |
одновременно с моле- |
ваются |
на катоде. |
|
восстанавливаются |
кулами воды: |
|
|
||
ионы водорода: |
2Н2О + 1e- = Н2 + 2ОН- |
|
|
||
2Н+ + 2е- = Н2 или |
|
|
|
|
|
2Н2О + 2е- = Н2 + 2OH- |
|
|
|
|
|
На аноде
В случае растворимого анода (Cu, Ag, Zn, Cd, Hg, Ni и др.) при электро-
лизе водного раствора окисляется анод, и металл переходит в раствор в виде ионов: Сu - 2е- = Сu2+
В случае с инертным (нерастворимым) анодом:
1)при электролизе водных растворов солей бескислородных кислот (Сl-, Вr-, I-, S2- и др.) окисляются анионы бескислородных кислот: 2Сl- - 2е- = С12;
2)при электролизе водных растворов солей кислородсодержащих кислот
окисляются молекулы воды или гидроксид-ионы: 2Н2О - 4е- = О2 + 4Н+ или 4ОН- - 4е- = О2 + 2Н2О.
Анионы по способности окисляться располагаются в следующем порядке: I-;Br-; S2-;Сl-;OH-;SO42-;NO3-;CO32-;РО43-;F- восстановительная активность уменьшается
65
Приложение 12
Взаимодействие серной и азотной кислот с некоторыми металлами
Металл |
|
Кислота (окислитель) |
|
|
|
|
H2SO4 |
HNO3 |
|
|
разб. |
конц. |
разб. |
конц. |
К, Ва, Са, |
соль+H2 |
соль +H2S+Н2О |
соль +NH3 (NH4NO3) |
соль +N2O+Н2О |
Na, Mg |
|
|
+ Н2O |
|
|
|
|
|
|
Al, Cr, Fe |
соль +H2 |
пассивация (на холо- |
соль +NO+Н2О |
пассивация |
|
|
де); |
|
|
|
|
при нагревании: |
|
|
|
|
с А1- соль +H2S+ |
|
|
|
|
Н2О, |
|
|
|
|
с Cr, Fe - соль + |
|
|
|
|
SO2+ Н2O) |
|
|
Zn, Sn |
соль +H2 |
соль +SO2+Н2О |
соль +NO+Н2О |
соль +NO2+Н2О |
Ni, Pb, |
|
|
|
|
|
|
|
|
|
Cu, Hg, Ag |
- |
соль + SO2+Н2О |
соль +NO+Н2О |
соль +NO2+H2O |
|
|
|
|
|
66
Приложение 13
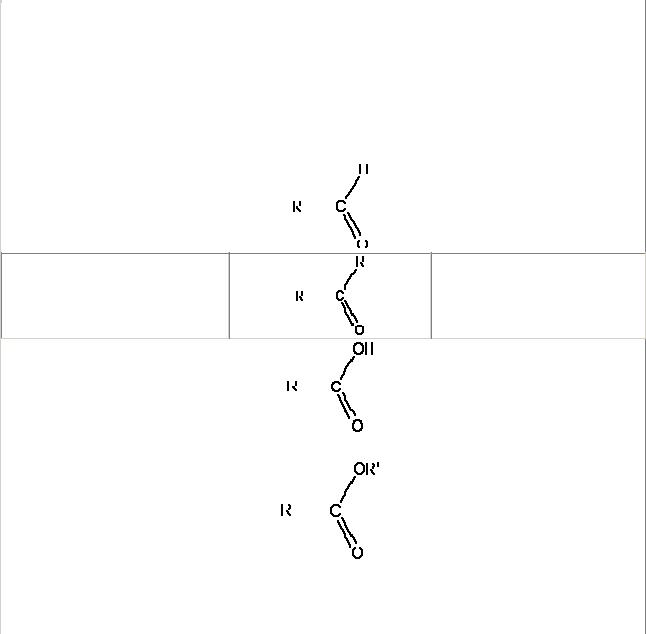
Важнейшие классы органических соединений
Название класса |
Функциональная группа |
Образование названия (в |
||||||||
суффиксе или приставке) |
||||||||||
Углеводороды предельные |
|
|
R–CH3 |
-ан |
||||||
с двойной связью |
R– HC=CH –R |
-ен |
||||||||
с тройной связью |
R–C≡C–R |
-ин |
||||||||
Углеводородный радикал |
|
|
|
R. |
-ил |
|||||
Спирты |
|
|
|
R-OH |
-ол |
|||||
Альдегиды |
|
|
|
|
|
|
|
|
|
-аль |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кетоны |
|
|
|
-он |
|
||||
|
|
Карбоновые кислоты |
|
|
|
|
|
|
|
|
|
|
|
-овая кислота |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Простые эфиры |
|
|
|
|
|
|
R–O–R’ |
R-ил – R’-овый эфир |
||||
Сложные эфиры |
|
|
|
|
|
|
|
|
|
|
|
-иловый эфир …-ой ки- |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
слоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Амины |
|
|
|
|
|
|
R -NH2 |
-амин |
||||
Нитросоединения |
|
|
|
|
|
|
R -NO2 |
нитро- |
||||
Аминокислоты |
H2N- R - COOH |
амино-…-ая кислота |
||||||||||
67
|
|
|
|
|
|
|
|
|
|
Приложение 14 |
|||
|
Номенклатура предельных углеводородов и их радикалов |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкан |
|
|
|
|
Радикал |
|||||
|
формула |
|
название |
|
формула |
|
|
название |
|||||
|
СН4 |
|
|
метан |
|
-СН3 |
|
|
метил |
||||
|
С2Н6 |
|
|
этан |
|
-С2Н5 |
|
|
этил |
||||
|
С3Н8 |
|
|
пропан |
|
-С3Н7 |
|
|
пропил |
||||
|
С4Н10 |
|
|
бутан |
|
-С4 Н9 |
|
|
бутил |
||||
|
С5Н12 |
|
|
пентан |
|
-С5Н11 |
|
|
пентил |
||||
|
С6Н14 |
|
|
гексан |
|
-С6Н13 |
|
|
гексил |
||||
|
С7Н16 |
|
|
гептан |
|
-С7Н15 |
|
|
гептил |
||||
|
С8Н18 |
|
|
октан |
|
-С8Н17 |
|
|
октил |
||||
|
С9Н20 |
|
|
нонан |
|
-С9Н19 |
|
|
нонил |
||||
|
С10Н22 |
|
|
декан |
|
-С10Н21 |
|
децил (декил) |
|||||
|
|
|
|
|
|
|
|
|
|
Приложение 15 |
|||
|
|
|
|
|
Типы ядерных реакций |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Типы ядерных реакций |
|
|
|
||||
|
α - распад |
|
Позитронный β+ - |
|
Электронный β– |
Электронный за- |
|
Спонтанное |
|
||||
|
|
|
распад |
|
|
- распад |
хват |
|
деление |
|
|||
|
Ядро атома |
|
Протон превра- |
|
Нейтрон в ядрах |
Один из электронов |
|
Самопроиз- |
|
||||
|
испускает ά - |
|
щается в нейтрон, |
|
атома превраща- |
собственной элек- |
|
вольный рас- |
|
||||
|
частицу (ядро |
|
образуется пози- |
|
ется в протон, |
тронной оболочки |
|
пад ядер тяже- |
|
||||
|
гелия). Это |
|
трон и нейтрино. |
|
образуется элек- |
захватывается |
|
лых элементов |
|
||||
|
приводит к |
|
Массовое число |
|
трон и антиней- |
ядром. Взаимодей- |
|
на 2 ядра- |
|
||||
|
уменьшению |
|
не меняется, за- |
|
трино. |
ствие электрона с |
|
осколка, при |
|
||||
|
заряда исход- |
|
ряд ядра умень- |
|
Массовое число |
протоном приводит |
|
этом испуска- |
|
||||
|
ного ядра на |
|
шается на 1 |
|
|
не меняется, за- |
к образованию ней- |
|
ется несколько |
|
|||
|
2, а его мас- |
|
|
|
|
|
ряд ядра увели- |
трона. Массовое |
|
нейтронов |
|
||
|
сового числа |
|
|
|
|
|
чивается на 1 |
число не изменяет- |
|
|
|
||
|
на 4. |
|
|
|
|
|
|
|
ся, заряд ядра |
|
|
|
|
|
|
|
|
|
|
|
|
|
уменьшается на 1. |
|
|
|
|
|
92234U→ |
|
611C →511B + β+ + |
|
83210Bi →84210Po + |
47Be +e-→37Li + v– |
|
92232U→56138Ba |
|
||||
|
90230Th + 24He |
|
v |
|
|
β– + v– |
|
|
|
+ 3686Kr + 8 01n |
|
||
68
Приложение 16 Пример оформления титульного листа
ФГОУ ВПО «Алтайский государственный аграрный университет» Кафедра химии
КОНТРОЛЬНАЯ РАБОТА по химии
Вариант №___
Выполнил:
Студент _____________________
Специальность __________________, (заочная форма обучения)
Проверил:
Довбыш С.А., к.с-х.н., доцент
«___» ___________ 2010 г.
Барнаул
2010
69
|
Содержание |
|
1. |
Целевая установка и организационно-методические указания.......................... |
3 |
2. |
Методические рекомендации по выполнению контрольных работ .................. |
5 |
3. |
Контрольные задания.............................................................................................. |
6 |
3.1. Моль. Эквивалентные массы и эквиваленты простых и сложных веществ. |
|
|
Закон эквивалентов..................................................................................................... |
6 |
|
3.2. Строение атома..................................................................................................... |
7 |
|
3.3. Периодическая система элементов Д.И. Менделеева ...................................... |
9 |
|
3.4. Химическая связь............................................................................................... |
10 |
|
3.5. Тепловые эффекты химических реакций. Термодинамические расчёты ..... |
12 |
|
3.6. Химическая кинетика и химическое равновесие............................................ |
14 |
|
3.7. Растворы. Способы выражения концентрации............................................... |
16 |
|
3.8. Свойства растворов............................................................................................ |
17 |
|
3.9. Ионно-молекулярные (ионные) реакции обмена........................................... |
19 |
|
3.10. Гидролиз солей................................................................................................. |
21 |
|
3.11. Окислительно-восстановительные реакции.................................................. |
22 |
|
3.12. Электрохимические процессы. Электролиз. Коррозия металлов............... |
25 |
|
3.13. Комплексные соединения................................................................................ |
26 |
|
3.14. Неметаллы......................................................................................................... |
28 |
|
3.15. Металлы............................................................................................................. |
29 |
|
3.16. Основные классы неорганических соединений............................................ |
31 |
|
3.17.Органические соединения................................................................................ |
31 |
|
3.18. Высокомолекулярные соединения ................................................................. |
33 |
|
3.19. Химическая идентификация веществ ............................................................ |
34 |
|
4. |
Примеры решения задач контрольной работы................................................... |
35 |
5. |
Контрольные вопросы для подготовки к зачету/экзамену ............................... |
52 |
6. |
Список рекомендуемой литературы.................................................................... |
54 |
Приложения ............................................................................................................... |
55 |
|
70
