
- •Кислотно-основные свойства органических соединений.
- ••Кислоты Брёнстеда-Лоури – это молекулы или ионы, способные отдавать протон.
- •Кислоты
- •Кислотность и основность органических соединений
- •!!! Кислотность определяется стабильностью сопряженных оснований (органических анионов).
- •Факторы стабильности
- •Факторы стабильности сопряженных оснований
- •Факторы стабильности сопряженных оснований
- •Основания
- •2) При одинаковых радикалах
- •4) Алифатические амины более сильные основания, чем
- •π–основания имеют двойную связь, в них центром основности являются π – электроны двойной
- •По направлению и конечному результату
- •По характеру изменения связей в субстратах и реагентах
- •Основные понятия
- •Основные понятия
- •Реакции радикального замещения (SR) – …
- •Обрыв цепи
- •Реакции электрофильного присоединения (АЕ) — …
- •*1. Образование -комплекса
- ••5.1. 3. Гидрогалогенирование
- •При присоединении НХ к алкенам, водород присоединяется к более гидрогенизированному атому углерода при
- ••5.1.4. Гидратация (присоединение воды)
- ••Присоединение воды к двойной связи протекает в организме и катализируется ферментами, например :
- •Реакции электрофильного замещения (SE)
- ••Механизм реакции нитрования
- •II. Образование -комплекса.
- •IV. Выброс протона
- ••Механизм галогенирования.
- ••II. Образование -комплекса
- •III. Выброс протона
- •*5.1.6. Ориентирующее действие заместителя
- •COOH
- •*Поражение кроветворных систем, кожных покровов, желез внутренней секреции, иммунитета, мутации.
- •*Расщепление жиров в организме жиров, ЖК, углеводов.
- •*Биосинтез ароматических гормонов и аминокислот.
- •СПАСИБО
Кислотно-основные свойства органических соединений.
Лектор: ст. преподаватель Усова
Марина Геннадиевна.
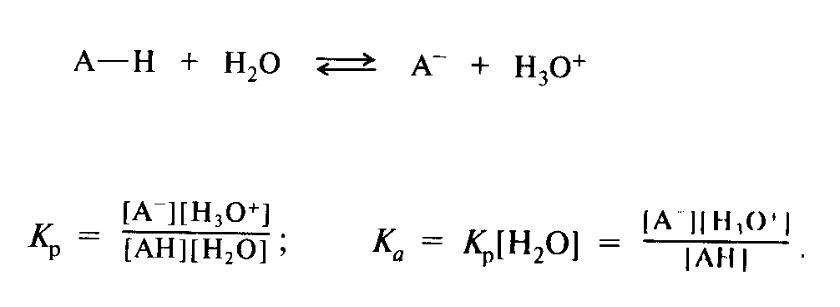
•Кислоты Брёнстеда-Лоури – это молекулы или ионы, способные отдавать протон.
•Основания Брёнстеда-Лоури – это молекулы или ионы, способные принимать протон.
- lg Kа = рКа
2 |
07/12/19 |

Кислоты
HA + Н2О A– + H3O+
H3C–COOH + H2O H3C–COO– + H3O+
кислота основание с. основание с. кислота
Сила кислоты находится в
обратной зависимости от величины показателя константы ионизации.
Кислотность и основность органических соединений
Соединения |
рКа |
рКвн+ |
|
_____________________________________________ |
|
||
ССl3СООН |
0,7 |
- |
|
НСООН |
3,76 |
- |
ОH |
СН3СООН |
4,76 |
-6 |
|
С6Н5ОН |
10,0 |
-6 |
|
НОН |
15,6 |
-1,7 |
|
C2H5OH |
18,0 |
-2,2 |
|
_________________________________________________ |
|||
СН3SH |
- |
-6,0 |
SH |
С2Н5SН |
12,0 |
-7,0 |
|
_________________________________________________ |
|||
С2Н5NH2 |
2,5 |
+10,7 |
|
(C2H5)2NH |
- |
+10,9 |
NH |
(C2H5)3N |
- |
+ 9,8 |
|
C6H5NH2 |
- |
+ 4,6 |
|
C5H5N |
|
+ 5,2 |
|
______________________ |
|
_CH |
|
C2H6 |
50,0 |
- _______ |
|
______ |
|
|
|
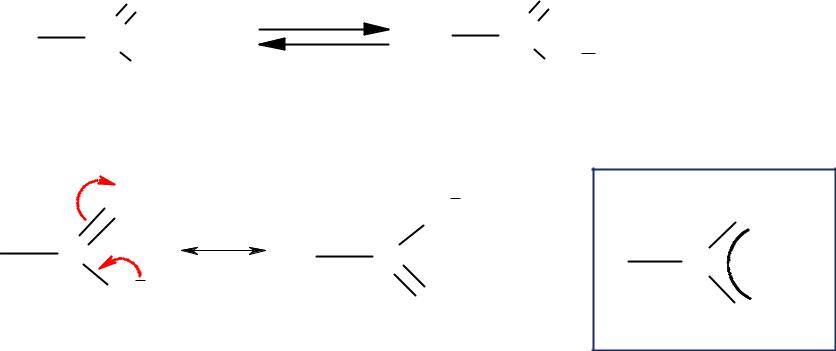
!!! Кислотность определяется стабильностью сопряженных оснований (органических анионов).
Факторы стабильности
сопряженных оснований
•Электроотрицательность и поляризуемость атома в кислотном центре
(SН > OН > NН > CН 12 > 18 > 25 > 50).
•Стабильность аниона за счет сопряжения -0,5
-0,5
O |
|
O |
C |
C |
+ H+ |
OH |
|
O |
O |
O |
O-0,5 |
|
C |
C |
C |
|
O |
O |
O |
-0,5 |
|
|
||
|
|
|
|
Нижник Я.П. |
7 |
07/12/19 |
http://norgchem.professorjournal.ru |
|
|
Факторы стабильности сопряженных оснований
•Влияние органических радикалов, связанных с кислотным центром:
Cl3C–COOH, H–COOH, H3C–COOH.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ РАДИКАЛОВ (Э.Д. – Э.А):
Н3С–СООН < Н–СООН < ClH2C – COOH < Cl3C - COOH рКа 4,75 3,75 2,80 0,70
Факторы стабильности сопряженных оснований
•Влияние растворителя: стабильность аниона зависит от сольватации его в растворе – чем он более сольватирован, тем более устойчив.
•Увеличение кислотности в водном |
||||||
растворе |
|
|
H |
|||
H3C |
|
C |
|
CH3 |
||
|
|
|||||
|
|
|
|
|||
Н3С–ОН > H3C–CH2–OH > |
|
|
OH |
|||
|
|
|
|
|
|
|
В газовой фазе зависимость обратная.
Основания
n – основания – нейтральные молекулы или отрицательно заряженные (NH3, ROH,
RSH, HOH, NH2–, RO–, RS–, HO– и др.).
Сила основания находится в прямой зависимости от величины показателя рКвн+.
Влияние природы атома в основном центре противоположно кислотам:
1) Чем больше
электроотрицательность атома основного центра, тем меньше основность соединения (H5C2–OH, H5C2–SH, H5C2–NH2).
