
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
9.2 Симметрия кристаллов. Система кристаллов
 Классификация
кристаллов основана на их симметрии.
Тот или иной объект обладает симметрией,
если после определенного изменения
его положения в пространстве он
совмещается со своим первоначальным
положением. Так, трехлопастный пропеллер
можно повернуть вокруг оси на 120° (на
одну треть оборота), и тогда его положение
нельзя отличить от первоначального при
условии, что все лопасти совершенно
одинаковы.
Классификация
кристаллов основана на их симметрии.
Тот или иной объект обладает симметрией,
если после определенного изменения
его положения в пространстве он
совмещается со своим первоначальным
положением. Так, трехлопастный пропеллер
можно повернуть вокруг оси на 120° (на
одну треть оборота), и тогда его положение
нельзя отличить от первоначального при
условии, что все лопасти совершенно
одинаковы.
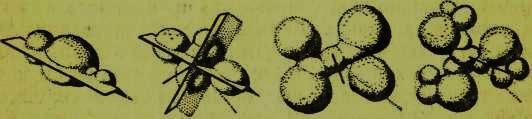
Рис. 3 Виды симметрии кристалла
Точно так же он может быть повернут на 240° (на две трети оборота), и снова невозможно будет отличить его новое положение от первоначального. Такое вращение на одну треть оборота, на две трети оборота, а также полный оборот образуют операции симметрии, характерные для оси симметрии третьего порядка. Некоторые другие примеры симметрии показаны на рисунке3.
Кристаллы обладают лишь некоторыми элементами симметрии, к числу которых относятся: центр симметрии, оси симметрии второго порядка, третьего порядка, четвертого порядка, шестого порядка, зеркально-поворотные оси четвертого и третьего порядка, плоскость симметрии. Все эти виды симметрии показаны на рисунке 4.
Ось симметрии пятого порядка в кристаллах не встречается, поскольку угол пятиугольника равен 108°, а на такое число не делится угол 360°.
Существует 32 сочетания элементов симметрии, свойственных кристаллам. Эти сочетания называются видами симметрии или классами кристаллов. Описание видов симметрии кристаллов можно найти в руководствах по кристаллографии. Тридцать два вида (класса) симметрии кристаллов разделяются на шесть систем или сингоний кристаллов:
кубическая система (иногда называемая изометрической) с осями симметрии третьего и четвертого порядка (оси четвертого порядка могут быть зеркально-поворотного типа);
тетрагональная система с одной осью четвертого порядка;
гексагональная или тригональная система (включает ромбоэдрические кристаллы) с одной осью шестого порядка или одной осью третьего порядка;
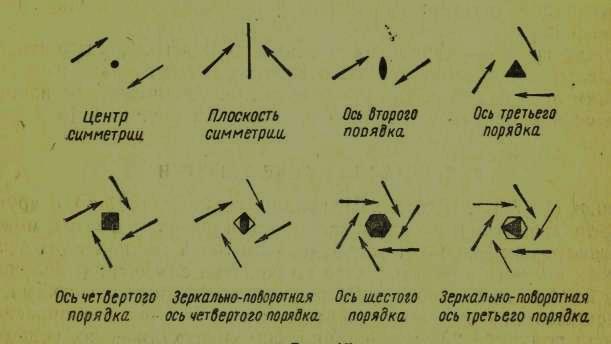
Рис. 4. Виды симметрии кристалла
ромбическая система с двумя или тремя плоскостями симметрии или осями симметрии второго порядка, образующими прямые углы между собой;
моноклинная система с одной плоскостью или одной осью второго порядка, или же с тем и другим элементом симметрии;
триклинная система с центром симметрии или без элементов симметрии.
Кристаллы и их элементарные ячейки можно описать осями симметрии, которые в одних случаях могут располагаться под прямыми углами одна к другой, в других под углами 120° (в случае гексагональной и тригональной систем), или под другими углами. Различным системам свойственны следующие типы осей:
кубической системе: три равные взаимно перпендикулярные оси длиной а;
тетрагональной системе: две равные оси длиной а и третья ось длиной с; все оси взаимно перпендикулярны;
гексагональной или тригональной системе: две равные оси длиной а образуют между собой угол 120°, третья ось длиной с расположена под прямым углом к первым двум:
ромбической системе: три оси длиной соответственно а, b, с, расположенные взаимно перпендикулярно;
моноклинной системе: две оси (а и с) образуют между собой угол β, а третья ось b расположена под прямым углом к осям а и с;
триклинной системе: три оси а, b и с образуют между собой углы α, β и γ.
Между гранями кристалла и осями должны существовать рациональные отношения: отрезки осей, отсекаемых гранью, относятся к длинам осей а, b и с, как простые числа. Схематическое изображение осей кристаллов и граней показано на рисунках 5 и 6.
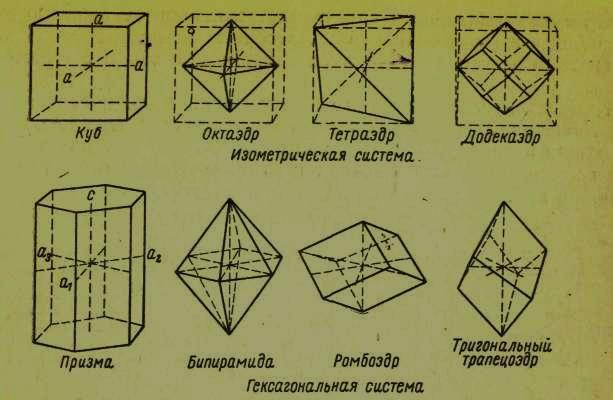
Рис. 5. Схематическое изображение осей кристаллов и граней
