
- •22. Кг металла вытесняют из кислоты 1,4 л водорода, измеренного при н.У. Эта же масса металла вытесняеткг свинца из растворов его солей. Вычислите эквивалентную массу свинца.
- •97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях ,,hcooh, .
- •122. Рассчитайте ∆h , если известно, что:
- •147. Определите расчетом, какие из реакций, уравнения которых:
- •197. Водный раствор содержит 577 г в 1 л. Плотность раствора 1,335 г/. Вычислите массовую долюв растворе, а также эквивалентную концентрацию раствора.
- •222. Сколько граммов глюкозы содержится в 200 мл раствора, осмотическое давление которого при 37℃ составляет 8 атм.?
- •247. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
- •272. Почему растворы иNaCn имеют щелочную реакцию, а растворы и– кислую? Ответ подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
197. Водный раствор содержит 577 г в 1 л. Плотность раствора 1,335 г/. Вычислите массовую долюв растворе, а также эквивалентную концентрацию раствора.
Ответ.
Пусть
имеется
 раствора серной кислоты. Масса раствора
равна:
раствора серной кислоты. Масса раствора
равна:

Массовая доля ‒ отношение массы растворенного вещества к массе раствора:

где
ω ‒ массовая доля;
 – масса растворенного вещества;
– масса растворенного вещества;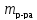 –
масса раствора.
–
масса раствора.
Подставляя значения, получим:
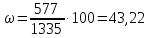
Эквивалентная концентрация ‒ число молей эквивалентов растворенного вещества, содержащихся в одном литре раствора:
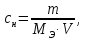
где
 – эквивалентная концентрация;
– эквивалентная концентрация; ‒ количество вещества эквивалентов;
‒ количество вещества эквивалентов; – масса растворенного вещества;
– масса растворенного вещества; –
молярная масса эквивалентов растворенного
вещества;
V
‒ объем раствора.
–
молярная масса эквивалентов растворенного
вещества;
V
‒ объем раствора.
Подставляя
значения и учитывая, что молярная масса
эквивалентов
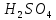 равна
равна г/моль, получим:
г/моль, получим:

222. Сколько граммов глюкозы содержится в 200 мл раствора, осмотическое давление которого при 37℃ составляет 8 атм.?
Ответ.
Осмотическое давление рассчитывается по уравнению Вант-Гоффа:

где
π
– осмотическое давление раствора;
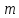 – масса растворенного вещества;R
–
универсальная газовая постоянная,
равная 82,057
– масса растворенного вещества;R
–
универсальная газовая постоянная,
равная 82,057
 ∙атм/(моль∙К);T
– абсолютная температура; М
– молярная масса растворенного вещества;
V
– объем раствора.
∙атм/(моль∙К);T
– абсолютная температура; М
– молярная масса растворенного вещества;
V
– объем раствора.
Отсюда
выражаем и рассчитываем массу растворенного
вещества, учитывая, что молярная масса
 равна 180 г/моль, а
равна 180 г/моль, а :
:
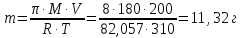
247. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
а)
 ;
;
б)
 ;
;
в)
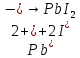 .
.
Ответ.
При составлении молекулярных уравнений для соответствующих ионно-молекулярных необходимо помнить, что формулы слабых электролитов, осадков и газов пишут в ионных уравнениях в молекулярной форме. Следовательно, если в левой части ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, то при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов.
а)
Наличие гидрокарбонат-анионов
 и катионов водорода
и катионов водорода говорит о том, что взаимодействуют два
сильных электролита – растворимая
кислая соль угольной кислоты и сильная
кислота, состав которых может быть
весьма разнообразным, то есть одному
ионно-молекулярному уравнению может
соответствовать несколько молекулярных
уравнений. Например:
говорит о том, что взаимодействуют два
сильных электролита – растворимая
кислая соль угольной кислоты и сильная
кислота, состав которых может быть
весьма разнообразным, то есть одному
ионно-молекулярному уравнению может
соответствовать несколько молекулярных
уравнений. Например:

б)
Наличие
катионов кадмия
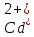 и сульфид-анионов
и сульфид-анионов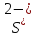 говорит о том, что взаимодействуют два
сильных электролита – растворимые соли
кадмия и сероводородной кислоты, состав
которых может быть весьма разнообразным,
то есть одному ионно-молекулярному
уравнению может соответствовать
несколько молекулярных уравнений
соответственно. Например:
говорит о том, что взаимодействуют два
сильных электролита – растворимые соли
кадмия и сероводородной кислоты, состав
которых может быть весьма разнообразным,
то есть одному ионно-молекулярному
уравнению может соответствовать
несколько молекулярных уравнений
соответственно. Например:
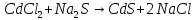
в)
Наличие катионов свинца(II)
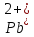 и йодид-анионов
и йодид-анионов говорит о том, что взаимодействуют два
сильных электролита – растворимые соли
свинца(II)
и йодоводородной кислоты, состав которых
может быть весьма разнообразным, то
есть одному ионно-молекулярному уравнению
может соответствовать несколько
молекулярных уравнений соответственно.
Например:
говорит о том, что взаимодействуют два
сильных электролита – растворимые соли
свинца(II)
и йодоводородной кислоты, состав которых
может быть весьма разнообразным, то
есть одному ионно-молекулярному уравнению
может соответствовать несколько
молекулярных уравнений соответственно.
Например:

