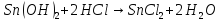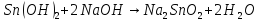- •22. Кг металла вытесняют из кислоты 1,4 л водорода, измеренного при н.У. Эта же масса металла вытесняеткг свинца из растворов его солей. Вычислите эквивалентную массу свинца.
- •97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях ,,hcooh, .
- •122. Рассчитайте ∆h , если известно, что:
- •147. Определите расчетом, какие из реакций, уравнения которых:
- •197. Водный раствор содержит 577 г в 1 л. Плотность раствора 1,335 г/. Вычислите массовую долюв растворе, а также эквивалентную концентрацию раствора.
- •222. Сколько граммов глюкозы содержится в 200 мл раствора, осмотическое давление которого при 37℃ составляет 8 атм.?
- •247. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
- •272. Почему растворы иNaCn имеют щелочную реакцию, а растворы и– кислую? Ответ подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
22. Кг металла вытесняют из кислоты 1,4 л водорода, измеренного при н.У. Эта же масса металла вытесняеткг свинца из растворов его солей. Вычислите эквивалентную массу свинца.
Ответ.
По закону эквивалентов массы (объемы) реагирующих друг с другом веществ, а также массы (объемы) продуктов этой реакции пропорциональны эквивалентным массам (объемам) этих веществ. Следовательно, можно записать:
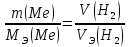
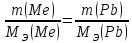
Отсюда выражаем и рассчитываем эквивалентную массу свинца, учитывая, что эквивалентный объем водорода равен 11,2 л/моль:

47.
В чем заключается принцип Паули? Может
ли быть на каком-нибудь подуровне атома
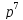 или
или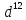 -электронов?
Почему? Составьте электронную формулу
атома элемента с порядковым номером 22
и укажите его валентные электроны.
-электронов?
Почему? Составьте электронную формулу
атома элемента с порядковым номером 22
и укажите его валентные электроны.
Ответ.
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами.
На
подуровне со значением орбитального
квантового числа, равным
 ,
находится (
,
находится ( )
орбиталь, на каждой из которых может
находиться не более двух электронов.
)
орбиталь, на каждой из которых может
находиться не более двух электронов.
На
подуровне атома не может быть
 -электронов,
так как для
-электронов,
так как для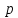 -подуровня
орбитальное квантовое число
-подуровня
орбитальное квантовое число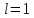 и, следовательно, на
и, следовательно, на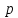 -подуровне
может находиться не более
-подуровне
может находиться не более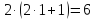 электронов.
электронов.
На
подуровне атома не может быть
 -электронов,
так как для
-электронов,
так как для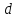 -подуровня
орбитальное квантовое число
-подуровня
орбитальное квантовое число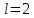 и, следовательно, на
и, следовательно, на -подуровне
может находиться не более
-подуровне
может находиться не более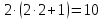 электронов.
электронов.
Так
как число электронов в атоме равно
заряду ядра, то есть порядковому номеру
элемента, то для атома элемента №22
электронная формула запишется следующим
образом:
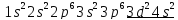 (валентные электроны подчеркнуты).
(валентные электроны подчеркнуты).
72.
Исходя из степени окисления атомов
соответствующих элементов, дайте
мотивированный ответ на вопрос: какой
из двух гидроксидов является более
сильным основанием: CuOH
или
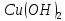 ;
;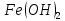 или
или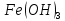 ;
; или
или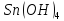 ?
Напишите уравнения реакций, доказывающих
амфотерность гидроксида олова(II).
?
Напишите уравнения реакций, доказывающих
амфотерность гидроксида олова(II).
Ответ.
Если элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства этих соединений изменяются от основных через амфотерные к кислотным.
Гидроксид
меди(I)
 проявляет основные свойства; с ростом
степени окисления меди меняются и
свойства образуемых гидроксидов –
гидроксид меди(II)
проявляет основные свойства; с ростом
степени окисления меди меняются и
свойства образуемых гидроксидов –
гидроксид меди(II)
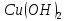 проявляет слабоосновные свойства. Таким
образом,
проявляет слабоосновные свойства. Таким
образом,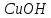 является более сильным основанием.
является более сильным основанием.
Гидроксид
железа(II)
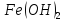 проявляет основные свойства, для
гидроксида железа(III)
проявляет основные свойства, для
гидроксида железа(III)
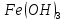 характерны слабоосновные свойства, с
долей амфотерности. Таким образом,
характерны слабоосновные свойства, с
долей амфотерности. Таким образом,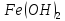 является более сильным основанием.
является более сильным основанием.
Гидроксид
олова(II)
 проявляет амфотерные свойства, гидроксид
олова(IV)
проявляет амфотерные свойства, гидроксид
олова(IV)
 также имеет амфотерный характер, с
преобладанием кислотных свойств. Таким
образом,
также имеет амфотерный характер, с
преобладанием кислотных свойств. Таким
образом,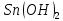 является более сильным основанием.
является более сильным основанием.
Уравнения реакций, доказывающих амфотерность гидроксида олова(II), запишутся следующим образом: