
voronina
.pdfОскільки пролін служить попередником гідроксипроліну, то обидві амінокислоти відносять до глутаматної родини амінокислот.
Гідроксипролін міститься в тканинах практично тільки в складі колагену, на частку якого припадає значна частина білка в організ- мі ссавців.
Що стосується амінокислотного складу колагену, то третина амінокислотних залишків припадає на гліцин, і близько третини – на пролін та гідроксипролін. Гідроксипролін стабілізує спіраль колагену відносно дії протеаз.
Відмінною особливістю метаболізму гідроксипроліну є те, що гі- дроксипролін, який входить до складу їжі, не включається у колаген.
Гістидин – це так звана «напівзамінна» амінокислота, оскільки вона синтезується в організмі, проте швидкість синтезу є недостат- ньою для того, щоб забезпечити ріст організму.
В організмі гістидин може синтезуватися з АТФ і рибози: пурино- ва частина АТФ постачає фрагмент –N=CH–NH– для імідазольного циклу гістидину; решта молекули утворюється за рахунок рибози.
Незамінні амінокислоти, за винятком лізину й треоніну, беруть участь у реакціях трансамінування. Таким чином, за наявності відпо- відних α-кетокислот вони також могли б синтезуватися в організмі (окрім лізину і треоніну). Незамінні, по суті, α-кетокислоти, котрі відповідають незамінним амінокислотам. Проте їжа людини не міс- тить скільки-небудь помітних кількостей таких кетокислот, тому їх єдиним джерелом є незамінні амінокислоти їжі. З цього випливає, що трансамінування незамінних амінокислот служить етапом тільки їх катаболізму, а не синтезу, на відміну від замінних амінокислот, для яких трансамінування може бути початковою стадією катаболі- зму або кінцевою стадією синтезу.
Утворення кінцевих продуктів білкового обміну
Внаслідок трансамінування і дезамінування із більшості амі- нокислот утворюються α-кетокислоти й аміак. Подальші шляхи метаболізму утворених безазотистих компонентів амінокислот і аміаку розходяться.
Піровиноградна кислота, яка утворилася під час дезамінування аланіну, серину та деяких їх похідних, зазнає складного окислювально- го декарбоксилювання і перетворюється в ацетил-КоА, котрий далі метаболізується до СО2 і Н2О у циклі Кребса.
Щавлевооцтова кислота, яка утворилася під час дезамінування аспарагінової кислоти, після декарбоксилювання також перетворю- ється в піровиноградну.
Зазнаючи також складного окислювального декарбоксилюван- ня, α-кетоглутарова кислота перетворюється в активну форму янта- рної кислоти – сукциніл-КоА, котра через ряд проміжних продуктів окислюється до щавлевооцтової, а остання, декарбоксилюючись, пе- ретворюється до піровиноградної і далі – до ацетил-КоА, метаболі- чна доля якого описана вище.
341
Утворений як продукт інтеграції обміну α-кетокислот, аце- тил-КоА, поряд з окисленням у циклі трикарбонових кислот до СО2 і Н2О, може використовуватися для біосинтезу вищих жирних кислот, холестерину, стероїдних гормонів, жовчних кислот та ін- ших органічних сполук.
За рахунок окислення продуктів обміну амінокислот до СО2 і Н2О вивільняється приблизно 10–15% енергії, необхідної організму. α-Кетоглутарова, щавлевооцтова і піровиноградна кислоти можуть також включатися в процеси трансамінування як акцептори аміно- груп з утворенням відповідних амінокислот і в ряд інших реакцій.
Аміак частково використовується для біосинтезу необхідних ор- ганізму азотистих сполук, таких як пуринові і піримідинові основи нуклеотидів – мономерів нуклеїнових кислот та ряду інших структур.
Проте переважна частина аміаку як токсичної речовини зазнає перетворення до сечовини, яка є нетоксичним кінцевим продуктом білкового обміну, і виводиться з організму із сечею.
Протягом доби в організмі людини дезамінується 100–120 г аміно- кислот, що відповідає 16–19,5 г азоту або 18–23,6 г аміаку. Невелика кі- лькість аміаку утворюється також під час розпаду азотистих основ нук- леотидіві деяких інших азотовмісних субстратів небілкової природи.
Біосинтез сечовини
Аміак є токсичною речовиною, і підвищення його вмісту в крові та інших тканинах є особливо небезпечним для мозку. Одне з пояс- нень високої чутливості мозку до вільного аміаку полягає ось у чому.
Вільний аміак легко проходить через мембрани і проникає в клі- тини мозку та їх мітохондрії. Тут він взаємодіє з α-кетоглутаровою кислотою, утворюючи глутамат. Це призводить до зменшення кіль- кості α-кетоглутарату як проміжного продукту циклу лимонної кис- лоти, що супроводжується зниженням швидкості окислення глюкози, яка відіграє провідну роль в енергетичному забезпеченні клітин моз- ку. Однак у нормі цього не відбувається. У процесі еволюції в органі- змі вищих тварин і людини сформувалися механізми зв'язування аміаку в місці його утворення, тут же відбувається знешкодження і подальше виведення з організму.
Аміак, який утворюється в різних тканинах і органах, у місці йо- го вивільнення зв'язується з моноамінодикарбоновими кислотами, переважно глутаміновою, у меншій мірі аспарагіновою, утворюючи аміди – глутамін та аспарагін.
Аміак може також зв'язуватися з білками, що містять ці аміно- кислоти. Фіксуючись у формі амідів, аміак тимчасово знешкоджуєть- ся, переноситься кров'ю до місця свого остаточного знешкодження – у печінку. Особливу роль у переносі аміаку до печінки в нетоксичній формі відіграє амінокислота аланін. Велике значення цей механізм має для працюючих м'язів. Послідовність реакцій при цьому така: утворений аміак перетворюється в аміногрупу глутамату під час ре- акції, яка каталізується глутаматдегідрогеназою. Глутамат перено-
342
сить потім свою α-аміногрупу на піровиноградну кислоту (піруват), яка завжди міститься в достатній кількості, оскільки це продукт глі- колізу, що протікає в м'язах. Реакція переносу каталізується аланін- амінотрансферазою (АЛТ). Аланін (нейтральна амінокислота, яка не несе сумарного заряду при значеннях рН, близьких до 7) виходить із клітин у кров і доставляється кров'ю до печінки. Тут він під дією аланін-амінотрансферази передає свою аміногрупу α-кетоглутарату, внаслідок чого утворюється глутамінова кислота. Остання в реакції, що каталізується глутаматдегідрогеназою, дезамінується з утворен- ням α-кетоглутарату й аміаку, який у печінці перетворюється на се- човину – кінцевий продукт азотистого обміну.
Цікаво, що використання саме аланіну для переносу аміаку з ін- тенсивно працюючих скелетних м'язів до печінки може служити на- очним прикладом принципу економії, який діє в живих організмах. Під час важкої роботи в скелетних м'язах при скороченні утворюєть- ся не лише аміак, але й велика кількість піровиноградної кислоти – пірувату, який є продуктом гліколізу. Ці обидва продукти мають надходити в печінку, де аміак перетворюється в сечовину і в такій формі виводиться з організму, а з пірувату ресинтезується глюкоза, яка через кров повертається до м'язів.
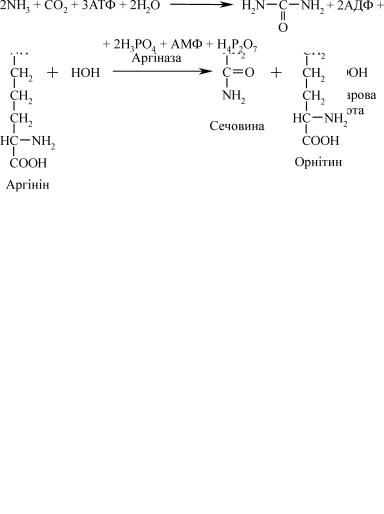
Отже, утворений під час дезамінування амінокислот аміак до- ставляється в печінку, де перетворюється в нетоксичний продукт – сечовину. Це перетворення відбувається у формі циклу, який був на-
званий циклом сечовини (орнітиновий цикл). Його відкрив Ганс Кребс разом зі студентом-медиком Куртом Хенселайтом у 1932 р. Вони встановили, що синтез сечовини посилюється, якщо до зрізів печінки добавити диаміномонокарбонові кислоти – аргінін та орні- тин, причому при введенні орнітину, міченого дейтерієм, синтезу- ється аргінін, який містить цей дейтерій. Це є прямим доказом утворення аргініну із орнітину. Якщо добавити до зрізів печінки солі вугільної кислоти, мічених за вуглецем, останній виявиться у моле- кулі сечовини. Це доводить, що для синтезу сечовини використову- ється вуглекислий газ. Останній є нормальним продуктом обміну і вивільняється в органах і тканинах при декарбоксилюванні α- кетокислот і амінокислот. Окрім того в печінці виявлено фермент аргіназу, який розщеплює аргінін на сечовину й орнітин. Нарешті, було встановлено, що сечовина синтезується в аеробних умовах, коли в найбільших кількостях утворюється АТФ. Усі ці дані дозволили описати наступний циклічний процес, що складається з двох основ- них етапів: синтезу аргініну і гідролізу аргініну на сечовину й орні- тин.
На першому етапі з аміаку, вуглекислого газу і фосфорної кис- лоти під впливом ферменту карбамоїлфосфатсинтетази синтезуєть- ся карбамоїлфосфорна кислота (карбамоїлфосфат). Для синтезу цієї сполуки використовується енергія двох молекул АТФ. Для реакції також є необхідною N-ацетилглутамінова кислота, яка, очевидно, ві- діграє роль активатора.
343

Аміак бере участь у реакції у вигляді транспортних форм, голо- вним чином у складі глутаміну.
Потім відбувається конденсація карбамоїлфосфорної кислоти з орнітином, у результаті якої синтезується цитрулін і звільняється неорганічна фосфорна кислота. Цей процес каталізується фермен-
том орнітинкарбамоїлтрансферазою
Синтез цитруліну забезпечується за рахунок енергії, акумульова- ної у карбамоїлфосфатному зв'язку.
Далі цитрулін реагує з аспарагіновою кислотою. При цьому утворюється проміжна сполука – аргініноянтарна кислота (аргіні- носукцинат). Реакція каталізується ферментом аргініносукцинат- синтетазою. У цьому процесі використовується енергія ще однієї молекули АТФ.
344
Далі аргініноянтарна кислота під впливом ферменту аргініносук- цинатліази розщеплюється на аргінін та фумарову кислоту
Утворенням аргінінузавершується першийетап синтезу сечовини. Другий етап полягає в розщепленні аргініну під впливом аргіна-
зи на сечовину та орнітин.
Розглянутий вище процес утворення сечовини можна подати схе- матично у вигляді послідовності NH3 → карбамоїлфосфат → цитрулін → аргінін → сечовина, а сумарне рівняння реакціїмає такий вигляд:
Орнітин може знову вступати в реакцію з карбамоїлфосфатом, і весь процес багаторазово повторюється. Фумарова кислота гідрату- ється, перетворюючись на яблучну, а остання внаслідок дегідрування – у щавлевооцтову кислоту (ЩОК). Остання може приєднувати аміак і перетворюватися в аспарагінову або зазнавати декарбоксилювання і перетворюватися в піровиноградну кислоту, а потім в ацетилкоензим А, який використовується в різних реакціях біосинтезу або окислюєть- ся до CO2 і H2O у циклі трикарбонових кислот (Кребса).
345
Внаслідок білкового обміну в людини за добу виділяється в сере- дньому 30 г сечовини, що складає приблизно 90% всього азоту сечі.
Близько 6% всього азоту сечі виділяється з організму у вигляді солей амонію, утворених у нирках; їх утворення та екскреція забезпе- чують видалення надлишкових протонів, тобто це вже є функцією з ре- гуляції кислотно-основного балансу.
Кількість сечовини може зменшуватися у разі підвищення кис- лотності в організмі, що спостерігається під час деяких захворювань, наприклад, цукрового діабету. При цьому аміак буде використовува- тися для нейтралізації кислот і в більшій кількості виділятися у ви- гляді солей амонію.
У разі позитивного азотистого балансу екскреція сечовини зме- ншується. Якщо відбувається збільшення екскреції азоту внаслідок підвищення розпаду білків організму, підвищення азоту сечі відбува- ється за рахунок сечовини.
Таким чином, утворення і екскреція сечовини є тим регулюючим механізмом, за допомогою якого підтримується азотиста рівновага.
Деякі дані вказують на те, що сечовина не тільки виступає «шла- ком обміну», але й, можливо, відіграє певну позитивну роль в органі- змі людини. Припускають, що вона, утворюючи комплекси з білками (сполучаючись з С-кінцевими амінокислотами поліпептидних лан- цюгів водневими та електростатичними зв'язками), змінює конфор- мацію багатьох білків, підвищуючи тим самим їх стійкість проти дії протеїназ, і сприяє стабілізації молекулярної структури білка.
Амінокислоти як лікарські препарати
У клінічній медицині застосовуються препарати гідролізати біл- ків, окремі амінокислоти та їх похідні. Як засоби для парентерально- го живлення використовуються препарати, які являють собою про- дукти кислотного або ферментативного гідролізу білків тканин ор- ганів великої рогатої худоби. Ці препарати забезпечують білкове живлення організму та позитивний азотистий баланс у хворих після значної втрати білків, наприклад, при опіках, а також у хворих після операцій на органах шлунково-кишкового тракту. Такими препара- тами є гідролізин, що являє собою гідролізат білків з домішком глюкози, гідролізат казеїну, амінопептид, амінокровін-гідролізат бі- лків крові людини з домішком глюкози, фібриносол – продукт пов- ного гідролізу фібрину, амікан, поліамін та ін.
Як плазмозамінюючі і антигеморагічні засоби застосовуються, наприклад, желатиноль – колоїдний розчин частково гідролізованого харчового желатину, а також такі препарати, як протамін сульфат, альбумін, який одержують із плацентарної сироватки або плазми донорської крові людини, антилімфолін-Кр.
Як фармпрепарати застостовуються такі амінокислоти та їх похі- дні: глутамінова кислота як ефективний засіб, що стимулює окислю- вальні процеси в тканині мозку, а також зв’язує утворений аміак; пре- парати ГАМК (γ-аміномасляна кислота), що є продуктом декарбокси-
346
лювання глутамінової кислоти і виконує роль нейромедіатора центральної нервової системи (аміналон, пантогам).
Гідрохлорид гістидину застосовується для лікування гепатитів, виразкової хвороби шлунка та дванадцятипалої кишки. Широко ви- користовуються такі препарати як панангін – калієва та магнієва сіль аспарагінової кислоти, метіонін, який є донором метильних груп і бере участь у синтезі адреналіну, ряду ферментів, а також застосову- ється для лікування атеросклерозу завдяки своїй ліпотропній дії.
Останніми роками був отриманий лікарський препарат на осно- ві амінокислоти гліцину, який сприяє синтезу лецитину, запобігаючи таким чином утворенню стеросклеротичних бляшок.
Широко застосовуються препарати, до складу яких входять цис- теїн і тирозин: віцеїн, вітайодурол, церебролізин, тиреоїдин, ангіо- тензинамід та ін.
347
ГЛАВА 10. МЕТАБОЛІЗМ СКЛАДНИХ БІЛКІВ
Обмін складних білків відрізняється від обміну простих білків тими перетвореннями, які властиві простетичній групі.
Розглянемо особливості обміну двох важливих груп складних білків – хромопротеїнів і нуклеопротеїнів.
Обмін гемпротеїнів
Проблеми синтезу й розпаду хромопротеїнів привертають увагу як дослідників, так і практичних працівників медичних закладів. Особ- ливо цікаві сучасні уявлення про синтез і розпад залізопорфіринів, зо- крема гемоглобіну, найбільш вивченого гемпротеїну.
В організмі людини міститься близько 3,3–4,0 г заліза. На час- тку гемоглобіну крові з цієї кількості припадає 60–70%, на частку міоглобіну – 3,5%, феритину – 20%, трансферину – близько 0,18%, функціонального заліза тканин – до 5%. Вміст заліза в організмі регулюється, головним чином, інтенсивністю всмоктування в ки- шечнику заліза, яке надходить із їжею. Крім того, джерелом заліза для синтезу є залізо, яке вивільняється при постійному розпаді еритроцитів у клітинах печінки й селезінки. Тривалість життя ери- троцитів становить 120 днів. За фізіологічних умов в організмі до- рослої людини руйнується 1–2 108 еритроцитів за годину і таким чином поновлюється приблизно 6 г гемоглобіну. Головними орга- нами, в яких відбувається руйнування еритроцитів і розпад гемо- глобіну, є печінка, селезінка і кістковий мозок.
Гемоглобін, який вивільняється з еритроцитів, у крові зв'язується з гаптоглобіном (α2-глобулін плазми) і в такому вигляді потрапляє в ретикулоендотеліальні клітини, головним чином, селезінки. Гемо- глобін окислюється в метгемоглобін (Fe3+), а потім зазнає розпаду. Гаптоглобін відщеплюється й переходить знову в кров.
Розпад гемоглобіну починається з розриву α-метиленового зв’язку між I і II пірольними кільцями порфірину. Цей процес каталі- зується гемоксигеназою, яка знаходиться в мікросомальній фракції ретикулоендотеліальних клітин. У результаті утворюється зелений пігмент вердоглобін (холеглобін).
Подальший розпад вердоглобіну, найімовірніше, відбувається спо- нтанно з вивільненням заліза, білка-глобіну й утворенням одного з жовчних пігментів– білівердину. Залізо сполучається з білком-перенос- ником трансферином і доставляється з кров'ю в кістковий мозок. Гло- бін гідролізується катепсинами селезінки доамінокислот.
Утворений білівердин ферментативним шляхом (білівердинре- дуктаза) відновлюється вбілірубін– пігмент червоно-жовтогокольору.
За розрахунками, із одного граму гемоглобіну утворюється 25 мг білірубіну. Добове утворення білірубіну в дорослої людини стано- вить приблизно 250–350 мг.
Білірубін – погано розчинна у воді сполука, токсична. Тому, надходячи в кров, він зв'язується з альбумінами плазми і транспор- тується в печінку.
348
Метаболізм білірубіну в печінці складається з трьох процесів: 1) поглинання білірубіну паренхіматозними клітинами печінки; 2) кон'югація білірубіну в гладкому ендоплазматичному ретикулумі і 3) секреція білірубіну з ендоплазматичного ретикулуму в жовч.
Кон'югація білірубіну здійснюється з УДФ-глюкуроновою кислотою й каталізується ферментом УДФ-глюкуронілтрансфе-
разою. Утворюються білірубінмоноглюкуроніди (20%) і білірубін-
диглюкуроніди (80%). Це добре розчинні у воді сполуки, які в по- дальшому секретуються в жовч. За фізіологічних умов практично весь білірубін, що секретується в жовч (понад 97%), перебуває в кон’югованій формі і лише незначна частина його може дифун- дувати в кровоносні капіляри. Тому в плазмі крові присутні дві форми білірубіну: некон’югований (він же непрямий, або вільний) і кон’югований (він же прямий, або зв'язаний). На частку першого припадає близько 75% загального білірубіну плазми крові, на ча- стку другого – близько 25%.
Білірубінглюкуроніди виділяються із жовчю в кишечник, де відбувається заключна фаза розпаду гемпротеїнів.
Спочатку глюкуронова кислота відщеплюється від комплексу з білірубіном. Утворений знову некон’югований білірубін у кишечни- ку зазнає багаторазового відновлення бактеріями або редуктазами слизової оболонки кишечника. У результаті цього процесу утворю-
ється мезобілірубін, потім мезобілірубіноген (уробіліноген). Після всмоктування невелика частина мезобілірубіногену надходить че- рез ворітну вену у печінку, де зазнає руйнування з утворенням мо- но- і дипірольних сполук. Незруйнований уробіліноген (мезобіліру- біноген) знову надходить із жовчю в кишечник. У товстому кишеч- нику мезобілірубіноген відновлюється анаеробними бактеріями до стеркобіліногену, котрий виділяється з фекаліями і швидко окислю- ється киснем повітря до стеркобіліну – жовтого пігменту, який ви- значає колір фекалій. Крім того, невелика частина стеркобіліногену після всмоктування крізь систему гемороїдальних вен потрапляє у ве- лике коло кровообігу, минаючи печінку, і в такому вигляді виво- диться нирками із сечею. Стеркобіліноген сечі, як і у фекаліях, оки- слюється в стеркобілін, частково визначаючи нормальний солом'я- но-жовтий колір сечі. Однак називати його уробіліногеном було б не зовсім точно, бо за будовою уробіліноген і стеркобіліноген від- різняються. Можливо, подібність їх забарвлення призвела до по- милкових висновків.
Добовий вміст стеркобіліну в сечі складає близько 4 мг, і саме стеркобілін є нормальною органічною складовою частиною сечі. За добу людина з калом виділяє близько 300 мг стеркобіліну.
Синтез гему. Вихідними матеріалами для синтезу гему є «ак- тивний сукцинат» – сукциніл-КоА, який утворюється в мітохонд- ріях у реакціях циклу лимонної кислоти, і амінокислота гліцин. Необхідною є також «активація» гліцину пірідоксальфосфатом.
349
Продуктом реакції конденсації гліцину із сукциніл-КоА є α-аміно- β-кетоадипінова кислота з подальшим утворенням δ-аміноле- вуленової кислоти. Ця реакція каталізується δ-амінолевулинат- синтазою (АЛК-синтаза). Відбувається цей процес у мітохондріях. У цитозолі фермент АЛК-дегідратаза каталізує конденсацію двох молекул δ-амінолевуленової кислоти з утворенням двох молекул води й однієї молекули порфобіліногену.
Утворення тетрапіролу (порфірину) відбувається шляхом кон- денсації чотирьох молекул порфобіліногену.
Завершальною стадією синтезу гему є включення в протопорфірин двовалентного заліза (Fe2+). Ця реакція каталізується мітохондріаль-
нимферментом гем-синтазоюабо феро-хелатазою.
Порушення обміну гему
Як бачимо, синтез гему – багатостадійний лінійний процес, кот- рий має різні відгалуження. Порушення окремої ланки в цьому про- цесі може призвести до накопичення в організмі проміжних продук- тів синтезу гему – порфіринів та їх похідних. Джерелом порфіринів може бути також порушення синтезу інших гемпротеїнів – цитохро- мів, пероксидаз та інших продуктів розпаду гемоглобіну в кишково- му тракті, які всмоктуються і потрапляють до кровообігу.
Порфірії – дефекти метаболізму порфіринів, які супроводжують- ся накопиченням і виведенням із сечею або фекаліями порфіринів та їх похідних.
Деякі форми порфірій є успадкованими, інші – набутими. Було запропоновано декілька різних класифікацій порфірій. Успадковані форми зручно поділити на три великі групи – еритропоетичні, печін- кові й форми, за яких порушення метаболізму спостерігаються одно- часно в еритропоетичній і печінковій тканинах.
Для кожного типу порфірій характерним є певний набір порфі- ринів та їх попередників, які екскретуються із сечею.
Окрім того, під впливом різних факторів в організмі може пору- шуватися утворення, перетворення й виведення білірубіну.
У тих випадках, коли вміст білірубіну в крові перевищує 17,1 мкмоль/л, визначається стан гіпербілірубінемії. Гіпербіліру- бінемія може бути наслідком утворення білірубіну в більшій кіль- кості, ніж та, яку може екскретувати печінка, або ж наслідком по- шкоджень клітин печінки, при яких порушується екскреція біліру- біну. Окрім пошкоджень самої печінки до розвитку гіпербілірубі- немії призводить закупорка жовчовивідних протоків печінки, що перешкоджає виділенню білірубіну. В усіх цих ситуаціях білірубін накопичується в крові і в разі досягнення певних концентрацій дифундує в тканини, забарвлюючи їх у жовтий колір. Цей стан на-
зивають жовтяницею.
Розрізняють декілька видів жовтяниць: гемолітична, паренхіма- тозна й обтураційна (механічна).
350
