
- •Що таке еквівалентна електрична провідність?
- •Охарактеризуйте особливості коагуляції золів сумішами електролітів.
- •Що таке діаграма плавкості?
- •Що таке кінетична стійкість дисперсної системи?
- •Які властивості розчинів називають колігативними?
- •Що таке активні молекули?
- •Як можна виміряти електродний потенціал?
- •В чому полягає сутність методів хроматографічного аналізу?
- •Що таке буферна система?
- •Що таке гальванічний елемент?
- •Як орієнтуються молекули поверхнево-активної речовини в адсорбційному шарі?
- •В чому полягає суть методу потенціометричного титрування?
- •Сформулюйте закон Кольрауша, наведіть математичний вираз закону.
- •В чому полягає спільність та відмінність у властивостях розчинів високомолекулярних сполук та істинних розчинів; розчинів вмс та колоїдних розчинів?
- •Дайте визначення понять: фаза, компонент, ступінь свободи системи.
- •В чому полягає сутність методу кондуктометричного титрування?
-
Що таке буферна система?
буферна система – це суміш сполук, які відіграють роль донора і акцептора протонів. Вивільнення та поглинання протонів із середовища сприяє стабілізації нормальних значень рН рідин організму (крові і тканин) в разі надходження кислот або лугів.
Які типи буферних систем Вам відомі?
Буферні системи кислотного типу
Кислотні буферні системи являють собою суміш слабкої кислоти HB (донор протона) і її солі B- (акцептор протона). Вони, як правило, мають кисле середовище (pH <7).
Буферні системи основного типу
Основні буферні системи являють собою суміш слабкої основи (акцептор протона) і його солі (донор протона). Вони, як правило, мають лужне середовище (pH> 7).
Буферні системи амфолітного типу
Амфолітние буферні системи складаються з суміші двох солей або з солі слабкої кислоти і слабкої основи, наприклад CH3COONH4, в якому CH3COO- проявляє слабкі основні властивості – акцептор протона, а NH4 + – слабка кислота – донор протона.
Наведіть приклади, вкажіть склад систем.
Буферні системи кислотного типу
Кислотні буферні системи являють собою суміш слабкої кислоти HB (донор протона) і її солі B- (акцептор протона). Вони, як правило, мають кисле середовище (pH <7).
Гідрокарбонатна буферна система (зона буферного дії pH 5,4-7,4) – суміш слабкої вугільної кислоти H2CO3 (донор протона) і її солі HCO3- (акцептор протона).
Гідрофосфатная буферна система (зона буферного дії pH 6,2-8,2) – суміш слабкої кислоти H2PO4- (донор протона) і її солі HPO42- (акцептор протона).
Гемоглобіновая буферна система представлена двома слабкими кислотами (донори протонів) – гемоглобіном HHb і оксігемоглобі-ном HHbO2 і сполученими їм слабкими підставами (акцепторами протонів) – відповідно гемоглобінат – Hb- і оксігемоглобінат-аніонами HbO2-.
Буферні системи основного типу
Основні буферні системи являють собою суміш слабкої основи (акцептор протона) і його солі (донор протона). Вони, як правило, мають лужне середовище (pH> 7).
Аміачна буферна система: суміш слабкої основи NH3 • H2O (акцептор протона) і його солі – сильного електроліту NH4 + (донор протона). Зона буферного дії при pH 8,2-10,2.
Буферні системи амфолітного типу
Амфолітние буферні системи складаються з суміші двох солей або з солі слабкої кислоти і слабкої основи, наприклад CH3COONH4, в якому CH3COO- проявляє слабкі основні властивості – акцептор протона, а NH4 + – слабка кислота – донор протона. Біологічно значущою буферною системою амфолітние типу є білкова буферна система – (NH3 +) m-Prot- (CH3COO-) n.
Буферні системи можна розглядати як суміш слабкого і сіл’-ного електролітів, що мають однойменні іони (ефект загального іона). Наприклад, в ацетатному буферном розчині – ацетат-іони, а в гідрокарбонатно – карбонат-іони.
Від яких факторів залежить рН буферних систем?
Лужності чи кислотності середовища
Наведіть та проаналізуйте рівняння Гендерсона-Гассельбаха.
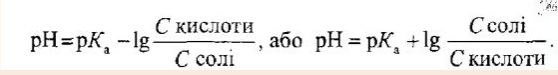
Дане рівняння (називають рівнянням Гендерсона- Гассельбаха.Його використовують для обчислення рН різних буферних розчинів.
Рівняння Гендерсона-Гассельбахадозволяє сформулювати ряд важливих висновків:
1. рН буферних розчинів залежить від негативної дії логарифма константи дисоціації слабкої кислоти рКа або основи рКВ і від відношення концентрацій компонентів парикислота-основа,але практично не залежить від розбавлення розчину водою.
Слід зазначити, що сталість рН добре виконується при малих концентраціях буферних розчинів. При концентраціях компонентів вище 0,1
моль/л необхідно враховувати коефіцієнти активності іонів системи.
2. Значення рКа будь-якоїкислоти і рКВ будь-якогорозчину можна обчислити за вимірюваним рН розчину, якщо відомі молярні концентрації компонентів.
Крім того, рівняння Гендерсона-Гассельбахадозволяє розрахувати рН буферного розчину, якщо відомі значення рКа і молярні концентрації компонентів.
3. Рівняння Гендерсона-Гассельбахаможна використовувати і для того,
щоб дізнатися, в якому співвідношенні потрібно взяти компоненти буферної суміші, щоб приготувати розчин з заданим значенням рН.
Поясніть механізм дії фосфатного буферу.
Фосфатна буферна система
Вищезазначена буферна система складається з дигідрофос-фату (NаН2РО4) та гідрофосфату (Nа2НРО4) натрію. Перший з них має властивості слабкої кислоти та взаємодіє з лужними речовинами, які надходять у кров. Другий компонент має влас-тивості слабкого лугу та реагує з більш сильними кислотами. Ця буферна система здатна стримувати зміни рН в інтервалі 6,2 – 8,2, таким чином, може забезпечити значну частку буферної ємності крові. На жаль ємність цього буфера невелика у зв’язку з низьким вмістом фосфатів у крові.
