
- •Що таке еквівалентна електрична провідність?
- •Охарактеризуйте особливості коагуляції золів сумішами електролітів.
- •Що таке діаграма плавкості?
- •Що таке кінетична стійкість дисперсної системи?
- •Які властивості розчинів називають колігативними?
- •Що таке активні молекули?
- •Як можна виміряти електродний потенціал?
- •В чому полягає сутність методів хроматографічного аналізу?
- •Що таке буферна система?
- •Що таке гальванічний елемент?
- •Як орієнтуються молекули поверхнево-активної речовини в адсорбційному шарі?
- •В чому полягає суть методу потенціометричного титрування?
- •Сформулюйте закон Кольрауша, наведіть математичний вираз закону.
- •В чому полягає спільність та відмінність у властивостях розчинів високомолекулярних сполук та істинних розчинів; розчинів вмс та колоїдних розчинів?
- •Дайте визначення понять: фаза, компонент, ступінь свободи системи.
- •В чому полягає сутність методу кондуктометричного титрування?
-
Що таке активні молекули?
Активні молекули – це такі молекули, які внаслідок невпорядкованих зіткнень і перерозподілу енергії в системі набувають певного надлишку енергії та стають здатними до хімічної взаємодії.
Що таке енергія активації?
Енергія переходу речовини в стан активованого комплексу, яка дорівнює різниці між середньою енергією молекул реакційної системи і енергією, необхідною для перебігу хімічної реакції, називається енергія активації.
В чому полягає графічний метод визначення енергії активації?
Графический метод определения энергии активации. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
![]()
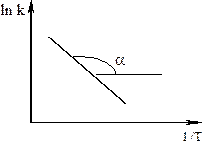
Здесь
tg a =![]()
Які вихідні експериментальні дані необхідні для цього?
Необходимо иметь несколько значений k при разных T
Білет 4
-
Як можна виміряти електродний потенціал?
Електродний потенціал — різниця електричних потенціалів між електродом та електролітом, в контакті з яким він знаходиться (найчастіше між металом і розчином електроліту).
Якщо пластинку будь-якого металу, наприклад, цинку ,занурити у воду, то іони цинку, що утворюють кристалічну решітку металу, під дією полярних молекул води гідратуються, їх зв'язок їз решіткою послаблюється і деяка кількість, відриваючись від металу, перейде у воду, а на металі залишиться еквівалентна кількість електронів:
Zn = Zn2+ + 2e-
Провідник (метал), занурений у розчин електроліту, називається електродом.
Різниця потенціалів (стрибок потенціалу), що виникає на межі поділу електрод — розчин, називається електродним потенціалом.
Величину електродного потенціалу можна розрахувати за рівнянням Нернста:
E=E0+(2.3RT/nF)lg a(x)
Для Т=298 К :
E=E0+(0.059/n)lg a(x)
Що таке електрод порівняння?
електрод з відомим значенням електродного потенціалу називають електродом порівняння.
Що таке електрод визначення?
Електрод, потенціал якого визачають, називають Електродом визначення.
Наведіть приклади електродів порівняння та електродів визначення, вкажіть переваги та недоліки роботи з тим чи іншим електродом.
Електрод порівняння (наприклад, електрод системи срібло - хлорид срібла або каломельний електрод) практично не пропускає струму, отже, його можна розглядати як точку з постійним потенціалом, щодо якої можна вимірювати анодний і катодний потенціали. Кожна з експериментально отриманих величин катодного і анодного потенціалів включає частину омічного падіння потенціалу (iR) між двома робочими електродами. щоб звести цю величину до мінімуму, користуються капілярним сольовим містком (капіляр Луггіна), поміщаючи його отвір в безпосередній близькості до поверхні електрода, або працюють в області струму низької щільності.
Як можна потенціометричним методом визначити рН розчину?
ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ рН — електрометричний метод визначення активності іонів гідрогену у вигляді водневого показника рН (див. Водневий показник), що базується на вимірюванні різниці потенціалів, які виникають на межі зовнішньої поверхні рН-селективної мембрани скляного електрода і випробовуваним розчином, з одного боку, та внутрішньої сторони мембрани і стандартним розчином кислоти — з іншого (див. Скляний рН-електрод) за умов нульового значення струму в колі.
На практиці П.в. рН здійснюють шляхом вимірювання різниці потенціалів кола з перенесенням іонів, складеного зі скляного рН-електрода, оборотного до активності іонів гідрогену, та хлоридосрібного електрода порівняння, насиченого хлоридом калію:
(–) Ag, AgCl | KCl (нас.) Н+ || скляна мембрана || HCl (0,1 М) | AgCl, Ag (+)
електрод порівняння скляний електрод
Різниця потенціалів скляного та хлоридосрібного електродів кола при 298 К:
Е=φcкл–φAg,AgCl|Cl-=φо–0,059 рН–φAg,AgCl|Cl-.
Оскільки потенціал хлоридосрібного електрода та стандартний потенціал скляного електрода (внутрішній електрод порівняння) величини постійні, можна записати: Е=const–0,059 pH. Вимірювання різниці потенціалів електродної системи здійснюють компенсаційним методом за допомогою іономіра (див. Іономір (рН-метр)), який попередньо градуюють в одиницях рН за стандартними буферними розчинами з точно відомим значенням величини рН. За умов збереження постійного значення дифузійного потенціалу після заміни стандартного буферного розчину досліджуваним розчином значення інструментальної величини рН випробовуваного розчину пов’язане з рН стандартного буферного розчину (рНст) таким рівнянням:
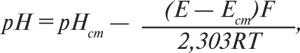
де Е — різниця потенціалів, яку спостерігають, у випробовуваному розчині, у вольтах; Ест — різниця потенціалів такої самої пари електродів у стандартному буферному розчині з відомим значенням рНст, у вольтах; T — абсолютна температура розчину, К; R — універсальна газова стала, дорівнює 8,314 Дж·град–1моль–1; F — число Фарадея, яке дорівнює 96485 Кл моль–1; n — кількість електронів, перенесених під час реакції, в розрахунку на 1 мол. м. еквівалента речовини. П.в. рН точніше за колориметричний, воно дає можливість здійснювати вимірювання показника активності іонів гідрогену з похибкою ±0,02–0,05 рН в інтервалі від 1 до 12 залежно від експлуатаційних характеристик скляного електрода та іономіра (рН-метра). П.в. рН є фармакопейним методом, його застосовують при контролі якості ЛП (див. Потенціометрія), для дослідження процесів у клітинах і тканинах живого організму. П.в. рН має важливе клінічне значення (рН сечі може мати значення при диференційній діагностиці алкалозу та ацидозу різної етіології).
