
Химия шпор
.pdf
1. Алкиныацети( углеводороды) н вые |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Алк–этоуглев,модлекулахортордых |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
дваатомауглернахвсостоянииодаятсяsp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
||||||||||
гибрисвязаныдизациидругомтройной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
связью. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Общая формула: CnH2n–2,гдеn > 2. |
|
|
|
|
|
|
|
|
|||||||||||||||||
Особенностиалкинов: длина1)связалкин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ах |
||||||||||
рав0,1н;мкаждый20)атомуглеродав |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
состоянииsp |
-гибрисвязандвумяизации |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
другиато; м3)ожетпрамиещесоединять |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
дваатома. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Существудваипазомлкинов:етрии1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
изомерия положетройнойия |
|
|
|
|
|
связи; 2) |
|
|
|||||||||||||||||
изомерияцепи |
|
|
|
. |
|
|
|
|
|
гическогоряда |
|
|
– этин |
||||||||||||
|
Первыедвачленагомоло |
|
|
|
|
|
|
|
|
||||||||||||||||
ипропин –изомеровнеимеют. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Существуетдватипаноменклатуры |
|
|
|
|
|
|
: |
|
1) |
||||||||||||||||
международнаяноменклатура:этин;пропин; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2)рациноменклатуральн: цетилен; я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
метиацетилен. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Физические |
|
свойстваалкинов |
|
|
|
|
: |
|
|
1) |
|||||||||||||||
С2Н2С…4Н6 |
|
|
|
– газы; С5Н82)С…15Н28 |
|
|
|
|
|
|
|
|
– |
||||||||||||
жидкости; С3)16Н30… |
|
|
|
|
– твердыевещества; 4) |
|
|
|
|
|
|
||||||||||||||
плохорастворимыводе. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Химические |
|
св-ваалкинов |
|
|
|
:большая |
|
|
|||||||||||||||||
реакционнойспособность |
|
|
|
|
|
,характеризуются |
|
|
|||||||||||||||||
реакциейприсоединения,тройнаясвязь |
|
|
|
|
|
|
Применение |
|
|
||||||||||||||||
содπержитве |
|
|
|
|
|
|
-связи. |
и |
|||||||||||||||||
получениеацетил на |
|
|
- |
|
|
|
иболеезначимых |
|
|
||||||||||||||||
Ацетилен–этоодинизна |
|
|
|
|
|
|
|
|
|||||||||||||||||
углеводорстройнсвязью.Онявляетсяойдов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
первымпредставителемрядаацетилена, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
такжебесцвегаз,которыйпрактическимным |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
нерастворимводе.Молекуацетилена |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
имеетнадваатомаводородаменьше,чем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
этилене,иприэтомхарактерно |
|
|
|
|
|
образование |
|||||||||||||||||||
третьейсвязимеждуатомамиуглерода. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Примаце: тиленанение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1) можетприменяться |
|
|
|
вкачестве |
горючего при |
||||||||||||||||||||
|
газовойсваркеирезке |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
металлов;2) |
|
используется |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
для синтеза различорганическихых |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
соединений;3) |
|
в |
результатеприсоединения |
|
|
|
|
|
|
||||||||||||||||
хлоракацети |
|
|
|
|
лену |
|
получаютрастворитель |
|
|
|
|
– |
|
||||||||||||
|
1,1,2,2-тетрахлорэтан. 4) |
|
|
|
|
вбольших |
|
|
|||||||||||||||||
количествах ацетиленидетнапроизводство |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
хлорэтена,илив нилхл,спомощьюрида |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
полимеризациикот роголучается |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
поливинилхлорид. 6) изацетиленаполучаются |
|
|
|
|
|
|
|||||||||||||||||||
идругиеполим,котонеобхрые |
|
|
|
|
|
|
|
|
|
|
|
|
одимыв |
|
|
||||||||||
производствепластмасс,каучуков |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
синтетическихволокон. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Получениеацетил: на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
влабораторияхпромышленацетилености |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
чащевсегополучается |
|
|
|
|
|
|
карбиднымспособом |
|
|
|
|
. |
|||||||||||||
Есликусочкикарбкальцияпоместитьдав |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
сосудвоилиеслиойводудобавлятьк |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
карбидукальц,начсильноенается |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
выделениеацетил:СаС2 на |
|
|
|
|
|
|
|
+НОН2→С22 |
|
|
|
|
+ |
||||||||||||
Са(ОН)2Состо. пронымышленности |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
полимематериаловкарбидныйныхспособ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
являетсямалоэффективным.Онсвязан |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
большимизатратамиэлектроэнергиина |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
получениекарбидакальция. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Особенностикарбидакальция:) |
|
|
|
|
|
|
|
карбид |
|||||||||||||||||
кальцияполучаютвэлектропечах; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
б) получпривзаимодействииетсяизвести |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
с;в) |
получаетсяпритемпературе2000 |
|
|
|
|
|
|
°C:СаО |
|
|
|||||||||||||||
+С→СаС32 |
|
|
|
|
+СО;2) |
|
применяетсяспособ |
|
|
||||||||||||||||
полученияацетиизбодоступноголеена |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
химического сырья – метана. |
|
|
|
|
|
|
. |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2. |
Аллотнеорганическихвеществопия |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
Углерод.Кис |
|
|
|
-д. Аллотропия - этоявление, |
|
|
|||||||||||||||||
прикотородинэлембразуетнесколькоент |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
простыхвеществ,которназываютсяе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
аллотропнымимодификациямиэтого |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
элемента.Причинааллотропии |
|
|
|
|
|
|
|
|
-разноечисло |
|
|
||||||||||||||
атомовмолекуле, |
|
|
|
какукислородаО2озона |
|
|
|
|
|
|
|
|
|||||||||||||
О3Или.разноестроениекристаллической |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
решетки, уалмазаграф.Иутогоита |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
другогоонаатомная, упаковканихатомов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
углеопрегдибридизациейоеляется.В |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
карбинефуллерене,м атомамиждууглерода |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
существуютдв |
|
тройныеи связи.Всеэто |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
сказываетсянафизическиххимических |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
свойствахаллотропов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Данныйнеметобрдвапросллзуетых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
вещества: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
газкислородприобычных( условиях), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
формулакоторогоО2;газообразныйозон, |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
эмпирическотраженисоставакоторогое |
|
|
|
|
|
|
|
|
|
|
|
|
О3. |
||||||||||||
Очевидно,чтоздесьсамглпричинавная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
существованиямодификаций |
|
|
|
|
|
|
|
|
- |
|
состав |
||||||||||||||
моле.Обычныйкулыислород |
|
|
|
|
|
|
- |
основажизни |
|
|
|||||||||||||||
всехживыхсуществ.Онявляетсяактивным |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
участникгазообм,истэнергиичникома |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
длявсехпроцессовжизнедеятельности.В |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
химическомотношении |
- |
окисл,притель |
|
|
|||||||||||||||||||||
помощикоторогоосуществляетсямножество |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
реакций. |
Озон жеобразуетсявприлироде |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
специальныхлабораторныхустановках озонаторахизкислородавоздухпод действиемсильногоразрядаэлектричества.В
естественныхусловиях |
|
|
|
|
|
- это молния.Внизких |
|
|
Внутримолекулярнаянейтрализация |
|
|
|
|
|
|
|
|
|
|
|
|
|
→ |
|
Физичесвойства: кие |
|
|
|
|
1)бензол |
– |
||||||||||||||||||||||||||||||||||||||||
рассеянныхконцентрацияхимеетприятный |
|
|
|
|
|
|
|
|
|
|
|
|
образуетсябиполярныйцвиттер |
|
|
|
|
|
|
|
|
|
-ион: |
|
|
|
|
|
|
легкокипящая,бесцве,нерастнаяворимая |
|
|
|
|
|
|
в |
||||||||||||||||||||||||||||||||||
запах.Являочсильныменьтсяокислителем, |
|
|
|
|
|
|
|
|
|
|
|
|
Водныерастворы |
|
|
|
электропроводны.Эти |
|
|
|
водежидкость; онимеет2)своеобразный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
отбелива,химичактив. елскиенм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
свойсбъясняются,емчтовамолекулы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
запах; 3) приохлаждениибензол |
|
|
|
|
|
|
|
легко |
||||||||||||||||||||||||||||
Углеобразуетод |
|
|
|
|
|
|
|
5аллотропных |
|
|
аминокисуществуютвидевнутреннихлот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
застываетбелуюкристма; ллическуюссу4) |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
модификаций: |
кубический |
|
|
|
алмаз, |
|
|
солей,котообразуютые |
|
|
|
|
|
|
|
сязасчпетреноса |
|
|
|
температураего |
|
|
|
плавления |
5 °C; это6) |
|
|
||||||||||||||||||||||||||||||||||||||||||||
гексалмазгональный, |
|
|
|
|
графит идвеформы |
|
|
проткарбоксилаонааминогруппе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ненасыщенное соединение:вмолекулеего |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
карбина . |
|
Гексагональныйалмаз |
|
|
найденв |
|
|
Водныерастворыаминокислотимеют |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
недвосатомовтаетемьводосоставарода. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
метеоритах |
иполученискусственноприочень |
|
|
|
|
|
|
|
нейтра,кисщелочнуюиьнуюсредув |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Применениебензола. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
высокомдавлеидлительномагревании. |
|
|
|
|
|
|
|
|
|
|
|
|
зависимостиотколичествафункциональных |
|
|
|
|
|
|
|
|
|
|
|
|
|
1. Бензолслужитисходнымвеществом |
|
|
|
|
|
|
|
|
|
|
|
|
для |
|||||||||||||||||||||||||||||||
Алмаз – самыйтвердыйизвсехприродных |
|
|
|
|
|
|
|
групп. |
Применение - 1) аминокислотышироко |
|
|
|
синтеза многихорганических |
|
соединений. |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
веществ – используютдлярезкистекладля |
|
|
|
|
|
|
|
|
|
распространенывприроде; |
|
|
|
|
|
|
|
|
2) молекулы |
|
2. Реакцией нитрования получают нитробензол |
||||||||||||||||||||||||||||||||||||||||||||||||||
бурениягорныхпород. |
|
|
|
|
|
|
|
|
Алмаз – прозрачное, |
|
|
аминокислот – эткирпичикиео,изкоторых |
|
|
|
|
|
|
|
|
|
|
C6H5NO2, |
|
хлорированием |
|
|
бензола |
– |
||||||||||||||||||||||||||||||||||||||||||
бесцветное,кристаллич |
|
|
|
|
|
|
|
ескоевещество, |
|
|
|
|
построенывсера |
|
|
|
|
стительныеживотные |
|
|
|
|
|
|
хлорбензол С6Н5Сiрастворит( )другиель |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
обладающеевысоксветопреломляемостьюй. |
|
|
|
|
|
|
|
белки; |
|
ами,необходимыеокислотыдля |
|
|
|
|
|
|
|
|
|
|
хлорпроизводные. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
Алмазыобразуютотдельныекристаллы, |
|
|
|
|
|
|
|
|
|
|
|
|
построенбелковорганизма,человекя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Бензол используется как исходныйпродукт |
|
|
||||||||||||||||||||||||||||||||||||
образующиекубическую |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
живполучаютвтныесоставебелковпищи; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
присинтезеле |
|
|
|
|
карственныхидушистых |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
гранецешеткунтрированную |
|
|
|
|
– |
одна |
|
|
3) аминокислоты прописываются присильном |
|
|
|
веществи |
т. |
д. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
половинаатомовкристалсположенав |
|
|
|
|
|
|
|
|
|
|
|
|
истощении,послетя |
|
|
|
|
|
желыхопераций; |
|
4) их |
|
4. Он |
|
применяется |
|
тавкачествеже |
|
|
||||||||||||||||||||||||||||||||||||||||||
вершинахцентрахгранейодногокуба, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
используют дляпитаниябольных; |
|
|
|
|
|
Реагируют |
|
растворителя икакдобавкамоторному |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
другая – ввершинах |
|
центрахгранейдругого |
|
|
|
|
скислотами - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
топливу вцеулучшенияяхегосвойств. |
|
|
|
|
|
|
|
|
|
8. В |
||||||||||||||||||||||||||||||||||
куба,смещенногоотносительноперв го |
|
|
|
|
|
|
|
|
|
|
|
|
H2N – CH2 – COOH + NaOH = [H3N – CH2 – |
|
сельскомхозяйствеиспользуется |
|
|
|
|
|
|
|
|
ядохимикаты |
|||||||||||||||||||||||||||||||||||||||||||||||
направленииегопространственной |
|
|
|
|
|
|
|
|
|
COOH- ]Cl - аминоуксуснаякислота |
|
|
|
|
|
|
|
|
|
|
дляборьбыснасекомыми. |
|
|
|
|
|
|
|
|
|
|
Строение |
|||||||||||||||||||||||||||||||||||||||
диагонали. |
|
sp3-гибридизация .Атомыобразует |
|
|
Реагируютсощелочами |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
гомологовбензола: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
трехмернуютетраэдрическуюсетку,гдеони |
|
|
|
|
|
|
|
|
|
|
|
|
H2N – CH2 – COOH + NaOH = H2N – CH3 – |
|
2) егомологирассматриваютсякак |
|
|
|
|
|
|
продукты |
|||||||||||||||||||||||||||||||||||||||||||||||||
связаныковалентнымисвязями. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COONa + H2O - натриеваясоглицинаь |
|
|
|
|
|
|
|
|
|
|
замещения |
одногоилинескольких |
|
|
|
|
|
|
|
атомов |
||||||||||||||||||||||||||||||||||||
Карбин полученсинтетически |
|
|
|
|
и |
формы |
|
|
Привз |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водорода вмолекулебенразличныеазо |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
аимодействиищелочам, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические |
||||||||||||||||||||||||||||||||||||||||||||||
каталитическимокислениемацетилена.Это |
|
|
|
|
|
|
|
|
|
аминокислотыреагипокаруютбоксильной |
|
|
|
|
|
|
|
|
|
|
|
|
|
углеворадикалы; ородные |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
твердые,черныевеществасостеклянным |
|
|
|
|
|
|
|
|
|
|
|
|
группе: |
|
nh2-ch2-cooh+naoh=nh2-ch2- |
|
|
|
|
|
|
свойствагомологовбензола: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
блеском.Принагребездоступавоздухаании |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
coona+h2o. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) при |
нитровании |
|
вжесткихусловиях |
|
|
|
|
|
|
|||||||||||||||||||||||||
переходятвграфи. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Привзаимодействиидругдругом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молбеинзолакутоСлу6Н5 ола |
|
|
|
|
|
|
|
|
|
-СН3 можно |
||||||||||||||||||||||||
Уголь – аморфныйуглерод |
|
|
|
– неупорядоченная |
|
|
аминокислообразуюпептиднуюы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ввеститри |
|
|
нитрогруппы; |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
структураграфита |
|
|
|
|
|
– |
получаетсяпри |
|
|
связь(существуетбелке): nh2 |
|
|
|
|
|
|
|
|
|
-ch2-cooh+nh2- |
|
2) толуолнитрируется |
|
|
нескольколегче, |
чем |
|||||||||||||||||||||||||||||||||||||||||||||
нагреванииуглеродосодсоединенийржащих |
|
|
|
|
|
. |
|
|
|
ch2-cooh=nh2-ch2-c(o)-nh-ch2-cooh |
|
|
|
|
|
|
; |
бензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
Впримеетсяродебольшие |
|
|
|
|
|
|
|
залежи угля. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3) приэтомобразуется2,4,6 |
|
|
|
|
-тринитротолуол – |
|||||||||||||||||||||||||||||
Угольимнеетсортовколько: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Привзаимссолянойкислотойдействии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
взрывчатоевещество,которназывается |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
1) кокс; |
2) костянойуголь; |
|
|
|
3) сажа. |
|
|
|
|
аминокреагируетпоаминогруппеслота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
толомилитротилом; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
3. |
Альдег,химстроеническое,свды |
|
|
|
|
|
|
|
|
-ва, |
|
|
образуетсоль: nh2 |
|
|
|
|
|
-ch2-cooh+hcl=[nh3-ch2- |
|
ФормулаC6H6. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
получипреми |
|
|
. Альдегиды– этоорганические |
|
|
|
cooh]cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. |
|
|
Белбиопкак |
|
|
|
|
олимеры.Свойства |
|
|
|||||||||||||||||||||||||||||||
вещества,молекулыкот держатх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. |
|
Анилин |
- |
представительаминов; |
|
|
|
|
|
|
|
|
|
биологические. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
карбонильнуюгруппу,котора |
|
|
|
|
|
|
|
ясвязанаодним |
|
|
|
|
химическоестроенисв |
|
|
|
|
|
|
|
|
-ва; |
|
́ |
|
|
|
Белки – этобиоп,состоящиелимерыиз |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Анилин— |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
атомомводородаиуглеводородным |
|
|
|
|
|
|
|
|
|
органическоесоединениеформулой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
остаткаминокислот,соединённыхв между |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
радикалХимиче. свальдегидовйствакие |
|
|
|
|
|
|
|
|
|
|
|
|
C6H5NH2,состоитизбе |
|
|
|
|
|
|
|
|
|
нзольногокольца,в |
|
|
|
|
|
|
собойпептиднымисвязями( |
|
|
|
|
-CO-NH-)Белки. |
||||||||||||||||||||||||||||||||||||
обуслоналичимолекулевихливаются |
|
|
|
|
|
|
|
|
|
|
|
|
котородинатводородам |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
входят всоставклетокитканейвсехживых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
карбонильнойгруппы.Особенностиреакции |
|
|
|
|
|
|
|
|
|
|
|
|
замещеннааминогруппу. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
организмов.Вмолбелковкулы |
|
|
|
|
|
|
|
|
входит20 |
|
|
|
||||||||||||||||||||||||||||
окисленияальдег:взаимсдодействуют |
|
|
|
|
|
|
|
|
|
Простейшароматамин. ческий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
остратковзличных |
|
аминокислот. |
|
Структура |
||||||||||||||||||||||||||||||||||||||||
аммиачнымраствооксидасе(I)ребраом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Структурнформул: ая |
|
|
|
|
NH2Врезультате:. 1) |
|
|
|
|
|
|
белка- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
гидроксмед(II)образованиемдом |
|
|
|
|
|
|
|
|
|
|
|
|
реакциизамещевкольцедляания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лина |
|
Обладаютнеисчерпаемымразнообразием |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
карбоновыхкислот. |
|
|
|
|
|
Особенности |
реакции |
|
|
протекаютлегче,чемдлябензола; 2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
структур. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
полимеризации |
альдегидов:1) |
|
|
линейная |
|
|
вступающийкольцозаместитель |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Первичнаяструктура |
|
|
|
|
|
|
|
|
– |
это |
||||||||||||||||||||||||||||||||||||
полимеризация; 2) |
|
|
|
|
|
|
|
|
циклическая |
|
|
направляетсяаминогруппой |
|
|
|
|
преимущественно |
|
последоватаминокислнзвве ьевостьтных |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
полимеризация. |
4) |
вкачествеокислителя |
|
|
|
|
вположения2,4,6. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
линейнойполипептиднойцепи. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
альдегидовможетбытьиспользовантакже |
|
|
|
|
|
|
|
|
|
|
|
|
Физичесвойства. кие |
|
|
|
|
|
|
|
Представляетсобой |
|
|
|
Вторичнаяструктура |
|
|
|
– |
эток нфигурация |
|
|
|||||||||||||||||||||||||||||||||||||||
гироксидмедиСu(ОН)2;еслиги3) |
|
|
|
|
|
|
|
|
|
|
|
дроксиду |
|
|
бесцветную |
маслянистую |
жидкость |
с |
|
белковоймолекулы,напомсп,ирнальющая |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
медипрраствортьбльдегидасмесь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
характерным запахом,немнтяжелеевоигоды |
|
|
|
|
|
|
котообраврезультатезуетсяскручивания |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
нагреть,наблюдаетсяобразованиежелтого |
|
|
|
|
|
|
|
|
|
|
|
|
плоховнейрастворим,хорошо |
|
|
|
|
|
|
|
|
|
растворяется в |
|
полипептидной цепизасчётводородных |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
осадкагидромедикотораясида(I), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
органическраст.Наво ителях |
|
|
|
|
|
|
|
|
|
|
|
здухе |
|
связеймеждугруппами: |
|
|
|
COиNH |
|
|
. |
|
|
|
|
|
||||||||||||||||||||||||||||||
превкрасныйращаетсяоксидмеди; 4) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
быстро |
окисляется |
иприобретаеткрасно |
|
|
|
- |
|
Треструктураичная |
|
|
– |
этопространственная |
||||||||||||||||||||||||||||||||||||||||||
гидроксидмедиокисля(II)альдв егидт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
буруюокраску. |
|
|
Ядовит |
|
|
|
|
|
|
|
|
|
|
|
|
|
конфигурация,принимаетзакрученнаяв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
ки,аслвамотусстанавливаетсядооксида |
|
|
|
|
|
|
|
|
|
Анилин легко реагируетсбромнойводойс |
|
|
|
|
|
|
|
|
|
|
спираль полипептидная цепь. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
меди(I) .Ресакцииммиачнымраствором |
|
|
|
|
|
|
|
|
|
образованиембелогонерастворимоговоде |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Четвеструктуратичная |
|
|
|
|
– |
этоп л имерные |
||||||||||||||||||||||||||||||||||||||
оксидасеребра(I)гидроксидоммеди(II) |
|
|
|
|
|
|
|
|
|
|
|
|
осадка2,4,6 |
|
|
-триброманилина: |
|
|
|
|
|
|
|
|
|
|
обраизнесколькихования |
|
|
|
|
|
|
|
|
макромолекул |
|||||||||||||||||||||||||||||||||||
могслудляобнжитьальдегидовружения. |
|
|
|
|
|
|
|
|
|
|
|
|
Анилинпрактическинереагируетводой; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
белка. |
Физичесвойствакие |
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Применениеаль. |
|
|
|
|
наибольшееприменение |
|
|
|
|
основсвойстванпроявляилинаые |
|
|
|
|
|
|
|
|
|
|
|
|
|
ютсяв |
|
|
|
Однибелки |
|
|
растворяются |
ввобразуя, де |
, |
|
|||||||||||||||||||||||||||||||||||||
имеетформальдегид.Особенности |
|
|
|
|
|
|
|
|
|
|
|
|
реакцияхссильнымиминеральными |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
коллоидные растворынапример( ,белокяйца); |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
примененияформальдегида:используется |
|
|
|
|
|
|
|
|
|
|
|
|
кислотами: |
Химичесвойствакие |
|
|
|
|
|
анилина- |
|
другие |
|
|
растворяютсяразбавленных |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
обычноввидеводногораствора |
|
|
|
|
|
|
|
|
|
– формалина; |
|
|
Являетсябо основаниемееабым,чем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
расолейтворах; |
|
|
|
|
|
|
третьи |
|
|
|
нерастворимы |
||||||||||||||||||||||||||||||
многиеспособыпримененияформальдегида |
|
|
|
|
|
|
|
|
|
алифатическиеамины,..электпаронная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(например,белкипокровн |
|
|
|
|
|
|
|
|
|
ыхтканей). |
|
|
||||||||||||||||||||||||||||||||
оснсвойствеованысвертыватьбелки; |
|
|
|
|
|
|
|
|
|
|
в |
|
|
азотачастичномещенавбензольноекольцо. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химичесвойствакие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
сельскомхозяйстве |
|
|
|
|
формалиннеоб |
|
|
ходимдля |
|
|
Анилин |
|
вступаетреакцию |
|
|
|
|
|
|
|
|
|
|
|
|
|
1. |
|
Денатурация – |
|
разрушениевторичной, |
|
|
||||||||||||||||||||||||||||||||||||||
протравливаниясемян, |
|
|
|
|
|
он |
применяетсяв |
|
|
сильными кислотами,образуясоли |
|
|
|
|
|
|
|
|
|
|
третичндействиемструктурыбелкапод |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
кожевеннпроизводстве; м |
|
|
|
|
|
|
|
|
|
формалин |
|
|
фениламмония,которые |
|
|
|
|
|
растворимыводе |
|
|
,но |
|
различныхфакторов:темп,дейсратвиеура |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
оказывает дубящдействиенакожилки, |
|
|
|
|
|
|
|
|
|
нераствнепорганическихлярныхримы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислот,солейтяжёлыхметаллов,спи.д.ртов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
делаетихболтве,негниющимирдыми; |
|
|
|
|
|
|
|
|
|
растворителях.Основсвойстваанилина:ые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Качественныереакциинабелки |
|
|
|
|
|
|
|
|
: |
|
|
|
|
||||||||||||||||||||||||||||||
формалинприметакжедлясохраненияется |
|
|
|
|
|
|
|
|
|
|
|
|
а) |
ароматический |
амин |
|
– |
анимеетлин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а)Пригорбелкании |
|
|
|
|
|
|
– запах палёныхперьев. |
|
|
||||||||||||||||||||||||||||||||||||||||||||||
биологическихпрепаратов |
|
|
|
|
|
|
|
|
|
|
;при |
|
|
|
|
большоепрактизна; чениеское |
|
|
|
|
|
|
|
|
|
|
|
в) имеет |
|
б)Белок+HNO3 |
|
|
|
|
→жёлтаяокраска |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
взаимформальдегидадействииаммиаком |
|
|
|
|
|
|
|
|
|
|
|
|
светло-коричневую окраску причастичном |
|
|
|
в)Растворбелка+NaOH + |
CuSO4 |
|
|
|
|
|
|
|
|
|
→ |
|||||||||||||||||||||||||||||||||||||||||||
получаетширокозвелекарственноеятное |
|
|
|
|
|
|
|
|
|
окислении навоздухе; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фиолетовкраская |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
вещесуро.Основтрвомассапиная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3) аниспользуетсялинпри |
|
|
|
|
|
|
|
|
|
получении |
|
3Гидролиз. |
|
|
БелокН2О→+смесь |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
формальдегидаидетнаполучение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лекарственных |
|
|
|
веществ,например |
|
|
|
|
|
|
аминокислот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
фенолформальдегидныхпластмасс,изкоторых |
|
|
|
|
|
|
|
|
|
сульфаниламиднпрепаратов,взрывчатых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Функцбелковприроде: и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
изготавливаются:)электротехнические |
|
|
|
|
|
|
|
|
|
веще,высоктвсоединениймолекулярных. |
|
|
|
|
|
|
|
|
|
|
|
|
|
·каталитические( |
ферменты); |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
изделия;б)детмадршинли. |
|
|
|
|
|
|
|
|
|
Ацетальдегид |
|
|
6. |
|
|
|
Ароматическиеуглеводороды |
|
|
|
|
|
|
|
. |
|
·регуляторные( |
гормоны); |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
(уксусныйальдегид) |
|
|
|
|
|
вбольшихколичествах |
|
|
|
|
|
Характерныеособенности |
|
|
|
ароматических |
|
|
·структурные( |
кератин |
шерсти,фиброин |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
исподпроизводстваляьзуксуснойется |
|
|
|
|
|
|
|
|
|
|
|
|
углеводородов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
шелка,коллаген); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
кислоты.Восстановлениемацетальдегида |
|
|
|
|
|
|
|
|
|
1) ароматическиеарены( ) |
|
|
|
|
|
– этоуглеводороды, |
|
|
|
полимерами называются вещества,имеющие |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
некоторых странахполучаютэтиловыйспирт. |
|
|
|
|
|
|
|
|
|
молекулыкотс держатходноили |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
большуюмолекулярнуюмас,состоящуюиз |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
Получениеальдегидов: общим1)способом |
|
|
|
|
|
|
|
|
|
|
|
|
несколько |
|
бензколецьных |
|
|
|
|
,например: |
|
|
|
множества повтостряющихсяуктурных |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
полученияальдегидовслужитокисление |
|
|
|
|
|
|
|
|
|
|
|
|
а) |
бензол;) |
|
нафталин;в) |
|
антрацен |
; |
|
|
|
|
|
|
звеньев.Существуютприродные |
|
|
|
|
|
|
|
|
|
|
|
полимеры |
|
||||||||||||||||||||||||||||||||
спиртов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) простейшим представиароматичелескихм |
|
|
|
|
|
|
|
(крахмал ,белки,целлюлоза,каучук)и |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
4.Амин,ихсоставикхимическиеслоты |
|
|
|
|
|
|
|
|
|
углеводородов |
является бензол,егоформула |
– |
|
|
синтетическиеполимеры( |
|
|
|
|
|
|
|
|
|
полиэтилен, |
||||||||||||||||||||||||||||||||||||||||||||||
свойства:взаимодействиесоляной |
|
|
|
|
|
|
|
|
|
|
|
|
С6Н6; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенопласты)Низкомолекулярные. вещества, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
кислотой. |
Аминокислоты — |
органические |
|
|
|
-Способыполученияприменения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изкоторыхсинтезпол, ируютмеры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
амфсотерединения,в ые |
|
|
|
|
|
|
|
|
составкоторых |
|
|
ароматическихуглеводородов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
называютсямономерами. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
входяткарбоксильныегруппы |
|
|
|
|
|
|
|
|
– СООНи |
|
|
1) ароматическиеуглеводороды |
|
|
|
|
|
|
|
содержатся в |
|
CH2=CH2 монполиэтиленамер |
|
|
|
|
- этилен |
|
|
||||||||||||||||||||||||||||||||||||||||||
аминогруппы -NH2. |
|
|
|
|
|
|
|
|
|
|
|
|
каменнсмолеугольной |
|
|
|
|
|
,получаемойпри |
|
|
|
(-CH2-CH2-)n –молекулаполимера |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
Аминокислоты можнорассматриватькак |
|
|
|
|
коксовакамеугля; нногоии |
|
|
|
|
|
|
|
|
|
|
|
|
|
2) другим |
|
-CH2-CH2- – структурноезвено |
|
|
|
– многократно |
||||||||||||||||||||||||||||||||||||||||||||||
карбонкислоты,вм выелекулахкоторых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
источникомихполученияслужит |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нефть |
|
повторяющаясягруппаатомов |
|
|
|
|
|
|
|
. |
Физические |
||||||||||||||||||||||||||||||
атводородамрадикалезамещен |
|
|
Химсв |
-ва |
|
|
|
|
|
|
|
|
некоторыхместорождений |
|
|
|
|
|
|
; |
|
|
|
3) чтобы |
|
свойства- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
аминогруппой. |
|
|
Аминокислоты |
|
|
удовлетворить |
|
|
огромнуюпотребностьв |
|
|
|
|
|
|
Полимеры |
|
|
имеютвысокую |
|
|
|
механическую |
||||||||||||||||||||||||||||||||||||||||||||||||
амфотерныеорганичсое,диненияские |
|
|
|
|
|
|
|
|
|
ляних |
|
|
ароматическихуглев, получаютдородах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
прочность.Стойкие |
|
|
|
, |
Неимеютопределённой |
|
|
||||||||||||||||||||||||||||||||||
характерныкислотно |
|
|
|
|
-основныесвойства. |
|
|
|
|
такжепут м |
|
|
|
каталитической |
ароматизации |
|
температуры плавления,нерастворяются |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ациклических |
|
|
углеводородовнефти. |
|
|
|
|
|
|
водеибольшиорганствеических |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||

растворителей. |
Полиэтилен – полупрозрачный |
||||||
материал,воздухо |
- влагонепроницаем, |
||||||
легкоплавкий,химическистойкий. |
|
|
|
||||
Применяетсядля |
плёнок,труб,бытовых |
|
|
||||
изделийпосуда( ,игрушки),электроизоляции, |
|
|
|
||||
поверхноспокры. тийных |
|
|
|
|
|
||
|
8. |
Взаимноевлияниеатомовмолекулах |
|
|
|
||
|
|
органическихвеществ |
. Этанол - |
типичный |
|
||
|
представительклассапредельных |
|
|
|
|
||
одноатомныхс |
пиртов, |
в |
котором |
||||
функциональная группа ОН связана с углеводородным радикалом. Так как кислород
обладает большей |
электроотрицательностью |
посрасводородомнениюуглеродом,связь |
|
О-Нвмолекуэтанола¬сильнополярнаяе, |
|
избыточнымотрицательнымзарядом |
на атоме |
кислоро¬да и с положительным зарядом на атоме водорода. Вследствие этого атом водорода гидроксогруппы обладает большей реакционной способностью, чем атомы
водородауглеводикале. ородном |
Спирты |
являются амфотернымисоединен,.. |
ями |
проявляют свойства кислот и оснований. |
|
Фенол - этопроизвбензола,к дноетором |
|
одинизатомовводорода |
|
замещеннагидроксильнуюгруппу.
Гидроксильная группа и бензольное кольцо оказывают влияние друг на друга. Под действием n-электронногооблака
неподеленная пара кислорода смещается в сторону бензольного ядра (возникает эффект сопряжения). Вследствие этого усиливается
поляризация |
связи О ~ Н |
и возрастает |
|
под¬вижность |
атомов |
водорода |
в |
гидроксогруппе. Влияние же гидроксогруппы на свойства бензольного кольца проявляется в увеличении подвижности атомов водорода в положениях 2, 4, 6. Фенол обладает более выраженными кислотными свойствами по сравнению со спиртами, в частности с этанолом. Раствор фенола, применяемый для дезинфекции, называется карболовой кислотой.
Этанол и фенол реагируют со щелочными металлами (кислотные свойства иосновное( свойство),дляэтанол
взаимодействует сгалогеноводородам фенолатакаяреакцияневозможнаН25О4
С2Н50ННС+] -)С2Н5С]Н20+
фенол реагирует с растворами щелочей (кислотное свойство), для этанола такая
реакцияневозможна |
|
|
анолаифенола |
- веществодина |
- |
Такимобразом,ср |
авнивсвоистваэтно |
|
различнымисвойствами, |
выводвзаимном |
|
влиянии атомов . |
|
|
9.Видыхимическойсвязи:ионная,
ковалеполярная,( еполтная |
|
|
|
|
рная}, |
||
металлическая. Ковалентнаясвязьобразуется |
|
|
|
||||
засчпетрекрыванияэлектронныхоблаков |
|
|
|
|
|||
двухатомов.Каждый̆атомпредоставляетодин |
|
|
|
|
|||
неспаренныйэлектдляоб азованиядной |
|
|
|
|
|||
химическсвязи,прэтомпр исходитй |
|
|
|
|
|||
образованиеобщэлектпай онной |
|
|
|
ы.Если |
|||
ковалентнаясвязьобразуетсямеждудвумя |
|
|
|
|
|
|
|
одинаковымиат, зывается |
|
|
|
|
|
|
|
неполярной. |
|
|
|
|
|
|
|
Есликовалентнаясвязьобразуетсямежду |
|
|
|
|
|
|
|
двумя |
различными |
ат,омамибщая |
|
|
|
||
электпасмещайсяроннаякатомубольшей |
|
|
|
|
|
|
|
электроотрицательностью |
|
|
|
|
|||
(электроотрицат ельностью |
|
называется |
|||||
способностьатомапритягиватьэлектроны)В. |
|
|
|
|
|||
этомслучаевозникаетполярнаяковалентная |
|
|
|
|
|||
связь.Часлучаемтным |
|
ковалентной связи |
|||||
являетсядонорно |
|
-акцепторнаясвязь.Дляее |
|
|
|
||
образованьяуоднатдолжнагомабыть |
|
|
|
|
|
|
|
свободнорбитальна я |
|
нешнемэлектронном |
|
|
|||
уровне,адругого |
|
|
— параэлектронов.Один |
|
|
||
атомдонор)пре( доставляетругому |
|
|
|
|
|||
(акцептору)своюэлектпа,вронную |
|
|
|
|
|
|
|
результатеонастанобщей, витсябразуется |
|
|
|
|
|||
химическаясвязь. |
|
Пример — молекулаСО |
|
: |
|||
Ионнаясвязь |
|
образуетсямеждуатома |
|
|
мис |
||
сильноотличающейся |
|
|
|
|
|
|
|
электрооПри. тодатомицательностью |
|
|
|
|
|||
отдаетэлектроныипревращается |
|
|
|
|
|||
положзаряжени,тельонатом, ныйо |
|
|
|
|
|
|
|
получившэлек, троныицательной |
|
|
|
|
|||
заряженный.Ионы |
|
удерживаются |
вместеза |
||||
счетсилэлектроспритатическогояж |
|
ения. |
|||||
Водороднаясвязь |
|
образуетсямежду |
|
|
|||
полярнымимолекуламивода,сп(, рты |
|
|
|
|
|
|
|
аммиак)засчетпритяженияразноименных зарядов. Прочнводсвязиосущественнороднойсть(~20 раз)меньше,чемионнойиликовалентной связи.
10. |
Водсоединемродыения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
таллов. |
|||||||||||||
Законовизмененийихсвойстверности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
связиположениемхимическихэлементов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
периодическойсистеме |
|
|
|
|
|
|
|
|
|
Гидриды, |
В |
|
|||||||||||||||||
соединенияхнеметалламиводородпроявляет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
степеньокисленияПоскольку+1энергия. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
ионизацииводорода |
|
|
|
|
|
|
|
|
|
|
|
|
оченьбольшая, |
|
|
|
|||||||||||||
химическая вязьегоснеметаллионная, ми |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
аполярно |
|
|
|
|
|
-ковалентная.Наиболее |
|
|
|
|
|
|
|
|
|||||||||||||||
электроотрицательные -элементывправой |
|
|
|
||||||||||||||||||||||||||
частипериодов,напримерсерахлор, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
реагируютсводор,образуяк домвалентные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
гидриды,которые |
|
|
|
|
|
|
|
обладаюткислотными |
|
|
|
||||||||||||||||||
свойсисилаэкислотвамиух |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
величивается |
|
|||||||||
помереув размераличенияатом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
присоекводнеметаллаиняемогоороду. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Исключениямиявляются |
|
|
|
|
|
|
|
|
|
|
|
метанСН4, |
|
|
|
||||||||||||||
представляющийсобойнейтральное |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
соединение,атакже |
|
|
|
|
|
|
аммиак NH3,обладающий |
|
|
|
|||||||||||||||||||
основнымисвойствами. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Водородные |
||||||||||||||
соединнеметалловния |
|
|
|
хорошо |
|
|
астворимы |
|
|
|
|||||||||||||||||||
водеиобразуюткистемиложе ы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
формулами. |
Боэлектроотрицательные |
|
р- |
||||||||||||||||||||||||||
элементы,наприалюм,креирмний |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
фосфор,внагресостомянии |
|
|
|
|
|
|
|
|
|
|
нереагируют |
с |
|||||||||||||||||
водородом. |
11. |
|
Началатермодинамики. |
|
|
|
|||||||||||||||||||||||
Представленобэнтропиия |
|
|
|
|
|
|
|
|
|
|
|
|
. Термодинамика |
|
|||||||||||||||
изучаетф |
|
изическиеобъектыматериального |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
миратольковсостояниитермодинамического |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
равновесНаходящаяся. пропределенныхи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
неизменвнешусловияхпостояннойыхих |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
температуреокружающейсреды.Тем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
термодинрассмусловатрмикаваетя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
существованиянеобпратимых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цессов. |
||||||||||||||
Например,распрогазастранениелекул |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
(закондиффузии)Задачей. термодинамики |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
необпроцессоватимыхсначалабыло |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
изучениенеравновесныхпроцессовдля |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
состояний,неслишкомсильноотличающихся |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
отравновесного.Второеначало |
|
|
|
|
|
. Второеначало |
|
|
|
||||||||||||||||||||
термодинамики.Энтропия |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
термодинамики вводитновфункцию |
|
|
|
|
энтропия |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
состояния – энтропию.Термин« |
|
|
|
|
|
|
|
||||||||||||||||||||||
означаетпревращение« »Вформулировке. : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
«Каждаятермодинасистеобладаетмическая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
функциейсостоя,называемойэ иятропией. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Энтропиявычисляется |
|
|
|
|
следующимобразом. |
|
|
|
|||||||||||||||||||||
Систпереводитсямапроизвольно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
выбранногоначальнсостоянияго |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
соответствующконесостояничерноез ее |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
последовательностьсостоянийравновесия; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
вычисляютсявсепроводимыеприэтомк |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
системепорциитеплаdQ,делятсякаждаяна |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
соответейабсолютвующую |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тную |
||||||||||||||
температуру Т, ивсеполученныетаким |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
образомзначениясу перваямируются( часть |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
второгоначалатермод)Пр. реальныхинамики |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
(неидеальных)процессахэнтропия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
изолсирвстемыованнойзрастает». |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Учетаи |
|
|
|
|||||||||||
сохраненияколичества |
|
|
|
|
|
|
|
|
|
энещергии |
|
|
|
||||||||||||||||
недостаточнодля |
|
|
|
|
|
|
того,чтобысудить |
|
|
|
|
|
|
|
|
||||||||||||||
возмтогоилииногожностипроцесса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Энергию следуетхарактеризовать |
|
|
|
нетолько |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
количеств,нокачеством.Приэт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
существенно,чтоэнергияопределенного |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
качествасамопроизвольноможет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
превращатьсятолькоэнергию |
|
|
|
|
|
|
|
|
|
|
|
|
болеенизкого |
|
|
|
|||||||||||||
качества.Величиной,определяющейкачество |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
энергии,являетсяэнтропия. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Процессыв |
|
|
|
|||||||||||
жинеживой |
|
|
|
|
войматвцеломпротекаютрии |
|
|
|
|
|
|
|
|
||||||||||||||||
так,чтоэнтропиявзамкнутыхизолированных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
системвозр,акастаетчествоэнергиих |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
понижается.Вэтомиестьмыслвторого |
Закон3! |
|
|
|
|
|
|
|
|
||||||||||||||||||||
началате |
рмодинамики. |
|
|
|
W – число |
||||||||||||||||||||||||
различныхсостояний |
|
|
|
|
|
|
|
|
системы,доступноеей |
|
|
|
|||||||||||||||||
приданныхусловиях,илитермодинамическая |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
вероятнмакрсистемыос. остоянияь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
энтправопсформированногояльно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
кристаллачистоговеществаприабсолютном |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
нулеравнанулю. |
|
|
|
|
|
|
|
Этпост |
|
|
тулат можетбыть |
|
|
|
|||||||||||||||
объяснтермодинамикойстатистической, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
согласнокоторэнтропияестьмерай |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
беспорядочностисистемынамикроуровне: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S = |
|||||||||||||
kblnW |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
12. |
|
Гинетичсвязьуглеводородовская |
|
|
|
|
|
. |
|||||||||||||||||||||
Средимножествавидовсвязейможно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
выделитьтакие,которыеуказывают,что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
первторично,ачто,какодниобъекты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
илиявленияпорождаютдругТакие. в ды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
связейназываютсягенетическими. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Междугомологическимирядами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
углеводородовсущ нетическаяст,уетязь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
которобнавпроцессеруживаетсявзаимного |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
превраэтихвещения |
|
|
|
|
|
|
|
|
|
|
|
|
еств.Например, |
|
|
|
|||||||||||||
С2Н6 |
- С2Н4 |
- С2Н2 |
- С6Н6 |
|
|
|
- С6Н6Сl6; |
|
|
|
|||||||||||||||||||
13. |
Гидролизсолей |
|
|
Гидролизом называется |
|||||||||
|
взаимодействиеионовсолиН2О, |
|
|
|
|
|
|
|
|
|
|
||
приводящеекобразованию |
|
|
|
|
|
слабого |
|||||||
электролита. |
|
|
|
|
|
|
|
|
|
|
|
||
Любуюсольможнопредставитькакпродукт |
|
|
|
|
|
|
|
|
|
|
|||
взаимодействиякислотыосновани |
|
|
|
|
|
|
я. |
||||||
Взависотвидовэтихмостиисодных |
|
|
|
|
|
|
|
|
|
|
|||
веществвыделяюттипасолей4 . |
|
|
|
|
|
|
|
|
|
|
|
||
С,образованныелисильнойкислотой |
|
|
|
|
|
|
|
|
|
|
|||
сильосн:ованиемым |
|
|
|
|
|
|
|
|
|
|
|
||
NaOH+HCl=NaCl+H2O |
|
|
|
|
|
|
|
||||||
Таксолиг едролизу |
|
|
|
|
|
неподвергаются их |
|||||||
водныерастворыимнейтютр. едуальную |
|
|
|
|
|
|
|||||||
С,образованныели |
|
|
слабой кислотой,но |
||||||||||
сильосн:ованиемым |
|
|
|
|
|
|
|
|
|
|
|
||
H2CO3 + 2 NaOHСO3 |
= Na2 |
+ 2 H2O |
|||||||||||
ВводныхраствтакихсолейH2Oрахбудут |
|
|
|
|
|
|
|
|
|
|
|||
взаимодействовать анионы слабойкислоты, |
|||||||||||||
которые образуютсяпри |
диссоциации соли: |
||||||||||||
Na2СO3 |
→2Na++CO32− |
|
|
|
|
|
|||||||
Этианионыбудутприксоединятьебеионы |
|
|
|
|
|
||||||||
Н+,отщ епившиесяотмолекул |
H2O,в |
||||||||||||
результэтогообрслабыйтезуется |
|
|
|
|
|
|
|
|
|
|
|||
электролит HСO3− |
- гидрокарбонат-анион,в |
||||||||||||
растнакапливатьсявореанутионыОН, − |
|
|
|
|
|
||||||||
которыебудутсообщатьраствтаксолируй |
|
|
|
|
|
|
|
|
|
|
|||
щелочнуюреакцию. |
|
|
|
|
|
|
|
|
|
|
|
||
14. |
Глицеринмногоатомныйспиртсос ав |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
молекулыф |
изическиехим |
|
. Физические |
||||||||||
свойствамногоатомныхспиртов:
1)важнпредставителийшиемногоатомных спиртов – это этиленгликольглицерин;
2)этобесцветныесиропообразныежидкости сладвк; овусатого
3)онихорастворимыошо; де
4) этисвойстваприсущи |
другим |
многоатомнымспиртам,например |
|
этиленгликольядовит. |
|
Химичесвойствамногоатомныхкие |
|
спиртов. |
|
1.Каквещества,котодержатрые гидроксильныегруппы,многоатомныеспирты имеютсходныесвойстваодноатомными спиртами.
2.Придействиигалогеноводо родныхкислот наспипроисходиттызамещение
гидроксильнойгруппы: |
|
|
|
|||
СН2ОН |
-СН2ОН+СI |
->СН2ОН |
-СН2I + |
|||
Н2О. |
|
|
|
|
|
|
Глицерин — |
бесцветная,вязкая, |
|
|
|||
очень гигроскопичная жидкость,смешивается |
||||||
сводойлюбыхпропорциях. |
Сладкий на вкус, |
|||||
отчегоиполучилсвоёназвание |
.Всоединении |
|||||
с пропиленгликолем становитсяменее |
|
|
||||
текучимприпонижениитемпературыдо |
|
|
|
|||
близкойнулюградусамЦельсия. |
|
|
|
|||
Областьприменразнообразнаяглицер:ина |
|
|
|
|||
пищеваяпромышленность,табачное |
|
|
|
|||
производство,электронныесига |
|
реты, |
||||
медицинскаяпромышленность,производство |
|
|
||||
моющихкосметичесредств,сельскоеих |
|
|
|
|||
хозяй,текстильная,бумажнаяво |
|
|
|
|||
кожевеннаяотраслипромышленности, |
|
|
||||
производствопластмасс,лакокрасочная |
|
|
|
|||
промышленность,электротехника |
|
|
|
|||
радиотехникав(качестве |
флюса при пайке). |
|||||
Способыполученияприменен |
ия |
|||||
многоатомныхспиртов: |
1)подобно |
|
|
|||
одноатомнымспиртам,многоатомныеспирты |
|
|
|
|||
могутбытьполученыизсоответствующих |
|
|
||||
углеводородовчерезихгалогенопроизводные |
; |
|||||
2)наибуполеетрмногоатомныйбительный |
|
|
||||
спирт – глицерин,онполучается |
|
|
||||
расщеплениемжиров, |
настоящеевремявсе |
|
|
|||
больше синтетическим способомиз |
|
|
||||
пропилена,котооб приыйазуется |
|
крекинге |
||||
нефтепродуктов. |
|
|
|
|||
15. |
|
Глюкозапредставителимоносахариды |
|
|
||
|
химическое. |
Глюкоза (C6H12O6), |
||||
или виноградный |
|
сахар, |
||||
или декстроза встречаетсясокемногих |
|
|
||||
фруктови |
ягод,втомчивиноградасле,отчего |
|
|
|||
проиназваниеэтогоошловидасахара. |
|
|
|
|||
Бесцветноекристаллическоевещество |
|
|
|
|||
сладкоговкуса,растворимоеводе |
|
|
|
|||
органическраствор,растворимотелях |
|
|
|
|||
реактивеШвейцера:аммиачномрастворе |
|
|
|
|||
гидроксидамеди |
— Cu(NH3)4(OH)2,в |
|||||
концентрирастворехлоиовнкиданном |
|
|
|
|||
концентрирраствореернкислоты. ванномй |
|
|
|
|||
Глюкоза |
– бесцветноекристаллическое |
|
|
|||
вещество,хорастворимошо,сладкде ое |
|
|
|
|||
навкуслат(.глюкос«» |
– сладкий): |
|
|
|||
1)онавстрепововсчорганахтсятиех растения:вплодах,корнях,листьях,цветах;
2)особенномногоглюкозывсокевинограда спелыхфруктах,ягодах;
3)глюкозаестьвживотныхорганизмах;
4)вкровичеловекаеесодепримерножится
0,1 %.
Особенностистроенияглюкозы
1.Составглюкозывыражаетс яформулой: С6Н12O6,онапринадлежиткмногоатомным
спиртам.
2.Еслирасэтвеществаоговорприлитьк
свежеосажденномугидроксидумеди(II),
образуетсяярко -синийраствор,какслучае глицерина.
Оподтвержытпринаглюкозыдаежность кмногоатомнымспир там. 3. Существуетсложныйэфирглюкозы, молекулекотпятьрогостатковуксусной кислоты.Изэтогоследует,чтовмолекуле углеводапятьгидроксильныхгрупп.Этотфакт объясняет,почемуглюкозахорошо растворяводеиимеетсладкийвкус.ся
Еслираств орглюкозынагретьсаммиачным раствооксидасерто(I),омебраполучится характсер« зеркалорноебрян». е
Шестойатомкислвмовеществалродакуле |
|
|
|
входитсоставальдегиднойгруппы. |
|
|
|
4. Чтсобыставитьполноепредставление |
|
||
строенииглюкозы,надознать |
,какпостроен |
|
|
скелетмолекулы.Посколькувсешестьатомов |
|
|
|
кислвхсоставродадятфункциональных |
|
||
групп,следоват,атомыугл, еродально |
|
|
|
образующиескел,соединеныдругтдругом |
|
|
|
непосредственно. |
|
|
|
5. Цепьатомовуглеродапрямая,не |
|
|
|
разветвленная. |
|
|
|
6. Альдегидруппаможетнаходиться |
|
||
тольковконценеразветвлеуглероднной |
|
|
|
цепи,гидроксильныегруппымогутбыть |
|
|
|
устойчивы,находясьлишьразныхатомов |
|
|
|
углерода. |
|
|
|
7. Глюкодновременноиальдегидза, |
|
|
|
многоспирт:онаальдегидоспирттомный. |
. |
||
16. |
Диеновые |
углеводороды, |
их |
химическоестроение, свойства, получение системы Диены — органические соединения, содержащие две двойных связи углеродуглерод. В зависимости от взаимного расположения двойных связей диены подразделяютсянатригруп:со ряженные диены, в которых двойные связи разделены одинарной (1,3-диены),алленыс
кумулированными двойными связями (1,2- диены) и диены с изолированными двойными связями, в которых двойные связи разделены
несколькимиодинарными. |
Низшиедиены |
- |
бесцветныелегкокипя |
щиежидкости |
|
(температукипенияизопренаы |
- 34 °C, 2,2- |
|
диметил-1,3-бутадиена — 68.78 °C, 1,3-
циклопентадиена — 41.5 °C).
Диеновые углеводороды различаются расположением двойных связей, такое расположение вследствие эффектов сопряжения связей сказывается на их реакционной способности. Существуют три классадиенов: Аллены — диены с кумулированными связями, замещённые производныепропадиена -1,2 H2C=C=CH2 Сопряжённые диены или 1,3- диены — замещённые производные бутадиена- 1,3 CH2=CH–CH=CH2 Изолированные диены, в которых двойные связи располагаются через двеиболеепростыхсвязиС –С Диеновые углеводлегкполимеризуютсяроды.Реакция полимдиуглеводородовризацииновых лежитвосновесинтезакаучука.Вступаютв реакцииприсоегид(инения,рирование галогенирование,
гидрогалогенирование. Натуральный каучук представляет собой полимер изопрена, который в большинстве своем содержится в млечном соке гевеи и многих других растений. Основными физическими и химическими свойствами этого эластомера является его растворимость в углеводородах и их производных, нерастворимость в воде и спиртах. При комнатной температуре, как правило, природный каучук присоединяет кислород,вследствиечегопроисходит
«старение»материла,всвязичем, |
|
|
уменьшаетсяиегоэластичн |
остьи |
|
прочность. |
Первым синтетическим каучуком, |
|
имевшим промышленное значение, был полибутадиеновый (дивиниловый) каучук, производившийся синтезом по методу С. В. Лебедеваани( поннаялимеризацияжидкого бутадвпринатриясутствииена),однакоиз -за
невысоких механических качеств нашёл огранприменение.ченное Основныетипы синтетических каучуков: Изопреновый Бутадиеновый
каучук Бутадиен-метилстирольный каучук Бутилкаучук (изобутиленизопреновый сополимер) Этиленпропиленовый (этилен-пропиленовый сополимер) Бутадиен-нитрильный (бутадиенакрилонитрильный сополимер) Хлоропреновый,

17. |
|
Дисистемыперсн.Коллоидное |
|
|
|
|
|
- |
|||||||
|
|
дисперсныесистемы |
|
|
|
|
|
|
|
|
|
|
|||
Впртехникеродечасто |
|
|
|
|
|
|
|
|
|
|
|||||
встречаются дисперсныесистемы,вкоторых |
|
|
|
|
|
||||||||||
одновеществоравномернораспределено |
|
|
|
|
|
|
|
|
|||||||
видеча |
|
стицвнутридругоговещества. |
|
|
|
|
|
|
|
|
|||||
Вдисперсныхсистема |
|
|
|
|
|
|
|
|
|
|
|||||
различают дисперсную |
|
|
|
|
|
|
|||||||||
фазу — мелкораздробленноевещество |
|
|
|
|
|
||||||||||
идисперсионнуюсреду |
|
|
|
|
— однородное |
||||||||||
вещество,которомраспределена |
|
|
|
|
|
дисперсная |
|||||||||
фаза.Например,вмутнойводе,содержащей |
|
|
|
|
|
|
|
|
|||||||
глину,дисперснойфазойявля |
|
|
|
|
|
|
ютсятвердые |
|
|||||||
частгл,адисперсионнойчкинысредой |
|
|
|
|
|
|
|
— |
|||||||
вода;туманедисперснаяфаза |
|
|
|
|
— частички |
||||||||||
жи,дисперсионнаякоредати |
|
|
|
|
— воздух; |
||||||||||
дымедисперснаяфаза |
|
|
|
—- твердыечастички |
|
||||||||||
угля,дисперсионнаясреда |
|
|
— воздух;молоке |
|
|||||||||||
— |
дисперснаяфаза |
|
|
— |
частжирчки |
а, |
|||||||||
дисперсионнаясреда |
— жидкость.. |
|
|||||||||||||
Кдисперссисотносятсяемаым |
|
|
|
|
|
обычные |
|||||||||
(истинные)растворы,коллоидныерастворы, |
|
|
|
|
|
|
|
|
|||||||
такжесуспензииэмульсии. |
|
|
|
|
|
Ониотличаются |
|||||||||
друготдругапреждевсегоразмерамичастиц, |
|
|
|
|
|
|
|
|
|||||||
т.е.степеньюдисперсности |
|
|
|
|
|
|
|
|
|||||||
(раздробленнос ти). |
|
|
|
|
|
|
|
|
|||||||
Систеразчастицмменеееромы10 |
|
|
|
|
|
|
|
|
|
-9 м |
|||||
представляютсобой |
|
|
|
— истинныерастворы, |
|
||||||||||
состоящмолекулиз илиионов |
|
|
|
|
|
|
|
|
|
|
|||||
растворвещ.Ихследуетстванного |
|
|
|
|
|
|
|
|
|||||||
рассматркакоднофазнуюи.стемувать |
|
|
|
|
|
|
|
|
|||||||
Систеразчастицмбольшеерамиы10 |
|
|
|
|
|
|
-7 м — |
||||||||
этогрубодисперсныесисте |
|
|
мы — суспензии |
||||||||||||
эмульсии. |
|
|
|
|
|
|
|
|
|
|
|
||||
Суспензии — |
этодисперсныесистемы,в |
|
|
|
|
|
|||||||||
которыхдисперснойфазойявлятв рдоется |
|
|
|
|
|
|
|
|
|||||||
веще,адисперсионнойтвосредой |
|
|
|
|
|
|
|
— |
|||||||
жидкость, |
— причтвердоемщество |
|
|||||||||||||
практическинераствориможидк.Чт бысти |
|
|
|
|
|
|
|
|
|||||||
приготовитьсуспензию,надовеществ |
|
|
|
|
|
|
|
о |
|||||||
измельчитьдотонкогопорошка,высыпать |
|
|
|
|
|
|
|
|
|||||||
жидкость,вкоторойвещрастворяетсяне , |
|
|
|
|
|
|
|
|
|||||||
ихорошовзболтатьнапример( ,взбалтывание |
|
|
|
|
|
|
|
|
|||||||
глинывводе)Со.временемчастичкивыпадут |
|
|
|
|
|
|
|
|
|||||||
наднососуда.Очевидно,чемменьше |
|
|
|
|
|
|
|
|
|||||||
частички,темдольшебудетсохраняться |
|
|
|
|
|
|
|
|
|||||||
суспензия. |
|
|
|
|
|
|
|
|
|
|
|
||||
Эмульсии — |
этодисперсныесистемы,в |
|
|
|
|
|
|||||||||
которыхидисперфазасперсионная |
|
|
|
|
|
|
|||||||||
средаявляютсяжидкостями,взаимноне |
|
|
|
|
|
|
|
|
|||||||
смешивающихся.Изводымасламожно |
|
|
|
|
|
|
|
|
|||||||
приготовитьэмудльсиюительным |
|
|
|
|
|
|
|
|
|||||||
встряхиваниемсмеси.Прэ ульсииером |
|
|
|
|
|
|
|
|
|||||||
являетсямолкотор, |
|
|
|
|
|
оммелкиешарики |
|
||||||||
жираплаваютжидкости. |
|
|
|
|
|
|
Суспензии |
||||||||
эмульсии — двухфазныесистемы. |
|
|
|
|
|
|
|||||||||
Коллоиднсистемые |
|
|
|
|
|
|
|
|
|
|
|||||
Коллоидныерастворы |
|
|
|
|
|
— |
это |
||||||||
высокоддвухфазнсист, персныемы |
|
|
|
|
|
|
|
|
|||||||
состоящиеиздисперсионнойср ды |
|
|
|
|
|
|
|
|
|||||||
диспефазы, рлинейныеичемснойразмеры |
|
|
|
|
|
|
|
|
|||||||
частицпослед |
|
нейлежатвпределахот10 |
|
|
|
|
-9 м |
||||||||
до10 |
-7 м. |
Каквидно, оллоидныерастворыпо |
|
|
|
|
|
||||||||
размерамчастицявляютсяпромежуточными |
|
|
|
|
|
|
|||||||||
междуистиннымирастворамисуспензиями |
|
|
|
|
|
|
|
|
|||||||
эмульсиями.Коллчастоиднбычноц е |
|
|
|
|
|
|
|
|
|||||||
состоятизбольшогочисламолекулили. нов |
|
|
|
|
|
|
|
|
|||||||
Суспензия — |
смесьвеществ,гдетвёрдое |
|
|
|
|
|
|||||||||
веществораспределеновидемельчайших |
|
|
|
|
|
|
|
|
|||||||
частвжидквзвешенномвеществецво |
|
|
|
|
|
|
|
|
|||||||
состоянии.Суспензия |
|
|
|
|
|
|
|
|
|
— |
|||||
это грубодисперсная систвёрдойтема |
|
||||||||||||||
дисперснойфазойжидкой |
|
|
|
|
|
дисперсионной |
|||||||||
средой.Обычночастицыдисперснойфазы |
|
|
|
|
|
|
|
|
|||||||
настолькове |
ликиболее( 10мкм),чтооседают |
|
|
|
|
|
|||||||||
поддействиседиментируютсилытяж( ести). |
|
|
|
|
|
|
|||||||||
Суспензии,вкоторыхсед ментациядёт |
|
|
|
|
|
|
|
|
|||||||
оченьмедленноиз |
|
|
-замалойразницыв |
|
|||||||||||
плотностидисперфазыперсионной |
|
|
|
|
|
|
|||||||||
среды,иногданазывзвесями.Вают |
|
|
|
|
|
|
|
|
|||||||
концентрированныхсуспензи |
|
|
|
|
яхлегко |
|
|||||||||
возникаютдисперсныеструктуры.Типичные |
|
|
|
|
|
|
|
|
|||||||
суспензии — пульпы,буровыепромывочные |
|
||||||||||||||
жидкости, |
цементные растворы, |
|
|||||||||||||
эмалевые краски.Ш спользуютсяроков |
|
|
|
|
|
||||||||||
производствекерамики |
|
|
|
|
. |
|
18. |
|
Железо, |
||||||
положениевпериодическойсистеме, |
|
|
|
|
|
|
|
|
|||||||
|
строениеатома |
|
Типичныесте |
пениок сления |
|
||||||||||
железаи+2Степень+3окисления. +2 |
|
|
|
|
|
|
|
|
|
||||||
проявлязасчетпотдвухе4sтсяри |
|
|
|
|
|
|
-электронов. |
||||||||
Степеньоки+3соолениятветствуетакжепри |
|
|
|
|
|
|
|
|
|||||||
потереещеодногоЗd |
|
|
|
-электрона,приэтомЗd |
- |
||||||||||
урокавеньзаполненнымывается |
|
|
|
|
|
|
|
|
|||||||
наполовину;такиеэле онфигтронные |
|
|
|
|
|
|
урации |
||||||||
отноусительнотойчивы. |
|
|
|
|
|
|
|
|
|
|
|||||
Физические |
свойства. |
Железотипичный |
|
||||||||||||
металл,образуетметаллическую кристаллическуюрешетку.Железопроводит электрическийток,довольнотугоплавко, темплавленияератураС.От1539 большинствадругихметажелезолов отличаетсяспособностьюнамагничиваться.
Химичесвой. ствакие |
|
Железореагируетсо |
|
|
|
организма.Нормальнаясвертываемостькрови |
|
|
|
|
|
|
которыезатвердеваюти |
|
|
|
|
образуют |
||||||||||||||||
многиминеметаллами: |
|
|
|
|
|
происходиттольковприсутствиисолей |
|
|
|
|
|
|
элементарныенити.УченыеРоссии |
|
|
|
|
|
|
|||||||||||||||
Образуетсяжелезнаяокалинасмешанный |
|
|
|
|
|
кальция.Кальцийиграетважнуюроль |
|
|
|
|
|
|
предвиделиблестящуюбудущность |
|
|
|
|
|
|
|||||||||||||||
оксиджелезаписывают.Егоф рмулутакже |
|
|
|
|
|
нервно-мышечнойвозбудимостиорганизма. |
|
|
|
|
вискозноговолокна. |
|
|
|
|
|
|
|
||||||||||||||||
так:ОFeО32. |
|
|
|
|
|
|
|
20. |
|
Жирыкаксложныеэфирыглицерина |
|
|
|
|
Свойства |
|
|
|
|
|
|
|
||||||||||||
Реагскисруетвыделениемлотамиводорода: |
|
|
|
|
|
карбонки,ихсослотивыхвойстваав. |
|
|
|
|
|
|
Вискозноеволокноявлясамымтся |
|
|
|
|
|
|
|
||||||||||||||
Вступвреакциизает |
|
мещенияссолями |
|
|
|
Ж,илитригры |
|
лицергде(ацидыл |
|
– остаток |
|
|
универсальнымиз |
химическихволокон,оно |
|
|
|
|
||||||||||||||||
мет,раллсппражеловложврядуезанных |
|
|
|
|
|
карбоновойкислоты |
|
|
|
|
-C(O)R)— |
|
приближенок |
хлоп.Ткизаньовому |
|
|
вискозы |
|||||||||||||||||
напряжений: |
|
|
|
|
|
|
природныеорганическиесоединенияполныесло |
|
на ощупьмягкаяи |
|
приятн.Онаобразуея |
т |
||||||||||||||||||||||
Соединенияжелеза. |
|
FeОосновнойоксид, |
|
|
|
жные, |
|
|
|
|
|
|
|
|
красивыескладки.Волокноимеетрыхлую |
|
|
|
|
|
|
|||||||||||||
реагируетсраствкислотобразованиемрами |
|
|
|
|
эфирыглицеринаодноосновныхжирных |
|
|
|
|
|
|
структуру,напоминаетшелк |
|
|
|
|
внешнему |
|||||||||||||||||
солжелеза(II)йО3амфотерный. Fe2оксид, |
|
|
|
|
|
кислот;входятлипидовасс.Вживых |
|
|
|
|
|
|
виду.Вистакжеотличаетозукрайневысокая |
|
|
|
|
|
|
|||||||||||||||
реагируеттакжесрастворамищелочей. |
|
|
|
|
|
организмахвыполняютструктурную, |
|
|
|
|
|
|
гигроскопичнос.Вискозавпитываеть |
|
|
|
|
два |
||||||||||||||||
гидроксиды: |
|
|
|
|
|
|
энергетическуюдр.функции. |
|
|
|
|
|
|
разабольшевлаги,чем,например,хлопок. |
|
|
|
|
|
|
||||||||||||||
Сплавыжелеза. |
|
|
Современная |
|
Всоставпр |
|
иродныхтриглицеридоввходят |
|
|
|
Тканьиз |
вискозыочлегкоокрашиваетсянь |
|
|
|
|
||||||||||||||||||
металлургическаяпромышленность |
|
|
|
|
остнаткисыщенных |
|
|
|
|
|
|
в самыеяркиецвета.Приувлажнениичистая |
|
|
|
|
|
|||||||||||||||||
производитжелезныесплавыразнообразного |
|
|
|
|
(предельных) |
|
|
|
|
|
|
|
вистановитсякозаменеепр, дч,этаакоой |
|
|
|
|
|
|
|||||||||||||||
состава. |
|
|
|
|
|
|
|
кислот(пальмитиновойC15H31COOH, |
|
|
|
|
|
|
пробполрешаетсяностьюемавплетением |
|
|
|
|
|
||||||||||||||
Всеж сплавылезныераздпосоставуляютсяи |
|
|
|
|
|
стеариновойC17H35COOHдр.) |
|
|
|
|
|
|
специальныхукрепво. яющихокон |
|
|
|
|
|
|
|||||||||||||||
свойствамнадвегруппы.Кпервойгруппе |
|
|
|
|
|
ненасыщенныхнепредельныхкислот( ) |
|
Плотннетканогоп изстьлотна |
|
|
|
|
|
вискозы |
||||||||||||||||||||
относятсяразличныесортачугуна,ковторой |
|
|
|
|
|
(олеиновойC17H33COOH, |
|
|
|
|
|
|
можетварьироватьсяот |
|
1,53г/смідо |
|
|
4,5г/смі. |
||||||||||||||||
различныесортастал |
|
и. |
|
|
|
|
линолевойC17H31COOH,линоленовой |
|
|
|
|
|
|
Эластичностьв |
искозыне |
превышает−3%2. |
||||||||||||||||||
Чугун,предназначенныйдляпереработкив |
|
|
|
|
|
C15H29COOHидр.). |
|
|
|
|
|
|
Вискознаянетканка |
|
|
теряетсвоихсвойств |
|
|
||||||||||||||||
сталь,называютпередельнымчугуном.Он |
|
|
|
|
Жирысодержатсявовсех |
|
|
|
|
растениях |
|
принагреваниивплотьдо |
|
|
150 °CВискозное. |
|||||||||||||||||||
содержитот3,9до4С,3%0,31,5% Si, 1,53,5% |
|
|
|
|
животных.Онипредставляютсобойсмеси |
|
|
|
|
|
|
волокочехорнсочетаетсяь шо |
|
|
|
|
другими |
|||||||||||||||||
Мn,неболее0,3%Ринеболее0,07%ЧугунS. |
|
|
|
|
|
полныхсложныхэфировглицимеютрина |
|
|
|
|
|
|
волокнами,чтоп зволяетулучшатьразличные |
|
|
|
|
|
||||||||||||||||
предназнаполуотливок,ченияныйдля |
|
|
|
|
чётковыраженнойтемплавленияературы. |
|
|
|
|
|
|
свойстваматерии:крепкость,мягкость, |
|
|
|
|
|
|
||||||||||||||||
называетсялитейнымчугуном,Вдоменных |
|
|
|
|
|
Жидкиежипрытвердыеращаютпутем |
|
|
|
|
|
|
гигроскопичность.В |
искозане |
электризуется. |
|||||||||||||||||||
печахвыплавляютсятакжеферросплавы, |
|
|
|
|
|
реакциигидрогенизации |
|
|
|
|
|
|
«Зеленые»свойства |
|
|
|
|
|
|
|
||||||||||||||
применяемыепреимущв ственно |
|
|
|
|
(каталитическогогидрирования)При. |
|
|
|
23 |
. кетонысоставсвойстваспособы |
|
|
|
|
|
|||||||||||||||||||
производствесталейкачестдобавок. е |
|
|
|
|
|
этомводородприсоединяетсяподвойнойсвязи, |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
полученияприменения |
|
|
: |
Способы |
||||||||||||||||||||||||
Ферросплавыимеют,посравнению |
|
|
|
|
|
содержащейсявуглеводородномрадикале |
|
|
|
|
|
|
получекетонияов |
|
|
|
|
|
|
|
||||||||||||||
передельнымчугуном,повышенное |
|
|
|
|
|
молекулмасел. |
|
|
|
|
|
|
|
|
Кетмобытьгутполученыокислением |
|
|
|
|
|
||||||||||||||
содекремнияжаниеферросилиций),( |
|
|
|
|
21. |
|
изорганическихмериясоединенийее |
|
|
|
|
алкеновислородом( присутствиисолей |
|
|
|
|
|
|
||||||||||||||||
марганцаферрома( ),хрома( ) рохромганец |
|
|
|
|
|
виды. Разлдвиачдазомерии:ют |
|
|
|
|
палладиозоном),спгидратациейяртов |
|
|
|
|
|
||||||||||||||||||
ид ругихэлементов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
алкинов.Промышлзначениеетоднное |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
структурнуюипространственную |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Общиеспособыполученияметаллов. |
|
|
|
|
|
(стереоизоме)Структурн. изомериюые |
|
|
|
|
|
|
гидроформилалкенокс( ). свинтезрования |
|
|
|
|
|
||||||||||||||||
Металлынаходятсявприроде |
|
|
|
|
|
отличаютсядругдругапорядкомсв зи |
|
|
|
|
|
|
1Из.спиртов.Дегидрспиртовованием |
|
|
|
|
|
||||||||||||||||
преимуществевидесо .Толькодиненийно |
|
|
|
|
|
атомовмолекуле,стерео |
|
|
|
|
-изомеры — |
|
получаютмногальдикет,нгидывон |
|
|
|
|
|
|
|||||||||||||||
металлысмалойхимическактивностьюй |
|
|
|
|
расположенатомвпр прстранствеием |
|
|
|
|
|
|
настоящеевремяпроцесссохранилсвое |
|
|
|
|
|
|
||||||||||||||||
(благороднвстречаютсяметалл) природеы |
|
|
|
|
|
одинаковомпорядкесвязеймеждуними. |
|
|
|
|
|
|
значениетолькодляполученияформальдегида |
|
|
|
|
|
||||||||||||||||
всвободномсостоянплатиновые( металлы, |
|
|
|
|
|
Структурнаяизомери |
|
|
|
|
|
|
|
(катализаторCu) |
.Промышленнымспособом |
|
|
|||||||||||||||||
золото,м |
|
едь,се,ртутьебро)Из. |
|
|
|
|
Изомерия |
углеродногоскелетаобусловлена |
|
|
|
|
полученияявляетсяокислениеспиртов.В |
|
|
|
|
|
|
|||||||||||||||
конструкциметаллвдостаточномвнных |
|
|
|
|
|
различнымпорядкомсвязимежду |
|
|
|
|
|
|
|
качествеокислприменяютлей |
|
|
|
|
|
|
||||||||||||||
количимеютсявприродествевиде |
|
|
|
|
|
атомами углерода,образующимискелет |
|
|
|
K2Cr2O7/разб. H2SO4,разб. H2SO4Cr2O3/. |
|
|
|
|
|
|||||||||||||||||||
соедлишьженений,алюминийезо,магний. |
|
|
|
|
|
молекубыло.Какужепоказано, |
|
|
|
|
|
|
Окисленпервичныхспполучаютртовем |
|
|
|
|
|
|
|||||||||||||||
Ониобрамощныезуюталжисторождений |
|
|
|
|
молекулярнойформулеС4Н10соответствуют |
|
|
|
|
альдегиды,вторичных |
|
– кетоны. |
|
|
|
|
||||||||||||||||||
относительнобогатыхруд.Этооблегчаетих |
|
|
|
|
|
двауглеводорода:н |
-бутаниизобутан.Для |
|
Сухаяперегонкаилидревесиныролиз |
|
|
|
|
|
||||||||||||||||||||
довбычуольшихмасштабах. |
|
|
|
|
|
углеводоС5Н12возможнытизомераи:да |
|
|
|
|
|
|
- нагреваниед |
ревесиныдо5500C |
|
|
|
|
||||||||||||||||
Посколькуметаллывсоединенияхнаходятсяв |
|
|
|
|
пентан,изо |
-пеинеопентан. |
|
|
|
|
Альдольная конденсациякетонов. |
|
|
|
|
|||||||||||||||||||
окисленномсостоянииимеют( положительную |
|
|
|
|
Большинствоприросоеявляютсядныхинений |
|
|
|
|
|
|
Кетонызначительнотруднеевступают |
|
|
|
|
|
|
||||||||||||||||
степеньокисления),тополучениеихв |
|
|
|
|
|
индивидуальнымиэнантиом |
|
|
ерами,их |
|
реакции альдольной автоконденсации по |
|||||||||||||||||||||||
свободномсостояниисводитсякпроцессу |
|
|
|
|
|
биологическоедейстначиная( отвкуса |
|
|
|
|
|
|
сравнениюальдегидами.Структурные |
|
|
|
|
|
||||||||||||||||
восстановления: |
|
|
|
|
|
запахаикончаялекарственнымдействием) |
|
|
|
|
|
|
условияздесьнеблагкаксточкипрятны |
|
|
|
|
|
||||||||||||||||
Этотпроцессм жносуществитьхимическим |
|
|
|
|
резкоотличаетсясвойствоптических |
|
|
|
|
|
|
зренияскорости,таксточкизрения |
|
|
|
|
|
|
|
|||||||||||||||
илиэлектрохимическимпутем. |
|
|
|
|
антиподов,полученныхлаборатории. |
|
|
|
|
|
|
равновесия.Од |
накоеслиреакциюпроводить |
|
|
|
|
|||||||||||||||||
Прихим |
ическомвосстановлениичестве |
|
|
|
|
Подоразлвбниочиелогической |
|
|
|
|
|
|
прик слотномка, образующийсяализе |
|
|
|
|
|
||||||||||||||||
восстчащевсегоновителяприменяютуголь |
|
|
|
|
|
актимеетогромноевносзначение,ткак |
|
|
|
|
|
|
продуктконденсациибудет |
|
|
|
|
|
|
|||||||||||||||
илиоксидуглерода(II),такжеводород, |
|
|
|
|
|
лежитвосновеважнесвойствавсехшего |
|
|
|
|
|
|
быстро дегидратиров,превращаясьться |
|
|
|
|
|||||||||||||||||
активныеметаллы,кремний.Спомощью |
|
|
|
|
|
живыхорганизмов |
— обменавеществ |
. |
|
|
в мезитилоксдия.Этапо летасмещаетн я |
|
|
|
|
|
||||||||||||||||||
оксидауглеродаполучают(II)железов( |
|
|
|
|
|
22 |
. искусствеволокнанапримерные |
|
|
|
|
|
|
равновесиесторополпревращенияуого |
|
|
|
|
|
|||||||||||||||
доменномпроцессе),многиецветныеталлы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кетона.Кат. гидратациейлитическая |
|
|
|
|
лкинов |
||||||||||||||
|
|
|
|
|
|
цнллофанаивискоз |
|
|
.– |
этохимические |
|
|
|
|
||||||||||||||||||||
(олово,свинец,ци |
|
нкидр.): |
|
|
|
|
вол,покналучаемыеизприродных |
|
|
|
|
|
|
(кромеэтина) |
(реакцияКучерова): |
|
|
|
|
|||||||||||||||
Восстановлениеводородомиспользуется, |
|
|
|
|
полиме,главнымобцеллюлозыровазом, |
|
|
|
|
|
|
R−C≡CH−→+H2OR−C(=O)−CH3R−≡ |
|
|
|
|
|
|
|
|||||||||||||||
например,дляполучениявольфрамаизоксида |
|
|
|
|
|
получаиздерисоломые.Тканивамойиз |
|
|
|
|
|
|
→+H2OR−C(=O)−CH3 |
|
. |
|
|
|
|
|
||||||||||||||
вольфрама(VI): |
|
|
|
|
|
|
искусственволо,такжекакизоных |
|
|
|
|
|
|
24. |
|
Кислородосодержащиекисерылоты |
|
|
: |
|||||||||||||||
|
|
Понятиежесткостиводы. |
|
Борьба. |
|
натуральных,обладаютвысокими |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
19. |
|
|
|
|
|
|
|
H2SO4 |
- тяжелаямаслжидкостьнистая |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
– |
этос вокупностьсвойств, |
|
|
|
гигиеинымикачествамиическими. |
|
|
|
|
|
|
,купоросннелетучаямасло,хорошо |
|
|
|
|
|
|
||||||||||||
Жесткостьводы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
обусодержаниемловводеленныхкатионов |
|
|
|
|
|
Висткизготавливаютсяаниозныеисходя |
|
|
|
|
|
|
растворимадегигроскопичнань, |
|
|
|
|
|
|
|
||||||||||||||
кальциямагния. |
|
Анионамирастворимых |
|
|
|
ихназначе.Имможнопридатьвнешнийия |
|
|
|
|
|
|
облаводооает |
|
нимающимисвойствами |
|
|
|||||||||||||||||
солейкальциямагниямогутбыть |
|
|
|
|
|
|
видхлопка,льна,шерстиилишелка.Кроме |
|
|
|
|
|
|
(обугливаниебумаги,дерева, |
|
|
|
|
|
|
|
|||||||||||||
гидрокарбонат-ионы,сульфат |
-ионыхлорид |
- |
|
того,вискозаприменяетсядл |
|
|
|
япрядения |
|
сахара)окислитель. . |
|
|
|
|
|
|
|
|||||||||||||||||
ионы.Различвременнуюк(аютрбонатную)и |
|
|
|
|
вискозныхневолокнизделистыхй |
|
|
|
|
|
|
ПроизводствоH2SO4: |
|
|
|
|
|
|
|
|||||||||||||||
постояннуюжесткость. |
|
|
|
|
|
(целлюлознойпленки,целлофана),такжедля |
|
|
|
|
|
|
1-ястадия.Обжигпиритавпечидляобжигав |
|
|
|
|
|
|
|||||||||||||||
Временнаяжесткость |
|
|
обусловлена |
|
проискусстзводкожикирзы()в. еннойа |
|
|
|
|
|
|
кипящемслое4FeS2 + 11O2 =2Fe2O3 + 8SO2 + |
|
|
||||||||||||||||||||
содержаниемвводегидрокарбонатовкальция |
|
|
|
|
Вискозаобладаетнекоторымидостоинствами |
|
|
|
|
QПроцгете:рогенныйсс |
|
|
|
|
|
|
||||||||||||||||||
магния.Временнаяжестк |
|
остьлегко |
|
|
|
посравнентрадиционныминатуральнымию |
|
|
|
|
1) измельчежелезколчеданапирита( ого);ие |
|
|
|
|
|
|
|||||||||||||||||
устранкип:яетсячением |
|
|
|
|
|
тканями.Так,вискозалучшевпитываетвлагу |
|
|
|
, |
|
|
2) метод "кипящегослоя"; |
|
|
|
|
|
||||||||||||||||
Постояннаяжесткость |
обусловленаналичием |
|
|
|
чемхлопок.Изделияизвискозыобладают |
|
|
|
|
|
|
3)С;отвод800°лишнеготепла; |
|
|
|
|
|
|
|
|||||||||||||||
вводесульфатов,хлоридовдругихсолей |
|
|
|
|
|
приятнымшелковистымблеск,приэто |
|
|
|
|
|
|
4)увеличениеконц |
|
-цииO2ввоздухе. |
|
|
|
|
|||||||||||||||
кальциямагния.Постояннуюжесткость |
|
|
|
|
|
легкоокрашиваютсяобладаютвысокой |
|
|
|
|
|
|
2-ястадия.Почисле,о ушкитки |
|
|
|
|
|
|
|||||||||||||||
можноустранить,используяследующие |
|
|
|
|
|
светос(тотличиешелкайкостью)Из. |
|
|
|
|
|
|
теплообменасернигазпоств ыйупает |
|
|
|
|
|
|
|||||||||||||||
способы. |
|
|
|
|
|
|
|
недостатковнеобходимоназватьсильную |
|
|
|
|
|
|
контактныйаппарат,гдеокисл |
|
|
|
-сявсерный |
|||||||||||||||
а) Известково-содовыйспособ |
– кводе |
|
|
|
сминаемость,высокуюстепеньусадки |
|
|
|
|
|
|
ангидрид(450°С |
– 500°С;катализаторV2O5): |
|
|
|||||||||||||||||||
добавляютсмес |
ьгашенойизвестисоды.Пр |
|
|
|
|
невысокуюпрочность |
|
(особеннововлажном |
|
2SO2 + O2 -> 2SO3. |
|
|
|
|
|
|||||||||||||||||||
этомвременнаяжесткостьводыустраняется |
|
|
|
|
|
состоянии)Поэтому. стиратьвискозу |
|
|
|
|
|
|
3-ястадия.Поглотительнаябашня: nSO3 + |
|
|
|
|
|
||||||||||||||||
гашенизвестью,постояннаяй |
|
– содой: |
|
|
|
необходимовщадящемрежиме.Отжимать |
|
|
|
|
|
|
H2SO4(конц) |
-> (H2SO4олеум) • nSO3)( |
|
|
||||||||||||||||||
б) Катионитныйспособ |
– |
водупропускают |
|
|
|
лучшевручнуюинеси,либвоьнонебще |
|
|
|
|
|
|
Примекерамнасадкияютпринципческие |
|
|
|
|
|
|
|||||||||||||||
черезколон,заполненкатиоунитомую |
|
|
|
|
|
отжимать,сразувешатьшиться.Гладитьее |
|
|
|
|
|
|
противотока. |
|
|
|
|
|
|
|
||||||||||||||
(катиониты – твердыевещества,содержащие |
|
|
|
рекомендуетсявтакомжережиме,какшелк. |
|
|
|
|
|
|
Химсв |
-ва: |
|
|
|
|
|
|
|
|||||||||||||||
своемсостаподвеижны |
екати,способные |
|
|
|
Вискозное волокно занимает |
первоеместо |
|
Свойствасернойкислоты. |
|
|
|
|
|
|
|
|||||||||||||||||||
обмениватьсянаио средыешней) |
|
|
|
|
|
средихимическихволпокон |
|
|
|
объему |
|
Свойствасернойкислоты.Химчистаячески |
|
|
|
|
|
|
||||||||||||||||
На катионитезадержионыкальцияваются |
|
|
|
|
производст.Вискозаводитсяа |
|
|
|
|
|
|
сернаякислота |
|
— |
тяжелаябесцветная |
|||||||||||||||||||
магния,врастворпереходятионынатрия,в |
|
|
|
|
|
из жидкихраствоприроднойцеллюлозы:в |
|
|
|
|
|
|
маслянжидкость.Обладаетстаясил ными |
|
|
|
|
|
||||||||||||||||
результатечегожесткостьводыумен: шается |
|
|
|
|
из древеели,сосны, итеблейекоторых |
|
|
|
|
|
|
гигроскопическимисвойства,поэто у |
|
|
|
|
|
|||||||||||||||||
Общеесодержаниекальцияворганизме |
|
|
|
|
|
растений,из |
|
отходовпереработкихлопкового |
|
|
|
применяетсядляосушениягазов.Онахорошо |
|
|
|
|
|
|
||||||||||||||||
человекасреднемсоставляет1 |
|
,9%отобщей |
|
|
|
волокна.Остаткиеловойщепы |
|
|
|
|
хлопкового |
|
раствооксидсе(VI)р,какыяетвыуже |
|
|
|
|
|
|
|
||||||||||||||
массытела,приэтом99%всегоколичества |
|
|
|
|
|
пухаобрабарасщелочитываютвором |
|
|
|
|
|
|
знаете,этотрастворназываютолеумом.Вы |
|
|
|
|
|
|
|||||||||||||||
прихнадоскелеталюдлишьтся1% |
|
|
|
|
|
(едкий натр),получаютщелочнуюцеллюлозу, |
|
|
|
|
такжезнаправилоразбавленияте |
|
|
|
|
|
|
|||||||||||||||||
содержитсявостальныхтканжидкостях |
|
|
|
|
|
котзатеморуюбрабатываютсероуглеродом |
|
|
|
|
концентрированнойсерн |
ойкислоты:нельзя |
|
|
||||||||||||||||||||
организма.Сутп требностьчнвкальциия |
|
|
|
|
|
и полученныйрастровпродавливаютчерез |
|
|
|
|
|
|
приливатьводукки,слотеедует |
|
|
|
|
|
|
|||||||||||||||
длявзрослогочеловека0,45 |
|
|
-1,2г.Кальций |
|
|
|
фильеры — |
пластины |
|
мельчайшими |
|
осторожно,тоненькойструйкойвливать |
|
|
|
|
|
|
||||||||||||||||
участвуетвовсехжизненныхпроцессах |
|
|
|
|
|
отверстиями — получструйкима,юттериала |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||

кислотувводу,непрерывнопомешивая |
|
|
|
|
|
металлы.Поэтойпричине,например, |
|
|
|
|
|
|
|
CH2=CH2 + H |
- H→ CH3 |
- |
|
CH3 (под |
|
сложноевнесколькоществ превращаетсяв |
|
|
|||||||||||||||||||
раствор. |
|
|
|
|
|
|
безводная |
|
|
|
|
|
|
|
|
|
действиемNi) |
|
|
|
|
|
|
|
веществпростых( илисложных): |
|
|
|
|
|
|
|
|||||||||
Слайд13 |
|
|
|
|
|
|
|
концентрированнаясернаякислотадействует |
|
|
|
|
|
|
|
Гидрогалогенирование: |
|
|
|
|
|
Реакциизамещения— |
|
|
|
|
|
||||||||||||||
Химичесвойсернойкислотытвакие |
|
|
|
|
|
почтинавсем приталлынагревании.При |
|
|
|
|
|
|
|
CH2=CH2 + →HBrCH3 |
- CH2Br |
|
|
|
изпростогоисложноговеществобразуется |
||||||||||||||||||||||
взначительнойстепзависятотеени |
|
|
|
|
|
|
этомобразуютсясолисернойкислоты,однако |
|
|
|
|
|
|
|
Гидратация: |
|
|
|
|
|
|
|
простоеисложноевещества: |
|
|
|
|
|
|
|
|||||||||||
концентрации.Разбавленнаясерная |
|
ислота |
|
водородневыделяется,аполучаютсядругие |
|
|
|
|
|
|
CH2=CH2 + →HOHCпод3CH2OH |
( |
|
|
|
|
Реакцииобмена |
|
|
|
|
|
— |
||||||||||||||||||
проявляетвсехараксвойкиерные:ствалот |
|
|
|
|
|
веще,напримерсернистыйтвагаз. |
|
|
|
|
|
|
|
дейскатализаторавием) |
|
|
|
|
|
|
|
издвухсложныхвеществобразуютсядвасложны |
|||||||||||||||||||
взаисмодействуететаллами,стоящими |
|
|
|
|
|
Так,принагреванииконцентрированной |
|
|
|
|
|
|
ЭтуреакциюоткрылAБутлеров.M,иона. |
|
|
|
|
|
|
|
хвещества: |
|
|
|
|
|
|
|
|||||||||||||
рядунапряженводорода,соксидамий |
|
|
|
|
|
сернойкимедьюлотывначалесерная |
|
|
|
|
|
|
|
используетсядляпромышлеполученияного |
|
|
|
|
|
^Классификацияпоиз |
|
менениюстепени |
|
|
|||||||||||||||||
металловосновными( амфотерными), |
|
|
|
|
кислотаокисляетмедьдомеди,а ама |
|
|
|
|
|
|
|
|
этиловогоспирта. |
|
|
|
|
|
|
|
|
окисления. |
|
|
|
|
|
|
|
|||||||||||
основаниямисолями.По ернаякольку |
|
|
|
|
|
восстанавливаетсяприэтомдосернистой |
|
|
|
|
|
|
|
Окисление: |
|
|
|
|
|
|
|
Окислительно-восстановительныереакции |
— |
||||||||||||||||||
кислотадвух,онабразуетсновнаядваряда |
|
|
|
|
|
кислоты,ко орая |
|
|
отчжерасзлнагается |
|
|
|
|
Этиленлегкоокисляется.Еслиэт лен |
|
|
|
|
|
|
|
входепроисходитеакцииизменениестепен й |
|
|
|
|
|
|
|||||||||||||
солей:среднсульфаты()кисле е |
|
|
|
|
|
сернистыйгазводу: |
|
|
|
|
|
|
|
|
пропускатьчерезрастворперманганатакалия, |
|
|
|
|
|
|
окисленияэлементов: |
|
|
|
|
|
|
|
||||||||||||
(гидросульфаты)Реактивом. насерную |
|
|
|
|
|
Образовавшаясяокисьмедиреагирует |
|
|
|
|
|
|
|
тоонобесцветится.Этареакцияиспользуется |
|
|
|
|
|
|
^Реакцииионногообмена |
|
|
|
|
|
— |
||||||||||||||
киислотуульфатыявляетсяхлоридбария: |
|
|
|
|
|
|
избытксернкислоты,образуяймсольводу: |
|
|
|
|
|
|
|
дляотличияпреднепредельных |
|
|
|
|
|
|
изменениястепенейокислениянепроисходит. |
|
|
|||||||||||||||||
сульфат-ионыSО42 |
|
- сионВ2+образуютми |
|
|
|
Такимобразом,окисьмедиявляется |
|
|
|
|
|
|
|
соединений. |
|
|
|
|
|
|
|
29. |
комплексныесоединениятеория |
|
|
|
|
|
|||||||||||||
белыйнерастворимыйсульфатбария:Ва2+ + |
|
|
|
|
|
промвежуточнымществомэтойреакции. |
|
|
|
|
|
|
|
Окисьэтилена |
|
— |
непрочноевещество, |
|
|
|
|
химическаясвязь |
|
|
. |
Молекулярные |
|
||||||||||||||
SО42 - =ВаSО4 |
|
|
|
|
|
|
Сложивэтиуравнения,мыполучимитоговое |
|
|
|
|
|
|
|
кислморазрываетсяродныйстик |
|
|
|
|
|
|
соединения,образующиесложио, ны |
|
|
|
|
|
|
|
||||||||||||
Сульфаты — минералы,солиH2SO4Вих . |
|
|
|
уравнениереакции,вкотороевходяттолько |
|
|
|
|
|
|
|
присвода,результатеединяется |
|
|
|
|
|
|
споксуществообныекакраст, ваниюоре |
|
|
|
|
|
|
||||||||||||||||
кристаллическойструктуреобособляются |
|
|
|
исходныеконв чныещества. |
|
|
|
|
|
|
|
образуется этиленгликоль: |
|
|
|
|
|
такивкристалле,называются |
|
комплексными. |
|||||||||||||||||||||
комплексныеанионыSO42−Р. |
|
|
-циясхлоридом |
|
|
|
26. |
классалкеныобщая |
|
|
формулаи |
|
Горение: |
|
|
|
|
|
|
|
|
Координационнаятеориястроения |
|
|
|
|
|
|
|||||||||||||
бариядаётбелыйкристаллическийосадок |
|
|
|
|
|
химическоестрг мологовени |
|
|
|
. |
|
|
Полимеризация. |
|
|
|
|
|
|
комплекссоединенийбыларазработанаыхв |
|
|
|
|
|
||||||||||||||||
сульфата |
|
|
|
|
|
|
Алкены (олефины) |
– |
|
ненасыщенные |
|
|
27. |
Классификацияорганических |
|
|
|
|
|
1893годушвейцарскимхимикомАльфредом |
|
|
|
|
|
||||||||||||||||
бария: |
|
|
|
|
|
|
|
ациклическиеуглевододндвойродыной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вернером: |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соединений. Взависимостиотстроения |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
связью,общаяформулагомологического |
|
|
|
|
|
|
углеродныхцепсредиорганическихй |
|
|
|
|
|
|
- центральноеместовкомпл ксном |
|
|
|
|
|
||||||||||||
ПолучениеГидросульфатыполучаютпри |
|
|
|
ряда CnH2n. Названиеобразуетсяот |
|
|
|
|
|
|
соединенийвыд |
еляюследующиетряся: да |
|
|
|
|
|
соединении |
|
|
|
|
|
|
|
||||||||||||||||
избыткесернойкис |
|
|
-ты:Na2CO3 |
+ |
|
|
углеводородаснаиболеедлиннойцепью, |
|
|
|
|
|
|
|
1) соединения соткрытойцепьюатомов |
|
|
|
|
|
занимает комплексообразователь – |
обычно |
|||||||||||||||||||
H2SO4(изб.)= 2NaHSO4↑Также+ H2O + CO2 |
|
|
|
содержащейдвойнуюсвязь, |
|
|
|
добавлением |
|
углерода, |
котакжеорыеназываются |
|
|
|
|
|
положзаряжени;тельонныйо |
|
|
|
|
|
|
|
|||||||||||||||||
умереннымнагреваниемс |
|
ульфатссерновй |
|
|
|
суффикса -ен.Цифройуказываетсяположение |
|
|
|
|
|
ациклическими,илисоедж ряданенрногоя |
|
|
|
|
|
|
- |
|
вокругкомплексообразователя |
|
|
||||||||||||||||||
кис-той:K2SO4 + H2SO4 = 2KHSO4 |
|
|
|
двойнойсвязи.Втабл. 12приведены.первые3 |
|
|
|
|
|
|
|
(этоназваисторическивозни:первымло |
|
|
|
|
|
|
координированыпротивоположнозаряженные |
|
|
|
|
|
|||||||||||||||||
Кислородсодержащие кислотыазота |
|
|
|
четыреалкена, изомеровслокоторых |
|
|
|
|
|
|
|
соесдлиннынезамкнутымиинениям |
|
|
|
|
|
|
иоилинейтральныемолекулы, |
|
|
|
|
|
|
|
|||||||||||||||
Изкислородскислотазотадержащих |
|
|
|
|
увеличиваетсянетолькоиз |
|
|
-заизомерии |
|
углероднымицепринадлежалиями |
|
|
кислоты). |
|
называемые лигандами; |
|
|
|
|
|
|||||||||||||||||||||
наиболеезвесазоНNтО2иныазотнаястая |
|
|
|
|
|
скелета,нотакжеизомерииположения |
|
|
|
|
|
|
|
Взависимостиотхарактсвязмеждурай |
|
|
|
|
|
|
|
- комплексообразовавмеслигандамитель |
|
|
|
|
|||||||||||||||
НNО3кисл.Азкислотатистая.ы |
|
|
|
|
|
|
двойнсвязигеометрическойизомерии |
|
|
|
|
|
|
|
атомамиуглероэтисоединенияа |
|
|
|
|
|
|
образуют внутреннююкоординационную |
|
|
|
|
|||||||||||||||
Получаетпрастворенииоказотидая(III) |
|
|
|
|
|
(цис -транс)Названия. одновалентных |
|
|
|
|
|
|
подрна:)прздеили(дельныеляются |
|
|
|
|
|
|
сферу комплекссоеди,призаписиненогоя |
|
|
|
|
|
||||||||||||||||
вводе: N2O3 + H2 |
O |
=Азотистая2HNO2 |
|
|
|
радикаловполучдоб ютвлением |
|
|
|
-илк |
|
насыщенные),котодержатврыемолекулах |
|
|
|
|
|
|
комплекссоедивнутрсфенияогоннююру |
|
|
|
|
|
|||||||||||||||||
кислотанеустойчивалегкоразлаг: ется |
|
|
|
|
|
названиюсоответствующегоуглеводорода. |
|
|
|
|
|
|
толькопр(рдинарныестые)связи;б) |
|
|
|
|
|
|
|
заключаютвквадраскобки.Внутренняяные |
|
|
|
|
|
|||||||||||||||
3HNO2А=вотеесолиHNO3 + 2NO + H2O |
— |
|
Полиалкеныбываюттрехтипов: |
|
|
|
|
|
|
|
|
непредельныеили(ненасыщенные),в |
|
|
|
|
|
|
сфераможимположительныйет , |
|
|
|
|
|
|||||||||||||||||
нитриты — болееустойчивы.Нитриты |
|
|
|
Сизолированнымидвойны |
|
связями |
|
|
|
|
молекулахкоторыхим |
|
еютсякратные |
|
|
|
отрицательныйилинулевойзаряд |
|
|
|
; |
|
|
||||||||||||||||||
щелочныхметалловплавятсябезразложения. |
|
|
|
|
CH2=CH—CH2—CH2—CH=CH2 |
1,5- |
|
|
|
(двойныеилитройные)связимеждуатомами |
|
|
|
|
|
|
- внешняясфера |
|
комплекссоединенияого |
|
|
||||||||||||||||||||
Внебольшихдозахиспользуютпри |
|
|
|
|
|
гексадиен |
|
|
|
|
|
|
|
|
|
углерода; |
|
|
|
|
|
|
|
|
образованаионами,имеющими |
|
|
|
|
|
|
||||||||||
изготкол, днаковлениибасольшиедозы |
|
|
их |
|
Ссопряжедвойсвязянными |
|
|
|
|
|
|
|
2) соединения сзамкнутойцепьюатомов |
|
|
|
|
|
противоположзнавнутрерядакннейый |
|
|
|
|
|
|||||||||||||||||
ядовиты. |
|
|
|
|
|
|
CH2=CH-CH=CH2 |
1,3-бутадиен |
|
|
|
|
углерода, |
иликарбоциклические. |
Эти |
|
сферы; |
|
|
|
|
|
|
|
|
||||||||||||||||
Азотнаякислота. |
|
|
|
|
|
|
(использприполимеровуетсячении) |
|
|
|
|
|
|
|
соедин,всвоюоч,подразделяютсянияредь: |
|
|
|
|
|
- числосвязейк мплексообразователя |
|
|
|
|
||||||||||||||||
Получениеазотнойкислоты.В |
|
|
|
|
|
|
Вполиалкенахссопряженными |
|
|
|
|
|
|
|
а) насоединенияароматическогоряда. |
|
|
|
|
|
|
лигандамиопределяется |
|
координационным |
|||||||||||||||||
промышленностиазотнуюкислотуполучаютв |
|
|
|
|
|
(чере)двойныующисвязямися |
|
|
|
|
|
|
|
Онихарактеризуютсяналичиемвмо |
|
|
лекулах |
|
числом. |
|
|
|
|
|
|
|
|
||||||||||||||
тристадии.Контактноеокислениеаммиакадо |
|
|
|
|
|
происходит делокализацияπ |
|
|
- |
|
особойциклическойгруппировкиизшести |
|
|
|
|
|
|
Примерыстркоениямплекссоединенийых |
|
|
|
|
|
||||||||||||||||||
оксидаазот(II): 4NH3 + 5O2 = 4NO + 6 H2O |
|
|
|
электронов. Соесдвойныинесвязяиями |
|
|
|
|
|
|
атомовуглерода |
– бензольного |
|
|
|
|
|
Комплексноесо |
единение |
|
|
|
|
||||||||||||||||||
катализаторомявляепла.Окисление2сяина. |
|
|
|
|
легкополимеризуются. |
|
|
|
|
|
|
|
ароматическогоряда. |
|
|
|
|
|
|
|
Na2[Be(OH)4] |
|
|
|
|
|
|
|
|||||||||||||
оксидаазот(II)до |
|
|
|
сидаазота(IV) |
|
|
|
Этилен (по ИЮПАК: |
этен) |
— органическое хи |
|
Этагруппировотличаетсяхарактером |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
́ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
кислородомвоздуха: 2NO + O2 = 2NO2 |
|
|
|
мическоесоединение,описываемформулоей |
|
|
|
|
|
|
|
связеймеждуатомамиуглепридает |
|
|
|
|
|
|
Образованиекомплекссоединенийых |
|
|
|
|
|
|
||||||||||||||||
Взаимодействиеоксидаазот(IV)водой |
|
|
|
|
|
С2H4Является. |
|
|
|
|
|
|
|
|
содесоединениямржащимособые |
|
|
|
|
|
|
происходитзасчетэлектпаодногонныой |
|
|
|
|
|
|
|||||||||||||
избыткекислорода: 4NO2+ 2H2O+O2 = 4HNO3 |
|
|
|
простейшим алкеном(олефином)В.природе |
|
|
|
|
|
|
химичесвой,которсназкиетваываютсяе |
|
|
|
|
|
|
изсоединяющиатомов.Еслиоднаиздвухся |
|
|
|
|
|
|
|||||||||||||||||
Свойстваазотнойкислоты. |
|
|
|
|
|
|
этиленпрактичневстр.Этоескичается |
|
|
|
|
|
|
|
ароматическимисвойствами; |
|
|
|
|
|
|
молекулимеетатссвободными |
|
|
|
|
|
|
|||||||||||||
Вразбрастворвленазоткислотанаяых |
|
|
|
|
|
бесцветныйгорючигаз |
|
сослабымзапахом. |
|
|
|
|
б) алициклсоедичненияские |
|
– этовсе |
|
|
|
орбиталями,другая |
|
– спаройнеподеленных |
||||||||||||||||||||
полнодис:стью4NO2оциирует+ 2H2O + O2 = |
|
|
|
Частичнорастворимводе(25,6мл100мл |
|
|
|
|
|
|
|
|
остальныекарбоциклическиесо .динения |
|
|
|
|
|
|
электрон,томеждунимипровисход |
|
|
|
|
ит |
||||||||||||||||
4HNO3 HNO3 = H+ +NO3Азотнаякислота |
|
|
|
водыпри0°C),этаноле(359млвтехже |
|
|
|
|
|
|
|
|
Ониразличаютсяпочислуатомовуглерода |
|
|
|
|
|
|
донорно-акцепторнвзаимод.Атом, ействие |
|
|
|
|
|||||||||||||||||
проявляетвсетипичныесвойки:ствалот |
|
|
|
|
|
|
условиях)Хорошо. растворяетсядиэтиловом |
|
|
|
|
|
|
|
цивзависимостиклеотхарактсвязерай |
|
|
|
|
|
|
|
постанасвоязьлянеподеленнующий |
|
|
|
|
|
|||||||||||||
взаимодействуетоксидмет, миллов |
|
|
|
|
|
эфиреуглев.Содвойнуюодахержит |
|
|
|
|
|
|
|
междуэтиатомамимогутбыть |
|
|
|
|
|
|
|
пару,называется |
|
донор.Второйатом |
|
|
|
|
|||||||||||||
основаниями,солями: 2HNO3 +CuO = |
|
|
|
связьипоэтноситсяомукненасыщенным |
|
|
|
|
|
|
непредельными; |
|
|
|
|
|
|
предствакорбитальнтнуювляет,принимая |
|
|
|
|
|
|
|||||||||||||||||
Cu(NO3)2 + H2O Ba(OH)2 + 2HNO3 = |
|
илинепредельным |
углеводородам.Играет |
|
3) гетероциклическсоед. инения |
|
|
|
|
|
этунеподелннуюпару.Он |
|
|
|
|
|
|
|
|||||||||||||||||||||||
Ba(NO3)2 + 2H2O 2HNO3 + CaCO3 = Ca(NO3)2 |
|
чрезвычайноважнуюрольпромышленности, |
|
|
|
|
|
|
Вмолекулахэтихсоединенийимеютсяциклы, |
|
|
|
|
|
|
|
называется акцептором. |
Химическаясвязьот |
|
|
|||||||||||||||||||||
+ CO2 + H2O 2HNO3 + Na2SiO3 = H2SiO3 + 2 |
|
атакжеявляется |
фитогормоном.Этилен |
— |
|
которыевключают,кромеатомовуглерода, |
|
|
|
|
|
|
доноракакцепторуобоз |
|
|
начаетсястрелкой®. |
|
|
|||||||||||||||||||||||
NaNO3 |
|
|
|
|
|
|
|
сампроизводеоргансоединениеческоемое |
|
|
|
|
|
|
|
также гетероатомы. |
|
|
|
|
|
|
Пример. |
NH3 + BF3 = NH3BF3 |
|
|
|
|
|||||||||||||
Азотнуюкислотуиспользуютдля |
|
|
|
|
|
вмире[1];общеемировоепроизводство |
|
|
|
|
|
|
|
Вря дациклхжирных( ) ческих |
|
|
|
|
|
|
Ионы,находящиесявовнешнейсфере |
|
|
|
|
|
|
|
|||||||||||||
произвазотныхк дствамплексных |
|
|
|
|
|
этиленав |
2008году |
состави113миллионов |
|
|
|
|
карбоцикличсоединенийпростейшимиских |
|
|
|
|
|
|
комплексоедине,связаыхнийы |
|
|
|
|
|
|
|
||||||||||||||
удоб,сеифосфорнойенийнойкислот, |
|
|
|
|
|
тоннипродолжаетрастина2 |
|
|
|
—3 %вго |
д[2]. |
|
являютсяуглеводороды.Всеостальн е |
|
|
|
|
|
|
комплекснымиономвосновномсила и |
|
|
|
|
|
|
|
||||||||||||||
взрывчатыхвеществ,красителей,лекарств, |
|
|
|
|
|
Применение |
|
|
|
|
|
|
|
|
соединенияэтихрядоврассмкактриваются |
|
|
|
|
|
|
электростатичевзаимодействия. кого |
|
|
|
|
|
||||||||||||||
пластмасс,пленок,нитролаковнитроэмалей, |
|
|
|
|
Этиявлвяетсяндущим |
|
|
|
|
|
|
|
|
производныеуглеводородов,которые |
|
|
|
|
|
|
Комплексноесоединениепри |
|
|
|
|
|
|
|
|||||||||||||
искусственволокомпонент,ка ых |
|
|
|
|
|
продуктом основногоорганичсинтескогоза |
|
и |
|
обрзамещензоваодного,двухилыием |
|
|
|
|
|
|
|
электролитическойдиссоциацииобразуют |
|
|
|
|
|
||||||||||||||||||
нитрующейсмеси,длятрав |
|
|
ления |
|
|
|
применяетсядляполученияследующих |
|
|
|
|
|
|
|
несколькихатомовводорода |
|
|
|
|
|
|
|
комплексныеионыв сфешнейкакры |
|
|
|
|
|
|
||||||||||||
растворметалловметаллургииния. |
|
|
|
|
|
соединпер( веалфавитномйчслены |
|
|
|
|
|
|
|
углеводоромолекуледнойругиато ами |
|
|
|
|
|
|
сильныеэлектролиты. |
|
|
|
|
|
|
|
|||||||||||||
|
25. |
|
Кислоты, |
их |
классификацияи |
|
порядке): |
|
|
|
|
|
|
|
|
|
илигруппамиатомов. |
|
|
|
|
|
|
|
30. |
крахмалвприродегидролиз |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Винилацетат; |
|
|
|
|
|
|
|
|
Остатуглеводородов,киотооб азуютсяые |
|
|
|
|
|
|
1. |
Крахмалпредставляетсобойбелый |
|
|
|
|
|
|
||||||||
|
|
свойствана |
основе |
представлений |
об |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
электролитической |
диссоциации. |
|
Дихлорэтан / винилхлорид (3-еместо, 12 |
% |
|
приотнятииихмолекилиодного,двух |
|
|
|
|
|
|
|
порошок,нерастворимыйводе. |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
всегообъёма); |
|
|
|
|
|
|
|
|
|
несколькихатомовводорода, |
|
|
|
|
|
|
|
2. Вгорячв набухаетдн ийобразует |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Окисьэтилена |
|
(2-е |
место, 14 |
—15 %всего |
|
называютсяуградика. леводороднымиами |
|
|
|
|
|
коллоидныйраствор |
|
– клейстер. |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
объёма); |
|
|
|
|
|
|
|
|
|
Атомыилигруппыатомов,которыезамещают |
|
|
|
|
|
|
3. Являяпродуктомсь |
|
|
военияоксида |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Полиэтилен (1-еместо,до60 |
|
%всегообъёма); |
|
|
|
|
водород вуглеводоснове, родной |
|
|
|
|
|
углеродазелеными(IV)содержащими( |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
Стирол; |
|
|
|
|
|
|
|
|
|
образуют функциональные или характеристич |
|
хлорофилл)клеткамирастений,крахмал |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
Уксуки;слотаная |
|
|
|
|
|
|
|
|
|
еские(этотразработанмин |
|
|
|
|
|
|
|
распространенврастительноммире. |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Этилбензол; |
|
|
|
|
|
|
|
|
Междунасоюзомтеориодныметической |
|
|
|
|
|
|
4. Клубникартофесодержатоколо20я |
|
|
|
|
% |
||||||||||
Солянаякислота |
— водныйраствгазахлоро |
- |
|
Этиленгликоль; |
|
|
|
|
|
|
|
прикладнойхимии)группы, |
|
|
|
|
|
|
|
крахмала,зернапшеницыкукурузы |
|
|
|
|
– около |
||||||||||||||||
|
Этиловыйспирт. |
|
|
|
|
|
|
|
|
|
обусловливающобщиехимические |
|
|
|
|
|
|
70 %,риса |
– около80 |
%. |
|
|
|
|
|||||||||||||||||
водводе. рода |
|
^Химичесвой. ствакие |
|
|
|
Этилвсмкислоресиниспользовалсядом |
|
|
|
|
|
|
свойствавеществ,которыепринадлежат |
|
|
|
|
|
|
5. Крахмал – одноизважн |
ейшихпитательных |
||||||||||||||||||||
Кислотыизмецветняютд |
|
|
икаторов:лакмус |
|
|
|
медляицине |
|
наркоза вплотьдосередины80 |
-х |
|
однитомужеклассуп |
|
роизводных |
|
вещдлячеловекаств. |
|
|
|
|
|
|
|
||||||||||||||||||
окрашивкрасныйц,вметилоранжается |
|
— в |
|
годовХХвекаСССР |
|
|
инаближнемВостоке. |
|
|
|
|
углеводородов. |
|
|
|
|
|
|
|
Строениекрахмала. |
|
|
|
|
|
|
|
||||||||||||||
желтый. |
|
|
|
|
|
|
Этиявленяется |
фитогормоном практическиу |
|
Видыорганическихсоединений: |
|
|
|
|
|
|
1. КрахмалС(6H10O5)n |
|
|
– природныйполимер. |
|
|
|||||||||||||||||||
Приреакциисоснобразуетсяваниямисоль |
|
|
|
|
|
всехрастений[4],средипрочего[5] |
|
|
|
отвечаетза |
|
1) галогенопруглеводор:) изводные |
|
|
|
|
|
2. Образуетсяонврезультате |
|
|
|
|
|
|
|||||||||||||||||
водареакция(нейт)В. еакциюализации |
|
|
|
|
|
опаданиеиголухв. йныхк |
|
|
|
|
|
|
|
|
фторпр;б)хлорпроизводные; |
|
|
|
|
|
фотосиндеятельнорастенийтичепри тикой |
|
|
|
|
|
|||||||||||||||
вступаюткакрас, воримыеак |
|
|
|
|
|
Основныехимичсвойскиетва |
|
|
|
|
|
|
|
в)бромопроизвйодопроизводные,г) ; |
|
|
|
|
|
поглощеизлученияэнергисол ечногои. |
|
|
|
|
|
|
|||||||||||||||
нерастворимыедеснования: |
|
|
|
|
|
Этилен — химичактивноещество.скиТак |
|
|
|
|
|
|
2) кислороединениядосодержащие:) |
|
|
|
|
|
3. Сначалаизуглекислогогазаводы |
|
|
|
|
|
|
||||||||||||||||
Приреакциисосновнымиоксидами |
|
|
|
|
|
каквмолеатомамикждуглерода |
|
|
|
|
|
|
|
спиртыфенолы;б)простыеэфиры;в) |
|
|
|
|
|
|
|
результатерядапроцессовсинтезируется |
|
|
|
|
|
||||||||||||||
образуютсясоли: |
|
|
|
|
|
|
имеется двойнаясвязь,тооднаизних,менее |
|
|
|
|
|
|
альдегиды;г)кетоны. |
|
|
|
|
|
|
глюкоза,чтовобщемвидеможетбыть |
|
|
|
|
|
|
|
|||||||||||||
Кислотыреагируютметаллами, |
|
|
|
|
|
прочная,легкоразрыв,ипоместуаетсязрыва |
|
|
|
|
|
|
|
28. |
|
Классификациихимическихреакцийв |
|
выраженоуравнением: СO26 |
|
|
|
+Н2О 6= |
|||||||||||||||||||
находящимисявряду |
|
|
напряженийдо |
|
|
|
связипроисхприсоединениет, к, сление |
|
|
|
|
|
|
|
|
неорганическойхимии |
|
|
|
|
|
|
С6Н12O6 |
+ 6O2. |
|
|
|
|
|
|
|||||||||||
водор,приэтвыделяетсяомдагазообразный |
|
|
|
|
полимеризациямолекул. |
|
|
|
|
|
|
|
Класпосоставуификацияисходныхвеществ |
|
|
|
|
|
|
4. Глюкозадалеепревкрахмалращается: |
|
|
|
|
|
||||||||||||||||
водоиобрсольодазуется. |
|
|
|
|
|
|
Галогенирование: |
|
|
|
|
|
|
|
продуреа. кциитов |
|
|
|
|
|
|
|
nС6Н12O6 |
=С6H10O5)n( |
+Н2О.n |
|
|
|
|
||||||||||||
Получениекислот.Многиекислотыможно |
|
|
|
|
|
CH2=CH2 + Cl2 →CH2Cl —CH2Cl |
|
|
|
|
Реакциисоединения |
|
|
— |
из |
|
5. Макромолекулыкрахмаланеодинаковыпо |
|
|
|
|
|
|||||||||||||||||||
получитьреакциикислотныхок идов |
|
|
|
|
|
Происходитбесцвечиваниебромнойводы. |
|
|
|
|
|
|
|
несколькихвеществ(простыхилисложных) |
|
|
|
|
|
|
размерам:)вн |
ихвходразноечизвеньевтсло |
|
|
|
|
|||||||||||||||
водой: |
|
|
|
|
|
|
|
Этокачественнаяреак |
|
циянанепредельные |
|
|
|
|
образуетсясложноевеществоРеакции^ |
|
|
|
|
|
|
С6H10O5 |
– отнесколькихсотдо скольких |
|
|
|
|
||||||||||||||
^Концентр ировасеркислотанприная |
|
|
|
|
соединения. |
|
|
|
|
|
|
|
|
разложения |
|
|
|
|
— |
|
тысяч,приэтомнеодинаковаих |
|
|
|
|
|
|
||||||||||||||
обычтемпндойеерайствунамногиеурет |
|
|
|
|
|
Гидрирование: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулярнаямасса;б)разлонипочаются |
|
|
|
|
|
|
|||||||||

строению:нарядулинейнымимолекуламис |
|
|
некослучаяторыхакжелегирующие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
молекулярноймассойвнесотенколькотысяч |
|
|
|
|
|
элементы(Cr,идр.)КакNi,.правило, V, Al |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
имеютсямолекулыр |
|
|
азветвленногостроения, |
|
чугун хрупок. |
|
|
|
|
|
Мета,ихположениевпериодическойлы |
|
|
|
|||||||||||
молемассакуляотод рстигаетнаяых |
|
|
|
|
|
Взависимоотсодержанияуглсертиодаый |
|
|
|
|
32. |
|
|
|
|||||||||||
нескоми.ллионовьких |
|
|
|
|
|
чугунназываетсядоэвтектическим(2,03 |
|
|
-4,3 % |
|
системехимическихэлементов |
|
|
|
|
||||||||||
Крахмкакпитвеществоательное. |
|
|
|
|
|
углерода),эвтектили(4,3ческим%) |
|
|
|
|
Д.И.Менделеева |
|
|
|
|
|
|
|
|||||||
1. Крахмал являетсяосновнымуглеводом |
|
заэвтектическим(4,3 |
-6,67Составсплава%). |
|
|
Общиехимичесвойметалловс. киетва |
|
|
|
|
|
|
|||||||||||||
нашейпищи,нооннеможетсамостоятельно |
|
|
влияетнаструктуруматериала. |
|
|
|
|
Впериодическойсистэлемеметаллывнтов |
|
|
|
|
|||||||||||||
усваиватьсяорганизмом. |
|
|
|
|
|
+Поспоспроизводствастальбу |
|
можетбыть |
|
основномрасп |
|
|
олагаютсявглавных |
|
|
|
|||||||||
2. Подобножи,красначалахмал |
|
|
|
|
|
мартеновской,конверте,элект, рнойосталью |
|
|
подгруппахI |
—Illгрупп,атакжевпобочных |
|
|
|
||||||||||||
подвергаетсягидролизу. |
|
|
|
|
|
электрошлаковогоперепиполученнава й |
|
|
|
|
подгруппах. |
|
|
|
|
|
|
|
|
||||||
3. Этотпроцессначинаетсяужепри |
|
|
|
|
|
другимиспособами.Иногдатрещебу тся |
|
|
|
|
Строениеметаллов. |
|
|
|
|
|
|
|
|
||||||
пережевываниипищивортуподдейств ем |
|
|
|
большееуточнение,напрк слая"мер |
|
|
|
|
Отличитособвстроенинностильные |
|
|
|
|
|
|||||||||||
фермента,содержащегосявслюне. |
|
|
|
мартеновскаясталь"и.п.Очастоеньот |
|
|
|
|
атомовметаллов |
|
|
— ихбольшиепосравнению |
|||||||||||||
4. Далеегидкролизахмалапродолжаетсяв |
|
|
споспрозависятизводствабанеко орые |
|
|
|
|
снеметалламиразмерырадиус( )небольшое |
|
|
|
|
|||||||||||||
кишечнике. |
|
|
|
|
|
особенностикачествам |
|
еталла.Например, |
|
|
числоэлектроновнавнешнемэнергетиче |
|
|
ском |
|||||||||||
5. Образующглюкозвсасываетсячерезяся |
|
|
несмотряодинакхимическийовыйстав |
|
|
|
|
уровнекак(правило, 1 |
|
|
|
|
-2электрона,режеили3 |
|
|
||||||||||
стенкикишечникавкровьпо |
|
|
|
ступаетв |
одинаковуюпослтедующуюрмообработку, |
|
|
|
4)Этим.объяслабаявнешнихетсязь |
|
|
|
|
||||||||||||
печень,аоттуда |
– вовсетканиорганизма. |
|
свойстсноикислойвмартеновскойной |
|
|
|
|
(валентных)электсядиспособностьроновм |
|
|
|
|
|||||||||||||
6. Избыглюкозытоклагавпечввидетсяни |
|
|
|
|
|
сталиразличны,этоучитывают |
|
|
|
|
атомовметалллегкотдаэтиэлектронывать, |
|
|
|
|
||||||||||
высокомолекулярногоуглевода |
– гликогена. |
потребителиэтойстали,сталеплавильщики. |
|
|
|
превположительращаясьзаряженныео |
|
|
|
|
|||||||||||||||
Особенностигликогена: |
|
|
|
а)построению |
Поназначениюможновыделитьследующие |
|
|
|
|
ионы. |
|
|
|
|
|
|
|
|
|
||||||
гликогенотличкрабольшейхмалается |
|
|
|
|
|
основныегруппыстал: й |
|
|
|
|
Этотпробрцесс,катиом |
|
|
|
|
|
ныметаллов |
||||||||
разветвленностьюсвоихмолекул;б)эт |
|
|
от |
1Конструкционная. сталь,которую |
|
|
|
|
могутвновьпритягиватьксебеэл нектроны( |
|
|
|
|
||||||||||||
запасныйгликогенмеждуприемамипищи |
|
|
|
|
|
применяютизготовлеразличныхии |
|
|
|
|
толькосвои»,«н чужие«»,тоесть |
|
|
|
|
|
|
|
|
||||||
сновапревглюкозуращаетсяпомере |
|
|
|
|
|
металлоконсдлястрои( трукцийельства |
|
|
|
|
«поте»дратоугиянные)Иными. ами |
|
|
|
|
||||||||||
расходеевклеткоргвания. низмах |
|
|
|
|
|
зданий,мостов,разлмашинт.пчных.). |
|
|
|
|
словами,электронысвободноперемещаются |
|
|
|
|||||||||||
Применениекрахмалаполучениеегоиз |
|
|
|
|
|
Конструкционныесталимогутбытькак |
|
|
|
|
объме,явтамелобщимияютсяла, |
|
|
|
|
||||||||||
крахмалсодержащихпродуктов. |
|
|
простымиуглеродистыми,так |
|
|
|
|
«коллекти»,назытакжевнымиаемыми |
|
|
|
|
|||||||||||||
1. Крахмалиспользуетсянетолькокакпродукт |
|
|
|
легированными (например,марганцовистая |
|
|
«электроннымг |
|
азом»Эти.электроныи |
|
|
|
|||||||||||||
питания. |
|
|
|
|
|
|
сталь,хромистаясталь)Легированная. сталь |
|
|
|
|
обеспечиваютхимичсвязьметаллов.Вскую |
|
|
|
|
|||||||||
2. Впищевойпромы |
|
|
шленнизнегготовятсти |
|
несколькодорожеуглеродистой, таккакона |
|
|
|
|
отличиековалентнсвязичаще(всегой |
|
|
|
|
|||||||||||
глюкозуипатоку. |
|
|
|
|
|
|
обладаетзначилучшимиельно |
|
|
|
|
образупаройэлемеждуктроновдвумяой |
|
|
|
|
|||||||||
3. Дляполучеглюкозыкрахмалнияагревают |
|
|
механическисвойства,торасходеена ми |
|
|
|
|
соседниатомами),металлическая |
|
|
|
|
|||||||||||||
сразбавленнойсернойкислотойтечение |
|
|
|
|
|
изготовлениетехилииныхконструкций |
|
|
|
|
связь делокализованамногоцентровая( ). |
|
|
|
|||||||||||
несколькихчасов. |
|
|
|
|
|
знач,ичемжетеугльноердис |
|
той. |
|
|
Металлическаясвязь |
- этосвмязь |
|
еталлах |
|||||||||||
4. Когдапроцессгидролизазакончится, |
|
|
|
2Топ. икочнтельнаяст |
|
|
— |
|
междуатомамиионами,образованнаязасчет |
|
|
|
|
||||||||||||
кислонеймеломтрализуют,образующийся |
|
|
низкоугста,применяемаяльеродистаядля |
|
|
|
|
обобщэле.кстроноввления |
|
|
|
|
|||||||||||||
осадоксульфатакальцотфияль |
|
|
|
тровываетсяи |
изготовленияпарк выхопоклов.Эта |
|
|
|
|
Металлическаясвязь |
бываетнетолько |
|
|
||||||||||||
растворупаривается. |
|
|
|
|
|
стальдолжнаиметьхорошиепластические |
|
|
|
|
чистыхменоталкжеарактернахдля |
|
|
|
|
||||||||||
5. Еслипроцессгидрне двлизаодить |
|
|
|
свойствахол дн,хорошояниим |
|
|
|
|
смесейразныхмета,спвлраовзныхов |
|
|
|
|
||||||||||||
конца,товрезультаполг частеаятся |
|
|
|
|
|
свариваться,недолжнаиметьсклонности |
|
|
|
|
агрегасос.тоянияхных |
Металлическаясвязь |
|||||||||||||
сладкаямасса |
– смдеськстриновглюкозы |
– |
старению. |
|
|
|
|
имеетважное |
|
|
значениеобуславливает |
||||||||||||||
патока. |
|
|
|
|
|
|
3Стал. |
ьдляжелезнодортранспортажного |
— |
|
основныесвойстваметаллов |
|
|
|
|
|
- |
||||||||
Особенностипатоки: |
|
|
а)онаприменяетсяв |
|
рельсовосеваясталь, ,стальдля |
|
|
|
|
электропроводность |
– |
беспорядочное |
|||||||||||||
конделдитприготовленияярском |
|
|
бандажейжелезнодорожныхколес.Это |
|
|
|
|
движениеелектронобъм .Нталламеприов |
|
|
|
|
|||||||||||||
некоторых сортовконфет,мармелада, |
|
среднеуглеродистаясталь,кней |
|
|
|
|
небольшойразностипотенциаловчтобы, |
|
|
|
|
||||||||||||||
пряниковт. |
п.б;)спаткондитерскиекой |
|
предъявляютсявысокиетребованияпри |
|
|
|
|
электроныдвигалисьупорядоченно.Металами |
|
|
|
|
|||||||||||||
изднкажутсяелияприторно |
|
|
|
-слад,какими |
механическиспытаниях,например, |
|
|
|
|
случшейпроводимоявляютAg, Cu,стьюя |
|
|
Au, |
||||||||||||
приготовленныеначистомсахаре,долго |
|
|
|
|
|
усталость,припроверкесплошности |
|
|
|
|
Al. - |
пластичность |
Связимеждуслоями |
|
|
||||||||||
остаютсямягкими. |
|
|
|
|
|
структурыметалла. |
|
|
|
|
металланеоченьзначительны,этоп зволяет |
|
|
|
|
||||||||||
6. Декстрины,получизкр,ахмыеала |
|
|
|
4Подшипников. стальслужитматериаялом |
|
|
|
|
перемещатьслподнагрузкойи |
|
|
|
|
||||||||||||
используютсявкачествеклея.Крахмал |
|
|
|
|
|
дляизготовленияшариковыхроликовых |
|
|
|
|
(деформирметаллнеломаяег). вать |
|
|
|
|
||||||||||
применяетсядлякрахмалениябелья:под |
|
|
подшипн.Кэтойстали,содержащейоколоков |
|
|
|
|
Наилучшедеформирующиесяметалы |
|
|
|
||||||||||||||
действиемнагреваниягорячимутюгомон |
|
|
|
|
|
1Си%1,5Сгпредъявляют%оченьвысокие |
|
|
|
|
(мягкие)Au, |
Ag, |
|
Cu. |
- |
металлический |
|||||||||
превдекстриныращается,которыесклеивают |
|
|
|
требпосодержаниюваниянеметаллических |
|
|
|
блеск |
Электронныйгазотража |
етпочтивсе |
|||||||||||||||
волокнатканиобразуютплотнуюпленку, |
|
|
|
|
|
включений. |
|
|
|
|
световыелучи.Вотпочемучистыеметакллы |
|
|
|
|
||||||||||
предохраняющуютканьотбыстрого |
|
|
|
Соединяяжелезос |
|
углеи,продоми |
|
|
сильноблестятчащевсе |
|
|
|
|
гоимсеилиютнрый |
|||||||||||
загрязнения. |
|
|
|
|
|
необходимости,разлегирующимиичными |
|
|
|
белыйцвет. |
|
|
|
|
|
|
|
|
|
||||||
Гидкрахмалаолиз |
|
|
– |
этопробменацесс |
|
элементами,витогеполучаютсталь.Методов |
|
|
|
|
Сильныевосстановители: |
Me0 – nē |
Men+ |
||||||||||||
междуионамивещ |
|
|
|
естваиводой,который |
|
еевыплавкидостатоколи.Особочествоно |
|
|
|
|
33. |
многоатомспиртыстроениые |
|
|
|
||||||||||
можбытьферментативнымилик слотным. |
|
|
отметимкислородно |
|
-конверторныйи |
|
|
|
физическиехимичесвой киетва |
|
|
/гицерин |
|
||||||||||||
Химгидческролахмалаийз |
|
|
|
- |
реакция |
электр,которыеявляютсяпавильный |
|
|
|
|
Многоатомныеспиможнорты |
|
ассматривать |
|
|||||||||||
каталитическая,таккакпроисходитпри |
|
|
|
|
|
самымисовременными |
|
|
|
|
какпроизводныеуглев,к торыходов |
|
|
|
|
||||||||||
нагреванииприсутствиинеорган ческих |
|
|
высокопродуктивными.К |
онверторнаяплавка |
|
|
нескатводородалькомовзамещенына |
|
|
|
|
||||||||||||||
кислот.Входеданной |
|
|
|
химической |
характеризусвоейскоротетсячностью |
|
|
|
группыОН. |
|
|
|
|
|
|
|
|
|
|||||||
реакции образуетсяглюкоза,котможнорую |
|
|
получениемвитогесталитребуемым |
|
|
|
|
Двухатомныеспирты,называютсядиолами |
|
|
|
|
|||||||||||||
выразитьуравнением: |
|
|
|
|
|
химичесоставо.О процессанкимву |
|
|
|
|
илигликолями,трехатомные |
|
– |
трилиолы |
|||||||||||
(С6Н10О5)n кат+. |
H2SO4+t°)nH2O +( = |
|
|
составляпродувкажидкогометалла |
|
|
|
|
глицерины. |
|
|
|
|
|
|
|
|
||||||||
nC6H12O6. |
|
|
|
|
|
кислородомчерезфурму,врезчегольтате |
|
|
|
|
Физичесвойспиртов. киетва |
|
|
|
|
|
|
|
|
||||||
Новпослврбольшеднеемяпопулярностью |
|
|
чугунокисляетсятрансформируетсявсталь. |
|
|
|
Многоатомныеспирты |
– этовязкиеж |
идкости, |
||||||||||||||||
приобферментативныйетаетгидролиз |
|
|
ПрокатМногиезаводыметаллургииимеютв |
|
|
|
|
сладкоговкуса,хорастворимыеошоде |
|
|
|
|
|||||||||||||
крахмала.Использу |
|
|
яспециальныетехнологии, |
|
своемсоставепрокатгруппуцехов.Внихую |
|
|
|
|
этан,плолехо |
|
|
– |
вдругихорганических |
|||||||||||
изнегополучают |
|
|
этиловыйспирт, |
патокуи |
производяткакполуфабрикаты,такуже |
|
|
|
|
растворителях.Этиленгликольсильныйяд. |
|
|
|
|
|||||||||||
глютакже, иозуакприх мическом |
|
|
|
полностьюготовупрод.Сущностькцию |
|
|
|
|
Взаимодсактивнымействталлами: е |
|
|
|
|
||||||||||||
гидролизе. |
|
|
|
|
|
процессазаключаетсявпропускеметаллав |
|
|
|
|
Взаимодействиесощелочами. |
|
Введение |
||||||||||||
|
31. |
чугунисталь |
. |
|
|
|
зазомеждувращающимися |
|
|
|
|
молекудопогрупплОНнительных, |
|
|
|
|
|||||||||
|
Простоев |
еществожелезо |
|
|
— ковкийметалл |
противоположныхнаправл |
|
енияхвалками |
|
|
являющихсяэ |
|
лектроноакцеп,усиливаеторами |
||||||||||||
серебристо-белогоцветасвысокой |
|
|
прокст.Причематногонаключевым |
|
|
|
|
кисвлспиртовтныейства,таккак |
|
|
|
|
|
|
|
|
|||||||||
химическреакционнойспособностью: |
|
|
моменявляетрасстоянието,чтоммежду |
|
|
|
|
происходитделокализацияэлектронной |
|
|
|
|
|||||||||||||
железобыстрокорродируетпривысоких |
|
|
|
|
|
валкадолжнобытьменьшеи,чемтолщина |
|
|
|
|
плотности. |
|
|
|
|
|
|
|
|
||||||
темпеиливысокойриатурвлажностих |
|
|
|
пропусказаготовки.Засчэтогометаллмой |
|
|
|
|
Взаимодействиегидроксидамитяжелых |
|
|
|
|
||||||||||||
воздухе.Вчистомкислородежелезогорит,ав |
|
|
|
|
|
втягиваетсяпросв,пер итогемещается |
|
|
|
|
металлгидроксидом( меди)в |
|
– качественная |
||||||||||||
мелкодисперсномсостоянииса |
|
мовозгорается |
деформируетсядозаданныхпараметр |
|
ов. |
|
|
реакциянамногоатомныеспирты. |
|
|
|
|
|||||||||||||
инавоздухе. |
|
|
|
|
|
|
ЛегирЭтпроцессзаключаетсявание |
|
|
|
|
Взаимодейстгалогеновиеод |
ородами: |
||||||||||||
Плотнопри( .у.):г/см³7,874ть |
|
|
|
|
|
изменениисосталипосредствомва |
|
|
|
|
Взаимодействзованиемки обрлот и |
|
|
|
|
||||||||||
Температураплавления: 1812 K |
|
|
|
|
|
внедрениянеерассчитанныхконцентраций |
|
|
|
|
сложныхэфиров: |
|
|
|
|
|
|
|
|
||||||
Температуракипения: 3134 K |
|
|
|
|
|
вспомогательныхэлементовдля |
|
|
|
|
а)сминеракислотамиьными |
|
|
|
|
||||||||||
Впромышжелезопоизенностиучают |
|
|
|
последующегоприданияейопределенных |
|
|
|
|
Нитроглицерин – |
бесцветнаямаслянистая |
|||||||||||||||
железнойруды,восновномизгематита |
|
|
|
|
|
свойств.Вчисленаиболеечастоприменяемых |
|
|
|
жидкость.Ввидеразбавленнспиртовых |
|
|
|
|
|||||||||||
(Fe2O3)имагнетита· Существуют2O3). |
|
|
легирующихкомпоненто |
|
взначатся:марганец, |
|
|
растворов(1%)применяетсястенокардии, |
|
|
|
|
|||||||||||||
различныеспособы |
|
|
извлжеизрудчл.енияза |
|
титан,коба,воль,алюминийфрамт. |
|
|
|
|
т.к.оказываетсосудорадейстширяющее |
|
вие. |
|||||||||||||
Наиболеераспространённымявляется |
|
|
|
|
|
|
|
|
Гидролиз жиров.Глицеринбылполучен |
|
|
|
|||||||||||||
доменныйпроцесс. |
|
|
|
|
|
|
|
|
|
|
|
гидролизом жиров,которыея ляются |
|
|
|
||||||||||
Чугун— сплавжелезауглеродомс |
|
|
|
|
|
|
|
сложнымиэфирамиглицеринавысших |
|
|
|
|
|||||||||||||
содержаниемболее2,03точка % |
( |
|
|
|
|
|
|
|
|
гомологуксукиисихонллефиновыхойты |
|
|
|
|
|||||||||||
эвтектическогопревращениянадиаграмме |
|
|
|
|
|
|
|
|
|
изологов.Пригидролизежировперегретым |
|
|
|
|
|||||||||||
состояний)Углер. вчугунем жетд |
|
|
|
|
|
|
|
|
|
|
|
паромглицериностаетсявводномрастворе, |
|
|
|
|
|||||||||
содержатьсяввидецементитаграф |
|
|
|
|
ита.В |
|
|
|
|
|
|
которыйотделяют |
|
|
|
|
отслоярасплавленных |
||||||||
зависимостиотфогрмыафитаколчества |
|
|
|
|
|
|
|
|
|
жирныхкислот. |
|
|
|
|
|
|
|
|
|||||||
цементита,выд:бел,серый,яютковкий |
|
|
|
|
|
|
|
|
|
|
|
Прищелочномгидролизежировполучают |
|
|
|
|
|||||||||
высокопрочныечуг.Чусодержатгуны |
|
|
|
|
|
|
|
|
|
|
|
натриевыесоливысшжирныхк слот |
|
|
|
|
|||||||||
постоянныепримеси(Si,ав Mn, |
S, |
P), |
|
|
|
|
|
|
|
|
– мыла.Отсюдапроцессгидрсл лизажных |
|
|
|
|
||||||||||
эфировпридействиищелочей |
|
||
называется омылением.Внастоящеевремя |
|
||
этотпроцесслежитвосновеполучен |
ия |
||
глицеринадлякосметических |
|
||
фармацевтическихцелей. |
|
||
34. |
Неметаллы,ихположениев |
|
|
периодхимическихческойсистемеэлементов |
|
||
Д.И.Менделеева . |
|
||
Придвижениисверхувнизпогруппам |
|
|
|
увеличрадатомаиследовательноваетсяус |
|
||
уменьшаюокисливойтельныесят |
ва. |
||
^Сравнительная |
|
||
характеристика окислительно- |
|
||
восстановиеметалловьныхсвойствна |
|
||
примерекислородасеры. |
|
||
Схемыэлектронныхоболочек: |
|
||
Навнешнемэлектроуроватомовнноме |
|
||
кислородасерынаходитсяпоэлектронов6 . |
|
||
Укислородаоки лительныевойства |
|
||
выражесиль,таккакрадиуснееатомаы |
|
||
меньшеивалентныеэлектронысильнее |
|
||
притягиваются |
|
||
|
|
кядру.Длякислорода |
|
|
|
наиболхарактернаст пень |
|
|
|
окисления — |
|
|
|
2,проявляющаясяпри |
|
|
|
достройкевнешн го |
|
|
|
энергетическогоуровнядо8 |
|
|
|
электронов. |
|
|
|
Сератакжеможетявлять |
ся |
|
|
окислите,проявлемяя |
|
|
|
степеньокисления |
—2,но |
|
|
характакжестерныпени |
|
|
|
окисления+4припотере( 4 |
- |
|
|
элект)и+6прио(новтере |
|
|
|
всехшестивалентных |
|
электронов). Вреакцсметалламисераяхлороди проявляюткисливойства, ельные
образисульфяоксиды идысоответственно: Вреакцснеметаияхпрслоламиродявляет свойствакислителя:
Сераможетбытькакислителем.
35. обратимостьреакций. Химическспосегоеравновесиеибы
смещения
Необратимыереакциипротекают дополногоднисхорасходованияг издных вещ,т.е. содноизтвлиполучающихся веществвыпадаетосадокиливыделяется видегаза:
^Обратимыееакциипротекают додостижениясостояния химическогоравновесия.
Химическоеравновесие — состояние,при которомскоростипрямойоб атнойеакций равны.
Обратимыееакциипротекаютдодостижения состоянияравновесия. Обратимостьмногихреакцийкажущаяся.Так, реакцводородасияслородсобразованием водыкажетсяобратимой.Однакопри темперС2000°сзаметнойскоростьютуре протекаетбратныйпроцесс
— разложенкислородиеводынаводороди устанрав.ноливесиеается Смещениехимическогоравновесияпри измененописываетсяусловий принципом Ле-Шателье. ^Приизменениивнешнихуслора новесиеий реакциисмещаетакимобразом,ч сяобы уменьшитьэтовоздействие.
Смещенравновпризмененииисия температуры.Вслучаеэкзотермической реакциипротекающей( свыделениемтепла) равносмещаетсяиевлево( рону исходныхвеществ)при
повышении темпе,ивправоатуры (встопронудктов реакции)при
понижений
температуры: | Вслучае
эндотермической
реакциипротекающей( споглощениемтепла) равновесиесмещается вправоприповышении температурыивлево припонижении температуры: ^Смещение равновесияпри изменениидавлен. я Еслиреакция протекаетс увелчислачением
молекулгазообразныхвеществ,при повышениидавлеравсмещаетсяияовесие влево,апринижениидавленияправо:

Еслиреакцияпротекаетсуменьшениемчисла |
|
|
|
|
|
Растворимостьмалорастворимыхсолейводе |
|
|
|
|||||||||||||
молекулгазообразныхвеществ,топри |
|
|
|
|
|
|
|
|
тожеум :ньшается |
|
|
|
|
|||||||||
повышениидавлеравсмещаетсяияовесие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
вправо,припонижений |
|
давле: нияво |
|
|
|
|
Слеванаправостворимостьгалогенидов |
|
|
|
||||||||||||
Еслиреакцияпротекаетбезизменениячисла |
|
|
|
|
|
уменьшается.АgFхорастворимошо |
|
|
||||||||||||||
молекулгазообразныхвеществ,топри |
|
|
|
|
|
|
|
|
воде. |
Всегалогенывсвободномсостоянии |
|
– |
||||||||||
изменениидавленрав смещаовесиея: тся |
|
|
|
|
|
окислители.С какхлаислителей |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
снижаетсяотфторакйоду.Вкристаллическом, |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
жигаздкосостоямбразвсе номии |
|
|
|
||||
|
|
. |
|
Общаяхарактеристика |
|
|
|
|
|
|
галогенысущесввидетдельныхвуют |
|
|
|
||||||||
|
36 |
|
|
|
|
|
|
молекул.Атомныерадиусывозраст |
|
|
аютвтом |
|||||||||||
|
высокоединениймолекулярных:состав, |
|
|
|
|
|
женаправлении,чтоприводкповышениют |
|
|
|
||||||||||||
стреакции, оение,лежащиевосновеих |
|
|
|
|
|
|
|
|
темплавленияературыкипения.Фтор |
|
|
|
|
|||||||||
получения . |
|
|
|
|
|
|
|
|
|
диссоциируетнаатомылучшейода. |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электродныепотенциалыприпереходевниз |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
подгруппегалогеновснижаются.Уфтора |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
самыйвысокийэлектродныйпотенциал. |
|
Фтор |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– самый сильныйокислитель.Любой |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вышестоящийсвободныйгалогенвытеснит |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нижест,нахвсостояниидящийся |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отрицательногооднозарядногоионав |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
растворе. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
38 |
. общиенаучныепринципыорганизации |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
химичеспроизводствасернаякислотаого |
|
. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кихчислуотносят: |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1)си нтезновыхвеществикомпозиций, |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
необходимыхдлярешетехническихзадач; я |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2)увеличэффудобренийниективностидля |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
повышенияурожайности |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сельскохозяйственнойпродукции; |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3)синтезпродуктовпитанияиз |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
несельсырьякохозяйственного; |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4)разработкаисоздан |
|
иеновыхисточников |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
энергии; |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5)охранаокружающейсреды; |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6)выяснемеханизмажнейших |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
биохимичепроцих сализациивсовких |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
искусловияхственных; |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7)освоениеогромныхокеанических |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
источниковсырья. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Научнуюосновухимическойпромышленности |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
составляетхимическаятехнология.Главна |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
задачахимическтехнолойгии |
– этоизучение, |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разработкаинепрерывноесовершенствование |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
производств,средствзводства |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
предметовпотребления. |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стоитотметить,чосновнойцельюявляется |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
непростополучцелениевого |
|
|
родукта, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
масспропродуквоеизводспри твоа |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
минимальныхзатратахресурсовтруда,сырья, |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
энергии,минимальныхкапитальных |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вложеиминиущербемальномдляях |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
человекаиокружающейприс . дыной |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Совершенсуществующованиех |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
технолпроицессовгических |
|
разработка |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
принципиальноовыхвключаетследующие |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
требования: |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1Недопустимость. ра ходовырьяэнергии |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
избытком.Насегодден10%сырьяяшний |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
идетвпроизводство,а 90% |
- |
вотходы. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эффективниспользованияэнергиисть |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
составляетвсего30%. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2Строгое. с |
облюдениеэкологических |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
требований,защитаокружающейсредыот |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
выбрасываемыхотходовпроизводства. |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3Потребность. произвматериалыдлееть |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
высокогокачества. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4Соотв. темпатствиерестртехнологиийки |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
проитемпазводстваразвитиярыночной |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конъюнктуры (ресурсивремяжизни |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
техническоборудованияго |
– |
10-40лет, |
|||||
|
37. |
|
|
общаяхарактеристикаподгруппы |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
технологиявидеаледолжнабытьочень |
|
|
|
|
||||||||||
галогенатомовстроениезможные |
|
|
|
|
|
|
|
гибкой,длятогочтнабыдноборудованиим |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Галогены – элементыVIIгруппы |
– фтор,хлор, |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
изготовлятьразныепродукты). |
|
|
|
|
||||||||||||||
бр,йод,астатм(мизученалотвсвязи |
|
|
|
|
|
|
|
|
Создатьтехнологию,удовлетворяющуюэтим |
|
|
|
||||||||||
егорадиоактив)Галоге. ностьюы |
– |
ярко |
|
|
|
|
||||||||||||||||
|
требова,м жпираясьнследующиеоиям |
|
|
|
||||||||||||||||||
выраженныенеметаллы.Лишьйодредких |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
принципы: |
|
|
|
|
||||||||||
случаяхобн |
аружинекоторыесвает,ойства |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
1Внедрение. достиженийфундаментальных |
|
|
|||||||||||||||
схожиеметаллами. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
науквтехнолпр.оцессыгические |
|
|
|
||||||||||
Вневозбужденномсостоянииатомыгалогенов |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
2Зам. ипенареходновыеапринципы |
|
|
|
||||||||||||
имеютобщиеэлектронную |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
организациипромышлструктурзаме( нныха |
|
|
|
||||||||||||
конфигурацию: |
ns2np5Этозначит,что. |
|
|
|
|
|
дифференциальноймонофункциональной |
|
|
|||||||||||||
галогвалентныхиме7ютэлектронов, |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
структурыпроизводстванаинтегральную). |
|
|
|
||||||||||||
кромефтора. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
3Внедрение. до |
стиженхимиивовсе й |
|
|
||||||||||
Физичесвойгалогеновс: киетва |
|
|
|
F2 |
|
– |
|
|
|
|||||||||||||
|
|
|
|
|
технолпрохцессыгимизацияческие( |
|
|
|
||||||||||||||
бесцветный, |
рудносжижающийсягаз; Cl2 |
|
|
– |
|
|
|
|
||||||||||||||
|
|
|
хозяйства). |
|
|
|
|
|||||||||||||||
желто-зелегко, сжижающийсяныйгаз |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
Такимобразом,химическаятехнология |
|
– это |
|||||||||||||||
резкимудушливымзапахом; Br2 |
|
|
|
– жидкость |
|
наукаонаибэкономичныхлееэкологически |
|
|
|
|||||||||||||
красно-бурогоцвета; I2 |
|
– кристаллическое |
|
целесоспособахисредствахбразных |
|
|
|
|||||||||||||||
вещестфиолетовогоц. ета |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
массовойхимичперсырьяескойработкив |
|
|
|
|||||||||||
Водныераствгалорыгеноводородовобразуют |
|
|
|
|
|
продуктысзаданнымисв |
|
ойствами. |
|
|
||||||||||||
|
|
|
|
|
Основприхимическогонцыепы |
|
|
|
||||||||||||||
кислоты.НF |
– фтороводороднаяпл( |
авиковая); |
|
|
|
|
||||||||||||||||
|
производства. |
Всоврехименныхических |
|
|
||||||||||||||||||
НCl |
|
– хлороводороднаясоляная();НBr |
|
|
– |
|
|
|
||||||||||||||
|
|
|
|
производствахш рокоспбщиельзуются |
|
|
|
|||||||||||||||
бромоводородная;НI |
– йодоводородная.Силы |
|
|
|
|
технологичпринципы:непрерывностьские |
|
|
|
|||||||||||||
кислотсверхувнизснижаются.Плавиковая |
|
|
|
|
|
процесса,противоток,кипящийслой |
|
|
|
|
||||||||||||
кислотаявляетсясамойслабойряду |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
(псевдоож),утилизациятеплотыжение |
|
|
|
||||||||||
галогеново-дородныхкислот,а |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
реакцииблагодарятеплоо( |
|
|
бмену), |
||||||||||||||
йодоводородная |
– самойсильной.Это |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
комплексноеиспользованиесырьяотходов |
|
|
|
||||||||||||||
объясняетсятем,чт |
|
|
оэнергиясвязиНгсверху |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
производства. |
|
|
|
|
|||||||||||
уменьшается.Втомженаправлении |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
Принципнепрерывностипроцесса. |
|
Процессы |
|||||||||||||
уменьшаетипрочномолекулыНГ,чтостья |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
бываютнепр, ерывныеиодические |
|
|
|
||||||||||||
связаноростоммежъядерногорасстояния. |
|
|
|
|
|
|
|
циркуляци.Внепрерывныхоцессанные |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
исходноесырьенепрерывноподается реакционныйап,паратродукты химическоговзаимодействияотводятсяиз аппарата.Принципнепрерывности использвпроизводствечугуна,приется обжигеиз,вконтактноместиспособе производствасернойкислоты,присинтезе аммиакавпроизводствеводяногогаза.
Впериодичепроцесстадиикоме смешивания реагирующихвеществ,химического взаимовыдепродуктовйствияления реакции,состав,следклдряющиезауютг другомипериодическивторезяются определенныепромвремени.Вкаждомжутки цикпротеканияусловияреакции
непрерывноизмен яют,таккакстечениемя времениконцентрацияисходныхвеществ уменьшается,чтоведеткснижениюскорости реакции,измт нениюмпературы.д.
Вследствиеэтогопериодичепроцесскиеы менеепроизводительны.Ихиспользуют
производствестали,кокса,соля нойкислоты др.
Принципкипящегослоя (псевдоожижения). Дляобразованиякипящего слоягазообразнчерезреагентпродуваюты отверстияснизуаппарата,находящиесявнем твердыеисходныевеществаприэтомкакбы кипят,находясьвсевремявовзвешенном состоянпринц.Этотполучилш рокое распространениевхимической промышленностидляинтенсификации гетерогенныхпроцессов,..химическогоили физическвзаимодвещ, гоействия находящивразныагрегасосхсятоянияхных
(обжигпиритавпроизводствесе рнойкислоты, каталитическийкрекингнефтепродуктов, сушкавлажныхм териалов,сорбцияиз газовыхсмесейирасит.д.)воров.
Принцтеплотыутилизации реакции. Утилизтеплотыре,а..циякции использованвыделяющейсяприх мических
взаимодействияхте плотыдляподогрева исходногосырьяилидальнейшейтеплово обработкиобразующихсяпродуктов, позволяетрезкоснижатьпроизводственные энергетическиезатр.Например,вты произвчугунадоподаютмнудствевоздух, нагретыйзасч плотыисходящих реакций.
39. Общиеспособыполученияметаллов.
Металлынаходятсявприроде преимуществвидесо .Толькодиненийно металлысмалойхимическактивнойстью (благороднвстречаютсяметалл) ы прирвсвосостояниибодномдеплатиновые( мета,зо,медьл,отосерлы ебро,ртуть)Из. конструкциметаллвдостаточномвнных количимеютсявприродествевиде соедлижешьнений,алюмиезо,магний.
Ониобрамощныезалуютжисторождений относительнобогатыхруд.Этооблегчаетих довбольшихычумасштабах.
Поскольку металлывсоединенияхнаходятсяв окисленномсостоянииимеют( положительную степеньокисления),тополучениеихв свободномсостояниисводитсякпроцессу восстановления: Этотпроцессм жносуществитьхимическим илиэлектрохимическимпутем.
Прихимическом воссткановлениичестве восстчащевсегоновителяприменяютуголь илиоксидуглерода(II),такжеводород,
активныеметаллы,кремний.Спомощью оксидауглеродаполучают(II)железов( доменномпроцессе),многиецветныеталлы (олово,свинец, др.нк ): Восстановлениеводородомиспользуется, например,дляполучениявольфрамаизоксида вольфрама(VI): Применениевкачевоствестановителя водородаобеспенаибольшчистоваеттую получаемметалла.Водиспользуютрдляго
получениячистогоеньжелеза, меди,никеля идругихметаллов.
Сполучениясобметаллов,котором качевоствестановителяприменяютметаллы, называют металлотермическим.Вэтом способевкачево твестаниспользуютвителя активныеметаллы.Примеры металлотермическихреакций: алюминотермия: магниетермия:
Металлынаибчастополучаютее восстановлениихоксид,котсвоюрыем очередьвыделяютизсоответствующей природнойруды.Еслиисхорудной являютсясульфидныеминералы,топосл дние подвергаютокислительномуобжигунапример: Электрпохимическоелучениеметаллов осуществляетсяприэлектрорасп авовизе соответствсоединений.Такимпутемющих
получаютнаиболееактивныеметаллы, щелочныеищелочноземельные,таллы алюми,магний. Электрохимическоевосстановление применяюттакже
для рафинирования (очистки)сырыхметаллов (меди,никеля,ц дрнка.),полученных другимиспособами.Приэлектролитическом рафиниркачествениив аниспользуютд черновойспримесями( )мет,качествелл электролитарасоетворданногоинений металла.
Способыполученияметаллов, осущеспривысокихтвляемыеемпературах,
называют пирометаллургическими (по - греческиpyrогонь)Многие. изэтихспособов
известныдревнихвремен.НарубежеXIXXX вв.начинают
развиваться гидрометаллургические способы
полученияметалловпо( |
-греческиhydorвода). |
|
|
|||
Приэтспособахкомпонентыруды |
|
|
|
|
||
переводятводныйрастворидалеевыделяют |
|
|
|
|
||
металлэлектролитическимилих мическим |
|
|
|
|||
восстановлением.Такполучают,например, |
|
|
|
|
||
медь.Меднсодержащуюруд, уоксидмеди |
|
|
|
|
||
(II)О,обрабатываCu |
ютразбавленнойсерной |
|
|
|||
кислотой: |
|
|
|
|
|
|
Длявосстановлмедиполучрастворенияный |
|
|
|
|
||
сульфатамедилибоподвергают(II) |
|
|
|
|
||
электр,либдействонализурастворют |
|
|
|
|
||
порошкомжелеза. |
|
|
|
|
|
|
Гидрометаллургическийспособимеет |
|
|
|
|||
большоебудущее,таккакпозволяетполучать |
|
|
|
|
||
продукт,н |
еизвлекаярудуземли.Сравните( |
|
|
|
||
достоинствагидрометаллургическогоспособа |
|
|
|
|||
полученияметалловсподземной |
|
|
|
|
||
газификациейугля.) |
|
|
|
|
||
40. |
Способыполучениясв йксидов. тва |
|
|
|
||
Это – сложныевеществасостоящиеизДВУХ |
|
|
|
|||
элемен,одинизкокислородто.врых |
|
|
|
|
||
Например: |
|
|
|
|
|
|
CuO– оксидмеди(II) |
|
|
|
|
||
AI2O3– оксидалюминия |
|
|
|
|||
SO3– оксидсеры(VI) |
|
|
|
|
||
Получениеоксидов: |
|
|
|
|
||
1окисление. кислородом, |
|
|
|
|
||
2Разложенокисление. высшоксиидовх |
|
|
|
|
||
низших, |
|
|
|
|
|
|
3Выт. леснениетучоксидамлетучимго |
|
|
|
|
||
привысокойтемпературе, |
|
|
|
|
||
4Взаимодействие. кислот |
|
-окислителей. |
||||
Основныеоксиды |
- этосложныехимические |
|||||
вещества,отнкосящиесякислам,которые |
|
|
|
|
||
образуютсолипрх мическойреакции |
|
|
|
|
||
кислотамиилислотныоксидане ми |
|
|
|
|
||
реагируютсосноваилиновнымииями |
|
|
|
|
||
оксидами.Например,основнымотносятся |
|
|
|
|
||
следующие: |
|
|
|
|
||
K2Oокалияись),(оCaOкались), (FeOция |
|
|
|
|
||
(окисьжелеза |
2 |
|
-валентного). |
|||
Кислотноксидые |
- этосложныехимические |
|||||
вещества,отнкосящиесякислам,которые |
|
|
|
|
||
образуютсолипрх мическом |
|
|
|
|
||
взаимодействииосноваилиновнымииями |
|
|
|
|||
оксидневзаимми |
|
одействуюткислотными |
||||
оксидами. |
|
|
|
|
|
|
Примерамикислотнокисловмогутбыть: х |
|
|
|
|
||
CO2всемизвестный(углекислыйгаз), P2O5 |
|
|
- |
|||
оксидфосфообразуется( псгораниина |
|
|
|
|
||
воздухебелф ),сфорагоSO3 |
|
- триокисьсеры |
||||
- этовеществоиспольздляполученияют |
|
|
|
|||
сернойкисл |
оты. - химическаяреакцияводой |
|
|
|||
CO2+H2O=H2CO3 - этовещество |
- угольная |
|||||
кислота - однаизслабыхкислот,еёдобавляют |
|
|
|
|||
вгазированнуюводудляпузырьков" "газа.С |
|
|
|
|
||
повышениемтемпературырастворимостьгаза |
|
|
|
|||
вводеуменьшается,егоизлишеквыходит |
|
|
|
|
||
видепу |
|
|
|
зырьков. |
||
Амфотерныеоксиды |
- |
этосложные |
||||
химическиевещества,такжеотносящиеся |
|
|
|
|||
окислам,котообрсолиазуютыепр |
|
|
|
|
||
химичевзаимодействиикислотамиком |
|
|
|
|
||
(илик слотныоксида)основаниямии |
|
|
|
|||
(илиосновнымиоксидами)Наиболее. частое |
|
|
|
|
||
применениеслово |
"амфотерный"внашем |
|
|
|||
случаеотноситсякоксидмет. алловм |
|
|
|
|
||
Приамфотерныхеромоксидовмогутбыть: |
|
|
|
|
||
ZnO - окисьцинкабелый(порош,часток |
|
|
|
|||
привменяемыйдилязготовленияцине |
|
|
|
|||
масокикремов), Al2O3 |
- |
окисьалюминия |
||||
(называютещеглинозёмом"")Химическ. |
|
|
ие |
|||
свойстваамфотерныхоксидовуникальнытем, |
|
|
|
|
||
чтоонимогутвступатьхимическреакции, е соответскакоснованиямитакующие кислотами.

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
составуфракции,основанноенаразличии |
|
|
|
|
|
|
ПериодическийзаконД.И.Менделеевастал |
|
|
|
|
|
|
|
|
Первспокисчнртваыльдегидыяются, |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
температурахкипенияеекомпонентов. |
|
|
|
|
баздлясоздайученияым |
|
|
Периодической |
которые всвоюочередьм гуткислятьсяв |
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
Основ,ихклассификацияния |
|
Фракция — химисоставнаячеастьнефтикая |
|
|
|
|
системыхимическихэлементов.Она |
|
|
|
|
|
|
|
|
карбоновыекисл.Вт сптыичнртые |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
41. |
|
содинаковымихимическимиилиф зическими |
|
|
|
|
представлена 7 периодами 8 группами. |
|
|
|
окисляютсявкетоны.Третспиртболеечные |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
химичесвойосноветвана кие |
|
|
|
|
|
|
|
|
|
свойствамитемпературойкипения( , |
|
|
|
|
|
|
Периодами называютсягоризонталь |
ныеряды |
усткокислейчивы.Придействиина юх |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
представленийобэлектролитической |
|
|
|
|
|
|
плотностью,размерами),выделяемаяпри |
|
|
|
|
|
|
таблицы,которыеделятсянамалыеибольшие. |
|
|
|
|
|
|
|
|
сильныхокислителейможетпроисходить |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
диссоциации. |
|
|
|
|
|
|
|
|
|
перегонке. |
|
|
|
|
|
|
|
2элемента(1 |
-йпериод)илиэлементов8 (2 |
|
|
|
-й, |
расщеплуглеродногоскмолниелетакулы |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Прямаяперегонка |
|
— этофизическийспособ |
|
|
|
3-йпериоды)находятсявмалыхпериодах,в |
|
|
|
|
|
|
|
|
третичногоспирта |
|
образовакарбоновыхием |
|
|
|
|||||||||||||||||||
|
Кислоты-этоеле,коттрвводныхрыелиты |
|
переработкинефтис |
|
|
помощьюатмосферно |
- |
|
большихпериодахнаходятся18элементов(4 |
|
|
|
|
|
- |
|
кислоткетоновменьшимчисло |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
растворахирозплавахдиссоциируютна |
|
вакуумустарис.но( принцип1вкий.1), |
|
|
|
|
|
|
й, 5 -йпериоды)или32элемента(6 |
|
|
|
-йпериод), |
углеродныхато,чемвмоисходноговлекуле |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
катионыВодораникислотныхданы |
|
|
|
|
|
|
|
|
работыкоторойзаключаетсявследующем. |
|
|
|
|
7-йпериодкастает |
|
сянезавершенным. |
третичногоспирта.Окислениеспиртовобычно |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
ост.ЗналичтковатомовКиихслородаем |
|
|
|
|
|
|
|
|
Врезультаспециальнойнагреванефти |
|
|
|
|
Каждыйпериод |
|
стипичногометалла |
|
|
|
|
|
провсильнымиодяткислителями |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
делятнакислородсодержащие(H2SO4,HNO3) |
|
трубпечидо7атой330Собразуется... 350 ° |
|
|
|
|
начинается заканчиваетсятипичным |
|
|
|
|
|
— |
|
|
|
|
|
хромовойсмесьюили |
||||||||||||||||||||||||||||||||||||
|
ибезкислородные(HCl,H2S)По личеству. |
|
смесьпаровнефтинеиспарившегосяжидкого |
|
|
|
|
неметиблаглломазомородным. |
|
|
|
|
|
|
|
|
смесьюперманганатакалияссернойкислотой. |
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
атомовВодор |
|
одакислотыбывают |
|
остатка,поступающаяврект |
|
|
|
ификационную |
|
Группами элементовназываются |
|
|
|
|
|
Впромышленности ивлабораторииспирты |
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
одноосновные(HNO3,HCl), |
|
|
|
|
|
|
|
|
|
колоннус3теплообменниками2. |
|
|
|
|
вертикальныестолбцы.Каждаягруппа |
|
|
|
|
|
|
|
|
такжепревальдращаютикевтонгиды |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
двуосновные(H2CO3,H2S)и |
|
|
|
|
|
|
|
|
|
Вректификационнойколоннерис. ( 1.2) |
|
|
|
|
предвумяставленаподгруппами |
|
|
|
|
|
|
|
|
результатереакцдегид.Прирования |
|
|
|
|
|
|
|||||||||||||||||||||||||
|
триосн(H3PO4)Пстепениовныедиссоциации. |
|
происходитразднефтяныхпаровлениена |
|
|
|
|
|
|
|
– главной и побочПодгруппой. называ |
|
|
|
ется |
пропаровспирусканиинадтализаторами |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
кислотыделятнасильные(HCl),средней |
|
|
|
|
|
|
|
|
|
фракции,составразличныеяющие |
|
|
|
|
|
|
совокупнэлементов,котявляютсястьрые |
|
|
|
|
|
|
|
|
(медь,цинк,серебро)при300Спроисходит° |
|
|
|
|
|
|
|||||||||||||||||||||||
|
силы(H3PO4)слабые(H2CO3) |
|
|
|
|
|
|
|
|
|
нефтепродукты.Приэ омпература |
|
|
|
|
полнымихимическианалога;частоми |
|
|
|
|
|
|
|
|
отщеплениемолекулыводородамолекулы |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
Химичесвой: ствакие |
|
|
|
|
|
|
|
|
|
кипениясмежныхгруппполучфракцийемых |
|
|
|
|
|
|
элементыподгруппыимеютв степеньсшую |
|
|
|
|
|
|
|
|
спиртаобр лзованием |
|
ьдегилкетонаи. да |
|
|
|
||||||||||||||||||||||||
|
1Диссоциация. |
|
|
|
|
|
|
|
|
|
можеттличатьсявсего |
|
|
ишьна5С...8 ˚ |
|
|
|
окисления,соответствномергруппы. ющую |
|
|
|
|
|
Этиловыйспирт |
|
- этанол,винныйспирт, |
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Взависотхимсичостнескогофтиава |
|
|
|
|
|
|
Например,высшаястепеньокисления(+ II) |
|
|
|
|
|
|
|
|
C2H5OH |
- |
важнпредставительйший |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
используютдвесхемыполучениятопливарис(. |
|
|
|
|
|
|
отвечаетэлементам |
|
|
|
|
|
|
|
|
|
одноасыщенныхтомныхспиртовобщей |
|
|
|
|
|
|
|
|||||||||||||||
|
2Взаимодействуют. основнымиоксидами: |
|
1В.пер3)случае. винтомтервалемператур |
|
|
|
|
подгруппы бериллия и цинка (гл авнаяи |
|
|
|
формулы |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
кипенияот40до150Сотбирави° аютционные |
|
|
|
|
побочнаядгIIруппы),элементам |
|
|
|
|
|
|
|
|
CnH2n+1OH. |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
3Соснования. (щелочами |
|
|
|
|
|
|
|
|
|
бензинывинтервалеот150до300С ° |
|
|
|
|
— |
|
подгруппы азота и ванадия (Vгруппа) |
|
|
|
Смешиваетсяво ехоотношенияхводой, |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
керосин,изкоторого |
|
|
|
изготавливают |
|
отвечаетысшаястепеньокисления(+ V). |
|
|
|
|
|
|
|
|
спиртами,эфирами,глиц,бензолом,рином |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
нерастворимыми): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
реактивныетоплива.Вовторомслучае |
|
|
|
|
|
|
|
46. |
|
получение спиртов изпредельных |
и |
др.огнеопасный; .Этило |
|
|
выйспиртводой |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
интервалемпературкипот40дония200С ° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
образуетазеотропнуюнераздельнокипящую( ) |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
непредуглеводородовльных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
4Самфотерными. гидроксидами: |
|
отбираютавтомоббензильные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
смесь(95этило.5спирт%4в.5ый)одаt% |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
промышспособылученияенные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
интервалеотдо200350С ˚ |
|
|
|
— дизельные |
|
|
|
|
|
|
|
|
|
кип= 78Сметаллич.15натриCсп. ертским |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
топлива. |
|
|
|
|
|
|
|
|
метанола |
|
|
|
|
|
|
|
|
|
образуеталк,приокисленииголят |
|
|
|
|
|
|
|
|||||||||||||
|
6Сметаллами. : |
|
|
|
|
|
|
|
|
|
Мазут,остающийсяп слетгонатопливных |
|
|
|
|
|
|
|
|
|
|
|
|
|
превацетальдегидращается,при |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
фракций(60отисходной... м80 % |
|
|
|
ассынефти), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дегинегодрзвзависимости(тации |
|
|
|
|
|
т |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
использдляполучмаселикрекингютния |
|
|
|
- |
|
Средиспособовполуче |
|
нияметилового |
|
|
|
усл)повийлучаютэтилдиенэ иловый |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензинов. |
|
|
|
|
|
|
|
|
|
|
|
|
эфир. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
42. |
|
|
основныеклассынеорганических |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
Углеводородыстемпературойкипенияниже |
|
|
|
|
|
|
спирта можновыделитьследующиеосновные: |
|
|
|
|
|
До 30-хгг. века20этиловыйспиртполучали |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
соединений. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
40Спопутные(°газы)используютвкачестве |
|
|
|
|
|
|
сухаяперегонкадревесины, |
каталитическое |
основномброжениемпищевогосырьязерна(, |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
добавкнекбензинамокторымвкачестве |
|
|
|
|
|
|
карит.п.офеля),сахараиотходовхарного |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сырьядляполучениярядасинтетических |
|
|
|
|
гидрировокс углеродаоксанида |
|
|
|
|
|
|
|
|
производства - мелассыпатоки)(Н. не |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
продуктов,атакжекактоп |
|
|
|
ливодля |
|
|
|
(синтез -газ). |
каталитическоенеполное |
|
|
|
|
|
значительноеколичествоэтиловогосп |
|
|
|
|
|
ирта |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
газобалонныхавтомобилей. |
|
|
|
|
|
|
|
|
|
|
|
получаютгидратациейэтилена,гидролизом |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
окислеметана, ие |
|
|
|
|
|
|
|
|
|
растительныхматериаловизацетилена. |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Продукты,получаемыеспособомпрямой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полученныйврезультатеброжения |
|
|
|
|
|
спирт- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
перегонки,обладаютвысокойхимической |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сырецпослеперегонкиназывают |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стабильнос,таккаквнихотсутствуютью |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ректификатом;содержит95.5 % C2H5OH. |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
непредугле. водородыльные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Этиловыйспиртприменяютпроизводстве |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исподперерляьзовнефтаботкие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
синтетическогокаучука, |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
крекинг-процессовпозувеляетичить |
ыход |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензиновыхфракций. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетальдегида,хлороформа, |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Крекинг — процесспереработкинефтиее |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
красителейдругих |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фракций,основанныйнаразложении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
органическихпродуктов,как |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(расщеплении)молекулсложных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
растворитель,антифриз, |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
углеводусловияхвыстемпературдовких |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
компонентреакттопливавного |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
идавлений. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т.п. |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Впервыекрекингбылпр русскимдложен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
значиастьэ еиловогоспиртаьидетная |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ученымА.А.Летнимв1875г.а, |
|
|
|
разработан — |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изготовленспиртныхнапитков.Эт ловыйе |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В.Г.Шуховымг.нопервая,1891 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
спирт - наркотик,действуетвозб |
|
ужднающе |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
промышленнаяустанобылапостроенавка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
организм. |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
США. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Преоднооснельныекарбоновыевные |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Существуютследующкрекингавиды: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
48. |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
термический,каталитический,также |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты,ихстроесвойстванаие |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидрокрекингкатал форминг.тический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
примереуксуснкислоты. й |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Термическийкрекинг |
|
|
используютдля |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Одноосновные |
предельные |
|
карбоновые |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
получениябензи |
наизмазута,керосина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты |
|
(одноосновные |
насыщенные |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дизельноготоплива. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбоновые кислоты) — карбоновые кислоты, |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Атомы |
|
Остаточныемасла |
|
— этоочищенныегудроны. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в которых |
насыщенный |
углеводородный |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дляихполучениямазутилиполугудрон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
радикал соединен с одной карбоксильной |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
смешиваютсжиженнымпропаном(6...8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
группой -COOHВсеониимеютобщую. |
|
|
|
|
|
|
||||||||||
43. |
Оснположенвныетеорихимическогоя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
частейпрнаоднупаначастьм)призута |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
формулуСnH2n+1COOH |
|
|
|
|
|
|
|
||||||||||||||||||||||||
строенияорганическихсоединений |
|
|
|
|
|
|
|
|
|
|
|
температу40С.Таким...об60разоме° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Карбоксильнаягруппасодержитве |
|
|
|
|
|
|
|
|||||||||||||||||
А.М.Бутл |
ерова.Химическоестроени |
|
|
|
|
получавиацют |
|
|
ионныемаслаМК |
|
-22, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
функциональныегруппы |
|
– карбонилС>=О |
|||||||||||||||||||||||||
|
вмолекулахсоединеныдругдругомв |
|
|
|
|
|
|
|
|
|
МС-20итрансмиссионноемаслоМТ |
-16МК. |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидроксил |
-OH, Изомерияскелетав |
|
|
|
|
||||||||||||||||||||
|
опредепослесоглннойдовихательностисно |
|
22рекомендованоидлясмазкиагрегат в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
углеворадикалепроявляетородном |
|
|
|
|
|
ся, |
|||||||||||||||||||||||||
|
валентностям.Последовательность |
|
некоавто,напррыхмобг узовыхимлейр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
начиная с бутановой кислоты, которая имеет |
|||||||||||||||||||||||||||||||
|
межатомныхсвязеймолекуленазываетсяее |
|
автомобилейМинскогоавтозавода. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дваизомера: |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
химическстротражаетсяеноднойием |
|
|
|
|
|
|
|
|
Всмазочныхмаслах,получаемыхизмазута, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 -CH2-CH2-COOHн |
|
|
|
-бутановая |
||||||||||||||||||||
|
Оснположвныетеорихимническогоя |
|
кромеугл обязатводс родовельноржат |
|
|
|
ся |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота; |
СН3 |
-CH(СН3) |
-COOH |
|
2- |
||||||||||||||||||||||||||||
|
строенияорганическихсоединенийбыли |
|
|
|
|
|
|
|
|
нафтеновернистыеки,слотысоедин ния |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метилпропановаякислота. |
|
|
Межклассовая |
||||||||||||||||||||||||
|
сформулированыпрофессоромКазанского |
|
смолисто-асфальтовыевещес,поэих, омува |
|
|
|
|
47. |
|
|
Предельныеодноатомныеспирты,их |
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
изомерия |
проявляется, |
начиная |
с |
уксусной |
||||||||||||||||||||||||||||||||||||||||||||
|
университетаА.М.Бутлеровым |
|
в 1861г. |
|
какитоплива,необходимоочищать. |
|
|
|
|
|
|
|
строение,свойства.П |
|
|
олучение |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
кислотынепосредственносвязанныедруг |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
45. |
|
периодическзакон |
ическаяй |
|
|
|
|
применениеэтиловогоспирта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
1)Атомывмолекулахсоединяютсявстрого |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
другом: |
Метановая,муравьиная |
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
системаменделеева |
|
|
|
|
|
|
|
Кисвлспиртовйстватныоченьражены |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота Этановая,уксукиснаялота |
|
|
|
|
У́ |
||||||||||||||||||||||||||||||||||
|
определенномпорядкевсоответствии |
|
|
Периодический законД.И. |
Менделеева |
|
cлабо.Прояэтихсвлениезаключаетсяойств |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
валентностьюэлементов. |
|
|
|
|
|
|
|
|
|
: Свойспростыхтел,а акжева |
|
|
|
формыи |
|
ихвзаимодейсощелочнымиметалламиствии |
|
|
|
|
|
|
|
|
ксусная кислота (этановая́ |
кислота) — |
|||||||||||||||||||||||||||||
|
2)Свойствавеществзависятнетолькоотих |
|
|
|
|
|
|
|
|
|
свойствасоеди |
|
ненийэлементовнаходятся |
|
|
|
|
обралкоголятовзованием. |
|
|
|
|
|
|
|
|
органическое |
вещество |
с |
|
формулой |
|||||||||||||||||||||||||
|
количественногокачественнсостава, |
го |
|
периодзавиотсимостической |
|
|
величины |
|
Поддействиводы,дажследоввлаги,м |
|
|
|
|
|
|
|
|
CH3COOH. Слабая, предельная однооснов́ная |
||||||||||||||||||||||||||||||||||||||
|
оттого,вкакомпорядкесоединеныатомыв |
|
|
|
|
|
|
|
|
|
атомныхвесовэлементов.Свойства( |
|
|
-тов |
|
алкоголятыполностью |
идролизуются,что |
карбоновая кислота. Производные уксусной |
||||||||||||||||||||||||||||||||||||||
|
молекулах,т.е.отхимическогостроения. |
|
находяхтсявпериодзавиотсимостической |
|
|
|
|
доказывает,чтокисвл спиртовтныейства |
|
|
|
|
|
|
|
|
кислотыносятназваниеацетаты« ». |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
3)Атомывмолекулахвзаимновлияютдругна |
|
|
|
|
|
|
|
|
|
зарядаатомовихядер). |
|
|
|
|
|
|
|
|
выраженыслабее,чемуводы. |
|
|
|
|
|
|
|
|
|
Представляет собой бесцветную жидкость с |
||||||||||||||||||||||||||
|
друга. |
|
|
|
|
|
|
|
|
|
|
Периодическаясистэлем.Рядыентов |
|
|
|
|
|
|
Сощелочамиалканолынереагируют. |
|
|
|
|
|
|
|
|
характерным резким запахом и кислым вкусом. |
||||||||||||||||||||||||||||
|
4)Свойствавеществопределяютсяих |
|
элементов,пре |
|
делах которыхсвойства |
|
|
|
Впромышленностидегидратациюспиртов |
|
|
|
|
|
|
|
|
Гигроскопична. Неограниченно растворима в |
||||||||||||||||||||||||||||||||||||||
|
строением,,наобо,знаяможноро, ениет |
|
|
|
|
|
|
|
|
|
изменяютсяпоследовательно,как,напри |
мер, |
|
осуществляютпропаровускспирн дниема |
|
|
|
|
|
|
|
|
воде. |
|
|
Смешивается |
со |
|
многими |
|||||||||||||||||||||||||||
|
прогнсво. зироватьйства |
|
|
|
|
|
|
|
|
|
рядизвосьмиэлемеотлитдонилиетоянав |
|
|
|
|
|
|
|
катализатором — оксидомалюминияAl2O3. |
|
|
|
|
|
растворителями; в уксусной кислоте хорошо |
|||||||||||||||||||||||||||||||
|
5)Химическоестроенивеществможетбыть |
|
|
|
|
|
|
|
|
|
отнатдор,Меиягоназвалделеев |
|
|
|
|
|
|
При температуре350 |
—500°С |
|
|
|
|
|
растворимыорганическиесоединениягазы, |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
установленохимическимимет |
|
одами. |
|
периодами. |
|
|
|
|
|
|
|
происходегидратацияитвнутримолекулярная |
|
|
|
|
|
такиекакHF, HCl, HBr, H |
|
I |
|
и другие. |
|||||||||||||||||||||||||||||||||
|
|
44. |
|
переработканефтиперегонканефти |
|
|
|
СовременнаяформулПериодическогоровка |
|
|
|
|
иобразуютсяалкены,приболеенизкой |
|
|
|
|
|
|
|
|
Существуетв |
видециклическихи |
|
линейных |
|||||||||||||||||||||||||||||||
|
|
|
|
химическая |
|
|
|
|
|
|
|
|
|
законаД.И.Менделеевазвучитследующим |
|
|
|
|
температуре(200 |
|
– |
250С) |
° |
|
димеров. |
Абсолютная |
уксусная |
|
кислота |
|||||||||||||||||||||||||||
|
Основнымспособомпереработкинефти |
|
|
|
|
|
|
|
|
образом: |
свойстваэ |
|
лементовнаходятся |
|
|
|
протекаетмежмолекулярнаядегидратация |
называется ледяной, ибо при замерзании |
||||||||||||||||||||||||||||||||||||||
|
являетсяеепрямаяперегонка. |
|
|
|
|
|
|
|
|
|
периодзавиотпорядковогосимостической |
|
|
|
|
получаютсяпростыеэфиры. |
|
|
|
|
|
|
|
|
|
образуетльдовиднуюмассу. |
|
Обладает всеми |
||||||||||||||||||||||||||||
|
Перегонка — дистилляциястекание( каплями) |
|
номера. |
|
|
|
|
|
|
|
|
Реаокисленияции. |
|
|
|
|
|
|
|
|
|
свойствами карбоновых кислот. Связь между |
||||||||||||||||||||||||||||||||||
|
— разднефнаотличающиесяленипо |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водородом |
и кислородом |
карбоксильной |
|||||||||||||||||||||||||

группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства. Уксусную кислотуможнополучитьокислением ацетальдегидакислородомвоздух.Процесс
проводятприсутств иикатализатора — ацетатамарг(II)нцаприMn(CH3COO)2
температуре50 -60С: 2° CH3CHO→2 + O2 CH3COOH .
49. Предельныеуглеводороды,общая
формулаихимическоестрг мологовени данного
Предельныеуглеводороды |
- |
органические |
||
соедин,несодфенияржащие |
ункциональных |
|||
групп и |
кратных связей. |
Формула |
- |
|
С(n)H(2n+2) |
Химическое |
|
строение |
- |
углеводородные цепи с ответвлениями или без с одинарными связями. Мета́н — простейший углеводород, бесцветный газ без запаха,
химическаяформула — CH4Малорастворим.
воде,легчевоздуха.Прииспользовании
быту,промышленностивметанобычно
добавляютодорансоспецифическимы
«запга»Сза.хомпоамсебеменетоксиченан
инеопасендляздоровьячеловека. |
|
Ободорагащеделаетсядлянтогоиетами, |
|
чтобычелвовремяз ек |
аметил утечку газа. На |
промышленных |
производствах эту роль |
выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха. Метан — первый член гомологического ряда насыщенных углеводородов, наиболее
устойчив к химическим воздействиям.
Подобно другим алканам вступает в реакции
радикального |
замещения |
(галогенировани,ясульфохлорировани,ясульф
оокислени,я нитрования и др.), но обладает
меньшей реакционной способностью.
Специфичнадляметанареакцияспарами
воды, которая протекает на Ni/Al2O3 при 800—
900 °C или безкатализаторапри 1400—1600 °C;
образующийся синтез-газ может быть
использован |
для |
синтеза |
метанола, |
углеводородов, |
|
уксусной |
кислоты, |
ацетальдегидадругихпродуктов.Горит |
|
|
|
воздухеголубоватымпламене |
|
м, |
при этом |
выделяется энергия около 39 М Дж на 1 м3. С
воздухом образует взрывоопасные смеси при
объёмных концентрациях от 5 до 15 процентов.
Точказамерзания |
-184С при ( |
нормальномдавлении)Вступаетгалогенами |
|
реакциизамещениянапример( , CH4 + 3Cl2= |
|
CHCl3+ |
3HCl), |
которыепроходятпосвободнорадикальному
механизму: CH4 хлорметан+ 1⁄2Cl2) = CH3Cl (
CH3Cl дихлорметан+ )1⁄2Cl2 = CH2Cl2 (
CH2Cl2трихлорметан+ ) 1⁄2Cl2 = CHCl3 (
CHCl3тетрахлормета+ 1⁄2Cl2)нВыше= CCl4 (
1400разлагаетсяпо°Cреакции: 2CH4 = |
C2H2 |
+ 3H2.
50. Присточникиродныеуглеводородов:
нефть,природнпопутныегаз й
Основнымиисточникамиуглеводородов являютсяприрпопутныенефтяныедный газы,нефтьиуголь. Приргаз.Всоприродногодныйставгаза
вхвосновндитметанок(олом93%) . Кроме метана приргазсодещеержитный другиеуглевод,атакжеаз,СОо2,ироды часто – сероводород.Природныйгазпри сгораниивыделяетмноготепла.Вэтом
отношениионзначительнопревосх дит |
|
|
|
|
|
|
|
Этооднаизпричинмногообразия |
|
|
|
|
||||||||
другиевидытопли.Поэтомув90%сегоа |
|
|
|
|
|
|
|
органическихсоединений |
|
. |
|
|
||||||||
количествапригазарасходногодуется |
|
|
|
|
|
|
|
2Ворганических. молекуласвязьатомов |
|
|
|
|
||||||||
качестветопливанаместныхэлектростанциях, |
|
|
|
|
|
|
|
ковалентнаямалополярная( )Поэтому. |
|
|
|
|
||||||||
промышленныхпредприятияхвб |
|
|
|
|
ыту. |
|
органическиевеществаобычноявляются |
|
|
|
|
|||||||||
Остальные10%используюткакценноесырье |
|
|
|
|
|
|
|
незлектролитами. |
|
|
|
|
||||||||
дляхимическойпромышленности.Сэтой |
|
|
|
|
|
|
|
3Если.ион(еорганическные)соединенияе |
|
|
|
|
||||||||
цельюизприродногогазавыдме, ляюттан |
|
|
|
|
|
|
|
легкодиссоциируютвводенаионы |
|
|
|
|
||||||||
этанидругие |
|
алканы.Продукты, |
которые |
|
иреакциимеждунимпротекаютвесьма |
|
|
|
|
|||||||||||
можнополучитьизметанаимеютважное |
|
|
|
|
|
|
|
быстро,то |
|
органическиевещества, |
|
|
||||||||
промышленноезначение. |
|
|
|
|
|
|
|
содепрожащие(динарныестые) |
|
|
С-С иС- |
|||||||||
Нефть – жидкоегорючископаемоет мно |
|
|
- |
|
Н связи,взаимодействуютеждусобой |
|
|
|
|
|||||||||||
бурогоцветасплотностью0,70 |
|
– 1,04г/см³. |
|
больштрудомилвовсеине |
|
|
|
|
||||||||||||
Нефтьпредсобтавляетложнуюсмесьй |
|
|
|
|
|
|
|
взаимодействуют. |
|
|
|
|
||||||||
веществ |
– |
преимущественножидких |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
углев.Псодородовнефставу |
|
тибывают |
|
|
|
|
|
|
|
|
|
|||||||||
парафиновыми,нафтеновыми |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ароматинаиболеекими.Однакочасто |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
встрнсмешанногофтьчаетсятипа.Кроме |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
углев,сонефтиставдорвходятпримесиов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
органичкислоерскиходныхнистых |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
соединений,атакже |
вода ирастворенныеней |
|
|
|
|
|
|
|
|
|
||||||||||
кальциевыемагниесоли.Содержатсяые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
нефтимеханпримческие |
|
– |
песоки |
|
|
|
|
|
|
|
|
|
||||||||
глина.Нефть |
|
– ценноесырьедляполучения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
высококачественныхвидовмоторного |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
топлива.П числе |
|
сткиотводыдругих |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
нежелательныхпримесейнефтьподвергают |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
перераб.Основнойспперткесобработки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
нефти – перегонка.Онаос разницеована |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
температуркипенияуглеводородов,входящих |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
всоставнефти.Поскнефтолдержитьку |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
сотниразличныхвеществ,м |
|
ногиеизкоторых |
|
|
|
|
|
|
|
|
|
|||||||||
имеютблизкиетемпкипения,ратуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
выделенуглеводородовиндивидуальных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
практическиневозможно. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Термическийкрекинг |
|
– |
расщепление |
|
|
|
|
|
|
|
|
|
||||||||
углеводпроисходитвоздействиемродов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
высокихтемператур(500 |
-700 оС)Например. , |
|
|
|
|
|
|
|
|
|
||||||||||
из молекулы предельногоуглеводородадекана |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
С10Н22образуются |
молекулы пентанаи |
|
|
|
|
|
|
|
|
|
||||||||||
пентена. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
51. |
|
|
присточникиродныеуглеводо |
|
|
|
родов |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нефтьиприродныйгазихприменение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Сначалаорганическимизываливещества, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
встречающиесяприродеживыхорганизмах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
53. |
производствоаммиакасырьесхема |
|
|
|
|
||||||||
Позднеебылоустан,чтчеткойвлено |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
границымеждуорганическими |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
неорганическимивещсуществуетствами, |
|
|
|
|
|
|
|
Произваммиака:сырье,одствосновные |
|
|
|
|
||||||||
органическиевещес |
твамогутполучатьсяиз |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
неорганич.Общеесвойствовсеских |
|
|
|
|
|
|
|
этапы. |
|
|
|
|
|
|
||||||
органическихвеществ |
- вихсоставвходит |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
углерод.Сейчоргахимиейнической |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
называютразделхимии,изучающий |
|
|
|
|
|
|
|
Производствоаммиака:осно |
|
|
вноесырье |
|||||||||
соединенияуглерода.Ещеоднапричина |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
приргаз,водивоздух.ныйа |
|
|
|
|
|||||||||
выделеоргахимиинивотдельныйческойя |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
1стадия: |
|
сероочисткаприродногогазаот |
|
|
|||||||||
раздел |
химии - огромазнообразиеое |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
серосоединенийде,протекаетвжащих2 |
|
|
|
|
|||||||||||
соединенийуглерихизвестно( даколо8 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
этапа. |
|
|
|
|
|
|
|||||||
миллионов)Этообъясняется. тем,чтоатомы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
1й - |
|
гидрированиена |
|
|
|||||||||
углеродам гутбразовыватьдлинные |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
алюмокобальтовоммолибденовом |
|||||||||||||
цепочки,вотличиеатомовдругих |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
катализаторе→связываниесерывиде |
|
|
|
|
|||||||||
элементов. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
сероводорода |
|
|
|
|
||||||||
алканы:СnH2n+2, |
|
|
|
|
|
c4h10 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
2й – |
взаимодействиесеровод |
ородас |
||||||||||||
Циклоалканы: |
CnH2n, |
c6h12 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
адсорбентомZnO→сульфидцинка |
|
|
|
|
|||||||||||
Алкены:C |
nH2n |
|
|
|
|
c4h8 |
|
|
|
|
|
|||||||||
|
|
|
|
|
2стадия:нагревприродногоавпечиниеза |
|
|
|
|
|||||||||||
Алкины |
|
CnH2n-2 |
|
|
|
|
c2h2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
первичногориформингасисп( льзованием |
|
|
||||||||||||
алкадиены |
CnH2n |
-2 |
|
|
|
c3h4 |
|
|
|
|||||||||||
|
|
|
|
водяногопара)Т.=800 |
|
|
-830С , кг°P= |
35 |
|
|||||||||||
арены |
|
CnH2n-6 |
|
|
|
|
c6h6 |
|
|
|
|
|||||||||
|
|
|
|
|
|
приводиткобразованиюводорода. |
|
|
|
|
||||||||||
спирты CnH2n+OH |
|
|
c2h5oh |
|
|
|
|
|
||||||||||||
|
|
|
3стадия:вторичныйриформинг:не |
|
|
|
|
|||||||||||||
альдегиды |
CnH2n+1 COH |
|
ch3-coh |
|
|
|
|
|
||||||||||||
|
|
прореагировавшийметансмеш |
|
|
ивается |
|||||||||||||||
кетоны |
|
CnH2nO |
|
ch3-c(o)-ch3 |
|
|
|
|||||||||||||
|
|
|
кислородомвоздухаТ=1100С; P=кг. 33° |
|
|
|
|
|||||||||||||
карбонeкислCnH2nn+1COOHовты |
|
|
|
|
ch2o2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
Происходитконвеугагазавсияного |
|
|
|
|
|||||||||||
простыеэфирыCnH3nO |
|
|
ch3-o-ch3 |
|
|
|
|
|
||||||||||||
|
|
|
углекислый(использованиематм.воздуха). |
|
|
|
|
|||||||||||||
сложныеэфи |
|
ры CnH2nO2 |
|
|
c2h4o2 |
|
|
|
|
|
||||||||||
|
|
|
|
Протекастадиив 2: еобразованиегаза |
|
( |
||||||||||||||
углеводыCn(h2o)m |
c6h12o6. |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
высоко- |
|
(железохромовыйкатализатор, |
|
|
||||||||||
52. |
|
Причинымногонеорганическихбрз я |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
Т=400 0С)и |
низкотемпературнаяконверсия |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
иорганическихвеществ;взаимосвязь |
|
|
|
|
|
|
|
(ц инково-медныйкатализаторТ=220 |
|
0С), |
||||||||||
веществ. |
|
|
|
|
|
|
|
|
|
происходитболеетонкаяочис,содержаниека |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
СОнеболее7%)СО2 , |
|
|
- конвекторгаз. |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4стад:Очисткаотуглекислогоягаза |
|
|
|
|
|||
привтом,чразлинатохимическихчных |
|
|
|
|
|
|
|
растворомБенф,уменьшдавллядоенияе |
|
|
|
|
||||||||
|
|
|
|
|
|
|
30кг,Т=80С,СО2 |
|
|
|
поглощаетсяраствором |
|||||||||
элементовмного.каждыйэлементобразует |
|
|
|
|
|
|
|
Бенфеля,очистка |
|
нарегенерате |
||||||||||
однопрвеществоможет,н ибольш |
|
|
|
|
е, |
|
(восстанов)Метанированиетеле |
|
– никелевый |
|||||||||||
напримеруглеродсуществуетвиде |
|
|
|
|
|
|
|
катализаторТ=300 |
-310С ° - |
получение |
||||||||||
аллотропныхмодификаций:алм,гр, зфит |
|
|
|
|
|
|
|
азотоводороднойсмеси |
|
(очисткаот |
||||||||||
карбин,фуллерены.такжехим.эл менты |
|
|
|
|
|
|
|
кислородсодгазов)→черезржащих |
|
|
|
|||||||||
могутсоединятьсянетолькосамисобой,но |
|
|
|
|
|
|
|
сепаратоап, роизводящий( ыат |
|
|
|
|
||||||||
сдр.ато.имогутсоединятьсяамипо |
|
|
-разному. |
|
разделениепродуктанафракциис |
|
|
|
|
|||||||||||
углеродиводообразодклассуютличные |
|
|
|
|
|
|
|
разными характеристиками)пост |
упнает |
|||||||||||
орган.соединенийалканы,алкены(, |
|
|
|
|
|
|
|
холодильныеустановки. |
|
|
|
|
||||||||
ароматичесуглеводороды,диены,ал,кины |
|
|
|
|
|
|
|
Захолжидк.аммиживакание |
|
– |
отделение |
|||||||||
циклоалканы)всезависитотпорядка |
|
|
|
|
|
|
|
потокагаза. |
|
|
|
|
|
|
||||||
соединенийатомовмолекулах |
|
|
|
|
|
|
|
5стадия: |
|
Синтезводоразота,п лучениеда |
|
|
||||||||
Особеноргасоединенийостиических |
|
|
|
|
|
|
|
аммиака. |
|
|
|
|
|
|||||||
Органическиевеществаотлич ются |
|
|
|
|
|
|
|
Температуранавыхизколонныде360С.Г з° |
|
|
|
|
||||||||
неорганическихрядомхарактерныхсвойств. |
|
|
|
|
|
|
|
охлажд,постунсепараторетсявысокогоет |
|
|
|
|
||||||||
1.Атомыуглерспособныдаеругиняться |
|
|
|
|
|
|
|
давлениядалеехолодил |
|
ьнаяустановка. |
||||||||||
сдругом,образуяцепикольца,поэтому |
|
|
|
|
|
|
|
Отходы: |
|
нет,дымовыегазы,к. хлаждаются |
|
|
||||||||
молекулымногихорганическихсоединений |
|
|
|
|
|
|
|
череззмеевики |
|
|
|
|
||||||||
состоятизбольшчислаатом,чтогов |
|
|
|
|
|
|
|
|
Аммиакиспользуется |
|
в производства азотной |
|||||||||
нетипичнодлянеорганическсоединен. ийх |
|
|
|
|
|
|
|
кис,дазотированиялоты,качестве |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
хладагента,длясозданияащитныхатмосфер, |
|
|
|
|
|||
каксыппроизводствеьеиминеральных |
|
|
|||
удобренийвосн( |
овномкарбаиаммидаака |
|
|
||
водноготехнического),органическом |
|
|
|||
синтезеприпроизводствепластмасс, |
|
|
|
||
ароматическихдругихсоединений. |
|
|
|
||
Ещеоднаособенностьпроизаммиакаводства |
|
|
|||
промышленностисостоитвтом,чтоего |
|
|
|
||
цикличностьтакжеспособствует |
|
|
|||
безотходности.Причемвходкакут |
|
|
|
||
полученнаяэнергия,такпобочныепродукты. |
|
|
|||
Дажесера,полуприоченнаяисходноготке |
|
|
|||
сырья,находитприменениевдругих |
|
|
|
||
химическихпроизводствах.Помимо |
|
|
|
||
перечисленныхмерпроисходиттакже |
|
|
|
||
постоискянныйптимальногосоч |
етания |
||||
давлениятем,пкоторомриературы |
|
|
|
||
происходитпроцесс.Ведьотсочетанияэ их |
|
|
|
||
параметровзависитконечныйвыход |
|
|
|
||
основногопродукта. |
|
|
|
||
|
Реакцииионногообменавводных |
|
|
||
54. |
|
|
|||
|
|
|
|
|
|
растворах.Условияихнеобратимости |
. |
|
|||
Врастворахэлектролреакцпротекаюитови |
|
т |
|||
между ионами. Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления. Условия течения реакций врастворахэлектролитовдоконца:
1)врез ультатереакциивыпадаетосадок:
2)врезультатереакциивыделяетсягаз:
3)в
результатереакцииобразуетсямалодиссоцииру ющевеществ:о
Ионный обмен – этопроцесс, в результатекоторогоионы, находящиеся в твердой фазе. обмениваются с ионами, находящимисяв растворе. Нерастворимое твердое вещество может представлять собой какойлибо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексныеалюмосиликатынатрия)
и глауконитовыйпесок. |
|
|
|
Наповерхностиэтвердыхихвеществимеются |
|
|
|
электзарцентрыичяженные, ски |
|
|
|
расположенныенабоилименеерегулярном |
|
|
|
расстояндруготдруга.Этцентрыии |
|
|
|
удерживаютнасебепроионсзарядамиые |
|
|
|
противоположногознака.Именэтиио ы |
|
|
|
обмениваютсядр |
угимиионами, |
|
|
содевржащимисяастворе. |
|
|
|
Катионообменники. |
Катионообменные |
||
материалы состоят из трех частей: |
|
||
1) |
основнаямасса, |
или |
скелет, |
обычнообозначаемыйсимволомR–; |
|
||
2)активны(такиегрупп,какцентры |
|
— либо |
|
— ); |
|
|
|
3)катионы, |
|
|
|
подлежащиеобмену(обычно |
это+илионыН |
|
|
Н3О+). |
|
|
|
Когда твердый катионообменник приходит в соприкосновениераствором,котором
содержатсякакие |
-либо,онымеждуними |
устанравновесие.Напримерли, ается |
|
Еслипервоначальнорасодетвор, жит |
|
например,хлорнатрия,тоод |
ны натрия |
обмениваются с ионами водорода и из нижней части колонки вытекает разбавленный раствор
соляной кислоты. |
|
|
Ионообменный |
материал |
можно |
регенерировать (восстанавливать), промывая колонку разбавленной соляной кислотой. Это
приводитксмещению |
влеворассматриваемого |
равновесия,результатечегоионынатрия |
|
замещаютсяионамиводорода. |
|
Анионообменники. удаляет |
|
израствораанионы.Типичнымримером |
|
анионногообменаявлясл тсядующее |
|
равновесие: |
|
Длярегеанионерацииможобменника |
ет |
использоватьсякакое |
-либооснование, |
напримеррастворгидроксиданатрия.Это сдвигуказанноеравновесиеетвлево.
55. Сахароза какпредставитель дисахаридов.
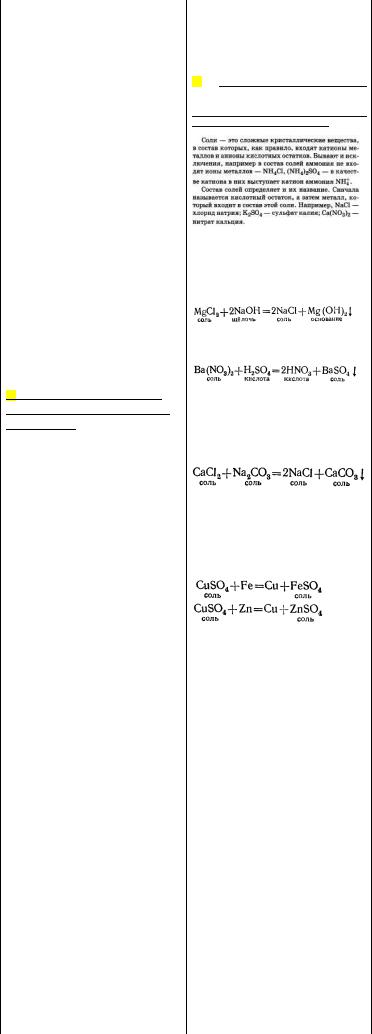
Сахарозасвекловичный( са |
|
хар) |
– одиниз |
|||||
наиболчеловекудавноизвестныхпищевых |
|
|
|
|
|
|||
продуктПервон. сахарозабылч льно |
|
|
|
|
|
|||
выделенаизсахарноготростника,затем |
|
|
|
|
– из |
|||
сахарнойсвеклы.Сахароза |
|
содержитсяво |
||||||
многихдругихрастенияхку(,куруза,лён |
|
|
|
|
|
|||
пальмаидр.). |
|
|
|
|
|
|
|
|
МолекулясоставсахаС розыный |
|
|
12Н22О11. |
|||||
Молекуласахарозысостоитиздвух |
|
|
|
|
|
|
||
моносахаридов:глюкозыα |
|
-D-пиранозной |
||||||
формеифруктозывβ |
|
-D-фуранознойформе, |
||||||
связанныхмеждусобой1 |
|
|
-2-гликозидной |
|||||
связьюучастиемдвухполуацетальных |
|
|
|
|
|
|||
(гликозидных)гидроксилов.Вмолекуле |
|
|
|
|
|
|||
сахарнетсвополуацетальныхбодныхзы |
|
|
|
|
|
|||
гидр,поксиловэтомунможета |
|
|
|
|
|
|
||
таутомернопереходитьв |
|
|
|
|
|
|||
гидроксикарбонильнуюформу. |
|
|
|
|
||||
Принагреваниивыше160°Ссахч розастично |
|
|
|
|
|
|||
разлагается,выделяяводуипре ращаясь |
|
|
|
|
|
|||
буруюмассу |
|
– карамель. |
|
|
|
|
||
Водныйрасахатворстворяетозы |
|
|
|
|
|
|||
гидроксидмеди,обра зуяахатвората |
|
|
|
|
|
|||
меди,проявляетприэтомсвойства |
|
|
|
|
|
|||
многоатомныхспи.Принагреваниитов |
|
|
|
|
|
|||
раствоахаприсутствииаозыминеральных |
|
|
|
|
|
|||
кисахарозалотгидролизуется,врезультате |
|
|
|
|
|
|||
образуетсясмесьглюкозыифруктозыв |
|
|
|
|
|
|||
равныхколичествахскусственный( мёд). |
|
|
|
|
|
|||
Процессгидролизасахарозы |
|
|
|
|
|
|||
называется инверсией, |
таккакприэтом |
|
|
|
||||
наблюдаетсяизменениеправоговращ ния |
|
|
|
|
|
|||
раствораналевое. |
|
|
|
|
|
|
|
|
Дисахариды |
– этосахароподобныесложные |
|
|
|
||||
углеводы,молеку |
|
лыкоторыхпригидролизе |
|
|
|
|||
распндвеамолекулыдаютсямоносахаридов. |
|
|
|
|
|
|||
МолекулярнаяформулаС |
|
|
|
12Н22О11. |
||||
Дисахаодевприжатсяодыуктах |
|
|
|
|
|
|||
природногопроис:сахожденияароза |
|
|
|
|
|
|||
(свекловичныйсахар)большомколичестве, |
|
|
|
|
|
|||
до 28%, |
– |
всахарнойсвёкле;лактоза |
|
|
|
|
||
(молочныйсахар) |
|
– |
вмолоке;трегалоза |
|||||
(грибнойсахар) |
|
– |
вгрибах;мальтоза |
|||||
(солодовыйсахар)образуется |
|
причастичном |
||||||
гидкрахмалаолизедр. |
|
|
|
|
|
|
||
Строение. |
Всоставдисахаридовмогутвходить |
|
|
|
|
|||
дваодинаковыхилиразличныхмоносахарида |
|
|
|
|
|
|||
вполуацетальнойциклической( )форме. |
|
|
|
|
|
|||
Так,молекумальтозысолодовый( сахар) |
|
|
|
|
|
|||
состоитиздвухмо |
|
|
лекулα |
-D-глюкозыв |
||||
пиранозной форме,связанныхмеждусобойl |
|
-4- |
||||||
α-гликозиднойсвязью. |
|
|
|
|
|
|||
Вовтороммон статкеахаридноммолекулы |
|
|
|
|
|
|||
мальтозысохра |
|
няетсясвободный |
||||||
полуацетальныйгидр.Пэтойпричинексилв |
|
|
|
|
|
|||
растворемальтозаможетсуществовать |
|
|
|
|
|
|||
таутомерныхформах:циклической |
|
|
|
|
|
|||
гидроксикарбонильной,находящихсямежду |
|
|
|
|
||||
собойвдинамическомравновесии. |
|
|
|
|
|
|||
56. |
скоростьхимическойреакции |
|
|
|
|
|
||
зависимостьск природырости |
|
|
|
|
|
|||
концентрации. |
|
|
|
|
|
|||
Однако,зависимскоприродыростисть |
|
|
|
|
|
|||
проявляетсязависимостиотсвойствсамих |
|
|
|
|
|
|||
веществтвердость( ,энергоотрицательность |
|
|
|
|
||||
т.д.). |
|
|
|
|
|
|
|
|
Чемменьшеконц,тбыстреемнтрация |
|
|
|
|
|
|||
пройдетреак |
|
цияпотому,чток л |
|
|
-вовеществ |
|||
будетпочтиравнопрреакциидуктбудет |
|
|
|
|
|
|||
полным.Чембольшеплощадьповерхности |
|
|
|
|
|
|||
соприкосновенияреагирующихвеществтем |
|
|
|
|
|
|||
быстреепройдетреакция.Дляэтогонередко |
|
|
|
|
|
|||
веществаразмельчаютсяилисжижаются. |
|
|
|
|
|
|||
Температурапозволяет |
|
меньшитьэн.барьер |
||||||
дляначалареакций.Онапопростуускоряет |
|
|
|
|
|
|||
движениеатомпоэтомучаще |
|
|
|
|
|
|
||
сталкиваютсядругдругом,позволяя |
|
|
|
|
|
|||
соквратитьпредемябольшестовляя |
|
|
|
|
|
|||
энергии.Катализаторынеобходимыдлятехже |
|
|
|
|
|
|||
ускорений,носаминеиспользуютсявовр |
|
|
|
|
емя |
|||
реакций. |
|
|
|
|
|
|
|
|
Подскоростьюхимическойреакцпон мают |
|
|
|
|
|
|||
измеконенодцеинзетрацииого |
|
|
|
|
|
|||
реагирующихвеществединицувремени. |
|
|
|
|
При |
|||
этомбезразлично,какомизучаствующих |
|
|
|
|
|
|||
реакциивещесиде:всетчьонисвязаныве |
|
|
|
|
|
|||
междусобойуравнениемреакции.
Вз ависимостиотприродыреагирующих веществреакциимогутпротекатькакочень медлнекоторыеннореакции( между органичвещ,многиеесреакцтвамикис и участиемтвердыхвеществ,как,например, коррозияме),таоченьлловбыстро
(ионныереакциивраств орах)В. промежутслучаескорреакцииочномсть можетбытьтакой,чтоеенетрудноизмерятьв ходекороткогоопыта.
Зависимостьскорреакцприродысти веществоченьсл, связанажнаих составомистроением.Химическийпроцесс
всегдапредставляетсо бойнекоторую перегруппировкуатомов,..ихобмен местами,разъединениеили,наоборот, объединенотдельныхатоилимолекулвв бослее.ожныеСовершенноестественно,что подобныепроцессымогутразвертываться лишьпридостаточноте ближениином молекулреагент.Анаэтотпрвоцессв значительнойстепенивлияетсо роениеав реагирующихвеществ.
Приповышениитемпературыскорость реакций,какпра,резковилоозрастает. На,прикомнатнойтемпературе скоростьвзаимодействияводорода кислородомпрактическинулевая,при температуре400Сонаделз° метнойется, хотяиостаетсянебольшой,притемпературе 600Среакцияпротекает° совзрывом. Число,показывающее,восколькораз увеличиваетсяскоростьреакциипри
повышениитемпературына10С, ° называется температурнымкоэффициентомскоростиγ)( этойреакции.
57. сложныеэфирыпищевыеэссенции
способыполученияхимичесвойствакие
сложныхэфиров .
-этос единения,содержащиекарбоксильную
группу,связаннуюдвумяалкильными
радикалами. Длясложныхэфихарактерныов трив дазомерии:
1Изомерия. углероднойцепиначинаетсяпо кислотномуостатбутановойкислоты,по
спиртовомуостатку |
– спропило вогоспирта, |
напр,этилбутиизомемерратуны |
|
этилиз,пробутиратпилацеат |
|
изопропилацетат. |
|
2Изомерия. положесложноэфирнойия |
|
группировки –СО–О–.Этотвизомериид начинаетсясосложныхэфиров,молекулах котсодержитсярыхменееатомов4 углерода, напрэтилацетатмер метилпропионат.
3Межкл. изоме,напрссовая, имер метизомлацпропановекислотатурна. я
Длясложныхэфиров,содержащих |
|
непредельнуюкиснепредельныйиоту |
|
спирт,возможныещед иадазомерии: |
|
изомеположекратнойиясвязия |
цис -, |
транс-изомерия. |
|
11Физиче.2.свойсложныхэфировкиетва |
|
Сложныеэфирынизшихкарбоновыхкислот |
|
спиредставляюттовсобойлетучие, |
|
нерастворводежидкости.Многмыезе |
|
нимеютхприятныйзап.Т,напримеркх, |
|
бутимеелбузапахананастират |
а, |
изоамилацетат – грушит.д. |
|
Сложныеэфирывысшжирныхк слот |
|
спиртов – воскообразныевещ, имеютства |
|
запаха,вводенер створимы. |
|
11Химиче.3.свойсложныхэфтвакиеров |
|
1Реакция. гидролиза,илиомыления.Так,как |
|
реакцияэтерификацииявляет |
сяобратимой, |
поэтомувприскислотпротекаеттствии |
|
обреакцияатнаягидролиза: |
|
2Реакция. присоеди.Сложэфиры, ненияые |
|
имеющиевсвоемсоставенепр дельную |
|
кисспиртл,отуспособныкреакциям |
|
присоединения. |
|
3Реакция. восстановления.Восстановление |
|
сложныхэфирводородомприводитк |
|
образованиюдвухспиртов: |
|
Получесложэфиров.Данныеиеых |
|
соедширокораспространеныненияв |
|
природе.Так,эфнизкомолекулярныхры |
|
среднихкарбоновыхкислотгомологического |
|
рядавляютсячастьюэфирмаселмногихых |
|
растенийнапример(,уксусноизоамиловый |
|
эфир,илигрушевая«эссенция»,которая |
|
входитсоставгрушмногихцветов),а эфирыглицеролавысшжирныхк слот – химическойосновойвсехж маселров.
Некоторыеслож ныеэфирыполучают синтетическимпутем.
58. Соли, их состави названия,
взаимодействиес металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления -
восстаиионногообменаовления.
Назв:название+названиеяонак тиона |
|
|
|
вро дительномпадеже |
+степеньокисления |
|
|
металла. |
|
|
|
1водных.Bрасолитврем гутагих |
|
ровать |
|
сощелочами.Так,хлористыймагнийMgCl2 |
|
|
|
взаимодействедкимнатром,образуетя |
|
|
|
новуюсольи воеснование: |
|
|
|
2Солимогут. реагироватьскислотами.Так, |
|
|
|
растворазотнокислогобарияВа(гЮз) |
|
|
|
взаимодействуетрас |
творомсернойкислоты, |
|
|
образновкислотуновуюясоль: |
|
|
|
З.Вводныхрасолитврем гутагих |
|
ровать |
|
междусобой. |
|
|
|
Есливместеводныетьрастворы |
|
|
|
хлористогокальцияCaCl |
2 яуглекислого |
||
натрияNa |
2CO3 TOтотчасжеобразуется |
|
|
белыйоса |
докнерастворимоговоде |
|
|
углекислогокальцияСаСО |
3,аврас |
творе — |
|
хлористыйнатрий: |
|
|
|
4Вводных. расолейтвормет,вхоаллх |
|
дящий |
|
вихсост,можетзавмещатьсядру |
|
гим |
|
металлом,стоящимдонеговрядуак |
|
|
|
тивности. |
|||
Есливра ернтвормедкпуислойтить |
|
|
|||||
чистуюжелезнуюпроволиликусокучек |
|
|
|||||
ци,тонка |
аихповерхностивыделяетсямедь, |
|
|||||
авраствореобразуетсясернокислоежелезо |
|
|
|||||
(еслибылоопущеножел)илис зорнокислый |
|
|
|||||
цинкесли( былопущенцинк): |
|
|
|
|
|
||
Ноизсернокислогоцинканельзявытеснить |
|
|
|||||
цинкмедью: врядуактивностистоит |
|
|
|||||
послецинка. |
|
|
|
|
|
||
59. |
|
Строениеатомовхим |
|
|
изакономерностей |
||
на |
примереа) |
|
… |
|
|
|
|
Рассмотримэтузаконапримереерность |
|
|
|||||
третьегопери.Уатвсехэлементовдамовтри |
|
|
|||||
энергетическихуровня,навнешнем |
|
|
|||||
энергетичуровнидетувелчисласкомчение |
|
|
|||||
электронов,вследствиеэтогоуменьшается |
|
|
|||||
радиусатома,увеличиваетсяэнергия |
|
|
|||||
ионизацииэн |
|
ергиясродствакэлектрону, |
- и |
||||
какрезультатэтого, |
|
- |
увеличиваетсязначение |
||||
электроотр.Всвязэт, имцательности |
|
||||||
металлическиесвойствапериодеослаб, вают |
|
|
|||||
анеметаллусил,кислотныеваютсяческие |
|
|
|||||
свойкисгидтватожеоврксидов |
|
|
|||||
усиливаются,о |
|
снОвныеослаб. |
вают |
||||
Вгруппах,числоэлектроновнавнешнем |
|
|
|||||
энергетичуровнат динаковоемов,ском |
|
|
|||||
связиэтэлементову одинаковаявысшая |
|
|
|||||
валентноположительнаяивысшаястепень |
|
|
|||||
окисления.Однако,засчетпоновоговления |
|
|
|||||
энергетическогоуровн |
яуатомов |
||||||
увеличрад,значиуменьшаетсявауст |
|
|
|||||
энергион,энеиясзацродствакгиия |
|
|
|||||
электронуиэлектроотрицательность. |
|
||||||
Металлическиесвойстваэлементов |
|
|
|||||
усиливаются.неметаллическиеослабевают, |
|
|
|||||
кисвл отныейкисгидтвароксидов |
|
|
|||||
осл,абевают |
оснОвныеусиливаются. |
|
|||||
С увеличением атомного номера свойства элементзаконизменяютсяовмерно . Так, углерод и кремний — типичныенеметаллы ,
оловоисвинец |
— металлы. Этопроявляется |
|
преждевсеготом |
, чтоуглеобродазует |
|
простоевещество |
-неметалл (алмаз), а свинец |
|
типичный металл. |
|
|
Германий |
занимает |
промежуточное |
положение. Согласно строению электронной оболатомачки p-элементы IV группыимеют
четныестепокисления |
: +4, +2, – 4. |
Формула простейших водородных соединений
—ЭН4, причемсвязиЭ—Нковалентныи
равноценнывследствиегибридизации s- ир - орбиталей с образованием направленных под тетраэдрическимиуглами sp3 -орбиталей.
А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнениюснеметаллическэлементамими
VII—V групппризнаки неметаллическогоэлементар -элементы IV группы проявляют в меньшей степени.
Поэтоподгруппыдляэлементовуглерода |
|
||||||
отрицатокисленнаястепнетипичнань я |
. |
||||||
60. |
|
тепловойэффектхимическойреакции |
|
||||
законгесса |
. |
|
|
– |
|||
Тепловойэффектхимическойреакции |
|||||||
количествотеплотывыделившейся |
|
||||||
поглотвходеимическойвшейсяреакциипри |
|
||||||
услов,чтоедиработойнстиявляетсяенной |
|
||||||
работарасширениятемпературыисходных |
|
||||||
веществипродуреаодинаковыциитов. |
|
||||||
Величинатепловэффектазависитого |
|
||||||
природыреаги |
|
|
руювещипродуктовихеств |
||||
реакции,ихагрегасоситоянияного |
|
||||||
температуры. |
|
|
|||||
Важнымипонят,которымиоперируетями |
|
||||||
термохимия,являютсятеплотаобразования |
|
||||||
теплотасгорания. |
|
|
|
|
|||
Теплотойобразования |
называюттепловой |
||||||
эффереаобразованииктцииоднмоляго |
|
||||||
сложноговеществаизпростых.Теплоты |
|
||||||
образпрвеществованстыхпринимаются |
|
||||||
равныминулю. |
|
|
|
|
|||
Теплотойсгорания |
|
|
|
называетсятепловой |
|||
эффереаоктцииисленияоднмоляго |
|
|
|||||
веществаизбыткекислородадовысших |
|
||||||
устоксидовйчпродуктоввыхсгорания. |
|
||||||
Например,в |
|
|
качествепродуктовсгорания |
||||
элементовC,иH,ClпринимаютN,COS |
2, H2O |
||||||
(ж), SO 2 (г), N |
2 (г), г)HCl. ( |
||||||
Основнымтермохимииявляется |
закон |
||||||
Гесса: |
тепловойэффектхимическойреакции |
||||||
приV=constилиP=constзавистолькоотида |
|
||||||
состоянияисходныхвещес |
|
твиконечных |
|||||
продук,нонезависитпутипереходаов. ДляпояснзакоГеможноссаия расследующиймотретьпример.Образование оксидажелеза(III)можнор ссматриватьили какрезультатнепосредственного взаимоддвухпростыхвеществйствия:
2Fe(т) + |
3/2 O2 (г) → Fe2O3(т)H |
1 = - 821кДж |
Втермохрасчетахиспользуютмических |
|
|
обычнорядследствийиззаконаГесса: |
|
|
1Тепловой. эффектхимическойреакцииравен |
|
|
разностимеждусуммойтеплотобразования |
|
|
продуреаисуммойкциитеплотов |
|
|
образоваисходвещесученияыхтомв |
|
|
стехиометркоэфф. ициентовческих |
|
|
ИззаконаГессавытекаюточевидные |
|
|
следствия,имеющиепрактичес |
коезначение: |
|
Тепловойэффектобразовасоедииз нения |
|
|
исходныхвещезависитне способа, |
|
|
которымэтос единениеполучено. |
|
|
Тепловойэфферазложениякакогот |
-либо |
|
химическогосоедоопределённыхинния |
|
|
продуктовравенпротивоположензнаку |
|
|
теплэффекобразованиявомутуого |
|
|
соединенияизтехжепродуктов. |
|
|
Разностьмеждутепловымиэффектами |
|
|
превдвухразличныхщениясистем |
в |
|
одинаковыепродуреаравнацииты тепловомуэффектупереходнойсистемывда другую.Илинаобор:разнтепловыхсть эффектпревращениядвуходинаковых химсивческразлстемпродуктыихчные реакцииравнатепловомуэффектуперехода
однихпродуктовреа |
|
кциивдругие. |
|||
61. |
|
термохимреакциимическиея |
|||
понятиеэнтальпии |
|
|
|||
Раздел |
- |
химическойтермодинамики |
|||
,изучающийтепловы |
|
еэффектыхимических |
|||
реакцийфазовыхпревращенийназывается, |
|||||
термохимией. |
|
|
|||
Входехимическойреакцпро сходит |
|||||
перестэнеруровнгетичойкаатомов, ейских |
|
молекул,изменяетсявнутреннэнерги, яя |
|
следов,должноательноблюдаться |
|
поглощвыделениеили |
теплоты - тепловой |
эффект. |
|
Уравненияхимическихреакций,которых |
|
укаизанымененияэнтальпиитепловые( |
|
эффектыреакций), называются термохимическими. При
написаниитермохуравнениймических указываетсяиагрегасосвеществаояниеное. Тепловыеэффектыреакцийвыражают килокДж()доднляоуляхмоляреагентаго илиреже()длямоляпродуреакции. та
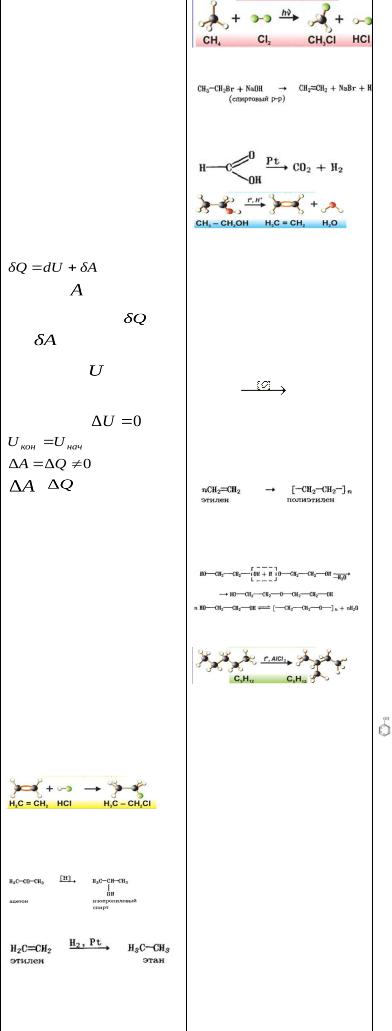
Напритермохимическое, уравнение |
|
|
|
||||||
реакциисинтезааммиака: |
|
|
|
||||||
N2(г) +Н3 2г)( = 2NH3г)( ,ΔН= |
– 92,4кДж |
|
|||||||
показывает,чтопривзаимодействии |
|
1моль |
|
||||||
азотаN |
2 имоль3водородаН |
|
2 образуется2 |
|
|||||
мольаммиакаNH |
|
3 ивыдеколяетсяичество |
|
||||||
теплоты,равное92,4кДж( |
|
|
∆Н= – 92,кДж).4 |
|
|||||
Представленноенижетермохимическое |
|
|
|||||||
уравненреакцсгоранияводородаеи |
|
|
|
||||||
кислороде: |
|
|
|
|
|
||||
H2(г) + 1/2 O |
2(г) = H 2О(ж) +кДж286 |
|
|
||||||
показывает,чтона1мольсгоревшеговодорода |
|
|
|
||||||
илинамо1бразовавшейсяльводы |
|
|
|
||||||
выделяется286кДжтеплоты(QкДж,=ΔН286 |
|
|
|
||||||
= -286кДж)Этареакция. является |
|
|
|
||||||
экзотермичхарактеризуетсяской |
|
|
|
||||||
значительнымтепловымэфф.Недаромктом |
|
|
|
||||||
водородсчитаетсяэффек |
|
|
тивнымтопливом |
|
|||||
будущего. |
Втермодинамикеважнуюроль |
|
|
||||||
играетсуммавнутреннэнергиисистU мый |
|
|
|
||||||
произдавсистемыленияедрнаобъемё |
|
|
|
||||||
V,назывэнтальпиейобозначаетсяемаяН. |
|
|
|
||||||
Н=U+pV, |
|
|
|
|
|
||||
Т.к.входящвеличинынееявляются |
|
|
|
||||||
функциямисостояния, |
исамаэнтальпия |
|
|||||||
являетсяфункциейсостояния,такжекак |
|
|
|
||||||
внутренняяэнергия,работатеплотаона |
|
|
|
||||||
измеряетсявДж. |
|
|
|
|
|
||||
Удельнаяэнтальпияпредставляетh=H/M |
|
|
|
||||||
собойэнтальпиюси,содержащейтемыкг1 |
|
|
|
||||||
вещества,иизмеряетсяДж/кг.Изменение |
|
|
|
||||||
энтальпиивлюбом |
|
|
роцессеопределяется |
|
|||||
тольконачальнымиконечнымсостояниями |
|
|
|
||||||
телаинез виситотхарактерпроцесса. |
|
|
|
||||||
Физическийсмыслэнтальпиивыяснимна |
|
|
|
||||||
примере: |
|
|
|
|
|
||||
Рассмотримрасширеннуюсистему, |
|
|
|
||||||
включающуюгазцилиндрепоршс нь |
|
|
|
||||||
грузом,общимвесомGЭнергияэтой. си |
|
стемы |
|||||||
складываизвнутреннейэнгазаргиится |
|
|
|
||||||
потеэнциальпоршерсгрузомии. няой |
|
|
|
||||||
|
62. |
типысисоткрытаяизолированаяем |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
системапервоеначалотермодинамикидля |
|
|
|||||||
каждойизтипов |
. |
|
|
|
|
||||
Подтермодинасистемической |
|
|
|
||||||
подразумевасовокупностьизбраннтелю |
|
|
|
||||||
иливеществ,состизбольшогоящуючисла |
|
|
|
||||||
структурныхединицмолекул( ,атомов,ионов) |
|
|
|
||||||
иотделенокружающейвнуюсредыешней |
|
|
|
||||||
опредегранилиповеннойцрхностью |
|
|
|
||||||
раздела. |
Внешнююср |
едуиливнешниймир |
|
||||||
представляетсобойто,чтонаходитсявне |
|
|
|
||||||
оболочкисистемы. |
|
|
|
|
|
||||
Выделентермодсиистеназмыической |
|
|
|||||||
окружающсредыиливнешнегомирасьмай |
|
|
|
||||||
относит.Менсложныесистемыльно, |
|
|
|
||||||
являясьсамостоятельструктурной |
|
|
|
||||||
единицей,могутдновре |
|
меннобыть |
|
||||||
состчабостямивнымилееожных,стем |
|
|
|
||||||
этомслучаеоничастоназываются |
|
|
|
||||||
подсистемами.Этопроиллюстрироватьжно |
|
|
|||||||
напримеребиологическихсистем, |
|
|
|
||||||
расположенныхвпорядкеусложненияв |
|
|
|
||||||
следующемиерархическомряду: |
|
органелла – |
|||||||
клетка – ткань – орган – системаорганов |
– |
||||||||
организм – популяция – биоценоз – биосфера. Границазделаилиповерхность
термодинасистемыической |
может |
||
представлятьсобойкакую |
-нибудьреал ную |
||
оболочку.Например,стенсосуда,вкотором |
|
|
|
осуществляетсяхимичреакция, ска |
|
мбрана |
|
животнойрастительнойклетки.Ночаще |
|
|
|
всегоэтаграницабываетвоображаемойили |
|
||
условнойинаделезар данныминееной |
|
|
|
свойствами. |
Так,онаможетбытьпроницаемой |
|
|
илинетеплопроводной,механическижесткой |
|
||
илинежестк,..спосизменятьосвобной |
|
и |
|
размеры. |
|
|
|
Взависимостиотсвойствповерхностираздела, |
|
|
|
термодинасистеделятся,впервуюмыические |
|
||
очередь, |
|
|
|
на изолированные,закрытыеиоткрытые(рис. 2). |
|||
Изолсированныестемы |
|
немогут |
|
обмениватьсяокружающейсредой |
|
|
|
веществом,ниэнергией. |
|
Закрытые |
|
системыобмесвниваютсяешниммиро |
|
||
толькоэнергией,а |
|
открытые– |
ивеществом,и |
энергией. |
|
|
|
Следуетпод,чтореальныееркнутьсистемы |
|
|
|
никогданебываютабсолютно |
|
|
|
изолирова,онитойшьилиннымиой |
|
|
|
степениприближаютсякданномупо, ятию |
|
|
|
полностьюнимнесовпадают. |
|
|
|
Некоторыесистемыможнопом(еальностить |
|
|
|
илимысленно)вусл,к твияр |
|
|
ыеделаютих |
искусственноизоли.Прованнымиимером такойизолсироваможстемысчитатьнной химическуюреакцию,идущуювтермостате. Измененэнергиивходепротеканияреакции компенсируетсявключениемили выключнагр,результатевателяниемчего общая энергиясистемыбудетоставаться постоянной.
Закрытиоткрсисымогутеемыые |
|
существоватьреально,причемнаиболее |
|
распространеннымисистемамивприроде |
|
являютоткрыси.Кихстемыячислуые |
|
относятсявсебиологическиесистемы: |
|
животныерастительныек |
летки,организмы, |
человекит.д.Примеромзакрысистемыой |
|
явлюбойяетсягерметическийсосуд,в |
|
которомпротектаилиинхимическаяяет |
|
реакция. |
|
Термодоткрысиописываетсянамикатемых |
|
спомощьюсложногоматематического |
|
аппарата,котднастоящегорый |
времени |
полностьюнеразр.Закрытыеиботан |
|
особенноизолсистемырованныеимеютболее |
|
просматематическоеоп, сание |
|
полученаихосноверезультатыныечасто |
|
успешноисподпрогнозированияльзуются |
|
протеканияаналогфиз чныхко |
-химических |
процессов открысис. темахых |
|
Взависимостиотсвоегосостава |
|
термодинасистеподразделяютсямыические |
|
на простыеилиоднокомпонентныеисложныеил имногокомпонентные
Первоеначалотермодинамики |
|
|
||||
|
|
|
|
|
. (2) |
|
Здесьпод |
|
понимаетсяработа, |
|
|||
совершаемаятелом.Бес |
|
конечномалое |
|
|||
изменениеколи |
-честватепла |
,также |
||||
каки |
,невсегдаявляетсяполным |
|
||||
дифференциа.Согласноопределомению |
|
|
||||
внутренняяэнергия |
|
естьоднозначная |
||||
функциясостотермодинаминия |
|
-ческой |
||||
сист.Поэтоебесконечномымалоеу |
|
|
||||
измененявляетсяполнымдифференциа |
|
-лом. |
||||
Вкругпроцвом |
ессе |
,таккак |
||||
|
|
|
|
|
.Приэтом |
|
|
|
|
|
|
(см.рис. Значения2). |
|
|
|
|
и |
зависятотвидатеплового |
|
|
процесса. |
|
|
|
|||
Первоеначалотермодинамикиявляется(2) |
|
|
||||
универсальнымзакономприроды.Оносправе |
|
- |
||||
дливоюбыхятепроцессовл илюбыхвых |
|
|
||||
агрегасосвещтоянийных.Вествадемще |
|
|
|
|||
одуважнуюфизичес |
|
куювеличину, |
|
|||
необхдляколичественногодописаниямую |
|
|
||||
тепроцессовл .вых |
|
|
|
|||
|
63. |
|
типы химическихреакцийв |
|
||
|
|
органическойхимусловиях |
|
|
|
|
протекания. |
|
|
|
|||
Разделхимическихреакцийние |
|
|
|
|||
неорганическиеявляется |
|
|
||||
довоусл.Ктипичнымовнымьно |
|
|
||||
органическимреакциямотносятте,вкоторых |
|
|
||||
участвуетхотябыодноорганическое |
|
|
||||
соединение,котвходереакциироеизменяет |
|
|
||||
своюмолекулярнуюструктуру.П |
|
оэтому |
||||
реакции,вкотморыхорганическоголекула |
|
|
||||
соединениявыступаеткачерастворителя |
|
|
||||
или,ктипичнымгандаорганическим |
|
|
||||
реакциямнеотносятся. |
|
|
|
|||
Ворганическойхимначастоболее |
|
|
|
|||
встречаютсяследующиетипыхими |
|
|
ческих |
|||
реакций: |
|
|
|
|||
1Реакции. присоединения. |
Вэтомслучаеиз |
|
||||
двухилинеск( )молобразуетсяькихул |
|
|
||||
одноновоевещество |
|
|
|
|||
Креакциямприсоединенияжтнести |
|
|
||||
реакциивосстановленприсоединение( я |
|
|
||||
атомовводорода)Этареакция. является |
|
|
||||
обратнойеакисленияциидействие( |
|
|
||||
восстанреагентаобознвливачаетсяющего |
|
|
||||
схемереакциисимволом |
|
[Н]) |
|
|||
Часлучтнымревосстановлениякциием |
|
|
||||
являетсягидрирование |
|
|
||||
2Реакции. замещения. |
|
Вмолекулеодинат |
ом |
|||
(илигруппаатомов)замещаетсядругим |
|
|
||||
атомомили(группойатомов),результате чегообразуютсяновыесоединения
3Реакции. отщепленияэлиминирования( ). |
В |
результатетакойреак |
цииобразуетсяновое |
вещество,содекратнуюсвязьжащее |
|
4Реакции. разложения. Этиреакцииприводят кобразованиюновыхвеществболеепростого строенияврезультатеразложисходногония соенадваиболеененияли
5Перегруппировки. . |
Приэтомпроисходят |
|||||||
внутримолекулярныепе |
ремещенияатомовили |
|||||||
группатомовбези молекулярнойенения |
|
|
|
|
||||
формсоединений,улычаствующ |
|
|
|
ихвреакции |
||||
СН2 =СН → СН3 – СО= |
|
|
|
|
||||
׀ ׀ |
|
|
|
|
|
|
||
ОН |
|
|
|
|
|
|
||
6Реа. окисленияции. |
|
|
|
|
Приокислении |
|||
исходногоедкислонения |
|
|
|
|
родомвоздуха |
|||
присутствкатализаторовилиок слителями |
|
|
|
|
||||
(дейст виеокисляющегореагентаобозначается |
|
|
|
|||||
всхемереакциисимволомО])[образуется |
|
|
|
|
|
|||
новоевещество |
|
|
|
|
|
|
||
О |
|
|
|
|
|
|
||
// |
|
|
|
|
|
|
|
|
СН3СН2ОН |
|
|
|
СН3 – СН+ 2О |
||||
\ |
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
||
этиловыйспиртуксусныйальдегид |
|
|
|
|
|
|||
7Реакц. поли. меризации |
|
|
|
Врезультате |
||||
присоединениядругкдругубольшогочисла |
|
|
|
|
|
|||
простыхвеществмономеров( )образуется |
|
|
|
|
|
|||
вещесложнстрвобоениягольшой |
|
|
|
|
|
|||
молекулярноймассойполимер( ) |
|
|
|
|
|
|
||
8Реакцконденсации. |
|
|
|
|
|
|||
поликонденсации. |
Образуетсясложное |
|||||||
вещрествозультатесоединнесколькихния |
|
|
|
|
||||
молекулиногда( |
|
— |
большогочисла), |
|||||
протекающсотщеболееростыхегонием |
|
|
|
|
|
|||
веществводы(,аммиака.п.) |
|
|
|
|
|
|
||
9Реакции. изомеризации |
|
|
.Образуетсяновое |
|||||
вещрествозультатеперегруппировки |
|
|
|
|
||||
элементарныхзвеньев. |
|
|
|
|
|
|
||
|
|
углеводыклассификацияосновные |
|
|
|
|||
64. |
|
|
|
|||||
|
представителифизическиехимсвойства |
|
|
|
|
|
||
Углеводы – |
|
вещества,имеющие |
|
|||||
первостепенноебиохимическоезначение, |
|
|
|
|
||||
широкораспространенывживойроде |
|
|
|
|
|
|||
играютбольшуюрольвжизничеловека. |
|
|
|
|
|
|||
Названиеуглеввозниклонадысновании |
|
|
|
|
|
|||
данныханализапервыхизвестных |
|
|
|
|
|
|||
представителейэтойгруппысоединения. |
|
|
|
|
|
|||
Вещества этойгруппысостоятизуглерода, |
|
|
|
|||||
водородаикислор,причемсоотношениеда |
|
|
|
|
||||
чиселатомовводородаикислорнихтакоеда |
|
|
|
|
|
|||
же,какивводе,т..накаждыеатома2 |
|
|
|
|
|
|
||
водородаприходитсяодинатомкислорода.В |
|
|
|
|
|
|||
прошстоихрассматривалиометиикак |
|
|
|
|
||||
гидратыуглер |
ода.Отсюдаивозниклорусск е |
|
|
|||||
названиеуглеводы,предложенное1844. |
|
|
|
|
||||
К.Шмидтом.Общаяфоруглеводов,ула |
|
|
|
|
|
|||
соглска,Сснозанному |
|
|
|
|
мН2п Оп.При |
|||
вынесении«n»заскобкиполучаетсяформула |
|
|
|
|
|
|||
См(Н 2О) n,котораяоченьнаглядноотражает |
|
|
|
|||||
названиеугле« |
- воды»Из. углеводовчение |
|||||||
показало,чтосуществуютсоединения, |
|
|
|
|
|
|||
котпвосрыеемвойснужтнвестиамо |
|
|
|
|
|
|||
груглеводппу,х имеютнитясо,нестав |
|
|
|
|
|
|||
точносоответствующийформуле |
|
|
|
|
||||
СмH2п Оп. Темменеестар |
|
|
|
иназваниеное |
||||
«углеводы»,сохранилосьдонашихдней,хотя |
|
|
|
|
|
|||
нарядусэтимназваниемдляобозначения |
|
|
|
|
||||
рассматриваемойгруппывеществиногда |
|
|
|
|
|
|||
приболееменовоеяютазвание |
|
|
|
– глициды. |
||||
Углеводы можразделитьно |
|
|
три |
|||||
группы: 1) Моносахариды – |
углеводы, |
|||||||
способныегидрсобразованиемлизоваться |
|
|
|
|
|
||||
болеепростыхуглевод.Кданнгруппеовй |
|
|
|
|
|
|
|||
относятсягексозыглюкоза( ифруктоза), |
|
|
|
|
|
|
|||
такжепентозарибоза(). 2) |
|
Олигосахариды – |
|||||||
продуктыконднесколькихнсации |
|
|
|
|
|
|
|||
моноснапримерхарид,сахар(). овза |
|
|
|
|
|
|
|||
3) Полисахариды – |
полимерные соединения, |
||||||||
содержащиебольшоечисломол кул |
|
|
|
|
|
|
|||
моносахаридов. |
|
|
|
|
|
|
|||
Моносахариды. Моносахаридыявляются |
|
|
|
|
|||||
гетерофункциональнымисоед.В хнениями |
|
|
|
|
|
||||
молекулаходноврсоди ржатсяменно |
|
|
|
|
|
|
|||
карбональдег( илкетоннаяиьная),идная |
|
|
|
|
|
|
|||
несколькогидроксильныхгрупп,т.. |
|
|
|
|
|
|
|||
моносахаридыпредставляютсобой |
|
|
|
|
|
||||
полигидроксикарбонильныесоединения |
|
|
|
- |
|
||||
полигидроксиальдегиды |
|
|
|
|
|
||||
полигидроксике.Взависимотэтог тоныи |
|
|
|
|
|
||||
моносахподрнарильзделяютсяв( озы |
|
|
|
|
|
|
|||
моноссодержальдегиднаяхаргруппаи)тся |
|
|
|
|
|
|
|||
икетс(одержитсязыкетогруппа)На. |
|
|
|
пример, |
|||||
глюкоза – этоальдоза,фруктоза |
|
– этокетоза. |
|
|
|||||
Получение. |
Всвободномвидеприроде |
|
|
|
|
|
|||
встречаетсяпреимущглюкоза.Онажественно |
|
|
|
|
|
||||
являетсяструктурнойедимногихице |
|
|
|
|
|
|
|||
полисахаридов.Другиемоносахариды |
|
|
|
|
|
||||
свободномсостояниивстревчаютсядко |
|
|
|
|
|
|
|||
основномизвестныкаккомпонентыолиго |
|
|
- |
и |
|||||
полисахаридов.Вприродеглюкозаполучается |
|
|
|
|
|
|
|||
врезультатереакциифотосинтеза: |
|
|
|
6CO2 + |
|||||
6H2O ® C6H12O6(глюкоза) + 6O |
|
2 Впервые |
|||||||
глюкозаполученав году1811русским |
|
|
|
|
|
|
|||
химикомГ.Э.Кирхгофпригидролизем |
|
|
|
|
|
|
|||
крахмала.Позжесинтезмоносахаридовиз |
|
|
|
|
|
||||
формальдегидавщелочнойсредепредложен |
|
|
|
|
|
|
|||
А.М.Бутлеровым |
|
|
|
|
|
|
|||
O II 6C–H ––Ca(OH)2® C6H12O6 I H |
|
|
|||||||
Впромышленносглюкозуполучаюти |
|
|
|
|
|
|
|||
гидролизом крахмалавприсутствиисерной |
|
|
|
|
|
||||
кислоты. |
|
|
|
|
|
|
|
||
Физичесвой. ствакие |
|
Моносахариды – твердые |
|||||||
вещрастворимыеа,легководе,плохо |
|
|
|
– в |
|||||
спиртесовсемнерастворимыеэфире. |
|
|
|
|
|
|
|||
Водныерастворыимеютйтральную |
|
|
|
|
|
|
|||
реакциюналакмус.Большинство |
|
|
|
|
|
|
|||
монобладаютсахаридов |
сладкимвкусом, |
|
|
||||||
однакоменьшим,чемсвекловичныйсахар. |
|
|
|
|
|
|
|||
Физичесвой. скиетва |
|
Глюкоза |
-- бесцветное |
||||||
кристалвеществососладкимичевкусом, кое |
|
|
|
|
|
|
|||
хорастворимошо.Изводндеоего |
|
|
|
|
|
|
|||
раствораонавыделявидется |
|
|
|
|
|
|
|||
кристаллогидратаС6Н12Об*Н2.По |
|
|
|
|
|
|
|||
сравнсосвеклниюсахаромвичнымна |
|
|
|
|
|
|
|||
менеесладкая. |
|
|
|
|
|
|
|
||
Глюкозаможетсуществоватьлинейн |
|
|
|
ойи |
|
|
|||
циклическойформах: |
. |
|
|
|
|
|
|||
|
Фенол, егохимическоестроени |
|
|
|
, |
||||
65. |
|
|
|
||||||
|
|
|
|
|
|
|
|
||
|
свойства, получениеприменение |
|
. |
|
) |
||||
Фенол (оксибензол, устар. карболоваякислота |
|
||||||||
|
́ |
— |
бесцветныеигольчатые |
|
|
||||
C6H5OH |
|
|
|||||||
кристаллы, розовеющиенавоздухеиз |
|
|
-за |
||||||
окисления, приводящкокрашегонным |
|
|
|
|
|
||||
продуктам. Обладаютспецифи |
ческимзапахом |
|
|
||||||
гуаши. Растворимводе |
(6 гна |
100 гводы ), в |
|||||||
растворах |
|
|
|
|
щелочей́ |
||||
,вспирте,вбензоле,вацетоне.5%растворвводе- |
|
|
|||||||
антисептик, шипрокоивменяемыйдицине |
|
|
|
|
|
||||
Химичесвойствакие |
Обладаетслабыми |
|
|
||||||
кислотнымисвойствами |
, |
придействии |
|
|
|||||
щелочейобр |
азуетсоли |
— феноляты. |
|
|
|||||
|
|
Вступавреакцииэл ктрофильного |
|
|
|
|
|
||
|
|
замещенияпоароматическомукольцу |
|
|
|
. |
|||
Гидрокси-группа, являясьоднойизсамых |
|
|
|
|
|
||||
сильдонгруппорных |
|
|
, |
увеличивает |
|||||
реакционнуюспос этимльцабность |
|
|
|
|
|
|
|||
реакциям, инапразамещвортоляениет |
|
- |
и |
||||||
пара-положения. |
Фенолслёгкостью |
|
|
||||||
алкилируется, ацилируется, галогенируется,
нитруетсясульфируется |
. |
|
|
РеакцияКольбе |
-Шмидта. |
|
|
Токсическиесвойства |
|
Фенядовитл |
. |
Вызываетнарушфу кцийрвнойе |
|
|
|
системы. Пыль, парыирастворфенола |
|
||
раздражаютслизис |
тыеобоглазочки |
, |
|
дыхательныхпутей |
, кожу (ПДК 5мг/м3, |
в |
|
водоёмах 0,001 мг/л). |
|
|
|
Применение Подананым |
2006 годмировое |
|
|
потрфеимблноласлениедующуют |
|
|
|
структуру: 44 |
% |
феноларасходуетсяна |
|
производствбоисфенолаА, который, всвою |
|
||
очередь, используетсядляпроизводства |
|
||
полиэпоксидныхкарбонатовсмол |
; 30 |
% |
|
феноларасходуетсянапроизводствфо |
|
|
|
енолформальдегидныхсмол |
; 12 |
% |
|
фенолагидрированиемпревращаетсяв |
|
||
циклогексанол, исподпользяуемыйчения |
|
||
искусственволоконых |
— нейлонаи |
|
|
капрона; остальные 14 % расходуютсяна |
|
||
другиенужды |
, втомчисленапроизводство |
|
|
антиоксидантов (ионол), |
неионогенныхПАВ |
|
|
