
01.Лечебное дело / Биоорганическая химия / 06.Дополнительно / Всякое / -1_stomat_med_r-r_metodichka-3
.pdfВ пробирку внести 5 капель раствора мыла и 1 каплю раствора хлорида кальция, смесь перемешать. Отметить внешний эффект, написать уравнение реакции, сделать выводы.
11.4. Реакция ненасыщенных жирных кислот.
В пробирку внести 5 капель масла и 4 капли бромной воды, перемешать. Отметить внешний эффект, написать уравнение реакции, сделать выводы.
Тема: РЕАКЦИОННАЯ СПОСОБНОСТЬ И БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ГЕТЕРОФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ
( ОКСИКИСЛОТЫ, ОКСОКИСЛОТЫ, ФЕНОЛОКИСЛОТЫ)
1.Актуальность темы: Гетерофункциональные производные – окси и оксокислоты являются продуктами обмена веществ в организме человека, фенолокислоты используются в медицине как лекарственные препараты. Реакционная способность этих соединений обусловлена наличием разных функциональных групп в молекуле, что определяет особенности их метаболических превращений в организме.
2.Цель общая – уметь использовать знание стереохимии и реакционной способности гетерофункциональных соединений и взаимного влияния функциональных групп для обьяснения особенностей обмена углеводов, липидов, аминокислот и их производных в организме.
3.Конкретные цели, уметь:
объяснять зависимость реакционной способности и биологических функций гетерофункциональных соединений от их строения и подходы к синтезу лекарственных средств на их основе.
4.Литература:
Основная:
4.1.Лекционный материал.
4.2.Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия, 1985, ст. 239 – 250; 1991, ст. 250 – 266.
4.3.Руководство к лабораторным занятиям по биоорганической химии,
под ред. Тюкавкиной Н.А., 1985. ст. 147 – 149, 154 – 156,
4.4.Рево А.Я. и др. Малый практикум по биоорганической химии. 1980 ст.
69.
.
Дополнительная:
4.5. Грандберг И.И. Органическая химия, М., 1980г.
31
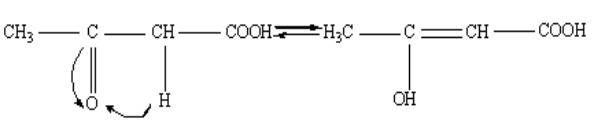
4.6.Райлс А., Смит К., Уорд Р. Основы органической химии (для студентов биологических, медицинских и сельскохозяйственных специальностей),
М., 1982г.
4.7.Терней А. Современная органическая химия, т.1,т.2, М., 1981г.
4.8.Чичибабин А.Е. Основные начала органической химии, т.1,т.2, М.,
1963г.
4.9.Каррер Н. Курс органической химии, М., 1960г.
4.10.Овчинников Ю.А. Биоорганическая химия, М., 1987г.
4.11.Степаненко Б.Н. „ Курс органической химии” 1972 г.
5.Основные вопросы темы:
5.1Оксикислоты (молочная, винная, лимонная, - оксимасляная, яблочная ), общие свойства, специфические реакции: Химизм их образования в организме человека и биологическое значение этих соединений.
5.2.Оксокислоты (пировиноградная, ацетоуксусная, щавелевоуксусная). Кето– енольная таутомерия. Химические свойства, реакция декаброксилирования.
5.3.Фенолокислоты и их производные. Использование салициловой кислоты и ее производных как лекарственных препаратов (салицилаты натрия, метилсалицилат, салол, ацетилсалициловая кислота.)
6.Вопросы для самостоятельного внеаудиторного изучения:
6.1.Классификация и изомерия оксикислот. Хиральность. Энантиомеры, диастериомеры.
6.2.Кетоновые тела, диагностическое значение их для выявления сахарного диабета.
7.Эталоны решения заданий:
7.1.Какая изомерия характерная для - кето - кислот (на примере ацетоуксусной кислоты) ?
Решение. В результате взаимного влияния кетонной и карбоксильной групп в молекуле образуется СН – кислотный центр, что обуславливает кето - енольную таутомерию.
Енольная форма более реакционно способная, чем кетонная.
32
8. Задание для закрепления материала (выполнить в протокольной тетради):
8.1.Напишите проекционные формулы энантиомеров лактата (молочной кислоты.
8.2.Напишите кето- и енольную формы пирувата (пировиноградной кислоты), реакцию ее восстановления и взаимодействия с этанолом.
8.3.Напишите уравнение специфических реакций с α , β и γ оксокислотами
9. Пример тестового контроля:
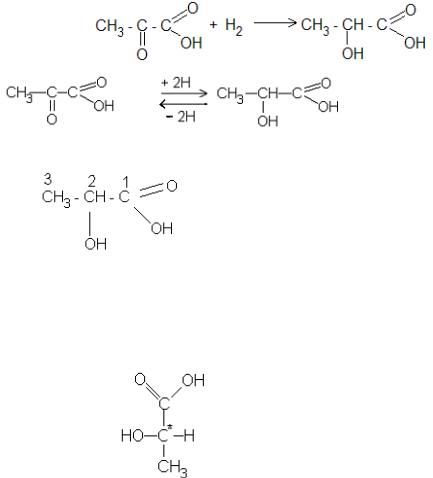
9.1. Напишите схему образования молочной кислоты и дайте характеристику ее химических свойств.
Ответы:
9.1.Образование в организме человека:
пировиноградная молочная
а)
С1,– sp2; С23 – sp3 ; С1 – С2 - sp2 – sp3; С2 |
– С3 - sp3 – sp3; |
(С1 - С2) |
(С2 - С1) |
б) для молочной кислоты характерная энантиомерия:
L-конфигурация
в) в карбокси–группе наблюдается р, - сопряжение:
33

г) проявляются электронные эфекты :
д) оксигруппа проявляет слабые кислотные свойства и дает соли алкоголяты R – OМе, а карбоксигруппа – сильнее и образует соответствующие соли R –COOМе - лактаты.
е) по карбоксигруппе лактат (молочная кислота) дает производные - эстеры и галогенангидриды:
ангидриды амиды
ж) оксигруппа может смещаться на галоген.
з) в организме человека происходит обратимое превращение лактата в пируват.
10. Алгоритм лабораторной работы:
10.1.Доказательство наличия двух карбокси-групп в винной кислоте.
10.2.Доказательство наличия гидроксильных групп в винной кислоте.
10.3.Разложение лимонной кислоты.
10.4.Получение и растворимость кальций цитрата и кальций тартрата.
10.5.Опыт отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирин) и ее гидролиз (опыт доброкачественности ацетилсалициловой кислоты).
11.Лабораторная работа:
11.1. Доказательство наличия двух карбокси-групп в винной кислоте.
В пробирку внести 5 капель раствора тартрата (винной кислоты), добавить 2 капли раствора КОН и стеклянной палочкой потереть стенки пробирки до образования осадка. Затем добавить 4-5 капель раствора КОН. Написать уравнения реакций, описать внешний эффект и сделать выводы.
Пробирку с раствором оставить для следующего опыта.
34
11.2. Доказательство наличия гидроксильных групп в винной кислоте.
В пробирку вносят 2 капли раствора СuSO4 и 2 капли раствора NaOH. К осадку, что образовался прибавить раствор из первого опыта. Написать уравнения реакций, описать внешний эффект, сделать выводы. Где применяется полученный раствор и под каким названием?
11.3. Разложение лимонной кислоты.
В сухую пробирку с газоотводной трубкой внести цитрат (лимонная кислота) слоем 1 см и 1 мл Н2SО4 конц. нагреть. Конец газоотводной трубки опустить в пробирку с 1 мл баритовой воды, а затем в пробирку с раствором Люголя обесцвеченного раствором NaOH. Написать схему реакции разложения. Описать внешний эффект реакции, сделать выводы.
11.4. Получение и растворимость кальций цитрата и кальций тартрата. Растворить в одной пробирке несколько кристалов цитрата лимонной кислоты, а в другой – тартрата (винной кислоты). Кислоты нейтрализовать раствором NH4OH (проверить лакмусом), потом прибавить 2-3 крапли раствора CaCl2. В одной пробирке осадок випадает сразу, а другую пробирку с раствором прокипятить 2-3 мин. Что наблюдается? Написать уравнение реакций, описать внешний эффект, сделать выводы.
11.5. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирин) и ее гидролиз (доказательство доброкачественности ацетилсалициловой кислоты).
В пробирку внести кусочек таблетки аспирина, прибавить 5-6 капель воды, перемешать, прибавить каплю раствора FeCl3. Если наблюдается внешний эффект, обьяснить его. Если изменений нет, тогда пробирку прокипятить 0,5мин. и прибавить 1 каплю раствора FeCl3. Что наблюдается? Написать уравнение реакции , описать внешний эффект и сделать выводы относительно доброкачественности ацетилсалициловой кислоты.
Тема: СТРОЕНИЕ И ХИМИЧЕСКИЕ СВОСТВА
- АМИНОКИСЛОТ.
1.Актуальность темы: аминокислоты – структурные единицы пептидов и белков. Знание строения и химических свойств аминокислот необходимые для понимания их реакционной способности, превращений и биологической активности в организме человека.
2.Цель общая, уметь: использовать знание свойств аминокислот для объяснения строения и физико-химических свойств и функций белков в организме.
35
3.Конкретные цели, уметь:
-интерпретировать особенности строения -аминокислот как структурной основы белков, которые функционируют в организме;
- |
делать выводы о путях превращений в организме -аминокислот; |
||
- |
на основе понимания строения и реакционной способности - |
||
|
аминокислот |
прогнозировать образование |
белков и других |
|
физиологически активных соединений и предвидеть пути деградации |
||
|
аминокислот в организме. |
|
|
4. Литература:
Основная:
4.1.Лекционный материал.
4.2.Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия, 1985, с.297318; 1991, с. 313 – 343.
4.3.Руководство к лабораторным занятиям по биоорганической химии, под ред. Тюкавкиной Н.А., 1985, с. 180 – 186.
4.4.Рево А.Я. и др.. малый практикум по органической химии, 1980,
оп.100.
Дополнительная:
4.5. Грандберг И.И. Органическая химия, М., 1980г.
4.6.Райлс А., Смит К., Уорд Р. Основы органической химии (для студентов биологических, медицинских и сельскохозяйственных специальностей),
М., 1982г.
4.7.Терней А. Современная органическая химия, т.1,т.2, М., 1981г.
4.8.Чичибабин А.Е. Основные начала органической химии, т.1,т.2, М.,
1963г.
4.9.Каррер Н. Курс органической химии, М., 1960г.
4.10.Овчинников Ю.А. Биоорганическая химия, М., 1987г.
5. Основные вопросы темы:
5.1.Аминокислоты: определение, состав, строение.
5.2.Кислотно – основные свойства аминокислот.
5.3.Химические реакции аминокислот по карбокси–группе: образование эстеров, галогенангидридов. Биологическое и аналитическое значение этих реакций.
5.4.Химические реакции аминокислот по аминогруппе: образование
N–ацильных производных, взаимодействие с нитритной кислотой, формальдегидом, фенилизотиоцианатом. Значение этих реакций.
5.5.Декарбоксилирование аминокислот и биологическое значение образованых биогенных аминов.
6.Вопросы для самостоятельного внеаудиторного изучения:
6.1.Классификация аминокислот.
36

6.2.Декарбоксилирование аминокислот в организме
7.Эталоны решения задач:
7.1.Какие виды изомерии характерны для -аминокислот? Решение:
а) Изомерия положения аминогруппы: -аминокислоты и-аминокислоты;
б) изомерия углеродного скелета: лейцин – изолейцин; в) энантиомерия: D–метионин L-метионин.
7.2. Объясните амфотерность аминокислот. Решение:
Амфотерность объясняется наличием в аминокислотах аминогруппы и карбоксигруппы. Карбоксигруппа проявляет кислотные свойства, т.е. она диссоциирует, образуя ион гидрогена Н+ (или протон); аминогруппа проявляет основные свойства, так как нитроген имеет неподеленную пару электронов. При растворении аминокислоты в воде протон присоединяется к нитрогену и образуется биполярный ион, содержащий карбоксилат-анион и протонированную аминогруппу, которая имеет положительный заряд. Амфотерный характер аминокислот также подтверждается взаимодействием их со щелочью и кислотой с образованием солей.
8. Задание для закрепления материала (выполнить в протокольной тетради):
8.1.Написать и выучить формулы 20 аминокислот, которые входят в состав белков; указать незаменимые аминокислоты.
8.2. Написать уравнение реакции взаимодействия серина с этанолом. 8.3.Написать уравнение реакции взаимодействия аспарагина с ФИТЦ
(фенилизотиоцианат).
.
9.Тестовый контроль (пример):
9.1.Написать образование биполярного иона аминокислоты - вал. В какой области рН находится его изоэлектрическая точка.
9.2.Написать формулы трёх возможных солей аланина.
Ответы.
9.2.
37
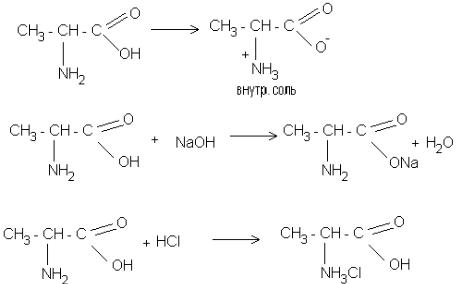
ИЕТ находится в слабокислой среде.
9.3.
10.Алгоритм лабораторной роботы:
10.1.Сравнительная оценка силы аминокислот и соответствующих им карбоновых кислот.
10.2.Реакция аминокислот с нингидрином.
10.3.Реакция глицина с формальдегидом.
10.4.Реакция глицина с нитритной кислотой.
11.Методика проведения эксперимента.
11.1.Сравнительная оценка силы аминокислот и соответствующих им карбоновых кислот. В три пробирки внести: в первую - 1мл дистиллированой воды, в другую – 1мл ацетатной (уксусной) кислоты, в третью – 1 мл глицина. В каждую пробирку прибавить по 2 капли индикатора метилового красного. Описать внешний эффект, сделать выводы.
11.2. Реакция аминокислот с нингидрином. |
В пробирку внести 4 капли |
раствора глицина и две капли раствора нингидрина и нагреть пробирку. |
|
Описать внешний эффект, сделать выводы. |
|
11.3. . Реакция глицина с формальдегидом. |
В пробирку внести 5 капель |
раствора глицина и прибавить 1 каплю индикатора метилового красного. Отметить цвет. Потом прибавить 6 капель формалина. Описать внешний эффект, написать уравнение реакции сделать выводы.
11.4. Реакция глицина с нитритной кислотой. |
В пробирку внести 5 |
капель раствора глицина, 5 капель раствора |
NaNO2 и 2 капли |
38
СН3СООН (конц.). Написать уравнение реакции, описать внешний эффект, сделать выводы.
Тема: ФИЗИКО_ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ.
1.Актуальность темы: знания о составе, строении и химических свойствах пептидов и белков необходимы для понимания их функций в организме человека в норме и патологии, применения в клинической практике для диагностики и лечения, синтеза пептидов и белков in vitro.
2.Цель общая – уметь: сформулировать общие понятия о белках как полимерах, которые являются структурными компонентами всех тканей организма.
3.Конкретные цели, уметь:
-объяснять зависимость физико-химических свойств белков от их аминокислотного состава;
-применять качественные реакции на аминокислоты для идентификации белков и определения их аминокислотного состава;
-использовать биуретовую реакцию для количественного определения белков.
4.Литература:
4.1.Лекционный материал.
4.2.Тюкавкина Н.А.,Бауков Ю.И. Биоорганическая химия, 1985,с.323-332; 1991, с. 345-376.
4.3.Руководство к лабораторным занятиям по биоорганической химии, под ред. Тюкавкиной Н.А., 1985, с.186-189, 192-200 .
Дополнительная:
4.5. Грандберг И.И. Органическая химия, М., 1980г.
4.6. Райлс А., Смит К., Уорд Р. Основы органической химии, М., 1982г. 4.7. Терней А. Современная органическая химия, т.1,т.2, М., 1981г. 4.8.Чичибабин А.Е.Основные начала органической химии,т.1,т.2,М.,1963г.
4.9.Каррер Н. Курс органической химии, М., 1960г.
4.10.Овчинников Ю.А. Биоорганическая химия, М., 1987г.
5.Основные вопросы темы:
5.1.Белки, определение, молярная маса белков.
39

5.2.Анализ пептидов и белков: определение аминокислотного состава и аминокислотной последовательности. Метод Эдмана.
5.3.Синтез пептидов и белков с применением защиты и активации функциональных групп.
5.4.Первые расшифрованные и синтезированные белки и пептиды: инсулин, вазопрессин, окcитоцин; их состав, строение, биологическая роль.
6.Вопросы для самостоятельного внеаудиторного изучения:
6.1.Образование и свойства пептидной связи.
6.2.Физико-химические свойства белков (амфотерность, образование амфиона, солей; изоэлектрическое состояние (ИЭС), изоэлектрическая точка (ИЭТ).
6.3.Уровни структурной организации белков: первичный, вторичный, третичный и четвертичный. Типы связей.
6.4.Методы выделения, разделения, очистки белков. Методы определения молярной массы белка.
7.Задание для закрепления материала (выполнить в протокольной тетради):
7.1.Написать уравнения реакций синтеза дипептида вал-цис с применением защиты и активации функциональных групп (6 этапов).
7.2.Написать трипептид: ала-лиз-лей; в какой среде находится его ИЭТ.
7.3.Написать схему определения N-концевой аминокислоты в дипептиде сер-три методом Эдмана.
8.Тестовый контроль (пример)
8.1.Написать дипептид лей-мет, указать, в какой среде лежит его изоэлектрическая точка ( ИЭТ).
8.2.Установить N-концевую аминокислоту в этом дипептиде методом Эдмана.
Ответы.
8.1.
ИЭТ – лежит в нейтральной среде
8.2.
40
