
- •1. Зависимость скорости реакции от концентрации субстрата
- •2. Зависимость от концентрации фермента
- •3. Зависимость скорости реакции от температуры
- •4. Зависимость скорости реакции от рН
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях.
- •55. Функции воды в организме. Регуляция обмена воды антидиуретическим гормоном.
- •56. Функции минеральных веществ. Регуляция солевого обмена альдостероном и гормонами предсердий. Биохимические механизмы развития почечной гипертензии.
- •57. Регуляция обмена кальция и фосфора. Роль паратгормона и тиреокальцитонина. Витамин д. Роль 1,25-дигидроксикальциферола в регуляции кальция и фосфатов. Рахит.
1. Первичная структура белков. Видовая специфичность белков. Наследственные изменения первичной структуры. Полиморфизм белков. Наследственные протеинопатии: серповидно-клеточная анемия, др примеры.
Белок – это последовательность АК, связанных друг с другом пептидными связями.
Легко представить, что количество аАК может быть различно: от минимум 2х до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 АК – полипептид, если более 40 АК – белок. Объединение АК через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка. Молекулярная масса белков колеблется в пределах от 6000 до 1000000 и более. Все белки построены в основном из двадцати различных АК. АК в пептидной цепи связаны м/у собой через карбоксильную группу 1й и аминогруппу другой АК. Такая связь называется пептидной связью. Пептидная связь имеет некоторые черты двойной связи: вокруг нее нет свободного вращения, и она короче других С—N-связей. Все 4 атома пептидной связи (С, Н, N, О) и два α-углеродных атома лежат в одной плоскости. Кислород карбоксильной группы и водород NH-группы чаще всего находятся в транс-положении. Группа, связанная с α-углеродным атомом, обладает свободным вращением. Форма пептидной молекулы определяется углами между плоскостями, в которых лежат атомы пептидной связи, разделенными друг от друга —СН—R-группами, что и ведет к возникновению определенных вторичных структур. Последовательность и соотношение АК в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
У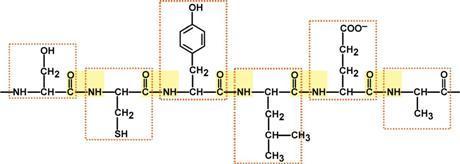 часток
белковой цепи длиной в 6 аминокислот
(Сер-Цис-Тир-Лей-Глу-Ала)
часток
белковой цепи длиной в 6 аминокислот
(Сер-Цис-Тир-Лей-Глу-Ала)
(пептидные связи выделены желтым цветом, АК - красной рамкой)
В организме человека насчитывают около
50 000 индивидуальных белков. Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток. Одни и те же АК присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования АК в белке. Однако многие белки, выполняя одну и ту же функцию, несколько отличаются по строению у разных представителей одного и того же вида. Примером могут служить белки групп крови у человека. Такое разнообразие белков обусловливает индивидуальную специфичность организмов.
В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии. Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Первичная структура белков, т.е. последовательность АК в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Если изменение последовательности аАКносит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизм белков.
При изучении структуры гемоглобина эритроцитов крови человека обнаружили, что каждая белковая молекула состоит из четырех полипептидных цепей (2 альфа и 2 бета-цепи). Установив первичную структуру белка, т. е. последовательность аминокислот в каждой цепи, выяснили также, с помощью каких связей между R-группами (радикалами аминокислот) образуется его третичная и четвертичная структура . Все здоровые люди имеют гемоглобин с одинаковой первичной и пространственной структурой. У людей, страдающих серповидноклеточной анемией - тяжелым наследственным заболеванием, эритроциты похожи не на диски, как обычно, а на серпы ( рис. 39 ). Такое изменение формы клеток происходит из-за отличия первичной структуры гемоглобина у больных людей. В беа-цепи нормального гемоглобина на шестом месте от NH2-конца стоит глутаминовая кислота. При серповидноклеточной анемии она заменена на аминокислоту валин ( рис. 40 ). Из 574 аминокислот, входящих в состав гемоглобина, заменены только две (по одной в каждой бета-цепи). Но это приводит к существенному изменению третичной и четвертичной структуры белка и, как следствие, к изменению формы и нарушению функции эритроцита. Серповидные эритроциты плохо справляются со своей задачей - переносом кислорода. Семейная гиперхолестеринемия (сокращенно СГ) - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, в частности, очень высоким уровнем липопротеидов низкой плотности (ЛПНП, т.н. "плохой холестерин"), а также ранним (в молодом возрасте) возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора (обычно отвечающего за поглощение ЛПНП с кровотока) или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором (процесс, необходимый для связывания ЛПНП с рецептором).
2. Конформация белковых молекул (вторичная и третичная структуры). Типы внутримолекулярных связей в белках. Роль пространственной организации пептидной цепи в образовании активных центров. Конформационные изменения при функционировании белков.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
В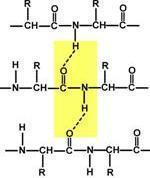 торичная
структура образуется только при участии
водородных связей между пептидными
группами: атом кислорода одной группы
реагирует с атомом водорода второй,
одновременно кислород второй пептидной
группы связывается с водородом третьей
и т.д.
торичная
структура образуется только при участии
водородных связей между пептидными
группами: атом кислорода одной группы
реагирует с атомом водорода второй,
одновременно кислород второй пептидной
группы связывается с водородом третьей
и т.д.
α-Спираль. Данная структура является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков. Формированию спирали препятствуют пролин и гидроксипролин, которые обуславливают "перелом" цепи, ее резкий изгиб. Высота витка спирали составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
β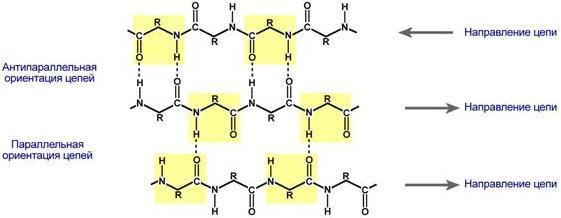 -Складчатый
слой.В
этом способе укладки белковая молекула
лежит "змейкой", удаленные отрезки
цепи оказываются поблизости друг от
друга. В результате пептидные группы
ранее удаленных аминокислот белковой
цепи способны взаимодействовать при
помощи водородных связей.
Ориентация
реагирующих участков может быть
параллельна (когда соседние цепи идут
в одном направлении) или антипараллельна
(цепи идут в противоположном направлении).
Таких взаимодействующих друг с другом
участков одного белка может быть от
двух до пяти. В структуре глобулярных
белков могут встречаться фрагменты
регулярного строения всех трех типов
в любой комбинации, но может не быть и
ни одного. Повторяющиеся, более сложные
комбинации, образованные из 3х фрагментов
регулярной структуры, иногда называют
супервторичной структурой.
-Складчатый
слой.В
этом способе укладки белковая молекула
лежит "змейкой", удаленные отрезки
цепи оказываются поблизости друг от
друга. В результате пептидные группы
ранее удаленных аминокислот белковой
цепи способны взаимодействовать при
помощи водородных связей.
Ориентация
реагирующих участков может быть
параллельна (когда соседние цепи идут
в одном направлении) или антипараллельна
(цепи идут в противоположном направлении).
Таких взаимодействующих друг с другом
участков одного белка может быть от
двух до пяти. В структуре глобулярных
белков могут встречаться фрагменты
регулярного строения всех трех типов
в любой комбинации, но может не быть и
ни одного. Повторяющиеся, более сложные
комбинации, образованные из 3х фрагментов
регулярной структуры, иногда называют
супервторичной структурой.
Т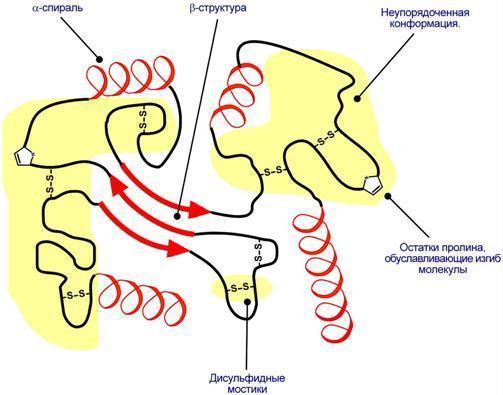 ретичная
структура
– это укладка полипептидной цепи в
глобулу ("клубок"). Четкой границы
между вторичной и третичной структурами
провести нельзя, однако в основе третичной
структуры лежат стерические взаимосвязи
между АК, отстоящими далеко друг от
друга в цепи. Благодаря третичной
структуре происходит еще более компактное
формирование цепи.
ретичная
структура
– это укладка полипептидной цепи в
глобулу ("клубок"). Четкой границы
между вторичной и третичной структурами
провести нельзя, однако в основе третичной
структуры лежат стерические взаимосвязи
между АК, отстоящими далеко друг от
друга в цепи. Благодаря третичной
структуре происходит еще более компактное
формирование цепи.
Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.
АК принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например: 1)водородные – между НО-, СООН-, NH2-группами радикалов АК (возникает между боковыми цепями АКи пептидными связями), 2) дисульфидные – между остатками цистеина (внутримолекулярная связь), 3)гидрофобные – между остатками алифатических и ароматических АК (отражает взаим-ие неполярных групп), 3) ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина (относится к электростатическим вз-ям), 4) псевдопептидные – между дополнительными СОО–группами глутамата и аспартата и дополнительными NH3+группами лизина и аргинина.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её на-тивной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами
3. Четвертичная структура белков. Кооперативные изменения конформации протомеров. Примеры строения и функционирования олигомерных белков: гемоглобин (в сравнении с миоглобином), аллостерические ферменты.
Четвертичная структура - это и количество, и способ укладки полипептидных цепей (протомеров) в пространстве. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой.Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
П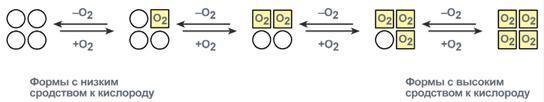 ротомеры
связаны друг с другом посредством лишь
нековалентных связей (ионных, водородных,
гидрофобных). Причем протомеры
взаимодействуют друг с другом только
определенными участками своей поверхности
(контактные участки). Взаимное «узнавание»
контактных участков происходит по
принципу комплементарности. Каждый
протомер взаимодействует с другим во
многих точках. Следовательно, ошибочные
комплексы в олигомере практически
невозможны.
Так
как субъединицы в олигомерах очень
тесно взаимодействуют между собой, то
любое изменение конформации какой-либо
одной субъединицы обязательно влечет
за собой изменение других субъединиц.
Этот эффект называется кооперативное
взаимодействие.
Например, у гемоглобина такое взаимодействие
субъединиц в легких ускоряет в 300 раз
присоединение О2
к гемоглобину. В тканях отдача О2
также ускоряется в 300 раз. Присоединение
в легких первой молекулы кислорода к
одной из субъединиц гемоглобина изменяет
ее конформацию. В результате она начинает
влиять на следующую убъединицу, облегчая
присоединение к ней кислорода. После
этого они вдвоем влияют на третью
субъединицу и так далее. В тканях первая
молекула кислорода отделяется от своей
субъединицы не очень легко, вторая уже
быстрее и т.д. Олигомерные белки способны
взаимодействовать с несколькими
лигандами в центрах, удаленных друг от
друга. Связывание одного протомера с
лигандом изменяет конформацию этого
протомера, а также всего олигомера и,
кроме того, сродство к другим лигандам.
Таким образом, функциональная активность
олигомерных белков может регулироваться
аллостерическими лигандами.
ротомеры
связаны друг с другом посредством лишь
нековалентных связей (ионных, водородных,
гидрофобных). Причем протомеры
взаимодействуют друг с другом только
определенными участками своей поверхности
(контактные участки). Взаимное «узнавание»
контактных участков происходит по
принципу комплементарности. Каждый
протомер взаимодействует с другим во
многих точках. Следовательно, ошибочные
комплексы в олигомере практически
невозможны.
Так
как субъединицы в олигомерах очень
тесно взаимодействуют между собой, то
любое изменение конформации какой-либо
одной субъединицы обязательно влечет
за собой изменение других субъединиц.
Этот эффект называется кооперативное
взаимодействие.
Например, у гемоглобина такое взаимодействие
субъединиц в легких ускоряет в 300 раз
присоединение О2
к гемоглобину. В тканях отдача О2
также ускоряется в 300 раз. Присоединение
в легких первой молекулы кислорода к
одной из субъединиц гемоглобина изменяет
ее конформацию. В результате она начинает
влиять на следующую убъединицу, облегчая
присоединение к ней кислорода. После
этого они вдвоем влияют на третью
субъединицу и так далее. В тканях первая
молекула кислорода отделяется от своей
субъединицы не очень легко, вторая уже
быстрее и т.д. Олигомерные белки способны
взаимодействовать с несколькими
лигандами в центрах, удаленных друг от
друга. Связывание одного протомера с
лигандом изменяет конформацию этого
протомера, а также всего олигомера и,
кроме того, сродство к другим лигандам.
Таким образом, функциональная активность
олигомерных белков может регулироваться
аллостерическими лигандами.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами (обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; аллостерические ферменты обладают свойством кооперативности: регуляция аллостерических ферментов обратима). Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Связь между структурой белка и его функцией можно рассмотреть на примере двух родственных белков: миоглобина и гемоглобина:
Миоглобин - мономер (состоит из одной полипептидной цепи), основная его функция - запасание кислорода в тканях. Имея высокое сродство к кислороду, миоглобин легко присоединяет его и отдает кислород только при интенсивной мышечной работе, когда парциальное давление кислорода падает ниже 10 мм рт. ст.
Гемоглобин - тетрамер (состоит из 4х протомеров). Основная функция гемоглобина - обратимое связывание с кислородом в легких, где парциальное давление кислорода высокое и гемоглобин взаимодействует с четырьмя молекулами кислорода.
В тканях СО2 и Н2О, образующиеся при катаболизме пищевых веществ, взаимодействуют с гемоглобином и уменьшают его сродство к кислороду, что облегчает поступление кислорода в ткани.
В эритроцитах имеется также аллостерический лиганд 2,3-дифосфоглицерат, способный взаимодействовать с дезоксигемоглобином. Это препятствует обратному связыванию освободившегося О2 с гемоглобином.
Таким образом, связывание гемоглобина с аллостерическими лигандами в тканях, при относительно высоком парциальном давлении, обеспечивает поступление кислорода в ткани.
Из рассмотренных примеров следует заключить, что аллостерический эффект является результатом связывания лиганда со специфическим участком белка. Это вызывает значительное изменение в белковой молекуле, которая в свою очередь влияет на активность другого, пространственно удаленного участка. Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности не только гемоглобина, но и многих других белков.
4. Понятие о ферментах. Специфичность действия ферментов. Кофакторы ферментов. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, температуры и рН. Принципы количественного определения ферментов. Единицы активности.
Ферменты – это катализаторы биологической природы (белки), которые обеспечивают протекание биохимических процессов в живых клетках. Ф. не входят в состав конечных продуктов реакции. Ф. не тратятся в процессе катализа. Ф. только ускоряют реакции, протекающие без них. Ф. не могут возбудить реакции, протекающие по законам термодинамики. Ф. не смещают положение равновеся, а лишь ускоряют его движение. Одна молекула Ф. при обычных условиях может катализировать превращение от тысячи до миллиона молекул в-ва в минуту. Простые ферменты состоят только из АК, а сложные из 2х частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно – коферментом. Кофактор – это ионы металла или сложные органические соединения, которые выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента (Пр.: в активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого гамма-фосфорного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата).
Особенности:
1. Используются неоднократно; 2. Работают в узком диапазоне t и pH; 3. Катализируют только те реакции, которые биохимически возможны; 4. Обладают каталитической эффективностью; 5. Характерна конформационная лабильность; 6. Способность к регуляции 7. Обладают специфичностью: а) субстратная (абсолютная - Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату: аргиназа в реакции расщепления аргинина до мочевины и орнитина; и групповая - Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов: Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира; Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000; стереоспецифичность - При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них: к D-сахарам (гексокиназа), к L-аминокислотам, к цистрансизомерам (фумараза), к α- и β-гликозидным связям(амилаза)) В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. 2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
б) каталитическая - Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость биохим. реакции определяется: а) изменением концентрации реагирующих веществ в единицу времени; б) не является постоянной в течении времени.
1. Зависимость скорости реакции от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается.
2. Зависимость от концентрации фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта
3. Зависимость скорости реакции от температуры
Зависимость активности ферментов (скорости реакции) от t описывается колоколообразной кривой с максимумом скорости при значениях оптимальной t для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении t на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до t денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых м/о, существующих в воде горячих источников и гейзеров. При понижении t активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), t тела которых понижается до 3-5°С.
4. Зависимость скорости реакции от рН
Зависимость также описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН. Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
6. Используются неоднократно; 7. Работают в узком диапазоне t и pH; 8. Катализируют только те реакции, которые биохимически возможны; 9. Обладают каталитической эффективностью; 10. Характерна конформационная лабильность; 11. Способность к регуляции
В повседневной биохимической практике практически не оценивается количество фермента, а только его активность. Активность – более широкое понятие, чем количество. Она подразумевает в первую очередь результат реакции, а именно убыль субстрата или накопление продукта. Естественно, при этом нельзя игнорировать время, которое проработал фермент и число молекул фермента. Но так как число молекул фермента подсчитать обычно нереально, то используют количество биологического материала, содержащего фермент (объем или массу). Таким образом при определении активности ферментов нужно одновременно учитывать три меняющихся фактора: 1) масса полученного продукта или исчезнувшего субстрата, 2) время, потраченное на реакцию, 3)количество биологического материала, содержащего фермент.
Основы количественного определения активности ферментов
1![]() .
Активность фермента выражается в
скорости накопления продукта или
скорости убыли субстрата в пересчете
на количество материала, содержащего
фермент.
.
Активность фермента выражается в
скорости накопления продукта или
скорости убыли субстрата в пересчете
на количество материала, содержащего
фермент.
Активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
2. Создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях – оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3. Необходимо наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
За единицу активности любого фермента принимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту. Активность ферментов опр-ют: пог скорости убыв субстрата; по скороти обр-я продукта. Удельная активность=мкм/мин.мг белка.
5. Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств.
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются АК, значительно удаленные друг от друга в линейной цепи, но сближенные в функциональной конформации. Наиболее часто в состав активного центра входят такие АК как серин, гистидин, трионин, цистеин.
Активный центр: -каталитический центр, -субстрат-связывающий участок, -кофермент-связывающий участок, - низкомолекулярное соединение, которое способствует взаимодействию субстрата и фермента.
Микросреда активного центра отличается от остального окружения фермента более низкой диэлектрической проницаемостью, приближающейся к таковой для некоторых органических растворителей. Также хар-ся повышенной микровязкостью, что ограничивает свободу вращательного движения группировок активного центра. Активный центр ограничивает влияние воды, что необходимо для эффективного катализа. При связывании субстрата и активного центра, субстрат претерпевает конформационные изменения (комплементарность увеличивается). – это явление индуцированного соответствия. В свою очередь в активном центре выделяют два участка:
1) якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2) каталитический – непосредственно отвечает за осуществление реакции.
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Энергия активации – это произведение энергии активации элементарного акта и постоянной Авогадро (Дж,/моль).
-Это энергетический барьер, который должны преодолеть молекулярные вещества по пути превращения в продукты реакции. Основная задача фермента – снизить Е активации.
Если фермент просто связывается с субстратом – этого не достаточно для катализа. Ф. не только распознает и связывает субстрат, но и индуцирует переходное состояние субстрата.
В![]() ферментативной реакции можно выделить
следующие этапы: 1. Присоединение
субстрата (S) к ферменту (E) с образованием
фермент-субстратного комплекса (E-S).
ферментативной реакции можно выделить
следующие этапы: 1. Присоединение
субстрата (S) к ферменту (E) с образованием
фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Механизмы катализа: 1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций (Доноры -СООН -NH3+ -SH, Акцепторы -СОО- -NH2 -S-)
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Типы ферментативных реакций: 1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование. 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Ингибитор - вещество, вызывающее специфичное снижение активности фермента. Т.о., неорганические к-ты и тяжелые Ме ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично.
Можно выделить два основных направления ингибирования:
1. по прочности связывания Ф. с ингибитором ингибирование бывает обратимым и необратимым.
2. по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
При необратимом ингибировании происходит связывание или разрушение функциональных групп Ф., необходимых для проявления его каталитической активности (модификации подвергается активный центр). Бывают: а)Специфические (блокируют определенные группы активного центра: диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию); б) Неспецифические (реагирует с любыми свободными SН-группами белков. Не имеют физиологического значения и являются ферментными ядами: Присоединение ацетильной группы аспирина (ацетилсалициловой к-ты) к аминогруппе в активном центре фермента циклооксигеназы вызывает инактивацию последнего и прекращение синтеза простагландинов).
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента слабыми нековалентными связями, вследствие чего активность фермента постепенно восстанавливается. Действует не долго. Пр.: прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентный ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. Пр.: Конкурентное взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. Лекарства: ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Увеличивают активность ацетилхолинэстеразы, конц-я ацетилхолина повышается, усиливается проведение нервного импульса (прозерин, эндрофомит). Антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.
Неконкурентное ингибирование связано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов.
Обратимо, но не может быть ослаблено или устранено повышением конц-ии субстрата. Пр.: синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Использование ингибиторов ферментов
Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы.
Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции.
Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления.
Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры.
Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях.
Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни.
6. Регуляция действия ферментов: аллостерические механизмы, химическая (ковалентная) модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие.Чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
1. изменением количества молекул фермента;
2.доступностью молекул субстрата и кофермента;
3.изменением каталитической активности молекулы фермента. Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
1. Доступность субстрата или кофермента. Здесь работает закон действия масс – фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию. Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА. Именно из-за недостатка оксалоацетата (относительного или абсолютного) развивается кетоацидоз (механизм развития) при голодании и инсулинзависимом сахарном диабете.
2. Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах. Например, ферменты цикла трикарбоновых кислот (ЦТК) и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах.
3. Изменение количества фермента может происходить в результате увеличения или снижения его синтеза. Изменение скорости синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции, например: -исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов); -при беременности и после родов в молочной железе активно идет синтез фермента лактозосинтазы под воздействием лактотропного гормона;
-гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови и устойчивость ЦНС к стрессу;
4. Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывания крови, лизосомальных ферментов (катепсины).
5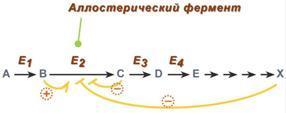 .
Аллостерическая регуляция.
Аллостерические ферменты построены из
двух и более субъединиц: одни субъединицы
содержат каталитический центр, другие
имеют аллостерический центр и являются
регуляторными. Аллостерический
центр (allos –
чужой) – центр регуляции активности
фермента, который пространственно
отделен от активного центра и имеется
не у всех ферментов. Связывание с
аллостерическим центром какой-либо
молекулы (называемой активатором или
ингибитором, а также эффектором,
модулятором, регулятором) вызывает
изменение конфигурации белка-фермента
и, как следствие, скорости ферментативной
реакции. В качестве такого регулятора
может выступать продукт данной или
одной из последующих реакций, субстрат
реакции или иное вещество. Присоединение
эффектора к аллостерической (регуляторной)
субъединице изменяет конформацию белка
и, соответственно, активность каталитической
субъединицы. Аллостерические ферменты
обычно стоят в начале метаболических
путей, и от их активности зависит течение
многих последующих реакций. Поэтому
они часто называются ключевыми
ферментами.
В качестве отрицательного регулятора
может выступать конечный метаболит
биохимического процесса или продукт
данной реакции, т.е включается механизм
обратной отрицательной связи. Если
регуляторами являются начальный
метаболит или субстрат реакции, то
говорят о прямой регуляции, она может
быть как положительной, так и отрицательной.
Также регулятором могут быть метаболиты
биохимических путей, каким-то образом
связанных с данной реакцией. Например,
фермент энергетического распада глюкозы,
фосфофруктокиназа, регулируется
промежуточными и конечными продуктами
этого распада. При этом АТФ, лимонная
кислота, фруктозо-1,6-дифосфат являются
ингибиторами, а фруктозо-6-фосфат и АМФ
– активаторами фермента. Аллостерическая
регуляция имеет большое значение в
следующих ситуациях:
.
Аллостерическая регуляция.
Аллостерические ферменты построены из
двух и более субъединиц: одни субъединицы
содержат каталитический центр, другие
имеют аллостерический центр и являются
регуляторными. Аллостерический
центр (allos –
чужой) – центр регуляции активности
фермента, который пространственно
отделен от активного центра и имеется
не у всех ферментов. Связывание с
аллостерическим центром какой-либо
молекулы (называемой активатором или
ингибитором, а также эффектором,
модулятором, регулятором) вызывает
изменение конфигурации белка-фермента
и, как следствие, скорости ферментативной
реакции. В качестве такого регулятора
может выступать продукт данной или
одной из последующих реакций, субстрат
реакции или иное вещество. Присоединение
эффектора к аллостерической (регуляторной)
субъединице изменяет конформацию белка
и, соответственно, активность каталитической
субъединицы. Аллостерические ферменты
обычно стоят в начале метаболических
путей, и от их активности зависит течение
многих последующих реакций. Поэтому
они часто называются ключевыми
ферментами.
В качестве отрицательного регулятора
может выступать конечный метаболит
биохимического процесса или продукт
данной реакции, т.е включается механизм
обратной отрицательной связи. Если
регуляторами являются начальный
метаболит или субстрат реакции, то
говорят о прямой регуляции, она может
быть как положительной, так и отрицательной.
Также регулятором могут быть метаболиты
биохимических путей, каким-то образом
связанных с данной реакцией. Например,
фермент энергетического распада глюкозы,
фосфофруктокиназа, регулируется
промежуточными и конечными продуктами
этого распада. При этом АТФ, лимонная
кислота, фруктозо-1,6-дифосфат являются
ингибиторами, а фруктозо-6-фосфат и АМФ
– активаторами фермента. Аллостерическая
регуляция имеет большое значение в
следующих ситуациях:
-при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
-при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
-для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
-для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
6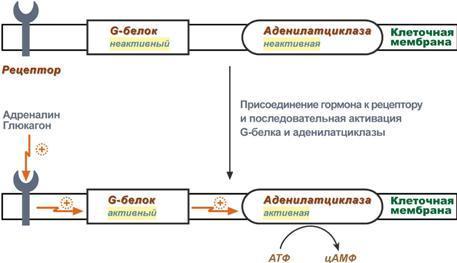 .
Белок-белковое взаимодействие
обозначает ситуацию, когда в качестве
регулятора выступают не метаболиты
биохимических процессов, а специфичные
белки. В целом ситуация схожа с
аллостерическим механизмом: после
влияния каких-либо факторов на специфичные
белки изменяется активность этих белков,
и они, в свою очередь, воздействуют на
нужный фермент. К примеру, мембранный
фермент аденилатциклаза является
чувствительным к воздействию мембранного
G-белка, который сам активируется при
действии на клетку некоторых гормонов
(например, адреналина и глюкагона).
.
Белок-белковое взаимодействие
обозначает ситуацию, когда в качестве
регулятора выступают не метаболиты
биохимических процессов, а специфичные
белки. В целом ситуация схожа с
аллостерическим механизмом: после
влияния каких-либо факторов на специфичные
белки изменяется активность этих белков,
и они, в свою очередь, воздействуют на
нужный фермент. К примеру, мембранный
фермент аденилатциклаза является
чувствительным к воздействию мембранного
G-белка, который сам активируется при
действии на клетку некоторых гормонов
(например, адреналина и глюкагона).
7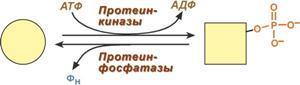 .
Ковалентная (химическая) модификация
заключается в обратимом присоединении
или отщеплении определенной группы,
благодаря чему изменяется активность
фермента. Чаще всего такой группой
является фосфорная кислота, реже
метильные и ацетильные группы.
Фосфорилирование фермента происходит
по остаткам серина и тирозина. Присоединение
фосфорной кислоты к белку осуществляют
ферменты протеинкиназы, отщепление –
протеинфосфатазы. Ферменты могут быть
активны как в фосфорилированном, так и
в дефосфорилированном состоянии.
Например, ферменты гликогенфосфорилаза
и гликогенсинтаза при потребности
организма в глюкозе фосфорилируются,
при этом фосфорилаза гликогена становится
активной и начинает расщепление
гликогена, а гликогенсинтаза неактивна.
При необходимости синтеза гликогена
оба фермента дефосфорилируются, синтаза
при этом становится активной, фосфорилаза
– неактивной.
.
Ковалентная (химическая) модификация
заключается в обратимом присоединении
или отщеплении определенной группы,
благодаря чему изменяется активность
фермента. Чаще всего такой группой
является фосфорная кислота, реже
метильные и ацетильные группы.
Фосфорилирование фермента происходит
по остаткам серина и тирозина. Присоединение
фосфорной кислоты к белку осуществляют
ферменты протеинкиназы, отщепление –
протеинфосфатазы. Ферменты могут быть
активны как в фосфорилированном, так и
в дефосфорилированном состоянии.
Например, ферменты гликогенфосфорилаза
и гликогенсинтаза при потребности
организма в глюкозе фосфорилируются,
при этом фосфорилаза гликогена становится
активной и начинает расщепление
гликогена, а гликогенсинтаза неактивна.
При необходимости синтеза гликогена
оба фермента дефосфорилируются, синтаза
при этом становится активной, фосфорилаза
– неактивной.
Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
7. Роль ферментов в метаболизме. Многообразие ферментов. Понятие о классификации. Наследственные первичные энзимопатии: фенилкетонурия, алкаптонурия. Другие примеры наследственных энзимопатий. Вторичные энзимопатии. Значение ферментов в медицине.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами.
В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии с этой классификацией все ферменты делятся: а) на классы – по типу катализируемой реакции, б)каждый класс подразделяется на подклассы – по природе атакуемой химической группы, в) подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора. Выделяют 6 классов ферментов:
I класс – Оксидоредуктазы (Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота).
II класс – Трансферазы (Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп. Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы. Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы. Систематическое название образуется: Донор группы : акцептор группы – переносимая группа трансфераза).
III класс – Гидролазы (осуществляют разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют. Широко представлены ферментами желудочно-кишечного тракта и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. Систематическое название образуется: Гидролизуемый субстрат : отделяемая группа гидролаза. Исторически названия гидролаз складывались из названия субстрата с окончанием "‑аза" – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз: 1. Эстеразы – гидролиз сложноэфирных связей. 2. Липазы – гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты. 4. Гликозидазы – гидролизуют О- и S-гликозидные связи. 5. Протеазы, пептидазы – гидролиз белков и пептидов. 6. Нуклеазы – гидролиз нуклеиновых кислот.).
IV класс – Лиазы (ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи. Систематическое название образуется: Расщепляемый субстрат : отделяемая группа – лиаза).
V класс – Изомеразы (ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др. Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу. Систематическое название образуется: Субстрат – [ ] – реакция, где [ ] – обозначение, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо").
VI класс – Лигазы (синтетазы – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты. Выделяют 6 подклассов. Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Систематическое название образуется: Субстрат 1 : субстрат 2 – лигаза)
Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе. Чтобы дать ферменту название существует два способа:
1. Систематическое название – согласно современной классификации. Часто такое название длинно и сложно для использования, поэтому как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий. 2. Тривиальное название – название, сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов (чаще для гидролаз) к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза. Тем не менее и у таких ферментов имеется систематическое название.
В случае, если фермент не может выполнять свою функцию, говорят об энзимопатологии (энзимопатии) – состояния, связанные с патологическим изменением активности ферментов. Наиболее часто встречается снижение активности и нарушение каких-либо метаболических процессов. В результате энзимопатологии клиническое значение может иметь:
-накопление субстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы),
-недостаток продукта, например: меланина при альбинизме, катехоламинов при паркинсонизме,
-обе особенности одновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени.
По характеру нарушения выделяют первичные и вторичные энзимопатии.
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности. Например, фенилкетонурия связана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты. Алкаптонурия - нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Кроме этого, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы, различные липидозы.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря.
Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий.
Использование ферментов в медицине происходит по четырем направлениям:
1. энзимодиагностика (это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатДГ, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах. С другой стороны, заболевания тех или иных органов всегда сопровождаются специфичным "ферментативным профилем". Например, инфаркт миокарда сопровождается увеличением активности лактатДГ, креатинкиназы, аспартатаминотрансферазы),
2. энзимотерапия (использование ферментов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Мезим форте), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте. Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель для лечения вирусных конъюнктивитов. Трипсин ингалируют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты. Коллагеназу применяют для ускорения отторжения некротизированных тканей, для очистки трофических язв),
3. использование ферментов в медицинских технологиях и промышленности (Специфичность ферментов к определенным субстратам применяетсяв лабораторной диагностике. Многие лабораторные методы основаны на взаимодействии добавляемого извне фермента с определяемым соединением. В результате возникает специфичный продукт реакции, после определения содержания последнего судят о концентрации искомого вещества (глюкозооксидазный, холестеролоксидазный методы), иммуноферментные методы, основанные на образовании тройного комплекса фермент-антиген-антитело. Определяемое вещество не является субстратом фермента, но является антигеном. Фермент может присоединять этот антиген вблизи от активного центра. Если в среде есть антиген, то при добавлении антител и формировании тройного комплекса активность фермента изменяется. Активность фермента измеряют любым способом),
4. применение ингибиторов ферментов (Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы. Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции. Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления. Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры. Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях. Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни).
8. Понятие о катаболизме и анаболизме и их взаимосвязи. Эндергонические и экзергонические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии (этапы катаболизма).
Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Он выполняет три специализированные функции:
1. Энергетическая – снабжение клетки химической энергией,
2. Пластическая – синтез макромолекул как строительных блоков,
3. Специфическая – синтез и распад биомолекул, необходимых для выполнения специфических клеточных функций.
Анаболизм – это биосинтез белков, полисахаридов, липидов, нуклеиновых кислот и других макромолекул из малых молекул-предшественников. Поскольку он сопровождается усложнением структуры, то требует затрат энергии (эндергонические реакции). Источником такой энергии является энергия АТФ. Также для биосинтеза некоторых веществ (жирные кислоты, холестерол) требуются богатые энергией атомы водорода – их источником является НАДФН. Молекулы НАДФН образуются в реакциях окисления глюкозо-6-фосфата в пентозном пути и оксалоацетата малик-ферментом. В реакциях анаболизма НАДФН передает свои атомы Н2 на синтетические реакции и окисляется до НАДФ. Так формируется НАДФ-НАДФН-цикл.
Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ (экзергонические реакции). Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой Е "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ. Следует заметить, что атомы водорода, высвобождаемые в реакциях окисления веществ, могут использоваться клеткой только по двум направлениям: 1)на анаболические реакции в составе НАДФН; 2)на образование АТФ в митохондриях при окислении НАДН и ФАДН2 .
Весь катаболизм условно подразделяется на три этапа:
I этап. Специфический. Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.
II этап. Специфический. Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ.
III этап. Общий, неспецефический. Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
Окислительно-восстановительными называются такие реакции, в процессе которых
происходит перенос электронов от восстановителя к окислителю. Существует четыре способа передачи электронов от одной молекулы к другой: 1. Прямой перенос электронов. 2. Перенос электрона в составе атома водорода. 3. Перенос двух электронов в составе гидрид-иона. 4. Перенос электронов на О2 путем присоединения оного к молекуле-восстановителю.
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Небиологические системы могут совершать работу за счёт тепловой энергии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам. В любой окислительно-восстановительной реакции участвует акцептор электронов (окислитель) и донор электронов (восстановитель). В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокспарой. Способность восстановителя отдавать электрон окислителю выражают стандартным
окислительно-восстановительным потенциалом (Е0). Величину окислительно-
восстановительного потенциала (в вольтах) конкретной окислительно-восстановительной пары
определяют путем сравнения со стандартом. Чем выше величина стандартного окислительно-восстановительного потенциала некоторой окислительно-восстановительной пары, тем выше способность этой пары принимать электроны. Поток электронов всегда направлен таким образом, чтобы в результате свободная энергия системы уменьшалась. Е, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ. Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют. Существует три основных способа использования АТФ:1)биосинтез веществ, 2)транспорт веществ через мембраны, 3)изменение формы клетки и ее движение.
Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл.
9. Оксидоредуктазы. Классификация. Характеристика подклассов. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм. Важнейшие субстраты НАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы: сукцинатдегидрогеназа и ацилКоА-дегидрогеназа.
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Систематическое название образуется: Донор электронов : акцептор электронов – оксидоредуктаза.
Первичные акцепторы водорода окислительно-восстановительных реакций относят к 2 типам дегидрогеназ: никотинамвдзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (пр: FAD, FMN, биотин). Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Н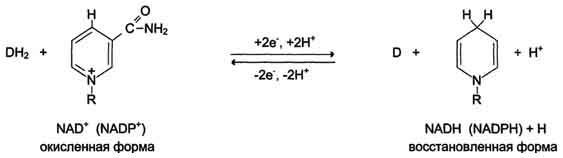 икотинамидзависимые
дегидрогеназы содержат в качестве
коферментов NAD+ или NADP+,
NAD+
и NADP+ - производные витамина PP. Эти
коферменты входят в состав активных
центров дегидрогеназ, но могут обратимо
диссоциировать из комплекса с апоферментами
и включаются в состав фермента в ходе
реакции. Субстраты NAD- и NADP-зависимых
дегидрогеназ находятся в матриксе
митохондрий и в цитозоле. Рабочей частью
никотинамидных коферментов служит
никотинамид . Большинство дегидрогеназ,
поставляющих электроны в ЦПЭ, содержат
NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+.
икотинамидзависимые
дегидрогеназы содержат в качестве
коферментов NAD+ или NADP+,
NAD+
и NADP+ - производные витамина PP. Эти
коферменты входят в состав активных
центров дегидрогеназ, но могут обратимо
диссоциировать из комплекса с апоферментами
и включаются в состав фермента в ходе
реакции. Субстраты NAD- и NADP-зависимых
дегидрогеназ находятся в матриксе
митохондрий и в цитозоле. Рабочей частью
никотинамидных коферментов служит
никотинамид . Большинство дегидрогеназ,
поставляющих электроны в ЦПЭ, содержат
NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+.
Т.о. NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах. Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей р-ию: NADPH + NAD+ ↔ NADP+ + NADH.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2. Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система. FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента.
Б ольшинство
FAD-зависимых дегидрогеназ - растворимые
белки, локализованные в матриксе
митохондрий. Исключение составляет
сукцинат-дегидрогеназа, находящаяся
во внутренней мембране митохондрий. К
FMN-содержащим ферментам принадлежит
NADH-дегидрогеназа, которая также
локализована во внутренней мембране
митохондрий; она окисляет NADH, образующийся
в митохондриальном матриксе.
ольшинство
FAD-зависимых дегидрогеназ - растворимые
белки, локализованные в матриксе
митохондрий. Исключение составляет
сукцинат-дегидрогеназа, находящаяся
во внутренней мембране митохондрий. К
FMN-содержащим ферментам принадлежит
NADH-дегидрогеназа, которая также
локализована во внутренней мембране
митохондрий; она окисляет NADH, образующийся
в митохондриальном матриксе.
10. Окислительное декарбоксилирование пирувата и цикл Кребса: последовательность реакций, связь с дыхательной цепью, регуляция, значение.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А.
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2
Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов:
1) Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию. 2)Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции. 3)Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД. Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2).
О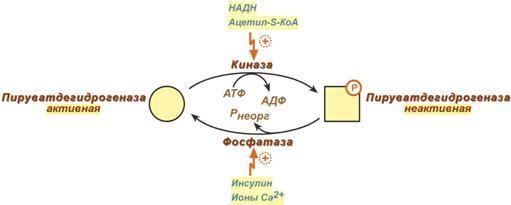 ставшиеся
2 реакции необходимы для возвращения
липоевой кислоты и ФАД в окисленное
состояние (катализируются
дигидролипоат-дегидрогеназой, Е3). При
этом образуется НАДН.
ставшиеся
2 реакции необходимы для возвращения
липоевой кислоты и ФАД в окисленное
состояние (катализируются
дигидролипоат-дегидрогеназой, Е3). При
этом образуется НАДН.
Регулируемым ферментом ПВК-дегидрогеназного комплекса является первый фермент – пируватдегидрогеназа (Е1). Два вспомогательных фермента – киназа и фосфатаза обеспечивают регуляцию активности пируватдегидрогеназы путем ее фосфорилирования и дефосфорилирования. Вспомогательный фермент киназа активируется при избытке конечного продукта биологического окисления АТФ и продуктов ПВК-дегидрогеназного комплекса – НАДН и ацетил-S-КоА. Активная киназа фосфорилирует пируватдегидрогеназу, инактивируя ее, в результате первая реакция процесса останавливается. Фермент фосфатаза, активируясь ионами кальция или инсулином, отщепляет фосфат и активирует пируватдегидрогеназу. Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) АТФ и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы в случае когда энергии достаточно. Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот.
Образующийся в ПВК-дегидрогеназной реакции ацетил-SКоА далее вступает в цикл трикарбоновых кислот (ЦТК, цикл лимонной кислоты, цикл Кребса). Кроме пирувата, в цикл вовлекаются кетокислоты, поступающие из катаболизма аминокислот или каких-либо иных веществ.
Цикл Кребса протекает в матриксе митохондрий и представляет собой восемь последовательных реакций: связывание ацетила и оксалоацетата (щавелевоуксусной кислоты) с образованием лимонной кислоты, изомеризация лимонной кислоты и последующие реакции окисления с сопутствующим выделением СО2. После восьми реакций цикла вновь образуется оксалоацетат.
Основная роль ЦТК заключается в генерации атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2. Кроме этого, в ЦТК образуется одна молекула АТФ, сукцинил-SКоА, участвующий в синтезе гема, кетокислоты, являющиеся аналогами АК – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой.
Главным и основным регулятором ЦТК является оксалоацетат, а точнее его доступность. Наличие оксалоацетата вовлекает в ЦТК ацетил-SКоА и запускает процесс.
Обычно в клетке имеется баланс между образованием ацетил-SКоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата в анаплеротической реакции), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты в результате трансаминирования.
Примером существенной роли оксалоацетата служит активация синтеза кетоновых тел и кетоацидоз плазмы крови при недостаточном количестве оксалоацетата в печени. Такое состояние наблюдается при инсулинзависимом сахарном диабете, при голодании, алкогольном отравлении или длительной физической нагрузке.
Также некоторые ферменты ЦТК являются чувствительными к аллостерической регуляции метаболитами: Ингибиторы Активаторы
Цитратсинтаза АТФ, цитрат, НАДН, ацил-S-КоА
Изоцитрат-дегидрогеназа АТФ, НАДН АМФ, АДФ
α-Кетоглутарат-дегидрогеназа Сукцинил-S-КоА, НАДН цАМФ
Ацетил-СоА является ключевым промежуточным соединением в превращении всех основных питательных веществ. В аэробных условиях он образуется изсахаров при окислительном декарбоксилировании пировиноградной кислоты, липидов при β-окислении жирных кислот и при гликолитическом распаде глицерина, АК путем образования пирувата (Gly, Ser, Val, Ala, Leu, Ile, Cys), промежуточных соединений цикла лимонной кислоты (Asp, Asn, Glu, Gln, Pro) или др промежуточных соединений (Leu, Ilе, Trp). Внутренняя мембрана митохондрий непроницаема для ацетил-СоА. Поэтому вначале АсСоА конденсируется с оксалоацетатом с образованием цитрата, легко проникающего в цитоплазму. В цитоплазме цитрат распадается под действием цитрат-омыляюшего фермента на оксалоацетат и исходный ацетил-СоА, который используется в синтетических реакциях (синтезе жирных кислот, синтезестероидов и т.д.). Фрагмент молекулы ацетил-СоА, содержащий 2С, вступает в реакцию конденсации с оксалоацетатом (4С), что приводит к образованию цитрата (6С), который в процессе шести последовательных реакций опять превращается в оксалоацетат. Два атома углерода постепенно отщепляются в виде молекул СО2 (одна молекула от ацетил-СоА, другая – от оксалоацетата), а восемь атомов водорода (4 х 2) отщепляются дегидрогеназами, при этом они оказываются связанными с коферментами соответствующих дегидрогеназ. Цикл лимонной кислоты протекает в тесной связи с дыхательной цепью, где большая часть энергии выделяется при окислении восстановленных коферментов. Реакции цикла лимонной кислоты протекают внутри митохондрий, в так называемом матриксе. Ферменты, способные катализировать эти реакции, не связаны с какой-либо биологической структурой. Практически это приводит к тому, что любая отдельная реакция цикла может служить исходным пунктом для дальнейших катаболических или анаболических процессов. Таким образом, цикл лимонной кислоты является одним из нескольких возможных путей превращения ацетил-СоА в организме, направленных на получение наибольшей энергии. Соединения, участвующие в цикле лимонной кислоты, образуют пул промежуточных веществ, дающих начало обратимым процессам в организме. Эти процессы метаболизма связывают в единое целое различные реакции распада и синтеза. С этой точки зрения отдельные реакции цикла лимонной кислоты занимают центральное место в метаболизме. α-Кетоглутарат является самым важным акцептором аминогрупп в реакциях переаминирования. Этот процесс приводит к получению глутамата, из которого могут образоваться глутамин или γ-аминомасляная кислота (последняя может превратиться в полуальдегид яблочной кислоты, который далее окисляется в яблочную кислоту). Глутамин также может выступать в качестве предшественника в синтезе пролина, орнитина, цитруллина, аргинина и других метаболитов.
Оксалоацетат является ключевым соединением для процесса глюконеогенеэа. Из него последова тельными реакциями (через фосфоенолпируват) получаются сахара. В этом случае каждый второй
атом углерода жирных кислот может входить в молекулу сахара. Полный синтез сахаров только
из липидов в организме млекопитающих невозможен, так как при превращениях ацетил-СоА в цикле лимонной кислоты один атом углерода отщепляется в виде CO2. Млекопитающие не способны синтезировать сахара из ацетил-СоА. Обратимое переаминирование оксалоацетата приводит к образованию аспарагиновой кислоты, способной служить исходным соединением для получения пиримидиновых нуклеотидов или некоторых АК. Сукцинил-СоА может образовывать с глицином
δ-аминолевулиновую кислоту, которая конденсируется в порфобилиноген - основное соединение, используемое в синтезе порфириновых структур. Фумарат является одним из продуктов разложения ароматических аминокислот, он также образуется из аспарагиновой кислоты в цикле мочевины.
Промежуточные соединения цикла лимонной кислоты включаются в следующие процессы биосинтеза:
а. Глюконеогенез - превращение оксалоацетата в фосфоенолпируват и в сахара.
б. Синтез жирных кислот, который протекает вне митохондрий (ацетил-СоА не может проходить через
мембрану митохондрий, сначала он должен быть превращен в цитрат реакцией с оксалоацетатом; далее цитрат переносится в цитоплазму). Ацетил-СоА вновь образуется в цитоплазме при распаде цитрата с помощью специального АТР-зависимого фермента (цитрат-омыляющий фермент) и затем включается в биосинтез жирных кислот.
в. Взаимопревращения АК. Все реакции начинаются с синтеза трех АК (Ala, Asp, Glu),
получающихся из кетокислот цикла лимонной кислоты за счет переаминирования; центральная роль в этой реакции принадлежит продукту цикла лимонной кислоты - α-кетоглутарату. Аминогруппы различных АК под действием трансаминазы переносятся к α-кетоглутарату. При этом образуется глутамат, а АК, участвующие в реакции переаминирования, превращаются в кетокислоты. Предполагается, что процессы переаминирования протекают преимущественно в цитоплазме. Образующийся в этой реакции глутамат при помощи специфического носителя переносится в митохондрии, где аминогруппа либо отщепляется окислительным дезаминированием, либо ее перенос к оксалоацетату приводит к образованию аспартата. Азот аминогрупп глутаминовой и аспарагиновой кислот в клетках печени оказывается в конце концов в составе мочевины, а образующийся при этом α-кетоглутарат окисляется в цикле лимонной кислоты.
г. Синтез пиримидинов и пуринов. Аспартат образует углеродный скелет пиримидинов. Из глутамина получаются аминогруппы пиримидинов и пуринов.
д. Синтез порфиринов. Сукцинил-СоА является исходным соединением для синтеза порфиринов.
е. Синтез изопреноидов начинается с ацетил-СоА и протекает в цитоплазме. Центральная роль ацетил-СоА в метаболизме определяется тем, что, являясь продуктом катаболизма сахаров, липидов и определенных аминокислот, он может быть или полностью окислен в цикле лимонной кислоты и дыхательной цепи до СО2 и Н2О, или же использован в качестве активного промежуточного соединения для синтеза (его свободная энергия несколько выше, чем свободная энергия АТР).
Последовательность реакций цитратного цикла
1. Образование цитрата. В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэ-фирная связь и освобождается коэнзим A. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
2. Превращение цитрата в изоцитрат. Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат. Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции.
3. Окислительное декарбоксилирование изоцитрата. Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и В) цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат. Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
4. Окислительное декарбоксилирование α-кетоглутарата. В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сукцинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА. Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом. Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD.
5. Превращение сукцинил-КоА в сукцинат. Сукцинил-КоА - высокоэнергетическое соединение. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ). Эту сопряжённую реакцию катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа. Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КоА) - пример субстратного фосфорилирования.
6. Дегидрирование сукцината. Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
7. Образование малата из фумарата. Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
8. Дегидрирование малата. В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
За 1 оборот цикла при окислении ацетил-КоА образуется: а) 2 молекулы СО2 б) 3 молекулы НАДН в) 1 молекула ФАДН2 г) 1 молекула АТФ (от субстратного фосфрилирования). Регуляция:
Ключевые ферменты Активаторы Ингибиторы
Цитаратсинатаза Ацетил-КоА, оксалоацетат АТФ, НАДН, сукцинил-КоА,
(начальный) динноцепочечные жирные кислоты
Изоцитратдегидрогеназа АДФ(аллостерический), АТФ, НАДН, НАДФН
(лимитирующий) цАМФ, Са2+
L-кетоглутаратдегидрогеназа цАМФ, Са2+ сукцинил-КоА, АТФ, НАДН
(фермент на развилке)
Значение: 1) Анаболическое: а) Катаболическая, т.к. в нём происходит распад ацетильных остатков, полученных из белков, липидов и углеводов; б) Анаболическая, т.к. субстраты цикла используются для синтеза др соединений (оксалоацетат, сукцинат – на синтез заменимых АК). 2) Энергетичекая – за 2 цикл образуется 1 АТФ. 3) Является основным поставщиком Н2 для дыхательной цепи, в составе НАДН и ФАДН2. 4) Регуляторная: продукты цикла являются регуляторами других процессов (АТФ и цитрат тормозят расщепление глюкозы, о стимулируют синитез ж. кислот.
11. Дыхательная цепь, компоненты, структурная организация. Электрохимический потенциал, его значение.
Дыхательная цепь – это совокупность red-ox реакций в результате которых Н2 и электроны переносятся на О2 с выделением Н2О и энергии. В результате окислительных реакций в цикле Кребса, катализируемых дегидрогеназами, протоны и электроны переходят от органических субстратов на кофакторы НАД и ФАД, восстанавливая их в НАДН иФАДН2. Эти вещества обладают высоким энергетическим потенциалом. Электроны от них передаются на О2 ч/з ряд red-ox реакций. Окисление органических веществ в клетках сопровождающееся потреблением О2 и образованием Н2О называется тканевым дыханием, а цепь переноса электронов – дыхательной цепью.
Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов и АК, далее поступают в митохондрии, где ферментами дыхательной цепи осуществляется процесс окислительного фосфорилирования.
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, (QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы.
Принцип работы дыхательной цепи:
1) Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2) Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3)Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4) В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5) Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
6) При этом они теряют энергию, которая используется для синтеза АТФ.
Таким образом, восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
В дыхательной цепи есть 2 входа: 1. Протоны поступают в цепь ч/з НАДН; 2. В составе ФАДН2
Характеристика компонентов дыхательной цепи (ферментативных комплексов):
1) НАДН-дегидрогеназа (НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. Сложный, имеет 2 простетические группы: ФМН (флавинмононуклеотид – активная форма витамина В2) и Железосерные белки (FеS-белки). Атомы Fe, входящие в FеS-центры являются негеминовыми (не входят в состав гема). Активный центр НАДНДГ обращён в сторону матрикса митохондрий. НАДНДГ дегедрирует НАДН (отщепляет Н2) и передаёт протоны и электроны сначала на ФМН, а потом ч/з FеS-центры на СоQ(восстанавливается и превращается в КоQН2 или убихинол).
Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
б) Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2) КоQ (убихинон) – небелковый переносчик, находится в растворенном состоянии, т.к. является жирорастворимым (растворяется в липидном слое мембран). Поэтому может перемещаться как вдоль так и поперек мембраны (не заряжен). Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь. Его называют коллектором электронов.
3) Цитохромы (b, c1, c, а, а3) – сложные белки (гемпротеины), небелковой частью которых является гем, содержащий Fе3+ (окисленная форма). Fе гема может обратимо принимать и отдавать электроны.
4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза) – это ферментный комплекс, состоящий из цитохромов b и с1, включающий также FеS-центры. Функция:
а) Принимает электроны от коэнзима Q и передает их на цитохром с (при этом Fе восстанавливается до 2х валентного); б)Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5) Цитохром с-кислород-оксидоредуктаза - В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
6) АТФ-синтаза – комплекс, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
«Хемиоосматическая теория сопряжения, окисления и фосфорилирования» Митчел:
«Перенос электронов по дыхательной цепи от НАДН к О2 сопровождается выкачиванием протонов из матрикса митохондрий ч/з внутреннюю мембрану в межмембранное пространство. Перенос протонов осуществляется за счет свободной энергии, освобождающейся при переносе электронов по градиенту окислительно-восстановительного потенциала.»
Протоны вернуться в матрик не могут, т.к. внутренняя мембрана митохондрий непроницаема для них и для других заряженных частиц. В результате на внешней стороне внутренней мембраны сосредотачиваются «+» заряды, а на внутренней «-». На мембране возникает разность электрических потенциалов (ΔΨ, "дельта пси"). Протоны накапливаются в межмембранном пространстве, рН снижается, т.е. среда будет кислая. А в матриксе протонов меньше, возникает градиент химического потенциала (ΔрН). ΔμH+ = ΔΨ + ΔрН (электрохимический потенциал Митчела).
Наиболее активный транспорт протонов в межмембранное пространство происходит в пунктах сопряжения, оксиления и фосфорилирования. Важную роль в процессе транспорта протонов выполняет КоQ. На каждую переносимую пару электронов по дыхательной цепи от НАДН к О2 вырабатывается 3 пары протонов. Если электроны переносятся с ФАДН2, то 2 пары протонов. Протоны могут вернутся в матрикс только по ионным каналам фермента АТФ-синтазы.
ΔμH+, генерируемый за счет протонов в каждом из пунктов сопряжения используется для синтеза 1й молекула АТФ. Синтезируемая АТФ переходит в матрикс митохондрий.
12. Окислительное фосфорилирование АДФ. Механизм. Сопряжение и разобщение окисления и фосфорилирования в дыхательной цепи. Коэффициент Р/0. Регуляция дыхательной цепи.
На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования:
1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов.
2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода.
4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию.
Ч![]() асть
энергии электронов используется I, III,
IV комплексами дыхательных ферментов
для перемещения ионов водорода через
мембрану в межмембранное пространство.
Другая часть рассеивается в виде тепла.
Упрощенно сказанное представить в виде
равенства:
асть
энергии электронов используется I, III,
IV комплексами дыхательных ферментов
для перемещения ионов водорода через
мембрану в межмембранное пространство.
Другая часть рассеивается в виде тепла.
Упрощенно сказанное представить в виде
равенства:
5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией.
Градиент (Δμ, "дельта мю") получил название электрохимический градиент или протонный градиент. Он имеет две составляющие – электрическую (ΔΨ, "дельта пси") и концентрационную (ΔрН):
Δμ = ΔΨ + ΔрН
Название "участки сопряжения" возникло из-за того, что появление протонного градиента в результате окислительных процессов обеспечивает в дальнейшем фосфорилирование АДФ до АТФ (см п.п.6). Именно благодаря этим трем ферментным комплексам энергия реакций окисления может передаваться на фосфорилирование, т.е. существует сопряжение (связывание) двух процессов.
6![]() .
Как завершение всех предыдущих событий
и необходимый их результат происходит
наработка АТФ: ионы H+ теряют свою энергию,
проходя через АТФ-синтазу (Н+-транспортирующая
АТФ-аза, КФ 3.6.3.14.). Часть этой энергии
тратится на синтез АТФ. Другая часть
рассеивается в виде тепла:
.
Как завершение всех предыдущих событий
и необходимый их результат происходит
наработка АТФ: ионы H+ теряют свою энергию,
проходя через АТФ-синтазу (Н+-транспортирующая
АТФ-аза, КФ 3.6.3.14.). Часть этой энергии
тратится на синтез АТФ. Другая часть
рассеивается в виде тепла:
Сопряжение в дыхательной цепи — это такое состояние, когда окисление (перенос электронов) сопровождается фосфорилированием, то есть синтезом АТФ. Разобщение — это такое состояние дыхательной цепи, когда окисление идет, а фосфорилирование не происходит, то есть пункты фосфорилирования выключены полностью или частично. В этом случае вся или какая-то часть образующейся энергии выделяется в виде тепла. Разобщение в дыхательной цепи могут вызывать липофиль-ные вещества, которые способны переносить протоны водорода с внешней стороны внутренней мембраны митохондрий на внутреннюю, минуя АТФ-синтетазу. В результате вся энергия мембранного потенциала будет рассеиваться в виде тепла. Разобщение вызывают: 2,4-ДНФ (динитрофенол), многие яды промышленных производств, бактериальные токсины, набухание митохондрий, жирные кислоты, ионофоры (вещества, переносящие ионы через мембрану). Разобщители повышают скорость переноса электронов по дыхательной цепи и выводят ее из под контроля АТФ.
Вещества, которые снижают величину электрохимического градиента, приводя к увеличению скорости движения электронов по ферментам дыхательной цепи, уменьшению синтеза АТФ и возрастанию катаболизма называются разобщители. Они разобщают (разъединяют) процессы окисления и фосфорилирования внутренней мембраны митохондрий. К разобщителям в первую очередь относят "протонофоры" – вещества переносящие ионы водорода. При этом одновременно уменьшаются оба компонента электрохимического градиента – электрический и химический, и энергия градиента рассеивается в виде тепла. Следствием эффекта протонофоров является возрастание катаболизма жиров и углеводов в клетке и во всем организме.
Классическим протонофором является динитрофенол, жирорастворимое соединение, присоединяющие ионы водорода на внешней поверхности внутренней митохондриальной мембраны и отдающие их на внутренней поверхности. Белок термогенин является физиологическим протонофором.
Кроме динитрофенола и термогенина протонофорами, к примеру, являются салицилаты, жирные кислоты и трийодтиронин.
яд веществ может ингибировать ферменты дыхательной цепи и блокировать движение электронов от НАДН и ФАДН2 на кислород. Они называются ингибиторы. В результате прекращается движение электронов, выкачивание ионов Н+ и работа АТФ-синтазы. Синтез АТФ отсутствует и клетка погибает. Выделяют три основных группы ингибиторов:
1. действующие на I комплекс, например, амитал (производное барбитуровой кислоты), ротенон, прогестерон,
2. действующие на III комплекс, например, экспериментальный антибиотик антимицин А,
3. действующие на IV комплекс, например, сероводород (H2S), угарный газ (СО), цианиды (-CN).
Энергетическую ценность и выгодность окисления вещества можно подсчитать. Количество запасенной энергии при окислении того или иного соединения характеризует количество АТФ, а эффективность использования энергии вещества и ее захвата – коэффициент P/O. Коэффициент Р/О – это коэффициент сопряжения окисления и фосфорилирования. Это количество моль АТФ, синтезируемых из АДФ и Н3РО4 на каждый полноценный грамм-атом поглощенного О2. Для субстратов пируват, изоцитрат, малат окисляющимися Над-зависимыми ДГ коэффициент Р/О=3. Для сукцината (ФАД-зависимая ДГ) =2. Если Р/О для пирувата=3 – митохондрии находятся в сопряженном состоянии.
Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль. Дыхательный контроль – это прямое влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ и АДФ, количественная сумма которых в клетке практически постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т.е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН2 на I и II комплексах и замедление катаболизма в клетке. Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+. При этом градиент, естественно, снижается, поток электронов возрастает, в результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров.
В клетке часто может создаваться ситуация, когда реакции окислительного фосфорилирования идут с определенными вариациями. Эти вариации могут являться следствием нарушений в организме или физиологической реакцией на воздействие.
Гипоэнергетические состояния. Причиной гипоэнергетических состояний может быть следующее:
-гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты,
-дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности,
снижение потребления углеводов и липидов как основных источников энергии,
-дефицит кислорода – отсутствие акцептора для электронов вызывает "переполнение" дыхательных ферментов, повышение электрохимического градиента, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма,
-дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы.
13. Субстратное фосфорилирование АДФ. Отличия от окислительного фосфорилирования. Основные пути использования АТФ. Цикл АДФ-АТФ. Понятие о свободном окислении и его значение. Тканевые особенности окислительно-восстановительных процессов.
АТФ - молекула, богатая энергией, поскольку она содержит две фосфоаншдридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват. В свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ. Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч. Основным способом получения АТФ в клетке является окислительное фосфорилирование, протекающее в структурах внутренней мембраны митохондрий. При этом энергия атомов водорода молекул НАДН и ФАДН2, образованных в гликолизе, ЦТК, окислении жирных кислот, преобразуется в энергию связей АТФ. Однако также есть другой способ фосфорилирования АДФ до АТФ – субстратное фосфорилирование, поскольку он является частью метаболического пути («субстратной цепи»). Их особенностью является катализирование растворимыми ферментами. Этот способ связан с передачей макроэргического фосфата или энергии макроэргической связи какого-либо вещества (субстрата) на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем 7,3 ккал/моль в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ. Отличия: разные источники энергии, для окислительного необходимы движение электронов в дых цепи, для субстратного необ-ма энергия макроэргической связи.
Существует три основных способа использования АТФ: 1. биосинтез веществ, 2. транспорт веществ через мембраны,
3. изменение формы клетки и ее движение. Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл:
И спользование
АТФ как источника Е возможно только при
условии непрерывного синтеза АТФ из
АДФ за счёт Е окисления орг-их соединений.
Цикл АТФ-АДФ - основной механизм обмена
энергии в биологических системах.
спользование
АТФ как источника Е возможно только при
условии непрерывного синтеза АТФ из
АДФ за счёт Е окисления орг-их соединений.
Цикл АТФ-АДФ - основной механизм обмена
энергии в биологических системах.
Свободное окисление. Одна из задач свободного (несопряженного) окисления – превращения природных или неприродных субстратов, называемых в этом случае ксенобиотиками (ксено – несовместимый, биос – жизнь). Они осуществляются ферментами диоксигеназами и монооксигеназами. Окисление протекает при участии специализированных цитохромов, локализованных чаще всего в эндоплазматическом ретикулуме, поэтому иногда этот процесс называют микросомальным окислением. В реакциях свободного окисления участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором электронов является цитохром Р-450 (иногда цитохром b5). Окисление субстрата протекает по следующей схеме: SH + O2–> SOH. Ферменты свободного окисления: оксидазы, оксигеназы, некоторые дегидрогеназы. Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных металлов. Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за счет электрона атома железа в активном центре. Монооксигеназы требуют участия в реакции НАДФН, атомы Н2 которого взаимодействуют с одним из атомов О2, поскольку только один электрон связывается с субстратом. В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные св-ва. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма. При свободном окислении высвобождающаяся при сопряженном с окислением распаде химических связей энергия переходит в тепловую и рассеивается. По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами или сопровождающиеся образованием Н202, многие реакции, катализируемые оксидазами. Процессы свободного окисления сосредоточены в цитозоле, в мембранах эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки.
Тканевые и возрастные особенности окислительных процессов. Анаэробные ткани могут получать энергию без кислорода. Такими тканями являются: скелетные мышцы, эритроциты, периферические нервы, мозговое вещество почек, кость, хрящ, соединительная ткань. Аэробные ткани получают энергию с использованием кислорода и полностью зависят от кровотока. К таким тканям относятся: головной мозг, сетчатка глаза, сердце, кора почек, печень, слизистая тонкого кишечника. Потребление кислорода, а значит, и интенсивность окислительных процессов с возрастом падают.
14. Функции углеводов. Потребность организма в углеводах. Переваривание углеводов. Нарушения переваривания и всасывания углеводов. Унификация моносахаридов. Роль печени в обмене углеводов.
Углеводы - это оксопроизводные многоатомных спиртов и продукты их конденсации. В организме человека имеется несколько десятков различных моносахаридов и разнообразные олиго‑ и полисахариды. Функции углеводов:
1. Углеводы служат источником энергии (главная роль принадлежит глюкозе и гликогену, около 57% суточного калоригенеза; Энергетич ценность 1 г+17,18 кДж).
2. Углеводы входят в состав структурно‑функциональных компонентов клеток. К ним относятся пентозы нуклеотидов и нуклеиновых кислот, углеводы гликолипидов и гликопротеинов, гетерополисахариды межклеточного вещества.
3. Из углеводов могут синтезироваться соединения других классов (липиды и аминокислоты).
4. Выполняют структурообразовательную функцию, то есть входят в состав клеточных и межклеточных структур (Углеводные структуры принимают участие и в др. высокоспецифич. явлениях клеточного взаимод., таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д. ).
К заболеваниям, связанным с патологией углеводного обмена относятся сахарный диабет, гликогенозы, агликогенозы, мукополисахаридозы, галактоземии и фруктоземии.
Потребность в углеводах взрослого организма составляет 350-400 г в сутки, при этом целлюлозы и других пищевых волокон должно быть не менее 30-40 г.
С пищей в основном поступают крахмал, гликоген, целлюлоза, сахароза, лактоза, мальтоза, глюкоза и фруктоза, рибоза.
Переваривание углеводов в ЖКТ: 1. Ротовая полость: Со слюной сюда поступает кальций-содержащий фермент α-амилаза. Оптимум ее рН 7,1-7,2, активируется ионами Cl–. Являясь эндоамилазой, она беспорядочно расщепляет внутренние α1,4-гликозидные связи крахмала и гликогена и не влияет на другие типы связей. Т.к. переваривание в ротовой полости длится не долго углеводы расщепляются до декстринов и мальтозы. Дисахариды не гидролизуются. Пищевой комок далее перемещается по пищеводу в желудок. 2. В желудке собственных ферментов для переваривания углеводов нет. Переваривание происходит под действием α-амилазы слюны внутри пищевого комка, пока содержимое не пропитается желудочным соком. рН его=1,5-2,5, поэтому α-амилаза инактивируется. В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей. 3. Основной процесс переваривания происходит в верхнем отделе кишечника – 12-перстной кишке под действием панкреатической α-амилазы. Декстрины в результате гидролизуются до мальтозы. Этот процесс происходит в просвете кишки. В полости тонкого кишечника работают совместно панкреатическая α-амилаза, разрывающая внутренние α1,4-связи, изомальтаза, разрывающая α1,6-связи изомальтозы, олиго-α1,6-глюкозидаза, действующая на точки ветвления крахмала и гликогена. Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов:
-сахаразо-изомальтазный комплекс (рабочее название сахараза) – в тощей кишке гидролизует α1,2-, α1,4-, α1,6-гликозидные связи, расщепляет сахарозу, мальтозу, мальтотриозу, изомальтозу,
-гликоамилазный комплекс – находится в нижних отделах тонкого кишечника и расщепляет α1,4-гликозидные связи в олигосахаридах,
-β-гликозидазный комплекс (рабочее название лактаза) – гидролизует β1,4-гликозидные связи между галактозой и глюкозой (лактозу). У детей активность лактазы очень высока уже до рождения и сохраняется на высоком уровне до 5-7 лет, после чего снижается.
- Трегалаза - также гликозидазный комплекс, гидролизующий связи между мономерами в тре-галозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Совместные действия перечисленных ферментов завершают переваривание пищевых углеводов с образованием моносахаров.
Целлюлоза ферментами человека не переваривается. Но в толстом кишечнике под действием микрофлоры до 75% ее количества гидролизуется с образованием целлобиозы и глюкозы. Глюкоза частично используется самой микрофлорой и окисляется до органических кислот (масляной, молочной), которые стимулируют перистальтику кишечника. Частично глюкоза может всасываться в кровь.
После переваривания начинается процесс всасывания. После переваривания крахмала и гликогена, после расщепления дисахаридов в полости кишечника накапливается глюкоза и другие моносахариды, которые должны попасть в кровь. Для этого им необходимо преодолеть, как минимум, апикальную мембрану энтероцита и его базальную мембрану. Всасывание моносахаридов из просвета кишечника происходит по механизму вторичного активного транспорта. Это значит, что затрата энергии при переносе сахаров происходит, но тратится она не непосредственно на транспорт молекулы, а на создание градиента концентрации другого вещества. В случае моносахаридов таким веществом является натрий. Фермент Na+,К+-АТФаза постоянно, в обмен на калий, выкачивает ионы натрия из клетки, именно этот транспорт требует затрат энергии. В просвете кишечника содержание натрия относительно высоко и он связывается со специфическим мембранным белком, имеющим два центра связывания: один для натрия, другой для сахара. Примечательно то, что сахар связывается с белком только после того, как с ним свяжется натрий. Белок-транспортер свободно мигрирует в толще мембраны. При контакте белка с цитоплазмой натрий быстро отделяется от него по градиенту концентрации и сразу отделяется сахар. Результатом является накопление сахара в клетке, а ионы натрия выкачиваются Na+,К+-АТФазой.
Выход глюкозы из клетки в межклеточное пространство и далее кровь происходит благодаря простой и облегченной диффузии. После выхода в кровь, оттекающую от кишечника, моносахариды движутся по сосудам воротной системы в печень, частично задерживаются в ней, частично выходят в большой круг кровообращения. Следующей их задачей стоит проникновение в клетки органов.
Из крови внутрь клеток глюкоза попадает при помощи облегченной диффузии по градиенту концентрации с участием белков-переносчиков (глюкозных транспортеров "ГлюТ"). Различают 5 видов транспортеров глюкозы ГлюТ 1, ГлюТ 2, ГлюТ 3, ГлюТ 4, ГлюТ 5. Глюкозные транспортеры имеются на мембранах всех клеток. В мышцах и жировой ткани находится ГлюТ 4, только эти транспортеры являются чувствительными к влиянию инсулина. При действии инсулина на клетку они поднимаются к поверхности мембраны и переносят глюкозу внутрь. Указанные ткани получили название инсулинзависимых.Некоторые ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. Часть клеток занимает промежуточное положение, т.е. на их мембранах находятся ГлюТ 4 и другие типы транспортеров.
НАРУШЕНИЯ ПЕРЕВАРИВАНИЯ И ВСАСЫВАНИЯ УГЛЕВОДОВ. В основе патологии переваривания и всасывания углеводов могут быть причины двух типов: 1)дефекты ферментов, участвующих в гидролизе углеводов в кишечнике; 2) нарушение всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника. В обоих случаях возникает осмотическая диарея, которую вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды. Всё вместе приводит к притоку воды в кишечник, увеличению объёма кишечного содержимого, усилению перистальтики, спазмам и болям, а также метеоризму.
Существуют две наиболее встречающиеся формы нарушения переваривания дисахаридов в кишечнике – дефект лактазы (β-гликозидазного комплекса) и сахаразы (сахаразо-изомальтазного комплекса), которые называются как интолерантность к лактозе и сахарозе или непереносимость лактозы и сахарозы. Приобретенная недостаточность. Приобретенные формы недостаточности переваривания углеводов возникают в результате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образование ферментов и их размещение на щеточной каемке энтероцитов. К тому же ухудшается всасывание моносахаров. Наследственная недостаточность. При наследственной (первичной) патологии лактазы симптомы проявляются после первых кормлений. Патология сахаразы обнаруживается позднее, при введении в рацион сладкого. Недостаточность лактазы может проявляться не только у младенцев, но и в подростковом и взрослом возрасте, что является физиологическим возрастным изменением. Такая недостаточность широко распространена среди монголоидов и негроидов.
Патогенез: Отсутствие гидролиза соответствующих дисахаридов приводит к осмотическому эффекту и задержке воды в просвете кишечника. Кроме этого, сахара активно потребляются микрофлорой толстого кишечника и метаболизируют с образованием органических кислот (масляная, молочная) и газов. Из-за этого симптомами лактазной или сахаразной недостаточности являются диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли, атопический дерматит.
Диагностика. Диагноз ферментативной недостаточности ставится на основании анамнеза, симптомов заболевания и анализа кала. Основы лечения. Использование препаратов, содержащих соответствующие ферменты, снижение в рационе содержания молока или продуктов с добавлением сахара в зависимости от типа непереносимого углевода.
Поскольку в кишечнике всасываются все поступающие с пищей моносахариды (фруктоза, галактоза, манноза и т.п.), то перед организмом встает задача превратить полученные гексозы в глюкозу для ее дальнейшего использования в реакциях метаболизма. Этот процесс получил название взаимопревращение сахаров (унификация моносахаридов).Цель этого процеса – создание только одного субстрата для реакций метаболизма, а именно α-D-глюкозы, что позволяет сэкономить ресурсы, не образовывать множество ферментов для каждого вида моносахарида. Реакции протекают в эпителии кишечника и, в основном, в гепатоцитах.
П ревращение
галактозы.Галактоза
сначала подвергается фосфорилированию
по 1-му атому углерода. Отличительной
особенностью является превращение в
глюкозу не напрямую, а через синтез
УДФ-галактозы из галактозо-1-фосфата.
Источником УМФ является УДФ-глюкоза,
заранее имеющаяся в клетке. Образованная
УДФ-галактоза впоследствии изомеризуется
в УДФ-глюкозу и далее ее судьба различна.
Она
может: -участвовать в реакции переноса
УМФ на галактозо-1-фосфат, -превращаться
в свободную глюкозу и выходить в кровь,
-отправляться на синтез гликогена.
Нарушения
обмена
галактозы могут быть вызваны генетическим
дефектом одного из ферментов: галактокиназы,
галактозо-1-фосфат-уридилтрансферазы,
эпимеразы. Заболевание, возникающее
при этих нарушениях, получило название
галактоземия.
ревращение
галактозы.Галактоза
сначала подвергается фосфорилированию
по 1-му атому углерода. Отличительной
особенностью является превращение в
глюкозу не напрямую, а через синтез
УДФ-галактозы из галактозо-1-фосфата.
Источником УМФ является УДФ-глюкоза,
заранее имеющаяся в клетке. Образованная
УДФ-галактоза впоследствии изомеризуется
в УДФ-глюкозу и далее ее судьба различна.
Она
может: -участвовать в реакции переноса
УМФ на галактозо-1-фосфат, -превращаться
в свободную глюкозу и выходить в кровь,
-отправляться на синтез гликогена.
Нарушения
обмена
галактозы могут быть вызваны генетическим
дефектом одного из ферментов: галактокиназы,
галактозо-1-фосфат-уридилтрансферазы,
эпимеразы. Заболевание, возникающее
при этих нарушениях, получило название
галактоземия.
П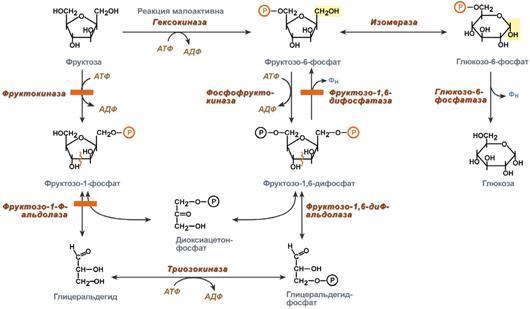 ревращение
фруктозы.Переход
фруктозы в глюкозу осуществляется по
двум направлениям. Сначала происходит
активация фруктозы посредством
фосфорилирования либо 6-го атома углерода
при участии гексокиназы, либо 1-го атома
при участии фруктокиназы. Но гексокиназа
имеет гораздо более низкое сродство к
фруктозе и этот путь не выражен.
Фруктозо-6-фосфат далее изомеризуется
и глюкозо-6-фосфатаза отщепляет уже
ненужный фосфат.
Если
образуется фруктозо-1-фосфат, под
действием соответствующей альдолазы
он превращается в глицеральдегид и
диоксиацетонфосфат, которые в дальнейших
реакциях либо используются в гликолизе,
либо в реакциях глюконеогенеза
превращаются в фруктозо-6-фосфат и далее
в глюкозу. Особенностью метаболизма
фруктозы является то, что фермент
фруктокиназа является инсулин-независимым.
В результате превращение фруктозы в
пировиноградную кислоту и ацетил-SКоА
происходит быстрее, чем для глюкозы.
Это объясняется "игнорированием"
лимитирующей реакции метаболизма
глюкозы, катализируемой фосфофруктокиназой.
Дальнейший метаболизм ацетил-SКоА в
данном случае может привести к избыточному
образованию жирных кислот и
триацилглицеролов. Генетический дефект
фруктокиназы приводит к доброкачественной
эссенциальной фруктозурии, протекающей
безо всяких отрицательных симптомов.
Наследственная
фруктозурия. Заболевание формируется
вследствие наследственных
аутосомно-рецессивных дефектов других
ферментов обмена фруктозы. Дефект
фруктозо-1-фосфатальдолазы проявляется
после введения в рацион младенца соков
и фруктов, содержащих фруктозу.
ревращение
фруктозы.Переход
фруктозы в глюкозу осуществляется по
двум направлениям. Сначала происходит
активация фруктозы посредством
фосфорилирования либо 6-го атома углерода
при участии гексокиназы, либо 1-го атома
при участии фруктокиназы. Но гексокиназа
имеет гораздо более низкое сродство к
фруктозе и этот путь не выражен.
Фруктозо-6-фосфат далее изомеризуется
и глюкозо-6-фосфатаза отщепляет уже
ненужный фосфат.
Если
образуется фруктозо-1-фосфат, под
действием соответствующей альдолазы
он превращается в глицеральдегид и
диоксиацетонфосфат, которые в дальнейших
реакциях либо используются в гликолизе,
либо в реакциях глюконеогенеза
превращаются в фруктозо-6-фосфат и далее
в глюкозу. Особенностью метаболизма
фруктозы является то, что фермент
фруктокиназа является инсулин-независимым.
В результате превращение фруктозы в
пировиноградную кислоту и ацетил-SКоА
происходит быстрее, чем для глюкозы.
Это объясняется "игнорированием"
лимитирующей реакции метаболизма
глюкозы, катализируемой фосфофруктокиназой.
Дальнейший метаболизм ацетил-SКоА в
данном случае может привести к избыточному
образованию жирных кислот и
триацилглицеролов. Генетический дефект
фруктокиназы приводит к доброкачественной
эссенциальной фруктозурии, протекающей
безо всяких отрицательных симптомов.
Наследственная
фруктозурия. Заболевание формируется
вследствие наследственных
аутосомно-рецессивных дефектов других
ферментов обмена фруктозы. Дефект
фруктозо-1-фосфатальдолазы проявляется
после введения в рацион младенца соков
и фруктов, содержащих фруктозу.
Роль печени: 1. В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенез из АК и глицерина. 2. Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз (фруктозы, галактозы) в глюкозу. 3. Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот и холестерола из глюкозы.
15. Биосинтез и мобилизация гликогена: последовательность реакций, физио- логическое значение. Регуляция обмена гликогена. Гликогенозы и агликогенозы.
Г
 ликоген- разветвлённый
гомополимер глюкозы, в котором остатки
глюкозы соединены в линейных участках
α-1,4-гликозидной связью. В точках ветвления
мономеры соединены α-1,6-гликозидными
связями. Эти связи образуются примерно
с каждым десятым остатком глюкозы.
Гликоген синтезируется в период
пищеварения (через 1-2 ч после приёма
углеводной пищи). Следует отметить, что
синтез гликогена
из глюкозы, как и любой анаболический
процесс, является эндергоническим, т.е.
требующим затрат энергии. Глюкоза,
поступающая в клетку, фосфорилируется
при участии АТФ (реакция 1). Затем
глюкозо-6-фосфат в ходе обратимой реакции
превращается в глюкозо-1 -фосфат (реакция
2) под действием фермента фосфоглюкомутазы.
Глюкозо-1-фосфат по термодинамическому
состоянию мог бы служить субстратом
для синтеза гликогена. Но в силу
обратимости реакции глюкозо-6-фосфат ↔
глюкозо-1-фосфат синтез гликогена из
глюкозо-1-фосфата и его распад оказались
бы также обратимыми и поэтому
неконтролируемыми. Чтобы синтез гликогена
был термодинамически необратимым,
необходима дополнительная стадия
образования уридинди-фосфатглюкозы из
УТФ и глюкозо-1-фосфата (реакция 3).
Фермент, катализирующий эту реакцию,
назван по обратной реакции:
УДФ-глюкопирофосфорилаза. Однако в
клетке обратная реакция не протекает,
потому что образовавшийся в ходе прямой
реакции пирофосфат очень быстро
расщепляется пирофосфатазой на 2 молекулы
фосфата.Реакция
образования УДФ-глюкозы обусловливает
необратимость всей серии реакций,
протекающих при синтезе гликогена.
Образованная УДФ-глюкоза далее
используется как донор остатка глюкозы
при синтезе гликогена. Эту реакцию
катализирует фермент гликогенсинтаза
(глюкозилтрансфераза). Поскольку в
данной реакции не используется АТФ,
фермент называют синтазой, а не синтетазой.
Так как гликоген в клетке никогда не
расщепляется полностью, синтез гликогена
осуществляется путём удлинения уже
имеющейся молекулы полисахарида,
называемой "затравка", или "праймер".
К "затравке" последовательно
присоединяются молекулы глюкозы.
Строением молекулы "затравки" как
бы предопределяется тип связи, который
возникает в реакции трансгли-козилирования.
Таким образом, синтезируется полисахарид,
аналогичный по строению с "затравочным".
В состав "затравки" может входить
белок гликогенин, в котором к ОН-группе
одного из тирозиновых остатков
присоединена олигосахаридная цепочка
(примерно 8 остатков глюкозы). Глюкозные
остатки переносятся гликогенсинтазой
на нередуцирующий конец олигосахарида
и связываются α-1,4-гликозидными связями.
По окончании синтеза гликогенин остаётся
включённым в гранулу гликогена.
Разветвлённая структура гликогена
образуется при участии амило-1,4
→1,6-глюкозилтрансферазы, называемой
ферментом "ветвления". Как только
гликогенсинтаза удлиняет линейный
участок примерно до 11 глюкозных остатков,
фермент ветвления переносит её концевой
блок, содержащий 6-7 остатков, на внутренний
остаток глюкозы этой или другой цепи.
В точке ветвления концевой остаток
глюкозы олигосахарида соединяется с
гидроксильной группой в С6 положении с
образованием α-1,6-гликозидной связи.
Новая точка ветвления может быть
образована на расстоянии не менее 4
остатков от любой уже существующей.
Таким образом, по мере синтеза гликогена
многократно возрастает число ветвлений.
Концы цепей служат точками роста молекулы
при её синтезе и началом при её распаде.
Распад
гликогена или его мобилизация происходят
в ответ на повышение потребности
организма в глюкозе. Гликоген печени
распадается в основном в интервалах
между приёмами пищи, кроме того, этот
процесс в печени и мышцах ускоряется
во время физической работы. Распад
гликогена происходит путём последовательного
отщепления остатков глюкозы в виде
глюкозо-1-фосфата. Гликозидная связь
расщепляется с использованием
неорганического фосфата, поэтому процесс
называется фосфоролизом, а фермент
гликогенфосфорилазой. Гликогенфосфорилаза
расщепляет только α-1,4-гликозидные связи
(реакция 1). Последовательное отщепление
глюкозных остатков прекращается, когда
до точки ветвления остаётся 4 мономера.
Дальнейший распад гликогена требует
участия двух других ферментов. Сначала
три оставшихся до точки ветвлении
глюкозных остатка переносятся при
участии олигосахаридтрансферазы
(реакция 2) на
нередуцирующий конец соседней цепи,
удлиняя её и таким образом создавая
условия для действия фосфорилазы.
Оставшийся в точке ветвления глюкозный
остаток гидролитически отщепляется с
помощью
α-1,6-глюкозидазы
в виде свободной глюкозы (реакция 3),
после чего неразветвлённый участок
гликогена может вновь атаковаться
фосфорилазой. Перенос 3х остатков глюкозы
и удаление мономера из точки ветвления
(реакции 2 и 3) катализирует один и тот
же фермент, который обладает двумя
разными ферментативными активностями
- трансферазной и гликозидазной. Его
называют "деветвящим" ферментом.
ликоген- разветвлённый
гомополимер глюкозы, в котором остатки
глюкозы соединены в линейных участках
α-1,4-гликозидной связью. В точках ветвления
мономеры соединены α-1,6-гликозидными
связями. Эти связи образуются примерно
с каждым десятым остатком глюкозы.
Гликоген синтезируется в период
пищеварения (через 1-2 ч после приёма
углеводной пищи). Следует отметить, что
синтез гликогена
из глюкозы, как и любой анаболический
процесс, является эндергоническим, т.е.
требующим затрат энергии. Глюкоза,
поступающая в клетку, фосфорилируется
при участии АТФ (реакция 1). Затем
глюкозо-6-фосфат в ходе обратимой реакции
превращается в глюкозо-1 -фосфат (реакция
2) под действием фермента фосфоглюкомутазы.
Глюкозо-1-фосфат по термодинамическому
состоянию мог бы служить субстратом
для синтеза гликогена. Но в силу
обратимости реакции глюкозо-6-фосфат ↔
глюкозо-1-фосфат синтез гликогена из
глюкозо-1-фосфата и его распад оказались
бы также обратимыми и поэтому
неконтролируемыми. Чтобы синтез гликогена
был термодинамически необратимым,
необходима дополнительная стадия
образования уридинди-фосфатглюкозы из
УТФ и глюкозо-1-фосфата (реакция 3).
Фермент, катализирующий эту реакцию,
назван по обратной реакции:
УДФ-глюкопирофосфорилаза. Однако в
клетке обратная реакция не протекает,
потому что образовавшийся в ходе прямой
реакции пирофосфат очень быстро
расщепляется пирофосфатазой на 2 молекулы
фосфата.Реакция
образования УДФ-глюкозы обусловливает
необратимость всей серии реакций,
протекающих при синтезе гликогена.
Образованная УДФ-глюкоза далее
используется как донор остатка глюкозы
при синтезе гликогена. Эту реакцию
катализирует фермент гликогенсинтаза
(глюкозилтрансфераза). Поскольку в
данной реакции не используется АТФ,
фермент называют синтазой, а не синтетазой.
Так как гликоген в клетке никогда не
расщепляется полностью, синтез гликогена
осуществляется путём удлинения уже
имеющейся молекулы полисахарида,
называемой "затравка", или "праймер".
К "затравке" последовательно
присоединяются молекулы глюкозы.
Строением молекулы "затравки" как
бы предопределяется тип связи, который
возникает в реакции трансгли-козилирования.
Таким образом, синтезируется полисахарид,
аналогичный по строению с "затравочным".
В состав "затравки" может входить
белок гликогенин, в котором к ОН-группе
одного из тирозиновых остатков
присоединена олигосахаридная цепочка
(примерно 8 остатков глюкозы). Глюкозные
остатки переносятся гликогенсинтазой
на нередуцирующий конец олигосахарида
и связываются α-1,4-гликозидными связями.
По окончании синтеза гликогенин остаётся
включённым в гранулу гликогена.
Разветвлённая структура гликогена
образуется при участии амило-1,4
→1,6-глюкозилтрансферазы, называемой
ферментом "ветвления". Как только
гликогенсинтаза удлиняет линейный
участок примерно до 11 глюкозных остатков,
фермент ветвления переносит её концевой
блок, содержащий 6-7 остатков, на внутренний
остаток глюкозы этой или другой цепи.
В точке ветвления концевой остаток
глюкозы олигосахарида соединяется с
гидроксильной группой в С6 положении с
образованием α-1,6-гликозидной связи.
Новая точка ветвления может быть
образована на расстоянии не менее 4
остатков от любой уже существующей.
Таким образом, по мере синтеза гликогена
многократно возрастает число ветвлений.
Концы цепей служат точками роста молекулы
при её синтезе и началом при её распаде.
Распад
гликогена или его мобилизация происходят
в ответ на повышение потребности
организма в глюкозе. Гликоген печени
распадается в основном в интервалах
между приёмами пищи, кроме того, этот
процесс в печени и мышцах ускоряется
во время физической работы. Распад
гликогена происходит путём последовательного
отщепления остатков глюкозы в виде
глюкозо-1-фосфата. Гликозидная связь
расщепляется с использованием
неорганического фосфата, поэтому процесс
называется фосфоролизом, а фермент
гликогенфосфорилазой. Гликогенфосфорилаза
расщепляет только α-1,4-гликозидные связи
(реакция 1). Последовательное отщепление
глюкозных остатков прекращается, когда
до точки ветвления остаётся 4 мономера.
Дальнейший распад гликогена требует
участия двух других ферментов. Сначала
три оставшихся до точки ветвлении
глюкозных остатка переносятся при
участии олигосахаридтрансферазы
(реакция 2) на
нередуцирующий конец соседней цепи,
удлиняя её и таким образом создавая
условия для действия фосфорилазы.
Оставшийся в точке ветвления глюкозный
остаток гидролитически отщепляется с
помощью
α-1,6-глюкозидазы
в виде свободной глюкозы (реакция 3),
после чего неразветвлённый участок
гликогена может вновь атаковаться
фосфорилазой. Перенос 3х остатков глюкозы
и удаление мономера из точки ветвления
(реакции 2 и 3) катализирует один и тот
же фермент, который обладает двумя
разными ферментативными активностями
- трансферазной и гликозидазной. Его
называют "деветвящим" ферментом.
Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.
Биологическое значение: *синтез и распад гликогена протекают по разным метаболическими путям;
*печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;
*функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
*синтез гликогена - процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
*распад гликогена до глюкозо-6-фосфата не требует энергии;
*необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны.
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме. Присоединение фосфатов к ферменту производят протеинкиназы, источником фосфора является АТФ: -фосфорилаза гликогена активируется после присоединения фосфатной группы, -синтаза гликогена после присоединения фосфата инактивируется. Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Например, во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения. При голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Способы активации синтазы гликогена. Гликогенсинтаза при присоединении фосфата прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз выступает инсулин – в результате он повышает синтез гликогена. Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Способы активации фосфорилазы гликогена. Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: •ковалентная модификация, •кальций-зависимая активация и •аллостерическая активация с помощью АМФ.
Ковалентная модификация фосфорилазы
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает: 1. Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
2. Активный гормон-рецепторный комплекс воздействует на мембранный G-‑белок;
3. G-белок активирует фермент аденилатциклазу;
4. Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
5. цАМФ аллостерически активирует фермент протеинкиназу А;
6. Протеинкиназа А фосфорилирует различные внутриклеточные белки:
-одним из этих белков является синтаза гликогена, ее активность угнетается,
-другим белком – киназа фосфорилазы, которая при фосфорилировании активируется;
7. Киназа фосфорилазы фосфорилирует фосфорилазу "b" гликогена, последняя в результате превращается в активную фосфорилазу "а";
8. Активная фосфорилаза "а" гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ и, следовательно, снижает активность гликоген-фосфорилазы.
Кальций-зависимая активация. Некоторые гормоны влияют на углеводный обмен посредством кальций-фосфолипидного механизма. Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca2+ и кальмодулином. Этот путь работает при инициации кальций-фосфолипидного механизма. Такой способ оправдывает себя, например, при мышечной нагрузке, если гормональные влияния через аденилатциклазу недостаточны, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca2+.
Аллостерическая активация. Также существует активация фосфорилазы гликогена с помощью АМФ – аллостерическая активация благодаря присоединению АМФ к молекуле фосфорилазы "b". Способ работает в любой клетке – при увеличении расхода АТФ и накоплении продуктов его распада.
Гликогеновые болезни – это наследственные заболевания, обусловленные недостаточностью каких-либо ферментов, отвечающих за метаболизм гликогена. Могут быть нарушены обе стороны обмена: как синтез гликогена, так и его распад. В настоящее время гликогенозы делят по патогенетическому признаку на печеночные, мышечные и смешанные формы. Печеночные гликогенозы. Самый частый гликогеноз I типа или болезнь фон Гирке обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликогена не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия. Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз – это аутосомно-рецессивный дефект амило-α1,6-глюкозидазы, "деветвящего" фермента, гидролизующего α1,6-гликозидную связь. Болезнь имеет более доброкачественное течение, и частота ее составляет примерно 25% от всех гликогенозов. Для больных характерна гепатомегалия, умеренная задержка физического развития, в подростковом возрасте возможна небольшая миопатия. Гликогеноз IV типа (болезнь Андерсена), связанный с дефектом ветвящего фермента и гликогеноз VI типа (болезнь Херса), связанный с дефицитом печеночной фосфорилазы гликогена встречаются довольно редко. Мышечные гликогенозы. Для этой группы гликогенозов характерны изменения ферментов мышечной ткани. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, к болям в мышцах, судорогам. Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем. Смешанные гликогенозы. Эти заболевания касаются и печени, и мышц, и других органов. Гликогеноз II типа (болезнь Помпе) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и тяжелой сердечной недостаточности.
Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результате гипогликемии наблюдается задержка психомоторного развития, умственная отсталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
1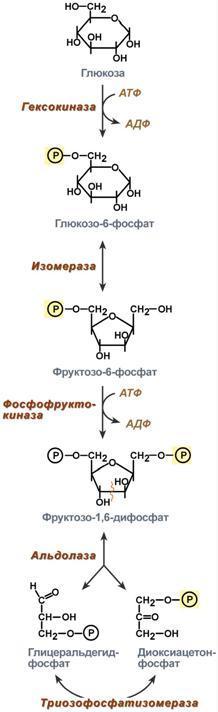 6.
Анаэробный распад глюкозы: последовательность
реакций, физиологиче¬ское значение.
Роль анаэробного распада глюкозы в
мышцах. Дальнейшая судьба молочной
кислоты.
6.
Анаэробный распад глюкозы: последовательность
реакций, физиологиче¬ское значение.
Роль анаэробного распада глюкозы в
мышцах. Дальнейшая судьба молочной
кислоты.
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват. Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Бескислородное окисление глюкозы усиливается при гипоксии клеток при анемиях, нарушении кровообращения в тканях. Гликолиз. Анаэробное превращение глюкозы локализуется в цитозоле и включает два этапа из 11 ферментативных реакций.
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза, при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (от электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Д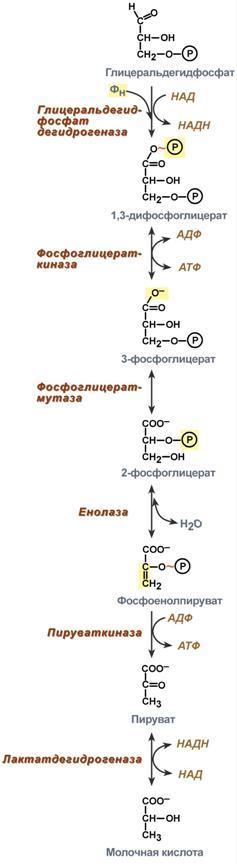 есятая
реакция
гликолиза – еще одна реакция субстратного
фосфорилирования – заключается в
переносе пируваткиназой макроэргического
фосфата с фосфоенолпирувата на АДФ и
образовании пировиноградной кислоты.
есятая
реакция
гликолиза – еще одна реакция субстратного
фосфорилирования – заключается в
переносе пируваткиназой макроэргического
фосфата с фосфоенолпирувата на АДФ и
образовании пировиноградной кислоты.
Р![]() еакция
одиннадцатая
– образование молочной кислоты из
пирувата под действием лактатдегидрогеназы.
Важно то, что эта реакция осуществляется
только в анаэробных условиях. Эта реакция
необходима клетке, так как НАДН,
образующийся в 6-й реакции, в отсутствие
кислорода не может окисляться в
митохондриях.
еакция
одиннадцатая
– образование молочной кислоты из
пирувата под действием лактатдегидрогеназы.
Важно то, что эта реакция осуществляется
только в анаэробных условиях. Эта реакция
необходима клетке, так как НАДН,
образующийся в 6-й реакции, в отсутствие
кислорода не может окисляться в
митохондриях.
При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА.
Для стабильного протекания гликолиза в бескислородных условиях необходимы ряд простых условий:-поступление глюкозы, -наличие минимальных количеств АТФ для активации процесса на первом этапе и АДФ как акцептора для фосфатов на втором этапе, -пополнение запасов окисленного НАД для шестой реакции. Если первые два условия подразумеваются сами собой, то для решения третьего условия существует специальное решение: в анаэробных условиях образуемый в шестой, глицеральдегидфосфат-дегидрогеназной реакции, НАДН используется в одиннадцатой реакции для восстановления пирувата до лактата. Образуемый таким образом НАД опять возвращается в шестую реакцию. Следовательно, клетке не нужны дополнительные источники НАД и дополнительные способы уборки НАДН! Процесс поддерживается самостоятельно. Процесс циклического восстановления и окисления НАД в реакциях анаэробного окисления глюкозы получил название гликолитическая оксидоредукция. В аэробных условиях гликолитической оксидоредукции не происходит, НАДН отдает свои атомы водорода на челночные системы для их передачи в дыхательную цепь митохондрий.
Для расчета количества АТФ, образованной при окислении глюкозы необходимо учитывать:
1. Реакции, идущие с затратой или образованием АТФ и ГТФ,
2. Реакции, продуцирующие НАДН и ФАДН2 и использующие их,
3. Так как глюкоза образует две триозы, то все соединения, образующиеся ниже ГАФ-дегидрогеназной реакции, образуются в двойном (относительно глюкозы) количестве.
Расчет АТФ при анаэробном окислении. На подготовительном этапе на активацию глюкозы затрачивается 2 молекулы АТФ, фосфат каждой из которых оказывается на триозе – глицеральдегидфосфате и диоксиацетонфосфате. В следующий второй этап входят две молекулы глицеральдегидфосфата, каждая из которых окисляется до пирувата с образованием 2-х молекул АТФ в седьмой и десятой реакциях – реакциях субстратного фосфорилирования. Таким образом, суммируя, получаем, что на пути от глюкозы до пирувата в чистом виде образуется 2 молекулы АТФ. Однако надо иметь в виду и пятую, глицеральдегидфосфат-дегидрогеназную, реакцию, из которой выходит НАДН. Если условия анаэробные, то он используется в лактатдегидрогеназной реакции, где окисляется для образования лактата и в получении АТФ не участвует.
В анаэробных условиях большое количество пировиноградной кислоты превращается в молочную кислоту, которая легко диффундирует во внеклеточное пространство и даже внутрь некоторых менее активных клеток. Следовательно, молочная кислота представляет собой разновидность «водосточного колодца», в котором исчезают конечные продукты гликолиза, что позволяет гликолизу осуществляться дольше, чем это могло быть при отсутствии молочной кислоты.Большое количество молочной кислоты, которое образуется во время анаэробного гликолиза, не теряется организмом, т.к. если кислород вновь становится доступным, молочная кислота может подвергнуться обратному превращению в глюкозу или напрямую использоваться для получения энергии. Большая часть этих превращений осуществляется в печени, но в небольших количествах может происходить и в других тканях. Если кислород вновь становится доступным после периода анаэробного метаболизма, молочная кислота быстро превращается в пировиноградную кислоту, НАД-Н и Н+. Большие количества этих веществ немедленно окисляются, образуя значительное количество АТФ. Избыток АТФ может явиться причиной того, что более 75% пировиноградной кислоты вновь превращается в глюкозу. Сердечная мышца обладает способностью превращать молочную кислоту в пировиноградную и затем использовать последнюю для получения энергии. В большинстве случаев это происходит при больших физических нагрузках, когда в кровь поступают значительное количество молочной кислоты из скелетных мышц и суммарно дает существенное количество энергии сердечной мышце.
Эффект Пастера. Это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода. Биохимический механизм эффекта заключается в конкуренции за пируват между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и лактатдегидрогеназой, превращающей пируват в лактат.
У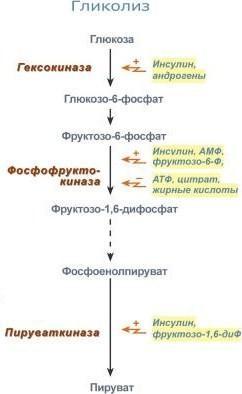 пируватдегидрогеназы сродство гораздо
выше и в обычных аэробных условиях она
окисляет большую часть пировиноградной
кислоты. Как только поступление кислорода
уменьшается (недостаток кровообращения,
тромбоз и т.п.) происходит следующее:
пируватдегидрогеназы сродство гораздо
выше и в обычных аэробных условиях она
окисляет большую часть пировиноградной
кислоты. Как только поступление кислорода
уменьшается (недостаток кровообращения,
тромбоз и т.п.) происходит следующее:
-внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется,
-моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот,
-ацетил-S-КоА не входит в ЦТК и ингибирует ПВК-дегидрогеназу.
В этой ситуации пировиноградной кислоте не остается ничего иного как превращаться в молочную.
При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
Регуляция гликолиза
Гликолиз стимулируется инсулином, повышающим количество молекул гексокиназы, фосфофруктокиназы, пируваткиназы.
В печени активность глюкокиназы регулируется гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
Для метаболической регуляции чувствительной является фосфофруктокиназа. Она активируется АМФ и собственным субстратом, ингибируется – АТФ, лимонной кислотой, жирными кислотами. Пируваткиназа активируется фруктозо-1,6-дифосфатом. Гексокиназа непеченочных клеток ингибируется продуктом собственной реакции – глюкозо-6-фосфатом.
17. Аэробный распад глюкозы: последовательность реакций, физиологическое значение. Роль аэробного распада глюкозы в мышцах при мышечной работе. Роль аэробного распада глюкозы в мозге.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки. В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Реакции аэробного гликолиза:
1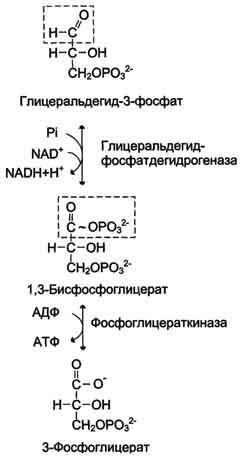
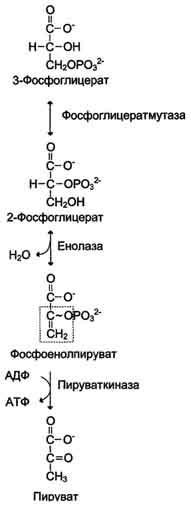 )
Превращение глюкозо-6-фосфата в 2 молекулы
глицеральдегид-3-фосфата.
Глюкозо-6-фосфат, образованный в результате
фосфорилирования глюкозы с участием
АТФ, в ходе следующей реакции превращается
в фруктозо-6-фосфат. Эта обратимая реакция
изомеризации протекает под действием
фермента глюкозофосфатизомеразы. Затем
следует ещё одна реакция фосфорилирования
с использованием фосфатного остатка и
энергии АТФ. В ходе этой реакции,
катализируемой фосфофруктокиназой,
фруктозо-6-фосфат превращается в
фруктозо-1,6-бисфосфат. Данная реакция,
так же, как гексокиназная, практически
необратима, и, кроме того, она наиболее
медленная из всех реакций гликолиза.
Реакция, катализируемая фосфофруктокиназой,
определяет скорость всего гликолиза,
поэтому, регулируя активность
фосфофруктокиназы, можно изменять
скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется
на 2 триозофосфата: глицеральдегид-3-фосфат
и дигидроксиацетонфосфат. Реакцию
катализирует фермент фруктозобисфосфатальдолаза,
или просто альдолаза. Этот фермент
катализирует как реакцию альдольного
расщепления, так и альдольной конденсации,
т.е. обратимую реакцию. Продукты реакции
альдольного расщепления - изомеры. В
последующих реакциях гликолиза
используется только глицеральдегид-3-фосфат,
поэтому дигидроксиацетонфосфат
превращается с участием фермента
триозофосфатизомеразы в
глицероальдегид-3-фосфат.
)
Превращение глюкозо-6-фосфата в 2 молекулы
глицеральдегид-3-фосфата.
Глюкозо-6-фосфат, образованный в результате
фосфорилирования глюкозы с участием
АТФ, в ходе следующей реакции превращается
в фруктозо-6-фосфат. Эта обратимая реакция
изомеризации протекает под действием
фермента глюкозофосфатизомеразы. Затем
следует ещё одна реакция фосфорилирования
с использованием фосфатного остатка и
энергии АТФ. В ходе этой реакции,
катализируемой фосфофруктокиназой,
фруктозо-6-фосфат превращается в
фруктозо-1,6-бисфосфат. Данная реакция,
так же, как гексокиназная, практически
необратима, и, кроме того, она наиболее
медленная из всех реакций гликолиза.
Реакция, катализируемая фосфофруктокиназой,
определяет скорость всего гликолиза,
поэтому, регулируя активность
фосфофруктокиназы, можно изменять
скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется
на 2 триозофосфата: глицеральдегид-3-фосфат
и дигидроксиацетонфосфат. Реакцию
катализирует фермент фруктозобисфосфатальдолаза,
или просто альдолаза. Этот фермент
катализирует как реакцию альдольного
расщепления, так и альдольной конденсации,
т.е. обратимую реакцию. Продукты реакции
альдольного расщепления - изомеры. В
последующих реакциях гликолиза
используется только глицеральдегид-3-фосфат,
поэтому дигидроксиацетонфосфат
превращается с участием фермента
триозофосфатизомеразы в
глицероальдегид-3-фосфат.
2) Превращение глицеральдегид-3-фосфата в пируват. Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение - первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная Е окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой. Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. В результате реакции образуется замещённый енол - фосфоенолпируват. Образованный фосфоенолпируват - макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы. Превращение фосфоенолпирувата в пируват - необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетоформу.
NADH, образующийся при окислении глицеральдегид-3-фосфата в аэробном гликолизе, подвергается окислению путём переноса атомов водорода в митохондриальную дыхательную цепь. Так как сама молекула НАДН через мембрану не проходит, то существуют специальные системы, принимающие атомы водорода от НАДН в цитоплазме и отдающие их в матриксе митохондрий. Эти системы получили название челночные системы. Определены две основные челночные системы – глицеролфосфатная и малат-аспартатная. Ключевыми ферментами глицеролфосфатного челнока являются изоферменты глицерол-3-фосфат-дегидрогеназы – цитоплазматический и митохондриальный. Они отличаются своими коферментами: у цитоплазматической формы – НАД, у митохондриальной – ФАД. В цитозоле метаболиты гликолиза – диоксиацетонфосфат и НАДН образуют глицерол-3-фосфат, поступающий в матрикс митохондрий. Там он окисляется с образованием ФАДН2. Далее ФАДН2 направляется в дыхательную цепь и используется для получения энергии. Таким образом, в результате действий челнока цитозольный НАДН+H+ как бы "превращается" в митохондриальный ФАДН2. Этот челнок активен в печени и белых скелетных мышцах и необходим для получения энергии из глюкозы при работе клетки. Ключевыми ферментами малат-аспартатного челнока являются изоферменты малатдегидрогеназы – цитоплазматический и митохондриальный. Он является распространенным по всем тканям. Этот механизм более сложен: постоянно идущие в цитоплазме реакции трансаминирования аспарагиновой кислоты поставляют оксалоацетат, который под действием цитозольного пула малатдегидрогеназы и за счет "гликолитического" НАДН восстанавливается до яблочной кислоты (малата). Последняя антипортом с α-кетоглутаратом проникает в митохондрии и, являясь метаболитом ЦТК, окисляется в оксалоацетат с образованием НАДН. Так как мембрана митохондрий непроницаема для оксалоацетата, то он аминируется до аспарагиновой кислоты, которая в обмен на глутамат выходит в цитозоль. Таким образом, атомы водорода от цитозольного НАДН перемещаются в состав митохондриального НАДН.
Выход АТФ. Если в клетке имеется кислород, то НАДН из гликолиза направляется в митохондрию (челночные системы), на процессы окислительного фосфорилирования, и там его окисление приносит дивиденды в виде трех молекул АТФ. Обр-ся в гликолизе пируват в аэробных условиях превращается в ПВК-‑дегидрогеназном комплексе в ацетил-S-КоА, при этом образуется 1 молекула НАДН. Ацетил-S-КоА вовлекается в ЦТК и, окисляясь, дает 3 молекулы НАДН, 1 молекулу ФАДН2, 1 молекулу ГТФ. Молекулы НАДН и ФАДН2 движутся в дыхательную цепь (посмотреть), где при их окислении в сумме образуется 11 молекул АТФ. В целом при сгорании одной ацетогруппы в ЦТК образуется 12 молекул АТФ. Суммируя результаты окисления "гликолитического" и "пируватдегидрогеназного" НАДН, "гликолитический" АТФ, энергетический выход ЦТК и умножая все на 2, получаем 38 молекул АТФ. Суммарное уравнение: С6Н12О6 + 6О2 → 6СО2 + Н2О + 2880 кДж/моль.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Аэробный гликолиз способствует метаболизму клеток опухолей. При высоких нагрузках резко возрастает скорость анаэробного гликогенолиза, конечным продуктом которого является молочная кислота. Энергетически этот процесс примерно в 15 раз менее эффективен, чем аэробный окислительный распад гликогена до Н2О и СО2. Такой путь энергообеспечения мышц играет основную роль при кратковременной работе большей мощности, например при финишных рывках.
18. Биосинтез глюкозы (глюконеогенез): возможные предшественники, последовательность реакций. Глюкозо-лактатный цикл (цикл Кори) и глюкозо-аланиновый цикл: физиологическое значение. Значение и регуляция глюко-неогенеза из аминокислот.
В клетках организма всегда существует потребность в глюкозе:
1. для эритроцитов глюкоза является единственным источником энергии,
2.нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников,
3. глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза. По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот. Необходимость глюконеогенеза в организме демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори) – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата. Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-‑5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-‑1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой. Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Г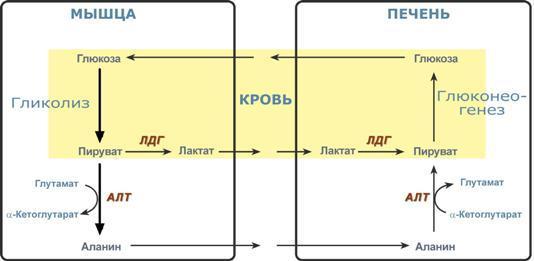 люкозо-аланиновый
цикл.Целью
глюкозо-аланинового цикла также является
уборка пирувата, но, кроме этого решается
еще одна немаловажная задача – уборка
лишнего азота из мышцы.
Аминокислоты,
которые при катаболизме превращаются
в пируват или метаболиты цитратного
цикла, могут рассматриваться как
потенциальные предшественники глюкозы
и гликогена и носят название гликогенных.
Например, оксалоацетат, образующийся
из аспарагиновой кислоты, является
промежуточным продуктом как цитратногр
цикла, так и глюконеогенеза. Из всех
аминокислот, поступающих в печень,
примерно 30% приходится на долю аланина.
Это объясняется тем, что при расщеплении
мышечных белков образуются аминокислоты,
многие из которых превращаются сразу
в пируват или сначала в оксалоацетат,
а затем в пируват. Последний превращается
в аланин, приобретая аминогруппу от
других аминокислот. Аланин из мышц
переносится кровью в печень, где снова
преобразуется в пируват, который частично
окисляется и частично включается в
глюкозонеогенез. При мышечной работе
и в покое в миоците распадаются белки
и образуемые аминокислоты трансаминируются
с α-кетоглутаратом. Полученный глутамат
взаимодействует с пируватом. Образующийся
аланин является транспортной формой
азота и пирувата из мышцы в печень. В
гепатоците идет обратная реакция
трансаминирования, аминогруппа передается
на синтез мочевины, пируват используется
для синтеза глюкозы.
Кроме
мышечной работы, глюкозо-аланиновый
цикл активируется во время голодания,
когда мышечные белки распадаются и
многие аминокислоты используются в
качестве источника энергии, а их азот
необходимо доставить в печень.
люкозо-аланиновый
цикл.Целью
глюкозо-аланинового цикла также является
уборка пирувата, но, кроме этого решается
еще одна немаловажная задача – уборка
лишнего азота из мышцы.
Аминокислоты,
которые при катаболизме превращаются
в пируват или метаболиты цитратного
цикла, могут рассматриваться как
потенциальные предшественники глюкозы
и гликогена и носят название гликогенных.
Например, оксалоацетат, образующийся
из аспарагиновой кислоты, является
промежуточным продуктом как цитратногр
цикла, так и глюконеогенеза. Из всех
аминокислот, поступающих в печень,
примерно 30% приходится на долю аланина.
Это объясняется тем, что при расщеплении
мышечных белков образуются аминокислоты,
многие из которых превращаются сразу
в пируват или сначала в оксалоацетат,
а затем в пируват. Последний превращается
в аланин, приобретая аминогруппу от
других аминокислот. Аланин из мышц
переносится кровью в печень, где снова
преобразуется в пируват, который частично
окисляется и частично включается в
глюкозонеогенез. При мышечной работе
и в покое в миоците распадаются белки
и образуемые аминокислоты трансаминируются
с α-кетоглутаратом. Полученный глутамат
взаимодействует с пируватом. Образующийся
аланин является транспортной формой
азота и пирувата из мышцы в печень. В
гепатоците идет обратная реакция
трансаминирования, аминогруппа передается
на синтез мочевины, пируват используется
для синтеза глюкозы.
Кроме
мышечной работы, глюкозо-аланиновый
цикл активируется во время голодания,
когда мышечные белки распадаются и
многие аминокислоты используются в
качестве источника энергии, а их азот
необходимо доставить в печень.
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из АК. Все АК, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них – глюкогенных – полностью включаются в молекулу глюкозы, некоторых – смешанных – частично. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку "шлаков" – лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани. Как известно, в гликолизе существуют три необратимые реакции: пируваткиназная (десятая), фосфофруктокиназная (третья) и гексокиназная (первая). В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры, которые клетка обходит с помощью дополнительных реакций. Глюконеогенез включает все обратимые реакции гликолиза, и особые обходные пути, т.е. он не полностью повторяет реакции окисления глюкозы. Его реакции способны идти во всех тканях, кроме последней глюкозо-6-фосфатазной реакции, которая идет только в печени и почках. Поэтому, строго говоря, глюконеогенез идет только в этих двух органах.
О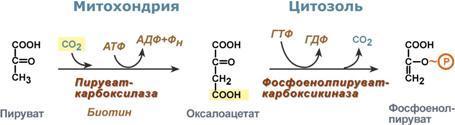 бход
десятой реакции гликолиза.На
этом этапе глюконеогенеза работают два
ключевых фермента – в митохондриях
пируваткарбоксилаза и в цитозоле
фосфоенолпируват-карбоксикиназа.
В
химическом плане обходной путь десятой
реакции выглядит достаточно просто:
бход
десятой реакции гликолиза.На
этом этапе глюконеогенеза работают два
ключевых фермента – в митохондриях
пируваткарбоксилаза и в цитозоле
фосфоенолпируват-карбоксикиназа.
В
химическом плане обходной путь десятой
реакции выглядит достаточно просто:
О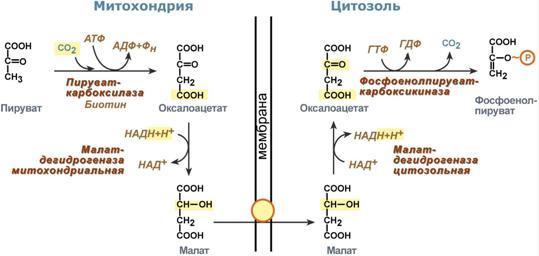 днако
дело в том, что пируваткарбоксилаза
находится в митохондрии, а
фосфоенолпируват-карбоксикиназа – в
цитозоле. Дополняет проблему непроницаемость
митохондриальной мембраны для
оксалоацетата. Зато через мембрану
может пройти малат, предшественник
оксалоацетата по ЦТК. Поэтому в реальности
все выглядит более сложно: 1. В цитозоле
пировиноградная кислота может появиться
при окислении молочной кислоты и в
реакции трансаминирования аланина.
После этого пируват симпортом с ионами
Н+, движущимися по протонному градиенту,
проникает в митохондрии. В митохондриях
пируваткарбоксилаза превращает
пировиноградную кислоту в оксалоацетат.
Эта реакция идет в клетке постоянно,
являясь анаплеротической (пополняюшей)
реакцией ЦТК.
днако
дело в том, что пируваткарбоксилаза
находится в митохондрии, а
фосфоенолпируват-карбоксикиназа – в
цитозоле. Дополняет проблему непроницаемость
митохондриальной мембраны для
оксалоацетата. Зато через мембрану
может пройти малат, предшественник
оксалоацетата по ЦТК. Поэтому в реальности
все выглядит более сложно: 1. В цитозоле
пировиноградная кислота может появиться
при окислении молочной кислоты и в
реакции трансаминирования аланина.
После этого пируват симпортом с ионами
Н+, движущимися по протонному градиенту,
проникает в митохондрии. В митохондриях
пируваткарбоксилаза превращает
пировиноградную кислоту в оксалоацетат.
Эта реакция идет в клетке постоянно,
являясь анаплеротической (пополняюшей)
реакцией ЦТК.
2. Далее оксалоацетат мог бы превратиться в фосфоенолпируват, но для этого сначала он должен попасть в цитозоль. Поэтому происходит реакция восстановления оксалоацетата в малат при участии малатдегидрогеназы.В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из ?-‑окисления жирных кислот, активируемого в условиях недостаточности глюкозы в гепатоците.
3. В цитоплазме фосфоенолпируват-карбоксикиназа осуществляет превращение оксалоацетата в фосфоенолпируват, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.
О![]() бход
третьей реакции гликолиза.Второе
препятствие на пути синтеза глюкозы –
фосфофруктокиназная реакция –
преодолевается с помощью фермента
фруктозо-1,6-дифосфатазы. Этот фермент
есть в почках, печени, поперечно-полосатых
мышцах. Таким образом, эти ткани способны
синтезировать фруктозо-6-фосфат и
глюкозо-6-фосфат.
бход
третьей реакции гликолиза.Второе
препятствие на пути синтеза глюкозы –
фосфофруктокиназная реакция –
преодолевается с помощью фермента
фруктозо-1,6-дифосфатазы. Этот фермент
есть в почках, печени, поперечно-полосатых
мышцах. Таким образом, эти ткани способны
синтезировать фруктозо-6-фосфат и
глюкозо-6-фосфат.
О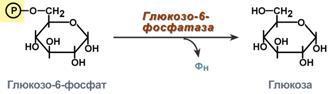 бход
первой реакции гликолиза.Последняя
реакция катализируется глюкозо-6-фосфатазой.
Она имеется только в печени и почках,
следовательно, только эти ткани могут
продуцировать свободную глюкозу.
бход
первой реакции гликолиза.Последняя
реакция катализируется глюкозо-6-фосфатазой.
Она имеется только в печени и почках,
следовательно, только эти ткани могут
продуцировать свободную глюкозу.
Глюконеогенез, как образование глюкозы из неуглеводных компонентов, необходим: 1. при гипогликемии во время мышечной нагрузки – синтез из молочной кислоты, поступающей из мышц, из глицерола, образующегося при мобилизации жиров;
2. при гипогликемии при голодании – синтез из аминокислот, образующихся при катаболизме белков.
Т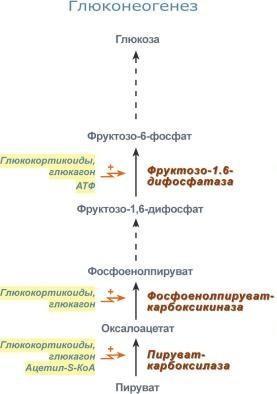 аким
образом, при голодании или физической
нагрузке глюконеогенез, идущий в печени,
обеспечивает глюкозой все остальные
органы (эритроциты, нервная ткань, мышцы
и др.), в которых активен гликолиз и
другие процессы, производящие энергию.
Наличие глюкозы в указанных клетках
необходимо, чтобы поддержать концентрацию
оксалоацетата и обеспечить сгорание
ацетил-SКоА (получаемого также из жирных
кислот или кетоновых тел) в цикле
трикарбоновых кислот.
аким
образом, при голодании или физической
нагрузке глюконеогенез, идущий в печени,
обеспечивает глюкозой все остальные
органы (эритроциты, нервная ткань, мышцы
и др.), в которых активен гликолиз и
другие процессы, производящие энергию.
Наличие глюкозы в указанных клетках
необходимо, чтобы поддержать концентрацию
оксалоацетата и обеспечить сгорание
ацетил-SКоА (получаемого также из жирных
кислот или кетоновых тел) в цикле
трикарбоновых кислот.
Регуляция глюконеогенеза. Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования. Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаз а при участии АТФ. Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью:
- аллостерической регуляции активности ферментов;
-ковалентной модификации ферментов путём фосфорилирования/дефосфорилирования;
-индукции/репрессии синтеза ключевых ферментов.
Регуляторные воздействия направлены на ферменты, катализирующие необратимые стадии глюконеогенеза, сочетание которых называют "субстратными", или "холостыми" циклами.
Суммарное уравнение глюконеогенеза из пирувата:
2 пируват + 4 ATФ + 2 GTP + 2(NADH) + 4 Н2О Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4.
За сутки в организме человека может синтезироваться до 80 г глюкозы. На синтез 1 моль глюкозы из пирувата расходуется 6 макроэргических связей (4 ATФ и 2 GTP).
19. Пентозофосфатный путь превращения глюкозы. Окислительный путь образования пентоз. Представление о неокислительном пути образования гексоз. Распространение, роль, регуляция.
Глюкоза – это субстрат для получения энергии. Энергетика любой клетки нашего организма основана на окислении глюкозы. Окисление глюкозы происходит по двум направлениям:
1.Окисление с образованием пентоз: рибозы, рибулозы, ксилулозы. Этот путь называется пентозофосфатный шунт и не связан с получением Е.
2. Окисление с получением Е.
Так как в кл непрерывно просходят реакции синтеза белков, то для этого процесса требуются рибонуклеиновые кислоты. В свою очередь для синтеза самих нуклеиновых кислот, а точнее пуриновых и пиримидиновых нуклеотидов, требуется рибозо-5-фосфат. Если клетка готовится к делению, то для синтеза ДНК ей нужны дезоксирибонуклеотиды, которые образуются при участии НАДФН. Молекулы НАДФН также используются:
-для синтеза жирных к-т (печень, жировая ткань),
-для синтеза холестерола и др стероидов (печень),
-для синтеза глутаминовой к-ты из α-кетоглутаровой к-ты (реакция восстановительного аминирования),
-для систем антиоксидантной защиты клетки от свободно-радикального окисления (эритроциты).
В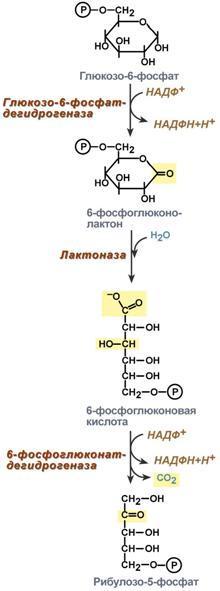 клетке существует процесс, обеспечивающий
одновременное образование рибозы и
НАДФН – этопентозофосфатный
путь.
Наиболее активно реакции пентозофосфатного
пути идут в цитозоле клеток печени,
жировой ткани, эритроцитах, коре
надпочечников, молочной железе при
лактации, в гораздо меньшей степени в
скелетных мышцах. Этот путь окисления
глюкозы не связан с образованием энергии,
а обеспечивает анаболизм клеток. В связи
с этим у новорожденных и детей первых
лет жизни его активность довольно
высока. Пентозофосфатный путь включает
два этапа – окислительный и структурных
перестроек (неокислительный).
клетке существует процесс, обеспечивающий
одновременное образование рибозы и
НАДФН – этопентозофосфатный
путь.
Наиболее активно реакции пентозофосфатного
пути идут в цитозоле клеток печени,
жировой ткани, эритроцитах, коре
надпочечников, молочной железе при
лактации, в гораздо меньшей степени в
скелетных мышцах. Этот путь окисления
глюкозы не связан с образованием энергии,
а обеспечивает анаболизм клеток. В связи
с этим у новорожденных и детей первых
лет жизни его активность довольно
высока. Пентозофосфатный путь включает
два этапа – окислительный и структурных
перестроек (неокислительный).
На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превращается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН.
Н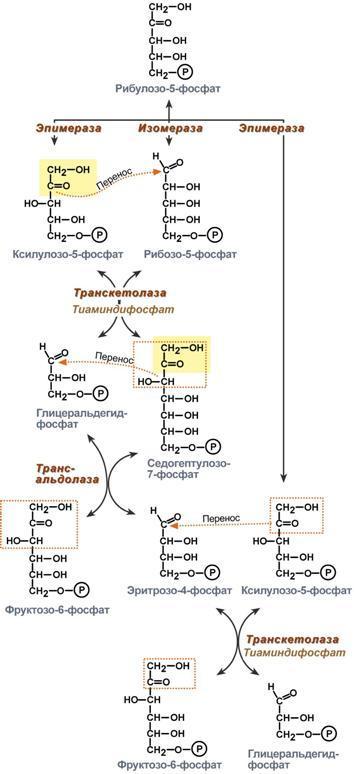 а
этом этапе происходит регуляция процесса:
инсулин повышает активность
глюкозо-6-фосфат-дегидрогеназы и
фосфоглюконат-дегидрогеназы.
а
этом этапе происходит регуляция процесса:
инсулин повышает активность
глюкозо-6-фосфат-дегидрогеназы и
фосфоглюконат-дегидрогеназы.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования. Суммарное уравнение: Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного пути протекают только в том случае, если восстановленный ко-фермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ. Если потребности клетки в NADPH незначительны, рибо-зо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных в-в метаболиты гликолиза - глицеральдегид-3-фосфат и фруктозо-6-фосфат.
Роль: Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм О2.
Второй этап – этап структурных перестроек, благодаря которым пентозы способны возвращаться в фонд гексоз. В этих реакциях рибулозо-5-фосфат изомеризуется до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием ферментов транскетолазы и трансальдолазы происходят структурные перестройки с образованием других моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегидфосфат. Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направляться в синтез фосфатидной кислоты и далее триацилглицеролов. При необходимости из него могут образоваться и гексозы.
Сумма: 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат → 2 Ксилулозо-5-фосфат + Рибозо-5-фосфат 2 Ксилулозо-5-фосфат → 2 Рибулозо-5-фосфат 2 Рибулозо-5-фосфат → 2 Рибозо-5-фосфат.
Т.о. неокислительный путь можно представить как процесс возвращения пентоз в фонд гексоз.
Особенности пентозофосфатного пути в разных клетках.
Если клетка нуждается в больших количествах НАДФН (например, синтез жирных кислот в печени или синтез холестерола), то активно будут идти как 1-й, так и 2-й этапы. Образованные фруктозо-6-фосфат и глицеральдегидфосфат в реакциях глюконеогенеза превратятся в глюкозо-6-фосфат, и цикл начнется вновь.
Если клетке нужны НАДФН и энергия АТФ (как в эритроците), то фруктозо-6-фосфат и глицеральдегидфосфат на выходе из 2-го этапа "провалятся" в гликолитические реакции.
Если клетка растет и делится, то ей необходимы НАДФН и рибозо-5-фосфат. В этом случае 2-й этап идти не будет, весь образуемый на 1-м этапе рибулозо-5-фосфат превратится в рибозо-5-фосфат, который используется для синтеза нуклеотидов. НАДФН будет расходоваться на синтез дезоксирибонуклеотидов.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
Из нарушений пентозофосфатного шунта наиболее часто встречается недостаточность первого фермента – глюкозо-6-фосфат-дегидрогеназы. Следствием ферментного дефекта является снижение синтеза НАДФН в клетке. Особенно существенно это влияет на эритроциты, в которых окислительный этап пентозофосфатного цикла является единственным источником НАДФН. з разнообразных функций НАДФН в данном случае имеет значение одна – участие в работе антиоксидантной системы.
Д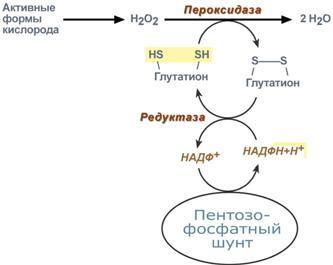 анная
система необходима для нейтрализации
активных форм кислорода, постоянно
образующихся в клетке. В частности,
перекись водорода восстанавливается
до воды с помощью глутатион-зависимой
пероксидазы. Восстановление глутатиона
в работоспособное состояние производит
редуктаза при участии НАДФН, поставляемого
пентозофосфатным шунтом.
анная
система необходима для нейтрализации
активных форм кислорода, постоянно
образующихся в клетке. В частности,
перекись водорода восстанавливается
до воды с помощью глутатион-зависимой
пероксидазы. Восстановление глутатиона
в работоспособное состояние производит
редуктаза при участии НАДФН, поставляемого
пентозофосфатным шунтом.
20. Глюкоза крови: источники, регуляция гормонами. Гипо- и гипергликемия, причины. Сахарные нагрузки и сахарные кривые, значение в диагностике.
Результат регуляции метаболических путей превращения глюкозы - постоянство концентрации глюкозы в крови. У здорового человека на тощак концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл (алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). При конц-ии глюкозы в крови 9-10 ммоль/л глюкоза начинает выводиться с мочой – глюкозурия. В норме глюкоза в моче не определяется. Более половины всей глюкозы (60%), поступающей из кишечника в воротную вену, поглощается печенью. Около 2/3 этого количества откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в форме гликогена, а в жировых клетках превращается в жиры. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При голодании в течение первых суток исчерпываются запасы гликогена в организме, и в дальнейшем источником глюкозы служит только глюконеогенез (из лактата, глицерина и АК). Глюконеогенез при этом ускоряется, а гликолиз замедляется вследствие низкой концентрации инсулина и высокой концентрации глюкагона. Но, кроме того, через 1-2 сут существенно проявляется действие и другого механизма регуляции - индукции и репрессии синтеза некоторых ферментов: снижается кол-во гликолитических ферментов и, наоборот, повышается количество ферментов глюконеогенеза. Изменение синтеза ферментов также связано с влиянием инсулина и глюкагона. Начиная со второго дня голодания достигается максимальная скорость глюконеогенеза из аминокислот и глицерина. Скорость глюконеогенеза из лактата остаётся постоянной. В результате синтезируется около 100 г глюкозы ежесуточно, главным образом в печени. Следует отметить, что при голодании глюкоза не используется мышечными и жировыми клетками, поскольку в отсутствие инсулина не проникает в них и таким образом сберегается для снабжения мозга и других глюкозозависимых клеток. Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасённый в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приёма углеводной пищи могут составлять 200-300 г.
Регуляция: Нервная регуляция концентрации глюкозы в крови выражается в положительном влиянии n.vagus на секрецию инсулина и тормозящем влиянии на этот процесс симпатической иннервации. Кроме этого, выделение адреналина в кровь подвержено симпатическим влияниям.
Основными факторами гормональной регуляции являются глюкагон, адреналин, глюкокортикоиды, соматотропный гормон с одной стороны, и инсулин с другой. Все гормоны, кроме инсулина, влияя на печень, увеличивают гликемию. Инсулин является единственным гормоном ор-ма, действие которого нацелено на снижение уровня глюкозы крови. При его влиянии глюкозу усиленно поглощают мышцы и жировая ткань. Уменьшение конц-ии глюкозы в крови инсулином достигается следующими путями:
-переход глюкозы в клетки – активация белков-транспортеров ГлюТ 4 на цитоплазматической мембране,
-вовлечение глюкозы в гликолиз – повышение синтеза глюкокиназы – фермента, получившего название "ловушка для глюкозы", стимуляция синтеза других ключевых ферментов гликолиза – фосфофруктокиназы, пируваткиназы,
-увеличение синтеза гликогена – активация гликогенсинтазы и стимуляция ее синтеза, что облегчает превращение излишков глюкозы в гликоген,
-активация пентозофосфатного пути – индукция синтеза глюкозо-6-фосфат-дегидрогеназы и 6-фосфоглюконатдегидрогеназы,
-усиление липогенеза – вовлечение глюкозы в синтез триацилглицеролов или фосфолипидов.
Многие ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. Глюкагон повышает содержание глюкозы крови:
-увеличивая мобилизацию гликогена через активацию гликогенфосфорилазы,
-стимулируя глюконеогенез – повышение работы ферментов пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы.
Адреналин вызывает гипергликемию:
-активируя мобилизацию гликогена – стимуляция гликогенфосфорилазы,
Глюкокортикоиды повышают глюкозу крови
-за счет подавления перехода глюкозы в клетку,
-стимулируя глюконеогенез – увеличивают синтез ферментов пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы.
Основные аспекты гормональных влияний:
Снижение глюкозы крови Повышение глюкозы крови
Инсулин Адреналин
Повышение ГлюТ 4-зависимого тр-та глюкозы в кл Активация гликогенолиза в печени
Усиление синтеза гликогена Глюкагон
Активация ПФП Активация гликогенолиза в печени
Активация гликолиза и ЦТК Стимуляция глюконеогенеза
Глюкокортикоиды
Усиление глюконеогенеза
Уменьшение проницаемости мембран для глюкозы
Гипергликемические состояния. Не представляют острой угрозы для жизни, но если уровень глюкозы от 16 до 22 ммоль/л сохраняется несколько дней, то глюкозы уходит из организма с мочой это влечет одновременную потерю воды и электроллитовприводит к прогрессирующей дегидратации и уменешению объёма крови, понижению кровяного давления, шоку, коме. Длительная гипергликемия – главная причина осложнений при сахарном диабете. Высокий уровень глюкозы вызывает неферментативное гликозилирование белков. В норме их 6%, при паталогии в 2-3 раза больше. Гликозилированные белки изменяют свою конформацию, поверхностный заряд, в следствии этого изменяются свойства белков и их взаимодействие с лигандами (гликозилированный гемоглобин имеет высокое сродство к О2, в рез-те О2 не поступает в кл, разв-ся гипоксия). Гипергликемическим является состояние, при котором концентрация глюкозы в крови более 6 ммоль/л. По происхождению выделяют две группы таких состояний:
Физиологические 1)алиментарные – связаны с приемом пищи и продолжаются в норме не более 2 часов после еды. 2) нейрогенные – нервное напряжение, стимулирующее секрецию адреналина и мобилизацию гликогена в печени, 3) гипергликемия беременных – связана с относительной недостаточностью инсулина при увеличении массы тела и потребностью плода в глюкозе.
Патологические 1)при заболеваниях гипофиза, коры и мозгового слоя надпочечников, щитовидной железы, связанных с избытком гликемических гормонов, 2)при органических поражениях ЦНС,
поражении β-клеток поджелудочной железы.
Гипогликемические состояния. Гипогликемия опасна для жизни. Если глюкоза снижается от 2,2 до 2,7 ммоль/л и остается таковой в течении 10 минут, это может привести к необратимому повреждению кл мозга., т.к. в кач-ве источника Е мозг исп-ет исключительно глюкозу (в обычных условиях) Гипогликемическим является состояние, при котором концентрация глюкозы в крови ниже 3,5 ммоль/л. Причиной гипогликемий может явиться:
Физиологические краткое или долгосрочное голодание, малоуглеводная диета.
Патологические 1)гиперинсулинизм в результате передозировки или инсулиномы (инсулинпродуцирующая опухоль) или избыточной активности инсулиназы (синдром Мак-Куорри),
2) гликогенозы, 3) недостаток гликемических гормонов при гипопитуитаризме, аддисоновой болезни,
4)у недоношенных и новорожденных – охлаждение, малые запасы гликогена в печени и ее общая незрелость, 5) нарушения кишечника, гельминтозы, дисбактериозы.
Сахарные нагрузки и сахарные кривые используют для диагностики сахарного диабета. Обследуемому даётся р-р глюкозы из расчета 1гм на 1кг массы тела. Концентрацию глюкозы измеряют сначала на тощак, а потом в течении 2-3х часов с интервалом в 1ч. По результатам строятся сахарные кривые.
21. Функции липидов. Пищевые жиры; норма суточного потребления, переваривание, всасывание продуктов переваривания. Ресинтез жиров в клетках кишечника. Хиломикроны, строение, значение, метаболизм. Пределы изменения концентрации жиров в крови.
Липиды – органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
Классификация липидов организма человека
1. Гликолипиды. Содержат углеводный компонент.
2. Жиры. Эфиры глицерина и высших жирных кислот. Химическое название - ацилглицерины. Преобладают триацилглицерины.
3. Минорные липиды. Свободные жирные кислоты, жирорастворимые витамины, биологически активные вещества липидной природы - простагландины и др.
4. Стероиды. В основе строения - полициклическая структура циклопентанпергидрофенантрен-стеран.
А. Стерины (спирты). Наиболее важен холестерин.
В. Стериды. Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы. Отличительная особенность - остаток фосфорной кислоты в составе молекулы.
Группы липидов отличаются по степени гидрофобности. Фосфолипиды и гликолипиды являются полярными липидами.
Холестерин занимает промежуточное положение между полярными и абсолютно гидрофобными липидами.
Абсолютно гидрофобными являются триглицериды и эфиры холестерина.
Большинство липидов (кроме стеринов и некоторых минорных липидов) содержат высшие жирные кислоты (ВЖК). В состав мембран входят только фосфолипиды (ФЛ), гликолипиды (ГЛ) и холестерин (ХС).
Функции:
1. Резервно-энергетическая функция. Триацилглицеролы подкожного жира являются основным энергетическим резервом организма при голодании. В адипоцитах жиры могут составлять 65-85% веса. Для поперечно-полосатой мускулатуры, печени и почек они являются основным источником энергии. При расщеплении 1г жира обр-ся 9,3 кКал Е. Является резервом эндогенной воды (окисление 1г жира даёт 1,7г воды)
2. Структурная функция. Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол. Основным компонентом сурфактанта легких является фосфатидилхолин. Т.к. активность мембранных ферментов зависит от состояния и текучести мембран, то жирнокислотный состав и наличие определенных видов фосфолипидов, количество холестерола влияет на активность мембранных липидзависимых ферментов (например, аденилатциклаза, Nа+,К+-АТФаза, цитохромоксидаза). Обеспечивают изберательную проницаемость, входят в состав рецепторов, определяют активный транспорт, образуют биопотенциалы.
3. Сигнальная функция. Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками. Фосфатидилинозитол непосредственно принимает участие в передаче гормональных сигналов в клетку. Производные жирных кислот – эйкозаноиды – являются "местными или тканевыми гормонами", обеспечивая регуляцию функций клеток.
4. Защитная функция. Подкожный жир является хорошим термоизолирующим средством, наряду с брыжеечным жиром он обеспечивает механическую защиту внутренних органов. Фосфолипиды играют определенную роль в активации свертывающей системы крови. Сохранение тепла происходит благодаря низкой теплопроводности.
5. Необходимы для растворения и всасывая жирорастворимых витаминов (А, Е, D, K, Q)
6. Являются предшественниками других соединений: глицерин испол-ся на синтез глюкозы, жирные к-ты окисляются до ацетилКоА и могут быть использованы на образование ацетилхолина)
7. Специфические функции: обеспечивают устойчивость эритроцитов, ганглиозиды связывают различные токсины и яды.
С пищей в организм ежедневно поступает от 80 до 150 г липидов. Основную массу составляют жиры, наряду с глюкозой служащие главными источниками энергии. Хотя калорийность жиров значительно выше, чем углеводов (9 по сравнению с 4,7 ккал/моль), при рациональном питании жиры обеспечивают не более 30% от общего количества калорий, поступающих с пищей. Жидкие жиры (масла) содержат в своём составе полиеновые жирные кислоты, которые не синтезируются в организме; поэтому жидкие жиры должны составлять не менее одной трети жиров пищи. Потребность в липидах взрослого организма составляет 80-100 г в сутки, из них растительных (жидких) жиров должно быть не менее 30%. С пищей в основном поступают триацилглицеролы, фосфолипиды и эфиры ХС.
Переваривание липидов осложняется тем, что их молекулы полностью или частично гидрофобны. Для преодоления этой помехи используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) или гидрофобные части молекул (ФЛ, ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к водной фазе. Условно внешний обмен липидов можно подразделить на следующие этапы:
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу.
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ.
3. Образование мицелл из продуктов переваривания (жирных кислот, МАГ, холестерола).
4. Всасывание образованных мицелл в эпителий кишечника.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
После ресинтеза липидов в кишечнике они собираются в транспортные формы – хиломикроны (основные) и липопротеины высокой плотности (ЛПВП) (малое кол-во) – и разносятся по организму.
Первые два этапа переваривания липидов, эмульгирование и гидролиз, происходят практически одновременно. Вместе с этим, продукты гидролиза не удаляются, а оставаясь в составе липидных капелек, облегчают дальнейшее эмульгирование и работу ферментов.
Переваривание в ротовой полости. У взрослых в ротовой полости переваривание липидов не идет, хотя длительное пережевывание пищи способствует частичному эмульгированию жиров.
П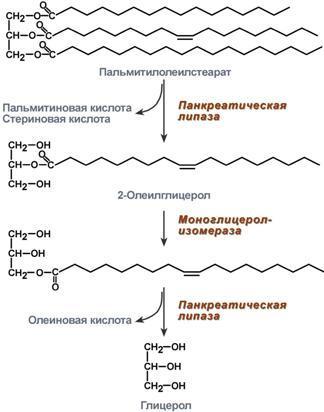 ереваривание
в желудке.
Собственная липаза желудка у взрослого
не играет существенной роли в переваривании
липидов из-за ее небольшого количества
и того, что ее оптимум рН 4,5-5,5. Также
влияет отсутствие эмульгированных
жиров в обычной пище (кроме молока). Тем
не менее, у взрослых теплая среда и
перистальтика желудка вызывает некоторое
эмульгирование жиров. При этом даже
низко активная липаза расщепляет
незначительные количества жира, что
важно для дальнейшего переваривания
жиров в кишечнике, т.к. наличие хотя бы
минимального количества свободных
жирных кислот облегчает эмульгирование
жиров в двенадцатиперстной кишке и
стимулирует секрецию панкреатической
липазы.
ереваривание
в желудке.
Собственная липаза желудка у взрослого
не играет существенной роли в переваривании
липидов из-за ее небольшого количества
и того, что ее оптимум рН 4,5-5,5. Также
влияет отсутствие эмульгированных
жиров в обычной пище (кроме молока). Тем
не менее, у взрослых теплая среда и
перистальтика желудка вызывает некоторое
эмульгирование жиров. При этом даже
низко активная липаза расщепляет
незначительные количества жира, что
важно для дальнейшего переваривания
жиров в кишечнике, т.к. наличие хотя бы
минимального количества свободных
жирных кислот облегчает эмульгирование
жиров в двенадцатиперстной кишке и
стимулирует секрецию панкреатической
липазы.
П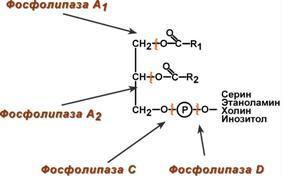 ереваривание
в кишечнике.
Под влиянием перистальтики ЖКТ и
составных компонентов желчи пищевой
жир эмульгируется. Образующиеся
лизофосфолипиды также являются хорошим
поверхностно-
активным
веществом, поэтому они способствуют
эмульгированию пищевых жиров и образованию
мицелл. Размер капель такой жировой
эмульсии не превышает 0,5 мкм. Гидролиз
эфиров ХС осуществляет холестерол-эстераза
панкреатического сока. Переваривание
ТАГ в кишечнике осуществляется под
воздействием панкреатической липазы
с оптимумом рН 8,0-9,0. В кишечник она
поступает в виде пролипазы, активируемой
при участии колипазы. Колипаза, в свою
очередь, активируется трипсином и затем
образует с липазой комплекс в соотношении
1:1. Панкреатическая липаза отщепляет
жирные кислоты, связанные с С1 и С3 атомами
углерода глицерола. В результате ее
работы остается 2-моноацилглицерол
(2-МАГ). 2-МАГ всасываются или превращаются
моноглицерол-изомеразой в 1-МАГ. Последний
гидролизуется до глицерола и жирной
кислоты. Примерно 3/4 ТАГ после гидролиза
остаются в форме 2-МАГ и только 1/4 часть
ТАГ гидролизуется полностью. В
панкреатическом соке также имеется
активируемая трипсином фосфолипаза
А2, отщепляющая жирную кислоту от С2.
Обнаружена активность фосфолипазы С и
лизофосфолипазы. В кишечном соке имеется
активность фосфолипазы А2 и С. Имеются
также данные о наличии в других клетках
организма фосфолипаз А1 и D.
ереваривание
в кишечнике.
Под влиянием перистальтики ЖКТ и
составных компонентов желчи пищевой
жир эмульгируется. Образующиеся
лизофосфолипиды также являются хорошим
поверхностно-
активным
веществом, поэтому они способствуют
эмульгированию пищевых жиров и образованию
мицелл. Размер капель такой жировой
эмульсии не превышает 0,5 мкм. Гидролиз
эфиров ХС осуществляет холестерол-эстераза
панкреатического сока. Переваривание
ТАГ в кишечнике осуществляется под
воздействием панкреатической липазы
с оптимумом рН 8,0-9,0. В кишечник она
поступает в виде пролипазы, активируемой
при участии колипазы. Колипаза, в свою
очередь, активируется трипсином и затем
образует с липазой комплекс в соотношении
1:1. Панкреатическая липаза отщепляет
жирные кислоты, связанные с С1 и С3 атомами
углерода глицерола. В результате ее
работы остается 2-моноацилглицерол
(2-МАГ). 2-МАГ всасываются или превращаются
моноглицерол-изомеразой в 1-МАГ. Последний
гидролизуется до глицерола и жирной
кислоты. Примерно 3/4 ТАГ после гидролиза
остаются в форме 2-МАГ и только 1/4 часть
ТАГ гидролизуется полностью. В
панкреатическом соке также имеется
активируемая трипсином фосфолипаза
А2, отщепляющая жирную кислоту от С2.
Обнаружена активность фосфолипазы С и
лизофосфолипазы. В кишечном соке имеется
активность фосфолипазы А2 и С. Имеются
также данные о наличии в других клетках
организма фосфолипаз А1 и D.
Образование мицелл. В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер около 5 нм). Свободный глицерол всасывается прямо в кровь.
П осле
расщепления полимерных липидных молекул
полученные мономерывсасываются
в верхнем отделе тонкого кишечника в
начальные 100 см. В норме всасывается 98%
пищевых липидов.
осле
расщепления полимерных липидных молекул
полученные мономерывсасываются
в верхнем отделе тонкого кишечника в
начальные 100 см. В норме всасывается 98%
пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты проникают внутрь клетки, после чего транспортируются в эндоплазматический ретикулум. Желчные кислоты частично также могут попадать в клетки и далее в кровь воротной вены, однако большая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Р![]() есинтез
липидов в энтероцитах.
После всасывания продуктов гидролиза
жиров жирные кислоты и 2-моноацилглицеролы
в клетках слизистой оболочки тонкого
кишечника включаются в процесс ресинтеза
с образованием триацилглицеролов.
Жирные кислоты вступают в реакцию
этерификации только в активной форме
в виде производных коэнзима А, поэтому
первая стадия ресинтеза жиров - реакция
активации жирной кислоты:
есинтез
липидов в энтероцитах.
После всасывания продуктов гидролиза
жиров жирные кислоты и 2-моноацилглицеролы
в клетках слизистой оболочки тонкого
кишечника включаются в процесс ресинтеза
с образованием триацилглицеролов.
Жирные кислоты вступают в реакцию
этерификации только в активной форме
в виде производных коэнзима А, поэтому
первая стадия ресинтеза жиров - реакция
активации жирной кислоты:
HS КоА + RCOOH + АТФ → R-CO ~ КоА + АМФ + Н4Р2О7.
Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой). Затем ацил~КоА участвует в реакции этерификации 2-моноацилглицерола с образованием сначала диацилгли-церола, а затем триацилглицерола. Реакции ресинтеза жиров катализируют ацилтранеферазы.Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, иногда могут использоваться и эндогенные жирные кислоты. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это ликвидирует их детергентное действие на мембраны и позволит переносить по крови в ткани. Поступившая в энтероцит жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
Р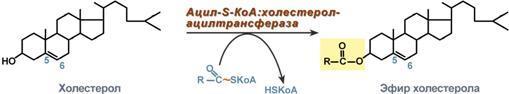 есинтез
эфиров холестерола.
Холестерол этерифицируется с использованием
ацил-S-КоА и фермента
ацил-КоА:холестерол-ацилтрансферазы
(АХАТ). Реэтерификация холестерола
напрямую влияет на его всасывание в
кровь. В настоящее время ищутся возможности
подавления этой реакции для снижения
концентрации ХС в крови.
есинтез
эфиров холестерола.
Холестерол этерифицируется с использованием
ацил-S-КоА и фермента
ацил-КоА:холестерол-ацилтрансферазы
(АХАТ). Реэтерификация холестерола
напрямую влияет на его всасывание в
кровь. В настоящее время ищутся возможности
подавления этой реакции для снижения
концентрации ХС в крови.
Р есинтез
триацилглицеролов.
Для ресинтеза ТАГ есть два пути: Первый
путь,
основной – 2-моноацилглицеридный
– происходит при участии экзогенных
2-МАГ и ЖК в гладком эндоплазматическом
ретикулуме энтероцитов: мультиферментный
комплекс триацилглицерол-синтазы
формирует ТАГ. Поскольку 1/4 часть ТАГ в
кишечнике полностью гидролизуется и
глицерол в энтероцитах не задерживается,
то возникает относительный избыток
жирных кислот для которых не хватает
глицерола. Поэтому существует второй,
глицеролфосфатный, путь в шероховатом
эндоплазматическом ретикулуме. Источником
глицерол-3-фосфата служит окисление
глюкозы, так как пищевой глицерол быстро
покидает энтероциты и уходит в кровь.
Здесь можно выделить следующие реакции:
1. Образование глицерол-3-фосфата из
глюкозы. 2.Превращение глицерол-3-фосфата
в фосфатидную кислоту. 3.Превращение
фосфатидной кислоты в 1,2-ДАГ. 3.Синтез
ТАГ.
есинтез
триацилглицеролов.
Для ресинтеза ТАГ есть два пути: Первый
путь,
основной – 2-моноацилглицеридный
– происходит при участии экзогенных
2-МАГ и ЖК в гладком эндоплазматическом
ретикулуме энтероцитов: мультиферментный
комплекс триацилглицерол-синтазы
формирует ТАГ. Поскольку 1/4 часть ТАГ в
кишечнике полностью гидролизуется и
глицерол в энтероцитах не задерживается,
то возникает относительный избыток
жирных кислот для которых не хватает
глицерола. Поэтому существует второй,
глицеролфосфатный, путь в шероховатом
эндоплазматическом ретикулуме. Источником
глицерол-3-фосфата служит окисление
глюкозы, так как пищевой глицерол быстро
покидает энтероциты и уходит в кровь.
Здесь можно выделить следующие реакции:
1. Образование глицерол-3-фосфата из
глюкозы. 2.Превращение глицерол-3-фосфата
в фосфатидную кислоту. 3.Превращение
фосфатидной кислоты в 1,2-ДАГ. 3.Синтез
ТАГ.
Р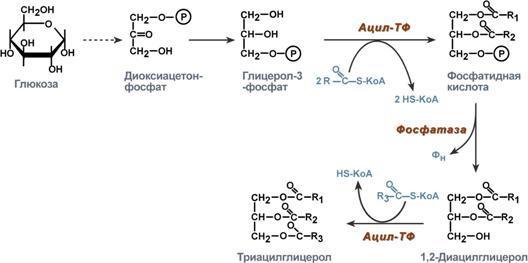 есинтез
фосфолипидов.
Фосфолипиды синтезируются также как и
в остальных клетках организма. Для этого
есть два способа. Первый – с использованием
1,2-ДАГ и активных форм холина и этаноламина
для синтеза фосфатидилхолина или
фосфатидилэтаноламина. Второй путь –
через синтезируемую in situ фосфатидную
кислоту. После ресинтеза фосфолипиды,
триацилглицеролы, холестерол и его
эфиры упаковываются в особые транспортные
формы липидов – липопротеины и только
в такой форме они способны покинуть
энтероцит. В кишечнике формируются два
вида липопротеинов – хиломикроны и
липопротеины высокой плотности.
есинтез
фосфолипидов.
Фосфолипиды синтезируются также как и
в остальных клетках организма. Для этого
есть два способа. Первый – с использованием
1,2-ДАГ и активных форм холина и этаноламина
для синтеза фосфатидилхолина или
фосфатидилэтаноламина. Второй путь –
через синтезируемую in situ фосфатидную
кислоту. После ресинтеза фосфолипиды,
триацилглицеролы, холестерол и его
эфиры упаковываются в особые транспортные
формы липидов – липопротеины и только
в такой форме они способны покинуть
энтероцит. В кишечнике формируются два
вида липопротеинов – хиломикроны и
липопротеины высокой плотности.
П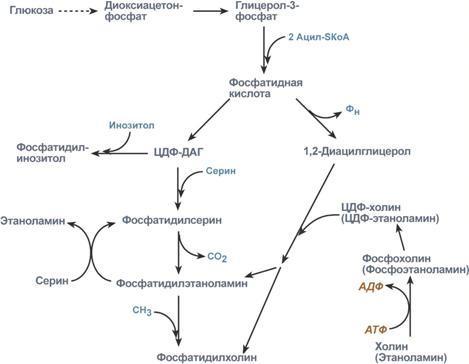 оскольку
липиды являются в основе своей гидрофобными
молекулами, то они транспортируются в
водной фазе крови в составе особых
частиц – липопротеинов. Такие транспортные
липопротеины можно сравнить с орехом,
который имеет скорлупу и ядро. Поверхность
липопротеиновой частицы ("скорлупа")
гидрофильна и сформирована белками,
фосфолипидами и свободным холестеролом.
Триацилглицеролы и эфиры холестерола
составляют гидрофобное ядро. Липопротеины
различаются по соотношению триацилглицеролов,
холестерола и его эфиров, фосфолипидов
и как сложные белки состоят из четырех
классов.1. хиломикроны (ХМ), 2.липопротеины
очень низкой плотности (ЛПОНП,
пре-β-липопротеины, пре-β-ЛП), 3. липопротеины
низкой плотности (ЛПНП, β-липопротеины,
β-ЛП), 4. липопротеины высокой плотности
(ЛПВП, α-липопротеины, α-ЛП). Транспорт
триацилглицеролов от кишечника к тканям
(экзогенные ТАГ) осуществляется в видехиломикронов
(ХМ),
от печени к тканям (эндогенные ТАГ) – в
виде липопротеинов очень низкой
плотности. В транспорте ТАГ к тканям
можно выделить последовательность
следующих событий:
оскольку
липиды являются в основе своей гидрофобными
молекулами, то они транспортируются в
водной фазе крови в составе особых
частиц – липопротеинов. Такие транспортные
липопротеины можно сравнить с орехом,
который имеет скорлупу и ядро. Поверхность
липопротеиновой частицы ("скорлупа")
гидрофильна и сформирована белками,
фосфолипидами и свободным холестеролом.
Триацилглицеролы и эфиры холестерола
составляют гидрофобное ядро. Липопротеины
различаются по соотношению триацилглицеролов,
холестерола и его эфиров, фосфолипидов
и как сложные белки состоят из четырех
классов.1. хиломикроны (ХМ), 2.липопротеины
очень низкой плотности (ЛПОНП,
пре-β-липопротеины, пре-β-ЛП), 3. липопротеины
низкой плотности (ЛПНП, β-липопротеины,
β-ЛП), 4. липопротеины высокой плотности
(ЛПВП, α-липопротеины, α-ЛП). Транспорт
триацилглицеролов от кишечника к тканям
(экзогенные ТАГ) осуществляется в видехиломикронов
(ХМ),
от печени к тканям (эндогенные ТАГ) – в
виде липопротеинов очень низкой
плотности. В транспорте ТАГ к тканям
можно выделить последовательность
следующих событий:
1)Образование незрелых первичных ХМ в кишечнике.
2)Движение первичных ХМ через лимфатические протоки в кровь.
3)Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
4)Взаимодействие с липопротеинлипазой (ЛПЛ) эндотелия, которая отщепляет жирные кислоты от ТАГ. Жирные кислоты переходят непосредственно в данную ткань или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается и образуются остаточные ХМ.
5)Переход остаточных ХМ в гепатоциты и полный распад их структуры.
6)Синтез ТАГ в печени из пищевой глюкозы. Использование ТАГ, пришедших в составе остаточных ХМ.
7)Образование первичных ЛПОНП в печени.
8)Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
9)Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП).
10)Остаточные ЛПОНП переходят в гепатоциты и полностью распадаются, либо остаются в плазме крови. После воздействия на них печеночной ТАГ-липазы в синусоидах печени ЛПОНП превращаются в ЛПНП.
Характеристика хиломикронов. Общая характеристика: -формируются в кишечнике из ресинтезированных жиров, -в их составе преобладают ТАГ, мало белка, фосфолипидов и холестерола (2% белка, 87% ТАГ, 2% ХС, 5% эфиров ХС, 4% фосфолипидов), - основным апобелком является апоВ-48, это структурный липопротеин, в плазме крови получают от ЛПВП белки апоС-II и апоЕ, - в норме натощак не обнаруживаются, в крови появляются после приема пищи, поступая из лимфы через грудной лимфатический проток, и полностью исчезают через 10-12 часов,- не атерогенны.
Функция: Транспорт экзогенных ТАГ из кишечника в ткани, запасающие или использующие жиры, в основном жировую ткань, легкие, печень, миокард, лактирующую молочную железу, костный мозг, почки, селезенку, макрофаги. На эндотелии капилляров этих тканей имеется фермент липопротеинлипаза.
М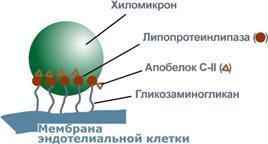 етаболизм
1. После ресинтеза жиров в эпителиоцитах
кишечника формируются первичные
хиломикроны, имеющие только апоВ-48.
етаболизм
1. После ресинтеза жиров в эпителиоцитах
кишечника формируются первичные
хиломикроны, имеющие только апоВ-48.
2. Из-за большого размера они не проникают напрямую в кровеносное русло и эвакуируются через лимфатическую систему, попадая в кровь через грудной лимфатический проток.
3. В крови хиломикроны взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. Белок апоС-II является активатором фермента липопротеинлипазы, белок апоЕ необходим для удаления из крови остаточных хиломикронов.
4. На эндотелии капилляров вышеперечисленных тканей находится фермент липопротеинлипаза (ЛПЛ), отщепляющий жирные кислоты от ТАГ. Количество фермента увеличивается при действии инсулина и прогестерона.
5. После взаимодействия хиломикрона с ферментом триацилглицеролы, находящиеся в составе хиломикронов, гидролизуются с образованием свободных жирных кислот. Жирные кислоты перемещаются в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. Липопротеинлипаза способна удалить до 90% всех ТАГ, находящихся в хиломикроне или ЛПОНП.
6. После окончания работы ЛПЛ остаточные хиломикроны попадают в гепатоциты посредством апоЕ-рецепторного эндоцитоза и разрушаются.
Содержание липидов в кровотоке может понижаться вслед¬ствие откладывания их в различных тканях. Способность откладывать жир характерна для всех тканей, кроме мозга. Главную роль в обмене липидов играют жировая ткань и печень. Количество жиро¬вой ткани нарастает с возрастом. Пределы конц жиров в крови:Норма-4-8г/л, если больше-гиперлипемия( при сах диабете, ожирении). В норме концентрация жиров в крови колеблется в довольно широких пределах — 10-200 мг/дл, в среднем около 0,1 %. Отметим для сравнения, что концентрация жиров в молоке равна примерно 3 %. После приема пищи концентрация хиломикронов в крови повышается, достигает максимума примерно через 5 ч, затем начинает снижаться. Сходным образом, но с меньшей амплитудой изменяется концентрация ЛОНП в крови. При этом надо отметить, что концентрация хиломикронов в большей мере зависит от содержания жиров в пище, а концентрация ЛОНП — от содержания углеводов. В крови, взятой для анализа утром до завтрака, т. е. после большого ночного перерыва в приеме пищи, хиломикроны не обнаруживаются, а концентрация ЛОНП минимальна. Пропорционально концентрации этих липопротеинов снижена и концентрация жиров в крови.При обычном ритме питания и небольших физических нагрузках в крови в дневное время постоянно имеются хиломикроны и ЛОНП, поскольку время переваривания жиров мало отличается от времени между приемами пищи.
Любое нарушение внешнего обмена липидов (проблемы переваривания или всасывания) проявляется увеличением содержания жира в кале – развивается стеаторея. Причины:
1. Снижение желчеобразования в результате недостаточного синтеза желчных кислот и фосфолипидов при болезнях печени, гиповитаминозах.
2. Снижение желчевыделения (обтурационная желтуха, билиарный цирроз, желчнокаменная болезнь). У детей часто причиной может быть перегиб желчного пузыря, который сохраняется и во взрослом состоянии.
3. Снижение переваривания при недостатке панкреатической липазы, который возникает при заболеваниях поджелудочной железы (острый и хронический панкреатит, острый некроз, склероз). Может возникать относительная недостаточность фермента при сниженном выделении желчи.
4. Избыток в пище катионов кальция и магния, которые связывают жирные кислоты, переводят их в нерастворимое состояние и препятствуют их всасыванию. Эти ионы также связывают желчные кислоты, нарушая их работу.
5. Снижение всасывания при повреждении стенки кишечника токсинами, антибиотиками (неомицин, хлортетрациклин).
6. Недостаточность синтеза пищеварительных ферментов и ферментов ресинтеза липидов в энтероцитах при белковой и витаминной недостаточности.
22. Окисление глицерина и высших жирных к-т. Последовательность реакций. Связь β-окисления с циклом Кребса и дых цепью. Физиологическое значение окисления жирных кислот в зависимости от ритма питания и мышечной активности.
Д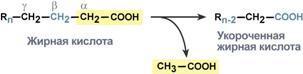 ля
преобразования энергии, заключенной в
жирных кислотах, в энергию связей АТФ
существует метаболический путь окисления
жирных кислот до СО2 и воды, тесно
связанный с циклом трикарбоновых кислот
и дыхательной цепью. Этот путь называется
β-окисление, т.к. происходит окисление
3-го углеродного атома жирной кислоты
(β-положение) в карбоксильную группу,
одновременно от кислоты отщепляется
ацетильная группа, включающая С1 и С2
исходной жирной кислоты. Реакции
β-окисления происходят в митохондриях
большинства клеток организма (кроме
нервных клеток). Для окисления используются
жирные кислоты, поступающие в цитозоль
из крови или появляющиеся при липолизе
собственных внутриклеточных ТАГ.
Суммарное уравнение окисления
пальмитиновой кислоты выглядит следующим
образом: Пальмитоил-SКоА + 7ФАД + 7НАД+ +
7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
ля
преобразования энергии, заключенной в
жирных кислотах, в энергию связей АТФ
существует метаболический путь окисления
жирных кислот до СО2 и воды, тесно
связанный с циклом трикарбоновых кислот
и дыхательной цепью. Этот путь называется
β-окисление, т.к. происходит окисление
3-го углеродного атома жирной кислоты
(β-положение) в карбоксильную группу,
одновременно от кислоты отщепляется
ацетильная группа, включающая С1 и С2
исходной жирной кислоты. Реакции
β-окисления происходят в митохондриях
большинства клеток организма (кроме
нервных клеток). Для окисления используются
жирные кислоты, поступающие в цитозоль
из крови или появляющиеся при липолизе
собственных внутриклеточных ТАГ.
Суммарное уравнение окисления
пальмитиновой кислоты выглядит следующим
образом: Пальмитоил-SКоА + 7ФАД + 7НАД+ +
7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Э![]() тапы
окисления жирных кислот:1.
Прежде, чем проникнуть в матрикс
митохондрий и окислиться, жирная к-та
должна активироваться в цитозоле. Это
осуществляется присоединением к ней
коэнзима А с обр-ем ацил-S-КоА. Ацил-S-КоА
яв-ся высокоэнергетическим соед-ем.
Необратимость реакции достигается
гидролизом дифосфата на 2 молекулы
фосфорной к-ты.
тапы
окисления жирных кислот:1.
Прежде, чем проникнуть в матрикс
митохондрий и окислиться, жирная к-та
должна активироваться в цитозоле. Это
осуществляется присоединением к ней
коэнзима А с обр-ем ацил-S-КоА. Ацил-S-КоА
яв-ся высокоэнергетическим соед-ем.
Необратимость реакции достигается
гидролизом дифосфата на 2 молекулы
фосфорной к-ты.
2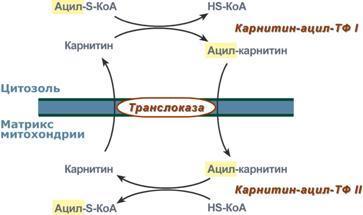 .
Ацил-S-КоА не способен проходить через
митохондриальную мембрану, поэтому
существует способ его переноса в
комплексе с витаминоподобным веществом
карнитином. На наружной мембране
митохондрий имеется фермент
карнитин-ацилтрансфераза I.
.
Ацил-S-КоА не способен проходить через
митохондриальную мембрану, поэтому
существует способ его переноса в
комплексе с витаминоподобным веществом
карнитином. На наружной мембране
митохондрий имеется фермент
карнитин-ацилтрансфераза I.
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно важно. Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет 2х параллельных процессов: карнитин-зависимого ок-ия жирных к-т и аэробного окисления глюкозы. Карнитин необходим для роста головного и спинного мозга, для вз-вия всех отделов НС, ответственных за движение и взаимодействие мышц. Сущ-ют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен "смерти в колыбели".
3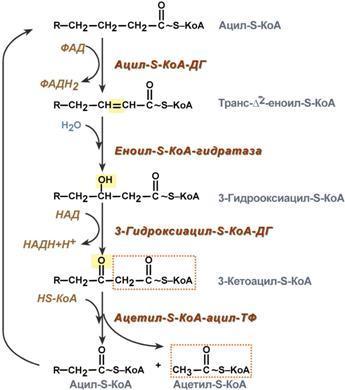 .
После св-ия с карнитином ж к-та переносится
ч/з мембрану транслоказой. Здесь на
внутренней стороне мембраны фермент
карнитин-ацилтрансфераза II вновь обр-ет
ацил-S-КоА кот вступает на путь β-окисления.
.
После св-ия с карнитином ж к-та переносится
ч/з мембрану транслоказой. Здесь на
внутренней стороне мембраны фермент
карнитин-ацилтрансфераза II вновь обр-ет
ацил-S-КоА кот вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
Расчет энергетического баланса β-окисления: При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
*количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2;
*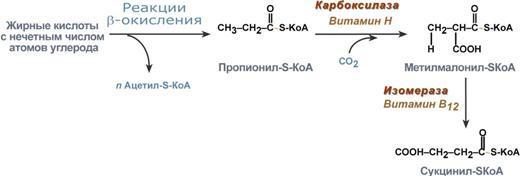 число
циклов β-окисления. Число циклов
β-окисления легко определить исходя из
представления о жирной кислоте как о
цепочке двухуглеродных звеньев. Число
разрывов между звеньями соответствует
числу циклов β-окисления. Эту же величину
можно подсчитать по формуле (n/2 -1), где
n – число атомов углерода в кислоте,
число
циклов β-окисления. Число циклов
β-окисления легко определить исходя из
представления о жирной кислоте как о
цепочке двухуглеродных звеньев. Число
разрывов между звеньями соответствует
числу циклов β-окисления. Эту же величину
можно подсчитать по формуле (n/2 -1), где
n – число атомов углерода в кислоте,
*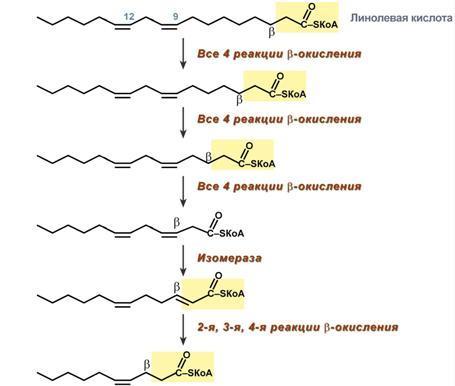 число
двойных связей в жирной кислоте. В первой
реакции β-окисления происходит образование
двойной связи при участии ФАД. Если
двойная связь в жирной кислоте уже
имеется, то необходимость в этой реакции
отпадает и ФАДН2 не образуется. Количество
необразованных ФАДН2 соответствует
числу двойных связей. Остальные реакции
цикла идут без изменений;
число
двойных связей в жирной кислоте. В первой
реакции β-окисления происходит образование
двойной связи при участии ФАД. Если
двойная связь в жирной кислоте уже
имеется, то необходимость в этой реакции
отпадает и ФАДН2 не образуется. Количество
необразованных ФАДН2 соответствует
числу двойных связей. Остальные реакции
цикла идут без изменений;
*количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
Окисление жирных кислот с нечетным числом углеродных атомов. Ж к-ты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой обр-ся пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и обр-ию сукцинил-SКоА. В этих реакциях участвуют биотин и В12.
Окисление ненасыщенных жирных кислот. При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ- в β-положение и переводят природные двойные связи из цис- в транс-положение. Т.о., уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
Глицерин – трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень. Окисление глицерина
Глицерин сначала фосфорилируется с участием АТФ до глицерофосфата (3-фосфоглицерол). Затем под действием НАД-зависимой глицерофосфатдегидрогеназы окисляется до 3-фосфоглицеринового альдегида. Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты.
Связь в-окисления с ЦК и Дц: Таким образом, молекула жирной кислоты в конце концов распадается до продуктов, имеющих всего два углеродных атома, превращающихся в цикле трикарбоновых кислот. Восстановленные коферменты впоследствии вновь окисляются в дыхательной цепи с одновременным образованием макроэргических фосфатов. С точки зрения образования АТР, окисление жирных кислот составляет основной энергетический резерв организма.
Регуляция в-окисления: Ключевой фермент – карнитинацилтрансфераза1, аллостерический фермент, в печени его аллостерический ингибитор – малонилКоА. Активируют: катехоламины, СТГ, глюкагон. Ингибирует: инсулин.
Е значение в-окисление имеет для скелетных мышц (50% Е), для сердечной мышцы (70%), головной мозг и другие нервные ткани, а также эритроциты не используют жирные к-ты для окисления; они не поступают в головной мозг, т.к. не проходят ч/з гематоэнцефалический барьер.
23. Липолиз и липогенез. Значение. Зависимость липогенеза от ритма питания и состава пищи. Регуляция липолиза и липогенеза. Транспорт и использование жирных кислот, образующихся при мобилизации жира.
Синтезируясь во время и сразу после приема пищи (липогенез) и запасаясь в жировой ткани, триацилглицеролы являются формой хранения насыщенных и мононенасыщенных жирных кислот. Распад триацилглицеролов (триглицеридов) по-другому называется липолиз или мобилизация жира. Он идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ.
Даже в состоянии покоя организма печень, сердце, скелетные мышцы и другие ткани (кроме эритроцитов и нейроцитов) более 50% энергии получают из окисления жирных кислот, поступающих из жировой ткани благодаря фоновому липолизу. По мере уменьшения резервов глюкозы клетки все больше энергии получают из окисления жирных кислот. Таким образом, насыщенные жирные кислоты выполняют роль своеобразного буфера энергии в организме. Мобилизация триацилглицеролов и окисление жирных кислот активируется при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертиреоз). В результате липолиза в адипоцитах образуются свободный глицерол и жирные кислоты. Глицерол с кровью доставляется в печень и почки, здесь фосфорилируется и окисляется в метаболит гликолиза диоксиацетонфосфат. В зависимости от условий ДАФ может включаться в реакции глюконеогенеза (при голодании, мышечной нагрузке) или окисляться в гликолизе до пировиноградной кислоты. Жирные кислоты транспортируются в крови в комплексе с альбуминами плазмы:
-при физической нагрузке – в мышцы,
-в обычных условиях и при голодании – в мышцы и большинство тканей, однако при этом около 30% жирных кислот захватывается печенью.
При голодании и физической нагрузке после проникновения в клетки жирные кислоты вступают на путь β-окисления.
В целом мобилизацию жира можно представить как последовательность следующих событий:
1.Липолиз – гормонзависимый распад ТАГ в жировой ткани или резервных ТАГ в самой клетке.
2.Транспорт жирных кислот из жировой ткани по крови в комплексе с альбумином.
3.Проникновение жирной кислоты в цитозоль клетки-мишени.
4.Активация жирной кислоты через присоединение HS-КоА.
5.Карнитин-зависимое перемещение жирной кислоты в митохондрию.
6.Окисление жирной кислоты с образованием ацетильных групп (в форме ацетил-S-КоА).
7.Сгорание ацетил-S-КоА в цикле лимонной кислоты или синтез (только в печени) кетоновых тел.
В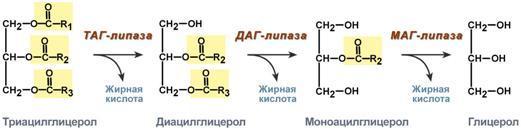 качестве источника энергии могут
использоваться только свободные, т.е.
неэстерифицированные, жирные кислоты.
Поэтому триглицериды сначала гидролизуются
при помощи специфических тканевых
ферментов – липаз – до глицерина и
свободных жирных кислот. Последние из
жировых депо могут переходить в плазму
крови (мобилизация высших жирных кислот),
после чего они используются тканями и
органами тела в качестве энергетического
материала. В жировой ткани содержится
несколько липаз, из которых наибольшее
значение имеют триглицеридлипаза (так
называемая гормоночувствитель-ная
липаза), диглицеридлипаза и
моноглицеридлипаза. Активность двух
последних ферментов в 10–100 раз превышает
активность первого. Три-глицеридлипаза
активируется рядом гормонов (например,
адреналином, норадреналином, глюкагоном
и др.), тогда как диглицеридлипаза и
мо-ноглицеридлипаза не чувствительны
к их действию. Триглицеридлипаза является
регуляторным ферментом. Первое, что
происходит при использовании нейтрального
жира во время голодания и физической
нагрузки – это активация фермента,
отвечающего за отщепление первой жирной
кислоты от триацилглицерола. Фермент
называется гормон-чувствительная
триацилглицерол-липаза или ТАГ-липаза.
Кроме ТАГ-липазы, в адипоцитах имеются
еще диацилглицерол-липаза ( ДАГ-липаза)
и моноацилглицерол-липаза (МАГ-липаза),
активность которых высока и постоянна,
однако в покое эта активность не
проявляется из-за отсутствия субстрата.
Как только в клетке после работы
ТАГ-липазы появляются диацилглицеролы
начинает работать постоянно активная
ДАГ-липаза, продукт ее реакции
моноацилглицерол (МАГ) является субстратом
для МАГ-липазы. Образующиеся жирные
кислоты и глицерол покидают клетку. Для
регуляции активности ТАГ-липазы
обязательно наличие гормонального
влияния (адреналин, глюкагон, соматотропин,
инсулин и др).
качестве источника энергии могут
использоваться только свободные, т.е.
неэстерифицированные, жирные кислоты.
Поэтому триглицериды сначала гидролизуются
при помощи специфических тканевых
ферментов – липаз – до глицерина и
свободных жирных кислот. Последние из
жировых депо могут переходить в плазму
крови (мобилизация высших жирных кислот),
после чего они используются тканями и
органами тела в качестве энергетического
материала. В жировой ткани содержится
несколько липаз, из которых наибольшее
значение имеют триглицеридлипаза (так
называемая гормоночувствитель-ная
липаза), диглицеридлипаза и
моноглицеридлипаза. Активность двух
последних ферментов в 10–100 раз превышает
активность первого. Три-глицеридлипаза
активируется рядом гормонов (например,
адреналином, норадреналином, глюкагоном
и др.), тогда как диглицеридлипаза и
мо-ноглицеридлипаза не чувствительны
к их действию. Триглицеридлипаза является
регуляторным ферментом. Первое, что
происходит при использовании нейтрального
жира во время голодания и физической
нагрузки – это активация фермента,
отвечающего за отщепление первой жирной
кислоты от триацилглицерола. Фермент
называется гормон-чувствительная
триацилглицерол-липаза или ТАГ-липаза.
Кроме ТАГ-липазы, в адипоцитах имеются
еще диацилглицерол-липаза ( ДАГ-липаза)
и моноацилглицерол-липаза (МАГ-липаза),
активность которых высока и постоянна,
однако в покое эта активность не
проявляется из-за отсутствия субстрата.
Как только в клетке после работы
ТАГ-липазы появляются диацилглицеролы
начинает работать постоянно активная
ДАГ-липаза, продукт ее реакции
моноацилглицерол (МАГ) является субстратом
для МАГ-липазы. Образующиеся жирные
кислоты и глицерол покидают клетку. Для
регуляции активности ТАГ-липазы
обязательно наличие гормонального
влияния (адреналин, глюкагон, соматотропин,
инсулин и др).
В целом последовательность событий активации липолиза выглядит следующим образом:
1.Молекула гормона (адреналин, глюкагон, АКТГ) взаимодействует со своим рецептором.
2.Активный гормон-рецепторный комплекс воздействует на мембранный G-белок.
3.G-белок активирует фермент аденилатциклазу.
4.Аденилатциклаза превращает АТФ в цАМФ – вторичный посредник (мессенджер).
5. цАМФ аллостерически активирует фермент протеинкиназу А.
6.Протеинкиназа А фосфорилирует ТАГ-липазу и активирует ее.
7.ТАГ-липаза
отщепляет от триацилглицеролов жирную
кислоту в 1 или 3 положении с образованием
диацилглицерола (ДАГ).А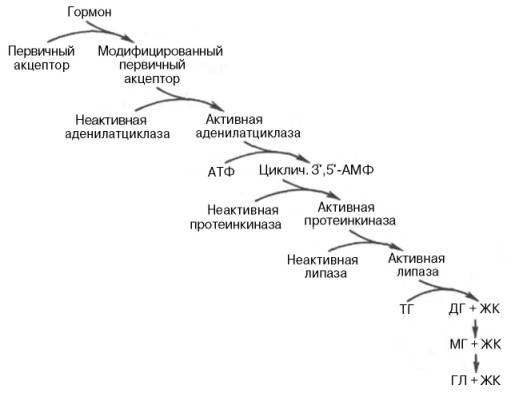 ктивная
триглицеридлипаза расщепляет триглицерид
на диглицерид и жирную кислоту. Затем
при действии ди- и моноглицеридлипаз
образуются конечные продукты липо-лиза
– глицерин и свободные жирные кислоты,
которые поступают в кровяное русло.
ктивная
триглицеридлипаза расщепляет триглицерид
на диглицерид и жирную кислоту. Затем
при действии ди- и моноглицеридлипаз
образуются конечные продукты липо-лиза
– глицерин и свободные жирные кислоты,
которые поступают в кровяное русло.
Скорость липолиза триглицеридов не является постоянной, она подвержена регулирующему влиянию различных факторов, среди которых особое значение имеют нейрогормональные.
Связанные с альбуминами плазмы крови в виде комплекса свободные жирные кислоты с током крови попадают в органы и ткани, где комплекс распадается, а жирные кислоты подвергаются либо β-окислению, либо частично используются для синтеза триглицеридов, глицерофосфолипидов, сфингофосфолипидов и других соединений, а также на эстерификацию холестерина. При физической работе и других состояниях организма, требующих повышенных энергозатрат, потребление триглицеридов жировой ткани как энергетического резерва увеличивается.
Активируют: катехоламины (адреналин), глюкагон, тироксин, кортизол, цАМФ. Ингибирует: инсулин.
Л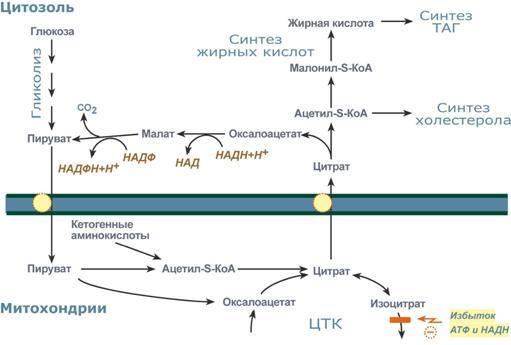 ипогенез
– это синтез жира из глицерина и жирных
к-т. Происходит в печени и жировой ткани.
Глицерин и жирные к-ты должны быть в
активной форме. В жировой тк глицеролкиназа
отсутствует, поэтому активная форма
обр-ся из ДОАФ – метаболита гликолиза
(из глюкозы). Синтез жира протекает в
адбсортивный период (после еды). Молекулы
жира в адипоцитах объединяются крупной
каплей и явл-ся компактной формой
хранения Е запасов. Обмен жира в жировой
тк протекает очень активно: обновляется
полностью за несколько дней. В печени
ежесуточно обр-ся 20-50г жира, который
поступает в кровь в составе ЛПОНП.
Ключевой фермент: ацилтрансфераза.
Активируют: инсулин, эстрогены и АТФ.
Ингибируют: катехоламины, СТГ, йодтиронины,
АКТГ, АДФ.Синтез
нейтральных жиров
происходит за счет этерификации
глицеро-1-фосфата двумя активированными
жирными кислотами. Фосфатная группа
образованной фосфатидной кислоты
отщепляется фосфатазами, что приводит
к образованию диацилглицерина, который
далее реагирует с другой активированной
жирной кислотой, образуя триацилглицерин.
Триацилглицерины составляют энергетическое
депо организма. Они обладают очень
высокой теплотой окисления, равной 37,6
кДж/моль. Жиры локализованы в жировых
клетках (адипоцитах) и характеризуются
высокой скоростью метаболизма. Их
превращение непосредственно регулируется
гормонами, в частности инсулином и
адреналином. Реакции биосинтеза
липидов
могут идти в гладкой эндоплазматической
сети клеток всех органов. Субстратом
для синтеза жиров de novo является глюкоза.
Как известно, попадая в кл, глюкоза
превращается в гликоген, пентозы и
окисляется до пировиноградной кислоты.
При высоком поступлении глюкоза
используется для синтеза гликогена, но
этот вариант ограничивается объемом
клетки. Поэтому глюкоза "проваливается"
в гликолиз и превращается в пируват
либо напрямую, либо через пентозофосфатный
шунт. Во втором случае образуется НАДФН,
который понадобится впоследствии для
синтеза жирных к-т. Пируват переходит
в митохондрии и декарбоксилируется в
ацетил-SКоА и вступает в ЦТК. Однако в
состоянии покоя, при отдыхе, при наличии
избыточного количества энергии в клетке
реакции ЦТК (в частности,
изоцитратдегидрогеназная реакция)
блокируются избытком АТФ и НАДН. В
результате накапливается первый
метаболит ЦТК – цитрат. По градиенту
концентрации он перемещается в цитозоль,
расщепляется с образованием ацетил-SКоА,
который далее используется в биосинтезе
холестерола, жирных кислот и
триацилглицеролов. Оксалоацетат, также
образуемый из цитрата, восстанавливается
до яблочной кислоты и возвращается в
митохондрии *посредством малат-аспартатного
челнока (на рисунке не показан), *после
декарбоксилирования малата до пирувата
НАДФ-зависимым малик-ферментом.
Образованный НАДФН будет использован
при синтезе жирных кислот.
ипогенез
– это синтез жира из глицерина и жирных
к-т. Происходит в печени и жировой ткани.
Глицерин и жирные к-ты должны быть в
активной форме. В жировой тк глицеролкиназа
отсутствует, поэтому активная форма
обр-ся из ДОАФ – метаболита гликолиза
(из глюкозы). Синтез жира протекает в
адбсортивный период (после еды). Молекулы
жира в адипоцитах объединяются крупной
каплей и явл-ся компактной формой
хранения Е запасов. Обмен жира в жировой
тк протекает очень активно: обновляется
полностью за несколько дней. В печени
ежесуточно обр-ся 20-50г жира, который
поступает в кровь в составе ЛПОНП.
Ключевой фермент: ацилтрансфераза.
Активируют: инсулин, эстрогены и АТФ.
Ингибируют: катехоламины, СТГ, йодтиронины,
АКТГ, АДФ.Синтез
нейтральных жиров
происходит за счет этерификации
глицеро-1-фосфата двумя активированными
жирными кислотами. Фосфатная группа
образованной фосфатидной кислоты
отщепляется фосфатазами, что приводит
к образованию диацилглицерина, который
далее реагирует с другой активированной
жирной кислотой, образуя триацилглицерин.
Триацилглицерины составляют энергетическое
депо организма. Они обладают очень
высокой теплотой окисления, равной 37,6
кДж/моль. Жиры локализованы в жировых
клетках (адипоцитах) и характеризуются
высокой скоростью метаболизма. Их
превращение непосредственно регулируется
гормонами, в частности инсулином и
адреналином. Реакции биосинтеза
липидов
могут идти в гладкой эндоплазматической
сети клеток всех органов. Субстратом
для синтеза жиров de novo является глюкоза.
Как известно, попадая в кл, глюкоза
превращается в гликоген, пентозы и
окисляется до пировиноградной кислоты.
При высоком поступлении глюкоза
используется для синтеза гликогена, но
этот вариант ограничивается объемом
клетки. Поэтому глюкоза "проваливается"
в гликолиз и превращается в пируват
либо напрямую, либо через пентозофосфатный
шунт. Во втором случае образуется НАДФН,
который понадобится впоследствии для
синтеза жирных к-т. Пируват переходит
в митохондрии и декарбоксилируется в
ацетил-SКоА и вступает в ЦТК. Однако в
состоянии покоя, при отдыхе, при наличии
избыточного количества энергии в клетке
реакции ЦТК (в частности,
изоцитратдегидрогеназная реакция)
блокируются избытком АТФ и НАДН. В
результате накапливается первый
метаболит ЦТК – цитрат. По градиенту
концентрации он перемещается в цитозоль,
расщепляется с образованием ацетил-SКоА,
который далее используется в биосинтезе
холестерола, жирных кислот и
триацилглицеролов. Оксалоацетат, также
образуемый из цитрата, восстанавливается
до яблочной кислоты и возвращается в
митохондрии *посредством малат-аспартатного
челнока (на рисунке не показан), *после
декарбоксилирования малата до пирувата
НАДФ-зависимым малик-ферментом.
Образованный НАДФН будет использован
при синтезе жирных кислот.
Голодание, мышечная работа, покой в постабсорбтивный период. В постабсорбтивный период и при голодании хиломикроны и ЛПОНП в крови отсутствуют. Так как данному состоянию обычно сопутствует гипогликемия, то для ее компенсации из поджелудочной железы секретируется глюкагон. Под влиянием глюкагона и других гормонов в жировых депо активируется расщепление ТАГ до жирных кислот и глицерола (липолиз). Транспорт жирных кислот, вышедших в кровь, осуществляется альбумином. При физической работе гормоны адреналин, соматотропин и глюкокортикоиды, влияя на адипоциты, также вызывают в них липолиз и выход жирных кислот в кровь. В комплексе с альбумином эти кислоты главным образом доставляются в мышцу для обеспечения мышечного сокращения. В состоянии покоя, когда процессы пищеварения уже закончились, при краткосрочном и длительном голодании, при физической нагрузке в большинстве клеток, кроме нейронов и эритроцитов, жирные кислоты сгорают в процессах β-окисления и ЦТК, обеспечивая 50% и более всей энергии клетки. В печени при длительном голодании (более 20 часов) жирные кислоты направляются в кетогенез на синтез кетоновых тел. Кетоновые тела далее разносятся по организму, преобразуются в ацетил-SКоА и используются для энергетического обеспечения клеток.
24. Биосинтез жирных кислот: последовательность реакций, физиологическое значение, регуляция.
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-SКоА из митохондрий в цитозоль:*может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении, *обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
П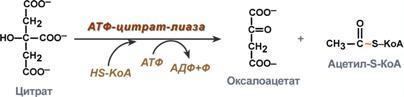
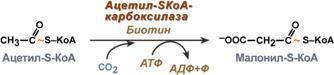 оступающий
из митохондрий цитрат в цитозоле
расщепляется АТФ-цитрат-лиазой до
оксалоацетата и ацетил-SКоА. Оксалоацетат
в дальнейшем восстанавливается до
малата, и последний либо переходит в
митохондрии (малат-аспартатный челнок),
либо декарбоксилируется в
пируватмалик-ферментом ("яблочный"
фермент).
оступающий
из митохондрий цитрат в цитозоле
расщепляется АТФ-цитрат-лиазой до
оксалоацетата и ацетил-SКоА. Оксалоацетат
в дальнейшем восстанавливается до
малата, и последний либо переходит в
митохондрии (малат-аспартатный челнок),
либо декарбоксилируется в
пируватмалик-ферментом ("яблочный"
фермент).
3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН. В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой. Удлинение цепи жирных кислот
С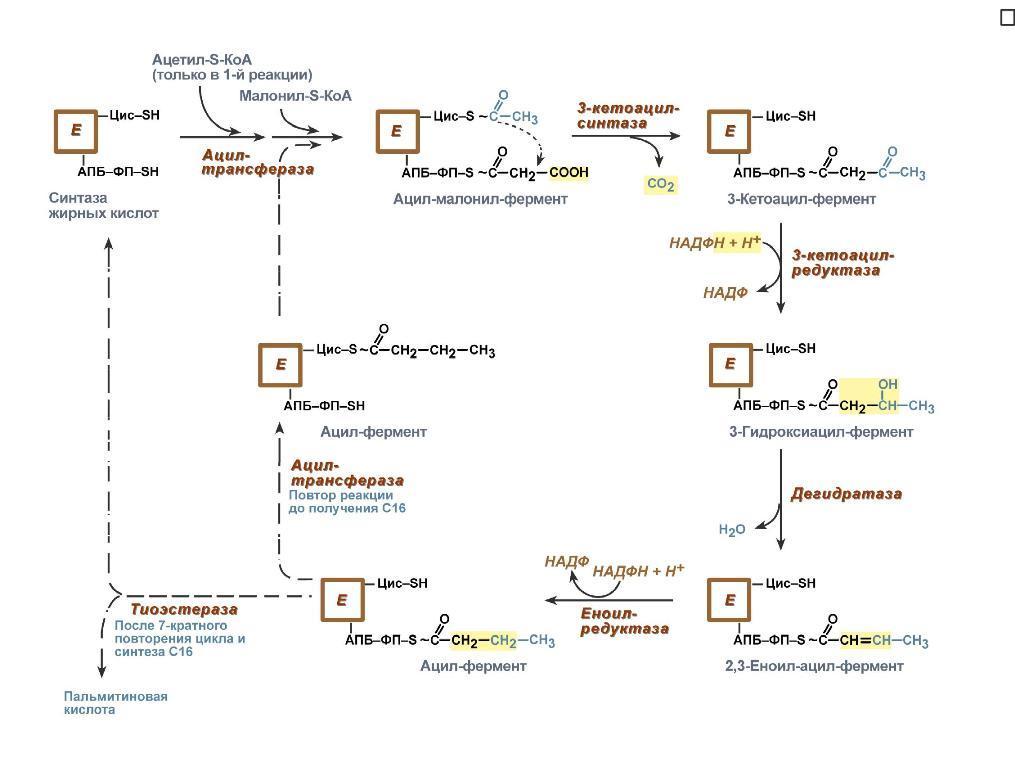 интезированная
пальмитиновая кислота при необходимости
поступает в эндоплазматический ретикулум
или в митохондрии. Здесь с участием
малонил-S-КоА и НАДФН цепь удлиняется
до С18 или С20. Удлиняться могут и
ненасыщенные жирные кислоты (олеиновая,
линолевая, линоленовая) с образованием
производных эйкозановой кислоты (С20).
Но двойная связь животными клетками
вводится не далее 9 атома углерода,
поэтому ω3- и ω6-полиненасыщенные жирные
кислоты синтезируются только из
соответствующих предшественников.
интезированная
пальмитиновая кислота при необходимости
поступает в эндоплазматический ретикулум
или в митохондрии. Здесь с участием
малонил-S-КоА и НАДФН цепь удлиняется
до С18 или С20. Удлиняться могут и
ненасыщенные жирные кислоты (олеиновая,
линолевая, линоленовая) с образованием
производных эйкозановой кислоты (С20).
Но двойная связь животными клетками
вводится не далее 9 атома углерода,
поэтому ω3- и ω6-полиненасыщенные жирные
кислоты синтезируются только из
соответствующих предшественников.
Синтезир-ся в орг-ме в основном пальмитиновая к-та. При необходимости ж к-ты с большим числом углеродных атомов. Ненасыщенные ж к-ты обр-ся на мембранах ЭПС с участием О2, НАДН и В5. Под воздействием ферментов десатураз обр-ся пальмитиновая и олеиновая к-ты. Полиненасыщенные ж к-ты (линолевая, арахидоновая, линоленовая) должны поступать с пищей. Источником углевода для синтеза ж к-т служит ацетилКоА, обр-ся при распаде углеводов. Избыток углеводов, поступающих в орг-м трансформир-ся в ж к-ты, а затем в жиры.
Лимитирующим ферментом является ацетил-КоАкарбоксилаза. Аллостерические активаторы — АТФ и цитрат, ингибиторы — жирные кислоты с длинной цепью. Инсулин, эстрогены активиру¬ют, катехоламины и стресс ингибируют синтез жирных кислот. Значение:при распаде УВ обр ацетил-Коа, который используется в синтезе ЖК, т.о. избыток УВ запасается в виде жира.
25. Пути образования и использования ацетил-КоА. Биосинтез и значение кетоновых тел. Пределы изменений концентрации кетоновых тел в крови в норме, при голодании и сахарном диабете.
А![]()
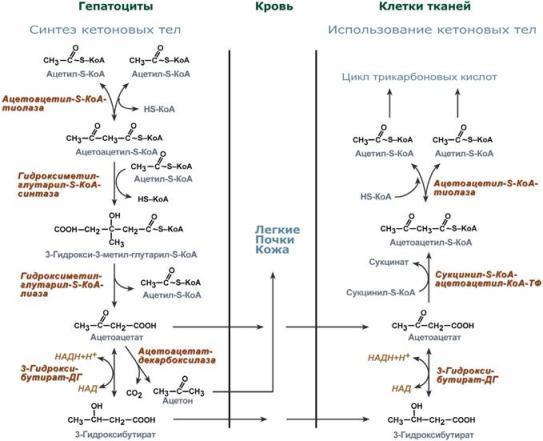 цетилКоА-
это центральный метаболит липидного
обмена.
цетилКоА-
это центральный метаболит липидного
обмена.
Источники: 1)Глюкоза 2)глицерин 3)АК} (при кратковременной напряженной мышечной работе) 4)Жирные к-ты (в-окисление при длительной мышечной работе, голодании, на холоде, при беременности и сахарном диабете). Пути использования образовавшегося ацетилКоА зависят от функционального состояния клетки (энергетический заряд) и ее специфики. Если в кл достаточно АТФ, то он используется на синтез ж к-т,т.к. АТФ активирует ключевой фермент ситеза ж к-т, а их накопление стимулирует синтез жира. Распад жира тормозится и в-окисление при этом тоже тормозится. Напряженная мышечная работа, стресс, увел-ие секреции катехоламинов активирует липолиз, в-окисление ж к-т; в этом случае актив-ся синтез кетоновых тел и ЦТК.
Пути использования: 1. окисляется в цикле Кребса(90%); 2. используется в синтезе ЖК (9%) 3. Образование В-гидрокси-в-метилглутарилКоА (а из него либо холестерин, либо кетоновые тела -1%)
При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс "трудоемкий", а нервная ткань вообще неспособна окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела. К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон. Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетонов. Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола. В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот. Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой. Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. Реакции утилизации кетоновых тел примерно совпадают с обратным направлением реакций синтеза. В цитозоле 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
Регуляция синтеза кетоновых тел. Регуляторный фермент синтеза кетоновых тел - ГМГ-КоА синтаза.
*ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови. Концентрация жирных кислот в крови увеличивается при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или физической работе.
*ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
*Когда поступление жирных кислот в клетки печени увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным.
*Если поступление жирных кислот в клетки печени уменьшается, то, соответственно, увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Кетоновые тела образуются в печени и выполняют следующие функции:1. Энергетическая. Скелетная и сердечная мышцы, мозг и др внепеченочные ткани обеспечивают энергетические потребности за счет катаболизма кетоновых тел. Печень не может окислять кетоновые тела. 2.необходимы для образования миелиновых оболочек нервов и белого вещества головного мозга.
Утилизация кетоновых тел происходит в митохондриях. Бета-гидроксибутират превращается в ацетоацетат, а ацетоацетат вступает в реакцию с промежуточным продуктом ЦТК - сукцинил-КоА. При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе. β-Гидроксибутират (рис. 8-34), попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сук-цинил-КоА - донором КоА: Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат
Реакцию катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза. Этот фермент не синтезируется в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их "на экспорт". Кетоновые тела - хорошие топливные молекулы; окисление одной молекулы β-гидроксибутирата до СО2 и Н2О обеспечивает синтез 27 молекул АТФ. Эквивалент одной макроэргической связи АТФ (в молекуле сукцинил-КоА) используется на активацию ацетоацетата, поэтому суммарный выход АТФ при окислении одной молекулы β-гидроксибутирата - 26 молекул.
В норме процессы синтеза и использования кетоновых тел уравновешены, поэтому концентрация кетоновых тел в крови и в тканях обычно очень низка, и составляет 0,12-0,30 ммоль/л.. В норме в крови кол-во КТ 1-3 мг, в моче 40мг. При сахарном диабете 10-50 мг в моче. Накопление кетоновых тел в организме называется кетозом.Он сопровождается кетонемией и кетонурией. Физиологиеский кетоз – при голодании, тяжелой мышечной работе, у новорожденных. Патологический – при сахарном диабете. Однако при общем или при углеводном голодании может нарушаться баланс между образованием и утилизацией кетоновых тел. Это связано с тем, что скорость образования кетоновых тел зависит от скорости -окисления жирных кислот в печени, а процесс -окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Усиление липолиза может происходить под действием гормона адреналина, при мышечной работе, при голодании. При недостатке инсулина (сахарный диабет) также происходит усиление липолиза. При усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании.
Постепенное истощение запасов углеводов при сахарном диабете приводит к относительному отставанию утилизации кетоновых тел от кетогенеза. Причина отставания: не хватает сукцинил-КоА и ЩУК, которые, в основном, являются продуктом обмена углеводов. Поэтому верно выражение: "Жиры сгорают в пламени углеводов". Это означает, что для эффективного использования продуктов распада жира необходимы продукты углеводного обмена: сукцинил-КоА и ЩУК.
Т.о., при углеводном голодании концентрация кетоновых тел в крови увеличивается. На 3-й день голодания концентрация кетоновых тел в крови будет примерно 2-3 ммоль/л, а при дальнейшем голодании - гораздо более высокой. Это состояние называют гиперкетонемия. У здоровых людей при мышечной работе и при голодании наблюдается гиперкетонемия, но она незначительна.
Похожая ситуация характерна для сахарного диабета. При сахарном диабете клетки постоянное сильнейшее углеводное голодание, потому что глюкоза плохо проникает в клетки. Наблюдается активация липолиза и повышается образование кетоновых тел. При тяжелых формах сахарного диабета концентрация кетоновых тел в крови может быть еще выше, и достигать опасных для жизни значений: до 20 ммоль/л и более. Все кетоновые тела являются органическими кислотами. Их накопление приводит к сдвигу pH в кислую сторону. В клинике повышение концентрации кетоновых тел в крови называется гиперкетонемия, а сдвиг pH при этом в кислую сторону - кетоацидоз. Нарушается работа многих ферментативных систем. Увеличение концентрации ацетоацетата приводит к ускоренному образованию ацетона. Ацетон - токсичное вещество (органический растворитель). Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего - клетки нервной ткани. Это может проявляться потерей сознания (гипергликемическая кома). В очень тяжелых случаях может наступить гибель организма. Организм пытается защититься, поэтому часть кетоновых тел удаляется с мочой. Появление кетоновых тел в моче - это кетонурия. Для распознавания гипер- и гипогликемической комы применяется экспресс-диагностика кетоновых тел. Основана на том, что гиперкетонемия приводит к выведению кетоновых тел с мочой (кетонурия). Поэтому проводят цветную реакцию на наличие кетоновых тел в моче. Раньше диагноз ставили по запаху ацетона изо рта больного при гипергликемической коме (запах гнилых яблок).
26. Синтез холестерина, регуляция. Биологическое значение холестерина. Атеросклероз. Факторы риска для развития атеросклероза.
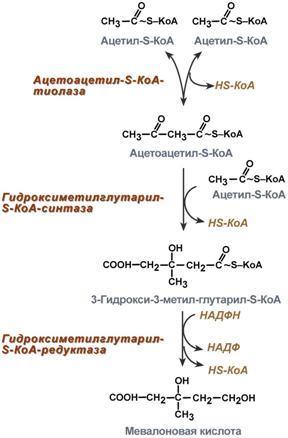
Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень. В печени синтезируется более 50% холестерола, в тонком кишечнике - 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг. Холестерин (Холестерол) представляет собой одноатомный спирт. Включает кольца циклопентанпергидрофенантрена и 8-углеродную боковую цепь. Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН. Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов:1. Синтез мевалоновой кислоты. Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2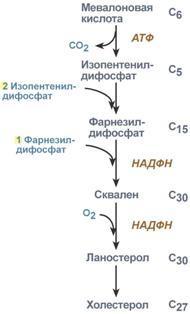 .Синтез
изопентенилдифосфата.
На этом этапе три остатка фосфат
присоединяются к мевалоновой кислоте,
затем она декарбоксилируется и
дегидрируется.
.Синтез
изопентенилдифосфата.
На этом этапе три остатка фосфат
присоединяются к мевалоновой кислоте,
затем она декарбоксилируется и
дегидрируется.
3. После объединения трех молекул изопентенилдифосфата синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекул ы приводит к появлению холестерола.
Регуляция синтеза. Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Ковалентная модификация при гормональной регуляции: инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние. Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина. Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
3. Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Этерификация холестерола. В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул - эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА:холестеролаиилтрансферазой). Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин:холестеролацилтрансфераза). Эфиры холестерола - форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Биологическая роль: 1)В печени из него синт-ся желчные к-ты, необходимые для эмульгирования жира, активации липазы и всасывания переваренных продуктов; 2)Под действием УФ-лучей в подкожной жировой клетчатке обр-ся витамин Д; 3) В эндокринных железах из холестерина образуются в коре надпочечников ГКС, минералокортикоиды, слабыне эстрогены и андрогены, в половых железах – половые гормоны; 4)Холестерин входит в состав всех плазматических мембран. Соотношение холестерин/фосфолипиды =1:1 Во внешнем слое мембран нах-ся 2/3, а во внутр-м 1/3 часть холестерина. Во внутриклеточных мембранах содержание холестерина в 10 раз меньше. Наличие его в мембране уменьшает подвижность ж к-т, снижает диффузию белков и липидов. Следствием этого яв-ся влияние на ф-ии мембранных белков: рецепторы, ферменты и переносчики. Концентрация холестерола в крови взрослых людей составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и, как правило, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией. Одним из самых ярких и клинически значимых нарушений обмена липопротеинов является атеросклероз.
Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии. Стадии атеросклероза. Морфологически выделяют четыре стадии атеросклероза. Первая и вторая стадии распространены широко и при правильном питании являются обратимыми, 3 и 4 стадии уже имеют клиническое значение и необратимы.
1 стадия – повреждение эндотелия. Это "долипидная" стадия, обнаруживается даже у годовалых детей. Изменения этой стадии неспецифичны и ее могут вызывать: дислипопротеинемия, гипертензия, повышение вязкости крови, курение, вирусные и бактериальные инфекции, свинец, кадмий и т.п. На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости. Внешне это проявляется в разрыхлении и истончении (вплоть до исчезновения) защитного гликокаликса на поверхности эндотелиоцитов, расширении межэндотелиальных щелей. Это приводит к усилению выхода моноцитов и липопротеинов (ЛПНП и ЛПОНП) в интиму.
2 стадия – стадия начальных изменений. Отмечается у большинства детей и молодых людей.
Поврежденный эндотелий и активированные тромбоциты вырабатывают медиаторы воспаления, факторы роста, эндогенные окислители. В результате через поврежденный эндотелий в интиму сосудов еще более активно проникают моноциты и способствуют развитию воспаления. Непосредственой биохимической причиной атеросклероза является модификация липопротеинов в зоне воспаления, в основном окислением, гликозилированием, ацетилированием. Например, окисление ЛПНП нарастает при недостаточной активности антиоксидантных систем – гиповитаминозах Е и С, нехватке металлов (железо, селен, медь, цинк), входящих в состав антиоксидантных ферментов каталазы, пероксидазы, супероксиддисмутазы. Гликозилирование белков ЛПНП ускоряется при сахарном диабете или при других хронических гипергликемиях. Такие модифицированные липопротеины теряют способность связываться с апоВ-100-рецептором и проникать в клетки-мишени и, в результате, накапливаются в крови и в интиме сосудов. Моноциты, преобразуясь в макрофаги, активно поглощают измененные липопротеины при участии "мусорных" рецепторов. Принципиальным моментом является то, что поглощение модифицированных липопротеинов макрофагами идет без участия апоВ‑100-рецепторов, а, значит, нерегулируемо.Под действием факторов роста гладкомышечные клетки медии мигрируют в интиму и начинают пролиферировать, превращаясь в макрофагоподобные клетки. Они также накапливают модифицированные ЛПНП. Накопление липидов в макрофагах быстро исчерпывает невысокие возможности клеток по утилизации свободного и этерифицированного ХС. Они переполняются стероидами и превращаются в пенистые клетки. Внешне на эндотелии появляются липидные пятна и полоски.
3 стадия – стадия поздних изменений. Внешне проявл-ся как выступание поверхности в просвет сосуда. Стадия характеризуется следующими особенностями: *продуцирование бывшими гладкими миоцитами коллагена, эластина и гликозаминогликанов (накопление межклеточного вещества), *пролиферация и гибель пенистых клеток (апоптоз), *накопление в межклеточном пространстве свободного ХС и этерифицированного ХС, *инкапсулирование холестерола и формирование фиброзной бляшки.
4 стадия – стадия осложнений. На этой стадии происходят: кальцификация бляшки и ее изъязвление, приводящее к липидной эмболии, тромбоз из-за адгезии и активации тромбоцитов, разрыв сосуда.
Основы лечения. В лечении атеросклероза обязательно должны быть две составляющие: диета и медикаменты. Целью лечения является снижение концентрации общего ХС плазмы, ХС ЛПНП и ЛПОНП, повышение концентрации ЛПВП. Диета: 1. Обеспечение организма витаминами: аскорбиновой кислотой, пантотеновой (коэнзим А) и никотиновой (НАДФ) кислотами, что способствует превращению холестерола печени в желчные кислоты (см синтез желчных кислот). Для снижения окислительной модификации ЛПНП необходим витамин Е.
2. Снижение калорийности пищи за счет углеводов и жиров. Жиры пищи должны включать равные доли насыщенных, мононенасыщенных и полиненасыщенных жиров. Доля жидких жиров, содержащих полиненасыщенные жирные кислоты (ПНЖК), должна быть около 30% от всех жиров, но не меньше 15 г/сут. Роль ПНЖК в лечении гиперхолестеролемии и атеросклероза сводится к: ограничению всасывания ХС в тонком кишечнике, активации синтеза фосфатидилхолина, что снижает вязкость желчи и облегчает ее отток в кишечник, усилению желчеотделения, снижению синтеза ЛПНП в печени и секреции их в кровь, увеличению синтеза ЛПВП и концентрации их в крови, что способствует удалению холестерина из тканей в печень.
3. Обеспечение организма чистой водой до физиологических норм (1,0-1.5 л/сут), что препятствует сгущению желчи.
4. Потребление высоких количеств овощей, содержащих целлюлозу (капуста, морковь, свекла) для усиления перистальтики кишечника, стимуляции желчеотделения и снижения всасывания ХС.
5. Умеренная физическая нагрузка – способствует синтезу ЛПВП и, значит, оттоку холестерина от тканей в печень.
Медикаменты: 1. Препараты ω6 и ω3 жирных кислот (Линетол, Эссенциале, Омеганол и т.п.) повышают концентрацию ЛПВП в плазме, ускоряют отток ЛПНП в печень, стимулируют желчеотделение.
2. Подавление всасывания ХС в желудочно-кишечном тракте – анионообменные смолы (Холестирамин, Холестид, Questran).
3. Препараты никотиновой кислоты подавляют мобилизацию жирных кислот из депо и снижают синтез ЛПОНП в печени, а, следовательно, и образование из них ЛПНП в крови.
4. Фибраты (клофибрат и т.п.) увеличивают активность липопротеинлипазы, ускоряют катаболизм ЛПОНП и хиломикронов, что повышает переход холестерола из них в ЛПВП и его эвакуацию в печень.
5. Статины (ловастатин, флувастатин) ингибируют ГМГ-S‑КоА-редуктазу, что снижает в 2 раза синтез ХС в печени и ускоряют его отток из ЛПВП в гепатоциты.
5. Подавление функции энтероцитов с помощью антибиотика неомицина, что снижает всасывание жиров.
6. Хирургическое удаление подвздошной кишки и прекращение реабсорбции желчных кислот.
Выделяют ряд факторов, увеличивающих риск развития этой болезни. К факторам риска относят: высокое содержание холестерина в крови; наличие сахарного диабета, гипертонии, ожирения; курение, наследственность, пожилой возраст, мужской пол.
27. Транспортные липопротеиды крови: особенности строения, состава и функций разных липопротеидов. Роль в обмене жиров и холестерина. Пре¬делы изменений концентрации жиров и холестерина в крови. Патология липидного обмена.
Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную, ферментативную и кофакторную функции.
Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов.
хиломикроны (ХМ),
липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП).
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. Липопротеины высокой и низкой плотности – за транспорт холестерола и жирных кислот в составе эфиров ХС.
Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности.В транспорте ТАГ к тканям можно выделить последовательность следующих событий:
1.Образование незрелых первичных ХМ в кишечнике.
2.Движение первичных ХМ через лимфатические протоки в кровь.
3.Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
4.Взаимодействие с липопротеинлипазой (ЛПЛ) эндотелия, которая отщепляет жирные кислоты от ТАГ. Жирные кислоты переходят непосредственно в данную ткань или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается и образуются остаточные ХМ.
5.Переход остаточных ХМ в гепатоциты и полный распад их структуры.
6.Синтез ТАГ в печени из пищевой глюкозы. Использование ТАГ, пришедших в составе остаточных ХМ.
7.Образование первичных ЛПОНП в печени.
8.Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
9.Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП).
10.Остаточные ЛПОНП переходят в гепатоциты и полностью распадаются, либо остаются в плазме крови. После воздействия на них печеночной ТАГ-липазы в синусоидах печени ЛПОНП превращаются в ЛПНП.
Липопротеины очень низкой плотности (пребеталипопротеиды):
-синтезируются в печени из эндогенных и экзогенных липидов,
-в их составе преобладают ТАГ, около 40% от массы составляют белок, фосфолипиды и холестерол (8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов),
-основным белком является апоВ-100, выполняющий структурную функцию,
-в норме концентрация 1,3-2,0 г/л,
-слабо атерогенны.
Функция: Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жиры, т.е. в те же ткани, что и хиломикроны (в сутки в печни обр-ся от 20 до 50 г жира на экспорт)
Метаболизм: 1. Первичные ЛПОНП образуются в печени из пищевых жиров, достигающих гепатоцитов с остаточными хиломикронами, и новосинтезированных из глюкозы жиров, содержат только апоВ-100;
2. В крови первичные ЛПОНП взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы.
3. Аналогично хиломикронам, на эндотелии капилляров ряда тканей зрелые ЛПОНП подвергаются воздействию липопротеинлипазы, которая находится на поверхности кл эндотелия сосудов с образованием свободных жирных кислот и глицерина. Жирные кислоты перемещаются в клетки органов и используются как Е материал, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани.
4. Остаточные ЛПОНП (также называемые липопротеины промежуточной плотности, ЛППП)
либо эвакуируются в гепатоциты посредством эндоцитоза, связанного с рецепторами к апоЕ и апоВ-100-белкам, либо после воздействия на них печеночной ТАГ-липазы (только в сосудах печени) превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП).
Липопротеины низкой плотности (ЛПНП или beta-липопротеипы):
Образуются в крови. Состоят из 25% белка и 75% липидов. Главным компонентом является холестерин (примерно50%) в виде эфиров с линолевой кислотой и фосфолипиды. У здоровых людей до 2/3 всего холестерина плазмы находится в составе ЛПНП. Они являются главным поставщиком холестерина в ткани. ЛПНП регулируют синтез холестерина de novo. Большинство ЛПНП являются продуктами расщепления ЛПОНП липопротеидлипазой. На клеточных мембранах имеются рецепторы для ЛПНП, они взаимодействуют с апопротеинами ЛПНП. После узнавания проникают в клетки путем эндоцитоза, там распадаются под действием ферментов гидролаз в лизосомах. Освободившийся холистерин идёт на построение мембран и метаболические нужды клеток. Функция: транспорт холестерина в ткани, в том числе в печени.
Липопротеины высокой плотности (ЛПВП или а-липопротеины):
Состав: 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. В поверхностном слое ЛПВПобразуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ). С помощью этого фермента остаток ж к-ты переносится с лицитина на свободный холестерин ЛПВП, превращая его в эфир (холестерид) и лизофосфотидилхолин. Холестерид является гидрофобным соединением, поэтому перемещается в ядро ЛПВП. Т.о. он нагружается эфирами холестерина, увел-ся в размерах и из дисковидного превращается в частицу сферической формы – зрелый ЛПВП. Далее он транспортируется в печень, где холестерин исп-ся на синтез желчных к-т. ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеидов и транспортируют его в печень, предотвращая накопление его в клетках. Концентрация ЛПВП меняется в зависимости от ритма питания. Их мах кол-во ч/з 4-5 часов после еды. Ч/з 10-12 часов хиломикронов 0%, ЛПОНП 15%, ЛПНП 60%, ЛПВП 25%.
ЛПОНП и ЛПНП считают атерогенными, то есть вызыва¬ющими атеросклероз. ЛПВП — антитиатерогенными.
Нарушения липидного обмена могут быть как первичными, так и вторичными, т.е. вызванными патологией эндокринной системы или компенсаторные при различных заболеваниях.
Нарушения переваривания и всасывания липидов сопровождаются развитием стеатореи (повышенное содержание липидов и жирных кислот в кале) и обусловливаются одной из следующих причин:
1.Дефицит панкреатической липазы, связанный с заболеваниями поджелудочной железы.
2.Дефицит желчи в кишечнике, обсуловленный заболеваниями печени или желчевыводящих путей.
3.Угнетение ферментных систем ресинтеза триглицеридов в стенке кишечника при его заболеваниях.
Повышение липопротеидов называется гиперлипопротеидемией. Главная опасность этого состояния связана с тем, что повыш-ся вер-ть возникновения атеросклероза. Вер-ть заболевания тем выше, чем больше отношение ЛПНП к ЛПВП в крови.
Атеросклероз -это патология, которая характеризуется отложением, главным образом, холестерина в стенке крупных сосудов (аорта, коронарные сосуды, сосуды мозга и т.д.) с образованием вначале пятен, полосок. Затем на их месте образуются утолщения (атеросклеротические бляшки). Эти липидные бляшки являются сво¬еобразным инородным телом, вокруг которого развивается со¬единительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы. В стенке сосудов есть два защитных механизма от избыточного отложения холестерина: Работа липопротеидлипазы, которая расщепляет жир липопротеидов, делает их меньше по размеру;ЛПВП, которые уносят холестерин.Ожирение: У нормально упитанного человека жиры составляют около 15% массы тела. При сбалансированном питании количество жира в организме не изменяется. При этом жиры жировой ткани все время обновляются, то есть одновременно идут липолиз и липогенез с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и физических нагрузках липолиз идет с большей скоростью, чем липогенез. В результате количество депонированного жира уменьшается. Если липогенез опережает липолиз, наступает ожирение. Наиболее частой причиной ожирения является несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при переедании (особенно углеводов, так как они легко переходят в жиры), при гиподинамии (при этом мобилизация жира идет с более низкой скоростью) и, особенно, при сочетании этих факторов. Кроме того, ожирение является характерным признаком многих эндокринных заболеваний. Генетические заболевания, при которых происходит неполное расщепление полимерных веществ и их накопление, получили название лизосомные болезни накопления, так как они обусловлены дефектами специфических лизосомальных гидролаз. В случае накопления липидов такие болезни называются липидозы. При липидозах нарушается нормальный катаболизм липидов до соответствующих мономеров. Болезнь Вольмана – редкое аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Проявляется в первые недели жизни рвотой, диареей и стеатореей, гепатоспленомегалией и двусторонним кальцинозом надпочечников. Больные умирают в возрасте до 6 мес. Болезнь Шюллера-Кристиана аутосомно-рецессивное заболевание характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Характерными являются деструктивные изменения в костях, остеопороз, мозжечковые расстройства. Заболевание обычно начинается в возрасте до 10 лет, реже позднее. Мужчины болеют в 2 раза чаще, чем женщины. Течение заболевания прогрессирующее. Дефектный фермент неизвестен. Болезнь Гоше – отложение цереброзидов в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. Возникает в связи с аутосомно-рецессивным отсутствием гликоцереброзидазы (β-глюкозидазы). Основными симптомами заболевания являются спленомегалия, увеличение печени и селезенки, а также изменения в костях, проявляющиеся в виде остеопороза. При болезни Нимана-Пика наблюдается отложение сфингомиелина в клетках различных органов из-за дефицита сфингомиелиназы. Болезнь наследуется аутосомно-рецессивно, проявляется резким увеличением печени и селезенки, замедлением психического развития ребенка, появлением слепоты и глухоты. Чаще всего дети погибают в возрасте до 2 лет. Болезнь Тея-Сакса (амавротическая семейная идиотия) является результатом дефекта N-ацетилгексозаминидазы, при котором происходит отложение ганглиозидов в клетках головного мозга, что сопровождается атрофией зрительных нервов, слепотой, слабоумием и смертью в младенческом возрасте.
28. Функции пептидов и белков. Суточная потребность в белках. Переваривание белков. Регуляция переваривания белков. Патология переваривания и всасывания белков.
Белки играют фундаментальную роль в формировании и поддержании структуры и функций живых организмов. В количественном отношении белки занимают первое место среди всех содержащихся в живой клетке макромолекул. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций:
1.Структурная. Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности),
К данной функции можно отнести участие в создании органелл – рибосомы.
2.Ферментативная. Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
3.Гормональная. Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон.
4.Рецепторная. Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
5.Транспортная. Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны - Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки).
6.Резервная. В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
7.Сократительная. Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
8.Защитная. Защитной функцией при инфекциях обладают иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны.
Для поддержания азотистого равновесия достаточно употреблять 30-50 г белков в сутки. Однако такое количество не обеспечивает сохранения работоспособности и здоровья человека. Принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и другие факторы. Взрослый человек при средней физической нагрузке должен получать 100-120 г белков в сутки. При тяжёлой физической работе эта норма увеличивается до 130-150 г. Детям до 12 лет достаточно 50-70 г белков в сутки. При этом подразумевается, что в пишу входят разнообразные белки животного и растительного происхождения. Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие, или, по другому, это состояние, когда количество выводимого азота равно количеству получаемого (Vпоступ= Vвывод). Если синтез белков превышает скорость их распада, то количество выводимого азота снижается и разность между поступающим азотом и выводимым (Vпоступ – Vвывод) становится положительной. В этом случае говорят о положительном азотистом балансе. Положительный азотистый баланс наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, спортсменов при наборе формы, т.е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках.При возрастании доли выводимого азота наблюдается отрицательный азотистый баланс. Отрицательный баланс отмечается у больных и голодающих. Всемирная организация здравоохранения рекомендует принимать не менее 42 г полноценного белка в сутки – это физиологический минимум. Только в этом случае в организме наступает азотистое равновесие. Основной трудностью при расчете нормативов потребления белков является разнообразие их аминокислотного состава и неодинаковая потребность организма в разных аминокислотах. В связи с этим введены критерии качества белка:
а) соотношение заменимых и незаменимых аминокислот – в белке должно быть не менее 32% незаменимых АК,
б)близость аминокислотного состава белка к аминокислотному составу усредненного белка тела человека,
в)легкость переваривания в ЖКТ.
Расщепление белков до АК начинается в желудке, продолжается в 12-перстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения АК могут происходить также в толстом кишечнике под влиянием микрофлоры. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Регуляция желудочного пищеварения. Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он обеспечивает секрецию гистамина. Гастрин выделяется специфичными G-клетками:
- в ответ на раздражение механорецепторов,- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков), - под влиянием n.vagus.
Гистамин, образующийся в энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам) слизистой оболочки желудка, взаимодействует с Н2-рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты.
З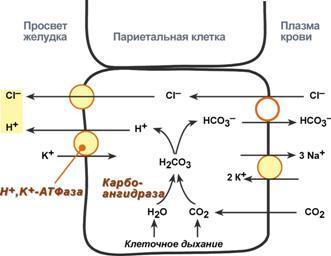 акисление
желудочного содержимого подавляет
активность G-клеток и по механизму
обратной отрицательной связи снижает
секрецию гастрина и желудочного сока.
акисление
желудочного содержимого подавляет
активность G-клеток и по механизму
обратной отрицательной связи снижает
секрецию гастрина и желудочного сока.
Соляная кислота. Одним из компонентов желудочного сока является HCL. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии. При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения. Функции соляной кислоты:
1.денатурация белков пищи,
2.бактерицидное действие,
3.высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания,
4.превращение неактивного пепсиногена в активный пепсин,
5.снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
после перехода в 12-перстную кишку – стимуляция секреции панкреатического сока.
П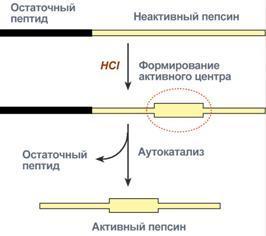
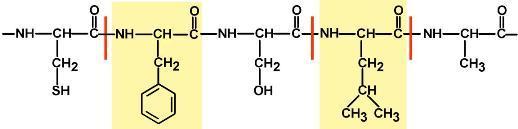 епсин.Пепсин
является эндопептидазой, то есть он
расщепляет внутренние пептидные связи
в молекулах белков и пептидов.
Синтезируется в главных клетках желудка
в виде неактивного профермента
пепсиногена, в котором активный центр
"прикрыт" N-концевым фрагментом.
При наличии соляной кислоты конформация
пепсиногена изменяется таким образом,
что "раскрывается" активный центр
фермента, который отщепляет остаточный
пептид (N-концевой фрагмент), т.е. происходит
аутокатализ. В результате образуется
активный пепсин, активирующий и другие
молекулы пепсиногена. Оптимум рН для
пепсина 1,5-2,0. Пепсин, не обладая высокой
специфичностью, гидролизует пептидные
связи, образованные аминогруппами
ароматических АК (тирозина, фенилаланина,
триптофана), аминогруппами и карбоксигруппами
лейцина, глутаминовой к-ты и т.д.
епсин.Пепсин
является эндопептидазой, то есть он
расщепляет внутренние пептидные связи
в молекулах белков и пептидов.
Синтезируется в главных клетках желудка
в виде неактивного профермента
пепсиногена, в котором активный центр
"прикрыт" N-концевым фрагментом.
При наличии соляной кислоты конформация
пепсиногена изменяется таким образом,
что "раскрывается" активный центр
фермента, который отщепляет остаточный
пептид (N-концевой фрагмент), т.е. происходит
аутокатализ. В результате образуется
активный пепсин, активирующий и другие
молекулы пепсиногена. Оптимум рН для
пепсина 1,5-2,0. Пепсин, не обладая высокой
специфичностью, гидролизует пептидные
связи, образованные аминогруппами
ароматических АК (тирозина, фенилаланина,
триптофана), аминогруппами и карбоксигруппами
лейцина, глутаминовой к-ты и т.д.
Гастриксин. Его оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых АК
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи.
Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способом ограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы.
Р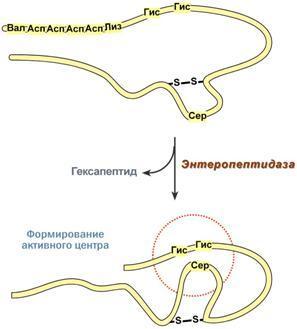 егуляция
кишечного пищеварения.
В кишечнике под влиянием соляной кислоты,
поступающей из желудка в составе пищевого
комка, начинается секреция гормона
секретина, который с током крови достигает
поджелудочной железы и стимулирует
выделение жидкой части панкреатического
сока, богатого карбонат-ионами (HCO3–). В
результате рН химуса повышается до
7,0-7,5. Благодаря работе желудочных
ферментов в химусе имеется некоторое
количество аминокислот, вызывающих
освобождение холецистокинина-панкреозимина.
Он стимулирует секрецию другой, богатой
проферментами, части поджелудочного
сока, и секрецию желчи. Нейтрализация
кислого химуса в двенадцатиперстной
кишке происходит также при участии
желчи. Формирование желчи (холерез) идет
непрерывно, не прекращаясь даже при
голодании.
егуляция
кишечного пищеварения.
В кишечнике под влиянием соляной кислоты,
поступающей из желудка в составе пищевого
комка, начинается секреция гормона
секретина, который с током крови достигает
поджелудочной железы и стимулирует
выделение жидкой части панкреатического
сока, богатого карбонат-ионами (HCO3–). В
результате рН химуса повышается до
7,0-7,5. Благодаря работе желудочных
ферментов в химусе имеется некоторое
количество аминокислот, вызывающих
освобождение холецистокинина-панкреозимина.
Он стимулирует секрецию другой, богатой
проферментами, части поджелудочного
сока, и секрецию желчи. Нейтрализация
кислого химуса в двенадцатиперстной
кишке происходит также при участии
желчи. Формирование желчи (холерез) идет
непрерывно, не прекращаясь даже при
голодании.
Трипсин. Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина. Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина. Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу. Параллельно трипсин участвует в переваривании пищевых липидов (посмотреть), активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов.
Химотрипсин.
Образуется из химотрипсиногена при
участии трипсина и промежуточных, уже
активных, форм химотрипсина, которые
выстригают два дипептида из цепи
профермента. Три образованных 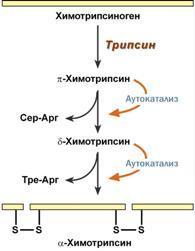 фрагмента
удерживаются друг с другом посредством
дисульфидных связей. Фермент специфичен
к пептидным связям, образованным с
участием карбоксильных групп фенилаланина,
тирозина и триптофана, т.е. так же, как
пепсин.
фрагмента
удерживаются друг с другом посредством
дисульфидных связей. Фермент специфичен
к пептидным связям, образованным с
участием карбоксильных групп фенилаланина,
тирозина и триптофана, т.е. так же, как
пепсин.
Эластаза. Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Карбоксипептидазы. Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Аминопептидазы. Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы. Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Лизосомы энтероцитов. Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами. При заболеваниях ЖКТ и нарушении переваривания, при диете с избытком белков часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами – развивается гниение белков в кишечнике.
При различныз заболеваниях ЖКТ в желудке нарушается выделение НС1 и пепсиеногена,переваривание белков снижается.Встречаются изменения кислотности желуд сока.Повыш кислотность лелуд сока сопровождается диареей,изжогой и может быть симптомом язвы желудка и12перстной кишки.Понижен кислотность при некоторых видах гастрита.Переваривание в кишечнике6 низкое значение рн химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь,он стимулирует выделение из поджел железы в тонкий кишечник панкреатич сока.Поступление пептидов в тонкий кишечник вызывает секрецию др белкового гормона-холецистокенина,который стимулирует выделение панкреатич ферментов. Под действие ферментов поджел железы и кл кишечника завершается переваривание белков
Нарушения: Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (АК) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать АТ молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый АТ и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого кол-ва нативных белков, достаточного для обеспечения иммунной реакции. Подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии (нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы. При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт АК в ткани и их метаболизм в клетках.
29. Источники АКи пути их использования. Заменимые и незаменимые АК. Биосинтез заменимых АК с использованием глюкозы. Источники азота для АК. Глюконеогенез из АК: регуляция, физиологическое значение.
А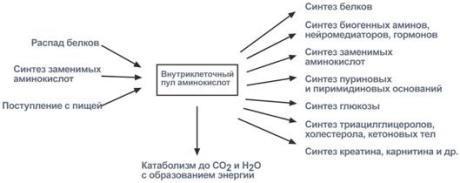
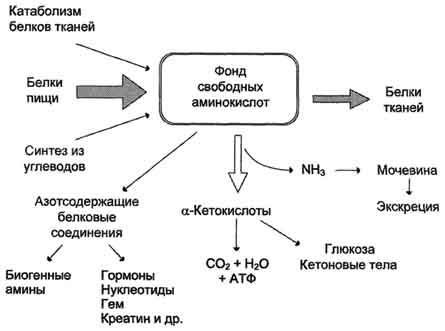 минокислоты,
класс органических соединений,
объединяющих в себе свойства кислот и
аминов, т.е. содержащих наряду с
карбоксильной группой - COOH аминогруппу
- NH2 Аминокислоты играют очень большую
роль в жизни организмов, т.к. все белковые
вещества построены из аминокислот. Все
белки при полном гидролизе (расщеплении
с присоединением воды) распадаются до
свободных аминокислот, играющих роль
мономеров в полимерной белковой молекуле.
Источники АК в клетке – поступление с
пищей, из крови, распад собственных
внутриклеточных белков и синтез заменимых
аминокислот, кетокислот. Основным
экзогенными источником аминокислот
являются белки пищи. Белки переводятся
в доступную для организма форму при
переваривании под действием протеолитических
ферментов, входящих в состав
желудочно-кишечных секретов. Свободные
аминокислоты всасываются и после
транспорта кровью включаются в клетках
в различные пути использования. Путь
дальнейшего превращения аминокислот
зависит от вида и функции клетки, условий
ее существования и гормональных влияний.
Спектр веществ, получаемых клеткой из
аминокислот, чрезвычайно широк.
минокислоты,
класс органических соединений,
объединяющих в себе свойства кислот и
аминов, т.е. содержащих наряду с
карбоксильной группой - COOH аминогруппу
- NH2 Аминокислоты играют очень большую
роль в жизни организмов, т.к. все белковые
вещества построены из аминокислот. Все
белки при полном гидролизе (расщеплении
с присоединением воды) распадаются до
свободных аминокислот, играющих роль
мономеров в полимерной белковой молекуле.
Источники АК в клетке – поступление с
пищей, из крови, распад собственных
внутриклеточных белков и синтез заменимых
аминокислот, кетокислот. Основным
экзогенными источником аминокислот
являются белки пищи. Белки переводятся
в доступную для организма форму при
переваривании под действием протеолитических
ферментов, входящих в состав
желудочно-кишечных секретов. Свободные
аминокислоты всасываются и после
транспорта кровью включаются в клетках
в различные пути использования. Путь
дальнейшего превращения аминокислот
зависит от вида и функции клетки, условий
ее существования и гормональных влияний.
Спектр веществ, получаемых клеткой из
аминокислот, чрезвычайно широк.
Г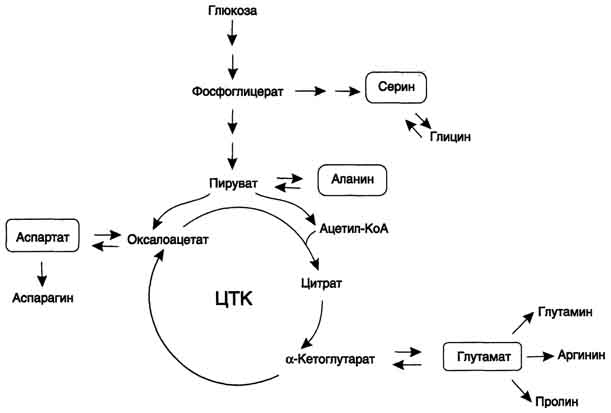 лавным
путь испол-я - синтез собственных белков.
АК используются для синтеза других
азотсодержащих соединений, например
таких, как тироксин, адреналин, гистамин,
выполняющих специфические функции.
Аминокислоты используются также как
источники энергии, включаясь в путь
катаболизма. Многие растения и бактерии
могут синтезировать все необходимые
им аминокислоты из простых неорганических
соединений. Большинство аминокислот
синтезируются в теле человека и животных
из обычных безазотистых продуктов
обмена веществ и усвояемого азота.
Однако восемь аминокислот (валин,
изолейцин, лейцин, лизин, фенилаланин,
метионин, треонин, триптофан) являются
незаменимыми, т.е. не могут синтезироваться
в организме животных и человека, и должны
доставляться с пищей. Суточная потребность
взрослого человека в каждой из незаменимых
аминокислот составляет в среднем около
1 грамма. При недостатке этих аминокислот
(чаще триптофана, лизина, метионина) или
в случае отсутствия в пище хотя бы одной
из них невозможен синтез белков и многих
других биологически важных веществ,
необходимых для жизни. Гистидин и аргинин
синтезируются в животном организме.
лавным
путь испол-я - синтез собственных белков.
АК используются для синтеза других
азотсодержащих соединений, например
таких, как тироксин, адреналин, гистамин,
выполняющих специфические функции.
Аминокислоты используются также как
источники энергии, включаясь в путь
катаболизма. Многие растения и бактерии
могут синтезировать все необходимые
им аминокислоты из простых неорганических
соединений. Большинство аминокислот
синтезируются в теле человека и животных
из обычных безазотистых продуктов
обмена веществ и усвояемого азота.
Однако восемь аминокислот (валин,
изолейцин, лейцин, лизин, фенилаланин,
метионин, треонин, триптофан) являются
незаменимыми, т.е. не могут синтезироваться
в организме животных и человека, и должны
доставляться с пищей. Суточная потребность
взрослого человека в каждой из незаменимых
аминокислот составляет в среднем около
1 грамма. При недостатке этих аминокислот
(чаще триптофана, лизина, метионина) или
в случае отсутствия в пище хотя бы одной
из них невозможен синтез белков и многих
других биологически важных веществ,
необходимых для жизни. Гистидин и аргинин
синтезируются в животном организме.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты. Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой. Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.
м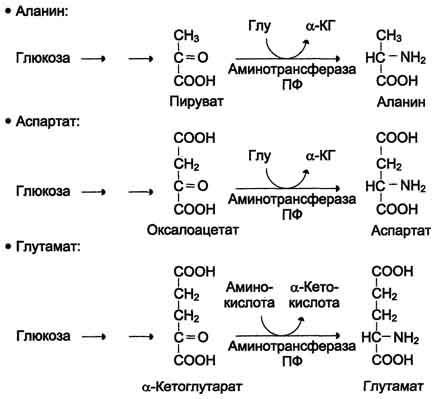 иды
глутамин и аспарагин синтезируются из
соответствующих дикарбоновых аминокислот
Глу и Асп. Серин образуется из
3-фосфоглицерата - промежуточного
продукта гликолиза, который окисляется
до 3-фосфопирувата и затем трансаминируется
с образованием серина
иды
глутамин и аспарагин синтезируются из
соответствующих дикарбоновых аминокислот
Глу и Асп. Серин образуется из
3-фосфоглицерата - промежуточного
продукта гликолиза, который окисляется
до 3-фосфопирувата и затем трансаминируется
с образованием серина
С![]()
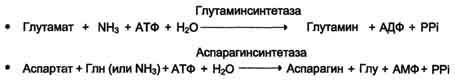 уществует
2 пути синтеза глицина: 1) из серина с
участием производного фолиевой кислоты
в результате действия се-риноксиметилтрансферазы.
2) в результате действия фермента
глицинсинтазы в реакции:
уществует
2 пути синтеза глицина: 1) из серина с
участием производного фолиевой кислоты
в результате действия се-риноксиметилтрансферазы.
2) в результате действия фермента
глицинсинтазы в реакции:
Пролин синтезируется из глутамата в цепи обратимых ре акций. Эти же реакции используются и при катаболизме пролита.
При определенных условиях углеродный скелет аминокислот не распадается, а участвует в синтезе углеводов (глюкогенные аминокислоты) и липидов (кетогенные аминокислоты).
К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат.
Строго кетогенными являются лизин и лейцин, при их окислении образуется исключительно ацетил-S-КоА. Он принимает участие в синтезе кетоновых тел, жирных кислот и холестерола.
Также выделяют небольшую группу смешанных аминокислот, из них образуется пируват, метаболиты ЦТК и ацетил-S-КоА (фенилаланин, тирозин, изолейцин, триптофан).
Глюкозо-аланиновый цикл. Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы. Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень. Все аминокислоты, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них – глюкогенных – полностью включаются в молекулу глюкозы, некоторых – смешанных – частично.
Регуляция: Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаза при участии АТФ.
30. Декарбоксилирование аминокислот. Его сущность. Декарбоксилирование гистидина, серина, цистеина, орнитина, лизина и глутамата. Роль биогенных аминов в регуляции метаболизма и функций.
П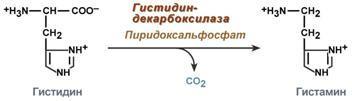 роцесс
отщепления карбоксильной группы
аминокислот в виде СО2 получил название
декарбоксилирования. Несмотря на
ограниченный круг аминокислот и их
производных, подвергающихся
декарбоксилиро-ванию в животных тканях,
образующиеся продукты реакции –
биогенные амины – оказывают сильное
фармакологическое действие на множество
физиологических функций человека и
животных. Реакции декарбоксилирования
в отличие от других процессов промежуточного
обмена аминокислот являются необратимыми.
Они катализируются специфическими
ферментами – декарбоксилазами
аминокислот. Декарбоксилазы аминокислот
состоят из белковой части, обеспечивающей
специфичность действия, и простетической
группы, представленной пиридоксальфосфатом
(ПФ). Синтез нейромедиаторов из аминокислот
в первую очередь связан с вовлечением
в метаболизм α-карбоксильной группы
аминокислот или, проще говоря, ее
удалением.
роцесс
отщепления карбоксильной группы
аминокислот в виде СО2 получил название
декарбоксилирования. Несмотря на
ограниченный круг аминокислот и их
производных, подвергающихся
декарбоксилиро-ванию в животных тканях,
образующиеся продукты реакции –
биогенные амины – оказывают сильное
фармакологическое действие на множество
физиологических функций человека и
животных. Реакции декарбоксилирования
в отличие от других процессов промежуточного
обмена аминокислот являются необратимыми.
Они катализируются специфическими
ферментами – декарбоксилазами
аминокислот. Декарбоксилазы аминокислот
состоят из белковой части, обеспечивающей
специфичность действия, и простетической
группы, представленной пиридоксальфосфатом
(ПФ). Синтез нейромедиаторов из аминокислот
в первую очередь связан с вовлечением
в метаболизм α-карбоксильной группы
аминокислот или, проще говоря, ее
удалением.
Гистидин. Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах.В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями – при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция. Физиологические эффекты:
расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления;
повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство (отечность), снижение артериального давления;
если предыдущие пункты имеют место в головном мозге – повышение внутричерепного давления;
увеличивает тонус гладких мышц бронхов, как следствие – спазм и удушье;
слабо повышает тонус мышц желудочно-кишечного тракта;
стимулирует секрецию слюны и желудочного сока.
Г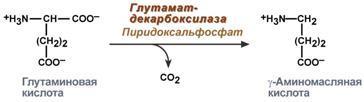
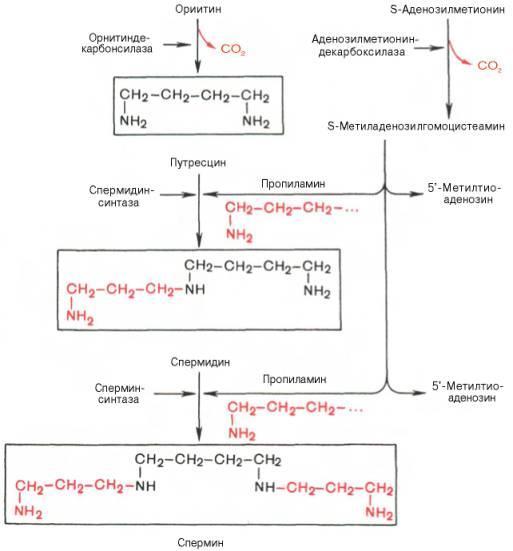 лутамат.
Синтез γ-аминомасляной кислоты (ГАМК)
происходит исключительно в центральной
нервной системе – в подкорковых
образованиях головного мозга.
Физиологические
эффекты:
В центральной нервной системе ГАМК
(наряду с глутаминовой кислотой) является
тормозным медиатором. Наиболее высока
ее роль в височной и лобной коре,
гиппокампе, миндалевидных и гипоталамических
ядрах, черной субстанции, ядрах мозжечка.
лутамат.
Синтез γ-аминомасляной кислоты (ГАМК)
происходит исключительно в центральной
нервной системе – в подкорковых
образованиях головного мозга.
Физиологические
эффекты:
В центральной нервной системе ГАМК
(наряду с глутаминовой кислотой) является
тормозным медиатором. Наиболее высока
ее роль в височной и лобной коре,
гиппокампе, миндалевидных и гипоталамических
ядрах, черной субстанции, ядрах мозжечка.
При декарбоксилировании орнитина образуется путресцин, лизина — кадаверин. образуются при бактериальном брожении из белков, известны из-за неприятного запаха.Из них об¬разуются полиамины. Из путресцина образуются спермин и спермидин, которые стабилизируют структуру мембран. Спермидин прочно связан с ДНК и может способствовать стабилизации ееструктуры.Продукты декарбоксилирования-путресцин,кадаверин,БЫВ-спермидин,Физиолог роль-изменяют степень агрегации полисом.Регулируют синтез РНК и белка.
При декарбоксилировании серина образуется этаноламин, который путем метилирования превращается в холин. Холин и этаноламин входят в состав сложных липидов. Из холина путем ацетилирования образуется ацетилхолин. Серин: продукт декарбоксилирования-этаноламин,БАВ-ацетилхолин,Физиолог роль-возбуждающий медиатор вегетативной нервной системы.
При декарбоксилировании цистеина образуется меркаптоэтиламин, который входит в состав КоА. Меркаптоэтиламин является радиопротектором.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов.
Биогенные амины – это вещества, характеризующиеся присутствием в их молекулярной структуре аминогруппы (NH2). Их можно обнаружить как в растениях, так и в животных. Их делят на несколько семейств, в частности – на этаноламины (холин и ацетилхолин), полиэтилендиамины (путресцин и кадаверин), полиамины (спермин), имидазолилалкиламины (гистамин), фенилалкиламины (мескалин и тирамин), катехоламины (адреналин, норадреналин и дофамин), индолилалкиламины (триптамин и серотонин), а также бетаины (карнитин). Биогенные амины могут быть предшественниками алкалоидов и гормонов. Кроме того, некоторые из них являются нейромедиаторами или компонентами фосфолипидов и витаминов. Их также можно обнаружить в рибосомах и некоторых бактериях. Обычно они синтезируются посредством декарбоксилирования или карбоксилирования аминокислот (например, гистидин превращается в гистамин). Некоторые биогенные амины являются галлюциногенами (мескалин), другие могут быть даже токсичными (путресцин и кадаверин). Мед и маточное молочко содержат холинергический фактор – ацетилхолин. Этот биогенный амин действует как нейромедиатор на уровне синапсов центральной нервной системы и вызывает сокращение гладких мышц на уровне бронхов и желудочно-кишечного тракта, стимулируя таким образом перистальтику (это может объяснять слабый послабляющий эффект меда). Он также расширяет капиллярные сосуды и снижает артериальное давление. Для получения дополнительной информации по этому вопросу см. свойства меда и маточного молочка при заболеваниях сердечно-сосудистой системы. Гистамин образуется посредством окислительного декарбоксилирования гистидина – аминокислоты, широко представленной в пыльце. Он стимулирует образование желудочного сока железами, расположенными в дне желудка, и таким образом способствует пищеварению. Он также расширяет кровеносные капилляры, повышает проницаемость мембран и вызывает сокращение гладких мышц пищеварительного тракта, матки и бронхов.
31. Трансаминирование аминокислот. Специфичность аминотрансфераз. Значение реакций трансаминирования. Непрямое дезаминирование аминокислот: последовательность реакций, ферменты, биологическое значение.
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
П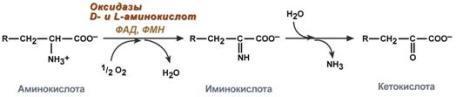 рямое
дезаминирование катализируется одним
ферментом, в результате образуется NH3
и кетокислота. Прямое окислительное
дезаминирование может идти в присутствии
кислорода (аэробное) и не нуждаться в
кислороде (анаэробное).
рямое
дезаминирование катализируется одним
ферментом, в результате образуется NH3
и кетокислота. Прямое окислительное
дезаминирование может идти в присутствии
кислорода (аэробное) и не нуждаться в
кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В орг-ме человека эти ферменты присутствуют, но практически неактивны.
2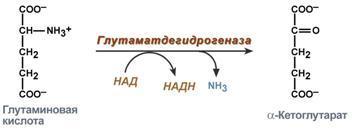 .
Анаэробное прямое окислительное
дезаминирование существует только для
глутаминовой к-ты, катализируется только
глутаматдегидрогеназой, превращающей
глутамат в α-кетоглутарат. Фермент
глутаматдегидрогеназа имеется в
митохондриях всех кл орг-ма (кроме
мышечных). Этот тип дезамин-ия тесным
образом связан с трансаминированием
аминокислот и формирует с ним процесс
трансдезаминирования.
.
Анаэробное прямое окислительное
дезаминирование существует только для
глутаминовой к-ты, катализируется только
глутаматдегидрогеназой, превращающей
глутамат в α-кетоглутарат. Фермент
глутаматдегидрогеназа имеется в
митохондриях всех кл орг-ма (кроме
мышечных). Этот тип дезамин-ия тесным
образом связан с трансаминированием
аминокислот и формирует с ним процесс
трансдезаминирования.
Н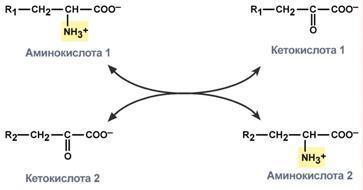 епрямое
окислительное дезаминирование
(трансдезаминирование).Непрямое
окислительное дезаминирование включает
2 этапа и активно идет во всех клетках
организма.
епрямое
окислительное дезаминирование
(трансдезаминирование).Непрямое
окислительное дезаминирование включает
2 этапа и активно идет во всех клетках
организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
В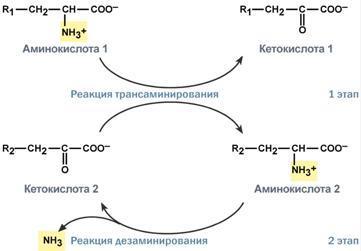 торой
этап
состоит в отщеплении аминогруппы от
аминокислоты 2 – дезаминирование. В
организме человека дезаминированию
подвергается только глутаминовая
кислота. Второй этап осуществляется
глутаматдегидрогеназой (перейти вверх).
В организме коллектором всех аминокислотных
аминогрупп является глутаминовая
кислота, и только она подвергается
окислительному дезаминированию с
образованием аммиака и α-кетоглутаровой
кислоты. Фермент глутаматдегидрогеназа
имеется в митохондриях всех клеток
организма, кроме мышечных. Учитывая
тесную связь обоих этапов, непрямое
окислительное дезаминирование называют
трансдезаминирование. Если реакция
идет в митохондриях печени, аммиак
используется для синтеза мочевины,
которая в дальнейшем удаляется с мочой.
В эпителии канальцев почек реакция
необходима для удаления аммиака в
процессе аммониегенеза. Так как НАДН
используется в дыхательной цепи и
α-кетоглутарат вовлекается в реакции
ЦТК, то реакция активируется при дефиците
энергии и ингибируется избытком АТФ и
НАДН.
Роль трансаминирования и трансдезаминирования:
торой
этап
состоит в отщеплении аминогруппы от
аминокислоты 2 – дезаминирование. В
организме человека дезаминированию
подвергается только глутаминовая
кислота. Второй этап осуществляется
глутаматдегидрогеназой (перейти вверх).
В организме коллектором всех аминокислотных
аминогрупп является глутаминовая
кислота, и только она подвергается
окислительному дезаминированию с
образованием аммиака и α-кетоглутаровой
кислоты. Фермент глутаматдегидрогеназа
имеется в митохондриях всех клеток
организма, кроме мышечных. Учитывая
тесную связь обоих этапов, непрямое
окислительное дезаминирование называют
трансдезаминирование. Если реакция
идет в митохондриях печени, аммиак
используется для синтеза мочевины,
которая в дальнейшем удаляется с мочой.
В эпителии канальцев почек реакция
необходима для удаления аммиака в
процессе аммониегенеза. Так как НАДН
используется в дыхательной цепи и
α-кетоглутарат вовлекается в реакции
ЦТК, то реакция активируется при дефиците
энергии и ингибируется избытком АТФ и
НАДН.
Роль трансаминирования и трансдезаминирования:
Реакции трансаминирования:
-активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
-обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
-начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
-необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
-при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для -глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
-является одной из транспортных форм аминного азота в гепатоциты,
-способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
М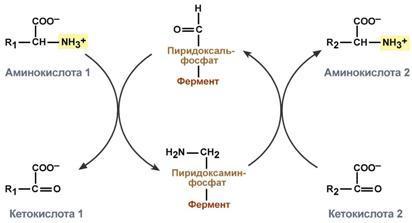 еханизм
реакции трансаминирования
непрост и протекает по типу "пинг-понг".
Катализируют реакцию ферменты
аминотрансферазы, Они являются сложными
ферментами, в качестве кофермента имеют
пиридоксальфосфат (активная форма
витамина В6). В тканях насчитывают около
10 аминотрансфераз, обладающие групповой
специфичностью и вовлекающие в реакции
все аминокислоты, кроме пролина, лизина,
треонина, которые не подвергаются
трансаминированию.
еханизм
реакции трансаминирования
непрост и протекает по типу "пинг-понг".
Катализируют реакцию ферменты
аминотрансферазы, Они являются сложными
ферментами, в качестве кофермента имеют
пиридоксальфосфат (активная форма
витамина В6). В тканях насчитывают около
10 аминотрансфераз, обладающие групповой
специфичностью и вовлекающие в реакции
все аминокислоты, кроме пролина, лизина,
треонина, которые не подвергаются
трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
1.к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
2. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Р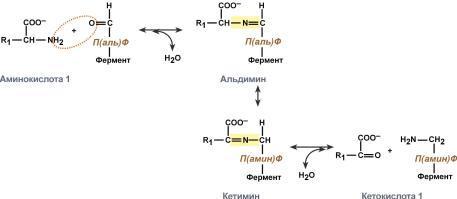 оль
и превращение пиридоксальфосфата
сводится к образованию промежуточных
соединений – шиффовых оснований
(альдимин и кетимин). В первой реакции
после отщепления воды образуется
иминовая связь между остатком аминокислоты
и пиридоксальфосфатом. Полученное
соединение называется альдимин.
Перемещение двойной связи приводит к
образованию кетимина, который гидролизуется
водой по месту двойной связи. От фермента
отщепляется готовый продукт – кетокислота.
оль
и превращение пиридоксальфосфата
сводится к образованию промежуточных
соединений – шиффовых оснований
(альдимин и кетимин). В первой реакции
после отщепления воды образуется
иминовая связь между остатком аминокислоты
и пиридоксальфосфатом. Полученное
соединение называется альдимин.
Перемещение двойной связи приводит к
образованию кетимина, который гидролизуется
водой по месту двойной связи. От фермента
отщепляется готовый продукт – кетокислота.
После
отщепления кетокислоты к комплексу
пиридоксамин-фермент присоединяется
новая кетокислота и процесс идет в
обратном порядке: образуется кетимин,
затем альдимин, после чего отделяется
новая аминокислота. Чаще всего аминокислоты
взаимодействуют со следующими
кетокислотами: пировиноградной с
образованием аланина, щавелевоуксусной
с образованием аспартата, α-кетоглутаровой
с образованием глутамата. Однако аланин
и аспартат в дальнейшем все равно
передают свою аминогруппу на
α-кетоглутаровую кислоту. Таким образом,
в тканях осуществляется поток избыточных
аминогрупп на один общий акцептор –
α-кетоглутаровую кислоту. В итоге
образуется большое количество глутаминовой
кислоты. Далее глутаминовая кислота
может вовлекается в процессы с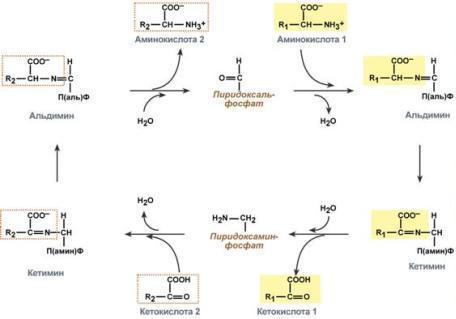 вязывания
аммиака (синтез глутамина) либо в прямое
окислительное дезаминирование.
вязывания
аммиака (синтез глутамина) либо в прямое
окислительное дезаминирование.
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
32. Образование и пути использования аммиака. Биосинтез мочевины: последовательность реакций, регуляция. Гипераммониемия.
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основные источники аммиака:
1.неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
2.окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
3.дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
4.катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
5.жизнедеятельность бактерий толстого кишечника,
6.распад пуриновых и пиримидиновых оснований – во всех тканях.
Т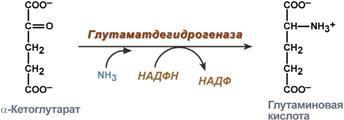 ак
как аммиак является чрезвычайно токсичным
соединением, то в тканях существуют
несколько реакций связывания
(обезвреживания) аммиака – синтез
глутаминовой кислоты и глутамина, синтез
аспарагина, синтез карбамоилфосфата:
синтез глутаминовой кислоты
(восстановительное аминирование) –
взаимодействие α-кетоглутарата с
аммиаком. Реакция по сути обратна реакции
окислительного дезаминирования, однако
в качестве кофермента используется
НАДФН. Происходит практически во всех
тканях, кроме мышечной, но имеет небольшое
значение, т.к. для глутаматдегидрогеназы
предпочтительным субстратом является
глутаминовая кислота и равновесие
реакции сдвинуто в сторону α-кетоглутарата,
ак
как аммиак является чрезвычайно токсичным
соединением, то в тканях существуют
несколько реакций связывания
(обезвреживания) аммиака – синтез
глутаминовой кислоты и глутамина, синтез
аспарагина, синтез карбамоилфосфата:
синтез глутаминовой кислоты
(восстановительное аминирование) –
взаимодействие α-кетоглутарата с
аммиаком. Реакция по сути обратна реакции
окислительного дезаминирования, однако
в качестве кофермента используется
НАДФН. Происходит практически во всех
тканях, кроме мышечной, но имеет небольшое
значение, т.к. для глутаматдегидрогеназы
предпочтительным субстратом является
глутаминовая кислота и равновесие
реакции сдвинуто в сторону α-кетоглутарата,
-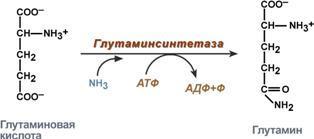
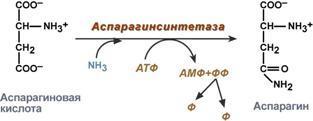 синтез
глутамина – взаимодействие глутамата
с аммиаком. Является главным способом
уборки аммиака, наиболее активно
происходит в нервной и мышечной тканях,
в почках, сетчатке глаза, печени. Реакция
протекает в митохондриях. Образование
большого количества глутамина обеспечивает
высокие концентрации его в крови (0,5-0,7
ммоль/л). Так как глутамин проникает
через клеточные мембраны путем облегченной
диффузии, то он легко попадает не только
в гепатоциты, но и в другие клетки, где
есть потребность в аминогруппах. Азот,
переносимый глутамином, используется
клетками для синтеза пуринового и
пиримидинового колец, гуанозинмонофосфата
(ГМФ), аспарагина, глюкозамино-6-фосфата
(предшественник всех остальных
аминосахаров). Синтез аспарагина –
взаимодействие аспартата с аммиаком.
Является второстепенным способом уборки
аммиака, энергетически невыгоден, т.к.
при этом тратятся 2 макроэргические
связи, синтез карбамоилфосфата в
митохондриях печени – реакция является
первой в процессе синтеза мочевины,
средства для удаления аммиака из
организма.Транспорт
аммиака.
Транспортными формами аммиака из тканей
в печень являются глутамин и аланин, в
меньшей степени аспарагин и глутамат,
некоторое количество аммиака находится
в крови в свободном виде. Глутамин и
аланин являются наиболее представленными,
их доля среди всех аминокислот крови
составляет до 50%. Большая часть глутамина
поступает от мышц и нервной ткани, аланин
переносит аммиак от мышц и стенки
кишечника. В мышцах основным акцептором
лишнего аминного азота является пируват.
При катаболизме белков в мышцах происходят
реакции трансаминирования аминокислот,
образуется глутамат, который далее
передает аминоазот на пируват и образуется
аланин. Из мышц с кровью аланин переносится
в печень, где в обратной реакции передает
свою аминогруппу на глутамат. Образующийся
пируват используется как субстрат в
реакциях синтеза глюкозы (глюконеогенез),
а глутаминовая кислота дезаминируется
и аммиак используется в синтезе мочевины.
синтез
глутамина – взаимодействие глутамата
с аммиаком. Является главным способом
уборки аммиака, наиболее активно
происходит в нервной и мышечной тканях,
в почках, сетчатке глаза, печени. Реакция
протекает в митохондриях. Образование
большого количества глутамина обеспечивает
высокие концентрации его в крови (0,5-0,7
ммоль/л). Так как глутамин проникает
через клеточные мембраны путем облегченной
диффузии, то он легко попадает не только
в гепатоциты, но и в другие клетки, где
есть потребность в аминогруппах. Азот,
переносимый глутамином, используется
клетками для синтеза пуринового и
пиримидинового колец, гуанозинмонофосфата
(ГМФ), аспарагина, глюкозамино-6-фосфата
(предшественник всех остальных
аминосахаров). Синтез аспарагина –
взаимодействие аспартата с аммиаком.
Является второстепенным способом уборки
аммиака, энергетически невыгоден, т.к.
при этом тратятся 2 макроэргические
связи, синтез карбамоилфосфата в
митохондриях печени – реакция является
первой в процессе синтеза мочевины,
средства для удаления аммиака из
организма.Транспорт
аммиака.
Транспортными формами аммиака из тканей
в печень являются глутамин и аланин, в
меньшей степени аспарагин и глутамат,
некоторое количество аммиака находится
в крови в свободном виде. Глутамин и
аланин являются наиболее представленными,
их доля среди всех аминокислот крови
составляет до 50%. Большая часть глутамина
поступает от мышц и нервной ткани, аланин
переносит аммиак от мышц и стенки
кишечника. В мышцах основным акцептором
лишнего аминного азота является пируват.
При катаболизме белков в мышцах происходят
реакции трансаминирования аминокислот,
образуется глутамат, который далее
передает аминоазот на пируват и образуется
аланин. Из мышц с кровью аланин переносится
в печень, где в обратной реакции передает
свою аминогруппу на глутамат. Образующийся
пируват используется как субстрат в
реакциях синтеза глюкозы (глюконеогенез),
а глутаминовая кислота дезаминируется
и аммиак используется в синтезе мочевины.
Целевыми органами для транспорта аммиака являются печень, почки и кишечник. В печени:
а)аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины, б)аланин вступает в реакции трансаминирования с α-кетоглутаратом, в)глутаминовая кислота подвергается окислительному дезаминированию. В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень, В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина.
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость.
Гипотезы токсичности аммиака. Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий. Приобретенная (вторичные) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений. Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния. Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения). Лабораторным критерием заболевания является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче. Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности.
П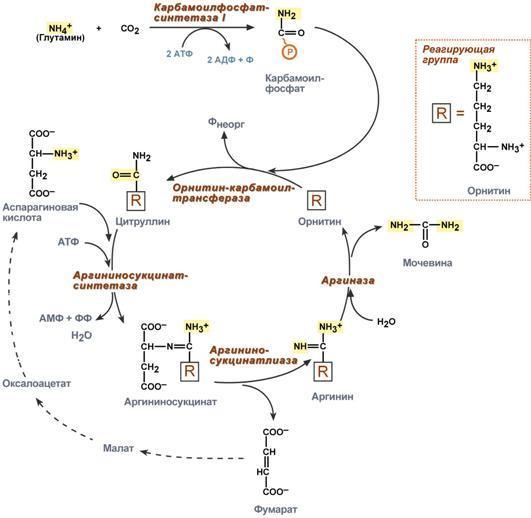 рактически
весь аммиак удаляется из организма
через почки в виде мочевины, которая
синтезируется в печени, и в виде
образующися в эпителии канальцев почек
солей иона аммония. В клетки печени и
почек аммиак попадает в составе глутамина
и аспарагина, глутаминовой кислоты,
аланина и в свободном виде. Кроме этого,
при метаболизме он образуется в большом
количестве и в самих гепатоцитах. В
клетке глутамин и аспарагин дезаминируются
соответственно глутаминазой и
аспарагиназой с образованием аммиака
(точнее, иона аммония). Аланин вступает
в реакцию трансаминирования. Образованный
в результате реакции пируват идет в
глюконеогенез или энергетический обмен.
Параллельно образуется глутаминовая
кислота. В целом глутаминовая кислота
в гепатоците может появляться тремя
путями: 1) из крови, 2) при дезаминировании
глутамина, 3) при трансаминировании
α-кетоглутарата с аспартатом или
аланином. Происхождение и дальнейшая
ее судьба зависит от конкретных
концентраций всех задействованных
веществ. Обычно далее глутамат
дезаминируется глутаматдегидрогеназой
с образованием аммиака.Синтез
мочевины.
В печени весь удаляемый аммиак используется
для синтеза мочевины. Увеличение синтеза
мочевины наблюдается при распаде
тканевых белков и азотистых соединений
(голодание, воспалительные процессы,
сахарный диабет) или при избыточном
белковом питании. У младенцев и детей
синтез мочевины может быть снижен по
двум причинам: незрелость печени и
активный синтез белков и нуклеиновых
кислот при росте организма. Реакции
синтеза мочевины являются циклическим
процессом и получили название орнитиновый
цикл. Синтез мочевины начинается в
митохондриях (первая и вторая реакции),
оставшиеся три реакции идут в цитозоле.
Для переноса цитруллина и орнитина
через митохондриальную мембрану
существуют специальные переносчики.Как
побочный продукт орнитинового цикла
образуется фумаровая кислота, переносимая
обратно в митохондрии. Здесь в реакциях
ЦТК из нее образуется оксалоацетат,
который трансаминируется с глутаматом
до аспартата, выходит в цитозоль и вновь
реагирует с цитруллином. В образовании
одной молекулы мочевины участвует 1
молекула NH4+, 1 молекула CO2, аминогруппа
1 молекулы аспарагиновой кислоты,
затрачивается 4 макроэргических связи
трех молекул АТФ. Синтез
аммонийных солей.
Непосредственный синтез аммонийных
солей или аммониегенез происходит в
просвете канальцев почек из секретируемых
сюда аммиака и ионов водорода и
фильтрующихся органических и неорганических
анионов первичной мочи. Около 10% всего
аммиака выводится почками в виде
аммонийных солей. Часть глутамина крови,
не задержавшаяся в печени, достигает
почек. В эпителиальных клетках почечных
канальцев, в основном в дистальных
канальцах, имеется фермент глутаминаза,
гидролизующая амидную группу с
образованием глутамата. Глутамат, в
свою очередь, дезаминируется
глутаматдегидрогеназой. Параллельно
в эпителии происходят процессы клеточного
дыхания, сопросождающиеся образованием
угольной кислоты, которая диссоциирует
на ион Н+ и карбонат-ион НСО3−. Ионы
водорода секретируются в первичную
мочу, карбонат-ионы – в кровь. Выделяемый
аммиак диффундирует в просвет канальца,
где соединяется с ионом Н+, образуя ионы
аммония NH4+. Они связываются с неорганическими
(фосфаты, хлориды, сульфаты) или с
органическими анионами (уксусной,
щавелевой, молочной кислот).
рактически
весь аммиак удаляется из организма
через почки в виде мочевины, которая
синтезируется в печени, и в виде
образующися в эпителии канальцев почек
солей иона аммония. В клетки печени и
почек аммиак попадает в составе глутамина
и аспарагина, глутаминовой кислоты,
аланина и в свободном виде. Кроме этого,
при метаболизме он образуется в большом
количестве и в самих гепатоцитах. В
клетке глутамин и аспарагин дезаминируются
соответственно глутаминазой и
аспарагиназой с образованием аммиака
(точнее, иона аммония). Аланин вступает
в реакцию трансаминирования. Образованный
в результате реакции пируват идет в
глюконеогенез или энергетический обмен.
Параллельно образуется глутаминовая
кислота. В целом глутаминовая кислота
в гепатоците может появляться тремя
путями: 1) из крови, 2) при дезаминировании
глутамина, 3) при трансаминировании
α-кетоглутарата с аспартатом или
аланином. Происхождение и дальнейшая
ее судьба зависит от конкретных
концентраций всех задействованных
веществ. Обычно далее глутамат
дезаминируется глутаматдегидрогеназой
с образованием аммиака.Синтез
мочевины.
В печени весь удаляемый аммиак используется
для синтеза мочевины. Увеличение синтеза
мочевины наблюдается при распаде
тканевых белков и азотистых соединений
(голодание, воспалительные процессы,
сахарный диабет) или при избыточном
белковом питании. У младенцев и детей
синтез мочевины может быть снижен по
двум причинам: незрелость печени и
активный синтез белков и нуклеиновых
кислот при росте организма. Реакции
синтеза мочевины являются циклическим
процессом и получили название орнитиновый
цикл. Синтез мочевины начинается в
митохондриях (первая и вторая реакции),
оставшиеся три реакции идут в цитозоле.
Для переноса цитруллина и орнитина
через митохондриальную мембрану
существуют специальные переносчики.Как
побочный продукт орнитинового цикла
образуется фумаровая кислота, переносимая
обратно в митохондрии. Здесь в реакциях
ЦТК из нее образуется оксалоацетат,
который трансаминируется с глутаматом
до аспартата, выходит в цитозоль и вновь
реагирует с цитруллином. В образовании
одной молекулы мочевины участвует 1
молекула NH4+, 1 молекула CO2, аминогруппа
1 молекулы аспарагиновой кислоты,
затрачивается 4 макроэргических связи
трех молекул АТФ. Синтез
аммонийных солей.
Непосредственный синтез аммонийных
солей или аммониегенез происходит в
просвете канальцев почек из секретируемых
сюда аммиака и ионов водорода и
фильтрующихся органических и неорганических
анионов первичной мочи. Около 10% всего
аммиака выводится почками в виде
аммонийных солей. Часть глутамина крови,
не задержавшаяся в печени, достигает
почек. В эпителиальных клетках почечных
канальцев, в основном в дистальных
канальцах, имеется фермент глутаминаза,
гидролизующая амидную группу с
образованием глутамата. Глутамат, в
свою очередь, дезаминируется
глутаматдегидрогеназой. Параллельно
в эпителии происходят процессы клеточного
дыхания, сопросождающиеся образованием
угольной кислоты, которая диссоциирует
на ион Н+ и карбонат-ион НСО3−. Ионы
водорода секретируются в первичную
мочу, карбонат-ионы – в кровь. Выделяемый
аммиак диффундирует в просвет канальца,
где соединяется с ионом Н+, образуя ионы
аммония NH4+. Они связываются с неорганическими
(фосфаты, хлориды, сульфаты) или с
органическими анионами (уксусной,
щавелевой, молочной кислот).
33. Обмен фенилаланина и тирозина. Наследственные нарушения обмена фенилаланина и тирозина. Значение серина, глицина и метионина.
Ф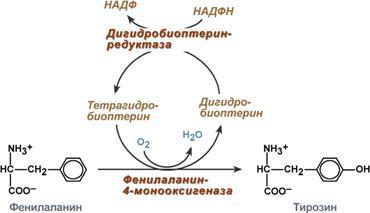
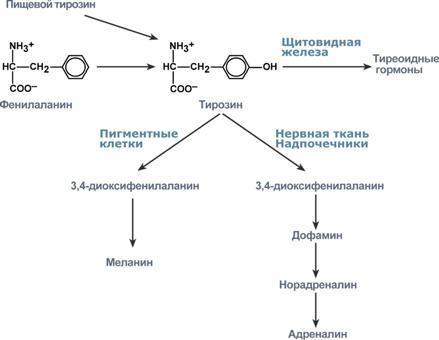 енилаланин
- незаменимая аминокислота, так как в
клетках животных не синтезируется её
бензольное кольцо. Тирозин - условно
заменимая аминокислота, поскольку
образуется из фенилаланина. Содержание
этих аминокислот в пищевых белках (в
том числе и растительных) достаточно
велико. Фенилаланин и тирозин используются
для синтеза многих биологически активных
соединений. В разных тканях метаболизм
этих аминокислот происходит поразному.
В организме фенилаланин используется
только в синтезе белков. Весь
неиспользованный запас аминокислоты
превращается в тирозин. В этом
непосредственно участвует фермент
фенилаланин-4-монооксигеназа, обеспечивающий
окисление ароматического кольца.
Кофермент тетрагидробиоптерин в реакции
окисляется до дигидроформы. Восстановление
кофермента осуществляет
дигидробиоптерин-редуктаза с своим
коферментом НАДФН. Тирозин, помимо
участия в синтезе белков, является
предшественником гормона надпочечников
адреналина, медиаторов норадреналина
и дофамина, гормонов щитовидной железы
тироксина и трийодтиронина и пигментов.
енилаланин
- незаменимая аминокислота, так как в
клетках животных не синтезируется её
бензольное кольцо. Тирозин - условно
заменимая аминокислота, поскольку
образуется из фенилаланина. Содержание
этих аминокислот в пищевых белках (в
том числе и растительных) достаточно
велико. Фенилаланин и тирозин используются
для синтеза многих биологически активных
соединений. В разных тканях метаболизм
этих аминокислот происходит поразному.
В организме фенилаланин используется
только в синтезе белков. Весь
неиспользованный запас аминокислоты
превращается в тирозин. В этом
непосредственно участвует фермент
фенилаланин-4-монооксигеназа, обеспечивающий
окисление ароматического кольца.
Кофермент тетрагидробиоптерин в реакции
окисляется до дигидроформы. Восстановление
кофермента осуществляет
дигидробиоптерин-редуктаза с своим
коферментом НАДФН. Тирозин, помимо
участия в синтезе белков, является
предшественником гормона надпочечников
адреналина, медиаторов норадреналина
и дофамина, гормонов щитовидной железы
тироксина и трийодтиронина и пигментов.
