
- •1. Витамины, понятие, история открытия и изучения витаминов.
- •11.Активные формы витамина д, их роль в регуляции фосфорно-кальциевого обмена.
- •12. Биохимическая характеристика патогенеза рахита, формы рахита.
- •13. Биохимическая характеристика гипервитаминоза д.
- •21. Витамин pp (b5), химическое строение, биологическая роль, проявления недостаточности
- •22. Витамин b6, химическое строение, биологическая роль, проявления авитаминоза.
- •23. Витамин b9, химическое строение, биологическая роль, проявления недостаточности. Антивитамины фолиевой кислоты
- •24. Витамин b12, химическая природа, роль в процессах метаболизма, проявление недостаточности.
- •25. Биотин, химическое строение, биологическая роль, проявления авитаминоза.
- •26. Витамин с, химическое строение, потребность, роль в процессах метаболизма. Проявление недостаточности витамина с.
- •27. Принципы и химизм качественного открытия и количественного определения витамина с в продуктах и биологических жидкостях.
- •4. Особенности ферментативного катализа.
4. Особенности ферментативного катализа.


Ферменты.5.После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад
В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом
катализе фермент Е соединяется (в принципе обратимо) со своим субстра-
том S, образуя нестойкий промежуточный фермент-субстратный комплекс
ES, который в конце реакции распадается с освобождением фермента
и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, всту-
пающих в реакции. Эти представления легли в основу теории «ключа-
замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы».
Таким образом, жесткая структура активного центра оказывается комп-
лементарной молекулярной структуре субстрата, обеспечивая тем самым
высокую специфичность фермента.
Л. Михаэлис не только постулировал образование промежуточного
фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации
субстрата на скорость реакции. В процессе реакции различают несколько
стадий: присоединение молекулы субстрата к ферменту, преобразование
первичного промежуточного соединения в один или несколько последова-
тельных (переходных) комплексов и протекающее в одну или несколько
стадий отделение конечных продуктов реакции от фермента. Это можно
схематически проиллюстрировать
следующими примерами:
![]()
В реакциях анаболизма, например А + В —> АВ, фермент может соединяться
как с одним, так и с другим субстратом
или обоими субстратами:

В реакциях катаболизма, например АВ —> А + В: а) АВ + Е –> ABE
б) АВЕ –> А + BE
в) ВЕ –> В + Е
(а + б + в): АВ + Е –> А + В + Е
. Если фермент в активном центре содержит
кофермент, то предполагается образование тройного комплекса (рис. 4.8).
Фермент вступает во взаимодействие с субстратом на очень короткий
период, поэтому долгое время не удавалось показать образование такого
комплекса. Прямые доказательства существования фермент-субстратного
комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В на-
стоящее время экспериментальные и математические методы кинетики,
термодинамики и статической механики химических реакций позволяют
определить для ряда ферментативных реакций кинетические и термоди-
намические показатели, в частности константы диссоциации промежуточ-
ных фермент-субстратных комплексов, константы скорости и равновесия их
образования.
В образовании фермент-субстратных комплексов участвуют водородные
связи, электростатические и гидрофобные взаимодействия, а в ряде случаев
также ковалентные, координационные связи . Информация о при-
роде связей между субстратом и связывающим участком активного центра
фермента может быть получена методами ЭПР и ЯМР, а также методами
УФ- и ИК-спектроскопии.
Для каталитической активности фермента существенное значение имеет
пространственная структура, в которой жесткие участки α-спиралей че-
редуются с гибкими, эластичными линейными отрезками, обеспечиваю-
щими динамические изменения белковой молекулы фермента. Этим изме-
неням придается большое значение в некоторых теориях ферментативного
катализа. Так, в противоположность модели Э. Фишера «ключ-замок»
Д. Кошлендом была разработана теория «индуцированного соответ-
ствия», допускающая высокую конформационную лабильность молекулы
белка-фермента и гибкость и подвижность активного центра. Эта теория
была основана на весьма убедительных экспериментах, свидетельствующих
о том, что субстрат индуцирует конформационные изменения молекулы
фермента таким образом, что активный центр принимает необходимую для
связывания субстрата пространственную ориентацию. Получены экспериментальные доказательства нового
положения о том, что постулированное Д. Кошлендом «индуцированное
соответствие» субстрата и фермента создается не обязательно изменениями
конформации белковой молекулы, но также геометрической и электрон-
но-топографической перестройкой молекулы субстрата.
В каталитическом процессе существенное значение имеют точное соот-
ветствие между ферментом и субстратом, а также термодинамические
и каталитические преимущества подобного соответствия. Гипотеза «инду-
цированного соответствия» предполагает существование между ферментом
и субстратом не только пространственной или геометрической компле-
ментарности, но и электростатического соответствия, обусловленного
спариванием противоположно заряженных групп субстрата и активного
центра фермента. Точное соответствие обеспечивает образование эффек-
тивного комплекса между субстратом и ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки
зрения, ускоряют химические реакции за счет снижения энергии активации *.
Энергией активации называется энергия, необходимая для перевода
всех молекул моля вещества в активированное состояние при данной
температуре. Другими словами, это энергия, необходимая для запуска
химической реакции, без которой реакция не начинается несмотря на ее
термодинамическую вероятность. Фермент снижает энергию активации
путем увеличения числа активированных молекул, которые становятся
реакционноспособными на более низком энергетическом уровне
На рисунке видно, что ферментативная реакция имеет более низкую
энергию активации. Следует отметить, что как катализируемая ферментом,
так и не катализируемая им реакция независимо от ее пути имеет одина-
ковую величину стандартного изменения свободной энергии (ΔG). Действуя
на скорость реакции, ферменты не изменяют равновесия между прямой
и обратной реакциями, как и не влияют на величину свободной энергии
реакции; они лишь ускоряют наступление равновесия химической реакции.
Таким образом, в механизме ферментативного катализа ведущую роль
играют промежуточные фермент-субстратные комплексы, образование ко-
торых определяется как тонкой трехмерной структурой активного центра,
так и уникальной структурной организацией всей молекулы фермента,
обеспечивающими высокую каталитическую активность и специфичность
действия биокатализатора. 6.Специфичность ферментов. Ферменты обладают высокой специфич-
ностью действия. Это свойство часто существенно отличает их от неорга-
нических катализаторов. Так, мелкоизмельченные платина и палладий
могут катализировать восстановление (с участием молекулярного водо-
рода) десятков тысяч химических соединений различной структуры. Высо-
кая специфичность ферментов обусловлена, как было отмечено, конфор-
мационной и электростатической комплементарностью между молекулами
субстрата и фермента и уникальной структурной организацией активного
центра, обеспечивающими «узнавание», высокое сродство и избиратель-
ность протекания одной какой-либо реакции из тысячи других химических
реакций, осуществляющихся одновременно в живых клетках.
В зависимости от механизма действия различают ферменты с отно-
сительной (или групповой) и абсолютной специфичностью. Так,
для действия некоторых гидролитических ферментов наибольшее значение
имеет тип химической связи в молекуле субстрата. Например, пепсин
в одинаковой степени расщепляет белки животного и растительного проис-
хождения, несмотря на то что эти белки существенно отличаются друг от
друга как по химическому строению и аминокислотному составу, так и по
физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы,
ни жиры. Объясняется это тем, что точкой приложения, местом действия
пепсина является пептидная —СО—NH-связь. Для действия липазы, ка-
тализирующей гидролиз жиров на глицерин и жирные кислоты, подобным
местом является сложноэфирная связь. Аналогичной групповой специфич-
ностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидроли-
зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся
в целлюлозе) в полисахаридах, и др. Обычно эти ферменты участву-
ют в процессе пищеварения, и их групповая специфичность, вероятнее
всего, имеет определенный биологический смысл. Относительной специ-
фичностью наделены также некоторые внутриклеточные ферменты, на-
пример гексокиназа, катализирующая в присутствии АТФ фосфорилиро-
вание почти всех гексоз, хотя одновременно в клетках имеются и спе-
цифические для каждой гексозы ферменты, выполняющие такое же фос-
форилирование (см. главу 10).
Абсолютной специфичностью действия называют способность фермента
катализировать превращение только единственного субстрата. Любые из-
менения (модификации) в структуре субстрата делают его недоступным для
действия фермента. Примерами таких ферментов могут служить аргиназа,
расщепляющая в естественных условиях (в организме) аргинин, уреаза,
катализирующая распад мочевины, и др.
Имеются экспериментальные доказательства существования так назы-
ваемой стереохимической специфичности, обусловленной сущест-
вованием оптически изомерных L- и D-форм или геометрических (цис-
и транс-) изомеров химических веществ. Так, известны оксидазы L-
и D-аминокислот, хотя в природных белках обнаружены только L-ами-
нокислоты. Каждый из видов оксидаз действует только на свой спе-
цифический стереоизомер *. L-аминокислота--1/2О2Оксидаза L-аминокислотα-Кетокислота + NH3 + Н2О; D-аминокислота---1/2О2 Оксидаза D-аминокислот α-Кетокислота + NH3 + H2О.
Наглядным примером стереохимической специфичности является бак-
териальная аспартатдекарбоксилаза, катализирующая отщепление СО2
только от L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-
реоспецифичность проявляют ферменты, катализирующие и синтетические
реакции. Так, из аммиака и α-кетоглутарата во всех живых организмах
синтезируется L-изомер глутаминовой кислоты, входящей в состав при-
родных белков. Если какое-либо соединение существует в форме цис-
и транс-изомеров с различным расположением групп атомов вокруг двой-
ной связи, то, как правило, только один из этих геометрических изомеров
может служить в качестве субстрата для действия фермента. Например,
фумараза катализирует превращение только фумаровой кислоты (транс-
изомер), но не действует на малеиновую кислоту (цис-изомер):

 фумаровая
кислота Малеиновая кислота
фумаровая
кислота Малеиновая кислота
Таким образом, благодаря высокой специфичности действия ферменты
обеспечивают протекание с большой скоростью лишь определенных хи-
мических реакций из огромного разнообразия возможных превращений
в микропространстве клеток и целостном организме, регулируя тем самым
интенсивность обмена веществ. 7.Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН (табл. 2-1).
Таблица 2-1. Оптимальные значения рН для некоторых ферментов
|
Фермент |
Оптимальное значение рН |
|
Пепсин |
1,5-2 |
|
Пируват-карбоксилаза |
4,8 |
|
Каталаза |
6,8-7 |
|
Фумараза |
6,5 |
|
Уреаза |
6,8-7,2 |
|
Кабоксипептидаза |
7,5 |
|
Трипсин |
6,5-7,5 |
|
Аргиназа |
9,5-9,9 |
8. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной

Рис. 2-16. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).
Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).

9.Зависимость скорости ферментативной реакции от количества субстрата
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой (рис. 2-19).
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Ферментативный процесс можно выразить следующим уравнением:

где k1- константа скорости образования фермент-субстратного комплекса; k-1- константа скорости обратной реакции, распада фермент-субстратного комплекса; k2- константа скорости образования продукта реакции.
Следующее соотношение констант скоростей (k-1+ k2)/k1называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V =
|
Vmax[S] |
|
|
|
Km+ [S] |
Это уравнение получило название уравнения Михаэлиса-Ментен.
В случае, когда скорость реакции равна половине максимальной, Km= [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Km(S >> Km), to увеличение концентрации субстрата на величину Кmпрактически не влияет на сумму (Km+ S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax- величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km+ S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна

Рис. 2-19. Зависимость скорости реакции (V) от концентрации субстрата S.Vmax- максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции. Кm- константа Михаэлиса.
концентрации субстрата (реакция имеет первый порядок).
Vmахи Km- кинетические характеристики эффективности фермента.
Vmaxдает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кmхарактеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше
Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
На рис. 2-20 представлена зависимость скорости двух ферментативных реакций (1 и 2) от концентрации субстрата. Константа Михаэлиса первого фермента меньше константы Михаэлиса второго фермента (Kml< Km2). Следовательно, сродство первого фермента к субстрату выше, чем у второго фермента, и начальная скорость реакции, катализируемой первым ферментом, выше в сравнении со вторым ферментом.
10. 11.Скорость ферментативной реакции, как и активность фермента, в значи-
тельной степени определяется также присутствием в среде активаторов
и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту
реакцию. Активирующее влияние на скорость ферментативной реакции
оказывают разнообразные вещества органической и неорганической приро-
ды. Так, соляная кислота активирует действие пепсина желудочного сока;
Количество продукта
Время
Повышение
концентрации фермента
4х
3х
2х
1х
желчные кислоты повышают активность панкреатической липазы; неко-
торые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), расти-
тельная протеиназа и др. в значительной степени активируются соеди-
нениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд
ферментов – также витамином С. Особенно часто активаторами выступают
ионы двухвалентных и, реже, одновалентных металлов. Получены дока-
зательства, что около четверти всех известных ферментов для проявления
полной каталитической активности нуждаются в присутствии металлов.
Многие ферменты вообще не активны в отсутствие металлов. Так, при
удалении цинка угольная ангидраза (карбоангидраза), катализирующая
биосинтез и распад Н2СО3, практически теряет свою ферментативную
активность; более того, цинк при этом не может быть заменен никаким
другим металлом. Известны ферменты *, действие которых активируется
ионами нескольких металлов; в частности, енолаза активируется Mg2+,
Mn2+, К+ (табл. 4.4).механизм действия металлов в энзиматическом катализе,
или роль металлов в активировании ферментами. В ряде случаев ионы
металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических
групп ферментов, или служат акцепторами и донаторами электронов, или
выступают в качестве электрофилов либо нуклеофилов, сохраняя реактив-
ные группы в необходимой ориентации. В других случаях они способствуют
присоединению субстрата к активному центру и образованию фермент-
субстратного комплекса. Например, ионы Mg2+ через отрицательно заря-
женную фосфатную группу обеспечивают присоединение монофосфатных
эфиров органических веществ к активному центру фосфатаз, катализирую-
щих гидролиз этих соединений. Иногда металл соединяется с субстратом,
образуя истинный субстрат, на который действует фермент. В частности,
ионы Mg2+ активируют креатинфосфокиназу благодаря образованию ис-
тинного субстрата – магниевой соли АТФ. Наконец, имеются эксперимен-
тальные доказательства прямого участия металлов (например, ионов Са2+
* Обычно трудно провести границу между металлоферментами (когда металл связан
прочно с белком и незаменим) и ферментами, активируемыми металлами (последние лишь
ускоряют реакцию и легко диссоциируют).в молекуле амилазы слюны) в формировании и стабилизации активного
центра и всей трехмерной структуры молекулы фермента. Следует отме-
тить также, что металлы нередко выступают в роли аллостерических
модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-
ким центром, подобный металл (эффектор) способствует образованию
наиболее выгодной пространственной конфигурации фермента и активного
фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или
оказывают небольшое активирующее влияние на ферменты. Исключение
составляют пепсин, некоторые оксидоредуктазы, активируемые анионами,
а также амилаза слюны, катализирующая гидролиз крахмала, активность
которой повышается при действии ионов хлора, и аденилатциклаза, кото-
рая активируется анионами галогенов. 12.Ингибиторы ферментов обычно принято делить на два больших
класса: обратимые и необратимые. Это вещества, вызывающие частичное
(обратимое) или полное торможение реакций, катализируемых фермента-
ми. Недавно открыты антиферменты (антиэнзимы, или антизимы),
представляющие собой белки (или полипептиды), действующие как инги-
биторы ферментов. К подобным веществам относятся, например, инги-
битор трипсина, обнаруженный в соевых бобах, и сывороточный анти-
трипсин. Недавно открыт в печени животных антифермент орнитинде-
карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-
диссоциируемые комплексы с соответствующими ферментами, выключая
их из химических реакций. Иногда ингибитор является составным компо-
нентом предшественника фермента, например пепсина (см. главу 12), или
входит в состав сложных комплексов ферментов, например в состав
протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-
рилирования-дефосфорилирования в живых организмах. Однако до сих
пор не выяснено, являются ли подобные антиферменты истинными инги-
биторами или регуляторными субъединицами, в частности, какова разница
в назначении регуляторной (R) субъединицы в составе протеинкиназы
и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие
денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание),
приводят к необратимой инактивации фермента. Однако подобное инак-
тивирование относительно неспецифично, оно не связано с механизмом
действия ферментов. Гораздо большую группу составляют так называемые
специфические ингибиторы, которые оказывают свое действие на какой-
либо один фермент или группу родственных ферментов, вызывая обрати-
мое или необратимое ингибирование. Исследование этих ингибиторов
имеет важное значение. Во-первых, ингибиторы могут дать ценную инфор-
мацию о химической природе активного центра фермента, а также о составе
его функциональных групп и природе химических связей, обеспечивающих
образование фермент-субстратного комплекса. Известны вещества, вклю-
чая лекарственные препараты, специфически связывающие ту или иную
функциональную группу в молекуле фермента, выключая ее из химической
реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-
хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнитель-
но легко вступают в химическую связь с некоторыми SH-группами фер-
ментов. Если такие группы имеют существенное значение для акта ката-
лиза, то добавление подобных ингибиторов приводит к полной потере
активности фермента:
R-SH + IСН2—СООН —> НI + R—S—CH2—COOH
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-
син) сильно тормозится некоторыми фосфорорганическими соединениями,
например ДФФ, вследствие блокирования ключевой гидроксильной группы
серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при
исследовании природы множественных форм ферментов и изоферментов,
различающихся не столько электрофоретической подвижностью, сколько
различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многосту-
пенчатого метаболического процесса, могут быть точно установлены не
только последовательность химических реакций, но и природа участвую-
щих в этих превращениях ферментов. Этим путем, применяя йодацетат,
фториды и другие специфические ингибиторы, был расшифрован глико-
литический путь окислительно-восстановительных превращений глюкозы
до стадии образования молочной кислоты в мышечной ткани, насчиты-
вающий 11 стадий с участием 11 ферментов и 10 промежуточных ме-
таболитов.
С ингибированием ферментов связан механизм действия многих токси-
нов и ядов на организм. Известно, что при отравлениях солями сенильной
кислоты смерть наступает вследствие полного торможения и выключения
дыхательных ферментов (цитохромная система) тканей, особенно клеток
мозга. Токсическое влияние на организм человека и животных некоторых
инсектицидов обусловлено торможением активности холинэстеразы – фер-
мента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направлен-
ное применение лекарственных препаратов в медицине) должна основы-
ваться на точном знании механизма действия лекарственных средств на
биосинтез ферментов, на активность уже синтезированных ферментов или
на регуляцию их активности в организме. Иногда для лечения некоторых
болезней используют избирательно действующие ингибиторы. Так, инги-
битор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол
широко применяется для лечения острого панкреатита – болезни, при ко-
торой уровень трипсина и химотрипсина в крови резко возрастает. Знание
избирательного ингибиторного действия некоторых природных и синте-
тических соединений (так называемых антиметаболитов) на ферменты
может служить методологической основой для разработки эффективных
методов синтеза химиотерапевтических препаратов. Этот путь открывает
широкие возможности для направленного воздействия на синтез ферментов
в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибиро-
вание. Если ингибитор вызывает стойкие изменения пространственной
третичной структуры молекулы фермента или модификацию функциональ-
ных групп фермента, то такой тип ингибирования называется необрати-
мым. Чаще, однако, имеет место обратимое ингибирование, под-
дающееся количественному изучению на основе уравнения Михаэлиса-
Ментен. Обратимое ингибирование в свою очередь разделяют на кон-
курентное и неконкурентное в зависимости от того, удается или не удается
преодолеть торможение ферментативной реакции путем увеличения кон-
центрации субстрата. Конкурентное ингибирование.
Неконкурентное ингибирование вызывается веществами, не
имеющими структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью дейст-
вия ингибитора на фермент. При данном типе ингибирования благодаря
образованию стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится необратимым. При-
мером необратимого ингибирования является действие йодацетата, ДФФ,
а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это
действие заключается в связывании и выключении функциональных групп
или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть
обратимым и необратимым, поскольку отсутствует конкуренция между
субстратом и ингибитором за активный центр. Примеры необратимого
ингибирования приведены ранее. При обратимом неконкурентном
ингибировании субстрат S и ингибитор I связываются с разными
центрами, поэтому появляется возможность образования как комплекса EI,
так и тройного комплекса EIS; последний может распадаться с осво-
бождением продукта, но с меньшей скоростью, чем комплекс ES.
Этот тип неконкурентного ингибирования чаще всего наблюдается
у ферментов, катализирующих превращения более одного субстрата, когда
связывание ингибитора не блокирует связывание субстрата с активным
центром. Ингибитор при этом соединяется как со свободным ферментом,
так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингиби-
рование, когда ингибитор связывается с ферментом также в некатали-
тическом центре, однако не со свободным ферментом, а только с ES-комп-
лексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями
Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравне-
нием Эди-Хофсти:
v = –Km(v/[S]) + Vmax
и соответствующими графиками в прямолинейных координатах.
При конкурентном типе ингибирования ингибитор увеличивает значение
Кm, не оказывая влияния на максимальную скорость Vmax (рис. 4.21). Это
означает, что при достаточно высокой концентрации субстрата [S] ин-
гибитор вытесняется молекулами субстрата из комплекса EI. При некон-
курентном ингибировании (рис. 4.22) ингибитор снижает величину макси-
мальной скорости. Если при этом величина Кm не уменьшается, то говорят
о полностью неконкурентном ингибировании. Подобный тип ингибиро-
вания имеет место при образовании неактивных, труднодиссоциирующих
комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип
ингибирования, иногда называемый частично неконкурентным, или обра-
тимым неконкурентным ингибированием (см. ранее), при котором сни-
жение Vmax сочетается с одновременным увеличением значений Кm. Это
означает, что комплекс EI сохраняет частичную активность, т.е. способ-
ность к образованию промежуточного тройного комплекса EIS, в котором
субстрат подвергается 13. Конкурентное ингибирование может быть вызвано веществами,
имеющими структуру, похожую на структуру субстрата, но несколько
отличающуюся от структуры истинного субстрата. Такое ингибирование
основано на связывании ингибитора с субстратсвязывающим (активным)
центром. Классическим примером подобного типа ингибирования является
торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фер-
мент катализирует окисление путем дегидрирования янтарной кислоты
(сукцината) в фумаровую:
Если в среду добавить малонат (ингибитор), то в результате структур-
ного сходства его с истинным субстратом сукцинатом (наличие двух таких
же ионизированных карбоксильных групп) он будет взаимодействовать
с активным центром с образованием фермент-ингибиторного комплекса,
однако при этом полностью исключается перенос атома водорода от
малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же
несколько различаются. Поэтому они конкурируют за связывание с актив-
ным центром, и степень торможения будет определяться соотношением
концентраций малоната и сукцината, а не абсолютной концентрацией
ингибитора. Таким образом, ингибитор может обратимо связываться
с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-
рования иногда называют ингибированием по типу метаболического анта-
гонизма .
В общей форме реакция взаимодействия ингибитора с ферментом может
быть представлена следующим уравнением:
Образовавшийся комплекс, называемый фермент-ингибиторным комп-
лексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается
с образованием продуктов реакции. Константу диссоциации комплекса EI,
или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Мен-
тен, определить как отношение констант обратной и прямой реакций:
т.е. ингибиторная константа прямо пропорциональна произведению кон-
центрации фермента и ингибитора и обратно пропорциональна концент-
рации комплекса EI.
Метод конкурентного торможения нашел широкое применение в ме-
дицинской практике. Известно, например, что для лечения некоторых
инфекционных заболеваний, вызываемых бактериями, применяют сульфа-
ниламидные препараты. Оказалось, что эти препараты имеют структурное
сходство с парааминобензойной кислотой, которую бактериальная клетка
использует для синтеза фолиевой кислоты, являющейся составной частью
ферментов бактерий. Благодаря этому структурному сходству сульфани-
ламид блокирует действие фермента путем вытеснения парааминобензой-
ной кислоты из комплекса с ферментом, синтезирующим фолиевую кисло-
ту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности
дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурент-
ные, так называемые коферментные, ингибиторы (или антивитамины),
тормозящие многие интенсивно протекающие при патологии биологи-
ческие процессы в организме. Применение подобных аналогов в меди-
цинской практике (в частности, в дерматологии и онкологии) основано на
конкурентном вытеснении коферментов из субстратсвязывающих центров
ключевых ферментов обмена. 14.неконкурентное
Неконкурентное ингибирование вызывается веществами, не
имеющими структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью дейст-
вия ингибитора на фермент. При данном типе ингибирования благодаря
образованию стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится необратимым. При-
мером необратимого ингибирования является действие йодацетата, ДФФ,
а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это
действие заключается в связывании и выключении функциональных групп
или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть
обратимым и необратимым, поскольку отсутствует конкуренция между
субстратом и ингибитором за активный центр. Примеры необратимого
ингибирования приведены ранее. При обратимом неконкурентном
ингибировании субстрат S и ингибитор I связываются с разными
центрами, поэтому появляется возможность образования как комплекса EI,
так и тройного комплекса EIS; последний может распадаться с осво-
бождением продукта, но с меньшей скоростью, чем комплекс ES.
Е + S ESE+P
+ +
I I
ЕI + SESIЭтот тип неконкурентного ингибирования чаще всего наблюдается
у ферментов, катализирующих превращения более одного субстрата, когда
связывание ингибитора не блокирует связывание субстрата с активным
центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ESкомплексом.15.Ингибиторы-лекарства, Лекарственные препараты, применяемые с целью подавления активности ферментов, называются ингибиторами ферментов.
Классификация
1. Ингибиторы протеиназ: контрикал.
2. Ингибиторы фибринолиза: кислота амино-капроновая.
3. Антихолинэстеразные средства: прозерин, физостигмина салицилат, галантамина гидробромид и др.
4. Ингибиторы МАО: ниаламид.
5. Ингибиторы карбоангидразы: диакарб.
6. Ингибиторы ксантиноксидазы: аллопуринол.
7. Ингибиторы ацетальдегидрогеназы: циамид, тетурам (дисульфирам) и др.
Контрикал — антиферментный препарат, ингибирующий активность трипсина, калликреина, плазмина.
Фармакокинетика: при внутривенном введении действие развивается через 10—15 мин.
Показания к применению: острый панкреатит, панкреанекроз в сочетании с гепарином в острый период инфаркта миокарда.
Противопоказания: с осторожностью у лиц, склонных к аллергическим реакциям.
Побочные эффекты: аллергические реакции. 16. Под коферментом часто подразумевают дополнительную группу,
легко отделяемую от апофермента при диссоциации. Предполагают, что
простетическая группа может быть связана с белком ковалентными и неко-
валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы ко-
фактор биотин ковалентно связан с апоферментом посредством амидной
связи (см. главу 7). С другой стороны, химические связи между кофакто-
рами и пептидными цепями могут быть относительно слабыми (например,
водородные связи, электростатические взаимодействия и др.). В таких
случаях при выделении ферментов наблюдается полная диссоциация обеих
частей, и изолированый белковый компонент оказывается лишенным фер-
ментативной активности, пока не будет добавлен извне недостающий
кофактор. Именно к подобным изолированным низкомолекулярным орга-
ническим веществам применим термин «кофермент», типичными предста-
вителями которых являются витамины В1, В2, В6, РР, содержащие кофер-
менты. Известно также, что и простетические группы, и коферменты
активно включаются в химические реакции, выполняя функции промежу-
тоных переносчиков электронов, атомов водорода или различных функцио-
нальных групп (например, аминных, ацетильных, карбоксильных). В подоб-
ных случаях кофермент рассматривают в качестве второго субстрата, или
косубстрата.
Роль кофермента (Ко) в качестве переносчика, например, атомов водо-
рода может быть представлена в виде схемы, где SH – субстрат, КоЕ – хо-
лофермент, А – акцептор протона: SH КoЕ AH

S КоЕН A
Субстрат подвергается окислению, отдавая электроны и протоны,
а КоЕ – восстановлению, принимая электроны и протоны. В следующей
полуреакции восстановленный КоЕН может отдавать электроны и протоны
на какой-либо другой промежуточный переносчик электронов и протонов
или на конечный акцептор (см. главу 9).
Коэнзим, кофактор, простетическая группа – двусмысленный биохими-
ческий жаргон. До сих пор продолжается терминологический спор, по-
скольку часто определения «коэнзим», «кофактор» и «простетическая груп-
па» рассматриваются через призму их роли в реакциях энзиматического
(ферментативного) катализа. Следует, однако, считаться с тем неоспо-
римым фактом, что во многих случаях небелковые органические молекулы,
как и ионы металлов, абсолютно необходимы белковому компоненту при
выполнении определенной биологической функции, не имеющей отношения
к биокатализу. Несомненно, имеют значение также тип и характер связи
небелкового компонента с молекулой белка. Поэтому очевидно, что ко-
фактором может служить любой фактор, абсолютно необходимый для
выполнения белком его каталитической или любой другой биологической
роли. С другой стороны, коферментом может быть любой небелковый
фактор, который непосредственно вовлечен в реакцию энзиматического
катализа. Кофактор, который непосредственно не участвует в акте ката-
лиза, не является коэнзимом. В то же время простетическую группу
(ковалентно связанный небелковый компонент, необходимый для опреде-
ленной функции) можно назвать коферментом, если она непосредственно
участвует в энзиматической реакции. Простетическая группа, которая не
вовлечена в акт катализа, но функционально является существенным как
для фермента, так и для некаталитического белка, может быть названа
кофактором. И наконец, кофактор и кофермент, непрочно связанные (или
слабо связанные) с ферментом или белком, тем не менее не классифи-
цируются в качестве простетических групп.
Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет пока-
зано далее, также выполняют роль кофакторов, хотя они не относятся ни
к коферментам, ни к простетическим группам. Известны примеры, когда
ионы металлов прочно связаны с белковой молекулой, выполняя функции
простетической группы. В частности, очищенный фермент, катализирую-
щий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую
кислоту, содержит 8 атомов меди на одну молекулу; все они настолько
прочно связаны с белковой молекулой, что даже не обмениваются с ионо-
обменными смолами и не отделяются методом диализа. Более того,
с помощью метода электронного парамагнитного резонанса показано
участие ионов меди в промежуточном переносе электронов. Интересно
отметить, что свободные ионы меди также наделены каталитической
активностью при окислении аскорбиновой кислоты, однако эта активность
повышается во многие тысячи раз, если ионы меди соединяются с апофер-
ментом в единый комплекс – холофермент.
Данные о важнейших коферментах и простетических группах ферментов,
включая их наименования и структуру, химическую природу витамина,
входящего в их состав, и характер выполняемой биохимической функции
в метаболизме, детально рассмотрены в главах 7 и 9–13.
Получены доказательства кофакторной функции в ферментативных
реакциях и ряда других биологически активных соединений, не относящихся
к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-
клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат),
порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК,
которые в составе ферментов аминоацил-тРНК-синтетаз принимают ак-
тивное участие в транспорте аминокислот в рибосоме, где осуществляется
синтез белка (см. главу 14).
Следует отметить одну отличительную особенность двухкомпонентных
ферментов: ни кофактор отдельно (включая большинство коферментов), ни
сам по себе апофермент каталитической активностью не наделены, и только
их объединение в одно целое, протекающее не хаотично, а в соответствии
с программой их структурной организации, обеспечивает быстрое про-
текание химической реакции.
17.Коферменты:
По
химической природе: витаминные,
витаминоподобные, невитаминные.
По
механизму действия: переносчики атомов
водорода,электронов,протонов.
переносчики отдельных химических
групп.18.Над
и
НАДФ
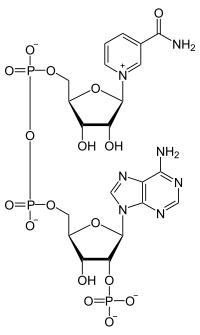
Производные PPвитамина. Биохимическая функция: дыхание,перенос водорода. Витамин РР входит в состав НАД или НАДФ,
являющихся коферментами большого числа обратимо действующих в
окислительно-восстановительных реакциях дегидрогеназ (формулы ко-
ферментов приведены в главе 9).
Показано, что ряд дегидрогеназ использует только НАД и НАДФ
(соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа),
другие могут катализировать окислительно-восстановительные реакции
в присутствии любого из них (например, глутаматдегидрогеназа; см. главу
12). В процессе биологического окисления НАД и НАДФ выполняют роль
промежуточных переносчиков электронов и протонов между окисляемым
субстратом и флавиновыми ферментами (молекулярные механизмы учас-
тия пиридиновых нуклеотидов в этом
процессе подробно рассматриваются
19.ФАД
и
ФМН

Производные витамина B2.Биологическая функция дыхание, перенос водорода. Рибофлавин входит в состав флавиновых кофер-
ментов, в частности ФМН и ФАД *, являющихся в свою очередь просте-
тическими группами ферментов ряда других сложных белков – флаво-
протеинов. Некоторые флавопротеины в дополнение к ФМН или ФАД
содержат еще прочно связанные неорганические ионы, в частности железо
или молибден, наделенные способностью катализировать транспорт элек-
тронов. Различают 2 типа химических реакций, катализируемых этими
ферментами. К первому относятся реакции, в которых фермент осуществ-
ляет прямое окисление с участием кислорода, т.е. дегидрирование (от-
щепление электронов и протонов) исходного субстрата или промежуточ-
ного метаболита. К ферментам этой группы относятся оксидазы L- и
D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др.
Вторая группа реакций, катализируемых флавопротеинами, характеризует-
ся переносом электронов и протонов не от исходного субстрата, а от
восстановленных пиридиновых коферментов. Ферменты этой группы иг-
рают главную роль в биологическом окислении. В каталитическом цикле
изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому
восстановлению с присоединением электронов и атомов водорода к N1
и N10. ФМН и ФАД прочно связываются с белковым компонентом, иногда
даже ковалентно, как, например, в молекуле сукцинатдегидрогеназы.
ФМН синтезируется в организме животных из свободного рибофлавина
и АТФ при участии специфического фермента рибофлавинкиназы:
Образование ФАД в тканях также протекает при участии специфического
АТФ-зависимого фермента ФМН-аденилилтрансферазы. Исходным ве-
ществом для синтеза является ФМН:
20.КоА
Витамин В3,транспорт ацильных групп. Пантотеновая кислота входит в состав кофер-
мента А, или коэнзима А (КоА). Название «коэнзим А» (кофермент
ацилирования) связано с тем, что это соединение участвует в фермен-
тативных реакциях, катализирующих как активирование, так и перенос
ацетильного радикала СН3СО; позже оказалось, что КоА активирует
и переносит также другие кислотные остатки (ацилы). В результате обра-
зования ацил-КоА происходит активация карбоновой кислоты, которая
поднимается на более высокий энергетический уровень, создающий вы-
годные термодинамические предпосылки для ее использования в реакциях,
протекающих с потреблением энергии.
Строение КоА расшифровал Ф. Линен. В основе структуры лежит
остаток 3'-фосфоаденозин-5'-дифосфата (отличается от АТФ наличием у
3'-гидроксила фосфатной группы), соединенный с остатком пантотеновой
кислоты, карбонильная группа которой в свою очередь связана с остатком
β-меркаптоэтиламина (тиоэтиламина).
Реакционноспособным участком молекулы КоА в биохимических реак-
циях является SH-группа, поэтому принято сокращенное обозначение КоА
в виде SH-KoA. О важнейшем значении КоА в обмене веществ (как будет
показано далее – см. главы 9–11) свидетельствуют обязательное непосред-
ственное участие его в основных биохимических процессах, окисление
и биосинтез высших жирных кислот, окислительное декарбоксилирование
α-кетокислот (пируват, α-кетоглутарат), биосинтез нейтральных жиров,
фосфолипидов, стероидных гормонов, гема гемоглобина, ацетилхолина,
гиппуровой кислоты и др.
21.Тиаминпирофосфат В1,
декарбоксилирование а-кетокислот,перенос
активного альдегида
(транскетолаза).
Экспериментально
доказано, что витамин B1 в
В1,
декарбоксилирование а-кетокислот,перенос
активного альдегида
(транскетолаза).
Экспериментально
доказано, что витамин B1 в
форме ТПФ является составной часть минимум 5 ферментов, участвующих
в промежуточном обмене веществ. ТПФ входит в состав двух сложных
ферментных систем – пируват- и α-кетоглутаратдегидрогеназных
комплексов, катализирующих окислительное декарбоксилирование
пировиноградной и α-кетоглутаровой кислот. В составе транскетолазы
ТПФ участвует в переносе гликоальдегидного радикала от кетосахаров на
альдосахара (см. главу 10). ТПФ является коферментом пируватдекар-
боксилазы клеток дрожжей (при алкогольной ферментации) и дегидро-
геназы γ-оксикетоглутаровой кислоты.
Приведенными примерами, вероятнее всего, не ограничиваются биоло-
гические функции тиамина. В частности, ТПФ участвует в окислительном
декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующих-
ся при распаде аминокислот с разветвленной боковой цепью; в растениях
ТПФ является эссенциальным кофактором при синтезе валина и лейцина
в составе фермента
ацетолактатсинтетазы.
22.Пиродаксальфосфат. В6,обмена
аминокислот,перенос аминогрупп.
Оказалось,
что, хотя все три производных 3-окси-
В6,обмена
аминокислот,перенос аминогрупп.
Оказалось,
что, хотя все три производных 3-окси-
пиридина наделены витаминными свойствами, коферментные функции
выполняют только фосфорилированные производные пиридоксаля и пи-
ридоксамина.
Фосфорилирование пиридоксаля и пиридоксамина является фермен-
тативной реакцией, протекающей при участии специфических киназ. Синтез
пиридоксальфосфата, например, катализирует пиридоксалькиназа, которая
наиболее активна в ткани мозга. Эту реакцию можно представить сле-
дующим уравнением:
Пиридоксаль + АТФ –> Пиридоксальфосфат + АДФ.
Доказано, что в животных тканях происходят взаимопревращения
пиридоксальфосфата и пиридоксаминфосфата, в частности в реакциях
трансаминирования и декарбоксилирования аминокислот (см. главу 12).
Следует отметить, что в выяснение биологической роли витамина В6
и пиридоксальфосфата в азотистом обмене существенный вклад внесли
А.Е. Браунштейн, С.Р. Мардашев, Э. Снелл, Д. Мецлер, А. Майстер и др.
Известно более 20 пиридоксалевых ферментов, катализирующих ключевые
реакции азотистого метаболизма во всех живых организмах. Так доказано,
что пиридоксальфосфат является простетической группой аминотранс-
фераз, катализирующих обратимый перенос аминогруппы (NH2-группы)
от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот, осу-
ществляющих необратимое отщепление СО2 от карбоксильной группы
аминокислот с образованием биогенных аминов. Установлена кофер-
ментная роль пиридоксальфосфата в ферментативных реакциях неокисли-
тельного дезаминирования серина и треонина, окисления триптофана,
кинуренина, превращения серосодержащих аминокислот, взаимопревраще-
ния серина и глицина (см. главу 12), а также в синтезе δ-аминолевулиновой
кислоты, являющейся предшественником молекулы гема гемоглобина, и др.
Пиридоксин относится к витаминам, коферментная роль которых изучена
наиболее подробно. В последние годы число вновь открытых пиридокса-
левых ферментов быстро увеличивалось. Так, для действия гликогенфос-
форилазы существенной оказалась фосфорильная, а не альдегидная группа
пиридоксальфосфата. Вследствие широкого участия пиридоксальфосфата
в процессах обмена при недостаточности витамина В6 отмечаются разно-
образные нарушения метаболизма
аминокислот.
23.Тетрагидрофолиевая
кислота. Фолиевая
кислота,Транспорт одноуглеродных
групп.
Коферментные функции фолиевой
кислоты связаны
Фолиевая
кислота,Транспорт одноуглеродных
групп.
Коферментные функции фолиевой
кислоты связаны
не со свободной формой витамина, а с восстановленным его птеридиновым
производным. Восстановление сводится к разрыву двух двойных связей
и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8
с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает
в 2 стадии в животных тканях при участии специфических ферментов,
содержащих восстановленный НАДФ. Сначала при действии фолатредук-
тазы образуется дигидрофолиевая кислота (ДГФК), которая при участии
второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:
ФК + НАДФН + Н+ <=> ДГФК + НАДФ+;
ДГФК + НАДФН + Н+ <=> ТГФК + НАДФ+
Доказано, что коферментные функции ТГФК непосредственно связаны
с переносом одноуглеродных групп, первичными источниками которых
в организме являются β-углеродный атом серина, α-углеродный атом
Фолиевая (птероилглутаминовая) кислота
5,6,7,8-Тетрагидрофолиевая кислота (ТГФК)
глицина, углерод метальных групп метионина, холина, 2-й углеродный
атом индольного кольца триптофана, 2-й углеродный атом имидазольного
кольца гистидина, а также формальдегид, муравьиная кислота и метанол.
К настоящему времени открыто шесть одноуглеродных групп, включа-
ющихся в разнообразные биохимические превращения в составе ТГФК:
формильная (—СНО), метильная (—СН3), метиленовая (—СН2—),
метенильная (—СН=), оксиметильная (—СН2ОН) и формими-
новая (—CH=NH). Выяснено, что присоединение этих фрагментов к
ТГФК является ферментативной реакцией ковалентного связывания их
с 5-м или 10-м атомом азота (или с обоими атомами вместе). В качестве
примера приводим отдельные функциональные группы в активных участках
ТГФК:
Имеются данные, что производные ТГФК участвуют в переносе одно-
углеродных фрагментов при биосинтезе метионина и тимина (перенос
метильной группы), серина (перенос оксиметильной группы), образовании
пуриновых нуклеотидов (перенос формильной группы) и т.д. (см. главы 12
и 13). Перечисленные вещества играют исключительно важную, ключевую,
роль в биосинтезе белков и нуклеиновых кислот, поэтому становятся
понятными те глубокие нарушения обмена, которые наблюдаются при
недостаточности фолиевой кислоты.
В медицинской практике (в частности, в онкологии) нашли применение
некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так,
4-аминоптерин используется в качестве препарата, тормозящего синтез
нуклеиновых кислот, и рекомендуется в качестве лечебного препарата при
опухолевых поражениях, в частности при острых и хронических формах
лейкозов у детей и взрослых.
24.Биотин. Витамин
Н,кофермент карбоксилирования.
Биотин
подробно изучен благодаря работам
Витамин
Н,кофермент карбоксилирования.
Биотин
подробно изучен благодаря работам
Ф. Линена. Известные к настоящему времени биотиновые ферменты (т.е.
ферменты, содержащие в качестве кофермента биотин) катализируют два
типа реакций:
1) реакции карбоксилирования (с участием СО2 или НСО3
–), сопря-
женные с распадом АТФ
RH + HCO3
– + АТФ <=> R-COOH + АДФ + Н3РО4;
2) реакции транскарбоксилирования (протекающие без участия АТФ),
при которых субстраты обмениваются карбоксильной группой
R1-COOH + R2H <=> R1H + R2-COOH.
Получены доказательства двустадийного механизма этих реакций с
образованием промежуточного комплекса (карбоксибиотинилфермент).
К реакциям первого типа относятся, например, ацетил-КоА- и пируват-
карбоксилазные реакции:
CH3–CO–S-KoA + CO2 + АТФ <=> HOOC–CH2–CO–KoA + АДФ + Pi.
Пируваткарбоксилаза является высокоспецифичным ферментом, ката-
лизирующим уникальную реакцию усвоения СО2 в организме животных.
Сущность реакции сводится к пополнению запасов оксалоацетата (щаве-
левоуксусная кислота) в лимоннокислом цикле (так называемые «анаплеро-
тические», «пополняющие» реакции), т.е. его синтезу из СО2 и пирувата:
Пируват + CO2 + АТФ + H2O —> Оксалоацетат + АДФ + Pi + 2H+
Реакция протекает в две стадии: на первой стадии, связанной с затратой
энергии, СО2 подвергается активированию, т.е. ковалентному связыванию
с биотином в активном центре фермента (Е-биотин):
229
CO2 + Биотин + АТФ + H2O Биотин + АДФ + Pi + 2H+
На второй стадии СО2 из комплекса переносится на пируват с об-
разованием оксалоацетата и освобождением фермента:
Примером второго типа реакций является метилмалонил-оксалоаце-
тат-транскарбоксилазная реакция, катализирующая обратимое превраще-
ние пировиноградной и щавелевоуксусной кислот:
Реакции карбоксилирования и транскарбоксилирования имеют важное
значение в организме при синтезе высших жирных кислот, белков, пури-
новых нуклеотидов (соответственно нуклеиновых кислот) и др. 25. Активный центр ферментов
При изучении механизма химической реакции, катализируемой фермента-
ми, исследователя всегда интересует не только определение промежуточных
и конечных продуктов и выяснение отдельных стадий реакции, но и природа
тех функциональных групп в молекуле фермента, которые обеспечивают
специфичность действия фермента на данный субстрат (субстраты) и высо-
кую каталитическую активность. Речь идет, следовательно, о точном
знании геометрии и третичной структуры фермента, а также химической
природы того участка (участков) молекулы фермента, который обеспе-
чивает высокую скорость каталитической реакции. Участвующие в фер-
ментативных реакциях молекулы субстратов часто имеют небольшие раз-
меры по сравнению с молекулами ферментов, поэтому было высказано
предположение, что при образовании фермент-субстратных комплексов
в непосредственный контакт с молекулой субстрата, очевидно, вступает
ограниченная часть аминокислот пептидной цепи. Отсюда возникло пред-
ставление об активном центре фермента. Под активным центром
подразумевают уникальную комбинацию аминокислотных остатков в мо-
лекуле фермента, обеспечивающую непосредственное связывание ее с мо-
лекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено,
что у сложных ферментов в состав активного центра входят также просте-
тические группы.
В активном центре условно различают так называемый каталити-

Рис. 4.2. Активный центр фер-
мента (схема) (по Малеру и
Кордесу).
Темные полосы - участки полипеп-
тидной цепи фермента; R - амино-
кислотные остатки и их порядковые
номера (с N-конца).
ческий центр, непосредственно вступающий в химическое взаимодейст-
вие с субстратом, и связывающий центр, или контактную («якор-
ную») площадку, которая обеспечивает специфическое сродство к субст-
рату и формирование его комплекса с ферментом. В свою очередь молекула
субстрата также содержит функционально различные участки: например,
субстраты эстераз или протеиназ – одну специфическую связь (или группу
атомов), подвергающуюся атаке со стороны фермента, и один или несколь-
ко участков, избирательно связываемых ферментом.
Получены экспериментальные доказательства наличия в активном цент-
ре химотрипсина двух остатков гистидина и остатка серина, схематически
представленных в трехмерной структурной модели предшественника этого
фермента (рис. 4.3). Выявление химической природы и вероятной топогра-
фии групп активного центра – проблема первостепенной важности. Она
сводится к определению природы аминокислот, их последовательности
и взаиморасположения в активном центре. Для идентификации так назы-
ваемых существенных аминокислотных остатков используют специфиче-
ские ингибиторы ферментов (часто это субстратподобные вещества или
аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в со-
четании с химической модификацией, включающей избирательное окисле-
ние, связывание, замещение остатков аминокислот и др.
При помощи методов ингибиторного анализа были предприняты по-
пытки установить закономерности состава и структуры активных центров
у ферментов, относящихся к разным группам. В частности, при использо-

Связывающий центр,активный центр Активный центр Молекула химотрипсина
вании диизопропилфторфосфата (ДФФ), принадлежащего к так называе-
мым нервным ядам, наблюдается полное выключение активного центра
холинэстеразы – фермента, катализирующего гидролиз ацетилхолина на
холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое
структурное сходство с ацетилхолином и подобно ему взаимодействует
с ОН-группой остатка серина в активном центре. Вызывая фосфори-
лирование серина в активном центре ряда других ферментов, ДФФ также
инактивирует их действие:
Показано, что ДФФ избирательно фосфорилирует в каждом чувстви-
тельном к нему ферменте только один остаток серина, наделенный
функциональной активностью. Учитывая этот механизм действия ДФФ,
сделаны попытки определения природы аминокислот в окружении «ка-
талитического» остатка серина у ряда ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты, сходные по типу действия,
хотя и различаются специфичностью, могут иметь почти одинаковую
последовательность аминокислотных остатков в тех участках, которые
примыкают к остатку серина, несущему функционально активную гидро-
ксильную группу. Существенное значение ОН-группы серина для акта
катализа было доказано, кроме того, химическим ее блокированием или
удалением, когда эстеразы полностью лишались ферментативной актив-
ности.
Активный фермент ДФФ Неактивный фермент
Фермент
Химотрипсин
Трипсин
Тромбин
Эластаза
Бутирилхолинэстераза
Ацетилхолинэстераза
Алиэстераза печени
Щелочная фосфатаза (E. coli)
Субтилизин (В. subtilis)
Протеаза (Aspergillius orizae)
Фосфоглюкомутаза
Фосфорилаза
Последовательность остатков
аминокислот вокруг серина
—Гли—Асп—Сер—Гли—Гли—
—Гли—Асп—Сер—Гли—Про—Вал—
—Асп—Сер—Гли—
—Асп—Сер—Гли—
—Гли—Глу—Сер—Ала—
—Глу—Сер—Ала—
—Гли—Глу—Сер—Ала—Гли—Гли—
—Тре—Асп—Сер—Ала—Сер—Ала—
—Гли—Тре—Сер—Мет—Ала—
—Тре—Сер—Мет—Ала—
—Тре—Ала—Сер—Гис—Асп—
—Глн—Иле—Сер—Вал—Apг—
Предполагают, что формирование активного центра фермента начи-
нается уже на ранних этапах синтеза белка-фермента (см. главу 14) на
рибосоме, когда линейная одномерная структура пептидной цепи превра-
щается в трехмерное тело строго определенной конфигурации. Образо-
вавшийся белок приобретает информацию совершенно нового типа, а
именно функциональную (в частности, каталитическую). Любые воздейст-
вия, приводящие к денатурации, т.е. нарушению третичной структуры,
приводят к искажению или разрушению структуры активного центра
и соответственно потере ферментом каталитических свойств. Если при
подходящих внешних условиях удается восстановить нативную трехмерную
структуру белка-фермента (ренатурировать его), то восстанавливается и его
каталитическая активность. Это было показано впервые на примере рибо-
нуклеазы поджелудочной железы 26. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Влияние закона действия масс. В катализируемой ферментом обратимой
химической реакции, например А + В <=> С + D, концентрация компонентов
реакции и соответственно направление реакции будут регулироваться влия-
нием закона действия масс. Оно, в частности, может быть показано
в обратимой реакции трансаминирования, катализируемой ферментом
аланинаминотрансферазой:
Аланин + α-Кетоглутарат <=> Пируват + Глутамат.
Этот тип регуляции играет, очевидно, лишь ограниченную роль, по-
скольку в реальных условиях реакция обычно протекает в одном направле-
нии, так как образовавшиеся продукты могут оказаться субстратами для
действия других ферментов и выводиться из сферы реакции. В этих случаях
устанавливается скорее устойчивое (стационарное) состояние, чем истинное
равновесие.
Изменение количества фермента. На бактериях хорошо изучен феномен
индуцированного (индуцирующего) синтеза ферментов при выращи-
вании их на среде, где единственным источником углерода и энергии служит
тот или иной углевод, например глюкоза. Замена в среде глюкозы на
лактозу (индуктор) приводит к индуцированному или адаптивному (после
небольшого периода лаг-фазы) синтезу фермента галактозидазы (програм-
мированному лактозным геном, см. главу 13), расщепляющей лактозу на
глюкозу и галактозу.
В клетках прокариот и эукариот имеются ферменты, концентрация
которых не требует добавления индуктора; это так называемые консти-
тутивные ферменты. Количество фермента в клетке зависит от наличия
продукта реакции, катализируемой данным ферментом, причем продукт
реакции вызывает торможение синтеза фермента в результате репрессии
(В животных тканях быстрый синтез ферментов наблюдается реже.
Механизм его (индуцирующий синтез) изучен только для небольшого
числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы,
триптофанпирролазы и др. – в ответ на введение гормонов или прием
белковой пищи. Однако при поступлении в организм некоторых ядов,
канцерогенных веществ, алкалоидов, инсектицидов через несколько дней
наблюдается резкое повышение активности (соответственно количества)
ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети
клеток печени, окисляющих чужеродные вещества в нетоксичные для
организма продукты. Вполне допустимо предположить, что в этих случаях
имеет место синтез ферментов путем индукции (т.е. de novo). Описаны
случаи, когда под действием подобных гидроксилаз чужеродные вещества
превращаются в организме в более токсичные соединения. Это явление,
обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты пищеварительного тракта,
а также поджелудочной железы синтезируются в неактивной форме – в виде
проферментов (зимогенов). Регуляция в этих случаях сводится к пре-
вращению проферментов в активные ферменты под влиянием специфи-
ческих агентов или других ферментов – протеиназ. Так, трипсин в под-
желудочной железе синтезируется в форме неактивного трипсиногена.
Поступив в кишечник, он превращается в активный трипсин в результате
аутокатализа или под действием других протеиназ (механизм активации
подробно рассматривается в главе 12). Превращение неактивного пепси-
ногена в активный пепсин происходит аутокаталитически в результате
специфического ограниченного протеолиза в присутствии соляной кислоты
и также связано с отщеплением от профермента специфического ингибитора
пептидной природы. Эти превращения зимогенов в активные ферменты
связаны с конформационными изменениями молекулы фермента и форми-
рованием активного центра или его раскрытием (демаскирование). Синтез
протеиназ в неактивной форме и ряда других неактивных белков-пред-
шественников имеет, очевидно, определенный биологический смысл, пре-
дотвращая разрушение клеток органов, в которых образуются профер-
менты.
Химическая модификация фермента. Некоторые белки при формиро-
вании третичной структуры подвергаются постсинтетической химической
модификации Оказалось, что активность ряда ключевых
ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы
и др., также контролируется путем фосфорилирования и дефосфорили-
рования, осуществляемого специфическими ферментами – протеинкиназой
и протеинфосфатазой, активность которых в свою очередь регулируется
гормонами .Уровень активности ключевых ферментов обмена
углеводов и соответственно интенсивность и направленность самих про-
цессов обмена определяются соотношением фосфорилированных и де-
фосфорилированных форм этих ферментов.
Обычно различают обратимую ковалентную и нековалентную хими-
ческие модификации ферментов, осуществляемые через ОН-группы серина,
реже – тирозина или за счет нековалентных взаимодействий с молекулой
фермента.
27. Аллостерическая регуляция.Во многих строго биосинтетических реак-
циях основным типом регуляции скорости многоступенчатого фермента-
тивного процесса является ингибирование по принципу обратной
связи. Это означает, что конечный продукт биосинтетической цепи подав-
ляет активность фермента, катализирующего первую стадию синтеза,
которая является ключевой для данной цепи реакции. Поскольку конечный
продукт структурно отличается от субстрата, он связывается с аллостери-
ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-
рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый био-
синтетический процесс, каждая стадия которого катализируется собст-
венным ферментом:
Скорость подобной суммарной последовательности реакций в значи-
тельной степени определяется концентрацией конечного продукта Р,
накопление которого выше допустимого уровня оказывает мощное инги-
бирующее действие на первую стадию процесса и соответственно на
фермент E1.
Впервые существование подобного механизма контроля активности
ферментов метаболитами было обнаружено у Е.coli при исследовании
синтеза изолейцина и ЦТФ. Оказалось, что изолейцин, являющийся
конечным продуктом синтеза, избирательно подавляет активность треонин-
дегидратазы, катализирующей первую стадию последовательного процесса
превращения треонина в изолейцин, насчитывающего пять ферментативных
реакций:
Аналогично ЦТФ как конечный продукт биосинтетического пути оказы-
вает ингибирующий эффект на первый фермент (аспартаткарбамоилтран-
сферазу), регулируя тем самым свой собственный синтез (см. главу 13).
Этот тип ингибирования получил название ингибирования по принципу
обратной связи, или ретроингибирования. Существование его доказано
во всех живых организмах. В настоящее время он рассматривается как один
из ведущих типов регуляции активности ферментов и клеточного мета-
болизма в целом *.
С другой стороны, в амфиболических процессах, выполняющих одно-
временно биосинтетические и биодеградативные функции **, доказано существование регуляции как по типу ретроингибирования, так и макроэрги-
ческими соединениями – индикаторами энергетического состояния клетки.
Для амфиболических процессов уникальным типом регуляции, свойствен-
ным только им, является, кроме того, активация предшественником,
когда первый метаболит в многоступенчатом пути активирует фермент,
катализирующий последнюю стадию. Так, доказано активирующее влияние
глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент
гликогенсинтазу.
Подобные типы ингибирования конечным продуктом и активирования
первым продуктом свойственны аллостерическим (регуляторным) фермен-
там, когда эффектор, модулятор, структурно отличаясь от субстрата,
связывается в особом (аллостерическом) центре молекулы фермента, прост-
ранственно удаленном от активного центра. Следует, однако, иметь в виду,
что модуляторами аллостерических ферментов могут быть как активаторы,
так и ингибиторы. Часто оказывается, что сам субстрат оказывает активи-
рующий эффект. Ферменты, для которых и субстрат, и модулятор пред-
ставлены идентичными структурами, носят название гомотропных в от-
личие от гетеротропных ферментов, для которых модулятор имеет
отличную от субстрата структуру. Взаимопревращение активного и неак-
тивного аллостерических ферментов в упрощенной форме, а также конфор-
мационные изменения, наблюдаемые при присоединении субстрата и эф-
фекторов, представлены на рис. 4.25. Присоединение отрицательного эф-
фектора к аллостерическому центру вызывает значительные изменения
конфигурации активного центра молекулы фермента, в результате чего
фермент теряет сродство к своему субстрату (образование неактивного
комплекса).
Аллостерические взаимодействия проявляются в характере кривых за-
висимости начальной скорости реакции от концентрации субстрата или
эффектора, в частности в S-образности этих кривых (отклонение от гипер-
болической кривой Михаэлиса-Ментен). S-образный характер зависимости
v от [S] в присутствии модулятора обусловлен эффектом кооперативности.
Это означает, что связывание одной молекулы субстрата облегчает связы-
вание второй молекулы в активном центре, способствуя тем самым увели-
чению скорости реакции. Кроме того, для аллостерических регуляторных
ферментов характерна нелинейная зависимость скорости реакции от кон-
центрации субстрата.
28. Четвертичная структура аллостерических ферментов. Кооперативные изменения конформации протомеров при функционировании.
29. Фосфорилирование дефосфорилирование. Протеинкиназы катализируют фосфорилирование белков по гидроксильным группам серина, треонина и тирозина. Если фосфорилируемые белки это тоже ферменты, то их активность в результате фосфорилирования в одних случаях уменьшается, в других — увеличивается. Например, в клетках жировой ткани есть липаза, существующая в двух формах — фосфопротеина и простого белка.

Регуляция ферментов.
Эти формы могут превращаться друг в друга. Фосфопротеин образуется в результате действия протеинкиназы и может вновь превращаться в простой белок при действии фосфопротеинфосфатазы — фермента, гидролитически отщепляющего фосфорную кислоту от фосфопротеинов Фосфорилированная липаза обладает значительно более высокой активностью, чем нефосфорилированная. Протеинкиназы — это группа ферментов, различающихся специфичностью: разные протеинкиназы фосфорилируют разные белки. То же можно сказать и о проте-инфосфатазах. Такой механизм регулирует активность очень многих ферментов.Одним из важных примеров такой регуляции является регуляция протеинкиназы А. Протеинкиназа А в активной форме представляет собой белок, построенный из одной пептидной цепи (субъединица С, каталитическая). В клетке имеется другой белок (субъединица R, регуляторная), способный соединяться с белком С, причем образуется тетрамерный комплекс R2C2. Этот комплекс не обладает ферментативной активностью: субъединица R выступает в роли белка-модулятора — ингибирует фермент (субъединицу С). Активация фермента происходит при участии цик-лоаденозинмонофосфата (З'^'-цикло-АМФ, или цАМФ).На поверхности субъединицы R есть два центра связывания цАМФ; после присоединения цАМФ изменяется конформация белка, при этом сродство субъединиц R к субъединицам С уменьшается, и происходит диссоциация комплекса с образованием двух молекул активной протеинкиназы А (рис. 2.29). Этот процесс обратимый, его направление зависит от концентрации цАМФ в клетке: повышение концентрации ведет к активации протеинкиназы, 30. Участие ферментов в проведении гормонального сигнала в клетку (лекция). 31. Изоферменты, или изоэнзимы,– это множественные формы фермента, ка-
тализирующие одну и ту же реакцию, но отличающиеся друг от друга по
физическим и химическим свойствам, в частности по сродству к субстрату,
максимальной скорости катализируемой реакции (активности), электро-
форетической подвижности или регуляторным свойствам.
В живой природе имеются ферменты, молекулы которых состоят из двух
и более субъединиц, обладающих одинаковой или разной первичной,
вторичной или третичной структурой. Субъединицы нередко называют
протомерами, а объединенную олигомерную молекулу – мультимером
Считают, что процесс олигомеризации придает субъединицам белков
повышенную стабильность и устойчивость по отношению к действию
денатурирующих агентов, включая нагревание, влияние протеиназ и др.
Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос
о существенности четвертичной структуры для каталитической активности
ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких»
условиях разрушить только лишь четвертичную структуру. Применяемые
обычно методы жесткой обработки (экстремальные значения рН, высокие
концентрации гуанидинхлорида или мочевины) приводят к разрушению не
только четвертичной структуры, но и вторичной и третичной структур
стабильного олигомерного фермента, протомеры которого оказываются
денатурированными и, как следствие этого, лишенными биологической
активности.
Следует указать на отсутствие ковалентных, главновалентных связей
между субъединицами. Связи в основном являются нековалентными,
поэтому такие ферменты довольно легко диссоциируют на протомеры.
Удивительной особенностью таких ферментов является зависимость актив-
ности всего комплекса от способа упаковки между собой отдельных
субъединиц. Если генетически различимые субъединицы могут сущест-
вовать более чем в одной форме, то соответственно и фермент, образо-
ванный из двух или нескольких типов субъединиц, сочетающихся в разных
количественных пропорциях, может существовать в нескольких сходных, но
не одинаковых формах. Подобные разновидности фермента получили
название изоферментов (изоэнзимов или, реже, изозимов). В частности,
если фермент состоит из 4 субъединиц двух разных типов – Н и М (сер-
дечный и мышечный), то активный фермент может представлять собой
одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ,
ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов
осуществляется различными генами и в разных органах экспрессируется
по-разному.
В одних случаях субъединицы имеют почти идентичную структуру
и каждая содержит каталитически активный участок (например, β-галакто-
зидаза, состоящая из 4 субъединиц). В других случаях субъединицы ока-
зываются неидентичными. Примером последних может служить трипто-
фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена
собственной (но не основной) энзиматической активностью, однако, только
будучи объединенными в макромолекулярную структуру, обе субъединицы
проявляют триптофансинтазную активность.
Термин «множественные формы фермента» применим к белкам, ка-
тализирующим одну и ту же реакцию и встречающимся в природе в орга-
низмах одного вида. Термин «изофермент» применим только к тем мно-
жественным формам ферментов, которые появляются вследствие гене-
тически обусловленных различий в первичной структуре белка (но не
к формам, образовавшимся в результате модификации одной первичной
последовательности).
Одним из наиболее изученных 4 ферментов, множественность форм
которого детально изучена методом гель-электрофореза, является ЛДГ,
катализирующая обратимое превращение пировиноградной кислоты в мо-
лочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно
одинакового размера, но двух разных типов. Поскольку Н-протомеры несут
более выраженный отрицательный заряд при рН 7,0–9,0, чем М-про-
томеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электро-
форезе будет мигрировать с наибольшей скоростью в электрическом поле
к положительному электроду (аноду). С наименьшей скоростью будет
продвигаться к аноду изофермент М4, в то время как остальные изо-
ферменты будут занимать промежуточные позиции. Следует подчеркнуть,
что изоферменты ЛДГ, обладая почти одинаковой ферментативной актив-
ностью, различаются некоторыми физико-химическими свойствами: мо-
лекулярной массой, электрофоретической подвижностью, отношением к ак-тиваторам и ингибиторам и др., однако для каждой ткани в норме
характерно свое соотношение форм (изоферментный спектр) ЛДГ. Напри-
мер, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах
и печени – М4 (ЛДГ5) (рис. 4.6). Эти обстоятельства широко используют
в клинической практике, поскольку изучение появления изоферментов ЛДГ
(и ряда других ферментов) в сыворотке крови может представлять интерес
для дифференциальной диагностики органических и функциональных по-
ражений органов и тканей. По изменению содержания изоферментов
в сыворотке крови можно судить как о топографии патологического
процесса, так и о степени поражения органа или ткани.
32.КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современные классификация и номенклатура ферментов были разработаны
Комиссией по ферментам Международного биохимического союза и ут-
верждены на V Международном биохимическом конгрессе в 1961 г.
в Москве *.
Необходимость систематики номенклатуры диктовалась прежде всего
стремительным ростом числа вновь открываемых ферментов, которым
разные исследователи присваивали названия по своему усмотрению. Более
того, одному и тому же ферменту часто давали два или несколько названий,
что вносило путаницу в номенклатуру. Некоторые названия ферментов
вообще не отражали тип катализируемой реакции, а при наименовании
фермента исходили из названия субстрата, на который действует фермент,
с добавлением окончания -аза: в частности, амилазы (ферменты, гидро-
лизирующие углеводы), липазы (действующие на липиды), протеиназы
(гидролизирующие белки) и т.д.
До 1961 г. не было и единой классификации ферментов. Трудности
заключались в том, что разные исследователи за основу классификации
ферментов брали различные принципы. Комиссией были рассмотрены
3 принципа, которые могли служить основой для классификации ферментов
и их обозначения. Первый принцип – химическая природа фермента, т.е.
принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемо-
протеинам, металлопротеинам и т. д. Однако этот принцип не мог служить
общей основой для классификации, так как только для небольшого числа
ферментов известны простетические группы, доступные идентификации
и прямому определению. Второй принцип – химическая природа субстрата,
на который действует фермент. По этому принципу трудно классифи-
цировать фермент, так как в качестве субстрата могут служить разнообраз-
ные соединения внутри определенного класса веществ (белки, углеводы,
липиды, нуклеиновые кислоты) и бесчисленное множество промежуточных
продуктов обмена. В основу принятой классификации положен третий
принцип – тип катализируемой реакции, который является специфич-
ным для действия любого фермента. Этот принцип логично использовать
в качестве основы для классификации и номенклатуры ферментов.
Таким образом, тип катализируемой химической реакции в сочетании
с названием субстрата (субстратов) служит основой для систематического
наименования ферментов. Согласно Международной классификации, фер-
менты делят на шесть главных классов, в каждом из которых несколько
подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы;
5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, ката-
лизирующие с участием двух субстратов окислительно-восстановительные
реакции, лежащие в основе биологического окисления. Систематические
названия их составляют по форме «донор: акцептор оксидоредуктаза».
Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы
(ЛДГ).
Различают следующие основные оксидоредуктазы: аэробные дегидро-
геназы или оксидазы, катализирующие перенос протонов (электронов)
непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие
перенос протонов (электронов) на промежуточный субстрат, но не на
кислород; цитохромы, катализирующие перенос только электронов. К это-
му классу относят также гемсодержащие ферменты каталазу и пероксидазу,
катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие
реакции межмолекулярного переноса различных атомов, групп атомов
и радикалов. Наименование их составляется по форме «донор: транспор-
тируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных ос-
татков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных
остатков, азотистых групп, остатков фосфорной и серной кислот и др.
Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-
трансферазы, фосфотрансферазы и др.
Гидролазы. В класс гидролаз входит большая группа ферментов, ката-
лизирующих расщепление внутримолекулярных связей органических ве-
ществ при участии молекулы воды. Наименование их составляют по форме
«субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализи-
рующие реакции гидролиза и синтеза сложных эфиров; гликозидазы,
ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы,
катализирующие гидролиз фосфоангидридных и пептидных связей; ами-
дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей
С—О, С—С, С—N и других, а также обратимые реакции отщепления
различных групп от субстратов не гидролитическим путем. Эти реакции
сопровождаются образованием двойной связи или присоединением групп
к месту разрыва двойной связи. Ферменты обозначают термином «суб-
страт-лиазы». Например, фумарат-гидратаза (систематическое название
«L-малат-гидролаза») катализирует обратимое отщепление молекулы
воды от яблочной кислоты с образованием фумаровой кислоты. В эту же
группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
Изомеразы. К классу изомераз относят ферменты, катализирующие
взаимопревращения оптических и геометрических изомеров. Системати-
ческое название их составляют с учетом типа реакции: «субстрат – цис-
транс-изомераза». Если изомеризация включает внутримолекулярный пе-
ренос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на
амино- и оксикислоты, углеводы и их производные; внутримолекулярные
оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз;
внутримолекулярные трансферазы, переносящие ацильные, фосфорильные
и другие группы, и т.д.
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие
синтез органических веществ из двух исходных молекул с использованием
энергии распада АТФ (или другого нуклеозидтрифосфата). Системати-
ческое название их составляют по форме «X : Y лигаза», где X и Y обозна-
чают исходные вещества. В качестве примера можно назвать L-глутамат:
аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-
за»), при участии которой из глутаминовой кислоты и аммиака в при-
сутствии АТФ синтезируется глутамин.
СПИСОК ФЕРМЕНТОВ
На основании разработанной системы, которая служит основой как для
классификации, так и для нумерации (индексации) ферментов, Между-
народная комиссия подготовила также Классификацию ферментов (КФ)
с включением списка ферментов, первоначально состоявшего к 1961 г.
примерно из 900 ферментов. В списке ферментов (см. Номенклатуру
ферментов, 1978) насчитывалось уже 2142 индивидуальных фермента, к де-
кабрю 1995 г. их идентифицировано более 3500. В списке для каждого
фермента, помимо кодового номера (шифра), приводятся систематическое
(рациональное) название, рекомендуемое (рабочее) название, химическая
реакция, которую катализирует данный фермент, а также примечания
о специфичности действия. Номер каждому ферменту рекомендуется при-
сваивать по четырехзначному коду.
Таким образом, код каждого фермента содержит четыре цифры,
разделенные точками, и составляется по определенному принципу. Первая
цифра указывает номер одного из шести главных классов ферментов.
Вторая цифра означает подкласс, характеризующий основные виды суб-
стратов, участвующих в данном типе химических превращений. Например,
у трансфераз вторая цифра указывает на природу той группы, которая
подвергается переносу, у гидролаз – на тип гидролизуемой связи и т.д. Эти
подклассы в свою очередь делятся на более частные подгруппы (подпод-
классы), отличающиеся природой химических соединений доноров или
акцепторов, участвующих в данной подгруппе реакций. Номер (цифра)
подподкласса ставят на 3-е место в шифре фермента. У гидролаз, например,
эта цифра уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой
группы и т.д. Первые 3 цифры кода точно определяют тип фермента.
Наконец, все ферменты, относящиеся к данному подподклассу, получают
порядковый номер в алфавитном порядке, который ставят на 4-е место
в шифре.
Каждый фермент, характеризующийся постоянной совокупностью 4
цифр, имеет соответствующий код, под которым он внесен в список
ферментов. В качестве примера в табл. 4.6 приведены 2 фермента из списка.
Следует особо отметить, что Международную классификацию фермен-
тов нельзя считать абсолютно совершенной, поскольку она в некоторых
отношениях не соответствует общепринятой в органической химии клас-
сификации химических реакций, несмотря на то что ферменты катали-
зируют по существу те же реакции. 34. Вопрос о локализации ферментов в структурных образованиях клетки
(ядро, митохондрии, лизосомы и др.) является чрезвычайно важным,
особенно в препаративной энзимологии, когда перед исследователем
поставлена задача изолировать и выделить фермент в чистом виде.
Сравнительно легко обнаружить локализацию фермента методами цито-
и гистохимии. Для этого тонкие срезы органа инкубируют с соответст-
вующими субстратами и после инкубации локализацию продукта реакции
устанавливают добавлением подходящих реактивов до появления специ-
фической окраски.
В препаративной энзимологии чаще пользуются методом дифферен-
циального центрифугирования гомогенатов тканей (рис. 4.26). Для этого
сначала разрушают клеточную структуру с помощью подходящего де-
зинтегратора и полученную квазиоднородную (гомогенизированную) массу
подвергают дифференциальному центрифугированию при температуре
0–4°С. Обычно распределение ферментов изучают в последовательных
индивидуальных фракциях, изолированных при дробном центрифугирова-
нии гомогенатов, в частности во фракции ядер, которую получают при
низкой скорости центрифугирования, во фракции митохондрий, которая
осаждается при средней скорости центрифугирования, во фракции микро-
сом (или рибосом), для изолирования которой требуется высокая скорость
центрифугирования, и, наконец, в оставшейся прозрачной надосадочной
жидкости (супернатант), представляющей собой растворимую фракцию
цитоплазмы. Следует отметить, что фракция митохондрий не является
гомогенной, поскольку из нее удается изолировать частицы, известные как
лизосомы, размер которых занимает промежуточное место между разме-
рами митохондрий и микросом. В свою очередь микросомальная фракция
также является гетерогенной, поскольку состоит в основном из элементов
эндоплазматической сети неоднородного строения.
При помощи метода фракционирования гомогенатов органов и тканей
в центрифугах было показано, что ядерная фракция печени и почек
содержит незначительное число ферментов, хотя известно, что в ядрах
осуществляется синтез некоторых белков. Основное место синтеза белка,
как теперь установлено,– фракция рибосом цитоплазмы. Показано, кроме
того, что ферменты гликолиза сосредоточены преимущественно в раство-
римой фракции цитоплазмы, в то время как цитохромоксидаза и ферменты
цикла Кребса локализованы во фракции митохондрий. С митохондриями
связаны также ферменты, катализирующие окислительное фосфорилиро-
вание и распад жирных кислот. Ферменты, катализирующие биосинтез
жирных кислот, наоборот, содержатся в растворимой фракции цитоплазмы.
Для изолирования и выделения ферментов из биологических объектов
в чистом (гомогенном) состоянии используют весь арсенал методов выде-
ления белков в индивидуальном виде (см. главу 1). 35/36/37Достижения энзимологии находят все большее применение в медицине,
в частности в профилактике, диагностике и лечении болезней. Успешно
развивается новое направление энзимологии – медицинская энзимология,
которая имеет свои цели и задачи, специфические методологические под-
ходы и методы исследования. Медицинская энзимология развивается по
трем главным направлениям, хотя возможности применения научных дос-
тижений энзимологии в медицине теоретически безграничны, в частности
в области энзимопатологии, энзимодиагностики и энзимотерапии.
Область исследований энзимопатологии является теоретической,
фундаментальной частью патологии. Она призвана изучать молекулярные
основы развития патологического процесса, основанные на данных нару-
шения механизмов регуляции активности или синтеза индивидуального
фермента или группы ферментов. Обладая высокой каталитической актив-
ностью и выраженной органотропностью, ферменты могут быть исполь-
зованы в качестве самых тонких и избирательных инструментов для
направленного воздействия на патологический процесс. Как известно, из
более чем 5000 наследственных болезней человека молекулярный механизм
развития выяснен только у 2-3 десятков. Считают, что развитие болезни
чаще всего связано с наследственной недостаточностью или полным от-
сутствием синтеза одного-единственного фермента в организме больного.
Иногда болезни называют также энзимопатиями. Так, галактоземия – на-
следственное заболевание, при котором наблюдается ненормально высокая
концентрация галактозы в крови. Болезнь развивается в результате наслед-
ственного дефекта синтеза фермента гексозо-1-фосфат-уридилтрансферазы,
катализирующего превращение галактозы в легкометаболизируемую глю-
козу. Причиной другого наследственного заболевания – фенилкетонурии,
сопровождающейся расстройством психической деятельности, является по-
теря клетками печени способности синтезировать фермент, катализирую-
щий превращение фенилаланина в тирозин (см. главу 12).
Энзимопатология успешно решает и проблемы патогенеза соматических
болезней. Созданы крупные научные центры и научно-исследовательские
институты, в которых ведутся работы по выяснению молекулярных основ
атеросклероза, злокачественного роста, ревматоидных артритов и др.
Нетрудно представить огромную роль ферментных систем или даже от-
дельных ферментов, нарушение регуляции активности и синтеза которых
приводит к формированию или развитию патологического процесса.
Второе направление медицинской энзимологии – энзимодиагнос-
тика – развивается по двум путям. Один путь – использование ферментов
в качестве избирательных реагентов для открытия и количественного
определения нормальных или аномальных химических веществ в сыворотке
крови, моче, желудочном соке и др. (например, выявление при помощи
ферментов глюкозы, белка или других веществ в моче, в норме не обна-
руживаемых). Другой путь – открытие и количественное определение самих
ферментов в биологических жидкостях при патологии. Оказалось, что ряд
ферментов появляется в сыворотке крови при распаде клеток (отсюда их
название «некротические ферменты»). Для диагностики органических и
функциональных поражений органов и тканей широко применяются от-
дельные ферментные тесты, выгодно отличающиеся от других химических
диагностических тестов, используемых в клинике, высокой чувствитель-
ностью и специфичностью. Известно около 20 тестов, основанных на
количественном определении активности ферментов (и изоферментов),
главным образом в крови (реже в моче), а также в биоптатах (кусочки
тканей, полученные при биопсии). Следует отметить, что из огромного
числа ферментов (более 3500), открытых в природе (частично и в организме
человека), в диагностической энзимологии используется лишь ограничен-
ный набор ферментов и для весьма небольшого числа болезней (гепатиты,
инфаркт миокарда, органические поражения почек, поджелудочной железы,
печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина
в крови резко увеличен при сахарном диабете, злокачественных поражениях
поджелудочной железы, болезнях печени и др. Резко повышается в сы-
воротке крови уровень двух аминотрансфераз, креатинкиназы (и ее изо-
форм) и лактатдегидрогеназы (и ее изоформ) при инфаркте миокарда;
умеренно повышено их содержание при поражениях тканей мозга и печени.
Определяют, кроме того, активность кислой фосфатазы (уровень повышен
при карциноме предстательной железы), щелочной фосфатазы, холинэсте-
разы и некоторых других органоспецифических ферментов (например,
гистидазы, уроканиназы, глицинамидинотрансферазы) в сыворотке крови
при патологии костной ткани, печени, метастатических карциномах и т. д.
Доказано, что органы и ткани человека характеризуются специфическим
ферментным и изоферментным спектром, подверженным не только инди-
видуальным, но и суточным колебаниям. Существует большой градиент
концентрации ферментов между внутриклеточными и внеклеточными час-
тями тела. Поэтому любые, даже незначительные, повреждения клеток
(иногда функциональные расстройства) приводят к выделению ферментов
во внеклеточное пространство, откуда они поступают в кровь. Механизм
гиперферментации (повышенное содержание ферментов в крови) до конца
не расшифрован. Повышение уровня внутриклеточных ферментов в плазме
крови прямо зависит от природы повреждающего воздействия, времени
действия и степени повреждения биомембран клеток и субклеточных струк-
тур органов. В оценке ферментных тестов для диагностических целей особое
значение имеет знание периода полужизни (полураспада) в плазме крови
каждого из диагностических ферментов, что делает важным выбор точного
времени для ферментного анализа крови. Весьма существенным является
также знание особенностей распределения (топографии) ферментов в инди-
видуальных органах и тканях, а также их внутриклеточной локализации.
В последнее время стали применять ферменты рестрикции – специфи-
ческие эндонуклеазы (см. главу 13), катализирующие разрывы межнуклео-
тидных связей ДНК, для диагностики фенилкетонурии, α- и β-талассемии
и других наследственных болезней человека. Метод основан на поли-
морфизме рестрикционных фрагментов ДНК.
Из представленных данных следует, что диагностическая энзимология
может служить основой не только для постановки правильного и своевре-
менного диагноза болезни, но и для проверки эффективности применяемого
метода лечения.
Дальнейшее развитие диагностической энзимологии преимущественно
идет по двум перспективным направлениям медицинской энзимологии: по
пути упрощения и рациональной модификации уже испытанных методов
и по пути поиска новых органоспецифических (тканеспецифических) фер-
ментов и изоферментов.
Третье направление медицинской энзимологии – энзимотерапия, т.е.
использование ферментов и модуляторов (активаторов и ингибиторов)
действия ферментов в качестве лекарственных средств, имеет пока не-
большую историю. До сих пор работы в этом направлении почти не
выходят за рамки эксперимента. Исключение составляют некоторые про-
теиназы: пепсин, трипсин, химотрипсин и их смеси (абомин, химопсин),
которые применяют для лечения ряда болезней пищеварительного тракта.
Помимо протеиназ, ряд других ферментов, в частности РНКаза, ДНКаза,
гиалуронидаза, коллагеназы, эластазы, отдельно или в смеси с протеина-
зами используются при ожогах, для обработки ран, воспалительных очагов,
устранения отеков, гематом, келоидных рубцов, кавернозных процессов при
туберкулезе легких и др. Ферменты применяются также для лечения
сердечно-сосудистых заболеваний, растворения сгустков крови. В нашей
стране разработан первый в мире препарат иммобилизованной стрептокина-
зы, рекомендованный для лечения инфаркта миокарда. Калликреины – фер-
менты кининовой системы используются для снижения кровяного давления.
Важной и многообещающей областью энзимотерапии является при-
менение ингибиторов ферментов. Так, естественные ингибиторы протеиназ
(α1-трипсин, α1-химотрипсин, α-макроглобулин) нашли применение в тера-
пии острых панкреатитов, артритов, аллергических заболеваний, при ко-
торых отмечается активация протеолиза и фибринолиза, сопровождаю-
щаяся образованием вазоактивных кининов.
В последнее время получило признание применение в онкологической
клинике ферментов бактериальной природы в качестве лекарственных
средств. Широко используется L-аспарагиназа (выпускается в промышлен-
ных количествах и L-глутамин(аспарагин)аза для лечения острых и хрони-
ческих форм лейкозов и лимфогранулематозов. Более десятка описанных
в литературе бактериальных ферментов испытаны в основном на животных
с перевивными опухолями или на раковых клетках опухолей человека
и животных, выращенных в культуре ткани. Основными постулатами
применения ферментов в онкологии являются различия в метаболизме
клеток опухолей по сравнению с обменом в нормальной, здоровой, клетке.
В частности, современные стратегия и тактика энзимотерапии опухолевых
поражений учитывают разную чувствительность нормальных и опухолевых
клеток к недостатку (дефициту) незаменимых (так называемых эссенциаль-
ных) факторов роста. К таким ростстимулирующим факторам относятся не
только пищевые факторы (витамины, незаменимые аминокислоты, макро-
и микроэлементы), но и ряд так называемых заменимых веществ, включая
заменимые аминокислоты, к недостатку которых опухолевая клетка ока-
зывается в силу особенностей ее обмена более чувствительной, чем нор-
мальная. Лечебный эффект, например, L-аспарагиназы и L-глутамин(аспа-
рагин)азы при лейкозах, вероятнее всего, объясняется необратимым распа-
дом как глутамина, так и аспарагина. Оказалось, что опухолевые клетки
для своего роста и размножения нуждаются в аминокислотах из организма,
поскольку сами лишены способности синтезировать амиды аминокислот,
в то время как нормальные клетки наделены этой способностью. Был
сделан вывод о том, что амидный азот глутамина и аспарагина выполняет
в клетках ряд уникальных функций, которые лучше выяснены для глута-
мина (см. главу 12). В частности, амидный азот глутамина оказался
абсолютно необходимым и не заменимым другими аминокислотами источ-
ником атома азота минимум в 10 реакциях синтеза, например, пуриновых
и пиримидиновых нуклеотидов, соответственно ДНК и РНК, АТФ, ге-
ксозаминов, гистидина и др. Таким образом, не лишена основания гипо-
теза, что любой фермент или агент, катализирующий необратимое рас-
щепление незаменимого для опухолевой клетки пищевого фактора (вклю-
чая аминокислоты), может в принципе быть применен в энзимотерапии
опухолей, если будут устранены ограничения, связанные с белковой при-
родой фермента. В оценке эффективности ферментов в экспериментальной
и клинической онкологии имеется немало противоречий и очень много
пробелов. Положительные результаты, отмеченные в ряде случаев, вселяют
надежду, что приготовление стандартных ферментных препаратов (включая
создание иммобилизованных форм) в промышленных масштабах и их
разумное применение в клинике, организованное на строгой научной
основе, несомненно дадут в руки врачей еще одно ценное оружие в борьбе
с опухолевыми заболеваниями человека.
Идея применения ферментов в качестве лекарственных средств (фарма-
кологии ферментов) всегда казалась заманчивой. Однако их нестабиль-
ность, короткий период полураспада, нежелательные антигенные свойства,
связанные с белковой природой ферментов и опасностью развития аллер-
гических реакций, трудности доставки к пораженным органам и тканям
(мишеням) существенно ограничивали возможности использования фер-
ментных препаратов. В разработке методов иммобилизации ферментов (см.
ранее) наметились конкретные пути преодоления указанных трудностей:
применение водорастворимых, биосовместимых носителей, например по-
лимолочной кислоты (легко разлагается в организме), использование ме-
тодов химической модификации и микрокапсулирования, приготовление
моно- и поликлональных антител и ферментсодержащих липосом и т.д.
В последнее время интенсивно разрабатываются методы направленного
транспорта ферментов, заключенных в своеобразные микроконтейнеры
(тени эритроцитов, липосомы и др.), к внешней поверхности которых могут
быть прикреплены адресные (векторные) белковые молекулы (например,
иммуноглобулины – антитела против специфических компонентов органа
или ткани-мишени, в частности опухоли). Иммобилизованные ферменты
в качестве лекарственных средств начали применять в специальных колон-
ках для экстракорпоральной перфузии крови (типа искусственной почки).
Такое лечение полностью исключает нежелательные воздействия на орга-
низм чужеродного белка и может проводиться длительное время.
Таким образом, области применения ферментов в медицине действи-
тельно безграничны. Рассмотренные примеры ясно показывают, какие
замечательные и многообещающие перспективы уже сегодня открывает
перед будущими врачами медицинская энзимология.
38) Биохимический анализ крови - Маркеры повреждения печени и поджелудочной железы
Определение активности ферментов наиболее широко используется при диагностике как первичных врожденных ферментопатий, так и вторичных, т. е. развивающихся в результате патологических нарушений на клеточном и субклеточном уровнях.
Изменение активности одних и тех же ферментов может наблюдаться при самых различных заболеваниях и, следовательно, не является специфичным для какой-либо патологии.
В связи с этим определение активности ферментов имеет диагностическую значимость только при сопоставлении с изменениями других показателей и клинической картиной заболевания в целом.
Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму.
Ферменты, выявляемые в плазме, условно делятся на 3 группы:
- собственные ферменты плазмы, выполняющие свои функции только в сосудистом русле (ферменты свертывания крови, холинэстераза, церулоплазмин);
- экскреторные ферменты, попавшие в плазму из секретов (дуоденального сока, слюны);
- клеточные ферменты, попавшие в плазму из поврежденного органа.
Появление, степень, длительность сдвига ферментативной активности ферментов в плазме или сыворотке крови обусловлены несколькими причинами: размерами и степенью повреждения клеток, величиной молекул фермента, его внутриклеточной локализацией, прочностью связей со структурными элементами клеток, влиянием разных факторов на активность и скорость деградации фермента в клетках.
Каждый орган в организме имеет определенный спектр ферментов. Его характеристикой может быть более или менее типичная группа ферментов, типичная энзиматическая констелляция. Это позволяет с помощью определения группы органоспецифических ферментов получать сведения о функциях отдельных органов организма.
Обычно ферментодиагностика — это определение ряда ферментов. Моноорганоспецифических ферментов практически не существует.
Измеряемая в сыворотке крови активность ферментов — результат совместной и согласованной работы клеточных структур (процессов синтеза и распада ферментов), функции мембран, скорости инактивации. Кроме того, на активность ферментов в крови значительное влияние оказывает продолжительность жизнедеятельности. Для основного числа ферментов период полураспада составляет от 10 до 120 часов. При этом ферменты с коротким периодом полураспада лучше отражают процессы, протекающие в органе.
39 Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
1. Причины, приводящие к увеличению количества
ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
2. Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).
Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
40) ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
Определение количественного содержания ферментов в биологических объектах представляет известные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции в определенных, согласованных условиях измерения. При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом скорость катализируемой реакции пропорциональна концентрации фермента. О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции. Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин).
В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат.
Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярной активности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессе реакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярной активностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента). Одна молекула каталазы эритроцитов способна, например, расщепить в 1 с 44000 молекул перекиси водорода.
41).ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Еще в 1916 г. Дж. Нельсон и Е. Гриффин показали, что сахароза, сорбированная на угле, сохраняла свою каталитическую активность, но лишь в 1953 г. Н. Грубхофер и Д. Шлейт впервые осуществили ковалентные связывания амилазы, пепсина, РНКазы и карбоксипептидазы с нерастворимым носителем.
В 1971 г. на первой конференции по инженерной энзимологии был узаконен термин «иммобилизованные ферменты». Однако в понятие «иммобилизация» в настоящее время вкладывают более широкий смысл, чем связывание на нерастворимом носителе, а именно - полное или частичное ограничение свободы движения белковых молекул.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами. Прежде всего, такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65 °С термоинактивация лактатдегидрогеназы, иммобилизованной в 60 %-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффектив-ность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
^ 5.1.1.Носители для иммобилизации ферментов
По Дж. Порату (1974), идеальные материалы, используемые для иммобилизации ферментов, должны обладать следующими основными свойствами: нерастворимостью; высокой химической и биологической стойкостью; значительной гидрофильностью; достаточной проницаемостью, как для ферментов, так и для коферментов, субстратов и продуктов реакции; способностью носителя легко активироваться (переходить в реакционно-способную форму).
Естественно, ни один из используемых в настоящее время в качестве носителя материал не отвечает полностью перечисленным требованиям. Тем не менее, существует широкий набор носителей, пригодных для иммобилизации определенных энзимов в конкретных условиях.
В зависимости от природы носители делятся на органические и неоргани-ческие материалы.
^ Органические полимерные носители. Иммобилизация многих ферментов осуществляется на полимерных носителях органической природы. Существующие органические полимерные носители можно разделить на два класса: природные и синтетические полимерные носители. В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют белковые, полисахаридные и липидные носители, а среди синтетических- полиметиленовые, полиамидные и полиэфирные.
К преимуществам природных носителей следует отнести их доступность, полифункциональность и гидрофильность, а к недостаткам - биодеградируемость и достаточно высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют целлюлозу, декстран, агарозу (агар) и их производные. Для придания химической устойчивости линейные цепи целлюлозы и декстрана поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры довольно легко вводят различные ионогенные группировки. Химической модификацией крахмала сшивающими агентами (формальдегид, глиоксаль, глутаровый альдегид) синтезирован новый носитель - губчатый крахмал, обладающий повышенной устойчивостью к гликозидазам.
Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие, как кератин, фиброин, коллаген и продукт переработки коллагена - желатина. Эти белки широко распространены в природе, поэтому доступны в значительных количествах, дешевы и имеют большое число функциональных групп для связывания фермента. Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для медицинских целей. К недостаткам белков как носителей в этом случае следует отнести их высокую иммуногенность.
^ Синтетические полимерные носители. Благодаря разнообразию и доступности материалы этой группы широко используются как носители для иммобилизации. К ним относятся полимеры на основе стирола, акриловой кислоты, поливинилового спирта; полиамидные и полиуретановые полимеры. Большинство синтетических полимерных носителей обладают механической прочностью, а при образовании обеспечивают возможность варьирования в широких пределах величины пор, введения различных функциональных групп. Некоторые синтетические полимеры могут быть произведены в различных физических формах (трубы, волокна, гранулы). Все эти свойства полезны для разных способов иммобилизации ферментов.
^ Носители неорганической природы. В качестве носителей наиболее часто применяют материалы из стекла, глины, керамики, графитовой сажи, силикагеля, а также силохромы, оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают пленкой оксидов алюминия, титана, гафния, циркония или обрабатывают органическими полимерами. Основное преимущество неорганических носителей - легкость регенерации. Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Таким образом, к настоящему времени создано огромное число разнообразных носителей для иммобилизации ферментов. Однако для каждого индивидуального фермента, используемого в конкретном технологическом процессе, необходимо подбирать оптимальные варианты, как носителя, так и условий и способов иммобилизации.
^ 5.1.2.Методы иммобилизации ферментов
Существуют два принципиально различных метода иммобилизации фер-ментов: без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации) и с образованием ковалентной связи между ними (химические методы иммобилизации). Каждый из этих методов осуществляется разными способами.
^ Физические методы иммобилизации ферментов реализуются посредст-вом адсорбции фермента на нерастворимом носителе, путем включения энзимов в поры поперечносшитого геля, в полупроницаемые структуры или двухфазные системы.
Адсорбция ферментов на нерастворимых носителях. При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счет электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей. Адсорбция была первым методом иммобилизации ферментов (Дж. Нель-сон, Э.Гриффин, 1916), но и сейчас не потеряла своего значения и стала наиболее широко распространенным способом получения иммобилизованных ферментов в промышленности. В литературе описано получение адсорбционным способом более 70 иммобилизованных ферментов с использованием главным образом таких носителей, как кремнезем, активированный уголь, графитовая сажа, различные глины, пористое стекло, полисахариды, синтетические полимеры, оксиды алюминия, титана и других металлов. Последние применяются наиболее часто. Эффективность адсорбции молекулы белка на носителе определяется удельной поверхностью (плотностью центров сорбции) и пористостью носителя. Процесс адсорбции ферментов на нерастворимых носителях отличается крайней простотой и достигается при контакте водного раствора фермента с носителем (статистическим способом, при перемешивании, динамическим способом с использованием колонок). С этой целью раствор фермента смешивают со свежим осадком, например, гидроксида титана, и высушивают в мягких условиях. Активность фермента при таком варианте иммобилизации сохраняется практически на 100 %, а удельная концентрация белка достигает 64 мг на 1 г носителя.
К недостаткам адсорбционного метода следует отнести невысокую прочность связывания фермента с носителем. При изменении условий иммобили-зации могут происходить десорбция фермента, его потеря и загрязнение продуктов реакции. Существенно повысить прочность связывания фермента с носителем может предварительная его модификация (обработка ионами металлов, полифункциональными агентами - полимерами, белками, гидрофобными соединениями, монослоем липида и пр.). Иногда, наоборот, модификации подвергается молекула исходного фермента, однако зачастую это ведет к снижению его активности.
Иммобилизация ферментов путем включения в гель. Способ иммобили-зации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток. Иммобилизацию ферментов в геле осуществляют двумя способами. В первом случае фермент вводят в водный раствор мономера, а затем проводят полимеризацию, в результате которой возникает пространственная структура полимерного геля с включенными в его ячейки молекулами фермента. Во втором случае фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние. Для первого варианта используют гели полиакриламида, поли-винилового спирта, поливинилпирролидона, силикагеля, для второго - гели крахмала, агар-агара, каррагинана, агарозы, фосфата кальция.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объеме носителя. Большинство гелевых матриц обладает высокой механической, химической, тепловой и биологической стойкостью и обеспечивает возможность многократного использования фермента, включенного в его структуру. Однако метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента. Разработано несколько модификаций этого метода, из которых интерес представляет микрокапсулирование и включение ферментов в липосомы.
Первый способ предложен Т.Чангом в 1964 г. и состоит в том, что водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Один из механизмов возникновения мембраны на поверхности водных микрокапсул фермента заключается в реакции межфазной поликонденсации двух соединений, одно из которых растворено в водной, а другое — в органической фазе. Примером может служить образование на поверхности раздела фаз микрокапсулы, получаемой путем поликонденсации гексаметилендиамина-1,6 (водная фаза) и галогенангидрида себациновой кислоты (органическая фаза):
-HCl
H2N-(CH2)6-NH2 + СlOС-(СН2)8-СОС1 → HN-(CH2)6-NH - СО-(СН2)8-СО-
Размер получаемых капсул составляет десятки или сотни микрометров, а толщина мембраны - сотые доли микрометра.
Достоинства метода микрокапсулирования - простота, универсальность, возможность многократного использования нативного фермента (фермент может быть отделен от непрореагировавшего субстрата и продуктов реакции процедурой простого фильтрования). Особенно существенно, что методом микрокапсулирования могут быть иммобилизованы не только индивидуальные ферменты, но и мультиэнзимные комплексы, целые клетки и отдельные фрагменты клеток. К недостаткам метода следует отнести невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Близким к инкапсулированию методом иммобилизации можно считать включение водных растворов ферментов в липосомы, представляющие собой сферические или ламеллярные системы двойных липидных бислоев. Впервые данный способ был применен для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 г. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую пленку липидов диспергируют в водном растворе, содержащем фермент. В процессе диспергирования происходит самосборка бислойных липидных структур липосомы, содержащих включенный раствор фермента.
Ферменты, иммобилизованные путем включения в структуру липосом, используют преимущественно в медицинских и научных целях, ибо значительная часть ферментов в клетке локализована в составе липидного матрикса биологи-ческих мембран, поэтому изучение липосом имеет большое значение для понимания закономерностей процессов жизнедеятельности в клетке.
Другие приемы иммобилизации ферментов, основанные на физических методах, менее распространены по сравнению с рассмотренными выше.
^ Химические методы иммобилизации ферментов. Иммобилизация ферментов путем образования новых ковалентных связей между ферментом и носителем - наиболее массовый способ получения промышленных биокатализаторов.
В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает стерические трудности в осуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки (сшивка, спейсер), в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, сульфурилхлорид, глутаровый диальдегид и др.). Например, для выведения галактозилтрансферазы из микроокружения носителя между ним и ферментом вставляют последовательность —СН2—NH—(СН2)5—СО—. В этом случае структура иммобилизованного фермента включает носитель, вставку и фермент, соединенные между собой ковалентными связями.
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Число методических приемов, разработанных для осуществления ковалентной иммобилизации ферментов, исключительно велико. Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента. Ниже представлен ряд примеров, иллюстрирующих некоторые способы химической иммобилизации ферментов.
Иммобилизация ферментов на носителях, обладающих гидроксо-группами. Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем или синтетическим диольным соединением является бромциановый метод, который был предложен Р.Аксеном,
Дж. Поратом и С.Эрнбаком в 1967 г. При обработке носителя бромцианом возникают реакционноспособные цианаты и имидокарбонаты, которые при взаимодействии с нуклеофильными аминогруппами фермента образуют производные изомочевины и уретанов:
Иммобилизация ферментов носителях, обладающих аминогруппами. Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазония, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, имидазольные, аминные, гуанидиновые, тиольные группы белков. Так, в щелочной среде фенольные радикалы тирозина образуют прочные азо-соединения, в составе которых белок связан с носителями:
Существенно, что п-аминофенильные функции могут быть легко введены в разнообразные носители.
Иммобилизация на носителях, обладающих активированными производными карбоксильной группы. Наиболее часто для соединения аминогрупп белка с ацильными группировками носителя используют ангидриды, галогенангидриды, активированные эфиры и другие производные карбоновых кислот. Например,
Реакционная способность производных карбоновых кислот в реакциях ацилирования аминогрупп фермента уменьшается от галогенангидридов до эфиров.
Иммобилизация на носителях, обладающих сульфгидрилъными группа-ми. Сульфгидрильные группы носителя и фермента легко окисляются с образова-нием дисульфидных связей под действием кислорода воздуха:
Иммобилизация путем химического присоединения биокатализатора к носителю отличается высокой эффективностью и прочностью связи. Несмотря на это, методы ковалентной иммобилизации ферментов все еще малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются незаменимыми инструментами в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
Гормоны
1) Для нормального функционирования многоклеточного организма необходима взаимосвязь между отдельными клетками, тканями и органами. Эту взаимосвязь осуществляют 4 основные системы регуляции .
Центральная и периферическая нервные системы через нервные импульсы и нейромедиаторы;
Эндокринная система через эндокринные железы и гормоны, которые секретируются в кровь и влияют на метаболизм различных клеток-мишеней;
Паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны ЖКТ, гистамин и др.);
Иммунная система через специфические белки (цитокины, антитела).
2) Гормональная регуляция, регуляция жизнедеятельности организма животных и человека, осуществляемая при участии поступающих в кровь гормонов; одна из систем саморегуляции функций, тесно связанная с нервной и гуморальной системами регуляции и координации функций. Гормоны выделяются в кровь железами внутренней секреции, разносятся по всему организму и влияют на состояние и деятельность различных органов и тканей. По характеру действия гормоны могут быть разделены на 2 группы. Одни действуют на определённые органы (органы-мишени), например тиреотропный гормон действует главным образом на щитовидную железу, адренокортикотропный (АКТГ) — на кору надпочечников, эстрогены — на матку и т. д. Др. гормоны (кортикостероиды, ростовой, или соматотропный, гормон и некоторые др.) обладают общим, или генерализованным, действием на все ткани организма. Так, инсулин действует на обмен углеводов; активируя гексокиназную реакцию, он также может стимулировать биосинтез белка. Тестостерон и др. андрогены усиливают процессы ассимиляции (анаболическое действие); их введение сопровождается задержкой азота в организме, Глюкокортикоиды вызывают многообразные изменения в обмене веществ, стимулируют образование гликогена в печени, тормозят утилизацию глюкозы на периферии и усиливают распад белков, особенно в соединительной и лимфоидной ткани. Эстрогены стимулируют синтез в матке фосфолипидов, белка и вызывают оводнение ткани этого органа. Гормон роста усиливает синтез белка в организме, влияет на жировой, фосфорный и кальциевый обмен. По-видимому, действие гормонов на обмен веществ связано с изменением скорости ферментативных реакций, и в большинстве случаев это осуществляется путём активации ферментов. Действие гормонов на биосинтез белка связано со стимуляцией образования информационной рибонуклеиновой кислоты (и-РНК), определяющей структуру синтезируемого белка. Г. р. обмена веществ обеспечивает нормальное функционирование органов и тканей. Рост и половое созревание организма регулируют ростовые и половые гормоны. В случае необходимости мобилизация возможностей организма также осуществляется при участии Г. р. Например, при опасности и вызванном ею мышечном напряжении усиливается поступление в кровь адреналина, повышающего уровень сахара в крови и увеличивающего кровоснабжение сердца и мозга; при интенсивных повреждающих воздействиях усиливается выработка адренокортикотропного гормона и др.
Результаты многих экспериментов позволили предположить, что гормоны обладают способностью активировать гены. Так, введение насекомым гормона линьки — экдизона — вызывает образование особых вздутий на гигантских хромосомах. Анализ этих вздутий показал, что в них происходит интенсивный процесс образования РНК. Поскольку изменения, касающиеся хромосом и синтеза РНК, опережают начало процесса окукливания, считают, что первым результатом действия экдизона является активация генов, затем стимуляция биосинтеза РНК и образование соответствующих ферментов. Последние обеспечивают процесс метаморфоза.
3) Гормо́ны— биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах. Используются в организме для поддержания его гомеостаза, а также для регуляции многих функций (роста, развития, обмена веществ, реакции на изменения условий среды).
4) Системы регуляции обмена веществ и функций организма образуют 3 иерархических уровня.
Первый уровень - ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы - медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень - эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень - внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
изменения активности ферментов путём активации или ингибирования;
изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения;
изменения скорости транспорта веществ через мембраны клеток.
5) Дистантный характер действия. Гомоны действуют на функции органов, расположенных на значительном расстоянии от той железы, в которой они образовались. Так, гормоны передней доли гипофиза, находящегося у основания мозга, воздействуют на щитовидную железу.
Специфичность действия гормонов. Определенные гормоны оказывает регулирующее влияние на определенные процессы. Так, антидиуретический гормон, выделяемой задней долей гипофиза, усиливает обратное всасывание воды в канальцах почек. Обычно на деятельность каждого органа, на каждую функцию влияют несколько гормонов. Действие этих гормонов или синергическое (в одном направлении), или антагонистическое (в противоположных направлениях). Так, гормоны коры надпочечников повышают чувствительность тканей к адреналину, а последний, в свою очередь, усиливает эффект действия этих гормонов.
Высокая биологическая активность гормонов. Гормоны образуются эндокринными железами и проявляют свое действие в очень малых количествах. Так, адреналин - гормон мозгового слоя надпочечников - вызывает учащение и усиление сокращений сердца лягушки в концентрации 1 : 10-7.
Небольшой размер молекул гормонов. Это обстоятельство позволяет им легко проникать через эндотелий капилляров и мембраны клеток.
Сравнительно быстрое разрушение гормонов тканями. Гормоны быстро разрушаются тканями, поэтому железы внутренней секреции должны вырабатывать их постоянно.
Отсутствие у большинства гормонов видовой специфичности. Можно использовать препараты, полученные из эндокринных желез разных видов животных. Однако гормоны белковой или полипептидной структуры у разных видов животных отличаются по составу и порядку соединения аминокислот.
Прогормоны — сложные вещества, производимые гормонообразующими клетками в процессе биосинтеза гормонов, являющиеся непосредственными биологическими предшественниками гормонов, сами не обладающие гормональными свойствами или обладающие низкой гормональной активностью и превращающиеся в гормоны либо непосредственно в секреторных клетках, либо в периферических тканях.
К прогормонам не относят исходные субстраты для биосинтеза гормонов, в частности, предшественники стероидных гормонов (такие, как прегненолон) или тирозин.
К прогормонам, в частности, относят:
препроинсулин
проинсулин
проопиомеланокортин
липокортин
Прогормоны в бодибилдинге
В последние два десятилетия прогормоны (простероиды) активно используются в атлетами в бодибилдинге, пауэрлифтинге и других силовых видах спорта для увеличения мышечной массы и силовых показателей. Изначально, основное преимущество прогормонов заключалось в их легальном статусе, так как формально они не относятся к анаболическим стероидам. Тем не менее в последние годы многие прогормоны занесены в список наряду со стероидами и оборот их ограничен.
На сегодняшний день, производители постоянно работают над созданием новых прогормонов, которые еще не внесены в список запрещенных, однако проходит 1-2 года и продукт изымают из оборота. Таким образом, происходит постоянная гонка компаний и государства, с отставанием последнего на какое-то время.
Как правило производители заявляют, что их прогормоны гораздо безопаснее стероидов, однако в действительности это не всегда так. Во-первых, основная цель производителя - это не создание более безопасного продукта, а синтез новой формулы, которая обладала бы анаболическим действием и при этом не была внесена в список запрещенных, в то время как вопрос безопасности уходит на второй план. Во-вторых, большинство прогормонов гораздо слабее анаболических стероидов, и этим объясняется меньшая частота побочных эффектов. Из чего можно сделать вывод, что прогормоны безопасны не более чем стероиды в умеренных дозах.
Постоянная гонка производителя и государственного контроля приводит к тому, что на рынке появляются прогормоны, которые не проходят никаких клинических испытаний, и зачастую выясняется, что эти добавки имеют довольно серьезные побочные эффекты, которые носят более тяжелый характер чем классические стероиды. Надо заметить, что прогормоны имеют статус пищевой добавки, а это значит, что контроль качества у данных продуктов значительно ниже чем у фармацевтических препаратов.
6) Все гормоны классифицируют по химическому строению, биологическим функциям и механизму действия.
1. Классификация гормонов по химическому строению
По химическому строению гормоны делят на 3 группы: пептидные (или белковые), стероидные и непептидные производные аминокислот.
Пептидные гормоны Стероиды Производные аминокислот
Адренокортикотропный гормон (кортикотропин, АКТГ) Альдостерон Адреналин
Гормон роста (соматотропин, ГР, СТГ) Кортизол Норадреналин
Тиреотропный гормон (тиреотропин, ТТГ) Кальцитриол Трийодтиронин (Т3)
Лактогенный гормон (пролактин, ЛТГ) Тестостерон Тироксин (Т4)
Лютеинизирующий гормон (лютропин, ЛГ) Эстрадиол
Фолликулостимулирующий гормон (ФСГ) Прогестерон
Меланоцитстимулирующий гормон (МСГ)
Хорионический гонадотропин (ХГ)
Антидиуретический гормон (вазопрессин, АДГ)
Окситоцин
Паратиреоидный гормон (паратгормон, ПТГ)
Кальцитонин
Инсулин
Глюкагон
2. Классификация гормонов по биологическим функциям
По биологическим функциям гормоны можно разделить на несколько групп. Эта классификация условна, поскольку одни и те же гормоны могут выполнять разные функции. Например, адреналин участвует в регуляции обмена жиров и углеводов и, кроме этого, регулирует частоту сердечных сокращений, АД, сокращение гладких мышц. Кортизол не только стимулирует глюконеогенез, но и вызывает задержку NaCl.
Регулируемые процессы Гормоны
Обмен углеводов, липйдов, аминокислот Инсулин, глюкагон, адреналин, кортизол, тироксин, соматотропин
Водно-солевой обмен Альдостерон, антидиуретический гормон
Обмен кальция и фосфатов Паратгормон, кальцитонин, кальцитриол
Репродуктивная функция Эстрадиол, тестостерон, прогестерон, гонадотропные гормоны
Синтез и секреция гормонов эндокринных желёз Тропные гормоны гипофиза, либерины и статины гипоталамуса
Изменение метаболизма в клетках, синтезирующих гормон Эйкозаноиды, гистамин, секретин, гастрин, соматостатин, вазоактивный интестинальный пептид (ВИП), цитокины
7) Зависимость скорости ферментативной реакции от рН среды
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
Фермент Оптимальное значение рН
Пепсин 1,5-2
Пируват-карбоксилаза 4,8
Каталаза 6,8-7
Фумараза 6,5
Уреаза 6,8-7,2
Кабоксипептидаза 7,5
Трипсин 6,5-7,5
Аргиназа 9,5-9,9
8) Зависимость скорости ферментативной реакции от температуры среды
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы.
Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
9) Зависимость скорости ферментативной реакции от количества субстрата
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой.
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Ферментативный процесс можно выразить следующим уравнением:
K1 K2
E+S=ES=E+P
где K1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V =Vmax[S]\Km + [S]
Это уравнение получило название уравнения Михаэлиса-Ментен.
В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
Vmах и Km - кинетические характеристики эффективности фермента.
Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше
Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
10) Виды действия гормонов
Различают пять видов действия гормонов на ткани-мишени: метаболическое, морфогенетическое, кинетическое, корригирующее и реактогенное.
1.1. Метаболическое действие гормонов
Метаболическое действие гормонов — вызывает изменение обмена веществ в тканях. Оно происходит за счет трех основных гормональных влияний.
Во-первых, гормоны меняют проницаемость мембран клетки и органоидов, что изменяет условия мембранного транспорта субстратов, ферментов, ионов и метаболитов и, соответственно, все виды метаболизма.
Во-вторых, гормоны меняют активность ферментов в клетке, приводя к изменению их структуры и конфигурации, облегчая связи с кофакторами, уменьшая или увеличивая интенсивность распада ферментных молекул, стимулируя или подавляя активацию проферментов.
В-третьих, гормоны изменяют синтез ферментов, индуцируя или подавляя их образование за счет влияния на генетический аппарат ядра клетки, как прямо вмешиваясь в процессы синтеза нуклеиновых кислот и белка, так и опосредованно через энергетическое и субстратно- ферментное обеспечение этих процессов. Сдвиги метаболизма, вызываемые гормонами, лежат в основе изменения функции клеток, ткани или органа.
1.2. Морфогенетическое действие гормонов
Морфогенетическое действие — влияние гормонов на процессы формообразования, дифференцировки и роста структурных элементов. Осуществляются эти процессы за счет изменений генетического аппарата клетки и обмена веществ. Примерами может служить влияние соматотропина на рост тела и внутренних органов, половых гормонов — на развитие вторичных половых признаков.
1.3. Кинетическое действие гормонов
Кинетическое действие — способность гормонов запускать деятельность эффектора, включать реализацию определенной функции. Например, окситоцин вызывает сокращение мускулатуры матки, адреналин запускает распад гликогена в печени и выход глюкозы в кровь, вазопрессин включает обратное всасывание воды в собирательных трубочках нефрона, без него не происходящее.
1.4. Корригирующее действие гормонов
Корригирующее действие — изменение деятельности органов или процессов, которые происходят и в отсутствие гормона. Примером корригирующего действия гормонов является влияние адреналина на частоту сердечных сокращений, активация окислительных процессов тироксином, уменьшение обратного всасывания ионов калия в почках под влиянием альдостерона. Разновидностью корригирующего действия является нормализующий эффект гормонов, когда их влияние направлено на восстановление измененного или даже нарушенного процесса. Например, при исходном превалировании анаболических процессов белкового обмена глюкокортикоиды вызывают катаболический эффект, но если исходно преобладает распад белков, глюкокортикоиды стимулируют их синтез.
В более широком плане зависимость величины и направленности эффекта гормона от имеющихся перед его действием особенностей метаболизма или функции определяется правилом исходного состояния, описанном в начале главы. Правило исходного состояния показывает, что гормональный эффект зависит не только от количества и свойств молекул гормона, но и от реактивности эффектора, определяемой числом и свойствами мембранных рецепторов к гормону. Реактивностью в рассматриваемом контексте называют способность эффектора реагировать определенной величиной и направленностью ответа на действие конкретного химического регулятора.
1.5. Реактогенное действие гормонов
Реактогенное действие гормонов — способность гормона менять реактивность ткани к действию того же гормона, других гормонов или медиаторов нервных импульсов. Так, например, кальцийрегули-рующие гормоны снижают чувствительность дистальных отделов нефрона к действию вазопрессина, фолликулин усиливает действие прогестерона на слизистую оболочку матки, тиреоидные гормоны усиливают эффекты катехоламинов. Разновидностью реактогенного действия гормонов является пермиссивное действие, означающее способность одного гормона давать возможность реализоваться эффекту другого гормона. Так, например, глюкокортикоиды обладают пермиссивным действием по отношению к катехоламинам, т.е. для реализации эффектов адреналина необходимо присутствие малых количеств кортизола, инсулин обладает пермиссивным действием для соматотропина (гормона роста) и др. Особенностью гормональной регуляции является то, что реактогенное действие гормоны могут реализовать не только в тканях — мишенях, где концентрация рецепторов к ним высока, но и в других тканях и органах, имеющих единичные рецепторы к гормону.
Пути действия гормонов
Пути действия гормонов рассматриваются в виде двух альтернативных возможностей:
1) действия гормона с поверхности клеточной мембраны после связывания со специфическим мембранным рецептором и запуска тем самым цепочки биохимических превращений в мембране и цитоплазме (эффекты пептидных гормонов и катехоламинов);
2) действия гормона путем проникновения через мембрану и связывания с рецептором цитоплазмы, после чего гормон-рецепторный комплекс проникает в ядро и органоиды клетки, где и реализует свой регуляторный эффект (стероидные Гормоны, гормоны щитовидной железы).
Считается, что функция распознавания предназначенного определенным клеткам специфического гормонального сигнала у всех клеток для всех гормонов осуществляется мембранным рецептором, а после связывания гормона с соответствующим ему рецептором, дальнейшая роль гормон- рецепторного комплекса для пептидных и стероидных гормонов различна.
У пептидных, белковых гормонов и катехоламинов гормон-рецепторный комплекс приводит к активации мембранных ферментов и образованию различных вторичных посредников гормонального регуляторного эффекта, реализующих свое действие в цитоплазме, органоидах и ядре клетки.
Известны четыре системы вторичных посредников:
1) аденилатциклаза — циклический аденозинмонофосфат (цАМФ);
2) гуанилатциклаза — циклический гуанозинмонофосфат (цГМФ);
3) фосфолипаза С — инозитолтрифосфат (ИФз);
4) ионизированный кальций
11) cAMP (цАМФ) система
3',5'-CYCLIC AMP
АМФ циклический (cAMP; структурную формулу см. рис.43 ) является универсальным посредником передачи внутриклеточного сигнала с внешней стороны клеточной мембраны к эффекторным системам клетки, действие которых вызывает генерализованную реакцию клетки на воздействие внешнего биологически-активного вещества, например гормона.
цАМФ синтезируется из АТФ при посредстве фермента аденилатциклазы .
цАМФ - основной вторичный посредник . В течение некоторого времени после открытия цАМФ в 1950 году он считался вторичным месенджером для всех гидрофильных гормонов. Связывание этих гормонов с рецептором увеличивает содержание цАМФ в клетке в результате активации фермента аденилатциклазы , превращающего АТФ ( аденозинтрифосфат ) цАМФ ( рис.1-9сер ). цАМФ затем стимулирует второй фермент, протеинкиназу , которая фосфорилирует ряд других белков. Последние обычно являются ферментами, которые существуют в активной и неактивной формах, в зависимости от того, подверглись они фосфорилированию или нет.
Таким образом, гормоны, которые действуют через цАМФ, осуществляют свою биологическую функцию путем фосфорилирования специфических ферментов и посредством этого изменяют (увеличивают или уменьшают) их активность.
Наконец, должен существовать некий механизм удаления внутриклеточного цАМФ, после того как гормон прекращает свое существование. Это удаление осуществляется вездесущим ферментом, фосфодиэстеразой , которая превращает цАМФ в неактивный метаболит аденозинмонофосфат ( АМФ ).
В ряде случаев внеклеточные лиганды после взаимодействия с рецепторами индуцируют образование вторичных мессенджеров через участие GTP-связывающих и GTP-гидролизующих гетеродимерных белков, названных G-белками.
В этих системах имеет место последовательность реакций, отображенная на рис. I.23,а. Внеклеточный лиганд специфически распознается трансмембранным рецептором, который, в свою очередь, активирует соответствующий G-белок, локализованный на цитоплазматической поверхности мембраны. Активированный G-белок изменяет активность эффектора (фермента или белка ионного канала, в данном случае - аденилатциклазы), который повышает внутриклеточную концентрацию вторичного мессенджера (в данном примере - cAMP). Каждый вид рецептора взаимодействует только с определенным представителем семейства G-белков, а каждый G-белок - со специфическим классом эффекторных молекул. Таким образом, в одном конкретном случае гормон или нейромедиатор, реагируя со своим рецептором, вызывает активацию GS-белка, стимулирующего аденилатциклазу. Этот фермент-эффектор превращает внутриклеточный ATP в cAMP - классический вторичный мессенджер. Внутриклеточный уровень cAMP может специфически понижаться под действием фосфодиэстеразы, которая превращает cAMP в 5'-AMP.
cAMP активирует множество cAMP-зависимых протеинкиназ, каждая из которых фосфорилирует определенные белки-субстраты. В большинстве клеток животных присутствуют две cAMP-зависимые протеинкиназы, фосфорилирующие белки-мишени по остаткам Ser и Thr ( серин/треониновые киназы ).
Специфичность регуляторных воздействий cAMP обеспечивается наличием в клетках определенных типов только им присущих тканеспецифических белков, являющихся субстратами для A-киназ. Например, клетки печени обогащены фосфорилазой-киназой и гликогенсинтазой, активность которых регулируется избирательным фосфорилированием по cAMP-зависимому механизму, что сопровождается накоплением или освобождением углеводов в гепатоцитах, адипоциты обогащены липазой, фосфорилирование которой по тому же механизму приводит к освобождению жирных кислот, и т.д.
При понижении концентрации гормонов во внеклеточной среде внутриклеточное содержание сАМР быстро уменьшается, так как фосфодиэстераза превращает сАМР в 5'-AMP. Одновременно происходит дефосфорилирование белков-мишеней A-киназ под действием фосфатаз . Активность некоторых фосфатаз также регулируется по cAMP- зависимому механизму. Кроме того, большинство клеток синтезирует белок, названный ингибитором протеинкиназы (PKI), который блокирует активность C-субъединиц A-киназы. Это сопровождается инактивацией соответствующих факторов транскрипции и подавлением экспрессии регулируемых ими генов.
12) Синтез и секреция гормонов регулируется нервной системой либо непосредственно, либо через выделение других гормонов или гуморальных факторов. Регуляторные центры образованы ганглиозными клетками определенных зон ЦНС. Гормоны являются необходимой составной частью системы нейроэндокринной регуляции организма.
Информация, полученная от периферических рецепторов организма и преобразованная в электрические импульсы, переносится к клеткам ЦНС. После обработки этой информации вырабатывается ответ на нее, который по эфферентным нервным волокнам переносится на рабочие органы и системы. Эта регуляция целенаправленная, быстрая, но не охватывающая функции всех клеток организма. Поэтому она дополняется регуляцией, основанной на действии гормонов.
Местом, в котором оба вида регуляции смыкаются и функционально дополняют друг друга, являются ганглиозные клетки гипоталамуса. С одной стороны, гипоталамус - это типичная нервная ткань, состоящая из нейронов - клеток нервной системы. Эти клетки посредством многочисленных волокон связаны со всеми отделами нервной системы, которая может быстро и легко передать информацию о внешнем и внутреннем состоянии организма в гипоталамус. С другой стороны, гипоталамус - типичная эндокринная железа, синтезирующая и выделяюшая специальные гормоны.
Здесь образуются гормоны пептидной природы, называемые либеринами или пусковыми факторами, которые в небольших количествах через систему портального кровообращения гипофиза приносятся к клеткам аденогипофиза. В клетках передней доли аденогипофиза под влиянием этих пептидов синтезируются различные гормоны. Попадая в кровоток, эти гормоны транспортируются к клеткам желез внутренней секреции, в которых вызывают синтез и высвобождение гормонов, оказывающих прямое биологическое действие. Под строгим контролем гипоталамуса функционируют гипофизарно-надпочечниковая, гипофизарно-тиреоидная и гипофизарно-репродуктивная системы.
В организме человека многие функции осуществялются в нормальных условиях автоматически, постоянно, со строгой последовательностью (подсосзнательно), благодаря деятельности гипоталамуса.
Нормальными местами синтеза гормонов являются: гипоталамус, передняя и задняя доли гипофиза, щитовидная и паращитовидная железы, островки в поджелудочной железе, кора и мозговой слой надпочечников, половые железы, плацента, определенные клетки желудочно-кишечного тракта, мозга, миокарда, жировой ткани. Гормоны также могут продуцироваться неэндокринными опухолями. Этот процесс называется эктопическим продуцированием гормонов.
Гормоны циркулируют в крови в очень низких концентрациях (обычно около 10-6-10-9 моль/л), но количество молекул, соответствующих этой концентрации, огромно (1017-1014 молекул/л) - практически триллионы молекул в 1 л крови. Это огромное количество молекул гормонов делает возможным их влияние на каждую отдельную клетку организма и регуляцию ее специфических метаболических процессов. Циркулирующие гормоны, однако, не действуют на все клетки одинаково. Причиной этого являются специфические рецепторные белки (рецепторы), локализованные в цитоплазматической мембране клеток, или их цитоплазме.
Рецепторы могут связывать молекулы гормонов с высокой избирательностью. Количество рецепторов на клеточных мембранах может составлять тысячи и даже десятки тысяч. Однако, количество рецепторов непостоянно. Оно регугулирется, как правило, действием соответствующих гормонов. Обычно при постоянно повышенном уровне гормона в крови число его рецепторов уменьшается. Кроме того, специфичность рецепторов невысока и поэтому они могут связывать не только гормоны, но и соединения, похожие на них по структуре. Это может стать причиной нарушения гормональной регуляции, проявляющейся резистентностью тканей к действию гормонов.
Клеточная резистентность к гормонам может быть обусловлена изменениями рецепторов клеточных мембран или нарушением соединения с внутриклеточными белками. Эти нарушения обусловлены образованием аномальных рецепторов и ферментов (чаще - врожденная патология). Приобретенная резистентность связана с возникновением антител к рецепторам.
Отличительной характеристикой эндокринной системы является гомеостатическая отрицательная обратная связь, которая частично определяет скорость продукции гормонов, фактически для всех эндокринных органов. Этот механизм направлен на поддержание стабильности в системе. Синтез и высвобождение гипофизарных гормонов не только запускаются под влиянием рилизинг-гормонов, но могут быть и остановлены под воздействием особых соединений - статинов.
Гипоталамус - высший вегетативный центр, координирующий функции различных систем для удовлетворения потребностей всего организма. Он играет ведущую роль в поддержании оптимального уровня обмена веществ (белкового, углеводного, жирового, водного и минерального) и энергии, в регуляции теплового баланса организма, функций пищеварительной, сердечно-сосудистой, выделительной, дыхательной и эндокринной систем. Под контролем гипоталамуса находятся такие железы внутренней секреции, как гипофиз, щитовидная железа, половые железы, надпочечники, поджелудочная железа. Гипоталамус имеет обширные анатомические и функциональные связи с другими структурами головного мозга.
Регуляция секреции тропных гормонов гипофиза осуществляется выделением гипоталамических нейрогормонов. Гипоталамус выделяет специфические медиаторы - рилизинг-гормоны, которые по сосудам портальной системы гипоталамуса-гипофиза поступают в гипофиз и, воздействуя непосредственно на его клетки, стимулируют или тормозят секрецию гормонов. Сеть кровеносных капилляров, относящихся к портальной системе гипоталамус-гипофиз, в срединном возвышении головного мозга образует вены, которые проходят по ножке гипофиза, а затем разделяются на вторичную капиллярную сеть в передней доле гипофиза. Гормоны гипоталамуса и гипофиза относятся к белковым и полипептидным гормонам.
13) Известны следующие либерины и статины:
соматолиберин (стимулирует продукцию гормона роста)
соматостатин (тормозит продукцию гормона роста)
гонадолиберин (люлиберин; стимулирует продукцию гонадотропных гормонов - фолликулостимулирующего и лютеинизирующего)
тиролиберин (стимулирует продукцию тиреотропного гормона)
кортиколиберин (стимулирует продукцию адренокортикотропного гормона)
дофамин (пролактостатин; тормозит продукцию пролактина)
пролактилиберин (стимулирует продукцию пролактина)
Либерины и статины синтезируются нейронами следующих ядер
переднего гипоталамуса:
(либерины и статины указаны по номерам, приведенным выше)
мелкоклеточная часть супраоптического (4,5) и паравентрикулярного (4, 5) ядер, супрахиазматическое ядро (3),преоптичесоке ядро (3), перивентрикулярное(2,3)
среднего гипоталамуса:
вентромедиальное ядро (1,6), аркуатное ядро (1,3,6)
Аксоны нейронов всех вышеназванных ядер идут в срединное возвышение и образуют синапсы с капиллярами первичной капиллярной сети.
Гипоталамус не до конца понятными механизмами контролирует работу островков Лангерганса и гомеостаз глюкозы, деятельность гормональных сисетем, обеспечивающих гомеостаз кальция (паратгормон, кальцитонин, витамин D3), натрия (альдостерон, ангиотензин-2, ренин).
Нейроны, аксоны которых оканчиваются в срединном возвышении гипоталамуса находится вне гемато- энцефалического барьера, так как нейроны имеют прямые контакты с сосудами (аксо-вазальные синапсы)
14) Тропные гормоны (син. тропины) – это гормоны, вырабатываемые передней долей гипофиза, регулирующие деятельность остальных желез внутренней секреции (щитовидной железы, надпочечников, яичников и яичек) и опосредованно влияющие на многие процессы жизнедеятельности организма.
К ним относятся:
адренокортикотропный гормон, контролирующий функционирование коры надпочечников;
тиреотропный гормон, регулирующий деятельность щитовидной железы;
соматотропный гормон (или гормон роста), регулирующий рост и развитие организма;
липотропные гормоны, ускоряющие расщепление жиров и тормозящие отложения жира;
меланоцитстимулирующий гормон, отвечающий за образование и отложение в волосах и коже пигмента меланина;
пролактин (или лактогенный гормон), отвечающий за выработку молока в период лактации;
а также группа гонадотропных гормонов: фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), отвечающих за деятельность половых желез.
Секреция и выброс тропных гормонов гипофиза осуществляется под контролем гипоталамуса и вырабатываемых им гипоталамических нейрогормонов (веществ, стимулирующих или тормозящих процессы секреции в гипофизе).
Избыточная выработка тропных гормонов может быть обусловлена аденомой гипофиза или его гиперплазией и приводит к развитию таких эндокринных заболеваний, как акромегалия, болезнь Иценко – Кушинга. Недостаточная же выработка становится причиной развития гипоталамо-гипофизарной недостаточности.
15) Инсули́н (от лат. insula — остров) — гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа.
Образование и секреция
Главным стимулом к синтезу и выделению инсулина служит повышение концентрации глюкозы в крови.
Синтез инсулина в клетке
Синтез и выделение инсулина представляют собой сложный процесс, включающий несколько этапов. Первоначально образуется неактивный предшественник гормона, который после ряда химических превращений в процессе созревания превращается в активную форму.Инсулин вырабатывается в течение всего дня,а не только в ночные часы.
Ген, кодирующий первичную структуру предшественника инсулина, локализуется в коротком плече 11 хромосомы.
На рибосомах шероховатой эндоплазматической сети синтезируется пептид-предшественник — т. н. препроинсулин. Он представляет собой полипептидную цепь, построенную из 110 аминокислотных остатков и включает в себя расположенные последовательно: L-пептид, B-пептид, C-пептид и A-пептид.
Почти сразу после синтеза в ЭПР от этой молекулы отщепляется сигнальный (L) пептид — последовательность из 24 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану ЭПР. Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина.
Созревание является наиболее длительным этапом образования инсулина. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид — фрагмент из 31 аминокислоты, соединяющий B-цепь и A-цепь. То есть молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток.
В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты.
Секреция инсулина
Бета-клетки островков Лангерганса чувствительны к изменению уровня глюкозы в крови; выделение ими инсулина в ответ на повышение концентрации глюкозы реализуется по следующему механизму:
Глюкоза свободно транспортируется в бета-клетки специальным белком-переносчиком GluT 2.
В клетке глюкоза подвергается гликолизу и далее окисляется в дыхательном цикле с образованием АТФ; интенсивность синтеза АТФ зависит от уровня глюкозы в крови.
АТФ регулирует закрытие ионных калиевых каналов, приводя к деполяризации мембраны.
Деполяризация вызывает открытие потенциал-зависимых кальциевых каналов, это приводит к току кальция в клетку.
Повышение уровня кальция в клетке активирует фосфолипазу C, которая расщепляет один из мембранных фосфолипидов — фосфатидилинозитол-4,5-бифосфат — на инозитол-1,4,5-трифосфат и диацилглицерат.
Инозитолтрифосфат связывается с рецепторными белками ЭПР. Это приводит к высвобождению связанного внутриклеточного кальция и резкому повышению его концентрации.
Значительное увеличение концентрации в клетке ионов кальция приводит к высвобождению заранее синтезированного инсулина, хранящегося в секреторных гранулах.
В зрелых секреторных гранулах кроме инсулина и C-пептида находятся ионы цинка, амилин и небольшие количества проинсулина и промежуточных форм.
Выделение инсулина из клетки происходит путём экзоцитоза — зрелая секреторная гранула приближается к плазматической мембране и сливается с ней, и содержимое гранулы выдавливается из клетки. Изменение физических свойств среды приводит к отщеплению цинка и распаду кристаллического неактивного инсулина на отдельные молекулы, которые и обладают биологической активностью.
Регуляция образования и секреции инсулина
Главным стимулятором освобождения инсулина является повышение уровня глюкозы в крови. Дополнительно образование инсулина и его выделение стимулируется во время приёма пищи, причём не только глюкозы или углеводов. Секрецию инсулина усиливают аминокислоты, особенно лейцин и аргинин, некоторые гормоны гастроэнтеропанкреатической системы: холецистокинин, ГИП, ГПП-1, а также такие гормоны, как соматостатин, АКТГ, СТГ, эстрогены и др., препараты сульфонилмочевины. Также секрецию инсулина усиливает повышение уровня калия или кальция, свободных жирных кислот в плазме крови.
Понижается секреция инсулина под влиянием глюкагона.
Бета-клетки также находятся под влиянием автономной нервной системы:
Парасимпатическая часть (холинергические окончания блуждающего нерва) стимулирует выделение инсулина;
Симпатическая часть (активация α2-адренорецепторов) подавляет выделение инсулина.
Причём синтез инсулина заново стимулируется глюкозой и холинергическими нервными сигналами.
Действие инсулина
Так или иначе инсулин затрагивает все виды обмена веществ во всём организме. Однако в первую очередь действие инсулина касается именно обмена углеводов. Основное влияние инсулина на углеводный обмен связано с усилением транспорта глюкозы через клеточные мембраны. Активация инсулинового рецептора запускает внутриклеточный механизм, который напрямую влияет на поступление глюкозы в клетку путём регуляции количества и работы мембранных белков, переносящих глюкозу в клетку.
В наибольшей степени от инсулина зависит транспорт глюкозы в двух типах тканей: мышечная ткань (миоциты) и жировая ткань (адипоциты) — это т. н. инсулинозависимые ткани. Составляя вместе почти 2/3 всей клеточной массы человеческого тела, они выполняют в организме такие важные функции как движение, дыхание, кровообращение и т. п., осуществляют запасание выделенной из пищи энергии.
Механизм действия
Подобно другим гормонам своё действие инсулин осуществляет через белок-рецептор.
Инсулиновый рецептор представляет собой сложный интегральный белок клеточной мембраны, построенный из 2 субъединиц (a и b), причём каждая из них образована двумя полипептидными цепочками.
Инсулин с высокой специфичностью связывается и распознаётся а-субъединицей рецептора, которая при присоединении гормона изменяет свою конформацию. Это приводит к появлению тирозинкиназной активности у субъединицы b, что запускает разветвлённую цепь реакций по активации ферментов, которая начинается с аутофосфорилирования рецептора.
Весь комплекс биохимических последствий взаимодействия инсулина и рецептора ещё до конца не вполне ясен, однако известно, что на промежуточном этапе происходит образование вторичных посредников: диацилглицеролов и инозитолтрифосфата, одним из эффектов которых является активация фермента — протеинкиназы С, с фосфорилирующим (и активирующим) действием которой на ферменты и связаны изменения во внутриклеточном обмене веществ.
Усиление поступления глюкозы в клетку связано с активирующим действием посредников инсулина на включение в клеточную мембрану цитоплазматических везикул, содержащих белок-переносчик глюкозы GLUT 4.
Физиологические эффекты инсулина
Инсулин оказывает на обмен веществ и энергии сложное и многогранное действие. Многие из эффектов инсулина реализуются через его способность действовать на активность ряда ферментов.
Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:
усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных веществ
Анаболические эффекты
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров.
Антикатаболические эффекты
подавляет гидролиз белков — уменьшает деградацию белков;
уменьшает липолиз — снижает поступление жирных кислот в кровь.
16) Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном.
Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон. Глюкагон был открыт в 1923 году Кимбеллом и Мерлином.
Первичная структура молекулы глюкагона следующая: NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu- Met-Asn-Thr-COOH
Физиологическая роль
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза). Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ - глюконеогенеза. Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ. Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.Глюкагон также активирует глюконеогенез, липолиз и кетогенез в печени.
Глюкагон практически не оказывает действия на гликоген скелетных мышц, по-видимому, из-за практически полного отсутствия в них глюкагоновых рецепторов. Глюкагон вызывает увеличение секреции инсулина из здоровых β-клеток поджелудочной железы и торможение активности инсулиназы. Это является, по-видимому, одним из физиологических механизмов противодействия вызываемой глюкагоном гипергликемии.
Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования цАМФ (то есть оказывает действие, подобное действию агонистов β-адренорецепторов, но без вовлечения β-адренергических систем в реализацию этого эффекта). Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений.
В высоких концентрациях глюкагон вызывает сильное спазмолитическое действие, расслабление гладкой мускулатуры внутренних органов, в особенности кишечника, не опосредованное аденилатциклазой.
Глюкагон участвует в реализации реакций типа «бей или беги», повышая доступность энергетических субстратов (в частности, глюкозы, свободных жирных кислот, кетокислот) для скелетных мышц и усиливая кровоснабжение скелетных мышц за счёт усиления работы сердца. Кроме того, глюкагон повышает секрецию катехоламинов мозговым веществом надпочечников и повышает чувствительность тканей к катехоламинам, что также благоприятствует реализации реакций типа «бей или беги».
17) Кортизол (Кр) - стероидный гормон, который вырабатывается пучковой зоной коры надпочечников. Его секреция стимулируется АКТГ передней доли гипофиза. В крови связан с транскортином (кортнкостероидсвязывающий глобулин), альбумином и секс-стероидсвязывающим глобулином. Лишь 10% Кр в крови находится в свободном состоянии и выделяется с мочой в неизмененном виде. В сутки в кровь выбрасывается 10-20 мг Кр, причем, в основном, утром и вечером. Основной эффект Кр заключается в системной регуляции обмена веществ и электролитного баланса.
Кроме содержания в крови, диагностически важным для подтверждения диагноза гиперкортицизма является определение содержания Кр в суточной моче - его экскреция. Эта величина хорошо коррелирует с уровнем свободного Кр в крови и со скоростью его синтеза.
Ранее широко применялся биохимический метод определения в крови и экскреции 11-оксикортикостероидов (11-ОКС) или 17-оксикортикостероидов (17-ОКС), основное количество которых у человека представлено Кр и, в меньшей степени, другими кортикостероидами (кортизоном, альдостероном и их метаболитами). Внедрение методов РИА и ИФА позволяет дифференцированно оценить содержание каждого из этих веществ, что повышает точность и специфичность анализа.
При интерпретации лабораторных результатов определения Кр необходимо учитывать, что Кр является стрессовым гормоном и на его уровень в крови существенно может повлиять общее психо-соматическое состояние пациента (стресс, депрессия, тяжелые сопутствующие заболевания, интоксикация), а так же условия забора крови (необходимо пациенту дать отдохнуть в комфортных условиях 30-40 минут, забор крови лучше проводить в положении лежа на спине, в идеале - сразу после пробуждения до первого вставания с кровати).
Увеличение уровня Кр в крови может быть связано с увеличением его секреции:
· синдром Кушинга,
· физическая нагрузка,
· страх, депрессия, голодание, психогенная анорексия, алкоголизм, хроническая почечная недостаточность
или с увеличением содержания в крови транспортных белков:
· беременность,
· прием эстрогенов (в т.ч. пероральных контрацептивов),
· гипертиреоз,
· сахарный диабет,
· гематологические заболевания.
Показания к определению содержания Кр в крови:
· нарушение функционирования системы гипоталамус-гипофиз-кора надпочечников;
· диагностика нарушений менструального цикла, синдрома склерокистозных яичников, эндокринного бесплодия, невынашивания беременности (наряду с ДГЭА-сульфатом);
· диагностика болезней Аддисона и Иценко-Кушинга,
· острая инфекция, шок, стресс, травматическая и ожоговая болезни;
· лечение эстрогенами (особенно при беременности);
· прием амфетамина;
· злокачественные заболевания с эктопической секрецией Кр (опухоли легких, поджелудочной железы, тимуса);
· аутоиммунные и аллергические заболевания;
· длительное лечение кортикоидами;
· дефицит ферментов синтеза Кр (в основном, 21-гидроксилазы, наряду с 17α-гидроксипргестероном).
Нормальные величины в крови- 220,1-509,0 нмоль/л; максимальный уровень отмечен в утренние часы.
Объём сыворотки или плазмы (ЭДТА, гепарин) крови и мочи, необходимый для анализа – 0,1 мл, время анализа - 2-3 часа.
Сбор мочи необходимо осуществлять в течение 24 часов, мочу во время сбора хранить в темном сосуде в прохладном месте, добавить 10 г/л борной кислоты, по окончанию сбора точно замерить объём.
Синдром гиперкортицизма (синдром Иценко-Кушинга, кушингоид) включает в себя группу заболеваний, при которых происходит длительное хроническое воздействие на организм избыточного количества гормонов коры надпочечников, независимо от причины, которая вызвала повышение количества этих гормонов в крови. В 1924 году этот синдром описан одесским неврологом Николаем Михайловичем Иценко, и независимо от него в 1912-м американским врачом Гарвеем Кушингом, который назвал его «polyglandular syndrome». Просуммировав свои наблюдения в 1932, Кушинг опубликовал работу «Базофильные аденомы гипофиза и их клинические проявления»
18) Адреналин - важнейший гормон, реализующий реакции типа «бей или беги». Его секреция резко повышается при стрессовых состояниях, пограничных ситуациях, ощущении опасности, при тревоге, страхе, при травмах, ожогах и шоковых состояниях.
Адреналин - не нейромедиатор, а гормон - то есть он не участвует напрямую в продвижении нервных импульсов. Зато, поступив в кровь, он вызывает целую бурю реакций в организме:
• усиливает и учащает сердцебиение
• вызывает сужение сосудов мускулатуры, брюшной полости, слизистых оболочек
• расслабляет мускулатуру кишечника, и расширяет зрачки. Да-да, выражение "у страха глаза велики" и байки о встречах охотников с медведями - имеют под собой абсолютно научные основания.
Основная задача адреналина - адаптировать организм к стрессовой ситуации. Адреналин улучшает функциональную способность скелетных мышц. При продолжительном воздействии адреналина отмечается увеличение размеров миокарда и скелетных мышц. Вместе с тем длительное воздействие высоких концентраций адреналина приводит к усиленному белковому обмену, уменьшению мышечной массы и силы, похуданию и истощению. Это объясняет исхудание и истощение при дистрессе (стрессе, превышающем адаптационные возможности организма).
Норадреналин - гормон и нейромедиатор. Норадреналин также повышается при стрессе, шоке, травмах, тревоге, страхе, нервном напряжении. В отличии от адреналина, основное действие норадреналина заключается в исключительно в сужении сосудов и повышении артериального давления. Сосудосуживающий эффект норадреналина выше, хотя продолжительность его действия короче.
И адреналин, и норадреналин способны вызывать тремор - то есть дрожание конечностей, подбородка. Особенно ясно эта реакция проявляется у детей возраста 2-5 лет, при наступлении стрессовой ситуации.
Непосредственно после определения ситуации как стрессовой, гипоталамус выделяет в кровь кортикотропин (адренокортикотропный гормон), который, достигнув надпочечников, побуждает синтез норадреналина и адреналина.
"Бодрящий" эффект никотина обеспечивается выбросом в кровь адреналина и норадреналина. В среднем достаточно около 7 секунд после вдыхания табачного дыма, чтобы никотин достиг мозга. При этом происходит кратковременное ускорение сердцебиения, увеличение кровяного давления, учащение дыхания и улучшение кровоснабжения головного мозга. Сопровождающий это выброс дофамина способствует закреплению никотиновой зависимости.
Интересно, что у разных животных соотношение клеток, синтезирующих адреналин и к норадреналин - колеблется. Норадреноциты весьма многочисленны в надпочечниках хищников и почти не встречаются у их потенциальных жертв. Например, у кроликов и морских свинок они почти совсем отсутствуют. Может, именно поэтому лев — царь зверей, а кролик всего лишь кролик?
Считается, что норадреналин - гормон ярости, а адреналин - гормон страха . Норадреналин вызывает в человеке ощущение злобы, ярости, вседозволенности. Адреналин и норадреналин тесно связаны друг с другом. В надпочечниках адреналин синтезируется из норадреналина. Что ещё раз подтверждает давно известную мысль, что эмоции страха и ненависти родственны, и порождаются одна из другой.
Без гормонов надпочечников организм оказывается "беззащитным" перед лицом любой опасности. Подтверждение этому — многочисленные эксперименты: животные, у которых удаляли мозговое вещество надпочечников, оказывались неспособными делать какие-либо стрессовые усилия: например, бежать от надвигающейся опасности, защищаться, или добывать пищу.
Синтез норадреналина
Предшественником норадреналина является дофамин (он синтезируется из тирозина, который, в свою очередь — производное фенилаланина), который с помощью фермента дофамин-бета-гидроксилазы гидроксилируется (присоединяет OH-группу) до норадреналина в везикулах синаптических окончаний. При этом норадреналин тормозит фермент, превращающий тирозин в предшественник дофамина, благодаря чему осуществляется саморегуляция его синтеза.
Рецепторы норадреналина
Выделяют альфа-1, альфа-2 и бета-рецепторы к норадреналину. Каждая группа делится на подгруппы, различающиеся сродством к разным агонистам, антагонистам и, частично, функциями. Альфа-1 и бета-рецепторы могут быть только постсинаптическими и стимулируют аденилатциклазу, альфа-2 могут быть и пост-, и пре-синаптическими, и тормозят аденилатциклазу. Бета-рецепторы стимулируют липолиз.
19) Альдостерон — основной минералокортикостероидный гормон коры надпочечников у человека. У некоторых видов животных основным естественным минералокортикоидом является дезоксикортикостерон, а не альдостерон, но для человека дезоксикортикостерон относительно малоактивен.
Минералокортикоиды вызывают усиление канальцевой реабсорбции катионов натрия, анионов хлора и одновременно усиливают канальцевую экскрецию катионов калия и повышают гидрофильность тканей (способность тканей удерживать воду), способствуют переходу жидкости и натрия из сосудистого русла в ткани.
Альдостерон образуется в клубочковой зоне коры надпочечников и является единственным поступающим в кровь минералокортикоидом человека. Регуляция синтеза и секреции альдостерона осуществляется преимущественно ангиотензином-II, что дало основание считать альдостерон частью ренин-ангиотензин-альдостероновй системой (РААС), обеспечивающей регуляцию водно-солевого обмена и гемодинамики. Поскольку альдостерон регулирует содержание в крови ионов Na+ и K+, обратная связь в регуляции реализуется прямыми эффектами ионов, особенно К+, на клубочковую зону. В РААС обратные связи включаются при сдвигах содержания Na+ в моче дистальных канальцах, объема и давления крови. Механизм действия альдостерона, как и всех стероидных гормонов, состоит в прямом влиянии на генетический аппарат ядра клеток со стимуляцией синтеза соответствующих РНК, активации синтеза транспортирующих катионы белков и ферментов, а также повышении проницаемости мембран для аминокислот. Основные физиологические эффекты альдостерона заключаются в поддержании водно-солевого обмена между внешней и внутренней средой организма. Одними из главных органов-мишеней гормона являются почки, где альдостерон вызывает усиленную реабсорбцию натрия в дистальных канальцах с его задержкой в организме и повышении экскреции калия с мочой. Под влиянием альдостерона происходит задержка в организме хлоридов и воды, усиленное выделение Н-ионов и аммония, увеличивается объем циркулирующей крови, формируется сдвиг кислотно-щелочного состояния в сторону алкалоза. Действуя на клетки сосудов и тканей, гормон способствует транспорту Na+ и воды во внутриклеточное пространство.
Конечным результатом действия минералокортикоидов является увеличение объёма циркулирующей крови и повышение системного артериального давления. В патологических случаях гиперальдостеронизма это приводит к развитию отёков, гипернатриемии, гипокалиемии, гиперволемии, артериальной гипертензии и иногда застойной сердечной недостаточности.
Водно-электролитным обменом называется совокупность процессов поступления воды и электролитов в организм, распределения их во внутренней среде и выделения из организма.
Жидкости организма не застаиваются в анатомических пространствах, в них постоянно протекают интенсивные процессы внутреннего обращения:
фильтрационные;
секреторные;
диффузионные;
осмотические.
Гидростатическое давление крови вытесняет из артериальных капилляров жидкость, которая через лимфатические пути и венозные капилляры попадает вновь в венозную систему. При различных воздействиях (температурные сдвиги среды, разный уровень физической активности, изменение характера питания) различные показатели данного процесса может меняться.
При участии воды формируются такие структуры, как:
клеточные мембраны;
транспортные частицы крови;
макромолекулярные образования;
надмолекулярные образования.
В процессе обмена веществ и окисления водорода образуется «вода окисления», ее количество зависит от обмена веществ.
20) Кальцитонин (КТ) – гормон, выделяемый щитовидной железой. Участвует в регуляции обмена кальция. Антагонист паратгормона (ПТГ), то есть имеет противоположное действие. О паратгормоне читайте статью "Паратгормон". В клетках костей кальцитонин подавляет действие ферментов, разрушающих костную ткань. Гормон предотвращает высвобождение кальция из кости и по этой причине его вводят при остеопорозе (разрежение, разрыхление костей, снижение костной плотности). В клетках почек способствует выведению из организма кальция, фосфора, магния, натрия, калия, тем самым приводит к снижению концентрации их в крови. Регуляцию образования кальцитонина осуществляет кальций – повышенная его концентрация способствует выработке гормона, сниженная замедляет этот процесс.
Кальцитонин осуществляет:
• Торможение резорбции костной ткани, снижая активность остеокластов
• Стимулирует остеобласты
• Подавляет канальцевую реабсорбцию кальция в почках, усиливая его экскрецию
• Тормозит всасывание кальция в тонкой кишке
В медицинской практике определение КТ необходимо для диагностики медуллярного рака щитовидной железы (опухоль с быстрым появлением метастазов в лимфатических узлах шеи). При этом заболевании содержание гормона кальцитонина в крови резко возрастает. В этом случае КТ выступает в роли онкомаркёра. Стойкое повышение КТ после удаления опухоли указывает на неэффективность операции или наличие метастазов. При прогрессировании болезни уровень КТ стремительно нарастает.
Также исследование КТ используют для оценки нарушений кальциевого обмена совместно с паратгормоном (ПТГ).
Повышение уровня кальцитонина может быть при
незлокачественных опухолях лёгких
почечной недостаточности
остром панкреатите (воспаление поджелудочной железы)
повышенной функции паращитовидных желёз (четыре маленькие эндокринные железы на задней поверхности щитовидной железы)
пернициозной анемии (нарушение кроветворения вследствие недостатка в организме витамина B12.)
болезни Педжета (хроническое заболевание костей, пораженные болезнью кости становятся тонкими, нарушается их строение)
злокачественных опухолях молочной железы, желудка, почек, печени, простаты
Повышение уровня гормона кальцитонина может быть при следующих состояниях
беременности ( особенно перед родами)
у новорожденных
лечении эстрогенами (женские половые гормоны)
после внутривенного введения кальция
после приёма алкоголя.
ПТГ – пратгормон или паратиреоидный гормон. Выделяется паращитовидными железами (или околощитовидными - четыре маленькие железы на задней поверхности щитовидной железы). ПТГ повышает концентрацию кальция и фосфора в крови. Чем ниже их содержание, тем выше уровень ПТГ. Гормон усиливает всасывание кальция и фосфора в кишечнике и дальнейшее их усвоение.
При нарушении продукции паратиреоидного гормона страдает кальций-фосфорный обмен. Органы, на которые воздействует ПТГ – кости, почки, тонкая кишка. При патологически повышенном действии (гиперфункции) паращитовидных желёз в кости образование новой костной ткани отстаёт от естественного рассасывания старой. Это ведёт к остеопорозу (заболевание, характеризующееся снижением плотности костей , химический состав кости не изменяется, но снижается её плотность, уменьшается прочность и увеличивается вероятность переломов), вымыванию кальция из кости, а следовательно, к повышению его концентрации в крови. При этом
в почках повышается выведение солей фосфора (фосфатов)
в желудке и в тонком кишечнике возникает опасность развития язвенной болезни в связи с тем, что повышенный уровень кальция вызывает кальцификацию сосудов (обызвествление, отложение солей кальция)
прямое действие повышенного паратгормона также способствует образованию язв в слизистых оболочках
Повышенное образование ПТГ в паращитовидных железах может быть первичным ( заболевание называется первичный гиперпаратиреоз) и вторичным ( вторичный гиперпаратиреоз).
Первичный гиперпаратиреоз вызывается опухолями паращитовидной железы (аденомой, бластомой). Опухоли эти почти всегда доброкачественны. Лишь в редких случаях может быть злокачественная опухоль – карцинома паращитовидных желёз. С возрастом частота опухолевого процесса возрастает. В крови при этом
ПТГ повышен
кальций повышен
фосфор в норме или снижен.
Повышение ПТГ вторичного характера ( заболевание называется вторичный гиперпаратиреоз) разрастание ткани паращитовидных желёз обусловлено
хронической почечной недостаточностью
дефицитом витамина Д3 и кальция.
В крови при этом
ПТГ повышен
кальций снижен или в норме
кальцитонин (КТ) снижен. (Читайте статью "Кальцитонин")
Недостаточная деятельность паращитовидных желёз ( гипофункция, гипопаратиреоз) характеризуется снижением уровня ПТГ в крови. При этом
уровень фосфора в крови повышен
уровень кальция понижен
кальцитонин (КТ) снижен
кальцитриол снижен (Читайте статьи "Кальцитонин" и "Кальцитриол").
Существует наследственное заболевание (синдром Олбрайта), когда при нормальной функции паращитовидный желёз в тканях отсутствуют рецепторы к действию ПТГ и он не может влиять на содержание кальция и фосфора.
21) Тироксин
Тироксин, 3,5,31,51-тетраиодтиронин, основной тиреоидный гормон позвоночных животных и человека, вырабатываемый фолликулами щитовидной железы. Синтезируется путём иодирования аминокислоты тирозина и окислительного конденсирования 2 молекул дииодтирозина с отщеплением аланина. Т. освобождается (как и др. тиреоидный гормон — трииодтиронин) при ферментативном расщеплении его комплекса с белком тиреоглобулином; при поступлении в кровь соединяется с белками плазмы. Связанный Т. находится в состоянии подвижного равновесия со свободным Т., который диффундирует в периферические клетки, где оказывает своё физиологическое действие.
У земноводных и некоторых костистых рыб (угрей, камбаловых) Т. стимулирует метаморфоз; у теплокровных животных и человека повышает интенсивность основного обмена и тем самым увеличивает теплопродукцию, оказывает влияние на рост и дифференцировку тканей. Введение в организм Т. спустя сутки вызывает повышение основного обмена (что сопровождается усиленным потреблением кислорода), учащение сердцебиений, повышение возбудимости нервной системы и др.
На изолированных митохондриях показано, что в высоких концентрациях Т. вызывает разобщение окислительного фосфорилирования. В результате энергия потока электронов в дыхательные цепи не запасается в форме богатых энергией соединений (АТФ и др.), а высвобождается в виде тепла. Действие Т. на ферменты окислительного фосфорилирования объясняют его способностью связывать ионы металлов, необходимых для активности этих ферментов. Синтез и секреция Т. щитовидной железой регулируется тиреотропным гормоном (ТТГ) гипофиза, причём образование Т. и ТТГ регулируется по принципу отрицательной обратной связи: повышение уровня Т. в крови тормозит секрецию ТТГ и тем самым уменьшает секрецию Т.; при понижении концентрации Т. секреция ТТГ увеличивается, и баланс Т. восстанавливается.
Кроме того, на секрецию Т. влияют факторы внешней среды (температура и стресс), пища (йод), состояние др. эндокринных желёз. Нарушение баланса Т.] (и трииодтиронина) у человека приводит к различным заболеваниям.
22) Болезнь Помпе относится к болезням накопления гликогена, гликогенозам II типа (кардиальный гликогеноз). Это аутосомно-рецессивное заболевание, характеризующееся отсутствием лизосомальных кислых альфа-1,4-глюкозидаз, что приводит к чрезмерному накоплению гликогена в лизосомах тканей.
Макроскопически выявляется утолщение стенок обоих желудочков при нормальном миокарде перегородок сердца.
Клиническая картина болезни Помпе. При рождении симптомы отмечаются у 25—30% больных. У младенцев уже с рождения выявляются симптомы угнетения ЦНС, плохая прибавка в весе. У них диагностируется большой язык, одутловатость лица, затрудненное дыхание, мышечная слабость, нарушение акта сосания. Сердце всегда увеличено в размерах. При аускультации может выслушиваться «мягкий» вариабельный систолический шум с максимумом на верхушке сердца. Пальпируется увеличенная печень. Постепенно развивается сердечная недостаточность, которая в большинстве случаев служит непосредственной причиной смерти.
Диагноз болезни Помпе ставится с учетом семейного анамнеза и данных биопсии скелетных мышц, содержащих депонированный гликоген в клетках с отсутствием кислых глюкозидаз.
На рентгенограмме определяется увеличение размеров сердца за счет всех отделов, застойные явления в легких.
Типична ЭКГ, на которой регистрируется укорочение интервала PQ, очень высокий и часто широкий комплекс QRS в левых прекордиальных отведениях, удлинение фазы реполяризации желудочков с инверсией зубца Т и дугообразным интервалом ST.
На эхоКГ выявляется гипертрофия стенок всех отделов сердца с резким уменьшением их полостей во время систолы.
В раннем периоде заболевания нет нарушения сократимости, оно развивается позже, одновременно с дилатацией желудочков. Симптомы сердечной недостаточности появляются к концу первого, началу второго месяца жизни.
Лечение болезни Помпе. Специфических методов лечения нет. Лечение симптоматическое, при терапии сердечной недостаточности следует учитывать опасность применения сердечных гликозидов.
Прогноз. Большинство детей погиоают до окончания первого года жизни.
Кардиомиопатии при врожденном гипо- и гипертиреоидизме.
Кардиопатия у новорожденных детей со сниженной функцией щитовидной железы наблюдается редко.
A. Avanzini et al. описали случай гипотиреоидной кардиопатии у глуооко недоношенного новорожденного ребенка, которая постнатально проявлялась в виде брадикардии, низкоамплитудных желудочковых комплексов QRS на ЭКГ. На первой неделе жизни у этого младенца развилась сердечная недостаточность.
Эхокардиографические исследования новорожденных детей с врожденным гипотиреоидизмом выявляют у них с большой частотой перикардиальный выпот.
Лечение тироксином приводит к быстрому улучшению функции сердца и показателей электро- и эхокардиографии.
Неонатальный тиреотоксикоз имеет место при трансплацентарной трансфузии тиреоидстимулирующего иммуноглобулина от матери.
Клинические проявления могут появляться в периоде новорожденности. Гипертиреоидизм может сочетаться с тяжелыми сердечными осложнениями, включая суправентрикулярную тахикардию, кардиомиопатию и застойную сердечную недостаточность. Отмечается случай возникновения обратимой легочной гипертензии у новорожденного с гипертиреоидизмом и сердечной недостаточностью.
Терапия сердечной недостаточности и тиреоидной функции приводит к полной регрессии легочной гипертензии.
Причины
Этиология • Диффузный токсический зоб (болезнь Грейвса) — наиболее частая причина гипертиреоза • Узловой токсический зоб (болезнь Пламмера) наблюдают реже, чем болезнь Грейвса, и обычно у более пожилых лиц • Подострый тиреоидит (тиреоидит де Кервена) способен вызвать преходящий гипертиреоз • Искусственный гипертиреоз может быть следствием бесконтрольного приёма тиреоидных гормонов • Редкие причины гипертиреоза: •• Опухоли гипофиза с избыточной секрецией ТТГ (например, синдром Труэлля–Жюне, или гипертиреоз акромегалоидный с гиперостозом, — сочетание диффузного гиперостоза свода черепа, акромегалии и признаков гиперфункции щитовидной железы, обусловленное увеличенной секрецией аденогипофизом СТГ и ТТГ) •• Тератомы яичников, вырабатывающие тиреоидные гормоны (струма яичника) •• Гиперпродукция гормонов щитовидной железой после избыточного введения в организм йода (синдром «йод - базедов»).
Патогенез • Тиреоидные гормоны увеличивают потребление кислорода тканями, повышая образование тепла и энергетический обмен • Повышается чувствительность тканей к катехоламинам и симпатической стимуляции • Увеличивается превращение андрогенов в эстрогены в тканях и возрастает содержание циркулирующего глобулина, связывающего половые гормоны, что повышает соотношение эстрогенов и андрогенов. Эти гормональные изменения могут вызвать гинекомастию у мужчин • Быстрое разрушение кортизола под влиянием тиреоидных гормонов обусловливает клиническую картину гипокортицизма (обратимая надпочечниковая недостаточность).
Факторы риска • Отягощённый семейный анамнез • Женский пол • Аутоиммунные заболевания.
23) Мужские половые гормоны
Мужские половые гормоны (рис. 11-39) вырабатываются в основном в мужских половых железах - в интерстициальных клетках Лейдига семенников (95%). Небольшое количество андрогенов образуется в коре надпочечников.
1. Синтез андрогенов
Путь биосинтеза андрогенов в яичках и коре надпочечников одинаков. Предшественником андрогенов, как и других стероидных гормонов, служит холестерол (рис. 11-40), который либо поступает из плазмы в составе ЛПНП, либо синтезируется в самих железах из ацетил-КоА.
Отщепление боковой цепи холестерола и образование прегненолона -скорость-лимитирующая реакция. Однако, в отличие от аналогичной реакции, протекающей в надпочечниках, эта стадия стимулируется ЛГ (а не АКТГ). ЛГ, связываясь с рецептором плазматической мембраны клеток Лейдига, активирует аденилатциклазу, увеличивая тем самым внутриклеточную концентрацию цАМФ, что в конечном итоге вызывает активацию фермента, который расщепляет боковую цепь холестерола между С-20 и С-22.
Тестостерон. Превращение прегненолона в тестостерон катализируется пятью микросо-мальными ферментами и может протекать двумя путями: через образование дегидроэпиандростерона или через образование прогестерона (что, по-видимому, преобладает в семенниках человека).
Суточная секреция тестостерона у мужчин составляет в норме примерно 5 мг и сохраняется на протяжении всей жизни организма. Гормон циркулирует в крови в связанном с белками плазмы состоянии: альбумином (40%) и специфически связывающим половые гормоны р-глобулином (называемым секс-гормонсвязывающим глобулином, СГСГ). Лишь 2% от общего количества гормона в крови транспортируется в свободном виде, и именно такие молекулы проявляют биологическую активность.
Дигидротестостерон. В семенных канальцах, предстательной железе, коже, наружных половых органах тестостерон служит предшественником более активного адцрогена - дигидротестостерона. Это превращение, в котором участвует примерно 4% тестостерона, происходит в результате восстановления двойной связи кольца А и 3-кетогруппы при участии цитоплазматического фермента - NADPH-зависимой 5α-редуктазы. Семенники человека секретируют в сутки до 50-100 мкг дигидротестостерона. Однако большее количество гормона - следствие периферических превращений, и суммарная сугочная секреция дигидротестостерона составляет 400 мкг, что почти в 10 раз меньше уровня секреции тестостерона.
В некоторых периферических тканях небольшое количество тестостерона превращается в эстрадиол. В качестве побочных продуктов клетки Лейдига также постоянно секретируют эстрадиол и прогестерон, хотя роль этих гормонов в развитии и поддержании функций размножения и формирования полового поведения у мужчин до настоящего времени не выяснена.
2. Регуляция синтеза и секреции андрогенов
В препубертатный период секреция андрогенов подавляет по механизму отрицательной обратной связи секрецию гонадотропина до начала пубертатного периода, когда гипофизарные клетки становятся менее чувствительными к ингибирующему действию циркулирующих в крови андрогенов. Эта потеря чувствительности приводит к циклически импульсному освобождению ЛГ и ФСГ. ЛГ, связьюаясь с рецепторами клеток Лейдига, стимулирует образование тестостерона интерстициальными клетками Лейдига, а ФСГ, связываясь с рецепторами клеток Сертоли в семенниках, стимулирует сперматогенез.
Тестостерон замыкает отрицательную обратную связь на уровне гипофиза и гипоталамуса, уменьшая частоту секреторных импульсов ЛГ. Торможение секреции ФСГ аденогипофизом происходит под действием белка ингибина, вырабатываемого клетками Сертоли. ФСГ стимулирует синтез этого белка, который по механизму отрицательной обратной связи тормозит дальнейшую секрецию ФСГ.
3. Мишени для андрогенов
К мишеням тестостерона относят эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки, мозг. Подобно другим стероидным гормонам, андрогены образуют внутри клетки комплекс с рецептором, который связывается с определённым участком хроматина, активируя специфические гены, белковые продукты которых опосредуют биологические эффекты андрогенов.
4. Эффекты андрогенов
Физиологическое действие андрогенов различно в разные периоды жизни организма. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. Поскольку андрогены в организме обладают мощным анаболическим действием и стимулируют клеточное деление, повышенный уровень андрогенов в препубертатный период приводит к скачкообразному увеличению линейных размеров тела, увеличению скелетных мышц, росту костей, но одновременно способствуют и остановке роста, так как стимулируют сращение эпифизов длинных костей с их стволами. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз.
В. Женские половые гормоны
В яичниках синтезируются женские половые гормоны - эстрогены и прогестины, среди которых наиболее активны 17β-эстрадиол и прогестерон (рис. 11-42).
1. Образование эстрогенов
Согласно современным представлениям, образование эстрогенов яичников предполагает выработку андрогенов (андростендиона) в клетках теки фолликулов с последующей ароматизацией андрогенов в клетках гранулёзы. В клетках теки синтезируются рецепторы ЛГ. Рецепторы ФСГ образуются в клетках гранулёзы. ЛГ, связываясь с рецепторами клеток теки и активируя фермент, который катализирует отщепление боковой цепи холестерола и превращение его в прегненолон, тем самым стимулирует образование основного андрогена яичников - андростендиона. ФСГ, взаимодействуя с рецепторами клеток гранулёзы, активирует содержащийся в этих клетках ароматазный ферментативный комплекс и стимулирует превращение андрогенов, вырабатываемых клетками теки, в эстрогены. Ароматизация андрогенов под действием ароматазного комплекса, содержащего цитохром Р450-оксидазу, включает 3 реакции гидроксилирования, которые протекают с участием О2 и NADPH.
Непосредственно в клетках теки синтезируется очень небольшое количество эстрогенов. Значительная часть эстрогенов продуцируется путём периферической ароматизации андрогенов в жёлтом теле, фетоплацентарном комплексе (во время беременности), корой надпочечников, в жировых клетках, печени, коже и других тканях, где обнаружена повышенная ароматазная активность.
В клетках гранулёзы может синтезироваться менее активный эстроген - эстрон, а ещё менее активный эстриол образуется из эстрона в крови. В печени β-эстрадиол инактивируется в результате гидроксилирования ароматического кольца по атому углерода С2 и образования конъюгатов с серной или глюкуроновой кислотами, которые и выводятся из организма с жёлчью или мочой.
Примерно 95% циркулирующих в крови эстрогенов связано с транспортными белками - СГСЁ (секс-гормонсвязывающий белок) и альбумином. Биологической активностью обладает только свободная форма эстрогенов.
2.Регуляция секреции эстрогенов
В детском возрасте незрелые яичники вырабатывают небольшое количество гормонов, поэтому концентрация эстрогенов в крови низкая. В пубертатный период чувствительность гипоталамо-гипофизарной системы к действию ЛГ и ФСГ снижается. Импульсная секреция гонадотропин-рилизинг-гормона устанавливает суточный ритм секреции ЛГ и ФСГ. В начале каждого менструального цикла секреция ФСГ и ЛГ вызывает развитие первичных фолликулов. Созревающий фолликул в результате совместного действия ЛГ, стимулирующего продукцию андрогенов клетками теки, и ФСГ, стимулирующего ароматизацию андрогенов, секретирует эстрогены, которые по механизму отрицательной обратной связи угнетают секрецию ФСГ.
Концентрация ФСГ в крови остаётся низкой ещё и в результате торможения секреции этого гормона белком ингибином, выделяемым яичниками (рис. 11-43).
По мере созревания фолликула (фолликулярная фаза) концентрация эстрадиола повышается, чувствительность гипофизарных клеток к гонадолиберину возрастает, и эстрадиол по механизму положительной обратной связи повышает секрецию ЛГ и ФСГ.
Повышение секреции ЛГ приводит к овуляции - освобождению яйцеклетки из лопнувшего фолликула. После овуляции клетки гранулёзы превращаются в жёлтое тело, которое, помимо эстрадиола, начинает вырабатывать всё большее количество основного гормона лютеиновой фазы - прогестерона (прогестина). Если возникает беременность, жёлтое тело продолжает функционировать и секретировать прогестерон, однако на более поздних этапах беременности прогестерон в основном продуцируется плацентой. Если оплодотворение не происходит, высокая концентрация прогестерона в плазме крови по механизму отрицательной обратной связи угнетает активность гипоталамо-гипофизарной системы, тормозится секреция ЛГ и ФСГ, жёлтое тело разрушается, и снижается продукция стероидов яичниками. Наступает менструация, которая длится примерно 5 дней, после чего начинает формироваться новый поверхностный слой эндометрия, и возникает новый цикл.
3. Механизм действия и биологические
эффекты эстрогенов
Эстрогены связываются с внутриклеточными рецепторами и, подобно другим стероидным гормонам, регулируют транскрипцию структурных генов. Предполагается, что эстрогены индуцируют синтез свыше 50 различных белков, участвующих в проявлении физиологических эффектов эстрогенов.
Эстрогены стимулируют развитие тканей, участвующих в размножении, определяют развитие многих женских вторичных половых признаков, регулируют транскрипцию гена рецептора прогестина. В лютеиновой фазе под действием эстрогенов вместе с прогестинами пролиферативный эндометрий (эпителий матки) превращается в секреторный, подготавливая его к имплантации оплодотворённой яйцеклетки.
Совместно с простагландином F2α эстрогены увеличивают чувствительность миометрия к действию окситоцина во время родов. Эстрогены оказывают анаболическое действие на кости и хрящи. Другие метаболические эффекты эстрогенов включают поддержание нормальной структуры кожи и кровеносных сосудов у женщин, способствуют образованию оксида азота в сосудах гладких мышц, что вызывает их расширение и усиливает теплоотдачу. Эстрогены стимулируют синтез транспортных белков тиреоидных и половых гормонов. Эстрогены могут индуцировать синтез факторов свёртывания крови II, VII, IX и X, уменьшать концентрацию антитромбина III.
Эстрогены оказывают влияние на обмен липидов. Так, увеличение скорости синтеза ЛПВП и торможение образования ЛПНП, вызываемое эстрогенами, приводит к снижению содержания холестерола в крови.
4. Образование прогестерона
Прогестерон, образующийся главным образом жёлтым телом во время менструации в лю-теиновую фазу, секретируется также фетоплацентарным комплексом во время беременности. В небольших количествах он вырабатывается у женщин и мужчин корой надпочечников. В фолликулярной фазе менструального цикла концентрация прогестерона в плазме обычно не превышает 5 нмоль/л, а в лютеиновой фазе увеличивается до 40-50 нмоль/л. В крови прогестерон связывается с транспортным глобулином транскортином и альбумином, и только 2% гормона находится в свободной биологически активной форме. Диффундируя в клетки-мишени, прогестерон связывается со специфическим ядерным рецептором. Образующийся комплекс гормон-рецептор взаимодействует с промоторным участком ДНК и активирует транскрипцию генов. Т1/2 прогестерона в крови составляет 5 мин. В печени гормон конъюгируется с глюкуроновой кислотой и выводится с мочой.
5. Биологические эффекты прогестерона
Действие прогестерона в основном направлено на репродуктивную функцию организма. Образование прогестерона отвечает за увеличение базальной температуры тела на 0,2-0,5 °С, которое происходит сразу после овуляции и сохраняется на протяжении лютеиновой фазы менструального цикла. При высоких концентрациях прогестерон взаимодействует с рецепторами, локализованными в клетках почечных канальцев, конкурируя таким образом с альдостероном. В результате конкурентного игибирования альдостерон теряет возможность стимулировать реабсорбцию натрия.
Прогестерон может также оказывать действие и на ЦНС, в частности вызывать некоторые особенности поведения в предменструальный период.
24) Действие гормона роста на органы и ткани
Гормоном роста соматотропин называют за то, что у детей и подростков, а также молодых людей с ещё не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет роста длинных трубчатых костей конечностей. Соматотропин оказывает мощное анаболическое и анти-катаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению сгорания жира и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена — он вызывает выраженное повышение уровня глюкозы в крови и является одним из контринсулярных гормонов, антагонистов инсулина по действию на углеводный обмен. Описано также его действие на островковые клетки поджелудочной железы, иммуностимулирующий эффект, усиление поглощения кальция костной тканью и др. Многие эффекты гормон роста вызывает непосредственно, но значительная часть его эффектов опосредуется инсулиноподобными факторами роста, главным образом IGF-1 (ранее его называли соматомедином С), который вырабатывается под действием гормона роста в печени и стимулирует рост большинства внутренних органов. Дополнительные количества IGF-1(Insulin–like growth factor) синтезируются в тканях-мишенях.
Рецептор гормона роста и механизм его действия
Рецептор гормона роста — трансмембранный белок, относящийся к суперсемейству рецепторов с тирозинкиназной активностью. Согласно данным большинства исследователей при взаимодействии с одной молекулой гормона происходит объединение двух молекул рецептора (димеризация), после чего рецептор активируется, и его внутриклеточный домен фосфорилирует сам рецептор и основной белок-мишень — янус-киназу (JAK-2). Дальнейшая передача сигнала идет несколькими путями — через белки STAT янус-киназа активирует транскрипцию ряда генов, через белок IRS (субстрат инсулинового рецептора) осуществляется влияние на транспорт глюкозы в клетки и др. JAK-2 может также непосредственно активировать другие рецепторы, например, рецептор эпидермального фактора роста, чем, видимо, объясняется митогенное действие гормона роста.
Регуляция секреции гормона роста
Главные регуляторы секреции гормона роста — пептидные гормоны гипоталамуса (соматостатин и соматолиберин), которые выделяются нейросекреторными клетками гипоталамуса в портальные вены гипофиза и действуют непосредственно на соматотропы. Однако на баланс этих гормонов и на секрецию гормона роста влияет множество физиологических факторов. Стимулируют секрецию гормона роста:
соматолиберин
грелин
сон
физические упражнения
потребление большого количества белков с пищей
увеличение секреции андрогенов в пубертатный период (у самцов в семенниках, а у самок в коре надпочечников)
аминокислота аргинин
гипогликемия
При гипогликемии уровень соматотропина в крови резко повышается — это один из естественных физиологических механизмов быстрой коррекции гипогликемии.
Подавляют секрецию гормона роста:
соматостатин
высокая концентрация гормона роста и инсулиноподобного фактора роста IGF-1 в плазме крови (действие по принципу отрицательной обратной связи на гипоталамус и переднюю долю гипофиза)
гипергликемия
высокое содержание свободных жирных кислот в плазме крови
глюкокортикоиды
эстрадиол и другие эстрогены.
На секрецию гормона роста влияют также некоторые ксенобиотики.
25) Регуляция секреции гормонов
Гормональная регуляция, регуляция жизнедеятельности организма животных и человека, осуществляемая при участии поступающих в кровь гормонов; одна из систем саморегуляции функций, тесно связанная с нервной и гуморальной системами регуляции и координации функций.
Одним из важнейших биологических процессов является регуляция секреции гормонов, обеспечивающая их образование, выделение из клеток и поступление в циркуляцию в количестве, необходимом для поддержания процессов метаболизма и других функций тканей и органов. Составными частями этой регулирующей системы являются гуморальные факторы, к которым надо отнести продукты метаболизма и гормоны, нейро-гормональные и нервные факторы.
Можно привести ряд примеров влияния продуктов метаболизма на различные этапы секреции гормонов. Так, примером гуморальных регуляций является выделение инсулина из бета-клеток островков поджелудочной железы во внеклеточное пространство и циркуляцию, при повышении уровня гликемии, тимуляторами этой секреции являются также аминокислоты, оординированно с процессом выделения инсулина происходит овышение его биосинтеза. Снижение уровня сахара крови способствует понижению секреции инсулина, повышению секреции и поступлению в циркуляцию его гормональных антагонистов — глюкагона, вырабатываемого альфа-клетками островков поджелудочной железы, гормона роста, гидрокортизона, адреналина и медиатора норадреналина. Это строго координированное взаимодействие ряда гормонов в итоге сложных метаболических процессов обеспечивает сохранение физиологического уровня сахара крови и метаболизма глюкозы.
Кроме регуляции секреции гормонов в ответ на повышенный к ним запрос, существенное значение имеет высвобождение гормонов из их связи с белками. Изучены специфические белки, связывающие в плазме крови инсулин, тироксин, гормон роста, прогестерон, гидрокортизон, кортикостероп и другие гормоны. Гормоны и протеины связаны нековалентными связями, обладающими сравнительно низкой энергией, поэтому эти комплексы легко разрушаются, освобождая гормон. Комплексирование с белками дает возможность сохранять часть гормона в неактивной форме. Кроме того, эта связь защищает гормон от действия химических и энзи-матических факторов. К представлению, что связанные с белками гормоны являются одной из транспортных форм в циркуляции и обеспечивают их резервирование, добавились другие факты: важным компонентом биологического значения этих комплексов является возможность быстрого высвобождения из них свободных, т. е. активных, гормонов.
Регуляция секреции гормонов осуществляется несколькими связанными между собой механизмами. Их можно проиллюстрировать на примере кортизола, основного глюкокортикоидного гормона надпочечников. Его продукция регулируется по механизму обратной связи, который действует на уровне гипоталамуса. Когда в крови снижается уровень кортизола, гипоталамус секретирует кортиколиберин – фактор, стимулирующий секрецию гипофизом кортикотропина (АКТГ). Повышение уровня АКТГ, в свою очередь, стимулирует секрецию кортизола в надпочечниках, и в результате содержание кортизола в крови возрастает. Повышенный уровень кортизола подавляет затем по механизму обратной связи выделение кортиколиберина – и содержание кортизола в крови снова снижается. Секреция кортизола регулируется не только механизмом обратной связи. Так, например, стресс вызывает освобождение кортиколиберина, а соответственно и всю серию реакций, повышающих секрецию кортизола. Кроме того, секреция кортизола подчиняется суточному ритму; она очень высока при пробуждении, но постепенно снижается до минимального уровня во время сна. К механизмам контроля относится также скорость метаболизма гормона и утраты им активности. Аналогичные системы регуляции действуют и в отношении других гормонов.
Самое важное значение имеет в регуляции секреции гормонов центральная нервная система. Одной из важнейщих областей ЦНС, координирующей и контролирующей функции эндокринных желез, является гипоталамус, где локализуются нейросекреторные ядра и центры, принимающие участие в регуляции синтеза и секреции гормонов аденогипофиза. Гипоталамо-гипофизарная регуляция осуществляется механизмами, функционирующими по принципу обратной связи, в которых четко выделяются различные уровни взаимодействия
Под “длинной” цепью обратной связи подразумевается взаимодействие периферической эндокринной железы с гипофизарными и гипоталамическими центрами (не исключено, что и с супрагипоталамическими и другими областями ЦНС) посредством влияния на указанные центры изменяющейся концентрации гормонов в циркулирующей крови.
Под “короткой” цепью обратной связи понимают такое взаимодействие, когда повышение гипофизарного тропного гормона (например, АКТГ) модулирует и модифицирует секрецию и высвобождение гипофизотропного гормона (в данном случае кортиколиберина).
“Ультракороткая” цепь обратной связи – вид взаимодействия в пределах гипоталамуса, когда высвобождение одного гипофизотропного гормона влияет на процессы секреции и высвобождения другого гипофизотропного гормона. Этот вид обратной связи имеет место в любой эндокринной железе. Так, высвобождение окситоцина или вазопрессина через аксоны этих нейронов и посредством межклеточных взаимодействий (от клетки к клетке) модифицирует активность нейронов, продуцирующих эти гормоны. Другой пример, высвобождение пролактина и его диффузия в межваскулярные пространства приводит к влиянию на соседние лактотрофы с последующим угнетением секреции пролактина.
“Длинная” и “короткая” цепи обратной связи функционируют как системы “закрытого” типа, т.е. являются саморегулирующими системами. Однако они отвечают на внутренние и внешние сигналы, изменяя на короткое время принцип саморегуляции (например, при стрессе и др.). Наряду с этим на указанные системы влияют механизмы, поддерживающие биологический циркадный ритм, связанный со сменой дня и ночи. Циркадный ритм представляет собой компонент системы, регулирующий гомеостаз организма и позволяющий адаптироваться к изменяющимся условиям внешней среды. Информация о ритме день-ночь передается в ЦНС с сетчатки глаза на супрахиазматические ядра, которые вместе с эпифизом образуют центральный циркадный механизм – ”биологические часы”. Помимо механизма день-ночь, в деятельности этих “часов” принимают участие другие регуляторы (изменение температуры тела, состояние отдыха, сна и др.)
26) Метаболизм гормонов
В частности, в основе механизма активации адреналином распада гликогена в печени лежит воздействие гормона на клеточный рецептор аденилатциклазу, под влиянием которой образуется цАМФ и активируется фермент фосфорилаза гликогена. Регуляторная функция некоторых гормонов (кортикостероидов, половых гормонов и др.) реализуется также через генетический аппарат клетки. Указанные гормоны активируют биосинтез белков на стадии транскрипции и трансляции. Многие гормоны влияют на проницаемость клеточных мембран, изменяя скорость транспорта субстратов в клетку (инсулин и др.). Каждому гормону свойствен строго определенный метаболизм, нарушение которого проявляется в изменении концентрации гормона в биологических жидкостях и может быть причиной эндокринной, патологии. Основные этапы обмена гормонов: 1. Биосинтез в клетках эндокринной железы. 2. Транспорт с кровью к органу-мишени, переход через многочисленные клеточные мембраны. 3. Взаимодействие с рецептором — высокоспецифичным белком, расположенным на мембране клетки-мишени или на мембране митохондрий, ядер. 4. Реализация гормонального воздействия. 5. Инактивация гормона путем его расщепления соответствующими ферментами или посредством модификации молекулы гормона в процессе его окисления в печени. 6. Выделение гормона или продуктов его распада с мочой. Таким образом, поступление гормонов в кровь регулируется несколькими механизмами — центральной нервной системой, гормонами гипоталамуса и гипофиза, механизмом обратной связи. Важное место занимает также авторегуляция.
27) Заместительная гормональная терапия
Заместительная гормональная терапия представляет собой прием препаратов, восполняющих недостаток или полное отсутствие гормонов в организме человека. Существует мужская, женская и общая виды терапии, показанной при различных эндокринных нарушениях, вследствие заболевания или в постоперационный период. Показаниями являются частичное или полное затухание функций эндокринных желез. Назначается постоянно в индивидуальной дозировке с учетом возраста, пола, динамики состояния и накопления препарата в организме.
В гинекологии и андрологии применение заместительной гормональной терапии, в основном, актуально для женщин в период климакса и мужчин в андрогеннодефицитном состоянии. В этом возрасте продуцирование организмом половых гормонов снижается в несколько раз и, как следствие, ухудшается качество жизни. Компенсирует подобное состояние прием гормональных препаратов, преимущественно содержащих эстрогены или тестостерон в нужном количестве.
В перименопаузальный период терапия эстрогенами сглаживает у женщины такие климактерические симптомы, как:
излишняя потливость,
сердцебиение,
приливы жара,
раннее увядание,
а также расстройства в сексуальной сфере.
Гормоны назначаются при исключении в анамнезе подозрений на онкологические заболевания, диспластические изменения шейки матки (цервикальная интраэпителиальная неоплазия), злокачественное поражение грудных желез. При грамотном соотнесении показаний и противопоказаний, периоду начала лечения (пост- или перименопаузальный период) выбирается длительность курса лечения и виды гормонсодержащих препаратов. Это могут быть натуральные эстрогены (например, изофлавоноиды сои), либо их синтетические аналоги.
Заместительную гормональную терапию у мужчин проводят в случаях недостатка тестостерона при мужском климаксе, выражающегося в:
угасании сексуальной активности,
ухудшении памяти,
увеличении веса,
стойком выпадении волос.
В психологическом аспекте добавляется раздражительность, апатичность, снижение общего жизненного тонуса. Перед назначением гормонов обязательно проводится обследование предстательной железы на предмет отсутствия предракового или ракового состояния, так как она первая реагирует на гормональное вмешательство. Показаниями также являются такие заболевания как гипогонадизм, полное отсутствие яичек. Терапия андрогенами проводится в виде таблетированных препаратов, подкожных имплантов или гелей.
Заместительная гормональная терапия проводится и при других клинико-патологических состояниях, например, при болезни Аддисона. Системный недостаток гормонов коры надпочечников восполняется глюкокортикоидами и минералкортикоидами в зависимости от степени гормонального нарушения. При инсулинозависимой форме сахарного диабет пожизненно применяются гормоны поджелудочной железы, которые поддерживают нормальный уровень глюкозы в крови.
