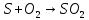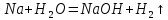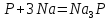1 КУРС (Лабораторные работы) / 4Лаба
.docxФедеральное государственное автономное
образовательное учреждение
высшего профессионального образования
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт цветных металлов и материаловедения
Кафедра: Физическая и неорганическая химия
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
Свойства серы, кислорода, фосфора и азота.
Преподаватель __________ Новикова Г.В.
Студент __________
Красноярск 2013
Теоретическая часть.
Аллотропные модификации кислорода.
О2 (Кислород) - наиболее устойчивая молекула. Это газ без запаха и цвета. Вследствие плохой деформиркемости электронной оболочки имеет низкие температуры плавления (-218,8 0 С) и кипения (-182,9 0 С). Жидкий кислород - кристаллы светлого-голубого цвета, а твердый - кристаллы синего цвета. Во всех агрегатных состояниях кислород парамагнитен. Он мало растворим в воде.
О3 (Озон) - в атмосфере образуется при грозовых разрядах и в верхних слоях атмосферы под действием ультрафиолетового излучения на кислород. Это газ синего цвета, молекулы которого диамагнитны. Цвет его обусловлен большой полярностью и поляризуемостью молекулы озона О3 по сравнению с кислородом. Этим же объясняются его гораздо более сильные окислительные свойства.
Свойства кислорода.
При обычных условиях молекула кислорода довольно инертна (Еатома = 490 кДж/моль). Активируется кислород или в присутствие воды (медленное окисление - дыхание, горение, коррозия) или при воспламенении (быстрое окисление - горение). Горит в кислороде все, кроме галогенов, благородных газов и некоторых благородных металлов (золото, платина и т.д.)
Аллотропные модификации серы.
В случае серы модификаций значительно больше благодаря ее способности образовывать прочные гомогенные цепи. При обычных условиях устойчива ромбическая сера (желтого цвета), построенная из зигзагообразных циклов S8. Выше 95,4 0С она переходит в моноклинную (светло-желтого цвета) - при этом плотность серы уменьшается с 2,07 до 1,96 г/см3. Переход обусловлен изменением взаимного расположения молекул S8 в решетке, что сказывается и на форме кристаллов. При 119,3 0С моноклинная сера плавится, образуя легкоподвижную желтую жидкость, которая выше 160 0С темнеет и густеет, так как происходит разрыв циклов S8 и образование длинных цепей Sn. Резким охлаждением такого расплава можно получить пластическую серу - прозрачную тягучую массу коричневого цвета. Однако, при старении она обратно переходит в ромбическую серу. Выше 250 0С подвижность расплава серы снова растет в результате укорочения молекул. И в пар (оранжевого цвета) при температуре кипения 444,6 0С сера переходит в виде цепей S8 и S6 (резким охлаждением этого пара с помощью жидкого азота получается неустойчивая оранжевая сера). При дальнейшем нагревании пара цепи продолжают укорачиваться, и выше 900 0С образуются двухатомные молекулы - парамагнитная сера (резким охлаждением этого пара получают пурпурную модификацию, которая уже выше -80 0С переходит в ромбическую). И, наконец, при 1500 0С наблюдается полная атомизация серы.
Сера мало растворима в воде, но растворяется (все формы, кроме пластической) в органических жидкостях (особенно хорошо в CS2), из которых кристаллизуется наиболее устойчивая ромбическая модификация.
Свойства серы:
Уменьшение окислительной активности при переходе от кислорода к сере иллюстрируется следующими реакциями:


а также активностью взаимодействия с водородом: кислород реагирует со взрывом, сера менее активна при нагревании.
Восстановительные
же свойства у серы, наоборот, выражены
сильнее. Если кислород выступает в
качестве восстановителя только при
взаимодействии со фтором ( ),
то сера окисляется кислотами-окислителями
и даже дисмутирует в щелочах:
),
то сера окисляется кислотами-окислителями
и даже дисмутирует в щелочах:
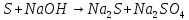
Являясь достаточно сильным окислителем и восстановителем, сера может служить хорошим антисептиком, что используется в медицине (серная мазь).
Физические свойства азота и фосфора.
Азот при обычных условиях представляет собой газ (имеющий формулу N2), без цвета, запаха и вкуса, легче воздуха, растворимость в воде меньше, чем у кислорода. Малая растворимость в воде, а также его очень низкая температура кипения объясняется весьма слабым межмолекулярным взаимодействием как между молекулами азота и воды, так и между молекулами азота.
В отличии от азота газообразный фосфор существует лишь при температуре выше 800 0С, а при конденсации паров формируетс в начале неустойчивая модификация - белый фосфор, состоящая из тетраэдров P4. При состоянии без доступа воздуха белый фосфор переходит в более устойчивый красный, построенный из полимерных цепей. Существует еще одна модификация фосфора - черный фосфор, и, хотя она термодинамически наиболее устойчива, получается лишь в жестких условиях (высокое давление и температура).
Устойчивость водородных соединений снижается от азота к фосфору, т.е. химическая активность возрастает (аммиак NH3, фосфин РН3), так если аммиак окисляется кислородом лишь при достаточно сильном нагревании, то фосфин самовоспламеняется на воздухе выше 500 0С.
В отличие от водородных соединений устойчивость кислородных соединений азота к фосфору возрастает. Кроме того, оксиды фосфора в отличие от оксидов азота (все газы) при обычных условиях - твердые вещества.
Оксиды азота N2O, NO, NO2 значительно различаются по окислительно-восстановительной активности. Так, NO, в отличие от других не поддерживает горение серы, которая особенно энергично сгорает в N2O. Зато NO (и меньшей степени NO2) за счет наличия в молекуле неспаренного электрона проявляет восстановительную активность (в отличии от N2O):


Благодаря способности выступать в роли окислителя и восстановителя оксиды азота могут дисмутировать:
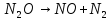


Оксиды N2O3 и N2O5 малоустойчивы.
Оксидов фосфора меньше (Р2О3 и Р2О5). Для Р2О3 проявление окислительных свойств не характерно, однако при действии горячей воды он дисмутирует с образованием Н3РО4 и РН3. Р2О5 устойчив в своей степени окисления, поэтому проявление окислительно-восстановительных свойст для него не характерно.
При повышении степени окисления азота окислительные свойства кислот увеличиваются HNO3 в отличие от HNO2 - сильнейший окислитель, окисляет и металлы, и неметаллы, и сложные вещества. При повышении концентрации окислительные свойства азотной кислоты усиливаются.
Окислительно-восстановительная активность кислот фосфора определяется их устойчивостью, которая понижается с уменьшением степени окисления фосфора. Поэтому гидрооксиды фосфора (I) и (III) - сильные восстановители.

Особенно неустойчив гидрооксид фосфора (I) - дисмутирует до РН3 и Н3РО4. Последняя тоже дисмутирует при нагревании, образуя Н3РО4 и РН3.
Реактив
Несслера
 - реагент на ион аммония.
- реагент на ион аммония.
|
Название и № опыта. |
Расчеты. |
Наблюдения и выводы. |
||
|
№1. Получение и свойства кислорода. А. Получение кислорода и взаимодействие его с органическими веществами. |
Собрали установку для получения кислорода. Сухую колбу на 100 мл наполнили на 1/12 объема перманганатом калия (сухого!) и нагрели на спиртовке:
Выделяющийся газ собрали в сосуд. Для этого наполнили его водой, закрыли кусочком фильтровальной бумаги и, придерживая бумагу пальцами, перевернули сосуд, погрузив его в кристаллизатор с водой. |
Когда почти вся вода вытиснилась из сосуда (оставили3-4 мл), закрыли его под водой фильтровальной бумагой, вынули из воды и накрыли чашкой Петри. Поставили на заполнение кислородом другой
сосуд,
а в первый внесли тлеющую лучинку Вывод: кислород можно получить при нагревании перманганата калия. Пламя у лучинки стало ярче, потому что кислород поддерживает горение. |
||
|
№2.Сжигание серы в кислороде. |
1. Перенесли сосуд с собранным кислородом под тягу, положили в ковшик для сжигания кусочек серы величиной с горошину и подожгли её.
2.
Внесли горящую серу в сосуд с
кислородом.
3. После прекращения горения встряхнули с водой и добавили раствор перманганата.
|
1. Горит синим пламенем. 2. Пламя стало ярче, пошел белый дым. 3. K2MnO4 обесцветился. Вывод: на воздухе горение серы происходит не интенсивно. При внесении горящей серы в сосуд с кислородом окисление серы становится интенсивнее, пламя начинает гореть намного ярче. При этом образуется оксид серы (IV) (сернистый газ).
|
||
|
|
|
|||
|
№3. Изучение окислительно-восстановительных свойств воды (А). |
А) В стакан на 100 мл внесли 30мл воды, добавили 6 капель фенолфталеина перемешали. Затем внесли в стакан кусочек натрия, величиной с горошину, очищенную от поверхностной пленки.
|
Наблюдались искры, натрий "бегал" по воде, оставляя за собой ярко-малиновый след. В итоге почти вся жидкость окрасилась в этот цвет. Вывод: А. В результате этой реакции образовалась щелочная среда, поэтому фенолфталеин окрасил раствор в ярко-малиновый цвет.
|
||
|
№4. Изучение окислительно-восстановительных свойств воды (Б). |
Налили в две пробирки по одной капле 0,1М раствора перманганата калия и добавили в одну 2 мл воды, а в другую 2 мл 1M серной кислоты. Нагревали растворы на водяной бане в течение 15-20 мин. Б) В первой пробирке:
В) Во второй пробирке:
|
В первой пробирке раствор приобрел слабо малиновый цвет, а во второй обесцветился.
|
||
|
|
|
|
||
|
№5. Свойства азотной кислоты. |
Налили в 2 пробирки по 1 мл концентрированной азотной кислоты. 1.
В
первую пробирку опустили медную
стружку.
2.
Во
вторую пробирку поместили гранулу
цинка.
3. В разбавленную азотную кислоту добавили цинк. Проверили с помощью реактива. При взаимодействии с разбавленной азотной кислоты с цинком:
При добавлении к нитрату цинка (II) реагента Несслера наблюдается выпадение бурого осадка:
При добавлении в разбавленную азотную кислоту меди произошло следующее:
|
1. Наблюдалась бурная реакция с выделением бурого газа, после завершения реакции раствор приобрел зеленый цвет. Реакция экзотермическая.
2. Наблюдалась бурная реакция с выделением бурого газа. После реакции раствор обесцветился. Реакция экзотермическая. 3. Начали выделяться пузырьки белого цвета. После того как в пробирку добавили реактив Несслера выпал рыжий осадок. 4. Вывод: 1. При взаимодействии концентрированной азотной кислоты с медью начал активно выделяться оксид азота (IV). 2. При взаимодействии концентрированной азотной кислоты с цинком начал активно выделяться оксид азота (IV). 3. При взаимодействии разбавленной азотной кислоты с цинком на выходе мы получаем нитрат аммония. Чтобы доказать наличие ионов аммония следует добавить в раствор реагент Несслера. Выпадает бурый осадок. Это является качественной реакцией на ион аммония.
|
|
|
№6. Изучение окислительно-восстановительных свойств нитрит-ионов. |
В две пробирки наливаем по 1 мл раствора нитрита натрия и по 0,5 мл 1М серной кислоты. Затем в одну пробирку добавляем каплю 0,1 М раствора перманганата калия, а во вторую - 1 мл раствора йодида калия.
1. 5NaNO2 + 3H2SO4+2KMnO4 = 5NaNO3 + 2MnSO4 + 3H2O + K2SO4
2. NaNO2 + KI + H2SO4 = NaNO3+ I2 + K2SO4 + H20
|
Наблюдаем: 1. Обесцвечивание раствора, ощущается резкий запах азота. 2. Бурную реакцию, раствор приобрел коричневый цвет, ощущается резкий запах.
|
|
|
№7. Свойства красного фосфора. |
Поместили в сухую пробирку 0,7 г красного фосфора и кусочек очищенного натрия величиной с горошину. Закрепив в держателе, нагрели пробирку на спиртовке. После охлаждения опустить пробирку в кристаллизатор (чтобы вода набралась в пробирку).
Опускаем пробирку в кристаллизатор:
|
При нагревании красного фосфора в отсутствии воздуха он сублимируется. Пары фосфора конденсируются на холодных поверхностях, образуя белый фосфор. Мы убедились в том что это белый фосфор, проверив его свечение в темноте, после остывания происходит гидролиз. При опускании пробирки в кристаллизатор начал активно выделяться фосфин (ядовитый газ). |
|
Вывод: в ходе изучения окислительно-восстановительных процессов и свойств азота, фосфора, кислорода и серы мы выяснили, что эти элементы очень важны для химической, производственной промышленности и для человека. Данные элементы обладают множествами свойств, имеют аллотропные модификации, что делает их более универсальными. Также эти элементы являются важнейшими составляющими живых организмов. Они проявляют окислительно-восстановительные свойства.


 пламя стало ярче.
пламя стало ярче.