
1 КУРС (Лабораторные работы) / 2Лаба
.docxФедеральное государственное автономное
образовательное учреждение
высшего профессионального образования
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт Цветных Металлов и Материаловедения
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
Руководитель ______________ Иртюго Л.А.
подпись, дата инициалы, фамилия
Студент ______________
Красноярск 2014
Цель работы: Научиться готовить растворы определенных концентраций.
Теоретическая часть:
Истинный раствор – это равновесная однофазная система переменного состава.
Раствор состоит по крайней мере из двух компонентов, один из которых является растворителем, а остальные растворёнными веществами.
Растворитель – тот компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем служит вещество, содержание которого в растворе наибольшее.
Эквивалент – некая реальную или условную частица, которая в данной обменной реакции соединяется с одним ионом водорода, вытесняет его из соединения либо каким-то опосредованным образом стехиометрически равноценна ему.
Закон эквивалентов: все вещества реагируют между собой в эквивалентных количествах.
Способы выражения концентрации раствора
Название, обозначение |
Расчетная формула |
Размерность |
Массовая доля (ω) |
M(в-ва) / m(р-ра) |
% |
Молярная концентрация (С) |
n/V |
моль/л |
Нормальная концентрация (Сf) |
nf/V |
моль/л |
Молярная концентрация (b) |
n/1000г р-ля |
моль/кг |
Однонормальный раствор содержит в себе один грамм-эквивалент вещества.
Одномолярный раствор содержит в себе один грамм-моль вещества.
Мольная концентрация – это число молей растворенного вещества в 1 л раствора.
Формулы расчета ошибки эксперимента:
А = |W%теор – W%эксп|, (абсолютная ошибка).
A% = A/W%теор*100%, (относительная ошибка).
Ход работы.
|
Название опыта |
Уравнения реакций и расчеты |
Наблюдение и выводы |
|
Опыт 1. Способы выражения состава раствора |
Расчеты, необходимые для того, чтобы узнать, какое количество фосфорной кислоты (H3PO4) нужно добавить в колбу с водой для получения раствора с требуемой концентрацией и плотностью: Требуется: приготовить 100 мл раствора H3PO4 концентрации 3% из кислоты с концентрацией 83,59 % (ρ = 1,667 г/мл). ρтеор H3PO4 = 1,014г/мл. 1)Находим массу раствора: mр-ра = ρ × V = 1,014 × 100 = 101,4г 2)Находим массу вещества. mв-ва
=
3) находим массу раствора с 3,042г в-ва 100г р-ра – 83,59г в-ва хг р-ра – 3,042г в-ва х=3,63г 4) Находим объем в-ва: Vв-ва
=
5) Считаем ошибку эксперимента: A = |3% - 2,33%| =0,67 абсолютная ошибка. A% = 0.67/3 × 100% = 22,3% относительная ошибка. 6) Ищем молярную концентрацию раствора. Cм = n/V n=m/M M=1×3+31+4×16=98 n=3,042/98=0.031моль См=0.031моль/1л=0,3моль/л 7) Ищем нормальную концентрацию раствора. Сf=
nf
/Vр-ра
= См/f
=
|
Из расчетов получаем: Для приготовления 100мл раствора H3PO4 с концентрацией 3% и плотностью 1,014г/мл необходимо добавить 2,1л данного вещества. В мерную колбу объемом 100мл наливали дистиллированной воды примерно до половины. С помощью градуированной пипетки отмерили ровно 2.1г H3PO4 и перенесли в колбу. Затем промытой пипеткой довели раствор до метки дистиллированной водой. Далее закрыли колбу и перемешали раствор. После перелили раствор в цилиндр и ареометром измерили плотность, которая составила – ρ H3PO4 = 1,011г По справочнику определяем концентрацию - 2,33%. После нашли ошибку эксперимента, которая составила: 0,67 абсолютная ошибка. 22,3% относительная ошибка |
Вывод: По окончанию работы получили 100мл раствора фосфорной кислоты 2,33%. Должно было получиться 3%. Относительная ошибка эксперимента составила 22,3%.

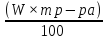 =
=
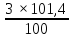 =3,042
=3,042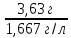 =2,1л
=2,1л =0,9моль/л
=0,9моль/л