
1 КУРС (Лекции по оптике и электричеству и магнетизму) / Lektsia_14_pdf-77762392
.pdfКрахалев М.Н.
Лекция №14
Основы квантовой теории. Элементы квантовой механики.
Крахалев Михаил Николаевич
Крахалев М.Н.
План лекции №14
³Боровская теория атома. Оптические спектры.
³Правило квантования круговых орбит. Модель атома водорода.
³Волновые свойства вещества. Гипотеза де Бройля.
³Уравнение Шредингера. Волновая функция.
³Соотношение неопределенностей.
³Электронная конфигурация атома. Принцип Паули.
³Электронные оболочки. Периодическая система элементов Менделеева.
Боровская теория атома.
Крахалев М.Н.
Закономерности в атомных спектрах.
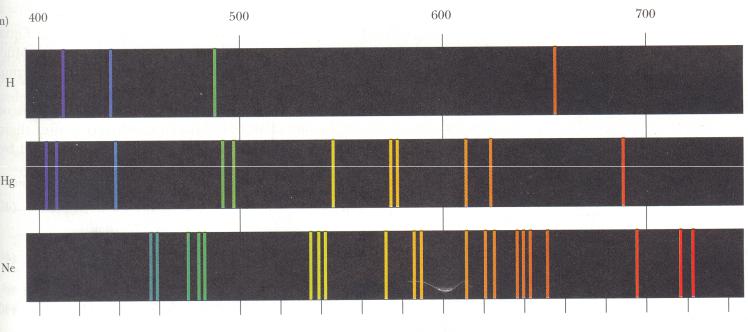
Изолированные атомы в виде разреженного газа или паров испускают спектр, состоящий из отдельных спектральных линий. В соответствии с этим спектр испускания атома называется линейчатым.
Изучение атомных спектров послужило ключом к познанию строения атома.
Было обнаружено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы (серии линий).
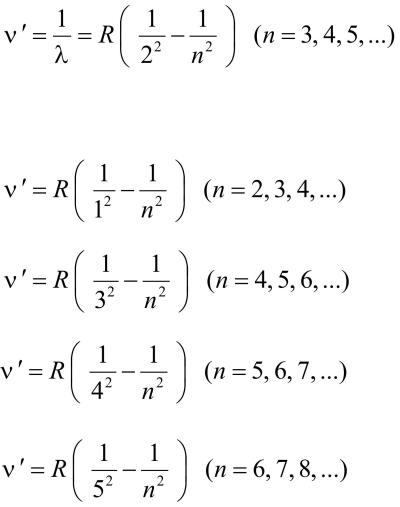
Боровская теория атома.
Крахалев М.Н.
Линейчатые спектры:
Бальмер (1885 г.) установил, что длинны волн серии линий водорода в видимой области спектра могут быть точно представлены формулой:
Видимая область спектра:
n’ – волновое число,
Ультрафиолетовая область спектра:
Инфракрасная область спектра:
Инфракрасная область спектра:
Инфракрасная область спектра:
- серия Бальмера.
R=1,1·108 м-1 – постоянная Ридберга.
- серия Лаймана.
- серия Пашена.
- серия Брэкета.
- серия Пфунда.

Боровская теория атома.
Крахалев М.Н.
Линейчатые спектры (продолжение):
- обобщенная формула Бальмера
Спектральная линия с наибольшей длиной волны из всех линий серии называется головной линией серии. Линия, соответствующая n = ∞, – коротковолновая граница. К ней примыкает непрерывный спектр.
Введем обозначение: |
- спектральные термы |
Длинна волны любой линии спектра водорода может быть представлена в виде разности двух термов.
Изучение спектров других атомов показало, что длинны волн линий и в этом случае могут быть представлены в виде разности двух термов:
Однако терм имеет более сложный вид, чем для водородного атома.
Боровская теория атома.
Крахалев М.Н.
Модель атома:
Для объяснения характера спектра, испускаемого изолированным атомом, следовало предположить, что электрон в излучающем атоме совершает гармонические колебания.
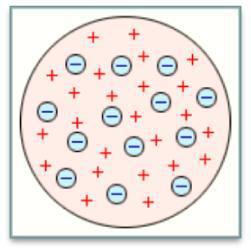
Модель атома Томсона: атом представляет собой равномерно заполненную положительным электричеством сферу, внутри которой находится электрон.
Боровская теория атома.
Крахалев М.Н.
Модель атома (продолжение):
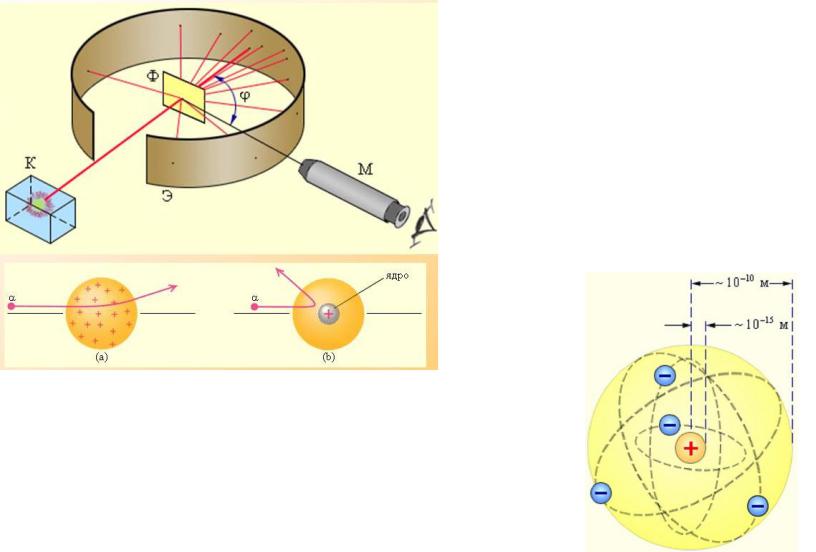
Опыт Резерфорда. Ядерная модель атома.
Ядерная модель атома: в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом электрически нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны.
В центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10-14-10-15 м. Это ядро занимает только 10-12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95% его массы.
Боровская теория атома.
Крахалев М.Н.
Постулаты Бора.
Ядерная модель атома Резерфорда оказалась в противоречии с законами классической механики и электродинамики. Электрон, вращаясь вокруг ядра, движется ускоренно. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Следующий шаг в развитии представлений об устройстве атома сделал в датский физик Нильс Бор (1913 г.). Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
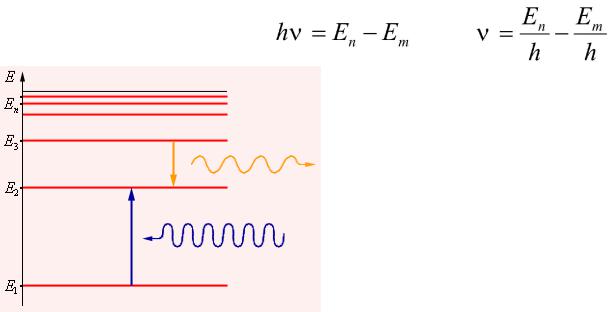
Боровская теория атома.
Крахалев М.Н.
Постулаты Бора (продолжение).
Первый постулат Бора: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, каждому из которых соответствует определенная энергия En. Электрон, находящийся на одной из этих орбит, не смотря на то, что он движется ускоренно, не излучает электромагнитных волн.
Второй постулат Бора: излучение испускается или поглощается в виде светового кванта энергии hn при переходе электрона из одного стационарного состояния в другое. Энергия кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачек электрона:
Если принять энергию электрона, удаленного от ядра на бесконечность, равную 0, то все En < 0. Величина E=E∞-E1=|E1| называется энергией ионизации. Состояние с энергией E1 называется
основным состоянием атома.

Атом водорода.
КрахалевБоровскаяМ.Н. теория водородного атома.
Бор предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде:
n называется главным квантовым числом.
Z – заряд ядра.
Радиусы стационарных круговых орбит:
Боровский радиус - первая орбита водородного атома (Z=1, n=1)
