
- •Контрольные вопросы к экзамену учебной дисциплины «Биохимия»
- •2.Уровни структурной организации белков: первичная, вторичная, третичная, четвертичная, домены, надмолекулярные структуры
- •3. Связь свойств, функций и активности белков с их структурной организацией (специфичность, видовая принадлежность, эффект узнавания, динамичность, эффект кооперативного взаимодействия).
- •4. Факторы повреждения структуры и функции белков, роль повреждений в патогенезе заболеваний. Протеинопатии.
- •5. Первичная структура белков. Зависимость свойств и функций белков от их первичной структуры. Изменения первичной структуры, протеинопатии.
- •6. Роль протеомики в оценке патологических состояний
- •7.Миоглобин и гемоглобин. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3 –бифосфоглицерата.
- •9. Кинетика ферментативных реакций. Уравнение Михаэлиса – Ментона. Преобразование Лайнуивера – Бэрка
- •10. Строение ферментов. Кофакторы и коферменты. Активный центр, строение, функции, связь со специфичностью действия ферментов. Возможность изменения специфичности (трансформация).
- •11. Международная классификация и номенклатура ферментов. Шифр ферментов. Классификация ферментов по их локализации в органах и клетках (компартментализация).
- •12. Ингибирование активности ферментов: обратимые, необратимые, конкурентные, неконкурентное. Принцип применения лекарственных препаратов, основанный на ингибировании ферментов (примеры).
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические
- •2. Необратимые ингибиторы ферментов как
- •13. Изоферменты. Особенности строения и функционирования (рассмотреть на примере лдг). Значение определения изоферментного спектра ферментов в диагностике заболеваний.
- •14. Аллостерическая регуляция. Ингибирование по принципу обратной связи.
- •15. Регуляция активности и количества ферментов (аллостерическая, регуляция путем фосфорилирования и дефосфорилирования, ограниченного протеолиза проферментов)
- •16. Первичные и вторичные ферментопатии. Биохимические механизмы развития патологий. Примеры заболеваний.
- •17. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты
- •18. Зависимость скорости ферментативных реакций от температуры, рН, концентрации субстратов (индукция и репрессия ферментов). Индукция к лекарственным веществам.
- •19. Кофакторы и коферменты. Водорастворимые витамины, как предшественники коферментов. Металлоферменты и ферменты, активируемые металлами
- •1. Роль металлов в присоединении субстрата
- •2. Роль металлов в стабилизации третичной
- •3. Роль металлов в ферментативном
- •4. Роль металлов в регуляции активности
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •Модуль II. Введение в обмен веществ. Биологическое окисление
- •20. Основные пищевые вещества. Суточная потребность. Незаменимые факторы питания
- •21.Переваривание основных пищевых веществ (жиров, белков, углеводов), ферменты пищеварительных соков. Наследственная непереносимость пищевых веществ.
- •22. Витамины. Классификация, функции. Алиментарные и вторичные авитаминозы и гиповитаминозы, их следствия, подходы к профилактике.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •24. Биологическое окисление. Особенности, функции. Макроэргические соединения. Синтез атф. Аэробный и субстратный типы окислительного фосфорилирования Превращение метаболической энергии в тепло.
- •25. Характеристика мультиферментных комплексов цепи переноса электронов. Структурная организация дыхательной цепи, ее функции (энергетическая, терморегуляторная) и место в системе дыхания
- •28. Микросомальное окисление, его организация, биологическая роль, связь с условиями внешней среды. Возможные побочные эффекты.
- •30. Механизм защиты от токсического действия кислорода. Антиоксидантная система
- •2. Антиоксидантная система
- •32. Нарушения энергетического обмена, причины. Гипоэнергетические (энергодефицитные) состояния, их причины и последствия.
- •Гипоэнергетические состояния
- •33. Окислительное декарбоксилирование пировиноградной кислоты. Строение пируватдегидрогеназного комплекса, роль витамина в-1
- •34. Цикл лимонной кислоты (цикл Кребса), последовательность реакций, характеристика окислительных ферментов, связь с цепью переноса электронов, энергетическая и пластическая функции.
- •Модуль III. Обмен и функции углеводов
- •35. Метаболизм фруктозы и галактозы, связь с онтогенезом. Галактоземия, фруктозурия.
- •36. Основные углеводы пищи. Общая схема источников и путей расходования глюкозы в организме.
- •37. Гликолиз, последовательность реакций, связь с общими путями катаболизма (полное аэробное окисление глюкозы). Физиологическая роль процесса.
- •38. Анаэробное окисление глюкозы (анаэробный гликолиз), последовательность реакций, физиологическое значение, регуляция. Судьба молочной кислоты.
- •39. Метаболизм фруктозы и галактозы, связь с онтогенезом. Галактоземия, фруктозурия.
- •40. Пентозофосфатный путь превращения глюкозы, окислительные реакции, энергетическая функция, образование восстановительных эквивалентов и рибозы.
- •41. Глюконеогенез. Ключевые реакции, роль пирувата, лактата, аминокислот. Значение процесса, регуляция. Роль биотина.
- •42. Синтез и распад гликогена: биологическое значение процесса. Зависимость от ритма питания. Регуляция. Гликогенозы и агликогенозы.
- •43. Поддержание физиологического уровня глюкозы в крови. Цикл Кори и глюкозо-аланиновый цикл.
- •44. Гипо- и гипергликемия, почечный порог для глюкозы, глюкозурия. Толерантность к глюкозе.
- •45. Особенности обмена глюкозы в различных тканях (мышцы, эритроциты, мозг, жировая ткань, печень). Зависимость путей использования глюкоза от ритма и характера питания.
- •Модуль IV. Структура, функция и обмен липидов. Биологические мембраны, строение, функции
- •47. Повреждение мембран, связь с развитием болезней. Основные повреждающие факторы. Перекисное окисление липидов (пол). Роль неблагоприятной экологической обстановки в активации этого процесса.
- •49. Ненасыщенные и полиненасыщенные (пнжк) жирные кислоты. Зависимость их концентрации от питания. W-3 и w-6 жирные кислоты как предшественники синтеза эйкозаноидов, простагландинов и лейкотриенов.
- •50. Транспортные липопротеины крови, особенности строения, функции. Апобелки. Роль липопротеинлипазы и лецитин-холестерин-ацилтрансферазы (лхат).
- •51.Метаболизм плазменных липопротеинов. Атерогенные и антиатерогенные липопротеины. Дислипопротеинемии, гиперлипопротеинемии. Атеросклероз. Коэффициент атерогенности.
- •52. Различия синтеза триацилглицеринов (таг) в печени и жировой ткани. Взаимопревращение глицерофосфолипидов. Жировое перерождение печени. Липотропные факторы.
- •53. Депонирование и мобилизация жиров, биологическая роль процессов, зависимость от ритма питания и физической нагрузки. Гормональная регуляция липолиза и липогенеза.
- •55. Синтез и использование кетоновых тел. Гиперкетонемия, кетонурия, ацидоз при сахарном диабете и голодании.
- •56. Синтез и функции холестерина. Образование мевалоновой кислоты. Регуляция процесса, гмг-КоА-редуктаза. Транспорт и выведение холестерина из организма.
- •57. Обмен полиненасыщенных жирных кислот. Образование эйкозаноидов, строение, номенклатура, биосинтез, биологическая роль.
- •58. Желчь, желчные кислоты (первичные и вторичные). Желчные мицеллы их образование и роль Применение хенодезоксихолевой кислоты для лечения болезни.
- •59.Синтез жирных кислот, пальмитат синтетазный комплекс, строение, последовательность реакций. Источники восстановительных эквивалентов. Микросомальная система удлинения жирных кислот.
- •Модуль V. Обмен белков и аминокислот
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •3. Биологическое значение трансаминирования
- •2. Органоспецифичные аминотрансферазы ант и act
- •1. Реакции синтеза мочевины
- •2. Энергетический баланс процесса
- •3. Биологическая роль орнитинового цикла
- •Модуль VI. Обмен и функции нуклеиновых кислот. Матричные биосинтезы.
- •Модуль VII. Гормоны. Гормональная регуляция метаболических процессов
- •81. Гормоны поджелудочной железы. Строение, образование, механизм действия инсулина и глюкагона.
- •82. Кальций и фосфор. Биологические функции, распределение в организме. Регуляция обмена, участие паратгормона, кальцитонина и активных форм витамина d.
- •83. Гормоны коры надпочечников: минерало - и глюкокортикоиды. Строение, синтез. Влияние на водно-солевой обмен, обмен белков, липидов и углеводов.
- •84. Йодсодержащие гормоны, строение, биосинтез, Влияние на обмен веществ. Изменения обмена при гипертиреозе и гипотиреозе.
- •85. Адреналин. Строение, биосинтез, биологическая роль.
- •86. Гормоны передней доли гипофиза, строение, место в системе регуляции. Биологическая роль.
- •87. Гормоны задней доли гипофиза (вазопрессин и окситоцин), строение, биологическая роль.
- •88. Половые гормоны: мужские и женские, влияние на обмен веществ.
- •89. Гипер- и гипопродукция гормонов (разобрать на примерах гормонов щитовидной железы, надпочечников). Модуль VIII. Биохимия крови и мочи
- •90. Общий белок и белковый спектр плазмы крови. Альбумины и глобулины их функции, гипо - и гиперпротеинемия, диспротеинемии, парапротеинемии.
- •92.Каликреин-кининовая система, синтез кининов, биологическая роль.
- •93. Форменные элементы крови. Особенности метаболизма в эритроцитах и лейкоцитах. Биохимические механизмы, обеспечивающие резистентность эритроцита.
- •94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
- •95. Железо. Транспорт, депонирование, функции, обмен. Нарушения обмена: железодефицитная анемия, гемосидероз, гемохроматоз.
- •96.Дыхательная функция крови. Молекулярные механизмы газообмена в легких и тканях. Факторы, влияющие на насыщение гемоглобина кислородом. Карбоксигемоглобин, метгемоглобин.
- •97.Ферменты крови «собственные» и поступающие при повреждении клеток. Диагностическая ценность анализа белков и ферментов крови
- •98. Белки и ферменты крови. Белки «острой фазы». Физиологически активные пептиды (кининовая система).
- •99. Распад гема, образование, обезвреживание и выделение билирубина. Конъюгированный и неконъюгированный билирубин. Гипербилирубинемии.
- •100. Виды желтух (гемолитическая, паренхиматозная, обтурационная, новорожденных). Диагностическое значение определения билирубина в крови и моче.
- •101. Буферные системы крови: бикарбонатная, фосфатная, белковая, гемоглобиновая. Причины развития и формы ацидоза и алкалоза. Возможные последствия этих отклонений.
- •102. Состав мочи. Нормальные и патологические компоненты. Исследование мочи с целью диагностики болезней.
- •103. Клиническое значение биохимического анализа крови (белки, ферменты, глюкоза, мочевина, железо, кальций и др.).
- •Модуль iх. Биохимии отдельных органов и тканей: соединительной, мышечной, нервной
- •113. Биохимические основы проведения нервного импульса. Роль ферментов, медиаторов, атф, мембранных белков, кальция, калия и натрия.
94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450.
Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
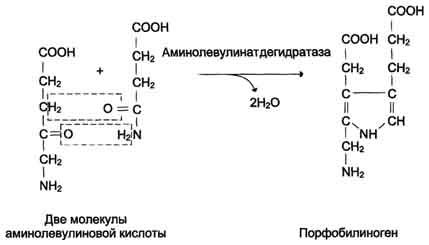
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена (рис. 13-4), дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентноелентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Донором железа служит депонирующий железо в клетках белок ферритин.

Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
Регуляция биосинтеза гема
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5).
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ, iron-responsiveelement, IRE) (рис. 13-6).
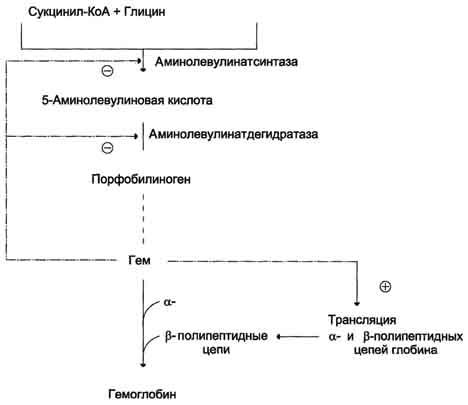
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5'-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь - комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных,это первичная структура .
Гемоглобинопатии группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии).
