
5 Лекция по БТ НЕПРЕРЫВНОЕ КУЛЬТИВИРОВАНИЕ
.docxНЕПРЕРЫВНОЕ КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
-
Непрерывное культивирование позволяет получить высокую производительность процесса и стабильные характеристики продукта.
-
Существуют два вида непрерывных процессов ферментации – тубулярные и хемостатные.
-
ТУБУЛЯРНЫЕ процессы реализуются в аппаратах полного вытеснения, а ХЕМОСТАТНЫЕ – в аппаратах полного смешения.
ТУБУЛЯРНЫЙ ПРОЦЕСС
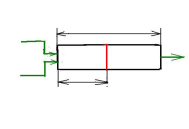
S0, F
X0
L
F, S, X
λ
F – расход жидкости через аппарат ;
S, S0 – концентрация субстрата на выходе и на входе в аппарат;
X, X0 - концентрация биомассы на выходе и на входе в аппарат;
L -полная длина или высота аппарата ;
λ -расстояние от входа в аппарат до произвольно взятого сечения;
А – площадь сечения
ТУБУЛЯРНЫЙ ПРОЦЕСС
-
Питательная среда и посевной материал непрерывно поступают в аппарат, в котором нет обратного смешения. На входе в аппарат жидкость смешивается с посевным материалом. По мере продвижения в аппарате одновременно осуществляются рост биомассы и биосинтез продукта.
-
Время пребывания жидкости в аппарате tL = LA / F.
-
Время пребывания жидкости от входа в аппарат до произвольно взятого сечения t λ = λ A /F
-
С учётом связи времени пребывания и длины аппарата кривые изменения всех концентраций такие же, как в периодическом процессе.
РЕЦИРКУЛЯЦИЯ КУЛЬТУРАЛЬНОЙ ЖИДКОСТИ В ТУБУЛЯРНОМ АППАРАТЕ

(F0 – F), S0
F, X , S
F0 , X
-
Необходимость непрерывной подпитки посевного материала можно исключить путём организации рециркуляции части потока с выхода аппарата на вход.
-
Преимуществом тубулярного процесса является возможность более полного исчерпания субстрата.
-
Недостатки – невозможность организовать аэрацию во всех зонах по длине аппарата, большая склонность к инфицированию посторонней микрофлорой.
ХЕМОСТАТНЫЙ ПРОЦЕСС НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ
F, S0
-
Процесс ферментации протекает в аппарате с перемешиванием. В аппарат с постоянной скоростью F подводится свежая питательная среда.
-
Из аппарата с той же скоростью отводится ферментационная среда, содержащая биомассу X, продукт метаболизма P, и остаточный субстрат S.
-
Посевной материал в аппарат подаётся только в момент запуска. Объём жидкости в аппарате V сохраняется постоянным.
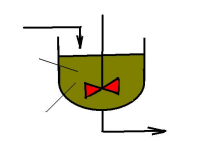
F,S,X,P
P,S,X
V
ПРОСТЕЙШАЯ МОДЕЛЬ ПРОЦЕССА
-
Принимаем, что процесс направлен только на рост биомассы, поэтому нет специального уравнения для биосинтеза целевого продукта dP/dt.
-
Принимаем субстрат-зависимую модель роста (Моно), так что ингибирующего продукта нет и уравнения для него не нужно.
-
Принимаем, что в процессе роста отсутствует диссимиляция биомассы ( )
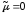
-
Принимаем, что для лимитирующего субстрата нет затрат на поддержание жизнедеятельности культуры (mS = 0)
СИСТЕМА УРАВНЕНИЙ
-
Материальный баланс процесса:
-
V(dX/dt) =[μmS/(KS + S)]XV - FX
-
V(dS/dt)= FS0–FS –(1/YXS) [μmS/(KS+S)]XV
-
Принимаем обозначение D = F/V, где D – скорость разбавления, [1/час]
-
Упрощённая запись системы уравнений:
-
dX/dt = μX –DX
-
dS/dt =D(S0 –S) – (1/YXS) μX
УСЛОВИЯ СТАЦИОНАРНОСТИ
-
В отличие от периодического процесса в непрерывном хемостатном процессе довольно быстро устанавливается стационарное состояние, при котором скорость роста биомассы будет равна скорости её вымывания из аппарата, а скорость притока субстрата за вычетом оттока остаточного субстрата равна скорости его расходования на рост биомассы микроорганизмов.
-
При этом (dX/dt) = 0 и (dS/dt) = 0
ПАРАМЕТРЫ СТАЦИОНАРНОГО ПРОЦЕССА: СКОРОСТЬ РОСТА
-
Из условий стационарности получаем:
-
μX – DX = 0 , откуда μ = D
-
Таким образом, в установившемся состоянии удельная скорость роста биомассы становится равной скорости разбавления D. Это очень удобно, поскольку скорость разбавления – это управляемый параметр, его задаёт оператор.
-
Если в какой-то момент времени это равенство нарушится (μ ≠ D), то скорость роста биомассы .
-
dX/dt =(μ – D)X будет либо положительной (и тогда биомасса увеличивается), либо отрицательной (соответственно, концентрация биомассы уменьшается). При этом устанавливается равновесие при той же скорости разбавления, но другой концентрации биомассы.
СТАЦИОНАРНЫЕ КОНЦЕНТРАЦИИ СУБСТРАТА И БИОМАССЫ
-
μ = D, или, с учётом выражения для μ:
-
μmS/(KS + S) = D, откуда получаем :
-
S = KSD/ (μm – D)
-
D(S0 –S) – (1/YXS) μX = 0, откуда :
-
X = YXS {S0 - KSD/ (μm – D)}
-
Графически выраженные зависимости X(D), S(D) называют «хемостатными кривыми»
X,S
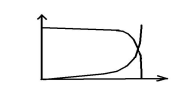
D
0
X
S
Dкр
X0
«ВЫМЫВАНИЕ» КУЛЬТУРЫ
-
Хемостатная кривая X(D) показывает, что при повышении скорости разбавления концентрация биомассы снижается до нуля при некоторой критической скорости разбавления Dкр и при более высоких скоростях разбавления остаётся равной нулю.
-
Физически это означает, что культура «вымывается»: выходит больше биомассы, чем может вырасти. Ясно, что при этом концентрация субстрата в выходящем потоке такая же, как на входе в аппарат – S0 .
КРИТИЧЕСКАЯ СКОРОСТЬ РАЗБАВЛЕНИЯ
-
Приравнивая уравнение для концентрации биомассы нулю, получаем величину D= Dкр
-
X = YXS {S0 - KSD/ (μm – D)} = 0
-
откуда Dкр = μm S0/(KS + S0)
-
Физически это означает, что критическая скорость разбавления равна удельной скорости роста биомассы при концентрации субстрата, равной его концентрации в подаваемом потоке среды.

РЕПЕРНЫЕ ТОЧКИ КРИВОЙ X(D)
-
Зависимость X(D) имеет 2 реперные точки:
-
X = X0 при D = 0 и D= Dкр при X = 0
-
Обе эти точки (X0 и Dкр ) зависят от S0
-
Вид зависимостей представлен на графике (линейная для X0 и с насыщением для Dкр )
Dкр
X0
S0
0
ХЕМОСТАТНЫЕ КРИВЫЕ ПРИ РАЗЛИЧНЫХ S0

X
0
D
КОНЦЕНТРАЦИЯ СУБСТРАТА В СВЕЖЕЙ СРЕДЕ
-
Таким образом, и начальное положение хемостатной кривой, и точка вымывания зависят от концентрации субстрата в свежей среде (подпитке) S0
-
Эта величина наряду со скоростью разбавления является параметром, с помощью которого оператор может управлять процессом. Чем больше S0 , тем выше концентрация биомассы в выходном потоке, причём в довольно широком диапазоне скоростей разбавления.
ОСТАТОЧНАЯ КОНЦЕНТРАЦИЯ СУБСТРАТА
-
Интересную особенность имеет зависимость стационарной (остаточной) концентрации субстрата от начальной (входной) его концентрации. В полученной формуле нет ничего, кроме скорости разбавления и кинетических констант.
-
Из этого следует парадоксальный вывод: при любом изменении концентрации субстрата во входящем потоке S0 в стационарном состоянии при заданной скорости разбавления устанавливается одна и та же остаточная концентрация субстрата S. Именно это свойство хемостата дало ему название: концентрация субстрата (химического соединения) стабилизируется сама по себе независимо от колебаний на входе.
ПРОИЗВОДИТЕЛЬНОСТЬ ХЕМОСТАТА
-
Производительность QX – количество биомассы, образующееся в единицу времени в единице объёма среды аппарата
-
QX =DX подставляем выражение для X:
-
QX =D YXS {S0 - KSD/ (μm – D)}
-
Для определения Dопт приравниваем нулю частную производную QX по D,

-
откуда: Dопт = μm { 1 - }
ОПТИМАЛЬНАЯ
ПРОИЗВОДИТЕЛЬНОСТЬ ХЕМОСТАТА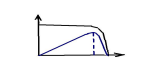
D
X
Qx
0
Dопт
Dкр
D
СРАВНЕНИЕ НЕПРЕРЫВНОГО И ПЕРИОДИЧЕСКОГО ПРОЦЕССОВ
-
Представляет интерес сравнить между собой в сопоставимых условиях два способа ферментации – периодический и непрерывный.
-
При сравнении возьмём процесс с одинаковыми кинетическими константами – максимальной удельной скоростью роста μm и характеристикой аппарата – максимально достижимой концентрацией биомассы Xm
-
Расчёты проведём в общем виде.
ПЕРИОДИЧЕСКИЙ ПРОЦЕСС
-
Предполагается, что между двумя последовательными процессами роста микроорганизмов имеет место «пустой», непродуктивный период, связанный с подготовкой аппарата, загрузкой среды и посевного материала и с лаг-фазой процесса – общее время t0 .
-
После этого от исходной концентрации X0 до максимально достижимой в данном аппарате Xm рост идёт до самого конца ферментации (время tm) с максимальной удельной скоростью роста μm ..
РОСТ В ПЕРИОДИЧЕСКОМ ПРОЦЕССЕ ФЕРМЕНТАЦИИ

X
Xm
X0
0
t0
tm
t
ПРОИЗВОДИТЕЛЬНОСТЬ ПЕРИОДИЧЕСКОГО ПРОЦЕССА
-
dX/dt = μmX (при t > t0)
-
Решение уравнения X = X0 e(t- t0)μm или ln X = lnX0 + μm ( t - t0)
-
Концентрация X = Xm достигается в момент времени t = tm , для которого
-
ln Xm = ln X0 + μm ( tm - t0) ,
откуда tm = t0 + (1/ μm ) ln (Xm/X0)
-
QXпериод = Xm /tm =Xm μm/[ ln (Xm/X0) + μmt0 ]
ПРОИЗВОДИТЕЛЬНОСТЬ НЕПРЕРЫВНОГО ПРОЦЕССА
-
Анализируем формулу для Dопт. Поскольку KS обычно значительно меньше S0 , величина Dопт ≈ μm и производительность непрерывного процесса QXнепр ≈ Xm μm
-
Соотношение производительностей RQ:
-
RQ = QXнепр / QXпериод ≈
-
≈Xm μm/ {Xm μm/[ ln (Xm/X0) + μmt0 ]} или RQ = ln (Xm/X0) + μmt0
ИСХОДНЫЕ ДАННЫЕ ДЛЯ СРАВНИТЕЛЬНОЙ ОЦЕНКИ
-
В начале процесса инокулят обычно составляет по объёму около 5% от объёма среды, а концентрация биомассы в нём примерно такая же, как в конце ферментации.
-
Обычное время подготовки аппарата (t0) – около 10 часов.
-
Величина μm для быстро растущих культур (бактерии, дрожжи) составляет 0,5 ч-1, а для медленно растущих (грибы, актиномицеты) – 0,05
ЦИФРОВАЯ ОЦЕНКА ВЕЛИЧИНЫ RQ
-
(Xm/X0) = (100%)/(5%) = 20
-
Ln (Xm/X0) ≈ 3
-
Упрощённая зависимость: RQ = 3 + 10 μm
-
Таким образом, для быстро растущих культур соотношение RQ составляет ≈ 8, а для медленных ≈ 3,5
-
Итак, непрерывный процесс для процессов роста эффективнее периодического.
АВТОСЕЛЕКЦИЯ
-
В ходе процесса непрерывного культивирования в культуре происходят изменения, в результате которых может появиться штамм, имеющий более высокую удельную скорость роста, чем исходный.
-
С этого момента оба штамма начинают конкурировать за субстрат.
-
Проведём анализ этого процесса

μ
КИНЕТИЧЕСКИЕ ЗАВИСИМОСТИ ИСХОДНОГО И МУТАНТНОГО ШТАММОВ
μ2
D2
μ1
D1
S
0
S2
S1
ТЕХНОЛОГИЧЕСКИЕ ПАРАМЕТРЫ В ПРОЦЕССЕ АВТОСЕЛЕКЦИИ
-
На графике изображены кинетические зависимости μ1(S) для исходного и μ2(S) для вновь образовавшегося мутантного штамма.
-
Если процесс протекает при скорости разбавления D1 , то исходный штамм обеспечивает саморегулирование процесса при концентрации субстрата в среде S1 .
КАК СЕБЯ ЧУВСТВУЕТ ШТАММ-МУТАНТ?
-
Для штамма-мутанта концентрация субстрата S1 обеспечивает удельную скорость роста μ2(S1) =D2, которая значительно больше скорости разбавления D1
-
Следовательно, концентрация биомассы мутантного штамма растёт:
-
dX2/dt = {μ2(S1) - D1}X > 0
-
Рост продолжается до тех пор, пока концентрация субстрата не снизится до S2.
КАК СЕБЯ ЧУВСТВУЕТ ИСХОДНЫЙ ШТАММ?
-
При уменьшении концентрации субстрата концентрация биомассы исходного штамма начинает уменьшаться :
-
dX1/dt = {μ1(S2) - D1}X < 0
-
Следствием этого становится вымывание исходного штамма и замена его мутантным.
-
Концентрация биомассы при этом возрастает по сравнению с той, которая была при исходном штамме
ВНЕШНИЕ ПРОЯВЛЕНИЯ ПРОЦЕССА АВТОСЕЛЕКЦИИ
-
Если наблюдать за концентрацией биомассы в процессе непрерывного культивирования, можно заметить скачкообразные повышения концентрации, свидетельствующие о самопроизвольной селекции (автоселекции).

X
0
t
ЗНАЧЕНИЕ АВТОСЕЛЕКЦИИ
-
Итак, длительный непрерывный процесс может быть использован для отбора штаммов, обеспечивающих более высокую скорость роста биомассы микроорганизмов.
-
Улучшение штаммов по удельной скорости роста не всегда полезно. При этом иногда происходит ухудшение качества белка и других компонентов клетки и снижение её способности к биосинтезу полезных метаболитов.
ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ КОНСТАНТ В ХЕМОСТАТЕ
-
В хемостате удобно определять кинетические константы. Задавая скорость разбавления, мы сразу имеем удельную скорость роста, которую в периодическом процессе можно получить лишь на основании двух-трёх измерений X на интервале времени Δt.
-
Концентрация субстрата S в хемостате требует только одного измерения, а в периодическом процессе – минимум двух для определения среднего значения за интервал времени.
-
Все эти измерения требуется проводить при 4 – 5 парах значений μ и S, так что преимущество непрерывного процесса очевидно.
ПРЕИМУЩЕСТВА НЕПРЕРЫВНОГО СПОСОБА КУЛЬТИВИРОВАНИЯ
-
Рост биомассы можно поддерживать неопределённо долго.
-
Можно поддерживать постоянную концентрацию биомассы.
-
Можно длительно поддерживать рост, лимитированный одним заданным субстратом.
-
Удобно определять кинетические константы.
-
Более высокая производительность по сравнению с периодическим.
-
Результаты, полученные в непрерывном процессе, более надёжны и воспроизводимы, чем в периодических.
-
Облегчены механизация и автоматизация.
-
Постоянное качество готового продукта.
-
Меньше контакт персонала с микроорганизмами.
-
Возможна автоселекция микроорганизмов.
-
Меньше износ измерительных приборов.
НЕДОСТАТКИ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ
-
Меньшая гибкость, регулировать можно только некоторые параметры.
-
Более высокие требования к постоянству качества сырья.
-
Больше капитальные вложения.
-
Трудно непрерывно дозировать нерастворимые твёрдые субстраты.
-
Больше опасность инфицирования из-за большей длительности культивирования.
-
Возможность «вырождения» культуры за счёт автоселекции.
-
Не всегда достигаются хорошие результаты для биосинтеза продуктов метаболизма.
-
Трудно культивировать мицелиальные культуры из-за вязкости, гетерогенности и пристеночного роста.
-
Повышенные требования к надёжности оборудования
