
onch_posobie
.pdf
|
636. Вычислите кажущуюся |
степень диссоциации Na2Cr2O7, если |
||||
температура |
замерзания |
его |
0,36 М водного |
раствора |
(плотность |
|
1,066 |
г/см3) равна минус 1,7 оС. |
|
|
|
||
|
|
|
|
|
(Отв. 74,3 %) |
|
|
637. Вычислите кажущуюся степень диссоциации (NH4)2Cr2O7, если |
|||||
температура |
замерзания |
его |
0,58 М водного |
раствора |
(плотность |
|
1,081 |
г/см3) равна минус 2,51 оС. |
|
|
|
||
(Отв. 57,8)
638. Вычислите изотонический коэффициент Cr(NO3)3, если температура замерзания его 0,28 М водного раствора (плотность 1,017 г/см3) равна минус 1,097 оС.
(Отв. 3,59)
Для 639-643. Не производя вычислений, на основании оценки природы, данных о степени и константе диссоциации в водных растворах веществ расположите последние в порядке, соответствующем возрастанию температуры кипения их 0,1 моляльных растворов.
639.С6Н12О6 —KNO3 —Cr(NO3)3 —Ca(NO3)2 —HF—CH3COOH.
640.С6Н5СООН —Na2SO4 —NaCl —Na3PO4 — H2O2 —H2SO3.
641.CCl4 —MgSO4 —H2S —NH4OH —K2SO4 —Cr2(SO4)3.
642.С6Н6 —H3PO4 —HCN —CaCl2 —(NH4)2SO4 —KCr(SO4)2.
643.CO(NH2)2 —AgNO3 —H2S —K2CO3 —K3PO4 —H2SO3.
Для 644-646. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если понижение давления насыщенного пара растворителя над ее 10 %-м водным раствором соли при 50 оС составляет (Ро воды при 50 оС = 92,51 мм рт. ст. или 12333,6 Па):
644. BaCl2, P = 1,803 мм рт. ст.
(Отв. 2,05; 52,4 %)
645. KNO3, P = 2,946 мм рт. ст.
(Отв. 1,64; 64 %)
646. K3PO4, P = 2,145 мм рт. ст.
(Отв. 2,49; 49,5 %)
647. Вычислите кажущуюся степень диссоциации Na2CrO4, если понижение давления насыщенного пара над его 0,125 М водным раствором (плотность 1,016 г/см3) при 40 оС составляет 38,05 Па (Ро воды при 40 оС = = 7375,9 Па).
(Отв. 63,5 %)
648. Вычислите изотонический коэффициент Na2Cr2O7, если понижение давления насыщенного пара над его 0,36 М водным раствором (плотность 1,066 г/см3) при 30 оС составляет 70,54 Па (Ро воды при 30 оС = = 4242,8 Па).
(Отв. 2,51)
121
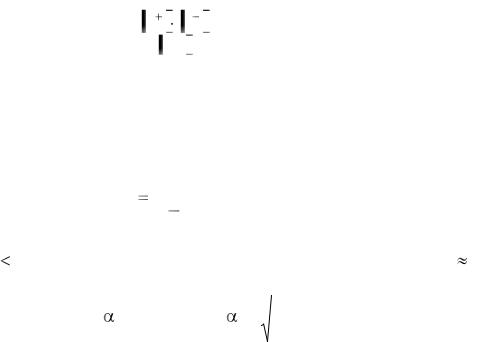
Для 649-652. Не производя вычислений, на основании оценки природы, данных о степени и константе диссоциации в водных растворах веществ расположите последние в порядке возрастания давления насыщенного пара над их 10 %-ми растворами.
649.С6Н12О6 —KNO3 —Cr(NO3)3 —CaCl2 —H2O2 —CH3COOH.
650.С2Н5ОН —KOH —CrCl3 —H3BO3 —HF —Ba(OH)2.
651.CO(NH2)2 —Ni(NO3)2 —H2S —NH4OH —KCl —Al2(SO4)3.
652.С12Н22О11 —BaCl2 —MgSO4 —KAl(SO4)2 —H3PO4 — HCN.
9.3.Равновесие в растворах слабых электролитов
Более удобной характеристикой электролита является константа диссоциации КД, не зависящая от концентрации раствора. Так, равновесие в системе АВ А+ + В- можно охарактеризовать с помощью константы равновесия, называемой константой электролитической диссоциации:
КД = |
А В |
, |
(9.7) |
|
АВ |
||||
|
|
|
где [A+], [B-] и [AB] – равновесные молярные концентрации ионов А+ и В-
имолекул АВ.
Вслучае слабого электролита АВ, диссоциирующего на ионы А+ и В-, константа и степень диссоциации связаны соотношением (закон разбавле-
ния Оствальда):
КД |
α2c |
М |
, |
(9.8) |
1 |
|
|||
|
α |
|
||
где сМ – исходная (начальная) молярная концентрация электролита АВ. Если  1, то для приближенных вычислений принимают 1 –
1, то для приближенных вычислений принимают 1 –  1 и
1 и
формула упрощается:
КД = |
2 |
сМ , откуда = |
|
K Д |
|
. |
(9.9) |
|
cM |
||||||
|
|
|
|
|
|
|
Данное соотношение показывает, что при разбавлении раствора (то есть при уменьшении концентрации электролита сM) степень диссоциации электролита возрастает. И наоборот, при увеличении сM степень диссоциации уменьшается.
Степень диссоциации слабого электролита также уменьшается, если в раствор вводят один из ионов, образующихся при его диссоциации, так на-
зываемый одноименный ион.
Для электролитов, более сложных по составу (А2В, АВ2, АВ3 и др.), выражения для констант диссоциации и закона разбавления Оствальда имеют несколько иной вид. Если электролит состоит из молекул А2В, то он может диссоциировать ступенчато:
122

А2В А+ + АВ- (первая ступень), АВ- А+ + В2- (вторая ступень).
Каждая ступень характеризуется своими значениями степени и кон-
станты диссоциации ( 1 и КД1 , 2 |
и КД2 ): |
|
|
|
|
||||
КД1 |
= |
[A ][AB ] |
; КД2 |
= |
[A ][B2 |
] |
. |
(9.10) |
|
|
[A2 B] |
[AB ] |
|
||||||
|
|
|
|
|
|
|
|
||
Произведение ступенчатых констант диссоциации равно общей константе диссоциации:
КД = КД1 КД2 . |
(9.11) |
Для многоосновных кислот и многокислотных (многоатомных) оснований количество ступеней диссоциации определяется основностью кислоты и кислотностью основания. Каждая последующая стадия диссоциации протекает менее глубоко, чем предыдущая (см. ч. 3, табл. 17, 18):
1 |
2 |
n |
Д1 |
Д2 |
Дn. |
В химической литературе принято константы диссоциации кислот обозначать Кa, а оснований – Kb.
Пример 1. Вычислите степень диссоциации и концентрацию ионов водорода [H+] в 0,025М растворе СН3СООН.
Решение.
СН3СООН СН3СОО- + Н+.
I способ. Уксусная кислота – слабый электролит. В соответствии с (9.7)
Ка СН 3 |
СООН = |
[CH3COO ][H ] |
= 1,8 · 10 |
–5 |
(ч. 3, табл. 17). |
|
[CH3COOH] |
|
|
||||
|
|
|
|
|
||
Так как в результате диссоциации [СН3СОО-] = [Н+], то
|
[H ]2 |
|
Ка СН 3 СООН = |
|
. |
|
||
|
[CH3COOH] |
|
Предполагая, что <<1, будем считать, что равновесная концентрация кислоты равна ее исходной концентрации, то есть
[CH3COOH] = ССН 3 СООН.
Тогда
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[H+] = |
Ka[CH3COOH] |
= |
1,8 10 |
5 0,025 = 6,7·10-4 моль/л, |
|||||||||||
|
|
= |
|
[H |
] |
= |
6,7 10 4 |
= 0,027 = 2,7 % . |
|||||||
|
|
|
CCH COOH |
0,025 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
II способ. Согласно закону разбавления Оствальда (9.9): |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
= |
|
|
Ka |
|
= |
1,8 10 |
= 0,027 = 2,7 % . |
||||||||
|
CCH COOH |
|
0,025 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
123
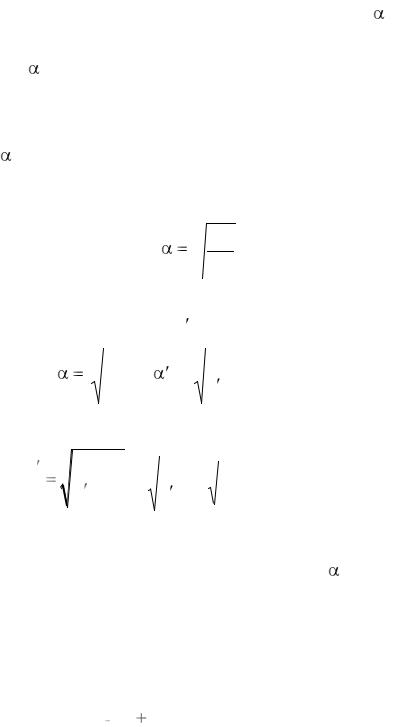
Исходя из определения понятия «степень диссоциации » и уравнения диссоциации уксусной кислоты СН3СООН, можно записать
[Н+] = ССН 3 СООН = 0,027 · 0,025 = 6,7·10-4 моль/л.
Пример 2. Как изменится степень диссоциации при разбавлении исходного раствора СН3СООН (см. пример 1) в 10 раз?
Решение. – степень диссоциации исходного раствора,  – степень диссоциации после разбавления.
– степень диссоциации после разбавления.
Согласно закону разбавления Оствальда (9.9)
Ka
 сM
сM
при разбавлении исходного раствора в 10 раз концентрация cМ = 0,025 моль/л уменьшится в 10 раз и станет равной с М = 0,0025 моль/л.
Можно записать |
|
|
|
Ka |
|
и |
|
= |
|
Ka |
|
. |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
сM |
|
|
|
|
|
сM |
|
||||||||||
Так как Ка от концентрации не зависит, то |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α |
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,025 |
|
|
||||||||
|
|
|
|
a |
|
M |
= |
|
M |
= |
|
= 3,16. |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
α |
|
|
cMКа |
cM |
0,0025 |
|
||||||||||||||||
Степень диссоциации увеличится в 3,16 раза. |
||||||||||||||||||||||||
Пример 3. |
Как изменятся степень диссоциации и концентрация |
|||||||||||||||||||||||
ионов водорода |
[H+] |
при |
добавлении |
к 1 л |
исходного раствора (см. |
|||||||||||||||||||
пример 1) 0,02 моль СН3СООК?
Решение. Ацетат калия является сильным электролитом и его молекулы в растворе диссоциируют полностью:
СН3СООК = СН3СОО- + К+.
Ка СН 3 СООН = |
[CH3COO ][H ] |
. |
||
[CH3COOH] |
|
|||
|
|
|||
При введении в раствор СН3СООН сильного электролита, содержащего одноименный ион, в данном случае СН3СОО-, его концентрация будет суммироваться:
-из уксусной кислоты: [CH3COO-] = [H+] = 6,7·10-4 моль/л (см.пример 1);
-из ацетата калия: [CH3COO-] = ССН 3 СООК = 0,02 моль/л.
124

Так как [CH3COO-] << ССН 3 СООК, величиной [CH3COO-] можно пренебречь. Тогда из выражения для Ка СН 3 СООК находим:
+ |
|
|
KaCH3COOHCCH3COOH |
|
1,8 10-5 0,025 |
|
-5 |
|
||||
[H ]' = |
|
|
|
|
|
= |
0,02 |
= 2,25·10 |
|
моль/л, |
||
|
|
[CH3COO ] |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||
|
H |
= |
6,7 10 |
4 |
= 29,8 30. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
H |
2,25 10 |
5 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
Таким образом, концентрация [H+] уменьшится примерно в 30 раз. Из определения понятия «степень диссоциации» находим
' = |
C |
H |
|
= |
2,25 10 |
5 |
= 9·10 |
-4 |
. |
||
|
|
|
|
||||||||
|
|
|
0,025 |
|
|
||||||
CCH COOH |
|
||||||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
Величина |
= 0,027 (см.пример 1), |
|
|
||||||||
|
α |
= |
0,027 |
= 30 и, следовательно, уменьшится тоже в 30 раз. |
|||||||
|
|
0,0009 |
|||||||||
|
α |
|
|
|
|
|
|
|
|||
Экспериментально определяемая степень диссоциации сильных электролитов оказывается меньше истинной (100 %), поэтому ее принято называть кажущейся. Заниженность результатов измерений объясняется уменьшением подвижности ионов из-за их высокой концентрации и наличия вокруг каждого из них ионной атмосферы, образованной противоположно заряженными ионами. Поэтому для описания состояния ионов в растворе используют понятие активность иона, то есть условная (эффективная, проявляющая себя в действии) концентрация иона.
Активность иона (а, моль/л) связана с его молярной концентрацией в растворе сМ соотношением
а = f cМ, |
(9.12) |
где f – коэффициент активности иона.
Величина f, учитывающая различные взаимодействия между ионами в растворе, меньше единицы, но с разбавлением раствора приближается к ней. В разбавленных растворах слабых электролитов и бесконечно разбавленных растворах сильных электролитов f = 1 и, соответственно, а = cМ.
Коэффициенты активности ионов зависят от состава и концентрации растворов, от заряда и природы ионов и других условий. В разбавленных растворах значение f для данного иона определяется его зарядом и ионной силой раствора.
Ионная сила раствора является мерой электростатического взаимодействия между всеми ионами, находящимися в растворе, и определяется как полусумма произведения моляльности сm каждого иона на квадрат его заряда Z:
125

|
n |
|
= 1/2(сm1Z12 + сm2Z22 + … + сmnZn2) = 1/2 |
cmi Zi2. |
(9.13) |
|
i 1 |
|
Для сильно разбавленных растворов можно заменить моляльности молярными концентрациями сМ, так как при этих условиях они практически одинаковы.
Чем больше электростатическое взаимодействие ионов в растворе, тем выше ионная сила раствора и, следовательно, меньше коэффициент активности иона.
Если 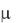 0,01, коэффициент активности иона f рассчитывается по формуле Дебая и Хюккеля:
0,01, коэффициент активности иона f рассчитывается по формуле Дебая и Хюккеля:
|
|
|
lg f = - |
0,5Z2 |
|
|
|
, |
|
(9.14) |
||
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
где Z – заряд иона. |
|
|
|
|
|
|
|
|
|
|
|
|
Для растворов с |
0,01 можно пользоваться приближенной формулой: |
|||||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
lg f = -0,5Z2 |
. |
|
(9.15) |
||||||
Пример 4. Вычислите ионную силу и активность ионов в растворе, |
||||||||||||
содержащем в 1 л 0,05 моль NaCl и 0,01 моль AlCl3. |
|
|||||||||||
Решение. Из уравнений диссоциации солей |
|
|
||||||||||
NaCl = Na+ + Cl- |
|
, AlCl3 = Al3+ + 3Cl- |
|
|
||||||||
следует, что концентрации ионов равны: |
|
|
|
|||||||||
NaCl: cNa = cCl = cNaCl = 0,05 моль/л, |
|
|
||||||||||
AlCl3: cAl 3 = cAlCl |
3 |
= 0,01 моль/л; cCl = 3cAlCl |
3 |
= 0,03 моль/л, |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||
cCl  общ. = 0,05 + 0,03 = 0,08 моль/л.
общ. = 0,05 + 0,03 = 0,08 моль/л.
Найдем ионную силу раствора (9.13):
= 0,5(cNa  Z2Na
Z2Na  + cAl 3
+ cAl 3 Z2Al 3
Z2Al 3 + cCl
+ cCl  Z2Cl
Z2Cl  ) =
) =
=0,5(0,05·12 + 0,01·32 + 0,08·12) = 0,11.
Так как 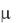 0,01, коэффициент активности рассчитываем по формуле
0,01, коэффициент активности рассчитываем по формуле
(9.14):
lg f = - |
0,5Z2 |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 12 |
|
|
|
|
|
|
||||||||||
lg fNa = lg fCl |
= - |
0,11 |
= -0,124, |
fNa = fCl = 0,751, |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
1 |
|
|
|
0,11 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
0,5 32 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
lg fAl |
3 = - |
0,11 |
= -1,121, fAl 3 |
= 0,076. |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
1 |
0,11 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Активности ионов находим по уравнению (9.12):
аNa  = fNa
= fNa  cNa
cNa  = 0,751 · 0,05 = 0,038 моль/л,
= 0,751 · 0,05 = 0,038 моль/л,
аAl 3 = fAl 3
= fAl 3 cAl 3
cAl 3 = 0,076 · 0,01 = 0,00076 моль/л, аCl
= 0,076 · 0,01 = 0,00076 моль/л, аCl  = fCl
= fCl  cCl
cCl  = 0,751 · 0,08 = 0,060 моль/л.
= 0,751 · 0,08 = 0,060 моль/л.
126

Задачи
653. Приготовлены 0,1 М водные растворы кислот HCl, HClO, CH3COOH, HF и HCN. Одинакова ли в них концентрация ионов водорода? Ответ подтвердите расчетом.
654. Для 0,125 М раствора НСООН вычислите [HCOO-] и . Какое количество ионов Н+ содержится в 250 мл раствора?
(Отв. 5,1 10-3моль/л; 0,041; 1,3 10-3моль)
655. Вычислите после добавления к 1 л раствора кислоты (см. зад. 654) 0,125 моль HCOONa. Как изменилось количество ионов Н+ в 250 мл раствора?
(Отв. 1,68 10-3; в 25 раз)
656. Для 0,125 М раствора NH4OH вычислите [OH-] и . Какое количество гидроксид-ионов содержится в 250 мл этого раствора?
(Отв. 1,5 10-3моль/л; 0,012; 4 10-4моль)
657. Вычислите после добавления к 1 л раствора аммиака (см. зад. 656) 0,125 моль NH4Cl. Как изменилось количество ионов OH- в 250 мл раствора?
(Отв. 1,4 10-4;  в 91 раз)
в 91 раз)
658. Вычислите [CN-] и  циановодородной кислоты в ее 0,05 М растворе. Какова масса ионов CN-, содержащихся в 550 мл этого раствора?
циановодородной кислоты в ее 0,05 М растворе. Какова масса ионов CN-, содержащихся в 550 мл этого раствора?
(Отв. 6 10-6моль/л; 1,2 10-4; 8,6 10-5 г)
659. Для 0,01 н. раствора HNО2 вычислите [NО2-] и . Какова масса ионов NО2-, содержащихся в 1,75 л этого раствора?
(Отв. 2,14 10-3моль/л; 0,214; 0,173 г)
660. Используя основные положения закона разбавления Оствальда,
вычислите, как изменится степень диссоциации |
HCN при разбавлении |
1 М раствора циановодородной кислоты в 10, 20, 100 и 1000 раз? |
|
661. Используя основные положения закона разбавления Оствальда, |
|
вычислите, как изменится степень диссоциации |
HCN при увеличении |
концентрации ее 0,001 М раствора в 10, 20, 100 и 1000 раз?
662. Используя основные положения закона разбавления Оствальда, вычислите, как изменится степень диссоциации HNО2 при разбавлении
ее1 М раствора в 10, 20, 100 и 1000 раз?
663.Используя основные положения закона разбавления Оствальда,
вычислите, как изменится степень диссоциации |
HNО2 при увеличении |
концентрации ее 0,001 М раствора в 10, 20, 100 и 1000 раз? |
|
664. Используя основные положения закона разбавления Оствальда, |
|
вычислите, как изменится степень диссоциации |
NH4ОН при разбавлении |
его 1 М раствора в 10, 20, 100 и 1000 раз? |
|
127

665. Используя основные положения закона разбавления Оствальда,
вычислите, как изменится степень диссоциации |
NH4ОН при увеличении |
|
концентрации его 0,001 М раствора в 10, 20, 100 и 1000 раз? |
|
|
666. Используя основные положения закона разбавления Оствальда, |
||
вычислите, как изменится степень диссоциации |
HSCN при разбавлении |
|
ее 1 М раствора в 10, 20, 100 и 1000 раз? |
|
|
667. Как изменятся степень диссоциации |
и концентрация ионов |
|
водорода [H+] в водном растворе СН3СООН, если концентрацию кислоты |
||
увеличить с 0,1 М до 0,25 М? |
|
|
|
(Отв. |
в 1,6 разa) |
668. Как изменятся степень диссоциации |
и концентрация ионов |
|
водорода [H+], если к 1 л 0,25 М раствора СН3СООН добавить 0,25 моль СН3СООNa ( СН3СООNa = 80 %)?
(Отв.  в 100 раз)
в 100 раз)
669. Вычислите концентрацию ионов водорода [H+] и степень диссоциации HCN в водном растворе, полученном сливанием равных объeмов
0,25 М HCN и 0,5 М KCN.
|
(Отв. 2,5 10-10моль/л; 2 10-9) |
|
670. |
Вычислите концентрацию ионов водорода [H+] и степень диссо- |
|
циации Н2СО3 по первой ступени в ее 0,25 М водном растворе. |
||
|
(Отв. 3,35 10-4моль/л; 1,34 10-3) |
|
671. |
Вычислите концентрацию ионов водорода [H+] и степень дис- |
|
социации |
Н2SО3 по первой ступени в ее 0,25 М водном растворе. |
|
|
(Отв. 6,32 10-2моль/л; 0,253) |
|
672. |
Вычислите концентрацию ионов водорода [H+] |
и степень дис- |
социации |
сероводородной кислоты по первой |
ступени в ее |
0,25 М растворе. |
|
|
|
(Отв. 3,87 10-4моль/л; 1,55 10-3) |
|
673.Какая молярная концентрация гидроксид-ионов [OH-] в водном растворе аммиака соответствует 0,97 %-й степени диссоциации NH4OH?
674.Как должна измениться 1 М концентрация азотистой кислоты в водном растворе, чтобы степень диссоциации HNO2 увеличилась в 10 раз?
(Отв.  в 100 раз)
в 100 раз)
675. Рассчитайте значение Ka для уксусной кислоты, если в 0,1 М водном растворе степень диссоциации равна 1,33 %.
(Отв. 1,77 10-5)
676. Вычислите концентрации ионов H+, HS- и S2- в 0,25 М водном растворе H2S.
(Отв. 1,22 10-4, 1,22 10-4 и 1,11 10-9моль/л)
128

677. Вычислите ионную силу 0,1 M растворов NaCl, Na2SO4, CaSO4. Какой можно сделать вывод?
(Отв. 0,1; 0,3; 0,4)
678. Вычислите ионную силу раствора, содержащего по 0,01 моль/л
NH4Сl и Сr2(SO4)3.
(Отв. 0,17)
679. Вычислите и а ионов в растворе, содержащем в 1 л 0,01 моль
(NH4)2S2O3 и 0,001 моль Na2S2O3.
(Отв. 0,033; 1,68 10-2 и 5,42 10-3моль/л)
680. Вычислите и а ионов в 0,05 М растворе K2CrO4, содержащем также 0,02 моль/л KCl.
(Отв. 0,17; 0,086; 0,014 и 0,013 моль/л)
681. Вычислите активность ионов в 0,001 М растворе хромовых квасцов (NH4)2SO4 Сr2(SO4)3.
(Отв.1,75 10-3, 2,32 10-3 и 5,87 10-4 моль/л)
682. Вычислите активность ионов в растворе, содержащем
0,03 моль/л CrCl3 и 0,07 моль/л NaCl.
(Отв. 6,9 10-4, 1,1 10-1 и 4,8 10-2 моль/л)
683. Вычислите активность ионов [H+] в растворе, содержащем 0,03 моль/л Cr(NO3)3 и 0,15 моль/л НСООН.
(Отв. 3,97 10-3 моль/л)
684.Во сколько раз ионная сила водного раствора Cr(NO3)3 выше ионной силы раствора KNO3 той же концентрации?
685.Вычислите ионную силу 0,01 М водных растворов солей
K2[SnCl4] и K4[Fe(CN)6].
(Отв. 0,02; 0,04)
686. Вычислите активности ионов K+, I-, H+ и OH- в 0,01 М растворе KI.
(Отв. 9 10-3 и 9 10-8 моль/л)
9.4. Ионное произведение воды Кw. Водородный показатель
Вода является слабым электролитом и частично диссоциирует по
схеме:
Н2О Н+ + ОН-.
Константа диссоциации воды, как и любая константа равновесия, зависит от температуры и для 25 оС равна:
КД = [H ][OH ] = 1,8·10-16 .
[H2O]
129

Поскольку степень диссоциации воды очень мала, то можно считать, что концентрация ее недиссоциированных молекул практически равна общей концентрации воды: в 1 л воды содержится 1000 г/18 г/моль = 55,56 моль Н2О.
[Н+][ОН-] = КД [Н2О] = 1,8·10-16 · 55,56 = 1·10-14 (при 25 оС).
Произведение концентраций ионов Н+ и ОН- для воды и водных растворов есть величина постоянная (при данной температуре). Она называет-
ся ионным произведением воды Кw:
Кw = [Н+][ОН-]. |
(9.16) |
Растворы, в которых концентрации ионов водорода и гидроксида
равны [Н+] = [ОН-] = 
 10 14 = 10-7 моль/л, называются нейтральными. В кислых растворах [Н+] > [ОН-], в щелочных растворах [Н+] < [ОН-].
10 14 = 10-7 моль/л, называются нейтральными. В кислых растворах [Н+] > [ОН-], в щелочных растворах [Н+] < [ОН-].
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться десятичными логарифмами, взятыми с обратным знаком:
рН = -lg [Н+] , |
рОН = -lg [ОН-]. |
(9.17) |
рН и рОН называются водородным и гидроксильным показателями, соответственно.
Логарифмируя выражение [Н+][ОН-] = Кw = 1·10-14 и меняя знак на обратный, получим
рН + рОН = рКw = 14 |
(9.18) |
для любого водного раствора, взятого при 25 оС.
При расчетах рН и рОН растворов сильных кислот и оснований можно считать соединение полностью диссоциированным. В других случаях (при  30 %) учитывается степень диссоциации электролита.
30 %) учитывается степень диссоциации электролита.
Пример 5. Вычислите значения рН и рОН 0,001 М водных раство-
ров HCl и NH4OH.
Решение. HCl = H+ + Cl-.
Так как HCl – сильный электролит, принимаем = 1. Следовательно,
[H+] = [Cl-] = 0,001моль/л,
рН = -lg [H+] = -lg 10-3 = 3,
pOH = 14 – pH = 14 – 3 = 11, NH4OH NH4+ + OH-.
Так как NH4OH – слабый электролит, необходимо вычислить степень диссоциации, используя Кb(NH4OH) = 1,8·10-4 (табличное значение). Из уравнения Оствальда (9.9) находим:
|
K |
|
|
|
|
|
|
|
|
= |
д |
= |
1,8 10 |
4 |
= 0,42, |
||||
|
|
|
|
||||||
|
сM |
0,001 |
|
|
|
||||
[OH-] = сМ = 0,42·0,001 = 4,2·10-4 моль/л,
рОН = -lg [OH-] = -lg(4,2·10-4) = 3,37, pH = 14 – pOH = 14 – 3,37 = 10,63.
130
