
»
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное образовательное учреждение высшего профессионального образования
УЛЬЯНОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Г И Д Р О Л О Г И Я
Учебное пособие по курсу «Науки о Земле» для студентов, обучающихся по специальности 28020265 «Инженерная защита окружающей среды»
Составитель В. А. Михеев
Ульяновск
2010
1

УДК 55 (075) ББК 26.22 я7
Г 46
Рецензенты: канд. биол. наук, ведущий инженер-гидролог М. Е. Лоснов; доцент кафедры «Природопользование» экологического факультета Института медицины, экологии и физической культуры УлГУ, канд. географ. наук Р. Х. Салахова.
Утверждено редакционно-издательским отделом университета в качестве учебного пособия
Гидрология : учебное пособие по курсу «Науки о Земле» для сту-
Г46 дентов, обучающихся по специальности 28020265 «Инженерная защита окружающей среды» / сост. В. А. Михеев. − Ульяновск : УлГТУ, 2010. − 200 с.
ISBN 978-5-9795-0751-4
Пособие составлено в соответствии с программой, рекомендованной Министерством образования России по дисциплине «Науки о Земле», и требованиями действующего Государственного образовательного стандарта по направлению «Инженерная защита окружающей среды». В пособии даны современные представления о происхождении и строении Земли, минералогии, эндогенным и экзогенным геологическим процессам, тектонике и геологической хронологии, а также экологическим функциям литосферы и последствиям антропогенного воздействия на литосферу. В заключении даны определения основных геологических терминов, используемых в данном пособии.
УДК 55 (075) ББК 26.22 я7
|
© Михеев В. А., составление, 2010 |
ISBN 978-5-9795-0751-4 |
© Оформление. УлГТУ, 2010 |
2
ОГЛАВЛЕНИЕ
Введение…………………………………………………………………………………… 5
1.Гидрология как наука……………………………………………………………….. 6
1.1.Методы изучения гидрологических процессов………………………….. 6
1.2.Вода как вещество………………………………………………………….. 7
1.3. |
Водный баланс в гидрологии……………………………………………… 19 |
1.4.Понятие о гидросфере……………………………………………………… 20
1.5.Круговорот воды в природе……………………………………………….. 22
1.6.Понятие о водных ресурсах……………………………………………….. 24
1.7.Водные объекты и их виды………………………………………………... 26
2.Гидрология рек…………………………………………………………........................ 27
2.1.Реки и их типы……………………………………………………………… 27
2.2.Морфометрические характеристики бассейна реки……………………... 30
2.3. |
Водный баланс речного бассейна…………………………….…………… 33 |
2.4.Строение реки…………………………………………………..…………... 34
2.5.Морфометрические характеристики реки и русла реки…………………. 37
2.6.Количественные характеристики стока реки…………………………….. 38
2.7.Водный режим рек……………………………………………..…………... 40
2.8.Классификация рек по водному режиму…………………………………. 41
2.9.Гидрометрия…………………………………………………….………….. 44
2.10.Русловые процессы на реках……………………..……………………….. 46
2.11.Термический и ледовый режим рек. Ледовые явления………………….. 51
2.12.Гидрохимия рек………………………………………………..…………… 55
2.13 |
Антропогенное воздействие на режим рек и речной сток….…………… 55 |
3.Гидрология подземных вод…………………………………………….……………. 57
3.1.Вода в земной коре…………………………………………….…………… 57
3.2. |
Интенсивность водообмена подземных вод……………………………… 57 |
3.3.Происхождение подземных вод…………………………………………… 58
3.4. |
Водные свойства горных пород…………………………………………… 59 |
3.5.Физические свойства и химический состав подземных вод…………….. 61
3.5.1.Физические свойства подземных вод…………………………………….. 61
3.5.2.Химический состав подземных вод……………………………………….. 62
3.5.3.Агрессивность подземных вод к строительным конструкция. …………. 66
3.6..Классификация подземных вод……………………………….…………... 66
3.6.1.Классификация подземных вод по характеру их использования…………………………………………………………… 66
3.6.2.Классификация подземных вод по условиям залегания…….…………... 67
3.7.Движение подземных вод………………………………………………….. 81
3.7.1.Общие понятия о движении подземных вод……………………………... 81
3.7.2.Основной закон фильтрации подземных вод – закон Дарси……………. 83
3.7.3.Фильтрационные параметры горных пород и водоносных
пластов………………………………………………………….…………… 84 3.7.4. Расход плоского стока подземных вод…………………………………… 87
3.8.Естественные выходы подземных вод
на поверхность (источники)…………………………………..…………… 88 3.8.1. Общие сведения об источниках…………………………………………… 88
3.8.2.Нисходящие источники………………………………………..…………... 89
3.8.3.Восходящие источники……………………………………………………. 89
3.9. |
Режим и баланс подземных вод…………………………………………… |
90 |
3.9.1 |
Режим подземных вод в естественных условиях………………………… |
90 |
3
3.9.2.Режим подземных вод в условиях влияния техногенных факторов…………………………………………………….. 92
3.9.3.Баланс подземных вод……………………………………………………... 93
3.10. Запасы и ресурсы подземных вод………………………………………… 95
3.10.1.Классификация запасов подземных вод
по гидрологическим условиям…………………………………………… 95
3.10.2.Классификация эксплуатационных запасов подземных
вод по степени изученности……………………………………..………… 97
3.11.Охрана подземных вод от истощения и загрязнения……….……………. 98
3.11.1.Истощение запасов подземных вод……………………………………….. 98
3.11.2.Загрязнение подземных вод………………………………….……………. 100
3.11.3. Зоны санитарной охраны……………………………………..…………… 102
4.Гидрология озер……………………………………………………………………… 104
4.1.Типы озер…………………………………………………………………… 104
4.2. |
Морфология и морфометрия озер………………………………………… 106 |
4.3.Водный баланс озер……………………………………………………….. 108
4.4.Динамика уровня воды в озерах………………………………………….. 109
4.5. |
Движение воды в озерах…………………………………………………… 110 |
4.6.Термический режим озер…………………………………………………... 112
4.7.Ледовые явления на озерах………………………………………………... 114
4.8.Гидрохимия озер…………………………………………………………… 115
4.9. |
Влияние озер на речной сток……………………………………………… 118 |
5.Гидрология водохранилищ…………………………………………………………. 119
5.1.Типы водохранилищ……………………………………………………….. 119
5.2.Основные морфометрические характеристики водохранилищ………………………………………………………………. 122
5.3.Водный режим водохранилищ………………………………..…………… 123
5.4.Термический режим водохранилищ……………………..…..……………. 124
5.5.Влияние водохранилищ на окружающую среду…………………………. 124
6.Гидрология болот………………………………………………………..…………… 127
6.1.Происхождение болот……………………………………………………… 127
6.2.Типы болот ………..…………………………….…………….……………. 128
6.3.Морфология и гидрология болот………………………………………….. 130
6.4.Влияние болот на речной сток и хозяйственное значение болот ……………………………………………………………... 132
7.Гидрология морей……………………………………………………….…………… 134
7.1.Мировой океан и его структура……………………………….…………... 134
7.2Водный баланс Мирового океана…………………………………………. 141
7.3.Морские течения и их классификация……………………………………. 142
7.4.Приливы и отливы……………………………………………..…………… 143
7.5.Динамика температуры морской воды……………………….…………… 146
7.6.Соленость морской воды…………………………………………………... 147
7.7Океан и климат……………………………………………………………... 148
7.8. Экологическое состояние Мирового океана…………………………… 153
Заключение…………………………………………………………………..……………. 158 Библиографический список……………………………………………….……………. 162 Словарь терминов……………………………………………………………………….. 163 Приложение……………………………………………………………………………….. 198
4
ВВЕДЕНИЕ
Проблема сохранения окружающей среды в XXI веке является одной из важнейших для мирового сообщества. В перспективе ее актуальность будет возрастать, ибо все современные глобальные проблемы, по сути, являются экологическими. В преодолении экологического кризиса ведущая роль принадлежит людям, ответственным за научно-технический прогресс и принимающим решения на государственном и международном уровнях. В то же время, решение локальных экологических проблем напрямую связано с формированием нового экологического мышления, в первую очередь у управленческих кадров
итехнических специалистов. Представляется, что экологическое образование это наиболее доступный способ внедрения рационального природопользования
исохранения устойчивого развития цивилизации.
Необходимость экологизации образования является следствием происходящего переворота в научном мировоззрении, называемого экологической революцией. Закономерным шагом в экологизации инженерного образования в России стало введение подготовки специалистов в области техносферной безопасности и инженерной защиты окружающей среды в технических вузах с 90-х гг. прошлого века. Можно прогнозировать, что направление подготовки специалистов высшей квалификации «Защита окружающей среды», учитывая его экологическую ориентацию и наиболее широкую фундаментальную общенаучную подготовку, способно внести значительный вклад в решение актуальных экологических проблем.
В 2000 г. в государственный образовательный стандарт (ГОС) подготовки по специальности 28020265 «Инженерная защита окружающей среды» и других специальностей направления подготовки специалистов 656600 «Защита окружающей среды» были внесены принципиальные изменения, в частности, в цикл естественнонаучных дисциплин (ЕН): дисциплина «Основы физиологии» переведена в цикл общепрофессиональных дисциплин (ОПД); «Биоэкология» заменена на «Общую экологию» (тем самым расширен круг рассматриваемых экологических проблем); впервые включена дисциплина «Науки о Земле» 8 .
«Науки о Земле» включают более 30 практически самостоятельных наук, в том числе и «Гидрологию».
Экологические функции гидросферы вытекают из ее взаимодействия с атмосферой и верхней частью литосферы, которое приводит к широкому интенсивному газообмену, способствует возникновению климата и погодных условий, обуславливает распределение температуры, солености и плотности Мирового океана, вызывает поверхностную и глубинную гидродинамику. Все это играет ведущую роль в распределении биоты, обуславливает жизнедеятельность организмов, транспортировку и аккумуляцию вещества. Как один из главнейших экзогенных факторов гидросфера преобразует земную поверхность, участвует в формировании рельефа, переносит во взвешенном и растворенном состоянии вещества и химические соединения и участвует в аккумуляции осадочного материала 11 .
5
1.ГИДРОЛОГИЯ КАК НАУКА
1.1.Методы изучения гидрологических процессов
1.2.Вода как вещество
1.3.Водный баланс в гидрологии
1.4.Понятие о гидросфере
1.5.Круговорот воды в природе
1.6.Понятие о водных ресурсах
1.7.Водные объекты и их типы
1.1.Методы изучения гидрологических процессов
Гидроло́гия (греч. Yδρoλoγια, от др. греч. Yδωρ – вода + λoγoς – слово, учение) – наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
В теоретическом и практическом отношении гидрология:
исследует круговорот воды в природе, влияние на него деятельности человека, управление режимом водных объектов и водным режимом отдельных территорий;
проводит анализ гидрологических элементов для отдельных территорий и Земли в целом;
дает оценку и прогноз состояния и рационального использования водных ресурсов; пользуетсяметодами, применяемымивгеографии, физикеидругихнауках.
К основным разделам гидрогеологии относятся:
Гидрохимия изучает химические характеристики природных вод. Гидробиология – раздел на стыке с биологией, рассматривающий вопро-
сы жизни и биологических процессов в воде.
Гидрогеология – изучает происхождение, условия залегания, состав и закономерности движений подземных вод.
Гидроинформатика – раздел на стыке с информатикой, в котором используют современные вычислительные мощности для решения проблем, связанных с водными ресурсами.
Гидрометеорология – изучает обменные процессы между поверхностью воды и нижними слоями атмосферы
Изотопная гидрология – изучает изотопические характеристики воды. Гидрология суши изучаетпроцессы, протекающиенаповерхностиЗемли. Океанология – изучает характеристики больших масс воды.
Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками 1 .
Современная гидрология располагает большим арсеналом взаимодополняющих друг друга методов изучения гидрологических процессов. Среди них важное место занимают методы полевых исследований, которые подразделяются на стационарные и экспедиционные. Большинство результатов стационар-
6
ных наблюдений на сети гидрологических станций и постов публикуется в материалах Государственного водного кадастра (ГВК), который представляет собой систематизированный, постоянно пополняемый и уточняемый свод сведений о водных объектах, режиме, качестве, использовании вод и составляет единый Государственный водный фонд страны.
В гидрологии широко используются экспериментальные исследования (в природных условиях или в лаборатории). При анализе материалов гидрологических наблюдений используются эмпирические и статистические методы. Теоретические методы анализа гидрологических процессов включают приемы географического обобщения, картографирования, методы математического и имитационного моделирования, системный анализ др.
1.2. Вода как вещество
Молекулярная структура Вода – (оксид водорода) Н20, молекулярная масса 18,016, простейшее ус-
тойчивое соединениеводородаскислородом. Жидкостьбеззапаха, вкусаицвета. Вода – одно из самых распространенных на Земле соединений. Молекулы
воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников. Количество воды на поверхности Земли оценивается в 1,39 •1018 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет около 11 • 1013 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4 • 1016т, примерно столько же имеется подземных вод, причем, только небольшая их часть – пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) воды, чем на поверхности. В атмосфере находится около 1,3 • 1013 т воды. Вода входит в состав многих минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязательным компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых разновидностей воды. Содержание их в пресной воде в среднем следующее (%): 1Н216О – 99,73; 1Н218O – 0,2; 1Н217О – 0,04; 1Н2Н16О – 0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3Н2 (или Т2О). Изотопный состав природных вод разного происхождения варьируется. Особенно непостоянно отношение 1Н/2Н в пресных водах – в среднем
6900, в морской воде – 5500, во льдах – 5500-9000.
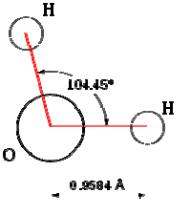
Строение молекулы и физические свойства. Атом водорода и кислоро-
да в молекуле воды расположены в углах равнобедренного треугольника с длиной связи 0,0957 нм; валентный угол Н—О—Н 104,5°(рис.1; дипольный момент 6,17 • 10 -30 Кл • м; поляризуемость молекулы 1,45 • 10 -3 нм3; средний квадрупольный момент – 1,87 • 10-41 Кл-м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы воды с другими атомами, моле-
7
кулами и ионами, в т.ч. с другими молекулами воды в конденсируемых фазах, эти параметры изменяются.
Рис. 1. Строение молекулы воды
Химический состав воды. В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3-, хлорид Cl- и сульфат SO42-) и четыре катиона (кальций Ca2+, магний Mg2+, натрий Na+ и калий K+) – их называют главны-
ми ионами. Хлорид-ионы придают воде соленый вкус, сульфат-ионы, ионы кальция и магния – горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95%, а в высокоминерализованных – свыше99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-, B3+, Sr3+ и др. Отнесение ионов K+ к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K+ могут играть главную роль.
Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары,
например MgHCO3+, CaHCO3+.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).
Классификация природных вод по химическому составу
Соотношение указанных элементов определяет основные свойства вод – щелочность, соленость и жесткость (рис. 2).
По анионам выделяют три типа воды: 1) гидрокарбонатные; 2) сульфатные; 3) хлоридные и ряд промежуточных – гидрокарбонатно-сульфатные, сульфатно-хлоридные, хлоридно-сульфатные, а также более сложного состава.
8

|
Ca(HCO3)2 |
CaSO4 |
Ca(HCO3)2 |
Ma(HCO3)2 |
MgSO4 |
Щелочность Mg(HCO3)2 |
Жесткость CaSO4 |
Соленость CaCl2 |
Na(HCO3) |
MgSO4 |
MgCl2 |
|
CaCl2 |
Na2SO4 |
|
MgCl2 |
NaCl |
Рис. 2. Сочетание различных элементов, обуславливающих свойства воды
Под классификацией природных вод по химическому составу понимают распределение химического состава природных вод на классы по определенным признакам, которое составляет систему. Основой для систематизации в существующих классификациях служат следующие признаки: минерализация воды, концентрация преобладающего компонента или их групп, соотношение между концентрациями разных ионов, наличие повышенных концентраций ка- ких-либо специфических компонентов газового (CO2, H2S, CH4 и др.) или минерального (F, Ra и др.) состава.
В настоящее время универсальной классификации не существует. К наиболее известным и часто употребляемым относятся классификации природных вод Ч. Пальмера, С. А. Щукарева, О. А. Алекина. Химический состав воды изображают в виде индекса, формулы, графика или диаграммы.
По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. Каждая группа подразделяется на 4 типа по соотношению содержащихся в воде ионов (в эквивалентах). При этом класс природных вод обозначается сим-
волом соответствующего аниона: С — НСО3-, S — SO42-, Сl — Сl-; группа: символом катиона: К+, Na+, Са2+, Мg2+; тип – римской цифрой.
Формула воды записывается следующим образом. К символу класса добавляется нижний индекс – значение минерализации (с точностью до 0,1 г/л ), к символу группы – верхний индекс – значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л), например: С1,2 Nа0,5 – гидро- карбонатно-натриевая вода с общей минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия. Или СсаІІ50,4 – это значит, что вода гидрокарбонатного класса, группы кальция, типа ІІ, с минерализацией 0,4 г/дм3 и жесткостью 5 ммоль/дм3 (мг-экв/л).
Вприродных водах присутствуют также растворенные газы. В основном это газы, которые диффундируют в воды из атмосферы воздуха, такие как кислород, углекислый газ, азот. Но в то же время в подземных водах или водах нецентрализованных источников водоснабжения, в минеральных и термальных водах могут присутствовать сероводород, радиоактивный газ радон, а также инертные и другие газы.
Втабл. 1. представлены ионы, наиболее часто встречающиеся в природных водах.
9

Таблица 1
Ионы, наиболее часто встречающиеся в природных водах
|
Катион |
|
Анион |
|
|
|
|
Наименование |
Обозначение |
Наименование |
Обозначение |
|
|
|
|
Водород |
H+ |
Гидроксильный |
OH- |
Натрий |
Na+ |
Бикарбонатный |
HCO3- |
Аммоний |
NH4+ |
Хлоридный |
Cl- |
Кальций |
Ca2+ |
Сульфатный |
SO42- |
Магний |
Mg2+ |
Нитритный |
NO2- |
Железо (двух- |
Fe2+, Fe3+ |
Нитратный |
NO3- |
и трехвалентное) |
|
|
|
Барий |
Ba2+ |
Силикатный |
SiO32- |
Алюминий |
Al3+ |
Ортофосфорный |
PO43- |
Калий |
K+ |
Фторидный |
F- |
Химические свойства воды
Химически чистая вода в обычных условиях – жидкость без цвета, вкуса и запаха. При нормальном атмосферном давлении (1013 гПа или 760 мм.рт.ст.) температура замерзания принята равной 0 С, а кипения 100 С.
Вода является слабым электролитом. При температуре 25 С примерно
1 на 5 • 109 молекул подвергается электролитической диссоциации по схеме
Н2О↔Н++ОН-.
Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- − являются важными характеристиками водных растворов и отражают водородный показатель (рН), который представляет десятичный логарифм концентрации водных ионов (моль/л), взятый с обратным знаком. Величина рН обусловливает кислотную или щелочную реакцию водной среды.
Минерализация воды. Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде ве-
ществ. Этот параметр также называют содержанием растворимых твердых веществ или общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. Минерализация выражается в мг/л или г/л. В по-
давляющем большинстве случаев солевой состав природных вод определяется катионами Са2+, Мg2+, Nа+, К+ и анионами НСO3-, Сl- , SO42-. Эти ионы называ-
ются главными ионами воды или макрокомпонентами; они определяют хими-
ческий тип воды. Остальные ионы присутствуют в значительно меньших количествахиназываютсямикрокомпонентами; онинеопределяютхимическийтипводы.
Содержание растворенных в воде веществ, выраженное в г/кг или промилле (одна тысячная доля, 1/10 процента обозначается дробью «0 делить на 00» (‰), называется соленостью воды. К числу наиболее распространенных относятся неорганические соли (в основном бикарбонаты, хлориды и сульфаты
10
