
- •Таблица 43
- •Соотношение патологии и клиники ОКС
- •Эрозия с заживлением
- •Неокклюзирующий тромбоз
- •Атероэмболия
- •ИМ без Q-зубца
- •Окклюзирующий тромбоз
- •ИМ с Q-зубцом
- •Спазм сосудов (вазоконстрикция)
- •В приемном отделении решается вопрос о месте лечения и начале медикаментозной терапии (МТ). Критерии госпитализации больных в отделение реанимации и интенсивной терапии, кардиологические отделения приводятся ниже.
- •Показания к коронарографии :
- •1. У пациентов со стенокардией:
- •2. У пациентов с острым ИМ:
- •3. У пациентов с перенесенным ИМ:
- •Противопоказания к коронарографии:
- •острое нарушение мозгового кровообращения в сроки до 1 месяца,
- •острые инфекционные заболевания
- •неконтролируемая артериальная гипертензия
- •тяжелые психические заболевания
- •интоксикация сердечными гликозидами
- •аллергия к рентгеноконтрастным веществам
- •1. Ангиографические (стеноз более 50%):
- •2. Клинические:
- •3. При наличии осложнений:
- •постинфарктная аневризма левого желудочка;
- •ОИМ при ранней постинфарктной стенокардии, кардиогенном шоке;
- •механические осложнения ОИМ (разрыв МЖП, разрыв стенки ЛЖ, острая митральная недостаточность);
- •диффузное поражение коронарных артерий;
- •2. Клинические:
- •при сниженной (<30%) фракции выброса и доказанной низкой массе жизнеспособного миокарда (вследствие перенесенных ИМ);
- •декомпенсированные тяжелые сопутствующие заболевания (обострение ЯБ, злокачественные опухоли, почечная, печеночная, дыхательная недостаточность, ожирение), беременность;
- •недавно перенесенное (менее 4 недель) ОНМК.
- •Благодаря усилиям многих исследователей, в хирургической реваскуляризации миокарда к настоящему времени получили распространение и продолжают развиваться следующие методики:
Министерство здравоохранения и социального развития Российской Федерации
ФГОУ ВПО "Самарский государственный медицинский университет Росздрава"
Министерство обороны Российской Федерации ФГОУ ВПО "Самарский военно-медицинский институт Минобороны РФ"
ФГОУ ВПО "Военно-медицинская академия имени С.М. Кирова Минобороны РФ"
Н.Н. КРЮКОВ Е.Н. НИКОЛАЕВСКИЙ В.П. ПОЛЯКОВ
ИШЕМИЧЕСКАЯ
БОЛЕЗНЬ СЕРДЦА
Современные аспекты клиники,
диагностики, лечения, профилактики,
медицинской реабилитации, экспертизы
Самара
2010
УДК 616.126 ББК 54.102
Крюков Н.Н., Николаевский Е.Н., Поляков В.П. Ишемическая болезнь сердца (современные аспекты клиники, диагностики, лечения, профилактики, медицинской реабилитации, экспертизы): Монография. – Самара, 2010. - 651 с.
ISBN 978-5-91082-10
В книге представлены общепринятая терминология, клиническая классификация, распространенность, особенности этиологии, патогенеза, клинической картины и современного течения наиболее распространённых форм ишемической болезни сердца и их осложненийсердечной недостаточности, нарушений ритма и проводимости. Рассмотрены новые данные по клинической и лабораторноинструментальной диагностике этой патологии. Приведена методология консервативного и хирургического лечения, первичной и вторичной профилактики, основанная на принципах доказательной медицины. Показана диагностическая эффективность лабораторно-инструментального скрининга. Представлены наиболее значимые клинические, лабораторные, инструментальные диагностические критерии, показания и противопоказания к проведению инвазивных методов исследования и лечения, кардиохирургических операций. На основе литературных данных и собственного опыта определена лечебно-диагностическая тактика, представлены основные положения экспертизы временной нетрудоспособности и медицинской реабилитации больных с ишемической болезнью сердца.
Издание предназначено для врачей общей практики, кардиологов, терапевтов. Может представлять несомненный интерес для преподавателей, клинических ординаторов, студентов и слушателей старших курсов медицинских ВУЗов по курсу кардиологии.
Таблиц 81. Рисунков 62. Библиография: 371 назв.
УДК 616.126 ББК 54.102
ISBN 978-5-91082-10
Рецензенты:
заслуженный врач РФ, доктор медицинских наук, профессор В.Н. Чернышев доктор медицинских наук, профессор В.В. Симерзин
© Крюков Н.Н., Поляков В.П., Николаевский Е.Н., 2010
2
Federal agency on public health services and social development the Russian Federation
SEE MPF "Samara state medical university Roszdrava"
The Ministry of Defence of the Russian Federation
SEE MPF "Samara military-medical institute MD RF"
Army medical-college of name С.М. Kirov
N.N. KRJUKOV
E.N. NIKOLAEVSKIY
V.P. POLIAKOV
ISCHEMIC
DISEASE OF HEART
Modern aspects of clinic,
diagnostics, treatments, preventive maintenance,
мedical rehabilitation, examinations
Samara
2010
3
UDC 616.126
BBC 54.102
Krjukov N.N., Poliakov V.P., Nikolaevskiy E.N. Ischemic disease of heart
(modern aspects of clinic, diagnostics, treatment, preventive maintenance, мedical re-
habilitation, examinations): Monography. - Samara, 2010. - 651 p.
ISBN 978-5-91082-10
In the book the standard terminology, clinical classification, prevalence, features etiology, patogenesise, a clinical picture and the modern trend of the most widespread forms of ischemic illness of heart and their complications - are submitted to intimate insufficiency, infringements of a rhythm and conductivity. The new data on clinical and laboratory-tool diagnostics are considered. The methodology of conservative and surgical treatment, the primary and secondary preventive maintenance, based on principles of demonstrative medicine is resulted. Diagnostic efficiency of laboratory-tool screening is shown at pathology of bodies of blood circulation. The most significant clinical, laboratory, tool diagnostic criterias, indications and contraindications to carrying out aggressive methods of research and treatment, сardiosurgicals operations are submitted. On the basis of the literary data and own experience medical-diagnostic tactics is determined, substantive provisions of examination of time invalidity and medical rehabilitation of patients with ischemic illness of heart are submitted.
The edition is intended for doctors of the general practice, cardiologists, therapists. Can represent doubtless interest for teachers, clinical interns, students and students of the senior rates of medical high schools at the rate of cardiology.
Tab. 81. Figures 62. Ref.: 371.
UDC 616.126
BBC 54.102
ISBN 978-5-91082-10
Reviewers:
Deserved doctor of the Russian Federation,
Doctor of medical sciences professor V.N. Tchernyshev
Doctor of medical sciences professor V.V. Simerzin
© Krjukov N.N., Poliakov V.P., Nikolaevskiy E.N., 2010
4
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ …………………………………………………….. 14
ПРЕДИСЛОВИЕ ………………………………………………………………… 16
Глава I АТЕРОСКЛЕРОЗ
Крюков Н.Н., Николаевский Е.Н., Павлова Т.В., Пичко Г.А.
1.1Этиология ……………………………………………………………………….. 18
1.2Патогенез ..……………………………………………………………………..... 28
1.3Киническая картина..……………………………………………………........... 39
1.4Лабораторно-инструментальная диагностика………………………………... 48
1.5Лечение и профилактика………………………………………………………. 60
Глава II
АТЕРОСКЛЕРОЗ ПРИ САХАРНОМ ДИАБЕТЕ
Шустов С.Б. |
|
2.1. Определение, особенности патогенеза при сахарном диабете ………………… |
75 |
2.2. Клинические проявления ………………………………………………………………… |
75 |
2.3.Диагностика синдрома диабетической стопы……………………………….. 77
2.4.Дифференциальный диагноз форм диабетической стопы………………….. 79
2.5.Профилактика диабетических макроангиопатий……………………………. 79
2.6.Консервативное лечение …………………………………………………………………. 81
2.7.Хирургическое лечение …………………………………………………………………… 87
Глава III
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Крюков Н.Н., Николаевский Е.Н.
3.1Определение…………………………………………………………………….. 89
3.2Этиология и патогенез……………………………………………….................. 90
3.3Классификация ……………………………………………………………......... 99
Глава IV
ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ
Николаевский Е.Н., Поляков В.П.
4.1Определение …………………………………………………………………..... 103
4.2Патогенез ..……………………………………………………………………..... 104
4.3Стратификация риска…………………………………………………………... 106
4.4Клиническая картина..………………………………………………………..... 113
4.5Диагностика …………………………………………………………………….. 114
4.6Лечение и профилактика…………………………………................................. 114
Глава V
СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
Крюков Н.Н., Николаевский Е.Н., Поляков В.П., Павлова Т.В., Пичко Г.А.
5.1Определение ..………………………………………………………................... 117
5.2Клиническая картина ..………………………………………………………..... 118
5.3Лабораторно-инструментальная диагностика ………………………………... 124
5.4Консервативное лечение …………………………….......................................... 149
5.5Профилактика приступов стенокардии ……………………………………….. 167
5.6Хирургическое лечение ………………………………………………………... 179
Глава VI
ОСОБЫЕ ФОРМЫ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
5
Николаевский Е.Н, Крюков Н.Н.
6.1Спонтанная (вариантная) стенокардия ……………………………………….. 183
6.2Безболевая ишемия миокарда……………………............................................. 188
6.3Кардиальный синдром Х……………………………………………………..... 192
Глава VII
НЕСТАБИЛЬНАЯ СТЕНОКАРДИЯ
Крюков Н.Н., Николаевский Е.Н., Поляков В.П., Пичко Г.А.
7.1Этиология ………………………………………………………………………. 195
7.2Патогенез ..…………………………………………………………………….... 196
7.3Клиническая картина..……………………………………………………….... 197
7.4Классификация ..……………………………………………………………….. 200
7.5Лабораторно-инструментальная диагностика……………………………….. 203
7.6Консервативное лечение ……………………………………………………….. 210
7.7Хирургическое лечение………………………………………………………... 216
Глава VIII
ИНФАРКТ МИОКАРДА
Крюков Н.Н., Николаевский Е.Н., Поляков В.П., Качковский М.А., Пичко Г.А.
8.1Определение ..…………………………………………………………………... 219
8.2Классификация ..……………………………………………………………….. 219
8.3Этиология и патогенез………………………………………………………… 225
8.4Клиническая картина..……………………………………………………….... 229
8.5Лабораторно-инструментальная диагностика……………………………….. 238
8.6Лечение ..………………………………………………………………………... 246
8.7Качество жизни больных инфарктом миокарда……………………………… 256
8.8Инфаркт миокарда правого желудочка……………………………………….. 261
8.9Осложнения инфаркта миокарда……………………………………………… 264
8.10 Депрессия у больных инфарктом миокарда………………………………… 301
Глава IX
ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ
Свистов А.С., Рыжман Н.Н., Поляков В.П.
9.1.Определение ..………………………………………………………………….. 308
9.2.Патогенез ..…………………………………………………………………….. 308
9.3.Диагностика острого коронарного синдрома..………………………………. 309
9.4.Визуализационные методики в диагностике ОКС…………………………... 310
9.5.Стратификация риска развития внезапной смерти и крупноочагового инфаркта миокарда у пациентов с ОКС ..……………………………………………. 311
9.6.Принципы лечения острого коронарного синдрома………………………… 313
9.7.Алгоритмы диагностики и лечения ОКС в специализированном кардиоло-
гическом стационаре ..……………………………………………………………… 317
Глава X
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Крюков Н.Н., Николаевский Е.Н.
10.1Определение …………………………………………………………………... 325
10.2Этиология ……………………………………………………………………… 325
10.3Патогенез ..……………………………………………………………………... 326
10.4Клиническая картина..………………………………………………………... 333
10.5Хроническая систолическая сердечная недостаточность………………….. 335
10.6Классификация хронической сердечной недостаточности………………… 345
10.7Лабораторно-инструментальная диагностика………………………………. 347
10.8Лечение ..………………………………………………………………………. 365
6
10.9 Хроническая диастолическая сердечная недостаточность..……………….. 392
Глава XI
ДИАГНОСТИКА И ЛЕЧЕНИЕ ОБРАТИМОЙ ИШЕМИЧЕСКОЙ ДИСФУНКЦИИ
Свистов А.С., Никифоров В.С., Сухов В.Ю.
11.1Определение ..………………………………………………………................. 398
11.2Патогенез ..………………………………………………………....................... 399
11.3Методы диагностики обратимой ишемической дисфункции миокарда…... 400
11.4Позитронно-эмиссионная томография………………………………………. 401
11.5Методы оценки перфузии миокарда………………………………………… 402
11.6Эхокардиографические методики…………………………………………… 404
11.7Магнитно-резонансная томография…………………………………………. 405
11.8Основные подходы к лечению обратимой ишемической дисфункции мио-
карда ..………………………………………………………...................................... 406
Глава XII
НАРУШЕНИЯ РИТМА И ПРОВОДИМОСТИ
Крюков Н.Н., Николаевский Е.Н., Поляков В.П., Пичко Г.А.
12.1Определение …………………………………………………………………. 408
12.2Этиология ……………………………………………………………………… 408
12.3Патогенез ..………………………………………………………………........... 408
12.4Классификация аритмий……………………………………………………. 411
12.5Клиническая картина..………………………………………………............ 412
12.6Инструментальная диагностика……………………………………………. 413
12.7Наджелудочковые нарушения ритма…………………………………........ 417
12.8Желудочковые аритмии…………………………………………………….. 433
12.9Медикаментозное лечение………………………………………………….. 439
12.10 Электрокардиостимуляция ………………………………………………… 459
12.11Электрическая кардиоверсия………………………………………………. 469
12.12Хирургическое лечение..………………………………………………........ 470
Глава XIII
СОВРЕМЕННОЕ СОСТОЯНИЕ И ПЕРСПЕКТИВЫ КАРДИОХИРУРГИИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Хубулава Г.Г., Пайвин А.А., Юрченко Д.Л.
13.1.Эволюция хирургического лечения ишемической болезни сердца………. 472
13.2.Визуализационные методы диагностики в определении показаний к хирургическому лечению ишемической болезни сердца …………………………... 474
13.3.Хирургическая реваскуляризация миокарда……………………………….. 479
13.4.Катетеризационные методы реваскуляризации миокарда………………… 486
13.5.Хирургическое лечение аневризмы левого желудочка и других осложне-
ний инфаркта миокарда ……………………………………………………………. 490
13.6.Реконструктивные вмешательства на клапанном аппарате сердца при ишемической болезни ……………………………………………………………… 495
13.7.Хирургическое лечение сердечной недостаточности……………………… 499
13.8. Роль кардиолога в послеоперационном ведении пациентов……………… 502
13.9. Перспективы кардиохирургического |
лечения ишемической болезни |
сердца |
505 |
……………………………………………………………………………………..
Глава XIV
ЭКСПЕРТИЗА ВРЕМЕННОЙ НЕТРУДОСПОСОБНОСТИ
7
БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Додонов А.Г., Николаевский Е.Н.
14.1Экспертиза временной нетрудоспособности………………………………... 506
14.2Медико-социальная экспертиза………………………………........................ 511
14.3Реабилитация инвалидов………………………………................................... 515
14.4 Экспертиза нетрудоспособности больных, перенесших инфаркт миокарда 516
14.5Экспертиза нетрудоспособности больных стенокардией напряжения……. 518
14.6Экспертиза нетрудоспособности больных нестабильной стенокардией….. 520
14.7Экспертиза нетрудоспособности больных особыми формами ишемиче-
ской болезни сердца ………………………………................................................... 521
14.8Экспертиза нетрудоспособности больных с хронической сердечной -не достаточностью ……………………………….......................................................... 522
14.9Экспертиза нетрудоспособности больных с нарушениям ритма и прово-
димости ………………………………....................................................................... 524
Глава XV
ВОССТАНОВИТЕЛЬНОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Удальцов Б.Б., Николаевский Е.Н., Додонов А.Г. |
|
15.1 Определение …………………………………………………………………... |
526 |
15.2 Восстановительное лечение больных ишемической болезнью сердца…… |
526 |
15.3Восстановительное лечение больных инфарктом миокарда………………. 528
15.4Восстановительное лечение больных стабильной стенокардией ………….. 534
15.5Восстановительное лечение больных с хронической сердечной недоста-
точностью …………………………………………………………………………… 545
15.6Восстановительное лечение больных с нарушениями ритма…………........ 551
15.7Восстановительное лечение больных после аортокоронарного шунтиро-
вания ………………………………………………………………………………… 553
Глава XVI
МЕДИКО-ПСИХОЛОГИЧЕСКАЯ РЕАБИЛИТАЦИЯ БОЛЬНЫХ ИНФАРКТОМ МИОКАРДА
Сухова Е.В.
16.1Психологические аспекты инфаркта миокарда …………………………….. 596
16.2Программа медико-психологической реабилитации больных инфарктом миокарда ……………………………………………………………………………. 600
16.3Техника проведения метода активной мышечной релаксации ……………. 603
16.4Техника проведения метода пассивной мышечной релаксации …………... 605
16.5Техника проведения аутогенной тренировки ………………………………. 607
ЗАКЛЮЧЕНИЕ …………………………………………………………………….. 611
БИБЛИОГРАФИЧЕСКИЙ СПИСОК ……………………………………………. 638
СВЕДЕНИЯ ОБ АВТОРАХ …………………………………………………….... 665
8
CОNTECST
REDUCTIONS …………………………………………………………………..
THE FOREWORD ………………………………………………………………
Chapter I
ATHEROSCLEROSIS
Krjukov N.N., Nikolaevskiy E.N., Pavlova T.V., Pichko A.G.
1.1Etiology ………………………………………………………………………..
1.2Patogenesis ……………………………………………………………………..
1.3A clinical picture …………………………………………………………..........
1.4Laboratory - tool diagnostics ……………………………………………………
1.5Treatment and preventive maintenance ………………………………………….
Chapter II
ATHEROSCLEROSIS AT A DIABETES
Shustov S.B.
2.1.Definition, features рatogenesis at a diabetes ……………………………………….
2.2.Clinical displays …………………………………………………………………….
2.3.Diagnostics of a syndrome diabetic stops …………………………………………...
2.4.The differential diagnosis of forms diabetic stops …………………………………..
2.5.Preventive maintenance diabetic macroangiopatiy ………………………………….
2.6.Conservative treatment ……………………………………………………………...
2.7.Surgical treatment ……………………………………………………………...........
Chapter III
ISCHEMIC ILLNESS of HEART
Krjukov N.N., Nikolaevskiy E.N.
3.1Etiology ………………………………………………………………………………
3.2Classification…………………………………………………………………………
3.3Patogenesis……………………………………………………………………………
3.4A clinical picture …………………………………………………………………….
Chapter IV
SUDDEN INTIMATE DEATH
Nikolaevskiy E.N., Poliakov V.P.
4.1Patogenesis .. … … … … … … … … … … … … … … … … … … … … ………
4.2A clinical picture .. … … … … … … … … … … … … … … … … … … ….........
4.3Diagnostics … … … … … … … … … … … … … … … … … … … … ………...
4.4Treatment .. … … … … … … … … … … … … … … … … … … … … ………..
Chapter V
STABLE STENOCARDIA OF A PRESSURE
Krjukov N.N., Poliakov V.P., Nikolaevskiy E.N., Pavlova T.V., Pichko A.G.
5.1A clinical picture ……………………………………………………………………..
5.2Laboratory - tool diagnostics ………………………………………………………...
5.3Conservative treatment ………………………………………………………………
5.4Preventive maintenance of attacks of a stenocardia …………………………………
5.5Surgical treatment ……………………………………………………………………
Chapter VI
SPECIAL FORMS of ISCHEMIC ILLNESS of HEART
Nikolaevskiy E.N., Krjukov N.N.
9
6.1A spontaneous (alternative) stenocardia ……………………………………………..
6.2Sine dolore an ischemia ……………………………………………………………..
6.3Cardiac a syndrome X ………………………………………………………………..
Chapter VII
ASTABLE STENOCARDIA
Krjukov N.N., Poliakov V.P., Nikolaevskiy E.N., Pichko A.G.
7.1Etiology … … … … … … … … … … … … … … … … … … … … … ………...
7.2Patogenesis .. … … … … … … … … … … … … … … … … … … … … ………
7.3A clinical picture .. … … … … … … … … … … … … … … … … … … ….........
7.4Classification .. … … … … … … … … … … … … … … … … … … … …..........
7.5Laboratory - tool diagnostics … … … … … … … … … … ……………………….
7.6Conservative treatment … … … … … … … … … … … … … … … … … … …..
7.7Surgical treatment … … … … … … … … … … … … … … … … … … … …….
Chapter VIII
HEART ATTACK of the MYOCARDIUM
Krjukov N.N., Poliakov V.P., Nikolaevskiy E.N., Kachkovskiy M.A., Pichko A.G.
8.1Classification .. … … … … … … … … … … … … … … … … … … … ……….
8.2Etiology and patogenesis … … … … … … … … … … … … … … … … … ........
8.2A clinical picture .. … … … … … … … … … … … … … … … … … … ….........
8.3Laboratory - tool diagnostics … … … … … … … … … … ……………………….
8.5Treatment .. … … … … … … … … … … … … … … … … … … … … ………..
8.6Heart attack of a myocardium right ventricle ………………………………………..
8.7Complications of a heart attack myocardium ………………………………………..
Chapter IX
SHARP CORONARY SYNDROME
Svistove A.S., Ryzhman N.N., Poliakov V.P.
9.1.Definition … … … … … … … … … … … … … … … … … … … … … … …..
9.2.Patogenesis ... … … … … … … … … … … … … … … … … … … … … … ….
9.3.Diagnostics of a sharp coronary syndrome.. … … … … … … … … … … … ……
9.4.Visualiseichen techniques in diagnostics of SCS … ………………………………..
9.5.Stratification of risk of development of sudden death and heart attack of a myocardium at patients from SCS ... … … … … … … … … … … … … …………………….
9.6.Principles of treatment of a sharp coronary syndrome … … … … … … … … …...
9.7.Algorithms of diagnostics and treatment of Construction Department in the specialized cardiological hospital.. … … … … … … … … … … … … … … … … … … ….
Chapter X
INTIMATE INSUFFICIENCY
Krjukov N.N., Nikolaevskiy E.N.
10.1Definition …………………………………………………………………………...
10.2Etiology ………………………………………………………………………….....
10.3Patogenesis ………………………………………………………………………….
10.4A clinical picture .…………………………………………………………………..
10.5Chronic sistolic intimate insufficiency …………………………………………….
10.6Classification of chronic intimate insufficiency ……………………………………
10.7Laboratory - tool diagnostics ……………………………………………………….
10.8Treatment …………………………………………………………………………...
10.9Chronic diastolic intimate insufficiency ……………………………………………
Chapter XI
DIAGNOSTICS AND TREATMENT
10
CONVERTIBLE ISCHEMIC DYSFUNCTION
Svistove A.S., Nikiforov V.S., Suhov V.J.
11.1Definition …………………………………………………………………………...
11.2Patogenesis ………………………………………………………………………….
11.3Methods of diagnostics of convertible ischemic dysfunction of a myocardium …...
11.4A postrone-issue tomography ………………………………………………………
11.5Methods of a rating perfusione a myocardium ……………………………………..
11.6Echocardiografic techniques ……………………………………………………….
11.7A magnitno-resonant tomography ………………………………………………….
11.8The basic approaches to treatment of convertible ischemic dysfunction of a myocardium …………………………………………………………………………..............
Chapter XII
INFRINGEMENTS of the RHYTHM AND CONDUCTIVITY
Krjukov N.N., Nikolaevskiy E.N.
12.1Etiology … … … … … … … … … … … … … … … … … … … … … ……...
12.2Patogenesis.. … … … … … … … … … … … … … … … … … … … … ……
12.3Classification of the rhythm and conductivity … … … … … … … … … ………
12.4A clinical picture .. … … … … … … … … … … … … … … … … … … ….......
12.5Tool diagnostics … … … … … … … … … … … … … … … … … …. ………
12.6Supraventricular extrasystoles infringements of a rhythm ………………………..
12.7Ventricular extrasystoles ………………………………………………………….
12.8Medicamentous treatment ………………………………………………………...
12.9Pacing ……………………………………………………………………………..
12.10Electric cardioversion ……………………………………………………………
12.11Surgical treatment ………………………………………………………………..
Chapter XIII
MODERN STATUS AND PROSPECTS
CARDIOSURGICAL ISCHEMIC ILLNESS OF HEART
Hubulava G.G., Pajvin A.A., Jurchenko D.L.
13.1.Evolution of surgical treatment of ischemic illness of heart ……………………….
13.2.Visualiseichen methods of diagnostics in definition of indications to surgical treatment of ischemic illness of heart ……………………………………………………
13.3.Surgical revasculariseichen a myocardium ………………………………………..
13.4.Сatheters methods revasculariseichen a myocardium ……………………………..
13.5.Surgical treatment aneurysms left ventricle and other complications of a heart attack of a myocardium ……………………………………………………………………
13.6.Reconstructive interventions on valve the device of heart at ischemic illness …….
13.7.Surgical treatment of intimate insufficiency ……………………………………….
13.8.A role of the cardiologist in postoperative conducting patients …………………...
13.9.Prospects саrdiosurgical treatments of ischemic illness of heart …………………..
Chapter XIV
EXAMINATION OF TIME INVALIDITY
PATIENTS WITH ISCHEMIC ILLNESS OF HEART
Dodonov A.G., Nikolaevskiy E.N.
14.1Examination of time invalidity ……………………………………………………..
14.2Medical-social examination ………………………………………………………...
14.3Rehabilitation of invalids …………………………………………………………...
14.4Examination of invalidity of the patients who have transferred a heart attack of a myocardium ………………………………………………………………………...........
14.5Examination of invalidity of patients by a stenocardia of a pressure …………........
11
14.6Examination of invalidity of patients by an astable stenocardia ……………………
14.7Examination of invalidity of patients by special forms of ischemic illness of heart .
14.8Examination of invalidity of patients with chronic intimate insufficiency …………
14.9Examination of invalidity with infringements of rhythm and conductivity ………..
Chapter XV
REGENERATIVE TREATMENT OF PATIENTS
ISCHEMIC ILLNESS OF HEART
Nikolaevskiy E.N., Udalcov B.B., Dodonov A.G.
15.1Regenerative treatment of patients by ischemic illness of heart ……………………
15.2Regenerative treatment of patients by a heart attack of a myocardium …………….
15.3Regenerative treatment of patients by a stable stenocardia ………………………...
15.4Regenerative treatment of patients with chronic intimate insufficiency ……………
15.5Regenerative treatment of patients with infringements of a rhythm ………………..
15.6Regenerative treatment of patients after operation aortocoronary shuntings ………
Chapter XVI
MEDICO-PSYCHOLOGICAL REHABILITATION
PATIENTS WITH THE HEART ATTACK OF THE MYOCARDIUM
Suhova E.V.
16.1Psychological aspects of a heart attack of a myocardium ………………………….
16.2The program of мedico-psychological rehabilitation of patients with a heart attack of a myocardium …………………………………………………………………………
16.3Technics of carrying out of a method of an active muscular relaxation ……………
16.4Technics of carrying out of a method of a passive muscular relaxation ……………
16.5Technics of carrying out autogenous trainings ……………………………………..
THE CONCLUSION ……………………………………………………………………
APPLICATIONS ………………………………………………………………………..
BIBLIOGRAPHIC LIST ………………………………………………………………..
DATA ON AUTHORS ………………………………………………………………….
12
|
СПИСОК СОКРАЩЕНИЙ |
АII |
- ангиотензин II |
АВ-узел |
- атриовентрикулярный узел |
АГ |
- артериальная гипертензия |
АД |
- артериальное давление |
АДГ |
- антидиуретический гормон |
АсАТ |
- аспарагиновая аминотранфераза |
АТФ |
- аденозинтрифосфорная кислота |
ВВФСУ |
- время восстановления функции СА-узла |
ВСА |
- внутренняя симпатомиметическая активность |
ВСР |
- вариабельность сердечного ритма |
ГКМП |
- гипертрофическая кардиомиопатия |
ДЗЛА |
- давление заклинивания легочной артерии |
ДН |
- дыхательная недостаточность |
ЖА |
- желудочковая аритмия |
ЖТ |
- желудочковая тахикардия |
ЖЭ |
- желудочковая экстрасистолия |
ИБС |
- ишемическая болезнь сердца |
ИМ |
- инфаркт миокарда |
КА |
- коронарные артерии |
КАГ |
- коронароангиография |
КДД |
- конечно-диастолическое давление |
КДО |
- конечный диастолический объем |
КЖ |
- качество жизни |
КСО |
- конечный диастолический объем |
КТ |
- компьютерная томография |
КФК |
- креатинфосфокиназа |
ЛА |
- легочная артерия |
ЛВП |
- липопротеиды высокой плотности |
ЛДГ |
- лактатдегидрогеназа |
ЛЖ |
- левый желудочек |
ЛКА |
- левая коронарная артерия |
ЛНП |
- липопротеиды низкой плотности |
ЛОНП |
- липопротеиды очень низкой плотности |
ЛП |
- левое предсердие |
ЛС |
- лекарственные средства |
МЖП |
- межжелудочковая перегородка |
ММ ЛЖ |
- масса миокарда левого желудочка |
МО |
- минутный объем |
МПК |
- максимальное потребление кислорода |
МТ |
- масса тела |
ОВ |
- огибающая ветвь |
ОДП |
- онкотическое давление плазмы |
ОПСС |
- общее периферическое сопротивление сосудов |
ОРП |
- относительный рефракторный период |
ОЦК |
- объем циркулирующей крови |
13
ОЦП |
- объем циркулирующей плазмы |
ПД |
- потенциал действия |
ПЖ |
- правый желудочек |
ПКА |
- правая коронарная артерия |
ПМЖВ |
- передняя межжелудочковая ветвь |
ПП |
- правое предсердие |
ПТ |
- пароксизмальная тахикардия |
РААС |
- ренин-ангиотензин-альдостероновая система |
РАС |
- ренин-ангиотензиновые системы |
СА |
- синусовая аритмия |
САС |
- симпатико-адреналовая система |
СА-узел |
- синоатриальный узел |
СБ |
- синусовая брадикардия |
СГ |
- сердечные гликозиды |
СИ |
- сердечный индекс |
СН |
- сердечная недостаточность |
СН |
- сердечная недостаточность |
СрД |
- среднее давление |
ССС |
- сердечно-сосудистая система |
СССУ |
- синдром слабости синусового узла |
СТ |
- синусовая тахикардия |
ТАП |
- тканевой активатор плазминогена |
ТГ |
- триглицериды |
ТЖ |
- трепетание желудочков |
ТМПД |
- трансмембранный потенциал действия |
ТП |
- трепетание предсердий |
ТЭЛА |
- тромбоэмболия легочной артерии |
УЗИ |
- ультразвуковое исследование |
УИ |
- ударный индекс |
УО |
- ударный объем |
ФВ |
- фракция выброса |
ФЖ |
- фибрилляция желудочков |
ФК |
- функциональный класс |
ФП |
- фибрилляция предсердий |
ХПН |
- хроническая почечная недостаточность |
ХС |
- холестерин |
ХСН |
- хроническая сердечная недостаточность |
ЦВД |
- центральное венозное давление |
ЧДД |
- число дыхательных движений |
ЧПЭС |
- чреспищеводная электрическая стимуляция сердца |
ЧЭСП |
- чреспищеводная электрическая стимуляция предсердий |
ЭИТ |
- электроимпульсная терапия |
ЭКГ |
- электрокардиограмма |
ЭКС |
- электрокардиостимулятор |
ЭПГ |
- электрограмма пучка Гиса |
ЭС |
- экстрасистолия |
ЭФИ |
- электрофизиологическое исследование |
ЭхоКГ |
- эхокардиография |
14
ПРЕДИСЛОВИЕ
Несмотря на современные достижения медицины, последнее десятилетие характеризуется неуклонным ростом сердечно-сосудистых заболеваний в популяции. Атеросклероз, ишемическая болезнь сердца, гипертоническая болезнь и их осложнения вышли на первое место среди причин заболеваемости, потери трудоспособности, инвалидности и смертности населения в экономически развитых странах. В России ежегодная смертность от сердечно-сосудистых причин превышает один миллион человек.
Инфаркт миокарда развивается 0,9у -1,4% мужчин в возрасте40-59 лет, у мужчин старшей возрастной группы- 2,1% в год. Отмечается неуклонный рост заболеваемости среди лиц молодого и среднего возраста. Несмотря на снижение госпитальной летальности, общая смертность от этого заболевания остается высокой, достигая 40-60%. Необходимо отметить, что большая часть летальных исходов наступает на догоспитальном этапе.
Многочисленные эпидемиологические исследования выявили значительную распространенность артериальной гипертонии среди взрослого населения. В странах Евросоюза число больных с повышенным артериальным давлением достигает2030%, в России - 30-40%. Артериальная гипертония является одним из главных факторов риска формирования ишемической болезни , сердцамозгового инсульта, сердечной недостаточности. Среди лиц, страдающих артериальной гипертонией, развитие острого нарушения мозгового кровообращения, ишемической болезни сердца, инфаркта миокарда встречается соответственно в 10, 5 и 3 раза чаще, чем у людей с нормальным артериальным давлением. Указанные обстоятельства определяют большое значение внедрения новых достижений кардиологии в практическое здравоохранение.
Основная цель реализуемого в наши дни приоритетного национального проекта
всфере здравоохранения - улучшение качества и доступности медицинской помощи населению. При этом акцент сделан на укрепление первичного звена отрасли. Цель настоящего руководства - предоставить врачам амбулаторно-поликлинического звена (врачам общей практики, кардиологам, терапевтам) доступную информацию о современных принципах диагностики, лечения, профилактики, медицинской реабилитации, экспертизы временной нетрудоспособности наиболее распространенных заболеваний системы кровообращения.
Есть все основания надеяться, что данное руководство поможет врачам в их повседневной практической работе повысить эффективность диагностики и лечения ишемической болезни сердца и её осложнений, а также внесет свой посильный вклад
вдостижение главной целивосстановление и улучшение здоровья населения России.
15
FOREWORD
Despite of achievements of medical science, last decade it is characterized by steady growth of socially significant cardiovascular diseases at the population of the Russian Federation. The atherosclerosis, ischemic illness of heart, hypertonic illness and have come out on top of their complication among the reasons of disease, disability, physical inability and death rate of the population in economically advanced countries. In Russia annual death rate from the cardiovascular reasons exceeds one million people.
The heart attack of a myocardium develops at 0,9-1,4% of men in the age of 40-59 years, at men of the senior age group - 2,1% one year. Steady growth of disease among persons young and middle-aged is marked. Despite of decrease hospital летальности, general death rate from this disease remains high, reaching 40-60%. It is necessary to note, that the most part of lethal outcomes attacks a pre-hospital stage.
Numerous epidemiological researches have revealed significant prevalence of an arterial hypertension among adult population. In the countries of the European Community the number of patients with the raised arterial pressure reaches 20-30%, in Russia - 30-40%. The arterial hypertension is one of primary factors of risk of formation of ischemic illness of heart, a brain insult, intimate insufficiency.
Among the persons, suffering an arterial hypertension, development of sharp infringement of brain blood circulation, ischemic illness of heart, a heart attack of a myocardium meets accordingly in 10, 5 and 3 times is smore often. The specified circumstances define the large value of introduction of new achievements of cardiology in practical public health services.
The basic purpose of the priority national project sold today in sphere of public health services - improvement of quality and availability of medical aid to the population. Thus the accent is made on strengthening of a primary link of branch. The purpose of the present monography - to give to doctors of an out-patient - polyclinic link (to doctors of the general practice, cardiologists, therapists) the important information on modern principles of diagnostics, treatment and preventive maintenance of the most widespread pathology of system of blood circulation.
There are all bases to hope, that the given management will help doctors with their daily practical job to raise efficiency of diagnostics and treatment of ischemic disease of heart and its complications, and also will bring in the feasible contribution to achievement of an overall objective - restoration and improvement of health of the population of Russia.
16
Глава I АТЕРОСКЛЕРОЗ
Атеросклероз - хроническое заболевание, характеризующееся возникновением в стенках артерий очагов липидной инфильтрации, разрастанием соединительной ткани с образованием фиброзных бляшек, суживающих просвет сосуда и нарушающих физиологические функции поражённых артерий, что приводит к нарушению адекватного кровообращения. Атеросклероз и связанные с ним ИБС, инфаркт миокарда, нестабильная стенокардия вышли на первое место среди причин заболеваемости, потери трудоспособности, инвалидности и смертности населения в экономически развитых странах. Атеросклероз обусловливает половину всех смертных случаев, около 30% летальных исходов у людей в возрасте 35-65 лет.
1.1. ЭТИОЛОГИЯ
На развитие и прогрессирование атеросклероза оказывают влияние многие внешние и внутренние факторы, называемые факторами риска (ФР). В настоящее время известно более30 факторов, действие которых увеличивает риск возникновения атеросклероза, его осложнений. Все ФР подразделяются на немодифицируемые (возраст старше 50-60 лет; мужской пол, отягощённая наследственность) и модифицируемые (дислипидемия, повышенное содержание в крови холестерина, триглицеридов, атерогенных липопротеинов, снижение концентрации антиатерогенных ЛВП, артериальная гипертензия (АГ), курение, ожирение, гипергликемия, сахарный диабет, гиподинамия, нерациональное питание). Концепция ФР атеросклероза имеет важное значение для понимания патогенеза и проведения профилактики заболевания. ФР способствуют возникновению и прогрессированию атеросклероза и ассоциируются с более высоким риском развития болезни. Уменьшение выраженности или ликвидация модифицируемых ФР сопровождается снижением заболеваемости и частоты осложнений. В настоящее время доказано, что в состав наиболее значимых ФР атеросклероза входят: дислипидемия, АГ, курение, ожирение, сахарный диабет.
Повышенное содержание в крови холестерина, триглицеридов, атерогенных липопротеинов (гиперлипидемии, ГЛП) являются главным фактором риска атеросклероза, ИМ, хронических форм ИБС, мозгового инсульта, облитерирующего атеросклероза артерий нижних конечностей. Концентрация в плазме крови общего холестерина (ХС) и его атерогенных фракций тесно коррелирует с заболеваемостью и смертностью от ИБС. Самый низкий уровень смертности от ИБС наблюдается при концентрации общего ХС менее5,2 ммоль/л. При повышении его концентрации до 5,3-6,5 ммоль/л регистрируется рост смертности среди больных ИБС, которая резко увеличивается при достижении уровня общего ХС свыше 7,8 ммоль/л.
17
Содержание общего ХС ниже5,2 ммоль/л считается оптимальным. Количество общего ХС5,3-6,5 ммоль/л принято считать пограничным, 6,6-7,7 ммоль/л - повышенным, более 7,8 ммоль/л - высоким. В Европе высокий уровень общего ХС встречается у25% взрослого населения. Для ЛНП оптимальный уровень составляет менее3,4 ммоль/л, пограничный - 3,4-4 ммоль/л). За оптимальную концентрацию триглицеридов принимают его значения менее1,7 ммоль/л.
Поэтому знание и изучение нарушений липидного обмена является обяза-
тельным |
условием |
эффективной |
профилактики |
заболеваний |
-сердечно |
сосудистой |
системы, определяющих прогноз жизни, трудоспособность, физи- |
||||
ческую активность людей пожилого возраста. В плазме крови есть три основных класса липидов: 1) холестерин (ХС) и его эфиры, 2) триглицериды (ТГ), 3) фосфолипиды (ФЛ). Наибольшее значение в атерогенезе имеют ХС и ТГ. Основной транспортной формой липидов являются липопротеины(ЛП), в которых ХС, ТГ, ФЛ связаны с белками-апопротеинами.
ЛП состоят из центральной части, содержащей нерастворимые в воде липиды, а также из оболочки, состоящей из апопротеинов, растворимых в воде неэстерифицированных ХС, ФЛ. Молекулы апопротеинов имеют неполярный гидрофобный участок, связанный с липидами, полярный гидрофильный участок, расположенный на поверхности ЛП и обращенный к окружающей липопротеин плазме крови. Гидрофильный участок апопротеина образует водорастворимые связи с молекулами воды. Такая структура ЛП определяет их свойство быть частично водо- и жирорастворимыми.
В зависимости от плотности и размеров частиц ЛП различают несколько классов:
1.Хиломикроны (ХМ) почти полностью (на 80-95%) состоят из ТГ. Они являются основной транспортной формой пищевых ТГ, перенося их из тонкого кишечника в скелетную мускулатуру, миокард, жировую ткань. В плазме крови ХМ расщепляются липопротеинлипазами до глицерина, свободных неэстерифицированных жирных кислот (НЭЖК). Остатки ХМ захватываются гепатоцитами и быстро удаляются из крови.
2.Липопротеины очень низкой плотности(ЛОНП) - это крупные ЛП, содержащие около 55% ТГ, 19% ХС, 8% белка (апопротеинов В-100, Е, С-I, С-II). Этот класс ЛП является главной транспортной формой эндогенных ТГ, синтезируемых в печени. В крови ЛОНП подвергаются воздействию липопротеинлипазы, происходит расщепление ТГ на глицерин, НЭЖК, которые используются миокардом, скелетной мускулатурой в качестве энергетического субстрата. Остатки ЛОНП превращаются в ЛП промежуточной плотности(ЛПП), которые удаляются печенью из крови. Небольшая часть трансформируются в ЛП низкой плотности (ЛНП) и удаляются из крови.
18
3.Липопротеины низкой плотности(ЛНП) являются основной транспортной формой ХС. Содержат около 6% ТГ, 50% ХС, 22% белка. Примерно 2/3 быстрообменивающегося пула ХС синтезируется в печени, 1/3 поступает с пищей. Ключевым ферментом, определяющим скорость синтеза эндогенного ХС, является гидроксил метил-глутарил-КоА-редуктаза(ГМГ-КоА-редуктаза). Дальнейший метаболизм ЛНП осуществляется следующим образом: происходит захват ЛНП специфическими рецепторами гепатоцитов, затем частицы поглощаются гепатоцитами, подвергаются гидролизу с образованием свободного ХС, белка, жирных кислот, утилизируемых клетками.
Количество внутриклеточного свободного ХС является важнейшим фактором, регулирующим скорость синтеза специфических ЛНП-рецепторов гепатоцитов, с помощью которых осуществляется захват частиц ЛНП. При снижении количества внутриклеточного ХС возрастает активность ГМГ-КоА-редуктазы, скорость синтеза эндогенного ХС. Одновременно увеличивается синтез ЛНПрецепторов гепатоцита и активизируется захват, поглощение ЛНП из кровотока, внутриклеточный катаболизм. В результате содержание ХС в клетке восстанавливается. Наоборот, при высокой внутриклеточной концентрации свободного ХС замедляется синтез эндогенного ХС, ЛНП-рецепторов и уровень внутриклеточного ХС постепенно нормализуется. Описанный принцип обратной связи между внутриклеточной концентрацией ХС и скоростью метаболических процессов используется для лечения некоторых нарушений липидного обмена.
Второй путь катаболизма ЛНП - свободнорадикальное перекисное окисление ЛНП. Свободные радикалы, образующиеся в процессе обмена веществ, являются высокоактивными и нестабильными молекулами, которые легко окисляют ЛНП. Образуются модифицированные (окисленные) ЛНП, которые плохо распознаются В- и Е-рецепторами гепатоцитов и поэтому не участвуют в нормальном физиологическом пути катаболизма. Окисленные ЛП захватываются макрофагами, которые трансформируются в пенистые клетки, входящие в состав атеросклеротических бляшек.
Модифицированные ЛНП вызывают повреждение сосудистого эндотелия, запуская целый каскад патологических реакций со стороны сосудистой стенки. В норме процессы перекисного окисления липидов слабо выражены. Они существенно усиливаются при различных заболеваниях сердечно-сосудистой системы, являясь одним из важных этиологических факторов, способствующих возникновению и прогрессированию заболевания. ЛНП относятся к наиболее атерогенной фракции ЛП. Увеличение общего содержания ЛНП, особенно модифицированных окисленных ЛП, ассоциируется с высоким риском возникновения атеросклероза и его осложнений.
4. Липопротеин (a), или ЛП (a), близок по своим физико-химическим свойствам к ЛНП, отличаясь от них наличием в оболочке апопротеина. Последний близок по своим свойствам к плазминогену и поэтому может конкурировать
19
с плазминогеном за места связывания на фибрине, ингибировать фибринолитическую активность крови. ЛП (a) относятся к числу атерогенных ЛП: их повышенный уровень в крови почти всегда ассоциируется с развитием атеросклероза и ИБС, а также с высоким риском тромботических осложнений.
5. Липопротеины высокой плотности (ЛВП) - самые мелкие и плотные частицы ЛП. Они содержат всего5% ТГ, 22% ХС и самое большое количество белка (40%) - апопротеинов А-I, А-II и С и относятся к ЛП, обладающим антиатерогенными свойствами. Последние определяются участием ЛВП в катаболизме всех остальных ЛП, поскольку с помощью ЛВП осуществляется обратный транспорт ХС из периферических органов, в том числе из артериальной стенки, с поверхности хиломикронов и ЛОНП, макрофагов и гладкомышечных клеток, в печень, где происходят его утилизация и превращение в желчь. Синтез “зрелых” частиц ЛВП как раз и осуществляется благодаря присоединению свободного ХС от других ЛП и периферических тканей к начальным формам ЛВП, имеющим форму дисков. Синтез полноценных сферических ЛВП происходит при обязательном участии ХМ, ЛОНП, ЛНП. ЛВП в процессе метаболизма ХМ, ЛОНП, ЛНП присоединяют к себе их апопротеины А и, Соказывающие влияние на активность многочисленных ферментных систем, участвующих в метаболизме липидов. Снижение содержания ЛВП, наряду с увеличением ЛНП, сопровождается значительным увеличением риска формирования атеросклероза. Факторами, способствующими снижению ЛПВП, являются: принадлежность к мужскому полу, ожирение, гипертриглицеридемия, высокое потребление углеводов, сахарный диабет, курение. Большое количество антиатерогенных ЛПВП связывают с принадлежностью к женскому полу, высоким уровнем эстрогенов, высокой физической активностью, снижением массы тела, умеренным потреблением алкоголя. Важность повышения АД(более 20%) в качестве ФР доказана в ряде эпидемиологических исследований экономически развитых стран. Выявлена тесная связь между уровнем диастолического АД и частотой развития ИБС и инсульта. Артериальная гипертензия оказывает существенное влияние на прогрессирование атеросклероза. Риск возникновения клинических проявлений атеросклероза у больных АГ примерно в3-4 раза выше, чем у пациентов без повышения АД. Повышенное АД оказывает повреждающее действие на эндотелий артериальных сосудов, нарушается функция эндотелия, интима сосудов пропитывается липидами.
Степень риска, связанного с курением сигарет, сопоставима с риском гиперлипидемии, АГ. Вероятность развития сердечно-сосудистых заболеваний у курящих примерно в 2-3 раза выше, чем у некурящих. Значение курения как ФР выросло в связи с распространением этой вредной привычки у40-50% населения. Курение ассоциируется с дисфункцией эндотелия, являющейся пусковым фактором атеросклероза. При курении увеличивается количество фибриногена, повышается адгезия тромбоцитов. Это приводит к снижению ЛВП, повышению тонуса сосудов. Прекращение курения приводит к снижению обострений ИБС на 50% в течение 1 года.
20
Ожирение относится к числу наиболее значимых, легко модифицируемых ФР. Является не только независимым ФР болезней сердечно-сосудистой системы (ССС), но и пусковым механизмом других факторов риска атеросклероза (АГ, гиперлипидемии, инсулинорезистентности, сахарного диабета). Выявлена прямая зависимость между уровнем смертности от болезней ССС и массой тела (МТ). Анализ результатов Фремингемского исследования показал, что на протяжении 26 лет частота заболеваний ССС в целом, ИБС, ИМ, внезапной сер-
дечной смерти возрастала в зависимости от величины избыточной МТ как у мужчин, так и у женщин. Даже у женщин, индекс массы тела (ИМТ) которых не выходил за пределы нормальных значений(меньше 25 кг/м2) и составил 23– 25 кг/м2, риск возникновения ИБС на 50% выше, чем у пациенток с ИМТ ниже 21 кг/м2. При увеличении ИМТ 25до-29 кг/м2 относительный риск ИБС возрастал в2 раза, а при ИМТ выше 29 кг/м2 - в 3 раза. В США больные с ИМТ более 30 кг/м2 ежегодно проводят в стационаре на 3 дня дольше, чем пациенты с ИМТ менее 23 кг/м2, что соответствует 70 миллионам “лишних” кой- ко-дней в год.
Повышенный риск сердечно-сосудистых заболеваний характерен не только для ожирения как такового, но и для самого процесса прибавки массы тела. Этот факт был убедительно продемонстрирован во Фремингемском исследовании, показавшем высокую степень корреляции величины прибавки массы тела после 25 лет с риском сердечно-сосудистых заболеваний. Похудание уменьшало степень риска. Во всех современных эпидемиологических исследованиях, посвященных изучению ФР ИБС и атеросклероза, подчеркивается тесная связь, существующая между ожирением и такими ФР как АГ, ГЛП и сахарный диабет. Именно эта взаимосвязь, наряду с независимым влиянием ожирения как такового, играет главную роль в увеличении степени риска сердечно-сосудистых заболеваний у лиц, страдающих избыточной массой тела.
Ожирению сопутствует ряд ГЛП, предрасполагающих к развитию ИБС, включая гиперхолестеринемию, гипертриглицеридемию, снижение уровня ХС ЛВП, повышение уровня апопротеина В и мелких плотных частиц ЛНП. Ожирение существенно повышает риск возникновения сахарного диабетаI и II типа. У женщин, прибавивших в весе после 18 лет всего 5–7,9 кг, риск возникновения сахарного диабета вдвое больше, чем у женщин со стабильной массой тела. У женщин с прибавкой массы тела8 кг и более риск увеличивается в3 раза. У пациентов среднего возраста, похудевших по разным причинам более чем на 5 кг, риск возникновения сахарного диабета уменьшается на 50%.
Ожирение закономерно сопровождается увеличением активности адипоцитов брюшной полости, которые секретируют свободные жирные кислоты непосредственно в систему воротной вены, что подавляет поглощение инсулина печенью. В результате повышается концентрация инсулина в периферическом кровотоке и снижается чувствительность тканей к инсулину, развивается инсу-
21
линорезистентность. Высокие концентрации свободных жирных кислот повышают содержание ТГ в крови.
В последние годы много внимания уделяется изучению клинической картины и патогенеза так называемого“метаболического синдрома” (“синдрома Х”), который очень часто сочетается с ожирением. В основе этого синдрома лежат инсулинорезистентность, гипертриглицеридемия и . АГУ лиц с метаболическим синдромом существенно повышен риск возникновения ИМ, внезапной смерти и сахарного диабета. В связи с этим N.M. Kaplan предложил называть сочетание таких ФР как ожирение, инсулинорезистентность, ГЛП и АГ “смертельным квартетом”. Инсулинорезистентность и гиперинсулинемия рассматриваются в настоящее время в качестве пусковых факторов, инициирующих целый ряд механизмов, приводящих в конечном счете к развитию на фоне ожирения ГЛП, АГ и ИБС. Ожирение сопровождается активацией РАС и САС, уменьшением секреторного ответа натрийуретического пептида, что оказывает влияние на патогенез атеросклероза, ИБС и АГ.
Сахарный диабет I и II типа сочетается со значительным увеличением заболеваемости атеросклерозом и тяжестью течения многих его клинических проявлений, при этом риск развития сердечно-сосудистых заболеваний увеличивается в 2–4 раза у мужчин и в 3–7 раз у женщин. При сахарном диабете I ти-
па дефицит инсулина приводит к снижению активности липопротеидлипаз и увеличению синтеза триглицеридов. Сахарный диабет II типа часто сочетается
с гиперлипидемией IV типа |
и увеличением синтеза ЛОНП |
и ЛНП. Особенно |
|
||||||||
неблагоприятным |
является |
сочетание |
нарушений |
углеводного |
обмен |
||||||
с |
некоторыми |
другими |
: |
ФРгипертриглицеридемией, |
АГ, |
курением |
|
||||
и ожирением. По сути сахарный диабет II типа в большинстве случаев развива- |
|
||||||||||
ется в результате имеющейся у больного инсулинорезистентности, которая при |
|
||||||||||
сочетании с ожирением, АГ и гипертриглицеридемией ведет к возникновению |
|
||||||||||
метаболического синдрома. |
|
|
|
|
|
|
|
||||
|
Для |
сахарного |
диабета |
характерен |
процесс |
гликозилирования |
Л |
||||
с |
образованием |
модифицированных |
форм |
ЛНП, ЛВП. Гликозилированные |
|
||||||
ЛНП отличаются меньшим сродством к специфическим В- и Е-рецепторам ге- |
|
||||||||||
патоцитов, что способствует уменьшению скорости элиминации ЛП. Гликози- |
|
||||||||||
лированные ЛНП вызывают повреждение эндотелия, активируют проникнове- |
|
||||||||||
ние моноцитов в интиму артерий, трансформацию макрофагов |
в пенистые |
|
|||||||||
клетки, пролиферацию гладкомышечных клеток, способствуя развитию атеро- |
|
||||||||||
склероза. |
|
|
|
|
|
|
|
|
|
|
|
|
Имеется линейная |
зависимость |
между |
заболеваемостью |
атеросклерозом |
||||||
и возрастом. Чем больше возраст, тем сильнее выражен атеросклероз и чаще встречаются тяжелые клинические проявления атеросклероза(ИБС, инфаркт миокарда, ишемический инсульт). В последние годы в экономически развитых странах отмечается значительный рост заболеваемости среди сравнительно мо-
22
лодых лиц (моложе 50 лет). До 55 лет заболеваемость ИБС, церебральным и периферическим атеросклерозом среди мужчин в3–4 раза выше, чем среди женщин. В более старшей возрастной группе(старше 65–70 лет) заболеваемость не зависит от пола. Это связывают с содержанием у женщин эстрогенов, которые вызывают вазопротективный эффект, оказывая влияние на липидный
обмен. До наступления менопаузы у женщин наблюдается более высокое -со держание ХС ЛВП и более низкая концентрация ХС ЛНП, при этом риск развития ИБС, инфаркта миокарда и мозгового инсульта примерно в8–10 раз меньше, чем у мужчин того же возраста. В менопаузе защитное действие эстрогенов уменьшается и риск возникновения осложнений атеросклероза увеличивается. В целом мужчины заболевают атеросклерозом на 10 лет раньше, чем женщины.
Риск развития атеросклероза существенно повышается у лиц, близкие родственники которых страдали ИБС, церебральным и периферическим атеросклерозом. Причем такая наследственная предрасположенность проявляется преимущественно у пациентов сравнительно молодого и среднего возраста(до 55 лет). В более старших возрастных группах генетические факторы оказываются, по-видимому, менее значимыми, уступая место многочисленным приобретенным ФР (АГ, сахарный диабет, курение, ожирение). Наследственная предрасположенность к сравнительно раннему возникновению атеросклероза связана с генетически детерминированным повреждением различных звеньев метаболизма липидов, структуры и функции эндотелия, активности ферментных систем гладкомышечных клеток, особенностями функционирования сосудистотромбоцитарного и коагуляционного гемостаза. Первичная семейная комбинированная гиперлипидемия с умеренным повышением ЛНП, ЛОНП и ТГ наблюдается у больных, перенесших ИМ в возрасте младше55 лет. Генетически детерминированное низкое содержание в плазме крови антиатерогенных ЛВП встречается примерно у 25% больных с ранним развитием ИБС. Учитывая многочисленность этиологических факторов, оказывающих влияние на различные звенья патогенеза атеросклероза, есть основания считать, что наследственная предрасположенность к различным нарушениям обмена, лежащим в основе развития атеросклероза, встречается еще чаще.
Малоподвижный образ жизни является важнейшим фактором формирования целого ряда заболеваний сердечно-сосудистой системы: АГ, ИБС, атеросклероза. У лиц с низкой физической активностью наблюдаются неадекватные реакции сердечно-сосудистой, дыхательной, нервной и других систем на любые внешние воздействия, в том числе психоэмоциональный стресс: возникает чрезмерная активация САС, РАС, усиливается выброс в кровяное русло катехоламинов и других биологически активных веществ, так или иначе оказывающих повреждающее действие на сосудистую систему, миокард и проводящую систему сердца. Недостаточная физическая активность закономерно сопровождается развитием ожирения, нарушениями липидного обмена, склонностью пациентов к спастическим реакциям, повышению АД, снижению скорости метаболических процессов, что также способствует развитию атеросклероза.
23
В исследовании MRFIT (2001) показано, что у пациентов со сниженной физической активностью смертность от ИБС на 27% выше, чем у лиц, которые регулярно подвергались физическим нагрузкам.
Высококалорийное питание с большим содержанием в пищевом рационе животных жиров является важнейшим ФР атеросклероза. Такой характер питания способствует развитию ожирения, нарушениям углеводного и липидного обменов, которые лежат в основе формирования атеросклероза. При хроническом употреблении в пищу продуктов с высоким содержанием насыщенных жирных кислот и ХС(преимущественно животный жир) в гепатоцитах накапливается избыточное количество ХС и по принципу отрицательной обратной связи в клетке снижается синтез специфических ЛНП-рецепторов, уменьшается захват и поглощение гепатоцитами атерогенных , ЛНПциркулирующих в крови. Сравнительно “новым” и окончательно не доказанным ФР атеросклероза является гипергомоцистеинемия. Тем не менее в ряде исследований (Framingham Heart Study; European Concerted Action Project; Hordaland Homocysteine
Study; COMAC) показана высокая корреляция между уровнем гомоцистеина в крови и риском развития атеросклероза, ИБС и ишемической болезни мозга (ИБМ).
Гомоцистеин представляет собой деметилированное производное незаменимой аминокислоты метионина, поступающего в организм с пищей. Циркулирующий в крови гомоцистеин подвергается внутриклеточному метаболизму с образованием цистатионина, который в дальнейшем превращается в цистеин. Нормальный метаболизм гомоцистеина возможен только с участием фермен-
тов, кофакторами которых являются витамины В, В и фолиевая кислота. Де-
6 12
фицит этих витаминов приводит к повышению содержания в крови гомоцистеина. Механизм атерогенного действия гомоцистеина пока не выяснен. Предполагают, что в присутствии гомоцистеина протеогликаны клеток сосудистой стенки теряют способность к поперечной сшивке и формированию нормальной здоровой ткани. Поврежденные гомоцистеином, они образуют в стенке артерий не волокнистую, а гранулированную структуру и, склеиваясь друг с другом, образуют своеобразные крупные “комки” на поверхности которых откладываются атерогенные ЛП. Повышенное содержание гомоцистеина активирует перекисное окисление липидов и образование модифицированных ЛНП, повреждающих эндотелий сосудистой стенки, ингибирующих продукцию эндотелиального вазодилатирующего фактора (NO) и способствующих пролиферации гладкомышечных клеток и образованию пенистых клеток.
Пределы нормальных значений гомоцистеина в сыворотке крови находятся в достаточно широком диапазоне, потому что зависят от пола, возраста, этниче-
ской принадлежности. Уровень гомоцистеина увеличивается на протяжении жизни: в детстве его уровень составляет примерно5 мкмоль/л, затем его концентрация постепенно повышается, причем у женщин репродуктивного возраста уровень гомоцистеина на 20% меньше, чем у мужчин. Оптимальный уровень
24
гомоцистеина для практически здоровых лиц составляет8,5-11,0 мкмоль/л. По степени повышения уровня гомоцистеина выделяют три степени гипергомоцистеинемии: умеренная степень – 11,1-15,0 мкмоль/л; средняя степень – 15,1- 20,0 мкмоль/л; высокая степень – более 20,0 мкмоль/л. ГГЦ может развиваться вследствие воздействия и взаимодействия целого ряда факторов (рисунок 1).
Генетические дефекты: МТГФР, Ц-β-С
Возраст и пол (гормональный статус, беременность)
Нарушение функции почек
Злокачественные
новообразования
Хронические
воспалительные
заболевания
Заболевания желудочно-кишечного тракта
Заболевания щитовидной железы
ДИАБЕТ
ГГЦ
Образ жизни: курение, алкоголизм, чрезмерное употребление кофе, низкая физическая активность неполноценное питание
Фармацевтические
препараты
Дефицит
фолиевой кислоты,
В12, В6
Рисунок 1. Факторы, влияющие на обмен гомоцистеина и развитие гипергомоцистеинемии (Шевченко О.П., 2004).
Результаты исследований последних лет позволили установить, что наличие гипергомоцистеинемии повышает риск раннего развития атеросклероза, венозных и артериальных тромбозов независимо от традиционных факторов риска. Риск развития тромбозов имеет дозозависимый характер и отмечается при значениях гомоцистеина выше10 мкмоль/л. Гипергомоцистеинемия относится к прогностическим маркерам летального исхода при ССЗ. Повышение концентрации гомоцистеина у беременных свидетельствует об угрозе спонтанного выкидыша и гипотрофии плода.
25
Исследование, проведенное нами на базе Самарского областного клинического кардиологического диспансера (СОККД, 2006) и включавшее 87 пациентов, выявило повышение исходного уровня гомоцитсеина более11 мкмоль/л у 73,4% пациентов, страдающих хроническими формами ИБС. Среднее значение гомоцистеина в изучаемой группе составило13,0±2,1 мкмоль/л, и достоверно отличалось от уровня гомоцистеина в контрольной группе(8,7±0,7 мкмоль/л; р = 0,0043).
Умеренная гипергомоцистеинемия приблизительно в40% случаев обусловлена генетическими дефектами. Основное клиническое значение имеют полиморфизмы ферментов, участвующих в метаболизме гомоцистеина – циста- тионин-β-синтазы (Ц-β-С) и метилентетрагидрофолат редуктазы (МТГФР). Дефект гена Ц-β-С приводит к тяжелой форме гипергомоцистеинемии, но встречается довольно редко. Полиморфизм гена МТГФР сопровождается развитием умеренной гипергомоцистеинемии и встречается, по разным данным, у 10-25% лиц здоровой популяции. В настоящее время описано около двадцати полиморфизмов в гене МТГФР, но наиболее часто встречаемой и хорошо изученной является мутация С667Т. В результате проведенных исследований изучена активность фермента, которая снижается до 30% от нормального уровня при гомозиготном носительстве, и до 65% – при гетерозиготном.
Исследования последних лет показали, что при гомозиготной мутации С677Т гена МТГФР наблюдается стойкая умеренная гипергомоцистеинемия, обуславливающая высокий риск развития ССЗ, склонность к тромбообразованию, а также нарушения функции нервной системы и развитие психических отклонений. Однако измерение плазменного уровня гомоцистеина при гомозиготном состоянии 677ТТ гена МТГФР является обязательным, поскольку именно гипергомоцистеинемия, а не сам полиморфизм рассматривается как независимый фактор риска тромбоза.
Другой причиной развития гипергомоцистеинемии является нарушение функции почек, которые играют важную роль и в метаболизме и выведении гомоцистеина. У пациентов, находящихся на гемодиализе, отмечается сопутствующая гипергомоцистеинемия, сопровождающаяся высоким риском развития атеросклероза, а вероятность инфаркта миокарда и других проявлений острого коронарного синдрома у таких пациентов в5-10 раз выше, чем в общей популяции.
Гипергомоцистеинемия отмечается при заболеваниях, сопровождающихся нарушением всасывания или повышенным потреблением фолиевой кислоты и витаминов В6 и В12 (воспалительные заболевания кишечника, злокачественные опухоли). Развитию гипергомоцистеинемии способствует ряд фармацевтических препаратов (метотрексат, метилпреднизолон, эстрогенсодержащие контрацептивы, противосудорожные препараты, фибраты, холестирамин, колистепол, метформин).
26
Существенное влияние на уровень гомоцистеина в крови оказывают чрезмерное потребление кофе, психоэмоциональные нагрузки, малоподвижный образ жизни, неправильное питание. Курение – один из наиболее сильных факторов, влияющих на уровень гомоцистеина. Каждая выкуренная за день сигарета увеличивает уровень гомоцистеина на1% у женщин и на0,5% у мужчин. У женщин, выкуривающих 20 и более сигарет в день, уровень гомоцистеина выше, чем у некурящих, на 18%. Умеренное употребление алкоголя способствует некоторому снижению уровня гомоцистеина, но у лиц, страдающих хроническим алкоголизмом, содержание гомоцистеина в плазме крови повышено почти вдвое. Нерациональное питание и недоедание за счет снижения содержания в рационе овощей и свежих фруктов приводят к дефициту витаминов и к повышению уровня гомоцистеина. При строгой вегетарианской диете может раз-
виться алиментарный дефицит витамина В , потому что его источником явля-
12
ется исключительно животная пища.
В последние годы в литературе широко обсуждается вопрос о роли воспаления в формировании неосложненной и осложненной атеросклеротической бляшки. К настоящему времени получено много доказательств наличия такого воспаления в очаге атеросклеротического поражения: присутствие в нем большого количества макрофагов, активированных Т-лимфоцитов, тучных клеток, тромбоцитов. Продукция этими клетками различных цитокинов (в первую очередь, фактора некроза опухолей α, интерлейкинов), действительно, может способствовать повреждению сосудистого эндотелия и“пропитыванию” интимы модифицированными атерогенными ЛП. Известные маркеры воспаления, в том числе повышенный уровень СR-протеина, скорее указывают не на наличие атеросклеротического поражения сосудистой стенки, а на нестабильность атеросклеротической бляшки, которая лежит в основе формирования так называемо-
го острого коронарного синдроманестабильной стенокардии и острого |
ИМ. |
В последние годы определенное значение в генезе атеросклеротических |
пора- |
жений придается цитомегаловирусной и хламидийной инфекции, широко распространенной среди взрослого населения. Антигены этих возбудителей нередко обнаруживают в атеросклеротических бляшках, а высокие титры антител определяются у значительной части больных ИБС. Имеются данные о том, что
хламидийная |
инфекция |
ассоциируется |
с |
большим |
риском |
смертельных |
и несмертельных обострений |
ИБС. Предполагают, |
что присутствие хламидий |
||||
в сосудистой стенке способствует окислению(модификации) ЛНП, что сопровождается повреждением эндотелия и образованием пенистых клеток, участвующих в формировании атеросклеротической бляшки. Тем не менее вопрос о
правомочности отнесения |
цитомегаловирусной и |
хламидийной |
инфекции |
к числу ФР атеросклероза |
и ИБС требует дальнейших |
исследований |
и более |
убедительных доказательств. |
|
|
|
1.2. ПАТОГЕНЕЗ |
|
|
|
27
Патогенез атеросклероза чрезвычайно сложен и многие его звенья до сих пор остаются малоизученными или имеют различную интерпретацию. Это объясняет отсутствие единой теории патогенеза этого заболевания, которая объединяла бы все известные механизмы его развития. Патогенез атеросклероза изучается с середины XIX века. В 1844 году К. Рокитанский выдвинул тромбогенную теорию его развития, в 1856 году R. Virchow – инфильтративную, в 1867 году Ю. Конгейм предложил воспалительную теорию. J. Duguid (1955, 1957) пытался доказать первичность отложений фибрина в развитии атеросклеротического поражения сосудов.
Согласно представлениям Н.Н. Аничкова и С.С. Халатова (1946) в основе возникновения атеросклероза лежит инфильтрация в стенку артерий экзогенного и эндогенного холестерина, что ведет к своеобразной клеточной реакции сосудистой стенки и формированию атеросклеротической бляшки. В 1958 году А.Л. Мясников отмечал, что в процессе развития атеросклероза наблюдаются дегенеративно-некротические изменения, развитию которых способствует тромбообразование в атеросклеротически измененных сосудах. Исследования Е.И. Чазова (1961) показали возможность воспроизведения тромба в артериях животных на фоне только нарушенного состояния стенки сосуда(дисфункции) при отсутствии в ней атеросклеротических изменений. В конце 80-х гг. XX века
R.Ross обосновал значение воспаления при атеросклерозе.
Впоследние годы широко обсуждается концепция атеротромбоза, суть которой заключается в следующем. Во-первых, атеросклеротический процесс всегда характеризуется распространенностью поражения, и при наличии клиники ишемического повреждения одного органа всегда следует ожидать скорого вовлечения в процесс и других органов. Во-вторых, главной опасностью для жизни человека является не сам атеросклероз, обычно протекающий со слабой клинической симптоматикой, а наслаивающийся на него тромбоз артерий, приводящий к острой ишемии жизненно важных органов и часто заканчивающийся летально.
Концепция атеротромбоза представляет в новом свете роль воспалительного компонента в прогрессировании атеросклеротического процесса. Именно воспалительные изменения в сосудистой стенке обусловливают повышенную склонность атеросклеротических бляшек к изъязвлению с последующей эмболизацией артериальных стволов продуктами распада бляшек, армированных агрегатами тромбоцитов и лейкоцитов. Эта концепция позволяет видеть не только отдельный пораженный орган, но и организм пациента в целом, а также акцентирует внимание на феномене тромбообразования, который подлежит и профилактике и лечению.
По современным представлениям, в основе развития атеросклероза лежит последовательное взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки(неосложненной и осложненной). Различают три основные стадии формирования атеросклеро-
28
тической бляшки (атерогенез): образование липидных пятен и полосок(стадия липоидоза); образование фиброзной бляшки (стадия липосклероза); формирование осложненной атеросклеротической бляшки. Начальная стадия атеросклероза характеризуется появлением в интиме артерий пятен и полосок, содержащих липиды. Липидные пятна представляют собой небольших размеров(до 1- 1,5 мм) участки на поверхности аорты или крупных артерий, которые имеют желтоватый цвет. Липидные пятна состоят, главным образом, из пенистых кле-
ток, |
содержащих большое |
количество липидов, и Т-лимфоцитов. |
В меньшем |
||||
количестве в них присутствуют также макрофаги и гладкомышечные |
клетки. |
||||||
Со |
временем |
липидные |
пятна |
увеличиваются в размерах, сливаются |
друг |
||
с другом и образуют так называемые липидные полоски, слегка возвышающие- |
|||||||
ся над поверхностью эндотелия. Они также состоят из макрофагов, лимфоци- |
|||||||
тов, гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии |
|||||||
развития атеросклероза |
ХС расположен |
преимущественно |
внутриклеточно |
||||
и лишь небольшое его количество находится вне клеток. |
|
|
|||||
|
Липидные |
пятна и полоски |
образуются |
в результате отложения |
липидов |
||
в интиме артерий. Первым звеном этого процесса является повреждение эндотелия и возникновение эндотелиальной дисфункции, сопровождающейся повышением проницаемости этого барьера. Причинами первоначального повреждения эндотелия могут служить несколько факторов: механическое воздействие на эндотелий турбулентного потока крови, особенно в местах разветвления артерий; артериальная гипертензия, увеличивающая напряжение сдвига; увеличение в крови атерогенных ЛНП и ЛП (α), особенно их модифицированных форм, образующихся в результате перекисного окисления липидов или их гликозилирования (при сахарном диабете) и обладающих выраженным цитотоксическим действием; увеличение активности САС и РАС, сопровождающееся цитотоксическим действием катехоламинов и ангиотензинаII на сосудистый эндотелий; хроническая гипоксия и гипоксемия любого происхождения; курение; повышение в крови уровня гомоцистеина при дефиците витамина 6,ВВ12 и фолиевой кислоты; вирусная и хламидийная инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
В результате повреждения эндотелия формируется эндотелиальная -дис функция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота) и увеличением образования вазоконстрикторных веществ (эндотелинов, АII, тромбоксана А2), еще больше повреждающих эндотелий и повышающих его проницаемость. Модифицированные ЛНП, ЛП (α)
и некоторые клеточные элементы крови(моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликозилированию(модифи-
кации), что способствует еще большему |
повреждению эндотелия и облегчает |
||
миграцию из кровотока в интиму артерий этих клеточных элементов. |
|||
Моноциты, проникшие в интиму, трансформируются в макрофаги, которые |
|||
с помощью |
так |
называемых |
скэвенджер-рецепторов(“рецепторов- |
29
мусорщиков”) поглощают модифицированные ЛНП (в меньшей степени - остатки ХМ и ЛОНП) и накапливают свободный и эстерифицированный ХС. Перегруженные липидами макрофаги превращаются в пенистые клетки, которые наряду с тромбоцитами, проникающими в интиму артерий из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные клетки, расположенные в средней оболочке артерий(медии). Под действием факторов роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают пролиферировать. Находясь в интиме, они захватывают и накапливают модифицированные ЛНП, также превращаясь в своеобразные пенистые клетки. Гладкомышечные клетки приобретают способность сами продуцировать элементы соединительной ткани (коллаген, эластин, гликозаминогликаны), которые в дальнейшем используются для построения фиброзного каркаса атеросклеротической бляшки. Со временем пенистые клетки подвергаются апоптозу - запрограммированной гибели клеток и разрушению клеточной оболочки, вследствие чего липиды попадают во внеклеточное пространство.
Описанные процессы лежат в основе первой стадии формирования атеросклеротической бляшки - образования липидных пятен и полосок. Липидные пятна появляются в артериях с раннего детства. В первом полугодии жизни они обнаруживаются в некоторых секционных случаях. У детей старшего возраста липоидоз встречается чаще и становится более интенсивным и распространенным. В возрасте 10 лет липидные пятна занимают около10% поверхности аорты, а к 25 годам - от 30% до 50% поверхности. В венечных артериях сердца липоидоз встречается с 10-15 лет, а в артериях мозга - в конце третьего десятилетия жизни (к 35-45 г).
По мере прогрессирования патологического процесса в участках отложения липидов разрастается молодая соединительная ткань, что ведет к образованию фиброзных бляшек, в центре которых формируется так называемое липидное ядро. Этому способствует увеличение количества липидов, высвобождающихся в результате апоптоза гладкомышечных клеток, макрофагов и пенистых клеток, перегруженных липидами. Экстрацеллюлярно расположенные липиды пропитывают интиму, образуя липидное ядро, которое представляет собой скопление атероматозных масс (липидно-белкового детрита). Вокруг липидного ядра возникает зона соединительной ткани, вначале богатой клеточными элементами (макрофагами, пенистыми и гладкомышечными клетками, Т-лимфоцитами), коллагеном и эластическими волокнами. Одновременно происходит васкуляризация очага атеросклеротического поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. По мере созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые волокна
утолщаются, формируя соединительнотканный каркас атеросклеротической бляшки, который отделяет липидное ядро от просвета сосуда(“покрышка”). Образуется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая кровоток в нем.
30
Клиническое и прогностическое значение атеросклеротической бляшки во |
|
|||||
многом зависит от структуры ее фиброзной покрышки и размеров липидного |
|
|||||
ядра. На ранних стадиях формирования бляшки ее липидное ядро хорошо вы- |
|
|||||
ражено, а соединительнотканная капсула сравнительно тонкая и может легко |
|
|||||
повреждаться |
под |
действием |
высокого АД, ускорения кровотока |
в артерии |
|
|
и других факторов. Такие мягкие и эластичные бляшки иногда называют“жел- |
|
|||||
тыми бляшками”. |
Они мало |
суживают просвет сосуда, но ассоциируются |
|
|||
с высоким |
риском |
повреждений |
и разрывов |
фиброзной |
к |
|
сформированием “осложненной” атеросклеротической бляшки.
Вдругих случаях фиброзная покрышка плотная и меньше подвержена повреждениям и разрывам. Такие бляшки называют “белыми”. Они нередко значительно выступают в просвет артерии и вызывают гемодинамически значимое ее сужение, которое в некоторых случаях может осложняться возникновением
пристеночного тромба. Прогрессирование атероматозного процесса приводит к формированию “осложненной” атеросклеротической бляшки. Эта стадия атероматоза характеризуется значительным увеличением липидного ядра(до 30% и более от общего объема бляшки), возникновением кровоизлияний в бляшку, истончением ее фиброзной капсулы и разрушением покрышки с образованием трещин, разрывов и атероматозных язв. Выпадающий в просвет сосудов детрит может стать источником эмболии, а сама атероматозная язва - служить основой для образования тромбов. Завершающей стадией атеросклероза является атерокальциноз - отложение солей кальция в атероматозные массы, межуточное вещество и фиброзную ткань.
Истончение |
фиброзной |
покрышки |
атеросклеротической |
бляш |
и склонность ее к разрывам связаны с действием протеолитических ферментов - |
|
|||
металлопротеиназ |
(коллагеназы, желатиназы, стромелизина), которые разру- |
|
||
шают соединительнотканный каркас бляшки. Имеет значение продолжающаяся |
|
|||
инфильтрация бляшки макрофагами, что поддерживает активность асептиче- |
|
|||
ского воспалительного процесса и способствует повреждению ее фиброзной |
|
|||
капсулы. Главным следствием формирования “осложненной” атеросклеротиче- |
|
|||
ской бляшки является образование |
пристеночного |
тромба, который внезапно |
|
|
и резко ограничивает кровоток в артерии. В большинстве случаев именно в этот период возникают клинические проявления обострения заболевания, соответствующие локализации атеросклеротической бляшки (нестабильная стенокардия, инфаркт миокарда, ишемический инсульт).
Тромбогенность атеросклеротической бляшки определяется содержанием в ней большого количества тканевого фактора, особенно в богатых липидами зонах. При экспонировании накопленного в бляшке тканевого фактора начинается процесс тромбообразования по внешнему пути свертывания крови. Стимулирующее влияние на активность тканевого фактора оказывает тромбин, являющийся продуктом каскада реакций, запускаемых тканевым фактором. Таким образом, инициируется механизм положительной обратной связи, при ко-
31
тором тромбин, генерируемый при активации тканевого фактора, способствует сохранению прокоагулянтного состояния, стимулируя дальнейший синтез тканевого фактора и принимая активное участие в атерогенезе.
Внутри бляшки обнаруживаются также фибрин-мономеры и фибринполимеры. В стенках артерий основными источниками тканевого фактора -яв ляются макрофаги, эндотелиоциты, пенистые и гладкомышечные клетки. Нарушение целостности атеросклеротической бляшки является основной причиной острого артериального тромбоза. Быстрое увеличение синтеза тканевого фактора и его накопление в неоинтиме наблюдаются после баллонного повреждения сосудов, в этом случае основным источником тканевого фактора являются гладкомышечные клетки.
Повреждение фиброзной покрышки атеросклеротической бляшки сопровождается контактом липидного ядра с кровью, в результате чего запускается первая стадия формирования тромба, который первоначально состоит из тромбоцитов и располагается внутри бляшки. В следующей стадии структура тромба изменяется, в его состав входят не только тромбоциты, но и фибрин. Тромб выходит в просвет сосуда, однако еще не перекрывает его. В дальнейшем происходит увеличение количества фибрина, захват эритроцитов, что сопровождается ростом тромба, который может перекрывать просвет сосуда.
Тромботические массы, закрывшие просвет артерии, могут подвергаться естественному лизису при условии достаточной активности фибринолитической системы. При этом внутри бляшки лизис обычно не происходит и оставшиеся там тромботические массы вызывают активную пролиферацию гладкомышечных клеток. В результате этого процесса просвет сосуда существенно сужается, причем зачастую в значительно большей степени, чем до повреждения. В тромбированных артериях, не подвергшихся лизису, может начаться процесс реканализации, продолжающийся от нескольких недель до нескольких месяцев.
Таким образом, развитие атеросклероза сопровождается значительным повышением функциональной активности тромбоцитов, нарушением функции сосудистой стенки, увеличением продукции тромбина, фибриногена, фактора Виллебранда, фактора свертывания кровиVII, а также снижением активности антисвертывающей и фибринолитической систем организма. Следовательно, в патологический процесс вовлекаются все компоненты системы гемостаза, что сопровождается постоянным гиперкоагуляционным состоянием, предрасполагающим к развитию на фоне атеросклероза тромботических осложнений.
Перечисленные выше нарушения со стороны системы гемостаза характерны и для ИБС. Многочисленные исследования, посвященные изучению состояния компонентов системы гемостаза у больных ИБС, установили нарушение реологических свойств крови, выраженную активацию тромбоцитарного звена
32
системы гемостаза, проявления дисфункции эндотелия, повышение активности калликреин-кининовой системы и факторов протромбинового комплекса, гиперфибриногенемию, нарушение полимеризации мономеров фибрина с образованием продуктов паракоагуляции, снижение активности естественных антикоагулянтов и фибринолитической системы. Эти нарушения формируют патогенетическую основу для непрерывного латентного микросвертывания крови и разрушения фибриногена в организме, то есть для развития хронически существующей гиперкоагуляционной фазы ДВС-синдрома.
На базе Самарского областного клинического кардиологического диспансера в 2006 году проведено исследование основных гемостазиологических показателей, уровней гомоцистеина (ГЦ) и СR-протеина (CRP) у 143 больных ИБС стабильного течения (стенокардия напряжения 2, 3 функциональных классов). Активность тромбоцитов и их способность образовывать агрегаты определялись с использованием метода морфо-функциональной оценки внутрисосудистой активации, в основе которого лежит немедленная фиксация венозной крови раствором антикоагулянта с последующим микроскопическим исследованием кровяных пластинок под фазово-контрастным микроскопом. Этот метод позволил сохранять внутрисосудистую морфологию тромбоцитов и отражает их функциональное состояние в кровотоке.
В сосудистом русле при отсутствии патологических активирующих влияний подавляющее большинство тромбоцитов интактны, имеют характерную дискоидную форму, практически гладкую поверхность. При воздействии факторов активации происходит изменение формы тромбоцитов, отражающее процессы их внутренней ультраструктурной и биохимической перестройки. При этом развивается типичная последовательность изменений: от формы интактного тромбоцита – дискоцита (Д) к активированным клеткам – дискоэхиноциту (ДЭ), то есть дискоциту, у которого на поверхности появляются отростки, далее к сфероциту (С), имеющего форму шара, и сфероэхиноциту (СЭ), у которого не только форма становится сферичной, но и возрастает число отростков.
Метод морфофункциональной оценки повышенной внутрисосудистой активации тромбоцитов позволяет не только дифференцировать различную - ак тивность кровяных пластинок, но и определять относительное количество малых и больших агрегатов (МА и БА), а также число тромбоцитов, вовлеченных в них (ТрА). Данный метод оказался наиболее чувствительным для диагностики гиперкоагуляционного состояния тромбоцитарного звена системы гемостаза в
патологических условиях и оценки адекватности проводимой дезагрегантной терапии.
Все пациенты в течение10 дней до момента исследования не принимали дезагреганты. В то же время базисная антиангинальная терапия(β- адреноблокаторы, антагонисты кальция, нитраты) не прерывалась. Сравнение
33
проводилось с группой здоровых лиц(37 человек). Средние значения изученных нами показателей представлены в таблице 1.
Таблица 1. Сравнение гемостазиологических параметров у здоровых людей и больных ИБС, не получавших дезагреганты
Переменная |
Средние значения переменных М ± m |
t-критерий |
||||
Контрольная группа |
|
ИБС |
||||
|
Стьюдента |
|||||
|
M |
m |
M |
|
m |
|
|
|
|
||||
Тр |
203,5 |
7,73 |
204,4 |
|
6,9 |
0,06 |
Д |
89,6 |
0,35 |
72,2 |
|
1,1 |
- 12,5 |
ДЭ |
9,8 |
0,33 |
21,8 |
|
0,9 |
10,6 |
С |
0,6 |
0,08 |
4,4 |
|
0,3 |
10,3 |
СЭ |
0,1 |
0,04 |
1 |
|
0,1 |
5,3 |
АФ |
10,5 |
0,4 |
27,5 |
|
1,1 |
12,3 |
ТрА |
8,3 |
0,5 |
12,4 |
|
0,5 |
5,7 |
МА |
4,2 |
0,3 |
5 |
|
0,3 |
2,2 |
БА |
0,1 |
0,03 |
0,8 |
|
0,08 |
7,3 |
АЧТВ |
32,3 |
0,9 |
26,1 |
|
1,4 |
- 3,6 |
ТВ |
17,2 |
0,54 |
18,4 |
|
0,7 |
1,3 |
ПТИ |
91,6 |
0,75 |
97,4 |
|
0,9 |
3,6 |
ФГ |
3 |
0,08 |
3,9 |
|
0,1 |
5,5 |
РФМК |
2,2 |
0,2 |
4,8 |
|
0,63 |
4,2 |
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр – тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ - сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА - малые агрегаты, БА – большие агрегаты, АЧТВ – активированное частичное тромбиновое время, ПТИ - протромбиновый индекс.
Базисное лечение ИБС оказывает ингибирующее влияние на агрегацию
тромбоцитов, реакцию высвобождения и продукцию ТхА, а также стимулиру-
2
ет образование PgI2. Однако наше исследование показало значительную внутрисосудистую активацию тромбоцитов у пациентов со стабильным течением ИБС, лечившихся по «классической» схеме, без одновременного приема дезагрегантов, в сравнении с контрольной группой.
При анализе полученных данных выявлено, что только средний уровень общего числа тромбоцитов примерно одинаков у здоровых лиц и у лиц, страдающих ИБС. Показатели, характеризующие внутрисосудистую активацию тромбоцитов, значительно различаются в сравниваемых группах, причем эти различия высоко достоверны(р < 0,001). Суммарное количество активных форм тромбоцитов (АФ) превышает аналогичный показатель у здоровых людей в 2,8 раза, число интактных форм (Д) снижено более чем на20%. Отмечается увеличение числа агрегатов ,исоответственно, тромбоцитов, вовлеченных в них. Обращает на себя внимание восьмикратное повышение числа больших агрегатов тромбоцитов (БА) у больных с ИБС.
34
У больных ИБС выявлена значительная внутрисосудистая активация тромбоцитов, проявляющаяся в изменении их морфофункционального состояния. Такие изменения являются закономерными и совпадают с данными других авторов о функциональных свойствах тромбоцитов у пациентов, страдающих ИБС. Следовательно, результаты нашего исследования не только подтверждают необходимость применения дезагрегантов у больных ИБС стабильного течения, но и показывают степень зависимости различных параметров тромбоцитарной активности от этого заболевания.
Анализ показателей скрининговой коагулограммы у больных ИБСста бильного течения выявил значительную активацию плазменного звена гемостаза. У обследованных лиц при сравнении с контрольной группой отмечены достоверные различия таких показателей как ПТИ, АПТВ, содержание фибриногена. Повышение уровня РФМК у пациентов с ИБС свидетельствует о наличии постоянного внутрисосудистого свертывания крови, а значительное увеличение среднего содержания СРБ – о системной воспалительной реакции.
Результаты проведенного исследования совпадают с данными других авторов, свидетельствующих об изменениях в функционировании свертывающей системы крови у пациентов с ИБС стабильного течения, характерных для гиперкоагуляционной фазы ДВС-синдрома, а также о присутствии воспалительного компонента при развитии атеросклеротического процесса. С целью выявления взаимосвязей между показателями, характеризующими состояние свертывающей системы крови, использован корреляционный анализ(рисунок ). Изучена корреляция параметров тромбоцитарной активности между собой, а также с другими гемостазиологическими, гематологическими, липидными показателями.
Выявлена выраженная корреляция между всеми параметрами внутрисосудистой активности тромбоцитов. Интактные тромбоциты (Д) связаны обратной корреляционной связью с ДЭ (r = - 0,8; p = 0,0001), С (r = - 0,3; p = 0,01), СЭ (r = -0,5; p = 0,0001), АФ (r = - 0,9; p = 0,0001), ТрА (r = - 0,3; р = 0,01) и БА (r = -0,4; р = 0,005).
Нарастание уровня активности кровяных пластинок и их способности образовывать агрегаты сопровождаются снижением числа Д ,инаоборот, – уменьшение активности тромбоцитов сопряжено с увеличением числа интактных форм. Прямая корреляционная связь выявлена между ДЭ и общим числом АФ
(r = 0,8; p = 0,0001), при этом возрастает и способность тромбоцитов образовывать агрегаты (рисунок 1).
Достоверная прямая корреляционная связь выявлена между ДЭ и числом ТрА (r = 0,3; р = 0,01), что свидетельствует об их активном участии в агрегатообразовании. В то же время ДЭ не связаны достоверно с числом С(r = 0,09; р = 0,5) и СЭ (r = 0,2; р = 0,1).
35
ДЭ
r=0,973 |
АФ |
p=0,000 |
|
r=-0,339 |
|
|
ТрА |
p=0,011 |
|
|
|
|
|
r=0,385 |
|
|
|
p=0,004 |
|
r=0,319 |
r=0,367 |
r=0,626 |
БА |
p=0,018 |
p=0,006 |
p=0,000 |
|
Рисунок 1. Корреляционные зависимости показателей активности тромбоцитов.
Между собой тесно коррелирует С и СЭ(r = 0,3; р = 0,01). Также выявлена прямая корреляционная связь этих параметров с числом АФ (r = 0,3 и r = 0,6 соответственно; р < 0,01). В то же время, число С достоверно не связано с числом ТрА (r = 0,1; р = 0,37) в отличие от числа СЭ, связь которых с этим показателем статистически достоверна (r = 0,3; р = 0,02). Число ТрА положительно и достоверно связано со всеми показателями, характеризующими внутрисосудистую активацию тромбоцитов, кроме С (r = 0,1; р = 0,37), и отрицательно – с числом Д (r = - 0,39; р = 0,003).
Помимо анализа связей показателей тромбоцитарной активности, проведен анализ их корреляции с гематологическими параметрами, показателями плазменного гемостаза, липидного профиля. Число Д коррелирует с уровнем гемо-
глобина (r = - 0,27; р = 0,047); С – с ПТИ (r = - 0,39; р = 0,016); СЭ – с концентрацией гемоглобина (r = 0,35; р = 0,008), ЛВП (r = - 0,5; р = 0,0001) и коэффи-
циентом атерогенности (r = 0,42; р = 0,03); ТрА – с числом лейкоцитов (r = - 0,3;
р = 0,03) и B-ЛП (r = - 0,53; р = 0,0001); МА – с АЧТВ (r = -0,38; р = 0,0001) и ТВ (r = - 0,34; р = 0,04); БА – с уровнем фибриногена (r = - 0,34; р = 0,04), лейкоцитов (r = - 0,28; р = 0,04), и ЛВП (r = - 0,46; р = 0,02).
По мере нарастания способности тромбоцитов образовывать агрегаты снижалось число свободно циркулирующих лейкоцитов. Это может быть связано с потреблением последних в тромбоцитарно-лейкоцитарные агрегаты, формирующиеся при прогрессировании ИБС (рисунок 2).
36
Д
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r=-0,395 |
|
|
|
|
ТрА |
|
|
|
|
|
|||||
|
p=0,003 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r=0,045 |
r=-0,300 |
лейкоциты |
p=0,748 |
p=0,029 |
|
гемоглобин
r=-0,274 |
r=0,002 |
r=-0,157 |
p=0,047 |
p=0,989 |
p=0,871 |
.
Рисунок 2. Корреляционные зависимости показателей активности тромбоцитов, лейкоцитов, гемоглобина.
Как видно из представленных данных, с увеличением активности кровяных пластинок нарастает уровеньB-ЛП, коэффициент атерогенности. При этом уровень ЛВП снижается, что может свидетельствовать о связи тромбоцитарного звена системы гемостаза и процессов атерогенеза. Между компонентами свертывающей системы, гематологическими характеристиками и показателями липидного обмена существуют сложные разнонаправленные взаимосвязи, обусловливающие при нарушении функции одного из звеньев формирование цепи патологических реакций, способствующих прогрессированию атеросклероза и ИБС.
Таким образом, повышенная активность тромбоцитов и дисфункция эндотелия играют ведущую роль в формировании атеросклеротических изменений сосудов. Активное участие в атерогенезе принимают и плазменные компоненты гемостаза, способствуя развитию гиперкоагуляционного состояния, которое зачастую трансформируется в тромбоз. Наиболее опасными и частыми для больных являются тромбозы коронарных, церебральных, периферических артерий.
В этой связи сотрудничество врачей различных специальностей, занимающихся лечением атеросклероза в разных сосудистых бассейнах, позволит оптимизировать лечение и профилактику тромбообразования. Лечение острого тромбоза наиболее эффективно при применении тромболитических и противотромботических препаратов – антикоагулянтов и антиагрегантов, к которым может быть добавлена внутриартериальная дилатационная ангиопластика или кардиохирургическая операция по показаниям. Очевидно, что профилактика
37
атеротромбоза должна воздействовать на все составляющие его патогенеза и обязательно включать здоровый образ жизни, борьбу с факторами риска атеросклероза, контроль состояния системы гемостаза, прием лекарственных препаратов.
1.3. КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина атеросклеротического поражения артерий зависит от преимущественной локализации процесса, а также степени и характера возникающих гемодинамических нарушений. В клинической практике наиболее часто встречаются следующие локализации атеросклероза: атеросклероз грудной аорты и ее ветвей; атеросклероз брюшной аорты и ее ветвей; атеросклероз коронарных артерий (ИБС); атеросклероз церебральных сосудов(ИБМ); атеросклероз периферических артерий; атеросклероз почечных артерий.
Наиболее часто в патологический процесс вовлекаются брюшная и грудная аорта, венечные сосуды сердца и церебральные сосуды. Каждый из приведенных вариантов преимущественной локализации атеросклеротических поражений отличается собственной клинической симптоматикой, обусловленной нарушением кровоснабжения и изменением структуры и функции того или иного органа. Атеросклероз коронарных артерий проявляется специфической симптоматикой ИБС; поражение брюшной аорты и ее ветвейклинической картиной абдоминального атеросклероза или перемежающейся хромотой; экстракраниальных сосудов - клиникой ИБМ. Несмотря на выраженную неравномерность атеросклеротического поражения отдельных сосудистых областей, у большинства больных патологический процесс носит все же более или менее распространенный системный характер и может быть верифицирован с помощью современных инструментальных методов исследования даже при отсутствии явных клинических проявлений атеросклероза.
В течение длительного времени атеросклеротическое сужение просвета артерии не проявляет себя клинически. Это связано с характером и степенью атеросклеротического поражения артерий, функционированием целого ряда компенсаторных механизмов. Отсутствие явных клинических проявлений атеросклероза той или иной локализации далеко не всегда указывает на малую степень атеросклеротического поражения артерий. Период клинических проявлений атеросклероза, наступающий в результате критического сужения артерии, несостоятельности компенсаторных механизмов или формирования“осложненной” атеросклеротической бляшки характеризуется возникновением ишемических расстройств в зонах преимущественного сосудистого поражения, развитием инфарктов, очагового и диффузного фиброза органов и нарушением их функции. Атеросклероз аорты относится к числу наиболее частых локализаций атеросклеротического процесса и нередко сочетается с поражениями коронарных, церебральных и периферических артерий, клинические проявления которых в большинстве случаев выступают на первый план.
38
Жалобы. Субъективная симптоматика атеросклеротического поражения аорты может быть весьма скудной или отсутствовать совсем. Иногда может наблюдаться своеобразный болевой синдромаорталгия - давящая или жгучая боль за грудиной с иррадиацией в шею, спину или верхнюю часть живота. Боль может появляться без всякой видимой причины и длится в течение нескольких часов или даже дней, то усиливаясь, то ослабевая. Иногда аорталгия сочетается с парестезиями в верхних конечностях. Появление аорталгии связывают обычно со значительным перерастяжением стенок аорты и раздражением соответствующих нервных окончаний, расположенных в аорте. В более редких случаях, при значительном расширении атеросклеротически измененной грудной аорты или при формировании аневризмы аорты, может происходить сдавление возвратного нерва или пищевода, в связи с чем у отдельных больных появляется охриплость голоса и затруднение глотания (дисфагия).
Осмотр. При общем осмотре иногда могут быть выявлены внешние признаки, указывающие на возможное наличие у больного распространенного атеросклероза. Речь идет о нескольких неспецифических признаках, которые можно обнаружить при атеросклерозе, независимо от его локализации.
1.Ксантомы и ксантелазмы. Ксантелазмы - это небольшие бледно-желтого цвета образования в области верхнего века, обусловленные отложением в них липидов. Подкожные отложения холестерина - ксантомы - могут встречаться и
вдругих частях тела(на грудной клетке, плечах, бедрах). Ксантомы и ксантелазмы обнаруживают не только при атеросклерозе и ИБС, но и при некоторых заболеваниях печени, сопровождающихся холестазом и ГЛП.
2.Старческая корнеальная дуга - своеобразная светло-серая полоска по периферии роговицы - также относится к проявлениям ГЛП и нередко встречается у больных пожилого и старческого возраста, страдающих атеросклерозом.
3.Внешние признаки преждевременного старения, в том числе - сравнительно раннее появление седых волос на голове (раннее поседение) и снижение тургора кожи. Описывают также и другие объективные признаки, которые, впрочем, не являются строго специфичными для атеросклероза и не столь часто обнаруживаются у больных атеросклерозом: обильный рост волос на ушных раковинах (симптом Габриелли); вертикальная или диагональная складка на мочке уха (симптом Франка). Отсутствие этих признаков, естественно, не исключает диагноза атеросклероза.
Исследование сердечно-сосудистой системы позволяет выявить несколько важных признаков, связанных в основном с уплотнением и расширением грудной аорты: усиленную пульсацию дуги аорты в югулярной ямке, выявляемую при пальпации; увеличение ширины сосудистого пучка больше 4–6 см при перкуссии, обусловленное не столько расширением аорты, сколько ее удлинением и разворотом против часовой стрелки, если смотреть со стороны верхушки
39
сердца; при аускультации - акцент II тона во II межреберье справа от грудины; II тон приобретает своеобразный металлический оттенок, обусловленный преобладанием высокочастотных составляющихII тона; функциональный систолический шум над аортой, связанный с появлением турбулентного тока крови в расширенной восходящей аорте, имеющей к тому же неровную шероховатую внутреннюю поверхность; при подъеме рук кверху и отклонении головы назад у некоторых больных атеросклерозом грудной аорты могут определяться усиление функционального систолического шума и увеличение громкостиII тона (симптом Сиротинина-Куковерова). Этот аускультативный феномен обусловлен тем, что при таком положении больного ключицы сдавливают подключичные артерии и в восходящей части аорты несколько возрастает уровень АД, что ведет к усилению турбулентного тока крови в аорте(шум) и увеличению скорости закрытия створок аортального клапана (акцент II тона на аорте).
Характерные изменения выявляются при исследовании артериального пульса и измерении АД. Обычно наблюдается тенденция к подъему систолического АД вплоть до развития гемодинамически обусловленной систолической АГ. Увеличивается уровень пульсового АД. Пульс на лучевой артерии становится большим, высоким. При осмотре и пальпации атеросклеротически измененных артерий (лучевых, плечевых, темпоральных) определяется их плотность, извитость, неравномерность утолщения стенок.
При атеросклерозе грудной аорты в некоторых случаях может наблюдаться асимметрия АД и артериального пульса на верхних конечностях. Если разница систолического АД на обеих руках превышает10-15 мм. рт. ст., это нередко может свидетельствовать о нарушении проходимости по одной из ветвей дуги аорты, в том числе вызванном наличием атеросклеротической бляшки у места отхождения подключичной артерии или брахиоцефального ствола.
В этих случаях при исследовании артериального пульса можно обнаружить разницу в величине пульсовых волн на правой и левой руках(pulsus differens). Перечисленные признаки являются неспецифическими и встречаются при поражениях аорты и ее ветвей иного генеза. Поэтому диагноз атеросклероза грудной аорты может быть установлен после соответствующего инструментального исследования.
Аневризмой аорты называют локальное мешковидное выбухание стенки аорты или диффузное расширение диаметра всей аорты более чем 2в раза по сравнению с нормой. По данным аутопсии, атеросклеротическая аневризма грудной аорты выявляется примерно в1% всех вскрытий у лиц старше50 лет. Развитие аневризмы аорты связано с постепенным разрушением преимущественно средней оболочки ее стенки; аорта теряет свою эластичность и начинает расширяться. Клиническая картина аневризмы грудной аорты складывается из гемодинамических нарушений и признаков сдавления близлежащих органов. При расспросе больные предъявляют жалобы на боли различной локализации,
40
одышку, кашель, сердцебиения и многочисленные“симптомы сдавления” близлежащих органов.
Болевой синдром при аневризмах грудной аорты имеет некоторые особенности в зависимости от локализации аневризмы. При аневризмах восходящей части аорты длительные жгучие боли обычно локализуются за грудиной, напоминая по своему характеру аорталгию. При аневризмах дуги аорты боли нередко иррадиируют в шею, плечо и спину. При аневризмах нисходящей части аорты боли чаще локализуются в спине и в межлопаточном пространстве, что нередко связано со сдавлением корешков спинного мозга. Многочисленные “симптомы сдавления” чрезвычайно характерны для аневризм грудной аорты, располагающихся в непосредственной близости от трахеи, бронхов, пищевода, нервных стволов и крупных ветвей аорты(подключичных артерий, брахиоцефального ствола).
1.Сдавление трахеи и главного бронха сопровождается одышкой, кашлем, иногда необильным легочным кровотечением в результате эрозии стенок бронха или трахеи. Одышка может быть связана с нарушением проходимости дыхательных путей и развивающимися ателектазами. В редких случаях может наблюдаться даже стридорозное шумное дыхание, вызванное обструкцией главного бронха или трахеи. Сдавление правого главного бронха наблюдается при аневризме восходящей части аорты, а левого бронха - при поражении дуги или нисходящей части аорты. В некоторых случаях(преимущественно при аневризме дуги аорты) можно наблюдать ритмичное смещение гортани во время систолы желудочков, обусловленное передачей систолической пульсации аневризматического мешка на бронх, трахею и гортань(симптом Оливера– Кардарелли).
2.Сдавление пищевода наблюдается при аневризме дуги и нисходящей части аорты и сопровождается затруднением глотания(дисфагией). Иногда анев-
ризматическое выпячивание в области нисходящей части аорты сдавливает нижнюю треть пищевода и кардиальный отдел желудка и вызывает интенсивные приступообразные боли в эпигастрии и диспептические расстройства.
3.Сдавление левого возвратного нерва аневризмой дуги аорты вызывает парез или паралич левой голосовой связки, что сопровождается охриплостью голоса.
4.Аневризмы дуги аорты нередко сопровождаются сдавлением левой подключичной артерии или брахиоцефального ствола, что приводит к асимметрии артериального пульса (pulsus differens) и АД. Сдавление левого брахиоцефаль-
ного ствола приводит к недостаточному кровоснабжению головного мозга и появлению нарушений зрения и обморокам.
41
5.Большие аневризмы дуги аорты могут вызывать сдавление левого шейного симпатического узла, что является причиной появления синдрома Горнера (анизокории, энофтальма, сужения глазной щели).
6.В редких случаях при больших размерах аневризмы восходящей части аорты может происходить сдавление верхней полой вены и затруднение оттока крови из соответствующей сосудистой области. У таких больных отмечаются обычно упорные головные боли, отечность лица.
При |
исследовании |
сердечно-сосудистой |
системы |
у |
бо |
с атеросклеротической аневризмой грудной аорты можно выявить несколько |
|
||||
описанных |
выше объективных |
признаков, указывающих |
на уплотнение |
|
|
и расширение аорты: усиленная пульсация в югулярной ямке или(реже) во II |
|
||||
межреберье справа от грудины; перкуторное расширение сосудистого пучка |
|
||||
вправо (симптом Потена), особенно при аневризме восходящего отдела аорты; |
|
||||
металлический акцент II тона над аортой; функциональный систолический шум |
|
||||
над аортой |
и в точке Боткина, связанный с турбулентным |
движением |
крови |
|
|
в области аневризматического выпячивания (при поражении восходящей части и дуги аорты); положительный симптом Сиротинина-Куковерова; асимметрия артериального пульса и АД (при аневризмах дуги аорты).
При вовлечении в патологический процесс кольца аортального клапана развивается его недостаточность в результате чего над аортой и в точке Боткина появляется мягкий диастолический шум, проводящийся на верхушку сердца. Наиболее тяжелым осложнением аневризмы грудной аорты является ее прорыв в полость перикарда, плевральную полость, трахею, пищевод или верхнюю полую вену с быстро наступающим летальным исходом.
К числу наиболее грозных осложнений атеросклероза грудной аорты отно- |
|
||||||
сится расслаивающая аневризма. Она характеризуется разрывом внутренней |
|
||||||
оболочки стенки аорты (интимы) и проникновением крови в среднюю оболоч- |
|
||||||
ку, обычно дегенеративно измененную. Образовавшаяся внутристеночная гема- |
|
||||||
тома |
расслаивает |
собственную |
стенку |
аорты |
и |
имеет |
тенд |
к значительному распространению по ходу артерий. В результате в течение не- |
|
||||||
которого |
времени в стенке аорты могут |
существовать два |
каналаистинный |
|
|||
и ложный. Причем истинный просвет аорты обычно сдавливается ложным ка- |
|
||||||
налом, увеличивая сопротивление изгнанию крови из ЛЖ(увеличение пост- |
|
||||||
нагрузки). Расслоение может сопровождаться вторым прорывом ложного кана- |
|
||||||
ла в истинный просвет аорты, обычно в ее нисходящей части или частичным тромбозом ложного канала. При отсутствии соответствующего лечения течение расслаивающей аневризмы завершается полным разрывом аорты и массивным кровотечением.
В зависимости от локализации первичного разрыва интимы и распространенности расслоения различают три типа аневризм(Покровский А.В. с соавт.,
42
2001): |
I тип - |
расслоение |
начинается |
в |
восходящей |
части |
аорты |
и распространяется на грудной и брюшной отделы; II тип - расслоение ограни- |
|
||||||
чено |
восходящим |
отделом грудной аорты; III |
тип - |
расслоение |
появляется |
|
|
в начале нисходящего отдела грудной аорты и может распространяться на брюшной отдел.
Вклинической картине заболевания выделяют2 этапа. Первый этап соответствует началу расслоения аорты и образованию внутристеночной гематомы. Второй этап характеризуется полным разрывом стенки аорты и развитием массивного кровотечения. При остром течении заболевания, когда смерть наступает в течение нескольких часов или1–2 дней, начало расслоения аорты характеризуется внезапным появлением очень интенсивной боли за грудиной, в спине или эпигастрии. Иррадиации в верхние конечности или шею обычно не наблюдается. Особенностью болевого синдрома при расслаивающей аневризме аорты является его интенсивность, отсутствие купирующего эффекта наркотических аналгетиков и мигрирующий волнообразный характер: начинаясь в большинстве случаев за грудиной, эпицентр боли постепенно перемещается в область спины, межлопаточного пространства и в эпигастральную область. Миграция боли соответствует распространению расслоения стенки аорты.
Вэтот период наблюдается кратковременное повышение, а затем быстрое снижение АД. На первом этапе развития заболевания острая сердечная недостаточность может развиться в результате распространения патологического процесса на кольцо аортального клапана с возникновением острой аортальной недостаточности, появлением систолодиастолического шума над аортой, снижением диастолического АД и быстрым прогрессированием симптомов левожелудочковой недостаточности. Такое развитие заболевания характерно дляI
иII типов расслаивающих аневризм, при которых в патологический процесс вовлекается восходящий отдел аорты. У части больных в этот период выявляется асимметрия артериального пульса и АД и даже гемипарезы и параплегии.
Абдоминальная ишемическая болезнь. Атеросклероз брюшной аорты прежде всего, сопровождается хроническим нарушением висцерального кровообращения. Сужение атеросклеротической бляшкой устьев непарных висцеральных артерий, отходящих от брюшной аорты(чревной, верхней и нижней брыжеечной), приводит к ишемическим расстройствам в органах брюшной полости в виде нарушений их моторной и секреторной функций, которые появляются обычно в период повышенной пищеварительной нагрузки. Морфофунк-
циональные особенности абдоминального кровообращения объясняют тот факт, что недостаточность мезентериального кровообращения может длительно и успешно компенсироваться, а сама абдоминальная ишемия в большинстве случаев протекает скрыто, латентно. Это является одной из причин сравнитель-
но редкого выявления абдоминальной ишемической болезни в клинической практике. Тем не менее, специальные исследования показывают, что абдоминальный атеросклероз является наиболее частой локализацией атеросклероза.
43
По данным ангиографических исследований, диагностически значимое сужение висцеральных сосудов выявляется у 44–68% всех больных атеросклерозом.
Для обозначения хронической ишемии мезентериального кровообращения в настоящее время используются различные термины: “синдром хронической абдоминальной ишемии”, “angina abdominalis” (по аналогии сangina pectoris -
стенокардией), “абдоминальная ишемическая болезнь”. Клиническая картина абдоминальной ишемической болезни складывается из триады симптомов: приступообразных болей в животе, обычно возникающих на высоте пищеварения; нарушений моторной и секреторной функции желудка и кишечника; прогрессивного похудания. Боли в животе обычно возникают после приема обильной или жирной пищи. Вначале появляется ощущение тяжести, переполнения в желудке, наступающее вскоре после еды, которое со временем сменяется отчетливыми тупыми ноющими болями в эпигастрии или вокруг пупка, возникающими через 20-30 минут после приема пищи и длящимися в течение2-2,5 часов. Проходят боли самостоятельно.
Нарушение моторной и секреторной функции желудка и кишечника проявляется в основном метеоризмом, отрыжкой, снижением аппетита, неустойчивым стулом, когда поносы сменяются запорами. Прогрессивное похудание, типичное для поражения чревной и верхней брыжеечной артерий, является следствием значительных нарушений секреторной и всасывательной функций -ки шечника. При объективном исследовании определяется умеренная болезненность при пальпации живота, особенно в его верхних отделах. У большинства больных (50–80%) в эпигастральной области выслушивается функциональный
систолический шум, обусловленный турбулентным током крови в атеросклеротически измененной брюшной аорте и ее суженных непарных висцеральных ветвях.
Тяжелым осложнением абдоминальной ишемической болезни является острый тромбоз одной из висцеральных артерий. В этих случаях внезапно появляются чрезвычайно интенсивные постоянные резкие боли в животе, не купирующиеся спазмолитиками и даже наркотическими аналгетиками. Интенсивность болей быстро нарастает, они становятся нестерпимыми и нередко сопровождаются признаками шока. При отсутствии своевременного адекватного, в том числе хирургического, вмешательства в течение нескольких часов или1– 2 суток развивается гангрена кишечника, появляются симптомы разлитого перитонита и наступает смерть.
Аневризма брюшной аорты примерно 3–в5 раз чаще встречается у мужчин, чем у женщин. В большинстве случаев она локализуется ниже отхождения от аорты почечных артерий. Аневризма сдавливает органы брюшной полости, нервные корешки и сплетения, что обусловливает характерную клиническую картину. Обычно больного беспокоят тупые ноющие боли в животе, преимущественно в левой половине или в области пупка. В некоторых случаях
44
боли локализуются в поясничной области. При распространении атеросклеротического процесса на почечные артерии или сдавлении их аневризмой развивается симптоматическая почечная АГ. Сдавление двенадцатиперстной кишки сопровождается симптомами затруднения прохождения пищи, рвотой. Нередко больные предъявляют жалобы на ощущение усиленной пульсации в животе.
При осмотре этой области может действительно определяться видимая на глаз пульсация (симптом Корригена), а при пальпации - плотное, обычно малоболезненное пульсирующее опухолевое образование. Над областью аневризмы в большинстве случаев выслушивается функциональный систолический шум.
Прогноз аневризмы брюшной аорты очень тяжелый: если не предпринимается радикальное хирургическое лечение, большинство больных погибает в течение 1–2 лет. Основной причиной смерти является разрыв аневризмы. При возникновении разрыва аневризмы брюшной аорты у больных внезапно появляются интенсивные боли в животе или в поясничной области, не купирующиеся наркотическими аналгетиками. Часто боли сопровождаются тошнотой, рвотой и симптомами коллапса. Отмечается тахикардия, быстрое снижение АД, анемия. При физикальном исследовании обычно определяются вздутие живота, пульсирующее опухолевое образование в брюшной полости и систолический шум над областью аневризмы. В большинстве случаев отсутствуют симптомы раздражения брюшины, поскольку аневризма брюшной аорты обычно прорывается в забрюшинное пространство с образованием там гематомы. Если не
проводится экстренная операция, у половины больных смерть наступает в течение 7–24 ч от начала разрыва, у 36% - в последующие 1–5 дней.
Синдром Лариша - это характерный клинический симптомокомплекс, развивающийся при выраженном сужении или полной окклюзии брюшной аорты в области ее бифуркации и/или обеих подвздошных артерий. Наиболее частой причиной этого симптомокомплекса является атеросклероз. Атеросклеротические бляшки располагаются обычно на задней стенке аорты и подвздошных артерий и очень часто сопровождаются выраженным кальцинозом и развитием пристеночного тромбоза. Заболевание встречается преимущественно у мужчин. Наличие стеноза или окклюзии брюшной аорты и подвздошных артерий ведет к развитию хронической артериальной недостаточности нижних конечностей, а также к хронической ишемии тазовых органов и ягодичных мышц.
Основным клиническим проявлением синдрома Лариша является болевой синдром. Боли чаще локализуются в икроножных мышцах и возникают во время ходьбы, что заставляет больного периодически останавливаться. Это объясняется значительным увеличением физической нагрузки, выполняемой мышцами нижних конечностей и ростом потребности в кислороде. Последняя не
может |
быть удовлетворена за счет увеличения |
магистрального кровотока |
в связи |
с наличием выраженного сужения или |
окклюзии брюшной аорты |
и подвздошных артерий. В покое боли проходят в связи с уменьшением работы мышц и их потребности в кислороде.
45
Наряду с болями, у больных с синдромом Лариша во время ходьбы возникают онемение и похолодание конечностей. Описанные особенности болевого синдрома при синдроме Лариша получили название“перемежающаяся хромо-
та”. В более редких случаях боли локализуются в бедренных мышцах и мышцах ягодицы (“высокая перемежающаяся хромота”). Обычно в этих случаях речь идет о преимущественном поражении брюшной аорты.
Различают 4 стадии хронической артериальной недостаточности нижних конечностей (ХАНК), развивающейся в том числе при синдроме Лариша: I стадия - боли появляются только при выполнении большой физической нагрузки (при ходьбе на расстояние больше 1 км); II стадия - боли появляются при ходьбе обычным шагом на расстояние менее1 км; если боли появляются при преодолении расстояния более 200 м, диагностируют ХАНК IIА стадии, а менее 200 м - ХАНК IIБ стадии; III стадия - боли появляются в покое или при ходьбе на расстояние меньше 25 м; IV стадия - у больного выявляются признаки яз- венно-некротических изменений тканей нижних конечностей(появление трофических язв и некрозов в области пальцев и стоп). Частым симптомом болезни является импотенция. Она наблюдается у1/2 больных с окклюзией брюшной аорты и вызвана как ишемией тазовых органов, так и хронической недостаточностью кровоснабжения спинного мозга.
При объективном исследовании у больных с синдромом Лариша можно выявить несколько важных симптомов, подтверждающих наличие хронической артериальной недостаточности нижних конечностей. К их числу относятся: отсутствие пульсации на обеих артериях стоп: на артерии тыла стопы и задней большеберцовой артерии; отсутствие или ослабление пульсации на бедренных артериях; систолический шум, выслушиваемый над стенозированной бедренной артерией, а в части случаев и над проекцией брюшной аорты(при полной окклюзии артерии шум по понятным причинам может отсутствовать вообще); наличие язв и некрозов в области пальцев и стоп; похолодание нижних конечностей; гипотрофия и атрофия мышц нижних конечностей; изменение окраски кожи ног, особенно в области стоп (бледность, цианоз или гиперемия стоп); нарушение роста ногтей и волос на ногах.
Особое диагностическое значение имеет измерение АД на нижних конечностях. Для этого АД определяют не только на плечевых, но и на бедренных артериях в положении пациента на животе. Тоны Короткова выслушивают в подколенных ямках. В норме систолическое АД на нижних конечностях примерно на 20 мм рт. ст. выше, чем на верхних, и колеблется в пределах 140–160 мм. рт. ст. Если систолическое АД на нижних конечностях ниже чем на верхних на 20 мм рт. ст., следует думать о нарушении проходимости по брюшной аорте или артериях нижних конечностей.
Симметричное снижение уровня систолического АД на обеих ногах свойственно для синдрома Лариша. Асимметрия АД на правой и левой ногах указы-
46
вает на поражение подвздошной или бедренной артерии. Клиническая симптоматика синдрома Лариша (перемежающаяся хромота, трофические и язвеннонекротические изменения голеней и стоп, гипотрофия мышц) напоминает клинические проявления поражения дистальных артерий ногклинику облитерирующего атеросклероза.
1.4. ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Целями лабораторного и инструментального обследования больных с -по дозрением на наличие атеросклероза являются:
1.Объективное подтверждение наличия или отсутствия атеросклеротических изменений сосудов.
2.Уточнение локализации атеросклеротического поражения(стеноза или окклюзии).
3.Уточнение степени и распространенности атеросклеротического сужения артерий, а также выраженности коллатерального кровообращения.
4.Оценка функциональных и структурных нарушений ишемизированных органов и тканей.
5.Выявление ФР атеросклероза и уточнение их возможного влияния на развитие и прогрессирование атеросклеротического процесса.
6.Выработка оптимальной тактики ведения больных, включая хирургические методы лечения, а также уточнение мер вторичной профилактики атеросклероза, направленных на замедление прогрессирования заболевания. Оценка нарушений липидного обмена имеет решающее значение для выбора -опти мальной лекарственной и немедикаментозной терапии больных атеросклерозом, направленной на коррекцию этого ФР.
Для характеристики нарушений липидного обмена используют определение: 1) общего количества ХС и ТГ в плазме крови; 2) содержания отдельных классов липопротеидов (ЛНП, ЛОНП, ЛВП); 3) расчет коэффициента атерогенности. В большинстве случаев этих данных бывает достаточно, чтобы оценить характер и выраженность нарушений липидного обмена, а также степени атерогенности этих нарушений. В последние годы дополнительно к этим исследованиям рекомендуют определять также содержание белков-апопротеинов, входящих в состав ЛП(апо-А, апо-В) и отличающихся различным влиянием на ате-
рогенез, хотя эти методы пока не нашли широкого распространени в клинической практике.
Общий холестерин и триглицериды в плазме крови. При различных дислипидемиях может повышаться содержание ХС(гиперхолестеринемия) или
47

ТГ (гипертриглицеридемия). Часто встречается также так называемая комбинированная гиперлипидемия, при которой имеет место повышение концентрации как ХС, так и ТГ. Одной из наиболее сложных проблем диагностики гиперлипидемий является вопрос о том, какой уровень ХС и ТГ считать “нормальным”. Как известно, содержание обоих липидов в плазме (сыворотке) крови здоровых
людей колеблется в широких пределах и зависит прежде всего от возраста и пола: с возрастом у здоровых людей уровень ХС и ТГ постепенно возрастает; у мужчин он выше, чем у женщин.
Усредненной и весьма условной верхней границей считают для ХС5,17 ммоль/л (200 мг/дл) и для ТГ - 1,7 ммоль/л (130 мг/дл). Сопоставление этих границ с данными, полученными при обследовании больших популяций здоровых людей, показывает, что у многих из них уровень ХС существенно превышает 5,17 ммоль/л, а триглицеридов - 1,7 ммоль/л. Дело в том, что атерогенное действие ХС и ТГ существенно возрастает при наличии у обследуемых таких ФР атеросклероза как отягощенная наследственность, курение, АГ, сахарный диабет, ожирение. У этих лиц границы нормы общего ХС и ТГ должны быть значительно снижены. Многочисленные рандомизированные исследования позволили рекомендовать наиболее приемлемые в настоящее время уровни ХС и ТГ, представленные в таблице 2.
Таблица 2. Концентрация холестерина и триглицеридов в крови
|
Липиды |
|
Единицы |
|
Желательный |
|
Погранично вы- |
|
Повышенный |
|
||
|
|
|
|
|
|
|||||||
|
|
измерения |
|
уровень |
|
сокий уровень |
|
|
уровень |
|
||
|
|
|
|
|
|
|
|
|||||
|
ХС |
|
ммоль/л |
|
< 5,2 |
|
5,2–6,2 |
|
|
|
6,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мг/дл |
|
< 200 |
|
200–239 |
|
|
240 |
|
||
|
|
|
|
|
|
|
|
|||||
|
ТГ |
|
ммоль/л |
|
< 1,7 |
|
1,7–2,29 |
|
|
2,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мг/дл |
|
< 130 |
|
130–200 |
|
|
200 |
|
||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
Гиперхолестеринемия диагностируется при содержании ХС в плазме(сы- |
||||||||||||
воротке) |
|
крови, |
превышающем |
6,2 |
ммоль/л |
(240 мг/дл), |
||||||
а гипертриглицеридемия - при концентрации |
ТГ |
|
больше2,3 ммоль/л |
|||||||||
(200 мг/дл). Сочетание погранично высокого уровня ХС(5,2–6,2 ммоль/л) и ТГ (1,7–2,3 ммоль/л) с другими ФР может иметь такое же значение в формировании и прогрессировании атеросклероза, как и более высокий уровень этих липидов, но при отсутствии АГ, сахарного диабета, ожирения, отягощенной наследственности.
Гиперхолестеринемия, гипертриглицеридемия и комбинированная гиперлипидемия встречаются не только при атеросклерозе, но и при многих заболеваниях печени, желчевыводящей системы, почек, эндокринной системы. Повышение уровня ХС и ТГ наблюдается при сахарном диабете, нефротическом синдроме, микседеме, обтурационной желтухе, холестатическом синдроме, бе-
48
ременности. Определение типа гиперлипопротеинемий по Фредриксону. Соотношение отдельных классов ЛП служит основанием для выделения нескольких типов гиперлипидемий, некоторые из которых обладают значительной атерогенностью. В таблице 3 приведено содержание различных фракций ЛП, общего ХС и ТГ в плазме здорового человека.
Таблица 3. Содержание липидов в плазме
Фракции липидов |
Содержание в плазме |
||
|
|
|
|
мг/дл |
|
ммоль/л |
|
|
|
||
|
|
|
|
Общий холестерин |
< 200 |
|
< 5,2 |
Триглицериды |
< 200 |
|
< 2,3 |
|
|
|
|
ЛНП |
< 130 |
|
< 3,4 |
ЛВП (мужчины) |
> 35 |
|
> 0,9 |
|
|
|
|
ЛВП (женщины) |
> 40 |
|
> 1 |
Хиломикроны (натощак) |
|
Следы |
|
|
|
|
|
Для определения типа ГЛП обычно используют классификацию, согласно которой различают 5 типов ГЛП. Тип I характеризуется высоким содержанием хиломикронов (натощак) и выраженной гипертриглицеридемией. Уровень ЛОНП может быть нормальным или слегка повышенным. Клинически этот тип ГЛП часто проявляется абдоминальным болевым синдромом, ксантоматозными высыпаниями, липоидной дугой роговицы, гепатоспленомегалией. Этот тип ГЛП встречается: 1) при первичной семейной гиперхиломикронемии, обусловленной наследственным дефицитом липопротеинлипазы, участвующей в расщеплении ХМ; 2) при сахарном диабете; 3) при панкреатитах; 4) при заболеваниях, сопровождающихся избыточной продукцией кортикостероидов (опухоли надпочечников, гипофиза, гормонпродуцирующая опухоль легкого, адреногенитальный синдром).
Тип II характеризуется высоким содержанием ЛНП, общего холестерина. Различают два варианта этого типа ГЛП: Тип IIа - значительно повышенная концентрация ЛНП и общего ХС сочетается с нормальным содержанием ЛОНП
ТГ. Тип IIб - значительно повышенная концентрация ЛНП и общего ХС сочетается с умеренным увеличением содержания ЛОНП и ТГ. Клинически этот тип ГЛП проявляется ранним развитием атеросклероза различной локализации, ИБС, острого ИМ, мозгового инсульта. Независимо от причин, вызвав-
ших ГЛП, этот тип, особенно тип IIа, ассоциируется с повышенным риском внезапной сердечной смерти. Тип II ГЛП встречается: 1) при первичной семейной гиперхолестеринемии (IIа) и семейной комбинированной гиперлипидемии (IIб); 2) при нефротическом синдроме (IIа и IIб); 3) при заболеваниях, сопровождающихся гиперкортицизмом (IIа); 4) при сахарном диабете (IIб); 5) при гипотиреозе (IIа).
49
Тип III характеризуется высоким содержанием в сыворотке крови триглицеридов, холестерина и патологически измененных(аномальных) ЛОНП и ЛНП, отличающихся значительным содержанием ТГ, ХС и одновременно высокой электрофоретической подвижностью. Клинически этот тип ГЛП также проявляется ксантоматозом и ранним развитием атеросклероза различной локализации. Основными причинами ГЛП типа III являются: 1) семейная ГЛП типа III; 2) сахарный диабет; 3) гипотиреоз; 4) ожирение. Тип IV отличается высоким уровнем ЛОНП и ТГ при нормальной концентрации ЛНП. Содержание ХС в сыворотке крови нормально или слегка повышено. Клинически этот тип ГЛП
часто |
сопровождается |
развитием |
атеросклероза, в том |
числе |
ИБС |
и периферического атеросклероза. |
|
|
|
||
Тип IV ГЛП встречается: 1) при первичной семейной гипертриглицеридемии; 2) ожирении; 3) сахарном диабете; 4) гипотиреозе; 5) нефротическом синдроме и уремии; 6) заболеваниях, сопровождающихся гиперкортицизмом; 7) гипопитуитаризме; 8) алкоголизме; 9) лечении эстрогенами. Тип V характеризуется повышенным содержанием хиломикронов и ЛОНП, а также ТГ и ХС. Клинически проявляется гепатоспленомегалией, приступами абдоминальной колики, развитием панкреатита, ксантоматозом. Наиболее частыми причинами ГЛП типа V являются: 1) первичная семейная гипертриглицеридемия; 2) сахарный диабет; 3) гипотиреоз; 4) нефротический синдром и уремия; 5) заболевания, сопровождающиеся гиперкортицизмом; 6) алкоголизм; 7) лечение эстрогенами. В таблице 4 суммированы основные критерии диагностики описанных типов ГЛП. Наибольшее значение для атерогенеза имеютII, III и IV типы, для которых характерно повышение содержания ЛНП и ЛОНП, наиболее богатых ХС и ТГ. Главными белками, входящими в состав этих ЛП, являются апо-В. При увеличении ЛНП и ЛОНП имеется высокий риск развития атеросклероза и патогенетически связанных с ним заболеваний(ИБС, ИМ, мозговой инсульт, облитерирующий атеросклероз артерий ног).
Таблица 4. Количество холестерина, триглицеридов, ЛП при разных типах ГЛП
Показатели |
I |
IIa |
IIб |
III |
IV |
V |
|
|
|
|
|
|
|
ХС |
(±) |
++ |
++ |
++ |
(±) |
+ |
ТГ |
+++ |
|
+ |
+++ |
+++ |
++ |
|
|
|
|
|
|
|
ХМ |
++ |
|
|
|
|
++ |
ЛОНП |
(±) |
|
+ |
++ * |
++ |
++ |
|
|
|
|
|
|
|
ЛНП |
|
++ |
++ |
++ * |
|
|
|
|
|
|
|
|
|
Примечание: + - увеличение содержания; (±) - отсутствие изменений или небольшое повышение; * - аномальные формы ЛП.
50
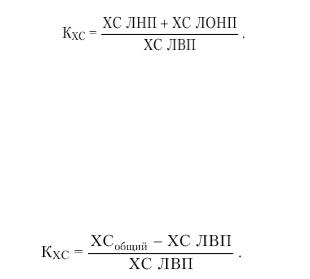
Определение коэффициента атерогенности. Не меньшее значение для атерогенеза имеет содержание в плазме ЛП высокой плотности(ЛВП), обладающих антиатерогенным действием. Их содержание обратно пропорционально скорости развития раннего атеросклероза. Чем ниже концентрация в плазме ЛПВП, тем выше риск развития атеросклероза. В целом риск развития атеросклероза во многом определяется соотношением атерогенных и неатерогенных ЛП в крови. Для ориентировочной количественной оценки степени риска атеросклероза разработан холестериновый коэффициент атерогенности(КХС), представляющий собой отношение ХС атерогенных и ХС антиатерогенных ЛП:
Поскольку суммарное количество |
ХС атерогенных липопротеидов(ЛНП |
и ЛОНП) можно представить как |
разницу между общим(ХСХСобщий) |
и ХС ЛВП, коэффициент атерогенности можно рассчитать на основании определения только двух показателей - общего ХС и ХС ЛВП:
Рентгенография. Исследование аорты в прямой, левой передней косой и левой боковой проекциях позволяет диагностировать ее расширение, удлинение, отложения кальция в ее стенке, а также аневризматические выпячивания аорты. Удлинение и расширение аорты чаще наблюдается при ее атеросклеротическом поражении и артериальных гипертензиях. При удлинении аорта выступает вправо и вверх и принимает участие в образовании правого верхнего контура сосудистой тени, значительно заходя на тень верхней полой вены. Верхний край аорты достигает уровня грудинно-ключичных сочленений. Удлиненная аорта нередко образует изгибы, в связи с чем увеличивается верхняя дуга левого контура тени сердца. Расширение аорты приводит к общему увели-
чению поперечника ее |
тени и к |
большему выбуханию дуг аорты в правое |
и левое легочные поля. В левой передней косой проекции тень аорты становит- |
||
ся развернутой, размеры |
аортального |
окна увеличиваются. Кальциноз аорты |
довольно часто встречается при атеросклерозе. В этих случаях в проекции тени аорты можно обнаружить отложение кальция. Аневризма аорты рентгенологи-
чески проявляется местным расширением ее тени различных размеров и локализации, а также усиленной пульсацией, выявляемой при рентгеноскопии.
51
Ангиография. Это инвазивный рентгенологический метод исследования сердца, аорты, легочной артерии, коронарных и других артерий с помощью селективного контрастирования крупных сосудов и полостей сердца. Селективная ангиография является наиболее информативным методом при распознавании
атеросклеротического |
поражения |
аорты, ее |
ветвей. Однако |
в связи |
с относительной сложностью и небезопасностью |
для больного процедуры -се |
|||
лективной ангиографии ее используют преимущественно в кардиохирургических клиниках при решении вопроса о показаниях и объеме оперативного вмешательства на сердце и крупных сосудах. Для селективного контрастирования левых отделов сердца, аорты и ее ветвей обычно применяют ретроградную катетеризацию левого желудочка через системную артерию. Гораздо реже используют методы чрескожной транссептальной пункции левого предсердия или прямой чрескожной пункции левого желудочка. Изображение контрастированных камер сердца или сосудов получают с помощью сложных рентгеновских установок, оснащенных электронно-оптическими усилителями, телевизионной системой, скоростными кино- и видеокамерами, которые позволяют делать серийные снимки. Для катетеризации левых отделов сердца и аорты используют два метода: 1) ретроградную артериальную катетеризацию аорты и левого желудочка, 2) транссептальный доступ. Чаще применяют ретроградный артери-
альный доступ. В этом случае специальный |
катетер вводят |
чрескожно |
в бедренную артерию или через небольшой разрез в плечевую артерию. Введе- |
||
ние катетера в аорту и затем в левый желудочек |
контролируют |
с помощью |
рентгенотелеустановки. |
|
|
Транссептальный доступ обычно используют в тех случаях, когда по ка- ким-то причинам ретроградная артериальная катетеризация оказывается технически сложной из-за выраженного сужения аортального клапана, наличия ги-
пертрофической |
кардиомиопатии, механического |
протеза клапана. |
Катетер |
||
вводят в правую бедренную вену и продвигают его в направлении к сердцу. Ко- |
|||||
гда катетер достигает правого предсердия, через |
него вводят длинную иглу |
||||
с закругленным |
концом, пунктируют |
ею |
межпредсердную |
перегородку |
|
в области овального отверстия. После этого катетер вводят по игле в левое предсердие, затем в левый желудочек, при необходимости, в аорту и регистрируют кривые давления. Рентгеновская контрастная аортография. Селективное контрастирование грудной и брюшной аорты (аортография) позволяет уточнить локализацию и размеры аневризмы аорты, а также сужение крупных магистральных артерий. Основной ангиографический признак расслаивающей аневризмы - двойной контур аорты.
Цифровая вычислительная ангиография (ЦВА) используется в крупных диагностических центрах для получения высококачественного рентгеновского изображения сосудистых структур. Метод основан на компьютерной обработке рентгенограмм, позволяющей “вычитать” рентгеноконтрастные тени сосудов и сердца после их контрастирования из изображения мягких тканей и костей соответствующей области тела. Получаемые рентгенограммы сосудистого рус-
52
ла благодаря высокому качеству изображения используются для диагностики разнообразной патологии церебральных, коронарных, почечных сосудов, аорты, легочной артерии.
Рентгеновская компьютерная и магнитно-резонансная томография.
Рентгеновская компьютерная томография(рентгеновская КТ) и магнитнорезонансная томография (МРТ) являются одними из наиболее перспективных и высокоинформативных методов визуализации сердца и крупных сосудов. Получение с помощью рентгеновской КТ последовательных тонких поперечных и продольных срезов, особенно в сочетании с введением контрастного вещества, позволяет получить изображение сердца и сосудов с высоким разрешением. Отчетливо выявляются морфологические изменения аорты и ее крупных ветвей, в том числе аневризмы аорты.
Перспективным представляется использование МРТ в связи с высокой разрешающей способностью при применении специальных методик контрастирования и способов высокоскоростной регистрации изображения. МРТ применяется в диагностике аневризм, стенозов, окклюзий аорты и ее ветвей. К числу недостатков относится высокая стоимость оборудования и его эксплуатации, что ограничивает использование этих методов в широкой клинической практике.
Ультразвуковое исследование магистральных сосудов. Позволяет оце-
нить размеры сосудов, выявить расширение или сужение их просвета, аневризматические выпячивания, атеросклеротические бляшки, тромбы, а также количественно оценить скорость и характер кровотока(ламинарный или турбулентный). С этой целью используют двухмерную эхокардиографию (В-режим), доплеровское исследование и цветное доплеровское картирование потоков. Большой информативностью обладают так называемые дуплексные системы, сочетающие двухмерное сканирование сосуда в В-режиме и спектральный анализ доплеровского сигнала. Наибольшее практическое значение имеет ультразвуковое исследование грудного и брюшного отделов, почечнаортых и брахиоцефальных артерий, артерий и вен нижних конечностей.
Двухмерное ультразвуковое исследование аорты и ее ветвей. Восходя-
щая и нисходящая части грудной аорты визуализируются обычно из супрастернального доступа, хотя изображение грудной аорты можно получить и из других позиций ультразвукового датчика. В норме диаметр грудной аорты, измеренный в М-режиме в начале систолы желудочков, колеблется от 2,4 см до 3,4 см. Брюшная аорта и ее крупные ветви чаще визуализируются из переднебрюшного доступа. Можно получать изображение чревного ствола и его крупных ветвей - печеночной и селезеночной артерий, верхней брыжеечной артерии, почечных артерий. Диаметр брюшной аорты на уровне диафрагмы составляет около 2 см. Для получения информации о характере кровотока по внут-
53
ренней и наружной сонным артериям, вертебральным и другим брахиоцефальным артериям используют различные позиции ультразвукового датчика.
При исследовании брахиоцефальных артерий в обязательном порядке -ис пользуют компрессионные пробы - сдавление общей сонной и ветвей наружной сонной артерии, которое приводит к неодинаковым изменениям характера и скорости кровотока в норме и при патологии. Аневризма сосудов. Диагноз аневризмы аорты ставят при локальном (ограниченном) выбухании стенки аорты или при диффузном увеличении диаметра грудной или брюшной аорты 2в раза по сравнению с нормой. В области расширения заметно снижается скорость кровотока; он становится неупорядоченным и даже разнонаправленным. Эти изменения обычно хорошо выявляются при ультразвуковой допплерографии.
Сходные изменения обнаруживают при аневризме крупных ветвей аорты, |
|
|
|||
хотя при применении В-режима исследования часто возникает необходимость |
|
|
|||
дифференцировать |
обнаруженное |
расширение |
сосуда |
с |
к |
и псевдокистами |
поджелудочной железы, |
почек и других |
органов, а также |
|
|
с наличием дивертикулов тонкой кишки и гидронефрозом. В этих случаях особенно показано использование ультразвуковой допплерографии, которая позволяет достаточно легко различать эти образования.
Сужение артерий. Наиболее частой причиной сужения артерий является атеросклероз, облитерирующий эндартериит, синдром Такаясу, врожденные аномалии развития сосудов. Атеросклеротические изменения аорты при ультразвуковом исследовании проявляются в утолщении, уплотнении и кальцинозе стенок, неровностях внутреннего контура сосуда, удлинении и нарушении прямолинейности хода артерий, наличии атеросклеротических бляшек.
Ультразвуковое исследование сонных артерий. В последние годы эту методику используют в качестве скринингового метода для выявления ранних изменений артериальной стенки, обусловленных атеросклерозом. Метод позволяет оценить структуру стенки и состояние просвета сосуда, измерить толщину слоя “интима-медиа” (ТИМ), которая хорошо коррелирует с данными, получаемыми при аутопсии. Многочисленные клинические исследования, проведенные с применением этой методики, также свидетельствуют о высокой корреляции этого показателя с риском развития коронарных и цереброваскулярных осложнений атеросклероза. Исследование проводят в В-режиме. Толщину слоя “интима-медиа” (ТИМ) измеряют на уровне общей сонной артерии(СА) и ее бифуркации. В норме ТИМ не превышает1 мм. ТИМ от 1 до 1,3 мм расценивают как утолщение стенки артерии, а значения этого показателя, превышающие 1,3 мм, - как ультразвуковой признак атеросклеротической бляшки, б). Диагноз атеросклероза считают достоверным при обнаружении утолщения стенки артерии или/и наличии фиброзной бляшки.
54
Доплеровское исследование. Сужение и окклюзия магистральных артерий лучше всего визуализируются при доплеровском ультразвуковом исследовании. Целесообразно сравнивать характер и скорость кровотока, зарегистрированного в соответствующих сосудах. Наиболее надежные критерии сужения или окклю-
зии магистральных сосудов выявляются при качественной и количественной оценке спектральных характеристик доплеровского сигнала. Спектрограмма представляет собой совокупность точек разного цвета(или яркости), положение каждой из которых по отношению к оси ординат(шкале частот) соответствует определенной скорости кровотока, зарегистрированной в поперечном сечении артерии за время сердечного цикла. Линейная скорость кровотока измеряется в кГц. Цвет каждой точки (или ее яркость) соответствует удельному весу данной частоты в спектре: при максимальной интенсивности точки окрашиваются в красный цвет, при минимальной - в синий.
Спектрограммы каждой магистральной артерии в норме существенно -от личаются по форме и величине максимальной систолической и диастолической частей спектра. Оценка степени стеноза по спектру доплеровского сигнала основана на теоретическом положении, согласно которому масса крови, протекающей через поперечное сечение сосуда, является величиной постоянной. Это означает, что непосредственно в месте сужения артерии линейная скорость движения возрастает (V2). В постстенотическом сегменте скорость кровотока резко замедляется (V3) и он становится турбулентным. Для объективной оценки полученного спектра доплеровского сигнала рассчитывают несколько количественных показателей:
1. Максимальная систолическая амплитуда линейной скорости кровотока
вточке ультразвуковой локации (Smax);
2.Максимальный диастолический пик скорости (Dmах);
3.Индекс спектрального расширения (SB), характеризующий степень турбулентности кровотока в месте локации:
где А - скорость максимальной интенсивности кровотока, амплитуда наиболее ярких точек спектра.
4. Индекс пульсации (PI), характеризующий циркуляторное сопротивление в бассейне лоцируемой артерии:
55

где М - средняя скорость кровотока в точке локации.
5. Индекс циркуляторного сопротивления - IR (индекс Пурселло):
Основным и наиболее достоверным признаком стеноза магистральной артерии в месте локации является увеличение максимальной систолической -ам плитуды допплерограммы (Smax). Считается, что увеличение степени стеноза на 10% сопровождается ростом Smax на 1 кГц. Если при доплеровском исследовании общей или внутренней сонной артерии значенияSmax составляют 4–5 кГц (в норме Smax в этих артериях не превышает4 кГц), имеется умеренный стеноз этих артерий (до 50% просвета сосудов). Если Smax больше 5 кГц, речь идет о
выраженном стенозе. Наряду с увеличением линейной скорости кровотока в участке сужения обнаруживают признаки повышения циркуляторного сопротивления сосуда в виде нарастания величины индекса пульсации(PI), индекса циркуляторного сопротивления (IR) и снижения величины максимального диастолического пика (Dmax).
Важным признаком сужения магистральной артерии при доплеровском исследовании является регистрация турбулентного потока с заметным расширением спектра как в систолу, так и в диастолу. Это сопровождается уменьшением амплитуды максимальной интенсивности кровотока(А) и увеличением индекса спектрального расширения (SB). Несмотря на отсутствие заметного увеличения максимальной систолической амплитуды линейной скорости, определяется широкое распределение частот и уменьшение площади“окна”, характерного для нормального ламинарного движения крови в магистральном сосуде, что является важным указанием на наличие турбулентного кровотока. При критическом сужении просвета магистральной артерии на 90% и более пиковая систолическая частота значительно снижается. При полной окклюзии магист-
ральной артерии ниже места окклюзии регистрируется спектр с типичными признаками так называемого коллатерального кровотока: низкая систолическая и относительно высокая диастолическая скорость со значительным уменьшением средней скорости кровотока и низкими значениями индекса пульсации.
Ультразвуковая допплерография артерий нижних конечностей. К числу наиболее частых причин гемодинамически значимого сужения артерий ног от-
56
носится атеросклероз периферических сосудов. Методика изучения кровотока в магистральных артериях нижних конечностей с использованием УЗДГ включает два этапа: 1) ультразвуковую локацию артерий в стандартных точках исследования с получением информации о характере кровотока, 2) измерение регионарного систолического АД с определением индексов давления.
Используют 4 стандартные позиции ультразвукового исследования артерий нижних конечностей: 1. Наружная подвздошная артерия - на 1,5 см медиальнее пупартовой связки. 2. Подколенная артерия - в области подколенной ямки. 3.
Задняя тибиальная артерия- в ямке, образованной медиальной лодыжкой и ахилловым сухожилием. 4. Терминальная ветвь передней тибиальной артерии - в области тыла стопы между фалангамиI и II пальцев. В норме при локации магистральных артерий нижних конечностей допплерограммы имеют харак-
терный вид трехфазной кривой. Первая положительная и следующая за ней вторая отрицательная волна возникают в систолу и отражают антеградный кровоток, направленный в сторону ультразвукового датчика, и небольшой ретроградный ток крови обратно в сторону сердца. Третья (положительная) волна возникает в конце диастолы в результате слабого антеградного кровотока после отражения крови от створок аортального клапана.
При наличии стеноза магистральной артерии в месте сужения регистрируются характерные изменения магистрального кровотока. Увеличивается максимальная амплитуда систолической волны(Smax), ее основание расширяется. Допплерограмма приобретает двухфазный (а не трехфазный, как в норме) вид за счет исчезновения третьей волны антеградного тока крови. Вторая (ретроградная) волна также может быть слабо выражена. Ниже места окклюзии регистрируется коллатеральный тип допплерограммы с низким, сглаженным систо-
лическим пиком, относительно высоким уровнем диастолической волны и отсутствием как второй систолической(ретроградной), так и третьей (антеградной) диастолической волны (монофазный характер кривой). При окклюзии средней или дистальной трети бедренной артерии коллатеральный тип кровотока обнаруживается в области подколенной, задней и передней тибиальных артерий, а магистральный тип (трехфазная кривая) - в области наружной подвздошной артерии. Окклюзия подколенной артерии сопровождается появлением коллатерального типа кровотока в тибиальных артериях.
Для определения уровня и степени сужения проводят также измерение регионарного систолического АД и расчет индексов давления. На правую и левую ноги накладывают по четыре пневматические манжеткитакие же, как и при измерении АД на плечевой артерии по методу Н.С.Короткова. Манжетки помещают на уровне верхней и нижней трети бедра и голени. Перед началом исследования трижды определяют АД на плечевой артерии. Для последующих расчетов выбирается наибольшее значение давления. Затем приступают к измерению регионарного систолического АД в отдельных сегментах артерий нижних конечностей: в проксимальном и дистальном отделах бедренной арте-
57
рии, в подколенной артерии и в артериях голени. Ультразвуковой датчик устанавливают в третьей или четвертой позициях и получают допплеровское изо-
бражение кровотока |
в передней |
или задней тибиальной артерии. После этого |
|
||||
в манжетку, установленную на уровне верхней |
трети бедра, нагнетают воздух |
|
|||||
несколько |
выше |
значения |
в |
момент |
полного |
прекращения |
кровото |
в тибиальной |
артерии. Затем медленно |
выпускают воздух, |
снижая давление |
|
|||
в манжетке и тем самым уменьшая сжатие артерии. При давлении в манжетке чуть ниже систолического артерия начинает пропускать в систолу первые пульсовые волны, которые фиксируются ультразвуковым датчиком. Так же определяют систолическое АД на всех четырех уровнях артериальной системы ниж-
них конечностей. В норме систолическое АД на ногах выше давления в плечевой артерии на 20–40 мм. рт. ст.
Абсолютное значение систолического АД в артериях ног зависит не только от степени стеноза, но и от величины системного АД, измеряемого в плечевой артерии. Поэтому для оценки степени изменения регионарного АД используют относительные показатели: “лодыжечный индекс давления” (ЛИД), где АДлод и АДплеч - уровень АД в лодыжечной(передней или задней тибиальной)
иплечевой артериях.
Вдиагностике окклюзии артерии нижних конечностей анализ спектра допплерограмм, зарегистрированных при прямой локации артерии, обладает большей информативностью, чем измерение регионарного систолического АД, поскольку выраженное развитие коллатералей может нивелировать падение давления проксимальнее места окклюзии. Для оценки степени уплотнения сосудистой стенки и изменений ее эластичности у больных атеросклерозом может быть использован простой неинвазивный способ определения скорости пульсовой волны.
Для определения этого параметра гемодинамики используют сфигмограммы центрального и периферического артериального пульса. Для этого синхронно регистрируют сфигмограммы сонной, бедренной и лучевой артерий и опре-
деляют время запаздывания периферического пульса по отношению к- цен тральному (Dt). Измерив расстояние между точками регистрации сфигмограм-
мы (СФ) сонной и бедренной, сонной и лучевой артерий (L 1, 2), рассчитывают скорость распространения пульсовой волны по сосудам эластического типа(на участке сонная - бедренная артерия) и мышечного типа (на участке сонная - лучевая артерия) по формуле: где V - скорость распространения пульсовой волны; Dt - время запаздывания периферического пульса по отношению к центральному; L - расстояние между точками регистрации центрального и периферического пульса. В норме скорость распространения пульсовой волны, рассчитанная таким способом, составляет 450–800 см/с. Она в несколько раз выше скорости кровотока, скорости перемещения порции крови по артериальной системе. По скорости распространения пульсовой волны можно судить об эластичности артерий и величине их мышечного тонуса. Скорость распространения пульсовой
58
волны увеличивается при атеросклерозе аорты, гипертонической болезни и симптоматических гипертензиях и уменьшается при аортальной недостаточности, открытом артериальном (боталловом) протоке, при снижении мышечного тонуса сосудов, а также при облитерации периферических артерий, их стенозах и уменьшении ударного объема и уровня АД.
1.5. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
Каждый из основных ФР в отдельности (ГЛП, АГ, курение) в 2 раза увеличивает смертность больных от ИБС, а их сочетаниепримерно в5 раз. В многочисленных многоцентровых плацебо-контролируемых исследованиях показано, что активные мероприятия, направленные на устранение или ослабление действия основных ФР, закономерно сопровождаются снижением частоты ИМ, мозгового инсульта и внезапной сердечной смерти. При применении одного из эффективных гиполипидемических препаратовсимвастатина - вместе с достоверным уменьшением содержания в крови ХС ЛНП(на 38%) происходит снижение общей смертности больных атеросклерозом на 30%, числа “коронарных эпизодов” - на 40% и количества мозговых инсультовна 30% (ис-
следование 4S - Scandinavian Simvastatine Survival Study). Коррекция уровня АД и отказ от курения сопровождаются снижением числа повторных ИМ и частоты внезапной смерти.
Первым принципом лечения и профилактики атеросклероза, осложнений является устранение или ослабление действия основных модифицируемых ФР: ГЛП, АГ, курения, ожирения, гиподинамии, нарушений углеводного обмена. Этот принцип должен использоваться как для лечения больных, страдающих атеросклерозом, так и для профилактики заболевания у лиц, имеющих те или иные ФР. Второй принцип, используемый в лечении осложнений атеросклероза у пациентов с доказанным атеросклеротическим процессом, заключается в предупреждении возможной дестабилизации атеросклеротической бляшки.
Дестабилизация бляшки характеризуется истончением ее покрышки, разрывами фиброзной капсулы с частичным опорожнением липидного ядра, кровоизлияниями и тромбозами внутри атероматозной бляшки. Факторами, способствующими такой дестабилизации, являются: действие на эндотелий сосуда и фиброзную оболочку окисленных(модифицированных) ЛНП и ЛП (α), присутствующих в крови и в интиме сосудистой стенки; повышение напряжение сдвига при высоком уровне давления в аорте или при выраженной физической нагрузке; повышенная агрегация тромбоцитов, ведущая к формированию при-
стеночных тромбов в области атеросклеротической бляшки или тромбов во вновь образовавшейся капиллярной сети внутри самой атеросклеротической бляшки; активация перекисного окисления липидов, способствующая модификации ЛНП и ЛП(α); активная воспалительная и иммунная реакция в атеросклеротической бляшке; дисфункция эндотелия, усугубляемая повышенной активностью нейрогуморальных систем регуляции (САС, РАС).
59

Эффективность коррекции ФР атеросклероза, о которой упоминалось выше связана прежде всего с уменьшением вероятности дестабилизации атеросклеротической бляшки. Более выраженный положительный эффект можно ожидать при одновременном использовании антиагрегантной терапии, ферментов антиоксидантной защиты, цитопротекторов, коррекции активности нейрогуморальных систем регуляции (применение ингибиторов АПФ, β-адреноблокаторов).
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Основой немедикаментозного лечения у больных атеросклерозом являются: рациональное диетическое питание, направленное на коррекцию нарушений липидного обмена и снижение избыточной массы тела; отказ от курения; отказ от злоупотребления алкоголем; достаточная физическая активность; устранение отрицательных психоэмоциональных воздействий(по возможности). В большинстве случаев эти мероприятия предполагают существенное изменение образа жизни больного атеросклерозом и требует максимальной настойчивости и терпения.
Гиполипидемические диеты. Нарушения липидного обмена играют решающую роль в возникновении и прогрессировании атеросклероза. Особое значение имеют атерогенные ЛНП, а также ЛП (α), транспортные формы ХС. Модифицированные ЛНП способствуют: повреждению и дисфункции эндотелия с преобладанием продукции эндотелинов и других вазоконстрикторов и факторов клеточного роста; пролиферации гладкомышечных клеток и продукции ими факторов роста; образованию пенистых клеток, выделяющих цитокины и факторы роста; адгезии и агрегации тромбоцитов.
Снижение уровня общего ХС и ХС ЛНП в результате длительного применения гиполипидемических диет, может сопровождаться отчетливой тенденцией к уменьшению частоты возникновения ,ИБСИМ, мозгового инсульта и внезапной смерти. В таблице 5 приведены уровни липидов и их возможная связь с риском ИБС как одного из наиболее частых осложнений атеросклероза.
Таблица 5. Концентрация липидов и риск возникновения ИБС
Липиды (ммоль/л) |
|
Желатель- |
|
Погранич- |
|
Повышен- |
|
Высокий |
|
|
|
|
|||||
|
|
|
ный риск |
|
||||
|
ный уровень |
|
ный уровень |
|
|
риск ИБС |
||
|
|
|
|
ИБС |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общий ХС |
|
< 5,2 |
|
5,2–6,5 |
|
> 6,5 |
|
> 7,8 |
|
|
|
|
|
|
|
|
|
ХС ЛНП |
|
< 4 |
|
4–5 |
|
> 5 |
|
> 5 |
|
|
|
|
|
|
|
|
|
ХС ЛВП |
|
> 1 |
|
0,9–1 |
|
< 0,9 |
|
– |
|
|
|
|
|
|
|
|
|
ТГ |
|
< 2 |
|
2–2,5 |
|
> 2,5 |
|
– |
|
|
|
|
|
|
|
|
|
Соотношение |
|
< 3 |
|
3–3,5 |
|
3,5–4 |
|
> 40 |
ХС ЛНП/ХС ЛВП |
|
|
|
|
||||
|
|
|
|
|
|
|
|
60

За необходимый уровень общего ХС приняты его значения меньше5,2 ммоль/л, ХС ЛНП - ниже 4 ммоль/л и ТГ - меньше 2 ммоль/л. Значения липидов, превышающие этот уровень, могут считаться атерогенными и требуют назначения соответствующей гиполипидемической терапии. Абсолютный уровень общего ХС или ХС ЛНП не всегда достоверно отражает степень риска возникновения осложнений, необходимость назначения гиполипидемической терапии.
Многочисленные эпидемиологические, клинические данные свидетельствуют о том, что критический уровень ХС ЛНП, который является атерогенным, варьирует индивидуально в широком диапазоне. Поэтому уровень ХС ЛНП, который принят за усредненный показатель нормы для популяции в целом(“желательный” уровень), может оказаться атерогенным у лиц с высоким индивидуальным абсолютным риском развития осложнений атеросклероза. Последний определяется имеющимися у пациента другими, негиперлипидемическими, ФР (АГ, курение, ожирение, гиподинамия), наличием ИБС, сахарного диабета.
В таблице 6 представлена общая тактика гиполипидемического лечения больных атеросклерозом в зависимости от уровня ХС ЛНП, наличия ИБС, сахарного диабета и негиперлипидемических ФР. У больных с клиническими проявлениями атеросклероза (ИБС, ишемическая болезнь мозга, перемежающаяся хромота и аневризма аорты) или/и сахарным диабетом гиполипидемическая диетотерапия назначается при уровне ХС ЛНП, превышающем 100 мг/дл (2,6 ммоль/л), или при содержании общего ХС больше150 мг/дл (3,9 ммоль/л). У лиц без клинических проявлений атеросклероза, но имеющих перечисленные ФР, специальная диетотерапия назначается при более высоких уровнях общего ХС и ХС ЛНП.
Таблица 6. Гиполипидемическое лечение в зависимости от ХС ЛНП
Исходный
Целевой уровень
уровень Категории больных ХС ЛНП
ХС ЛНП
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мг/дл |
ммоль/л мг/дл |
|
ммоль/л |
||||
|
|
|
|
|
|
|
|
|
|
|
Диетотерапия |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Нет клинических признаков атеросклеро- |
|
|
> 160 |
|
> 4,1 |
|
< 160 |
|
< 4,1 |
|
|
|
|
|
|
||||||
за* + 1 ФР ** |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нет клинических признаков атеросклеро- |
|
|
> 130 |
|
> 3,4 |
|
< 130 |
|
< 3,4 |
|
за* + 2 ФР ** |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Наличие клинических признаков атеро- |
|
|
> 100 |
|
> 2,6 |
|
< 100 |
|
< 2,6 |
|
склероза или/и сахарного диабета* |
|
|
|
|
|
|
|
|
|
|
Липидснижающие лекарственные средства |
|
|
|
|
||||||
Нет клинических признаков атеросклеро- |
|
> 190 |
|
> 4,9 |
|
< 160 |
|
< 4,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
61
за* + 1 ФР ** |
|
После 6 мес. дие- |
|
|
||
|
|
тотерапии |
|
|
||
|
|
|
|
|
|
|
Нет клинических признаков атеросклеро- |
> 160 |
|
> 4,1 |
< 130 |
< 3,4 |
|
После 6 мес. дие- |
|
|
||||
|
|
|||||
за * + 2 ФР ** |
|
|
|
|||
|
|
тотерапии |
|
|
||
Наличие клинических признаков |
атеро- |
> 130 |
|
> 3,4 |
|
|
|
|
|
|
|||
После 6–12 не- |
< 100 |
< 2,6 |
||||
склероза или/и сахарного диабета* |
|
дель диетотера- |
|
|
||
|
|
|
пии |
|
|
|
Примечания: * - клинические признаки атеросклероза - ИБС, ишемическая болезнь мозга, перемежающаяся хромота, аневризма аорты; ** - к факторам риска атеросклероза (ФР) отнесены курение; АД 140/90 мм рт. ст.; ХС ЛВП < 40 мг/дл у мужчин и< 45 мг/дл - у женщин; наличие ИБС и других проявлений атеросклероза у ближайших родственников(для мужчин моложе 55 лет, для женщин моложе 65 лет).
Принципы лечебной диеты. На основании современных представлений об этиологии и патогенезе атеросклероза, анализа многочисленных исследований сформулированы следующие принципы лечебной диеты больных атеросклерозом.
1.Индивидуально подобранное снижение общей энергетической ценности пищевого рациона. Предложено множество диет, основанных на этом принципе, многие из которых неплохо зарекомендовали себя. Однако в последние годы большинство исследователей склоняются к тому, что резкого снижения суточного калоража у больных атеросклерозом, особенно при наличии сопутствующих заболеваний сердечно-сосудистой системы, целесообразно избегать и применять его в качестве кратковременной мотивационной меры. Оптимальным является применение гипокалорийных диет с умеренным ограничением суточного калоража до 2000 ккал.
2.Ограничение в пищевом рационе содержания жиров, обладающих высо-
кой энергетической ценностью. Рекомендуется использование диет с ограничением содержания жиров до 25–30% от общей энергетической ценности пищи (“низкожировые” диеты). Несколько недавних исследований убедительно показали, что “низкожировая” диета приводит к снижению общего ХС и избыточной массы тела даже в том случае, если общее потребление энергии не изменяется. Важно отметить, что уменьшение ХС и массы тела при соблюдении “низкожировой” диеты обычно умеренное, но вполне достаточное для получения положительного клинического эффекта. Более значительное снижение жиров в пищевом рационе(до 10% от суточной калорийности) показано только больным с высокой гипертриглицеридемией(более 8,5 ммоль/л), пациентам с семейной гиперхолестеринемией.
62
3. Целесообразным является резкое уменьшение потребления насыщенных жирных кислот (до 7–10% от общей энергетической ценности пищи), поскольку их количество в пищевом рационе достоверно связано с риском развития ИБС и других осложнений атеросклероза. Длинноцепочные насыщенные жирные кислоты влияют на процесс эстерификации свободного ХС и тем самым увеличивают регуляторный пул свободного ХС в печени, что приводит к увеличению концентрации ХС в гепатоцитах. В результате по механизму обратной связи снижается синтез специфических ЛНП-рецепторов в печеночных клетках. По-
следние перестают захватывать и утилизировать циркулирующий в крови ХС ЛНП. Употребление в пищу продуктов, содержащих большое количество насыщенных жирных кислот (сливочное и бутербродное масло, говяжий, бараний и свиной жир, пальмовое масло, твердые сорта маргарина), способствует увеличению содержания общего ХС и ХС ЛНП в крови.
4. Увеличение потребления мононенасыщенных и полиненасыщенных ЖК, которые, увеличивают активность ЛНП-рецепторов. Мононенасыщенные ЖК в относительно большом количестве содержатся в арахисовом, оливковом, подсолнечном и кукурузном маслах. У больных атеросклерозом их количество должно быть увеличено до10–15% от общей калорийности пищи. Полиненасыщенные ЖК (линолевая кислота) также содержатся в растительных маслах (подсолнечном, кукурузном), морских продуктах, рыбе, птице, а также в мягких сортах маргарина. Рекомендуется увеличение полиненасыщенных ЖК до10% от общей суточной калорийности питания. Добиваться более высокого потребления полиненасыщенных ЖК нецелесообразно, так как при этом значительно увеличивается общая калорийность пищи. Соотношение полиненасыщенных и насыщенных ЖК в гиполипидемической диете должно быть больше1,0–1,4.
Только за счет изменения соотношения различных классов ЖК и назначения низкожировой диеты удается добиться примерно десятипроцентного снижения уровня ХС (на 0,6 ммоль/л), что соответствует уменьшению риска ИБС на20– 39%.
5. Изменение соотношения простых и сложных углеводов в пищевом -ра ционе. В составе рекомендуемых“низкожировых” диет на долю углеводов приходится около 55–60% общей калорийности питания. Резко ограничивается или полностью исключается потребление легкоусвояемых простых углеводов, содержащихся, в кондитерских изделиях (сахар, варенье, конфеты). Углеводы должны поступать в составе овощей, зелени, не очень сладких фруктов и ягод,
обладающих невысокой энергетической ценностью и большим объемом и обеспечивающих субъективное насыщение больных. Особое значение имеет введение достаточного количества клетчатки в виде сырых овощей и фруктов (морковь, свекла, капуста), отрубей, бобовых (горох, фасоль).
6. Резкое уменьшение потребления продуктов, богатых холестерином. Этот принцип диетического питания имеет особое значение. Чрезмерное поступление с пищей ХС увеличивает в печени внутриклеточный пул свободного(неэс-
63

терифицированного) ХС, что |
по |
механизму |
обратной |
связи приводит |
к снижению активности ЛНП-рецепторов гепатоцитов и уменьшению катабо- |
||||
лизма ХС ЛНП и повышению в плазме содержания общего ХС и ХС ЛНП. Об- |
||||
щее количество поступающего |
с |
пищей ХС |
должно быть |
меньше300 мг |
в сутки. |
|
|
|
|
Продуктами, богатыми ХС, являются почки (в 100 г продукта содержится 1126 мг ХС), консервированная печень трески (746 мг ХС), говяжья печень (438 мг ХС), красная и черная икра (до 300 мг ХС), яичный желток (200 мг ХС), сливочное масло (190 мг ХС), креветки (150 мг ХС), крабы, кальмары (95 мг ХС), сырокопченая колбаса (105 мг ХС), говяжий, бараний и свиной жир(около 100 мг ХС), жирные сорта мяса, птицы (таблица 7).
Таблица 7. Содержание холестерина в пищевых продуктах
Готовые продукты |
ХС, |
|
Готовые продукты |
|
ХС, |
||
|
|
||||||
мг |
|
|
мг |
||||
|
|
|
|
|
|
||
Молоко 6%, ряженка, 1 стакан |
47 |
Сосиски, 100 г |
|
|
32 |
||
|
|
|
|
|
|
|
|
Молоко, 3,2%, |
кефир 3,2%, 1 |
29 |
Колбаса вареная, 100 г |
|
60 |
||
стак. |
|
|
|||||
|
|
|
|
|
|
|
|
Кефир 1%, молоко 1%, 1 стакан |
6 |
Колбаса варенокопченая, 100 г |
90 |
||||
Кефир, молоко |
обезжир.,1 ста- |
2 |
Колбаса сырокопченая, 100 г |
105 |
|||
кан |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Куры |
(мясо |
темное): |
ножки, |
91 |
Молоко сгущеное, 1 ч./ложка |
2 |
спинка, шейка · с кожей, |
100 г · |
89 |
|||
|
|
|
без кожи, 100 г |
|
|
||
Сметана 30%, 100 г |
91 |
Куры (мясо белое): крылья, гру- |
80 |
||||
динка, 100 г |
|
|
|||||
|
|
|
|
|
|
||
Сметана 30%, 1 ч./ложка |
5 |
Гусь, утка, 100 г |
|
|
91 |
||
|
|
|
|
|
|
||
Сливки 20%, 100 г |
63 |
Печень, 100 г |
|
|
438 |
||
|
|
|
|
|
|
||
Творог 18%, 100 г |
57 |
Почки, 100 г |
|
|
1126 |
||
|
|
|
|
|
|
|
|
Творог 9%, 100 г |
|
32 |
Вымя, 100 г |
|
|
360 |
|
Творог обезжиренный, 100 г |
9 |
Желудок куриный, 100 г |
|
212 |
|||
|
|
|
|
|
|
||
Сырок творожный, 100 г |
71 |
Язык, 100 г |
|
|
90 |
||
Сыр жирный, 25 г |
23 |
Консервы рыбные в собственном |
95 |
||||
соку, 100 г |
|
|
|||||
|
|
|
|
|
|
||
Сыр нежирный, 25 г |
17 |
Консервы рыбные в томате, 100г |
51 |
||||
|
|
|
|
|
|
||
Сыр плавленый, 25 г |
16 |
Печень |
трески |
консервир, 100 г |
746 |
||
Брынза, рассольные сыры, 25 г |
17 |
Рыба: треска, хек, судак, тощая, |
65 |
||||
100 г |
|
|
|
||||
|
|
|
|
|
|
|
|
64
|
|
Рыба: морской окунь, сом, карп, |
|
|
|
|
|
||
Мороженое молочное, 100 г |
14 |
лещ, сельдь, осетр средней жир- |
88 |
|
|
|
ности, 100 г |
|
|
Мороженое сливочное, 100 г |
35 |
Крабы, кальмары, 100 г |
95 |
|
|
|
|
|
|
Мороженое пломбир, 100 г |
47 |
Креветки, 100 г |
150 |
|
Масло сливочное, 5 г (1 чай- |
12 |
Красная, черная икра, 100 г |
300 |
|
ная/ложка) |
||||
|
|
|
||
Баранина вареная, 100 г |
98 |
Яйцо (желток) |
202 |
|
|
|
|
|
|
Говядина вареная, 100 г |
94 |
Шпиг, корейка, грудинка, 100 г |
80 |
|
|
|
|
|
|
Свинина без жира, вареная, 100 г |
88 |
Бараний, говяжий жир, 5 г (1 |
4 |
|
чайная/ложка) |
||||
|
|
|
||
Кролик вареный, 100 г |
90 |
Свиной, куриный жир, 5 г |
5 |
|
|
|
|
|
Гиполипидемические диеты I и II ступени. Указанные принципы диети-
ческого лечения используются при разработке большинства“низкожировых” и гипокалорийных диет. Широкое распространение получили рекомендации Американской ассоциации сердца, согласно которым для лечения больных атеросклерозом используются 2 типа гиполипидемических диет (таблица 8).
В этих диетах предусмотрено ограничение потребления животных жиров, ограничение количества вводимых насыщенных ЖК, увеличение мононенасыщенных и полиненасыщенных ЖК.
Таблица 8. Характеристика гиполипидемических диет
Название
Краткая характеристика диет
диеты
55–60% энергетических потребностей организма удовлетворяется за счет сложных углеводов (фрукты, овощи)
Менее 30% энергетических потребностей удовлетворяется за сче жиров
Диета Насыщенные ЖК составляют только8–10% от общей энергетиче-
ской потребности организма
I
Соотношение полиненасыщенных и насыщенных ЖК= 1,0 Соотступени ношение полиненасыщенных, мононенасыщенных и насыщенных
ЖК - 1:1:1
Потребление ХС менее 300 мг в день
Количество водорастворимой клетчатки составляет не менее16 г в день
65

|
|
|
55–60% энергетических потребностей организма удовлетворяется за |
|
|
|
|
счет сложных углеводов (фрукты, овощи). |
|
|
|
|
Менее 30% энергетических потребностей удовлетворяется за сче |
|
|
Диета |
|
жиров |
|
|
|
Насыщенные ЖКсоставляют 17% от энергетической потребност |
|
|
|
II |
|
организма |
|
|
|
Соотношение полиненасыщенных и насыщенных ЖК> 1,4, соотно- |
|
|
|
|
|
|
|
|
ступени |
|
шение полиненасыщенных, мононенасыщенных и насыщенных ЖК |
|
|
|
- 1:1:0,7 |
|
|
|
|
|
Потребление ХС менее 300 мг в день |
|
Количество водорастворимой клетчатки составляет не менее16 г
вдень
Вдиете I ступени (Step I) потребление насыщенных жиров составляет8– 10% от общей калорийности пищи, а соотношение полиненасыщенных и насыщенных ЖК - больше 1. В диете II ступени (Step II) предусмотрено еще большее ограничение насыщенных ЖК(17%) и соотношение полиненасыщенных и насыщенных ЖК больше1,4. В обоих типах диет за счет жиров удовлетворяется менее 30% энергетических потребностей организма. Количество экзогенного ХС не превышает 300 мг в сутки. К сожалению, в реальной клинической практике около 75% больных ожирением и ГЛП, которым была назначена гипокалорийная диета с низким содержанием жиров в пище, после относитель-
но короткого периода эффективного снижения ХС |
и избыточной массы тела |
в течение 1–2 лет вновь набирают большую часть |
из потерянного веса. Это |
объясняется отказом многих больных от строгого соблюдения диетических рекомендаций, связанных с существенным ограничением в пищевом рационе жира и полноценного белка. Поэтому современные диетические рекомендации предусматривают не резкое ограничение общей калорийности питания. Акцент делают на изменение соотношения полиненасыщенных и насыщенных ЖК.
По |
данным метаанализа 19 рандомизированных |
исследований, в которых |
||
изучалась эффективность описанных диетических вмешательств, при использо- |
||||
вании |
гиполипидемической |
диетыI ступени |
концентрация |
общего |
ХС снижалась на 3%, а II ступени - на 6,1%. Тем не менее, даже такой гиполипидемический эффект заметно уменьшает многие клинические проявления ате-
росклероза. Речь |
идет о |
положительном |
влиянии“ зкожировых” диет |
|
с повышенным соотношением |
полиненасыщенных и насыщенных |
ЖК на - со |
||
стояние фиброзной оболочки атеросклеротической бляшки, что уменьшает ве- |
||||
роятность ее разрывов и формирование пристеночных тромбов. Этот эффект |
||||
может усилен |
включением |
в состав диет |
α-линоленовой |
кислоты-3- и ω |
полиненасыщенных ЖК.
66
Диета с повышенным содержанием α-линоленовой кислоты(средизем-
номорская диета). В этой диете предусмотрено существенное ограничение говяжьего, бараньего и свиного мяса, которое заменяется мясом домашней птицы. Рекомендуется употребление больших количеств корнеплодов, зелени, фруктов, морской рыбы. Сливочное масло и сливки заменяются оливковым
ирапсовым маслом, а также маргарином мягких сортов. Количество пищевого ХС не превышает 200–220 мг в сутки, а общее содержание жиров - не больше 30% от энергетической потребности. В состав средиземноморской диеты включено большое количество олеиновой(13% суточной калорийности пищи), линолевой (0,8%) и эйкозопентаеновой кислот. Количество пищевых волокон увеличено до 20 г в сутки. При длительном применении этой диеты летальность
исердечно-сосудистая заболеваемость в исследуемой группе снизилась на 73%. Частота кардиальной смертности, нефатального ИМ, нестабильной стенокар-
дии, СН, мозгового инсульта, тромбоэмболий оказалась в3,1 раза ниже, чем в контрольной группе с таким же гиполипидемическим эффектом.
Диеты с высоким содержанием ω-3-полиненасыщенных кислот. В по-
следние годы показано, что применение диет с повышенным содержанием ω-3- полиненасыщенных ЖК (эйкозопентаеновой и докозогексаеновой), содержащихся в жире морских рыб, у больных с атеросклерозом и ИБС снижает коронарную смертность на 30% и внезапную сердечную смерть на45%. Доказано, что употребление жира морских рыб, отличающегося высоким содержанием эйкозопентаеновой и докозогексаеновой ЖК, на 25–30% уменьшает уровень ТГ плазмы, оказывая незначительное влияние на уровень общего ХС и ХС ЛНП. Важной стороной действия ω-3-полиненасыщенных ЖК является их положительное влияние на эндотелиальную функцию и агрегацию тромбоцитов. Как известно, эйкозопентаеновая кислота ингибирует обмен арахидоновой кислоты,
снижая продукцию тромбоксана А и увеличивая синтез простациклина, что
2
уменьшает агрегацию тромбоцитов и склонность больных к тромбообразованию. ω -3-полиненасыщенные ЖК способствуют также увеличению вариабельности сердечного ритма и снижению риска желудочковых аритмий у больных
атеросклерозом и ИБС. Независимо от |
влияния на уровень общего ХС |
и ХС ЛНП, прослеживается отчетливое |
кардиопротективное действие -3ω- |
полиненасыщенных ЖК. |
|
Эйкозопентаеновая и докозогексаеновая ЖК содержатся в большом количестве в жире морских рыб, причем максимальным лечебным эффектом обладает жир, получаемый из тушек рыб в виде пищевого ихтиенового масла и эйконола. Пищевое ихтиеновое масло принимают в течение 3–4 месяцев в дозе 30 мл в сутки. Широко используется также отечественный препарат эйконол, который содержит жир морских рыб, огатый ω-3-полиненасышенными ЖК, а также витамины А, Е и D. Эйконол выпускается в капсулах по 1,0 г, которые принимают 4 раза в день. Продолжительность курса лечения - 2–3 месяца. Созданы и другие, в том числе таблетизированные, формы, содержащие эйкозопентаеновую и докозогексаеновую кислоты.
67
Отсутствие желательного эффекта от применения гиполипидемических диет является основанием для начала лекарственной терапии атеросклероза. Со-
временные гиполипидемические препараты целесообразно назначать всем больным с установленным диагнозом атеросклероза или/и сахарного диабета при уровне ХС ЛНП, превышающем 100 мг/дл (2,6 ммоль/л), не дожидаясь результатов пробной диетотерапии в течение6–12 недель, как это рекомендуется национальной образовательной. Программой борьбы с холестерином. При отсутствии клинических проявлений атеросклероза или/и сахарного диабета можно ориентироваться на рекомендации, приведенные в ранее.
В клинической практике в настоящее время используются несколько классов гиполипидемических препаратов: 1. Статины или ингибиторы 3-гидрокси- 3-метилглютарил-КоА-редуктазы (ГМГ-КоА-редуктазы). 2. Секвестранты желчных кислот. 3. Фибраты. 4. Никотиновая кислота и ее производные.
Статины
Относятся к новому классу монокалинов, обладающих выраженным гиполипидемическим эффектом. Это единственный класс гиполипидемических лекарственных средств (ЛС), для которых доказана эффективность в уменьшении смертности, обусловленной ИБС, а также увеличения продолжительности жиз-
ни |
больных |
атеросклерозом. Механизм |
действия |
статинов |
заключается |
|||
в мощном конкурентном ингибировании ГМГ-КоА-редуктазы- фермента, уча- |
||||||||
ствующего в синтезе холестерина печеночной клеткой на самых ранних стадиях |
||||||||
этого процесса. |
|
|
|
|
|
|
||
|
В результате |
снижается |
синтез |
ХС гепатоцитами |
и |
его содержание |
||
в |
клетках, |
что |
приводит |
к компенсаторному |
повышению |
числа - ЛНП |
||
рецепторов, |
а также к усиленному захвату и утилизации ХС |
ЛНП, циркули- |
||||||
рующих в крови. Повышается также метаболизм других ЛП, содержащих белок апо-В, который распознается активированными ЛНП-рецепторами гепатоцитов.
Статины уменьшают эстерификацию ХС в клетках различных тканей, в том числе в энтероцитах, гепатоцитах, клетках сосудистой стенки. Это приводит к снижению всасывания ХС в кишечнике, секреции ЛОНП, наполнения макрофагов липидами, образования пенистых клеток и пролиферации гладкомышечных клеток, а также к нормализации повышенной агрегации тромбоцитов.
Происходит уменьшение размеров и стабилизация атеросклеротических бляшек, уменьшается вероятность их разрыва и пристеночного тромбообразования. В клинической практике наиболее широко используются4 препарата, относящихся к группе статинов: ловастатин (мевакор); симвастатин (зокор); правастатин (липостат); флювастатин (лескол). Эти препараты получают из грибков Aspergillus terreus, Penicillium brevicompactum или синтетическим пу-
тем. В таблице 9 приведены рекомендуемые для длительного приема дозы.
68
Таблица 9. Рекомендуемые дозы статинов
Препарат |
Суточные дозы, мг/с |
||
|
|
||
взрослые |
пожилые |
||
|
|||
|
|
|
|
Ловастатин |
10–80 |
до 80 |
|
|
|
|
|
Симвастатин |
5–40 |
до 40 |
|
|
|
|
|
Правастатин |
10–40 |
20 |
|
Флювастатин |
20–80 |
20 |
|
|
|
|
|
Статины назначают в суточной дозе от10–20 мг до 80 мг однократно вечером во время приема пищи или двукратно(утром и вечером). Вечерний прием препаратов предпочтителен, поскольку скорость биосинтеза ХС оказывается наибольшей во время сна. Начальная доза приема статинов обычно не превышает 10–20 мг в сутки; она увеличивается каждые 4 недели, если не достигнут желаемый уровень ХС. При снижении уровня ХС ЛНП меньше2,6 ммоль/л (100 мг/дл) доза препарата снижается. Поддерживающая терапия проводится длительно, годами, под контролем показателей липидного обмена. Изредка (в 1–2% случаев) при применении статинов могут наблюдаться следующие побочные эффекты: метеоризм, диарея, запор, тошнота, боли в животе; головные боли, головокружение; мышечные судороги, миалгия, миозит; изменения функциональных проб печени; усталость, нарушения сна, расстройства вкуса, зуд кожи; тератогенный эффект.
Большинство из побочных эффектов носят временный характер и проходят после снижения дозировки или отмены препаратов. Заслуживает внимания влияние ингибиторов ГМГ-КоА-редуктазы на мышцы. У больных, принимающих эти ЛС, может наблюдаться транзиторное возрастание креатинфосфокиназы (КФК) без каких-либо клинических симптомов. В редких случаях наблюдается миалгия, а в исключительных случаях - признаки миопатии вплоть до развития выраженного рабдомиолиза (острого воспаления и распада поперечнополосатых мышц, ведущего к миоглобулинурии и острой почечной недостаточности). Миопатия наблюдалась у больных, одновременно со статинами лечившихся иммунодепрессантами (циклоспорин), фибратами (гемфиброзил) или никотиновой кислотой (ниацин). У больных, получавших ингибиторы ГМГ- КоА-редуктазы без применения указанных препаратов, миопатия развивалась в 0,1% случаев. Возможность негативного влияния статинов на мышцы следует учитывать у всех пациентов с диффузными миалгиями, миозитами различного генеза и повышением уровня КФК.
При длительном лечении статинами следует каждые4–6 недель контролировать активность трансаминаз и других ферментов в крови. При возрастании
на фоне лечения |
статинами уровня ферментов 3в и более раз по сравнению |
с нормой следует |
оценить возможный риск продолжения лечения. Умеренное |
69

повышение активности трансаминаз (менее чем в 3 раза по сравнению с верхней границей нормы) при отсутствии каких-либо клинических проявлений не требует немедленной отмены препаратов.
Прием препаратов противопоказан в следующих клинических ситуациях: 1. Активные патологические процессы в печени или исходно повышенный уровень печеночных ферментов. 2. Беременность и кормление грудью. 3. Повышенная чувствительность к компонентам препаратов.
Поскольку почки почти не участвуют в выведении из организма ингибиторов ГМГ-КоА-редуктазы, изменений дозировок этих ЛС у пациентов с почечной недостаточностью не требуется. Лечение статинами ведет к значительному и стабильному снижению общего ХС и ХС ЛНП(23–61%). Эффект зависит от суточной дозы препаратов. Каждое удвоение суточной дозы статинов сопровождается дополнительным снижением ХС ЛНП на 6–7%. Под влиянием лечения уменьшается также содержание апо-В и апо-Е(15–25%). По данным многоцентровых рандомизированных плацебо-контролируемых исследований, при длительном применении ингибиторов ГМГ-КоА-редуктазы наблюдается достоверное снижение смертности от ИБС - на 42%, общей смертности - на 30%, частоты нефатальных коронарных событийна 34%, уменьшение риска мозговых инсультов - на 21%. Статины - препараты первого выбора в лечении больных атеросклерозом с повышенным уровнем общего ХС и ХС ЛНП (ГЛП IIа типа).
Фибраты
Производные фибровой кислоты используются для лечения ГЛП, сопровождающихся высоким уровнем ТГ (ГЛП IIб, III, IV, V типов). Механизм действия фибратов заключается в увеличении активности липопротеинлипазы, расщепляющей ЛОНП. Фибраты вызывают небольшое повышение уровня ЛВП и белков апо-АI и апо-АII в крови. Некоторые из препаратов этого класса(фенофибрат, безафибрат) ускоряют метаболизм ХС в печени, снижая активность ГМГ-КоА-редуктазы.
Под влиянием фибратов происходит снижение содержания фибриногена и агрегации тромбоцитов, активация фибринолиза. К производным фибровой кислоты относятся: гемфиброзил; фенофибрат; безафибрат; ципрофибрат. В таблице 10 приведены суточные дозы фибратов, рекомендуемые для лечения больных атеросклерозом.
Таблица 10. Дозы фибратов в лечении атеросклероза
Препарат
Дозы (мг), кратность приема
Гемфиброзил
600 ґ 2 раза в сутки или
900 1 раз (вечером)
70
Фенофибрат |
100 ґ 2–3 раза в сутки |
Липантил 200М |
200 1 раз в сутки |
|
|
Безафибрат |
200 ґ 3 раза в сутки |
Ципрофибрат |
100–200 1 раз в сутки |
|
|
Клиническая эффективность фибратов выражена в меньшей степени, чем ингибиторов ГМГ-КоА-редуктазы. При длительном лечении фибратами наблюдается снижение уровня ТГ (на 28-38%), умеренное повышение ХС ЛВП (на 8– 9%), тогда как уровень общего ХС и ХС ЛНП не изменяется или незначительно уменьшается (на 6–10%). Эти изменения сопровождаются уменьшением смертности от ИБС (на 34%).
Пи лечении фибратами больных с ГЛПIV типа возможно повышение содержания в крови ХС ЛНП и общего ХС. Побочные эффекты фибратов многочисленны, хотя и наблюдаются относительно редко. Наиболее значимыми из них являются: миалгии, миопатии, слабость мышц, сопровождающиеся повышением КФК в крови; повышение литогенного индекса и образование камней в желчевыводящих путях; боли в животе, тошнота, анорексия, метеоризм, запоры; повышение активности печеночных ферментов; головная боль, обмороки, парестезии, головокружения, сонливость, депрессия, снижение либидо, гипоензия; кожные аллергические реакции; анемия, лейкопения.
Лечение фибратами противопоказано в следующих клинических ситуациях. 1. Печеночная или почечная недостаточность. 2. Желчнокаменная болезнь, хронический холецистит, первичный билиарный цирроз печени. 3. Беременность и кормление грудью. 4. Гипопротеинемия. 5. Гиперчувствительность к препаратам. При применении фибратов наблюдается усиление эффекта непрямых антикоагулянтов.
Секвестранты желчных кислот
Используются в качестве дополнительных ЛС, усиливающих гиполипидемическое действие статинов или фибратов. Возможно самостоятельное назначение секвестрантов желчных кислот в случае непереносимости статинов. ЛС этой группы связывают желчные кислоты в кишечнике, замедляя их реабсорбцию и увеличивая экскрецию с калом. Вследствие этого возрастает синтез желчных кислот в печени из ХС, содержание которого в гепатоцитах снижается. Это приводит к увеличению активности ЛНП-рецепторов печеночной клетки. Ускоряется процесс утилизации ХС ЛНП, уровень которого в плазме начинает снижаться. К числу секвестрантов желчных кислот относятся колестира-
мин, колестипол. При их длительном применении уровень общего ХС и ХС ЛНП снижается на 10–20%. Одновременно наблюдается умеренное повышение ТГ и ХС ЛВП.
71
Секвестранты желчных кислот сравнительно хорошо переносятся больными, поскольку они не всасываются в кишечнике и не оказывают токсического действия на организм. При приеме колестирамина и колестипола возможны запоры, метеоризм, тошнота, стеаторея, анорексия, панкреатит, геморроидальные
кровотечения, кровотечения из |
язвы желудка и двенадцатиперстной кишки, |
а также нарушение всасывания |
других :ЛСb-адреноблокаторов, сердечных |
гликозидов, тиазидовых диуретиков, непрямых антикоагулянтов. При длительном применении возможно нарушение всасывания жирорастворимых витаминов (А, D, К) и фолиевой кислоты. Лечение секвестрантами желчных кислот противопоказано при значительной гипертриглицеридемии(более 350– 500 мг/дл); при обструкции желчевыводящих путей; при гиперчувствительности к препаратам; при беременности.
Никотиновая кислота и ее производные
Никотиновая кислота представляет собой водорастворимый витамин группы В (витамин РР). В дозах 1,5–3 г в сутки она оказывает выраженное гиполипидемическое действие, причем под влиянием никотиновой кислоты происходит снижение не только уровня ТГ и ЛОНП(на 20–40% в зависимости от типа ГЛП и дозы препарата), но и общего ХС и ХС ЛНП(на 10–70%). На 25–30% возрастает также уровень ХС ЛВП.
В отличие от всех других гиполипидемических препаратов, никотиновая кислота обладает уникальной способностью на30% снижать уровень ЛП (a), обладающих выраженной атерогенной активностью. Длительное применение никотиновой кислоты приводит к уменьшению частоты развития ИМ(27%)
и значительному снижению смертности от ИБС и общей смертности больных атеросклерозом. Никотиновая кислота подавляет липолиз жировой ткани, уменьшает мобилизацию свободных ЖК и их приток в печень, где происходит синтез ТГ и ЛОНП. В результате продукция ТГ и ЛОНП значительно снижается. Абсолютными показаниями к назначению никотиновой кислоты является ГЛП V типа, осложнившаяся острым панкреатитом, который в случае рецидивирования может представлять непосредственную угрозу для жизни больного. Длительное лечение никотиновой кислотой показано при всех остальных атерогенных типах ГЛП (IIа, IIб, III, IV).
Длительное применение этого препарата ограничено в связи с большим количеством побочных эффектов, вызванных преимущественно выраженными сосудистыми реакциями. Значительная вазодилатация при приеме никотиновой кислоты обусловлена увеличением продукции сосудорасширяющих простагландинов. Их эффект проявляется в виде приступообразных приливов жара, гиперемии лица и верхней половины туловища, сопровождающихся зудом кожи. В большинстве случаев эти явления проходят или ослабевают через несколько недель приема никотиновой кислоты. Для уменьшения выраженности сосудистых реакций рекомендуют постепенно наращивать суточную дозу препарата,
72
начиная с 300 мг в сутки, каждую неделю увеличивая дозу на 300 мг. За 30 мин до очередного приема никотиновой кислоты целесообразно назначение аспирина в дозе 325 мг, который подавляет метаболизм арахидоновой кислоты.
К числу побочных эффектов относятся: повышение уровня глюкозы крови; повышение уровня мочевой кислоты крови; гепатотоксические реакции с повышением активности трансаминаз и холестатической желтухой; обострение хронического гастрита, язвенной болезни двенадцатиперстной кишки и желудка в связи с раздражающим действием никотиновой кислоты на слизистые; возникновение суправентрикулярных аритмий; увеличение наклонности к образованию желчных камней. Современные препараты никотиновой кислоты пролонгированного действия (эндурацин) отличаются меньшей частотой сосудистых реакций, но большей гепатотоксичностью.
Прием никотиновой кислоты противопоказан при тяжелых формах АГ; при подагре; при язвенной болезни желудка и двенадцатиперстной кишки; при тяжелых заболеваниях печени и снижении ее функционального состояния; при беременности и кормлении грудью; при индивидуальной гиперчувствительности к препарату.
Необходимо отметить, что длительное применение современных липидснижающих лекарственных препаратов, наряду со строгим выполнением диетических рекомендаций и воздействием на другие ФР(курение, АГ, сахарный диабет, гиподинамия, ожирение и др.) существенно снижает число коронарных, мозговых событий и смертности.
73
Глава II
АТЕРОСКЛЕРОЗ ПРИ САХАРНОМ ДИАБЕТЕ
2.1. ОПРЕДЕЛЕНИЕ, ОСОБЕННОСТИ ПАТОГЕНЕЗА ПРИ САХАРНОМ ДИАБЕТЕ
Атеросклеротические поражения артерий крупного, среднего и малого калибра у больных сахарным диабетом(СД) определяются как диабетические макроангиопатии. Появление специального термина для обозначения атеросклероза у лиц с диабетом обусловлено ранним его развитием и злокачественным течением у таких пациентов. Установлено, при одинаковой степени дислипидемии атеросклероз у больных СД развивается вдвое быстрее, чем у людей без нарушений углеводного обмена. В этой связи проблема диагностики и лечения ИБС при сахарном диабете представляется весьма актуальной.
У больных сахарным диабетом злокачественному течению атеросклероза способствуют гликирование липопротеидов и их перекисная модификация, что способствует существенному увеличению их атерогенности, а также наклонность к гиперкоагуляции.
Кроме того атерогенной модификации ЛПНП способствует триглицеридемия, часто наблюдающаяся у лиц с сахарным диабетом2 типа. Поражению органов-мишеней также способствует сочетание макро- и микроангиопатий, которое значительно ухудшает перфузию тканей и затрудняет образование коллатералей.
2.2. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
В начальной стадии СД течение атеросклероза скрытое. В связи с этим обосновано выделение доклинического периода атеросклероза. В этот период возможны изменения на биохимическом уровне. В плазме крови определяются три основных класса липидов: холестерина и его эфиров, триглицеридов, фосфолипидов. Большое клиническое значение имеет определение в крови холестерина в ЛПВП, ЛПНП, ЛПОНП.
ЛПВП при электрофорезе на бумаге вместе с а-глобулинами, ЛПНП движутся с в-глобулинами, ЛПОНП - на бумаге оказываются между а-ЛП и в-ЛП. Полученные результаты оценивают по уровню холестеринового коэффициента: это отношение суммы холестерина ЛПНП и ЛПОНП к холестерину ЛПВП. Можно рассчитывать этот коэффициент и по другой формуле: отношение раз-
ности между общим холестерином и холестерином ЛПВП к холестерину ЛПВП. У здоровых мужчин 30 лет он равен 2, 5, у мужчин в возрасте 40-60 лет без симптомов ИБС - 3-3,5. У больных ИБС коэффициент атерогенности достигает значений - 4-6.
В период клинических проявлений аспекты атеросклероза рассматриваются как основные прямые последствия в виде: ишемической болезни сердца, стенокардии, инфаркта миокарда, атеросклеротического кардиосклероза, внезапной смерти, ишемической болезни мозга (острое нарушение мозгового кровообращения, ишемическая энцефалопатия, ишемическая болезнь органов
74
брюшной полости, атеросклероз почечных артерий, ишемическая болезнь конечностей). В клинике диабетических макроангиопатий наибольшее значение имеют ишемическая болезнь сердца, облитерирующий атеросклероз сосудов нижних конечностей и острые нарушения мозгового кровообращения.
Самой частой причиной ИБС у больных СД служит атеросклеротическое поражение коронарных артерий. Происходит сужение артерий, уменьшается кровоток, возникает ишемия миокарда. Неадекватное снабжение миокарда кислородом и питательными веществами приводят к нарушению важнейших функций: механической, биохимической, электрофизиологической.
Преходящая ишемия проявляется у больных СД приступами стенокардии, продолжительные приступы ишемии могут привести к появлению некроза участка миокарда. Типичным симптомом при ИБС является стенокардитический приступ. При этом больной жалуется на дискомфорт или боль за грудиной различной интенсивности. Боль носит возрастающе-убывающий характер, усиливается при физической нагрузке, стрессе, воздействии холодного воздуха. Типична иррадиация боли в левую руку, левое плечо. Купирование боли происходит в течение 5 минут сублингвальным приемом нитроглицерина.
При объективном осмотре обычно во время приступа стенокардии можно выявить небольшую тахикардию, признаки вегетативной лабильности, смещение границ относительной сердечной тупости влево, при аускультации 1 тон на верхушке может быть ослаблен, во II межреберье справа - акцент 2 тона.
Помогает верификации диагноза электрокардиографическое исследование: будет регистрироваться смещение сегментаSТ и инверсия зубца . ТВ трудных случаях проводят регистрацию ЭКГ при физических нагрузках, суточное мониторирование. Проведение ультразвукового исследования позволяет косвенно подтвердить ИБС, в частности выявляют зоны гипо-, акинезии, поражение клапанного аппарата.
Для изучения стенозов коронарных артерий используют инвазивный метод - коронарографию. Более подробно ИБС изложена в литературе, специально посвященной этой теме. У лиц с сахарным диабетом имеется ряд особенностей течения ишемической болезни сердца. У этих пациентов велика частота безболевых форм ИБС и инфаркта миокарда, что объясняют наличием диабетической нейропатии. Это обусловливает необходимость не только контроля гликемии, но и регистрации ЭКГ при любых "трудно объяснимых" ухудшениях состояния этих больных. Кроме того, у лиц с сахарным диабетом должно максимально широко использоваться суточное мониторирование ЭКГ в целях выявления безболевой ишемии.
У больных сахарным диабетом ИБС выявляется с одинаковой частотой у женщин и мужчин во всех возрастных группах, инфаркт миокарда у них развивается в 2-4 раза чаще, чем в общей популяции, часто имеет осложненное, рецидивирующее течение. Госпитальная летальность от инфаркта миокарда у пациентов с диабетом в 2 раза выше, чем у лиц без нарушений углеводного обмена.
При атеросклерозе артерий нижних конечностей больные СД предъявляют жалобы на«перемежающую хромоту», которая проявляется во время на-
75
грузки в виде усталости, приступообразной боли, судорог в голенях, обычно проходящих во время покоя. Прогрессирование атеросклеротического процесса приводит к появлению указанных симптомов в покое. Боли в покое проявляются симптомами интенсивного жжения в стопе и могут сопровождаться нарушением чувствительности и движения.
При объективном обследовании отличительным признаком является -ос лабление или исчезновение пульса на тыльной артерии стопы, бледность нижних конечностей при возвышенном положении конечности, утолщение ногтей, выпадение волос, атрофия кожи. Кожа на ноге холодная дряблая, отмечается гипотрофия конечности, возможно развитие гангрены. При аускультации можно выслушать сосудистые шумы вследствие турбулентности кровотока в аневризматических и стенотически измененных артериях.
Острая ишемия конечности проявляется синдромом«5 Р»: Pulselessness, Pain, Pallor, Paresthesia, Paralysis (отсутствие пульса, боль, бледность, наруше-
ние чувствительности и двигательных функций). При допплеровском ультразвуковом исследовании выявляют стенозы, оценивают состояние коллатералей. Атеросклероз сосудов нижних конечностей – частая находка у больных сахарным диабетом. Наиболее тяжелым клиническим проявлением поражения артерий ног у больных сахарным диабетом является ишемическая и нейроишемическая форма синдрома диабетической стопы.
2.3. ДИАГНОСТИКА СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
В процессе проведения диагностических мероприятий необходимо решение следующих задач: определить клиническую форму синдрома диабетической стопы, определить степень выраженности нейропатии и (или) ишемии, определить глубину язвенного поражения, оценить состояние костных структур, выявить патогенную микрофлору и определить ее чувствительность к антибиотикам.
Ошибки в диагностике могут приводить к неправильному выбору тактики оказания медицинской помощи. Нередко ампутации конечностей при нейропатически инфицированной форме синдрома проводятся необоснованно. Между тем, ранняя адекватная консервативная терапия позволяет избежать хирургического вмешательства в 90-95% случаев.
Осмотр ног - наиболее простой и эффективный метод выявления поражения стоп. Важно обратить внимание на наличие костно-суставных деформаций и отеков, выявление участков гиперкератозов и их расположение, на наличие язвенных дефектов, особенно в межпальцевых промежутках, остающихся незамеченными самими пациентами. Пальпаторно определяют пульсацию артерий стопы.
Важнейшим критерием дифференциального диагноза различных форм диабетической стопы является оценка характера болей. Для макроангиопатии (облитерирующего атеросклероза) характерна перемежающаяся хромота. Нейропатически обусловленный болевой синдром проходит при ходьбе и усиливается в ночное время. Ишемические боли несколько ослабевают при свешивании ног с края постели. Наличие язв или ампутаций в анамнезе является крайне
76
важным признаком развития новых поражений стоп. Следует помнить, что если у больного имеются другие поздние осложнения сахарного диабета(ретинопа-
тия и/или нефропатия), то вероятность развития язвенного дефекта особенно высока.
В оценке неврологического статуса самым ранним признаком развития нейропатической формы диабетической стопы является изменение вибрационной чувствительности, которые диагностируются с помощью градуированного камертона или специального прибора - биотензиометра. Легким ударом камертон приводится в состояние вибрации. Основание камертона прикладывается к участкам выступа костей стопы. Обычно это кончик большого пальца, основание первой плюсневой кости или лодыжки. Больного просят закрыть глаза и указать, когда исчезнут ощущения вибрации камертона.
Исследователь фиксирует уровень, которому соответствует исчезновение ощущения вибрации у пациента по точке схождения треугольников, удвоенных при движении дужек камертона. Снижением считаются показатели ниже6 условных единиц. С помощью биотензиометра определяется показатель, который называется порог вибрационной чувствительности. Кроме того, проводится исследование тактильной и температурной чувствительности, однако эти изменения наступают несколько позднее.
Тактильную чувствительность рекомендуется определять с помощью набора монофиламентов. Для исследования состояния артериального кровотока в магистральных артериях лучше всего использовать ультразвуковую допплерометрию и допплерографию. Обязательной процедурой является измерение артериального давления на нижних конечностях. В дальнейшем возможно рассчитывать лодыжечно-плечевой индексчастное от деления систолического артериального давления в артериях нижних конечностей(при этом измерение уровня АД проводится на голенях, либо, что значительно точнее, с помощью дуплексного допплеровского сканирования артерии тыла стопы) на систолическое давление в плечевой артерии. В норме этот показатель находится в преде-
лах 0,9 - 1,15.
При нейропатической форме синдрома диабетической стопы лодыжечноплечевой индекс не изменяется. Величина индекса в пределах0,8 - 0,7 характерна для наличия облитерирующих заболеваний артерий нижних конечностей. Возможна эффективная консервативная терапия. Если индекс менее 0,5, то следует думать о выраженной обструкции артерий голеней (критической ишемии). Крайне велика опасность развития гангрены нижней конечности. Консервативная терапия в таком случае малоэффективна. Показано проведение реконструктивных операций на артериях. Для исследования микроциркуляции на нижних конечностях эффективно проведение лазерной допплеровской флоуметрии.
Рентгенография стоп и голеней позволяет выявить признаки диабетической остеоартропатии, диагностировать спонтанные переломы, остеомиелит. Рентгеновское исследование нижних конечностей обязательно для всех пациентов с минимальными клиническими признаками синдрома диабетической стопы.
77
2.4. ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ ФОРМ ДИАБЕТИЧЕСКОЙ СТОПЫ
Для нейропатической формы характерны жалобы на нарушение чувствительности (больше в стопах), особенно по ночам, парестезии. Эта форма синдрома диабетической стопы клинически характеризуется теплой сухой кожей нормальной окраски, наличием участков гиперкератоза в областях избыточного нагрузочного давления.
Выявляется специфическая деформация стоп, пальцев, голеностопных суставов, двухсторонние отеки. Пульсация на артериях стоп сохранена с обеих сторон. Язвенные дефекты формируются в точках избыточного давления, они безболезненны. Более характерна влажная гангрена. Лодыжечно-плечевой индекс более 0,9, диагностируется уменьшение или отсутствие вибрационной чувствительности.
Основной жалобой больных с ишемической формой синдрома является наличие перемежающейся хромоты. При ишемической форме синдрома диабетической стопы кожа голеней и стоп бледная или цианотичн, атрофичная, часто образуются трещины.
Характерна неспецифическая деформация пальцев стопы. Пульсация на артериях стопы снижена или отсутствует. Резко болезненные акральные некрозы. Чаще всего развивается сухая гангрена пальцев. Лодыжечно-плечевой индекс менее 0,9, обнаруживается сохраненная или незначительно сниженная вибрационная чувствительность.
2.5. ПРОФИЛАКТИКА ДИАБЕТИЧЕСКИХ МАКРОАНГИОПАТИЙ
Профилактика диабетических макроангиопатий основана на трех лечебных мероприятиях: лечении артериальной гипертензии с достижением целевого уровня АД - не выше 130 и 80 мм. рт.ст., гиполипидемической терапии и строгой компенсации углеводного обмена. Антигипертензивная терапия может про-
водиться любыми препаратами, за исключением неселективных - бета адреноблокаторов и больших доз тиазидных диуретиков. Выбор препарата или комбинации препаратов определяется как их эффективностью в отношении снижения уровня АД у конкретного больного, так и сопутствующей патологией (хроническая сердечная недостаточность, диабетическая нефропатия).
Гиполипидемическая терапия включает в себя диетические мероприятия (исключение продуктов, богатых холестерином - печени, икры, жирного мяса; замену животных жиров на растительные; преимущественное употребление рыбных блюд, нежирных молочнокислых продуктов, растительной клетчатки), повышение физической активности и медикаментозную терапию. Медикаментозное лечение проводится статинами(симвастатин, ловастатин, аторвастатин, розувастатин) или фибратами (фенофибрат, гембифрозил).
Статины и фибраты можно сочетать с секвестрантами желчных кислот или ингибиторами всасывания липидов в кишечнике(эзетрол). Препараты никотиновой кислоты у больных сахарным диабетом не применяются. Гиполипидемическая терапия проводится ежедневно и пожизненно. Данные ряда исследований свидетельствуют о том, что активная терапия дислипидемий у пациен-
78
тов с сахарным диабетом 2 типа дает больший терапевтический эффект в отношении предотвращения острого коронарного синдрома и инсульта, нежели у больных без диабета.
Строгий контроль углеводного обмена является третьим по значимости мероприятием по снижению сердечно-сосудистого риска у больных сахарным диабетом. В исследовании UKPDS показано, что снижение уровня гликированного гемоглобина на 1% уменьшает риск инфаркта миокарда на14%. Лечение клинически манифестных макроангиопатий(ишемической болезни сердца и мозга, облитерирующего атеросклероза сосудов нижних конечностей) проводится по общим правилам, описанным в соответствующих томах настоящего руководства. Имеет свои особенности терапия сахарного диабета 2 типа у больных инфарктом миокарда, поскольку доказано, что перевод этих пациентов на инсулинотерапию безотносительно к степени компенсации у них углеводного обмена продлевает им жизнь.
Ишемическая (ишемически-гангренозная) форма синдрома диабетической стопы. Указаний на специфически "диабетическую" природу поражения крупных сосудов или на существование "диабетического атеросклероза" до сих пор нет. Однако, сахарный диабет явно ускоряет атеросклеротический процесс. Это влияние можно наблюдать не только при развернутой клинической картине сахарного диабета, но и при нарушении толерантности к углеводам. У многих пациентов профиль атеросклеротического риска, скорее всего берет начало еще на стадии нарушения толерантности к глюкозе. В результате ко времени установления диагноза сахарного диабета 2 типа у больных уже имеются выраженные макрососудистые изменения.
Морфологически атеросклеротические поражения при СД неотличимы от таковых у лиц без диабета, однако для него характерны более протяженные и обширные поражения магистральных артерий с захватом дистальных участков артериального русла, что делает невозможными или трудновыполнимыми реконструктивные операции на сосудах, нижних конечностей. Все указанные формы диабетической стопы могут сочетаться с различными вариантами -ин фекционно-некротического процесса. Очаги хирургической инфекции и ган- гренозно-некротические процессы на стопе при диабете возникают в20 раз чаще, чем улиц без диабета.
Местные изменения со стороны стоп у больных СД классифицируют в зависимости от степени поражения: язвенный дефект отсутствует, но есть сухость кожи, клювовидная деформация пальцев, другие костные и суставные аномалии; поверхностные язвы без инфицирования(встречаются крайне редко и для больных с СД эта степень поражения стоп является скорее исключением); глубокая язва, обычно инфицированная; глубокая язва с образованием абсцесса, с вовлечением в процесс костной ткани; ограниченная гангрена (пальца или части стопы); гангрена всей стопы. Для инфицированной язвы при СД характерны следующие особенности, которые достаточно хорошо объясняются особенностями патогенеза этого заболевания: отсутствие признаков воспаления, атипические микроорганизмы, атипичная симптоматика.
Нейро-ишемическая форма синдрома диабетической стопы. Для нейро-
79
ишемической формы синдрома диабетической стопы характерно наличие признаков нейропатической (нейропатически-инфицированной) и ишемической (ишемически-гангренозной) форм синдрома диабетической стопы у одного больного. Возможно превалирование одной из них, что усложняет диагностический процесс и может неблагоприятно сказаться на прогнозе заболевания изза неправильно назначенного лечения. Своевременная и правильная диагностика формы поражения стоп имеет принципиальное значение для назначения эффективной терапии. Диагностика характера патологического процесса при ней- ро-ишемической форме может быть существенно затруднена. Например, наличие резкого снижения чувствительности, как следствие диабетической нейропатии, не позволяет правильно оценить признаки перемежающейся хромоты и функциональные возможности конечности.
Кроме того, при наличии смешанной формы диабетической стопы, происходит утяжеление течения заболевания (взаимное отягощение). У больных с сахарным диабетом снижение периферического кровотока усугубляется оксидативным стрессом - ситуацией, когда избыточная продукция свободных радикалов, характерная для течения воспалительного процесса, и связанные с этим оксидативные реакции приводят к повреждению тканей. Без достаточного поступления крови борьба с инфекцией и заживление раны крайне затруднены. Само по себе, наличие инфицированной раны в значительной степени повышает потребность тканей в кислороде. Поэтому даже небольшое оперативное вмешательство или ссадина на стопе в условиях нарушения макро- и микроциркуляции могут закончиться развитием состояния относительной ишемии и резким ухудшением течения заживления раневого процесса.
2.6. КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
До настоящего времени существовало две точки зрения на ведение больных СД с поражением нижних конечностей. Одна из них исходит из неотвратимости ампутации конечности у больного СД. Главный аргумент в ее пользу - наличие диабетической нейропатии, значительно снижающей вероятность заживления и, следовательно возможности консервативного ведения пациента и реконструктивных операций на сосудах.
Другая точка зрения - это максимально возможное предотвращение ампутаций нижних конечностей или, по крайней мере, снижение ее частоты и уменьшение объема операции. Ниже перечислены основные аргументы в пользу второй точки зрения. Послеампутационная летальность у больных СД очень высока: в ближайшие 3 недели после ампутаций погибают22% пациентов, в течение первого года - до 40%. Высокая частота повторных операций, в том числе частота реампутации. Огромные прямые и непрямые затраты, связанные
споследующим лечением и реабилитацией больных.
Видеале, подход к терапии должен быть комплексным. Лечение должно проводится с участием эндокринолога, подиатра (специалист по уходу за ногами), хирурга и подготовленного среднего медперсонала. Своевременная и адекватная терапия позволяет избежать оперативного вмешательства в 95% случаев. При назначении терапии больным с синдромом диабетической стопы, прежде
80
всего необходимо в каждом конкретном случае определитькакое звено патогенеза играет решающую роль в развитии и прогрессировании заболевания.
Необходимо установить конкретную формулировку диагноза, например: сахарный диабет, дистальная симметричная диабетическая полинейропатия, синдром диабетической стопы, нейропатическая форма. В этом случае, сразу становится ясна абсолютная бессмысленность назначения сосудистых и вазоактивных препаратов типа пентоксифиллина (трентала) или вазапростана. Основное внимание в лечении в этом случае необходимо направить на терапию нейропатии и местное воздействие непосредственно на язвенный дефект.
Вкомплексной терапии любой формы синдрома диабетической стопы решающая роль отводится оптимизации метаболического контроля, местной обработке раны, антибиотикотерапии, разгрузке пораженного участка, удалению участков гиперкератоза, правильному подбору и ношению специальной обуви, дифференцированной системной медикаментозной терапии макроангиопатии (вазоактивные препараты, препараты, улучшающие реологические свойства крови) и микроангиопатии (комплексные витаминные препараты, препараты тиоктовой (а-липоевой) кислоты, ингибиторы альдозоредуктазы).
Главной причиной развития диабетической полинейропатии, лежащей в основе развития и прогрессирования синдрома диабетической стопы, является хроническая гипергликемия, которая изменяет нормальный метаболизм в периферических нервах. Поэтому в ее лечении оптимизация гликемических показателей имеет важнейшее значение.
Влечении инфицированной язвы решающую роль играет радикальное дренирование и антибиотикотерапия. Проводится некрэктомия и обеспечивается отток гнойно-некротических масс. Использование мазей не допускается. Накладываются только влажновысыхающие повязки с1% раствором диоксидина, 0,5% раствором хлоргексидина, фурацилина. Одним из наиболее эффективных
препаратор для местного применения в терапии язвенного дефекта является раствор цитеала, который состоит из смеси активных антисептиков: гексамидина диизетионата, хлоргексидина диглюконата и хлорокрезола.
При ежедневных аппликациях на раневую поверхность в разведении 1:10, препарат эффективен в отношении грамположительных и грамотрицательных микроорганизмов, а также обладает бактерицидным действием в отношении трихомонад и микостатическим действием - в отношении Candida albicans. Все антисептические растворы не должны обладать красящими свойствами, так как это затрудняет наблюдение за течением раневого процесса.
Имеются специальные гидрогелевые повязки(гидрокол, гелевин, гидросорб), обеспечивающие достаточную влажность внутри раны и не затрудняющие оттока гнойно-некротического содержимого. Эти повязки обеспечивают беспрепятственный газообмен, непроницаемы для бактерий. Гидрогелевые повязки противопоказаны при наличии ишемической формы.
Антибиотикотерапия больных с различными формами синдрома диабетической стопы является одним из важных компонентов консервативного лечения. Показанием к назначению антибактериальной терапии является наличие язв, пенетрирующих всю глубину кожи, перифокального воспаления, наличие
81
лихорадки, связанной с образованием язвы, а также глубоких и обширных гнойно-некротических очагов.
В выборе антибиотиков, методов их введения и длительности применения придерживаются следующих принципов: в связи с наличием дефектов в -им мунной системе у больных СД, показано применение только бактерицидных препаратов; длительный процесс заживления раны требует проведения -дли тельной антибактериальной терапии с неоднократной сменой препаратов; связи с большой частотой нарушения периферического магистрального кровотока и микроциркуляции у этой категории больных, показано назначение высоких доз антибиотиков, вводимых парентерально; частое выявление полимикробной инфекции требует использования антибиотиков широкого спектра действия, включая препараты, обладающие высокой активностью в отношении анаэробов; наличие сопутствующей диабетической нефропатии у большинства больных с синдромом диабетической стопы требует исключения нефротоксических препаратов.
Чаще всего возбудителями инфекции при синдроме диабетической стопы являются грамположительные и грамотрицательные кокки, кишечная палочка и ассоциации микроорганизмов. Поэтому до получения результатов посева отделяемого раны на микрофлору и ее чувствительность к антибиотикам целесообразно назначение пенициллинов, цефалоспоринов. Допустимо использование фторхинолонов. В связи с высокой вероятностью ассоциации гнойной и анаэробной инфекции, при назначении антибиотиков широкого спектра действия, целесообразно применение препаратов, активных и в отношении анаэробов: клиндомицина, имипенема, цефокситина.
При доказанной анаэробной флоре необходимо назначение метронидазола. Аминогликозиды нежелательно назначать при наличии клинических и лабораторных признаков поражения почек диабетического или другого генеза. Длительность применения и дозировка антибиотиков определяется характером и распространенностью воспалительного процесса и может составлять от4 недель до нескольких месяцев. При эмпирической антибактериальной терапии, до получения результатов исследования чувствительности микрофлоры, необходимо тщательно следить за динамикой гнойного очага.
Важное значение для терапии имеет знание характера микрофлоры и исследование ее чувствительности к антибиотикам. Материал для посева лучше всего забирать методом соскоба с язвенной поверхности стерильной ложечкой после многократной обработки раневой поверхности сухой стерильной салфеткой (кюретаж язвы). В связи с наличием резкого снижения чувствительности, вследствие диабетической нейропатии, процедура эта достаточно легко переносится больным. Рекомендуется также метод забора материала с помощью стерильного шприца и иглы с широким просветом из глубины раны, однако он не имеет преимущества перед способом забора материала кюретажем раневой поверхности.
Одним из самых важных факторов, определяющих заживление язвенных дефектов при нейропатической форме диабетической стопы, является ее разгрузка. В связи с развитием полной анестезии, больной может продолжать хо-
82
дить, наступая даже на язвенный дефект на подошвенной поверхности. Это должно быть обязательно категорически запрещено. Различают кратковременную (несколько дней) и длительную разгрузку. Кратковременная разгрузка достигается назначением постельного режима, использованием костылей и креслакаталки. Длительная разгрузка достигается ношением специальной разгрузочной обуви. Возможно использование специальных разгрузочных стелексупинаторов эффективность которых значительно ниже, но которые более доступны для больного ввиду их дешевизны.
Больным с ишемической формой диабетической стопы, в отличие от пациентов с нейропатической формой, показана ходьба с постепенным увеличением расстояния до появления ишемических болей в нижних конечностях. Физические нагрузки и развивающиеся при них метаболические изменения, способствуют развитию коллатералей. Обычно рекомендуется ежедневная, небыстрая ходьба по ровной местности на расстояние, равное приблизительно 70% расстояния, при преодолении которого больной вынужден останавливаться в связи с появлением болевых ощущений. Уменьшению отечности способствует приподнятое положение конечностей.
Удаление участков гиперкератоза должна проводится врачом-подиатром, либо хорошо обученным средним медицинским работником. Удаление проводится стерильным скальпелем или с помощью специального косметологического оборудования. Категорически запрещается проводить эту процедуру необученному персоналу или самому больному после распаривания конечности в горячей воде и при помощи подручного инструмента, чаще всего лезвия для безопасной бритвы или обычных канцелярских ножниц. Риск развития язвенного дефекта после подобной "процедуры" очень велик.
Подбор обуви для постоянного ношения у больных СД при наличии признаков диабетической нейропатии - непростая и очень важная задача. Больному необходимо рекомендовать ношение легкой, мягкой обуви из натуральной кожи. Примерять ее необходимо во второй половине дня, так как к вечеру размер стопы может увеличиваться. Категорически запрещается ношение обуви, неподходящей по размеру или по форме стопы.
Дифференцированная системная медикаментозная терапия макроангиопатии (вазоактивные препараты, препараты, улучшающие реологические свойства крови) и микроангиопатии (комплексные витаминные препараты, тиоктовая (а-липоевая) кислота, ингибиторы альдозо-редуктазы) проводится с учетом превалирования основного патогенетического звена в развитии синдрома диабетической стопы.
При значительном снижении артериального кровотока(ишемическая и смешанная форма) комплексное лечение предполагает улучшение гемореологических свойств крови(реополиглюкин, пентоксифиллин), инфузионную терапию препаратами альпростадила (вазапростан). Показано назначение пентоксифиллина, сулодексида. При неэффективности консервативной терапии проводят хирургическую ангиопластику. К сожалению, возможности ангиопластики ограниченны из-за особенностей атеросклеротического поражения артерий при сахарном диабете.
83
Терапия нейропатической формы сводится в первую очередь к терапии диабетической нейропатии. В настоящее время доказано положительное влияние на этот процесс следующих групп препаратов. Тиоктовая (а-липоевая) кислота (тиоктацид, эспалипон, тиогамма) является коэнзимом митохондриального комплекса ферментов и биокатализатором энергетического обмена. Активирует митохондриальные ферменты и тем самым противодействует потере энергии, имеющей место при сахарном диабете: повышается окисление глюкозы, тормозятся глюконеогенез и кетогенез.
Благодаря свойствам естественного окислителя, тиоктовая кислота защищает ткани от воздействия свободных радикалов, уменьшает интенсивность болей и парестезий. Благодаря уменьшению образования холестерина она является средством профилактики гиперхолестеринемии. Лечение проводится курсом в течение 8 - 12 недель, путем внутривенных инфузий 300 - 600 мг в сутки (10 - 20 вливаний) с последующим переходом на пероральный прием от одной(200 мг) до 3 таблеток в сутки.
Мильгамма 100. Препарат витаминов группы В - жирорастворимый витамин B1 (бенфотиамин) и пиридоксина гидрохлорида - мильгаммма 100, комплекс бенфотиамина, пиридоксина гидрохлорида и цианокобаламина(B1 + B6 + B12, или мильгамма 100). При наличии нейропатических болей рекомендуется назначение карбамазепина или трициклических антидепрессантов. Возможно использование нестероидных противовоспалительных препаратов, эффективность которых, однако, невелика.
Препараты "сосудистого" действия (пентоксифиллин, трентал, агапурин) и "вазоактивные" препараты (вазапростан) можно использовать только при наличии облитерирующего поражения сосудов нижних конечностей, в связи с их абсолютной неэффективностью при нейропатической форме синдрома диабетической стопы. Терапевтические мероприятия наиболее эффективны на -на чальных стадиях диабетической нейропатии.
При проведении терапии диабетической остеоартропатии в случае развития сустава Шарко без язвенных дефектов рекомендуется полная разгрузка пораженной конечности, ее фиксация с помощью гипсовой лангеты до полного срастания костей. При наличии язвенного дефекта применение фиксирующих повязок крайне опасно в связи с угрозой его расширения и ухудшения течения инфекционного процесса. Терапия язвы проводится с максимально-возможной разгрузкой конечности до исчезновения язвенного дефекта и только потом возможно наложение лангеты. После срастания перелома необходимо ношение индивидуальной ортопедической обуви. К сожалению, даже при соблюдении всех мер профилактики, выраженная деформация стопы приводит к рецидивированию язвенного дефекта.
Таким образом, основные меры по предотвращению ампутаций нижних конечностей у больных с сахарным диабетом заключаются в профилактике и лечении периферической нейропатии и микромакроангиопатии, а также мерах по предотвращению, раннему выявлению и адекватному лечению поражений нижних конечностей, которые могут предшествовать развитию диабетической гангрены. Среди профилактических мер следует особо отметить необходимость
84
формирования групп риска, динамическое наблюдение больных из групп риска
вспециализированных центрах и кабинетах “диабетическая стопа”, правильный подбор и ношение ортопедической обуви, обучение пациентов в школах.
При обучении больных очень важно использовать различные брошюры, яркие наглядные пособия. Основными принципам обучения должны быть простые, доступные для больного указания по уходу за ногами. Ниже приводится примерное содержание кратких рекомендаций пациенту, входящему в группу риска по диабетической стопе.
Самое незначительное воспаление на ногах при диабете может перерасти
всерьезное осложнение. Даже при небольшом воспалении необходимо обратиться к врачу. Часто встречающиеся грибковые заболевания стоп необходимо настойчиво лечить. Не следует ждать, когда появятся проблемы с ногами! Проводите профилактические мероприятия. Профилактика - лучшая защита ног.
Больным с СД необходимо ежедневно мыть ноги. Используется только теплая вода (максимальная температура 37°С). Рекомендуется постоянно проверять температуру воды в ванной рукой или термометром, чтобы убедиться, что она не очень горячая. Очень горячей водой можно ошпарить ноги, при этом подобные раны заживают очень медленно. Ванны для ног должны длиться не более 5 минут, при длительном мытье ног здоровая кожа становится мягкой, а между пальцами она очень сильно размокает.
Не следует пользоваться щеткой или массажной перчаткой, необходимо избегать всего, что может вызвать раздражение кожиэто может привести к повреждению тканей. Рекомендуется применение мочалки и нейтрального мыла (без химических добавок) и осторожно, не растирая, вытирать ноги промакивающими движениями. После душа или плавания ноги нужно тщательно просушить полотенцем или феном с прохладным воздухом.
Ноги подвергаются ежедневному осмотру, чтобы вовремя обнаружить волдыри, порезы, царапины и другие повреждения, через которые может проникнуть инфекция. Необходимо особенно тщательно осмотреть промежутки между пальцами. Подошвы стоп можно легко осмотреть с помощью зеркала. Если пациент не может сделать это сам, то ему необходимо попросить сделать это кого-либо из членов семьи. Если ноги мерзнут по ночам, рекомендуется надевать теплые носки, в том числе на ночь. Никогда нельзя пользоваться грелками или другими горячими предметами для согревания ног. Во время отпуска нельзя допускать, чтобы ноги загорали.
Мозоли и ороговевшие участки кожи всегда имеют причину: неправильная форма ноги, неправильно подобранная обувь. Очень важно ежедневно менять носки или чулки. Нельзя носить заштопанные носки или носки с тугой резинкой. Не рекомендуется никогда не ходить босиком, даже дома. На работе рекомендуется пользоваться специальной рабочей обувью. По возможности, лучше не носить резиновые сапоги.
При наличии сухой кожи необходимо втирать в кожу тонкий слой нейтрального крема (на ланолиновой или вазелиновой основе). Нельзя наносить крем между пальцами. Не рекомендуется пользоваться тальком или другими присыпками - это размягчает кожу. Если ноги потеют, очень важно не допус-
85
тить размягчения кожи. Несколько раз в день необходимо мыть ноги и хорошо просушивать кожу.
Длинные, очень короткие или плохо обрезанные ногти могут повредить кожу или привести к инфекции. Для обрезания ногтей используются ножницы с закругленными концами. Стричь ногти можно только прямо; уголки аккуратно подпиливаются. Никогда нельзя пользоваться острыми ножницами, лезвием, ножом, острыми предметами. Этими предметами можно пораниться. Если у пациента плохое зрение, необходимо попросить кого-либо ему помочь.
Больному СД рекомендуется ежедневно осматривать свою обувьне попали ли в нее посторонние предметы, не порвана ли подкладка. Все это может поранить или натереть кожу ног. Необходимо покупать только ту обувь, которая с самого начала удобно сидит на ноге. При покупке, примерка обуви должна происходить во вторую половину дня(ноги к этому времени отекают и размер стопы увеличивается). Хорошая обувь легкая и из мягкой кожи.
Подошва не должна быть скользкой и кожаной. Каблуки не должны быть слишком низкими или слишком высокими(2-2,5 см для мужчин, 3 - 3,5 см для женщин). Нежелательно, чтобы обувь была слишком узкой или широкой. Нельзя носить обувь, которая натирает ногу. Регулярно проверяются каблуки, если они стоптались, обувь необходимо отнести в ремонт. Нельзя носить металлических набоек, это может нарушить походку.
Если на ногах появилась рана необходимо продезинфицировать ее с помощью бесцветного, неспиртсодержащего антисептического вещества (нельзя использовать перекись водорода). Накладывается сухая стерильная повязка. Исключается применение мазей, антибиотиков местного действия или красящих веществ, потому что это может увеличить рану.
2.7. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
У больных с синдромом диабетической стопы проводятся две принципиально различные группы операций: реконструктивные сосудистые операции и хирургическое лечение гнойно-некротических форм. Основными показаниями к проведению реконструктивного оперативного лечения являютсянеэффективность консервативной терапии, сохранение или прогрессирование критической ишемии при отсутствии гнойно-некротического очага в оперируемой области.
Наиболее частой операцией является шунтирование с использованием аутовены, либо сосудистого протеза из политетрафторэтилена. Важными критериями проходимости шунтов после оперативного лечения считаются клинические показатели: восстановление периферической пульсации, исчезновение ишемических болей при ходьбе, а также нормализация плече-лодыжечного индекса и транскутанного напряжения кислорода. Следует отметить, что в связи с тем, что эластичные свойства искусственного сосудистого протеза отличаются от свойств сосудов пациента, результаты исследования плече-лодыжечного индекса после протезирования артерии могут быть несколько завышенными, и не соответствовать истинному кровотоку по шунту.
Лечение гнойно-некротических форм синдрома диабетической стопы
86
проводится в гнойном отделении. Спектр возможных операций достаточно широк: от локальной хирургической обработки раны до ампутации конечности. Показаниями к срочным оперативным вмешательствам являются, влажная гангрена пальцев и стопы, флегмона стоп, флегмона стопы с переходом воспаления на голень, глубокие абсцессы стопы, гнойно-некротические раны, не имеющие адекватного дренирования, отдаленные септические метастатические очаги, вновь образующиеся абсцессы и плохо дренирующиеся затеки.
Во всех других случаях гнойно-некротических форм синдрома диабетической стопы хирургическое лечение может проводиться в плановом порядке после установления факта отсутствия положительной динамики на фоне консервативной терапии. Что касается конкретных методик операций, то они изложены в соответствующих руководствах по хирургии.
87
Глава III ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
3.1. ОПРЕДЕЛЕНИЕ
Ишемическая болезнь сердца (ИБС) - это заболевание миокарда, обусловленное острым или хроническим несоответствием потребности миокарда в кислороде и коронарного кровоснабжения сердечной мышцы, которое выражается в развитии в миокарде участков ишемии, ишемического повреждения, некрозов и рубцовых полей, сопровождается нарушением систолической и/или диастолической функции сердца.
ИБС является одним из наиболее распространенных заболеваний сердеч- но-сосудистой системы во всех экономически развитых странах. По данным проспективных исследований, ИБС страдают около 5-8% мужчин в возрасте от 20 до 44 лет и 18-24,5% - в возрасте от 45 до 69 лет. Распространенность ИБС у женщин несколько меньше и в старшей возрастной группе обычно не превышает 13-15%. На долю ИБС приходится более половины всех смертей от сер- дечно-сосудистых заболеваний. В Российской Федерации отмечается один из наиболее высоких в Европе показателей распространенности и смертности населения от ИБС. Высокая социально-экономическая значимость ИБС обусловлена относительно ранней потере трудоспособности и инвалидизации больных. По мнению Р. Stamler (1973): “ИБС достигла такой распространенности, что в последующие годы приведет человечество к величайшей эпидемии, если мы не будем в состоянии изменить эту тенденцию путем настойчивых исследований по выяснению причин возникновения и путей профилактики этого заболевания”.
Характерным клиническим признаком ИБС является стенокардия(angina pectoris - грудная жаба). Первое описание классической стенокардии принадлежит Гебердену (1772), который для ее обозначения впервые применил термин “angina pectoris” (грудная жаба). Однако еще Гиппократ, а затем Бартолетти
(1576-1630), Гарвей (1527-1658), Морганьи (1684-1771) описывали случаи воз-
никновения у пожилых и старых людей сильных острых болей в левой половине грудной клетки, сопровождавшихся беспокойством, страхом, удушьем, обмороком во время приступа.
Parry (1799) первым указал на связь стенокардии с изменением структуры сердца и поражением КА. Он же первым высказал предположение, что ангинозная (стенокардитическая) боль возникает вследствие уменьшения снабжения сердца кровью. Большинство врачей, еще задолго до Гебердена описывавших подобные ангинозные приступы, подчеркивали их связь с внезапной сердечной смертью. Гиппократ указывал, что “боль в области сердца, которая появляется с определенной частотой у старых людей, является предзнаменованием внезапной смерти”.
88
3.2. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Атеросклероз
Морфологической основой ИБС более чем 95в-97% случаев является атеросклероз коронарных артерий(КА). Атеросклеротические бляшки, суживающие просвет венечных сосудов, локализуются главным образом в проксимальных КА, преимущественно в области их устья. Интрамуральные венечные сосуды макроскопически остаются интактными. Передняя межжелудочковая ветвь левой коронарной артерии(ПМЖВ ЛКА) кровоснабжает всю
переднюю стенку ЛЖ |
и большую |
часть. |
ОгибающаяМЖП ветвь |
ЛКА (ОВ ЛКА) обеспечивает |
кровоснабжение |
боковой |
и задней стенок ЛЖ, |
а правая коронарная артерия(ПКА) - заднедиафрагмальную стенку ЛЖ, базальную часть МЖП и ПЖ, а также АВ-узел. Атеросклеротические изменения коронарного русла приводят к возникновению преходящей или постоянной ишемии и другим последствиям нарушения коронарного кровотока в бассейне пораженной артерии.
Степень |
атеросклеротического |
сужения |
трех |
наиболее |
крупны |
КА (ПМЖВ, ОВ и ПКА) у больных ИБС |
неодинакова. Поражение одной из них |
|
|||
(ПМЖВ, ОВ или ПКА) обнаруживают примерно в 30% случаев, двух КА - еще у трети больных и трех КА- у остальных больных. У 2/3 больных ИБС при коронароангиографии (аутопсии) можно обнаружить 2-3-х сосудистое поражение КА, которое отличается наиболее серьезным прогнозом. Чаще всего поражается ПМЖВ, которая кровоснабжает значительную часть ЛЖ. Нарушение кровотока в ПМЖВ отличается высоким риском возникновения ИМ и внезапной смерти.
Еще более тяжелый прогноз отмечен при атеросклеротическом сужении или окклюзии ствола ЛКА.
Кардиальный синдром Х
У 10-15% больных с типичной клинической картиной ИБС и верифицируемыми объективными признаками преходящей ишемии миокарда явного атеросклеротического сужения крупных проксимальных КА не обнаруживают. Такой вариант течения ИБС получил название“синдром Х”. Его возникновение связывают с поражением мелких коронарных артерий, которые не визуализируются при коронароангиографии. В иностранной литературе в качестве относительно редких причин ИБС называют некоторые заболевания и синдромы, сопровождающиеся ишемическими поражениями сердечной мышцы: врожденные аномалии развития КА; воспалительные коронарииты, обусловленные вовлечением в патологический воспалительный процесс КА(узелковый периартериит, системные заболевания соединительной ткани); сифилитический аортит; расслаивающая аневризма грудной аорты; эмболия КА (при инфекционном эндокардите, фибрилляции предсердий, ревматических пороках сердца ); аортальные пороки сердца и другие.
89
Все эти поражения коронарного русла могут сопровождаться развитием преходящей ишемии сердечной мышцы или даже возникновением ИМ. Однако целесообразность их включения в понятие ИБС весьма сомнительна, поскольку это заболевание имеет свою четко очерченную клиническую и патоморфологическую картину, позволяющую выделять ИБС как самостоятельную нозологическую единицу. Большинство из перечисленных поражений коронарного русла следует рассматривать как осложнение других заболеваний, инфекционного эндокардита с поражением аортального клапана, осложненного тромбоэмболией ПМЖВ с развитием острого инфаркта миокарда.
Факторы риска ИБС
К числу наиболее значимых из них относятся: 1. Немодифицируемые (неизменяемые) ФР: возраст старше 50-60 лет; пол (мужской); отягощенная наследственность. 2. Модифицируемые (изменяемые): дислипидемии (повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных ЛВП); артериальная гипертензия (АГ); курение; ожирение; нарушения углеводного обмена (гипергликемия, сахарный диабет); гиподинамия; нерациональное питание; гипергомоцистеинемия. В настоящее время доказано, что наибольшее прогностическое значение имеют такие ФР ИБС как дислипидемии, АГ, курение, ожирение и сахарный диабет. Возникновению коронарной недостаточности способствует действие любых органических или функциональных факторов, ызывающих
либо прямое ограничение коронарного кровотока и снижение перфузионного давления в коронарной системе, либо значительное увеличение потребности миокарда в кислороде, которое не сопровождается адекватным увеличением коронарного кровотока.
Выделяют 4 механизма острой или хронической коронарной недостаточ-
ности: 1.Сужение |
проксимальных |
КА |
атеросклеротической |
бляшкой |
с ограничением коронарного кровотока |
и/или |
его функционального |
резерва |
|
и невозможностью адекватного расширения венечных сосудов в ответ на увеличение потребности миокарда в кислороде(“фиксированный стеноз”). 2. Выраженный спазм КА(“динамический стеноз”). 3. Тромбоз КА, в том числе образование микротромбов в микроциркуляторном сосудистом русле. 4. Микроваскулярная дисфункция. В большинстве случаев у больных коронарным атеросклерозом имеет место сочетание действий нескольких из этих механизмов. Сужение коронарных артерий атеросклеротической бляшкой("фиксированный стеноз") Прогрессирующее сужение проксимальной(эпикардиальной) КА атеросклеротической бляшкой ведет к значительному повышению сопротивления в области стенозированной КА. Расположенные дистально от места стеноза артериолы компенсаторно расширяются, их сопротивление (R2) снижается, что при умеренных степенях стеноза способствует сохранению нормального общего сопротивления коронарного русла стенозированной артерии (Rобщ) и величины перфузионного давления в ней. Перфузионное давление ( Р), под
90
действием которого осуществляется кровоток в системе интактной артерии, равно разнице давления в проксимальном сосуде (Р1) и в ее дистальных отделах
(Р2): P = Р1 - Р2.
В стенозированной КА общее коронарное сопротивление(Rобщ) складывается из сопротивления проксимального участка артерии(R1), сопротивления области стеноза (RS) и сопротивления дистального участка коронарного русла (R2). В покое, несмотря на сужение КА, которое оказывает значительное сопротивление коронарному кровотоку (RS), Rобщ увеличено незначительно, поскольку за счет компенсаторного расширения артериол и мелких артерий величина R2 уменьшается. В постстенотическом участке проксимальной артерии по понятным причинам давление (Р1) снижено, но перфузионное давление ( Р) остается почти таким же, как в интактной КА за счет резкого уменьшения Р2.
При увеличении потребности миокарда в кислороде в системе интактной КА, сохранившей коронарный резерв, происходит значительное расширение артериол и мелких артерий, и величина сопротивления дистального участка артерии (R2) и Rобщ значительно падает. Это приводит к увеличению градиента давления (DР), и коронарный кровоток увеличивается. В стенозированном участке на фоне физической нагрузки и возрастания интенсивности кровотокаRS увеличивается, тогда как R2 больше не уменьшается, поскольку мелкие сосуды максимально расширены и коронарный резерв исчерпан. В результате величина общего сопротивления (Rобщ) значительно возрастает. Это приводит к еще большему падению постстенотического давления (Р1) при сохранении прежней
величины Р . Поэтому перфузионное давление(DР) и коронарный кровоток
2
уменьшаются до критического уровня, и появляются условия для возникновения ишемии миокарда.
На этой стадии стенозирования КА компенсаторная дилатация интрамуральных резистивных сосудов происходит преимущественно благодаря действию метаболических механизмов саморегуляции коронарного кровотока, повышенной продукции аденозина, эндотелийзависимого фактора расслабления (оксида азота - NО), простациклина PGI2. Это обеспечивает сохранение адекватного коронарного кровообращения в покое, но ограничивает коронарный резерв и возможности расширения резистивных сосудов при воздействии факторов, увеличивающих потребность миокарда в кислороде.
К числу таких факторов относятся: 1. Увеличение напряжения миокарда, определяемого уровнем систолического АД, величиной постнагрузки, диастолическими размерами полости ЛЖ и уровнем КДД в нем. 2. Увеличение ЧСС. 3. Увеличение инотропизма сердечной мышцы, которое чаще всего ассоциируется с активацией САС и повышением концентрации катехоламинов в крови. На этой стадии развития заболевания клинические и инструментальные при-
знаки преходящей ишемии миокарда возникают при значительной активации
91
САС, физическом или эмоциональном напряжении, увеличении ЧСС, подъеме АД
По мере увеличения степени стеноза проксимальной КА возрастает выраженность компенсаторной вазодилатации и одновременно снижается коронарный расширительный резерв. При достижении критической степени стеноза (75-80% от просвета сосуда) увеличение кровотока в ответ на возрастающую потребность миокарда в кислороде становится невозможным. Признаки КН возникают при незначительной нагрузке, в покое. При указанной степени стеноза и максимальном расширении резистивных венечных сосудов уровень коронарного кровотока становится чрезвычайно зависимым от внутримиокардиального напряжения (или уровня внутрижелудочкового давления). Поэтому любое увеличение КДД ЛЖ, обусловленное падением сократительной способности миокарда у больных с ХСН, дилатацией полости ЛЖ, увеличением преднагрузки, выраженной гипертрофией миокарда или увеличением ЧСС, ведет к сдавлению микроциркуляторного сосудистого русла и еще более резкому ограничению перфузии миокарда в бассейне стенозированной КА. Наличие выраженного стеноза проксимальной КА, максимальная дилатация резистивных венечных сосудов, снижение возможности их дальнейшего расширения и адекватно возросшей потребности миокарда в кислороде являются первыми механизмами развития коронарной недостаточности у больных ИБС.
Спазм коронарной артерии
Спазм |
КА |
у |
больных |
ИБС |
может |
затрагивать |
как |
кр |
(эпикардиальные), так и интрамуральные резистивные венечные сосуды. Этот |
|
|||||||
важный механизм коронарной недостаточности связан, главным образом, с на- |
|
|||||||
рушением метаболической и нейрогуморальной регуляции коронарного крово- |
|
|||||||
тока. В физиологических условиях в ответ на любое усиление метаболизма сер- |
|
|||||||
дечной мышцы и увеличение потребности миокарда в кислороде происходит |
|
|||||||
высвобождение из клеток сосудистого эндотелия эндотелийзависимого фактора |
|
|||||||
расслабления (оксида азота - NО) и простациклина PGI2, обладающих мощным |
|
|||||||
вазодилатирующим |
действием и антиагрегантными свойствами. В результате |
|
||||||
интрамуральные резистивные КА (артериолы) расширяются и коронарный кровоток увеличивается, обеспечивая адекватную перфузию миокарда в условиях возросшей потребности миокарда в кислороде. Компенсаторная релаксация венечных сосудов, вызываемая аденозином, брадикинином, субстанцией Р, ацетилхолином и другими прямыми вазодилататорами также является эндотелийзависимой реакцией.
В основе адекватной физиологической реакции венечных сосудов на любое усиление метаболизма сердечной мышцы лежит нормальное функционирование сосудистого эндотелия. Поэтому повреждение эндотелия, которое закономерно наблюдается у больных коронарным атеросклерозом, АГ, сахарным диабетом, гиперлипидемией, ожирением, сопровождается двумя отрицатель-
92
ными последствиями: ослаблением эндотелийзависимой релаксации , КА в первую очередь связанным с уменьшением выделения клетками эндотелия оксида азота (NО) и простациклина; избыточной продукцией эндотелиальных вазоконстрикторных субстанций (тканевого ангиотензина II, эндотелина, тромбоксана А2, серотонина).
Поврежденный эндотелий КА извращенно и неадекватно реагирует на обычные гемодинамические и гуморальные стимулы. В условиях стенозирования КА эта ситуация усугубляется значительными изменениями гемодинамики в области атеросклеротической бляшки(снижение давления и турбулентный ток крови в постстенотическом участке, увеличение градиента давления между престенотическим и постстенотическим участками КА). В результате активируется тканевой ангиотензин-превращающий фермент (АПФ) и резко увеличивается высвобождение ангиотензина II. Одновременно возрастает продукция эндотелиальными клетками другого мощного вазоконстриктораэндотелина, который, связываясь со специфическими рецепторами на мембране гладкомышечных клеток, повышает концентрацию внутриклеточного кальция, вызывает длительное и значительное повышение тонуса сосудистой стенки.
Снижение |
эндотелиальной |
продукцииPGI2 и NО у больных ИБС имеет |
|||
следствием не только подавление реактивной вазодилатации венечных сосудов, |
|||||
но и приводит к усилению пристеночной агрегации тромбоцитов. В результате |
|||||
активируется |
тромбоксановый |
путь |
метаболизма |
арахидоновой |
кислоты |
с избыточным образованием тромбоксана А. Последний индуцирует дальней-
2
шую агрегацию тромбоцитов и тромбообразование.
Важной причиной возникновения вазоконстрикторных реакций атеросклеротически измененных КА является нарушение нервной регуляции коронарного кровотока значительное преобладание эффектов активации САС и высокой концентрации катехоламинов. Наибольшее значение здесь имеет
прямое сосудосуживающее действие катехоламинов, опосредованное α-
1
адренергическими рецепторами, возбуждение которых вызывает сужение преимущественно крупных (эпикардиальных) КА. Стимулирование -М холинорецепторов при активации парасимпатической нервной системы оказывает сосудорасширяющее действие. Однако нужно учитывать, что эффекты ацетилхолина также опосредуются эндотелием КА. Повышение сосудистого тонуса и спазм КА у больных ИБС является одним из ведущих механизмов возникновения коронарной недостаточности.
Тромбоз
У здорового человека нормальное функционирование системы тромбоци- тарно-сосудистого и коагуляционного гемостаза обеспечивает сохранение -це лостности сосудистой стенки. В норме кровотечение из мелких сосудов при их повреждении останавливается за 1-3 мин. Это происходит главным образом за
93
счет адгезии и агрегации тромбоцитов и, в меньшей степени, спазма микрососудов. Пусковую роль в этом процессе играют повреждение стенок кровеносных сосудов и обнажение субэндотелиальных тканевых структур коллагена.
Под действием коллагена (К) и содержащегося в субэндотелии фактора Виллебранда (ФВ) происходит быстрая активизация тромбоцитов, которые, изменяя свою форму, набухая и образуя шиповидные отростки, прилипают (адгезируют) к волокнам соединительной ткани по краям раны. Адгезия (прилипание) тромбоцитов к субэндотелию поврежденных кровеносных сосудов являет-
ся |
начальным |
этапом |
сосудисто-тромбоцитарного |
гемостаза |
и связан |
с взаимодействием трех его компонентов: 1) специфических рецепторов мем- |
|||||
бран тромбоцитов (гликопротеина Ib, IIb, IIIа); 2) коллагена; |
3) фактора |
Вил- |
|||
лебранда. Последний образует своеобразные мостики между коллагеном субэндотелия сосудов и рецепторами тромбоцитов.
Под влиянием АДФ, катехоламинов (КА) и серотонина, выделяющихся из поврежденных клеток, коллагена повышается способность тромбоцитов к агрегации. Из тромбоцитов выделяются и начинают действовать вещества, содержащиеся в так называемых электронно-плотныхa-гранулах тромбоцитов: большое количество АДФ, серотонин, адреналин, некоторые белки, участвующие в агрегации и свертывании крови(антигепариновый фактор тромбоцитов IV, β-тромбоглобулин, пластиночный фактор роста и некоторые факторы свертывания, аналогичные плазменным - фибриноген, факторы V и VIII, калликреин, α2-антиплазмин).В процессе разрушения тромбоцитов из них выделяются некоторые важные факторы свертывания: 1) тромбоцитарный фактор III (тромбопластин); 2) антигепариновый фактор IV; 3) фактор Виллебранда VIII; 4) фактор V; 5) β-тромбоглобулин; 6) ростковый фактор, α2-антиплазмин, фибриноген.
Тромбоциты, оказывая большое влияние на интенсивность и скорость локального свертывания в зоне тромбообразования, оказывают меньшее влияние на свертывание крови. Сосудисто-тромбоцитарный и коагуляционный гемостаз являются взаимосвязанными (сопряженными), но все же относительно независимыми процессами. В результате взаимодействия плазменных и высвобож-
дающихся пластиночных факторов и тканевого тромбопластина начинается процесс свертывания крови. В зоне первичного гемостаза образуются вначале малые количества тромбина, который, с одной стороны, завершает процесс необратимой агрегации тромбоцитов, а с другой, способствует образованию фибрина, который вплетается в тромбоцитарный сгусток и уплотняет его. Взаимодействие тромбоцитов с фибриногеном осуществляется с помощью специфических рецепторов IIb/IIIа. Важную роль в формировании тромбоцитарной агрегации играют производные арахидоновой кислотыпростагландины PGG2
и PGH2 и другие, из которых в тромбоцитах образуется тромбоксан 2А, обладающий мощным агрегирующим и сосудосуживающим эффектом, а в сосуди-
94
стой стенке - простациклин (PGI2), являющийся основным ингибитором агрегации.
У больных коронарным атеросклерозом активация тромбоцитарнососудистого гемостаза выполняет роль важнейшего механизма возникновения коронарной недостаточности. Причиной этого служат многочисленные дефекты эндотелиального покрова. Это ведет к обнажению субэндотелиальных структур - коллагеновых волокон, гладкомышечных клеток. Активация тромбоцитарного гемостаза может приводить к образованию пристеночного тромба,
эмболизации дистально расположенных венечных сосудов отслоившимися фрагментами тромба и атероматозной бляшки. Такая ситуация складывается у больных с так называемой нестабильной стенокардией и острым ИМ.
Микроваскулярная дисфункция
Микроваскулярная дисфункция - важный механизм нарушения коронарного кровотока, который лежит в основе возникновения особой формы ИБСмикроваскулярной стенокардии (синдром Х). Микроваскулярная дисфункция характеризуется: отсутствием типичных атеросклеротических изменений крупных (эпикардиальных) КА и наличием выраженных функциональных и морфологических расстройств дистально расположенных КА. Основные изменения происходят на уровне мелких КА - преартериол, размер которых не превышает 150-350 мкм. Они характеризуются значительным сужением просвета мелких КА за счет гипертрофии и гиперплазии гладкомышечных клеток медии и фибропластических процессов в ней. В различных участках миокарда происходит неодинаковое сужение преартериол, снижается их способность расширяться при увеличении потребности миокарда в кислороде.
В основе этих изменений лежит выраженная дисфункция эндотелия, повышенная продукция вазоконстрикторных субстанций(эндотелина, нейропептида Y). Снижается продукция оксида азота (NО), простациклина и других вазодилатирующих субстанций. Развивается выраженный спазм преартериол, появляются участки преходящей ишемии сердечной мышцы. Происходит расширение более дистально расположенных, интактных артериол. Это сопровождается синдромом межкоронарного обкрадывания и нарастанием ишемии. Возникновению описанных дисфункций микроциркуляторного сосудистого русла способствуют повышение агрегации тромбоцитов, ухудшение реологических свойств крови.
Снижение кровоснабжения миокарда, развитие ишемических повреждений ЛЖ (ишемия, дистрофия, некроз) приводят к формированию многочисленных функциональных и морфологических нарушений в сердечной мышце, которые определяют клиническую картину заболевания и его прогноз. К числу наиболее значимых последствий ИБС относят: снижение энергетического обеспечения кардиомиоцитов; гибернирующий (“спящий”) и “оглушенный” мио-
95
кард; кардиосклероз; диастолическая и систолическая дисфункция ЛЖ; нарушения ритма и проводимости.
Снижение энергетического обеспечения кардиомиоцитов
В норме в присутствии достаточного количества кислорода энергетические потребности кардиомиоцитов удовлетворяются за счет нелимитированного окисления жирных кислот и глюкозы. В результате образуются высокоэнергетические фосфаты - аденозинтрифосфат (АТФ) и креатинфосфат (КФ), которые используются на обеспечение механической, электрической и других функций кардиомиоцита. Снижение коронарного кровотока создает дефицит кислорода в миокарде, пораженные клетки переходят на гораздо менее эффективный, анаэробный, путь метаболизма. Нарушается процесс окислительного фосфорилирования, активируется менее эффективное окисление ЖК, глюкоза превращается в лактат, снижается рН клетки, уменьшается содержание внутриклеточного К+ и выработка макроэргических соединений. Это ведет к прогрессирующему снижению электрической активности клетки, нарушению проведения электрического импульса и снижению механической функции миокарда.
Возникает нарушение локальной сократимости ишемизированных -сег ментов ЛЖ (гипокинезия). При полном прекращении коронарного кровотока развивается некроз кардиомиоцитов. В некротизированном участке миокарда полностью отсутствует электрическая активность, не проводится электрический импульс, прекращается механическая активность (акинезия миокарда).
Гибернирующий (“спящий”) и “оглушенный” миокард
Выраженное хроническое нарушение коронарного кровотока не всегда приводит к гибели кардиомиоцитов. В некоторых случаях можно наблюдать две своеобразные реакции миокарда на длительное существование нарушений коронарного кровотока: 1. Феномен гибернации миокарда, находящегося в условиях хронического уменьшения коронарной перфузии. 2. Феномен “ог-
лушения”, выявляющийся после восстановления исходной перфузии тканей (реперфузии).
Гибернация миокарда (hybernatio - спячка) - это нарушение локальной сократимости ЛЖ, возникающее при выраженном и продолжительном снижении его перфузии, не сопровождающемся иными признаками ишемии. Феномен гибернации является своеобразной формой клеточного анабиоза, обеспечивающего выживаемость кардиомиоцитов в условиях дефицита кислорода. Глубокие метаболические сдвиги, происходящие при гипоксии(дефицит макроэргиче-
+
ских соединений, накопление в клетках ионов Н и выход из клеток аденозина и ионов К+ ), вынуждают кардиомиоциты резко ограничить расход энергии и сократительную функцию. Возникает неустойчивое равновесие между сниженной перфузией и сниженной сократимостью. Миокард в течение длительного времени сохраняет способность полностью восстанавливать свою прежнюю со-
96
кратительную функцию, если произойдет нормализация коронарного кровотока (успешный тромболизис, реваскуляризация). Дальнейшее снижение перфузии или увеличение потребности миокарда в кислороде приводит к развитию ишемии, некроза.
Гибернирующий миокард реагирует на введение катехоламинов под влиянием малых доз добутамина временно восстанавливается сократимость миокарда, что доказывает его жизнеспособность. Феномен “оглушенного” миокарда (stunning) - это преходящее постишемическое нарушение локальной сократимости ЛЖ, возникающее после восстановления исходного коронарного
кровообращения (реперфузии) и прекращения действия . ишемии В “оглушенном” миокарде, пережившем период длительной ишемии, энергетические ресурсы и сократительная функция отдельных кардиомиоцитов восстанавливаются медленно, в течение нескольких дней. Несмотря на отсутствие повреждения клеток, сократимость миокарда в течение некоторого времени оста-
ется |
нарушенной. Феномены |
гибернирующего “иоглушенного” |
миокарда |
||
очень |
характерны |
для |
больных“обострением” ИБС |
у |
пациентов |
с нестабильной стенокардией, хотя встречаются и при стабильном течении заболевания.
Кардиосклероз
Хроническое нарушение перфузии миокарда и снижение его метаболизма закономерно сопровождаются уменьшением количества кардиомиоцитов, замещением их вновь образующейся соединительной тканью, а также развитием компенсаторной гипертрофии сохранившихся мышечных волокон. Совокупность этих морфологических изменений вместе с признаками ишемических по-
вреждений |
миокарда (участков |
дистрофии |
миокарда |
и микронекрозов) |
в отечественной литературе традиционно описывается как |
диффузный атеро- |
|||
склеротический кардиосклероз. Клинически он проявляется признаками систолической и диастолической дисфункции ЛЖ, медленно прогрессирующей ХСН,
а также |
часто |
развивающимися |
нарушениями |
сердечного |
и внутрижелудочковой проводимости (блокады ножек и ветвей пучка Гиса). |
||||
Атеросклеротический |
кардиосклероз |
сопутствует другим |
формам ИБС |
|
и в современной международной классификации ИБС не выделяется в качестве самостоятельной формы этого заболевания. Тем не менее он значительно усугубляет течение заболевания. Диффузное разрастание соединительной ткани в сердечной мышце частично является следствием повышения активности САС, тканевых РАС, ангиотензина II, альдостерона и других веществ, которые способствуют новообразованию коллагена.
У больных ИМ в результате организации зоны некроза в сердце образуются крупные рубцовые поля, являющиеся морфологической основой постинфарктного кардиосклероза. Последний существенно осложняет течение ИБС за
97
счет прогрессирования ХСН, возникновения желудочковых аритмий высоких градаций. Весьма неблагоприятным следствием постинфарктного кардиосклероза является хроническая аневризма ЛЖ - мешковидное локальное выбухание, которое изменяет характер течения ИБС, определяет прогноз заболевания.
Дисфункция левого желудочка
Дисфункция ЛЖ - один из характерных признаков, присущих многим клиническим формам ИБС. Ранним функциональным нарушением сердечной мышцы при ИБС является диастолическая дисфункция ЛЖ, которая обусловлена: увеличением ригидности сердечной мышцы за счет ишемии миокарда, наличия атеросклеротического и постинфарктного кардиосклероза, а также компенсаторной гипертрофии миокарда ЛЖ; существенным замедлением процесса активного диастолического расслабления в результате нарушения обратного транспорта Са2+ в саркоплазматический ретикулум и внеклеточную среду. Систолическая дисфункция ЛЖ развивается при выраженном дефиците макроэргических соединений и обусловлена нарушением актин-миозинового взаимодей-
2+
ствия и доставки Са к сократительным белкам вследствие повреждения ионных насосов и истощения запасов макроэргических соединений.
Нарушения ритма и проводимости
Внутрижелудочковые и АВ-блокады развиваются у больных ИБС, главным образом, вследствие диффузного и очагового кардиосклероза, а также хронического нарушения кровоснабжения АВ-узла и проводящей системы сердца.
В основе желудочковых и суправентрикулярных нарушений ритма лежит -вы раженная электрическая негомогенность сердечной мышцы, отдельные участки которой отличаются по продолжительности эффективных рефрактерных - пе риодов, общей длительности реполяризации, по скорости проведения электрического импульса, что способствует возникновению ранних и поздних деполяризаций и формированию повторного входа волны возбуждения(re-entry). Желудочковые аритмии высоких градаций, фатальные нарушения проводимости (АВ-блокада III степени, асистолия желудочков ) являются наиболее частыми причинами внезапной сердечной смерти у больных ИБС.
3.3. КЛАССИФИКАЦИЯ
Существуют многочисленные варианты клинических проявлений этого заболевания: внезапная сердечная смерть (ВСС), стенокардия, безболевая ишемия миокарда (БИМ), инфаркт миокарда (ИМ), постинфарктный кардиосклероз. Общепринятой клинической классификации ИБС не существует. Это связано с быстро меняющимися представлениями о механизмах развития коронарной недостаточности, с наличием общего морфологического субстрата различных форм ИБС и возможностью быстрого и часто непредсказуемого перехода одной клинической формы этого заболевания в другую, существованием у одного больного нескольких форм ИБС(постинфарктного кардиосклероза, стенокар-
98
дии, безболевой ишемии миокарда). Наибольшее распространение в нашей стране получила классификация ВКНЦ АМН СССР(1984), разработанная на основе рекомендаций экспертов ВОЗ (1979).
Клиническая классификация ишемической болезни сердца (1984)
1. Внезапная сердечная смерть (первичная остановка сердца). 2. Стенокардия. 2.1. Стенокардия напряжения: 2.1.1. Впервые возникшая стенокардия. 2.1.2. Стабильная стенокардия (с указанием функционального класса отI до IV). 2.1.3. Прогрессирующая стенокардия (нестабильная). 2.2. Спонтанная (особая, вариантная, вазоспастическая) стенокардия. 3. Инфаркт миокарда. 3.1. Крупноочаговый (трансмуральный). 3.2. Мелкоочаговый. 4. Постинфарктный кардиосклероз. 5. Сердечная недостаточность (с указанием формы и стадии). 6. Нарушения сердечного ритма (с указанием формы).
Позднее в эту классификацию была добавлена еще одна форма ИБС- “безболевая ишемия миокарда” (БИМ). Последние две формы ИБС в этой классификации (сердечная недостаточность, нарушения сердечного ритма) рассматриваются как самостоятельные варианты течения заб и диагностируются при отсутствии у больных других клинических проявлений ИБС (стенокардии, ИМ, постинфарктного кардиосклероза).
Классификация ишемической болезни сердца
1. Внезапная сердечная смерть. 2. Стенокардия. 2.1. Стабильная стенокардия напряжения (с указанием функционального класса отI до IV). 2.2. Нестабильная стенокардия: 2.2.1. Впервые возникшая стенокардия (ВВС).* 2.2.2. Прогрессирующая стенокардия (ПС). 2.2.3. Ранняя постинфарктная или послеоперационная стенокардия. 2.3. Спонтанная (вазоспастическая, вариантная, Принцметала) стенокардия. ** 3. Безболевая ишемия миокарда. ** 4. Микроваскулярная стенокардия (кардиальный синдром Х). 5. Инфаркт миокарда. 5.1. Инфаркт миокарда с зубцомQ (крупноочаговый, трансмуральный). 5.2. Инфаркт миокарда без зубца Q (мелкоочаговый). 6. Постинфарктный кардиосклероз. 7. Сердечная недостаточность (с указанием формы и стадии). 8. Нарушения сердечного ритма и проводимости (с указанием формы).
Примечание: * - иногда впервые возникшая стенокардия с самого начала имеет стабильное течение; ** - некоторые случаи безболевой ишемии миокар-
да, тяжелые приступы спонтанной стенокардии могут быть отнесены
кнестабильной стенокардии.
Врабочей классификации предусмотрено выделение основных вариантов нестабильной стенокардии, которая занимает как бы промежуточное положение между стабильной стенокардией напряжения и ИМ, отличаясь высоким риском возникновения ИМ и летальностью (10-20% в год по сравнению с3-4%
вгод при стабильной стенокардии напряжения). Многие случаи нестабильной
99
стенокардии, сопровождающиеся относительно непродолжительной (в течение нескольких дней) отрицательной динамикой ЭКГ (депрессией сегмента RS-Т, инверсией Т, преходящими нарушениями ритма и проводимости) вполне соответствуют распространенному в прошлом в отечественной литературе термину “острая очаговая дистрофия миокарда”.
Важно выделение в особую рубрику случаев безболевой ишемии миокарда (БИМ), которая диагностируется с помощью современных инструментальных методов функционального исследования сердца(нагрузочные тесты, суточное мониторирование ЭКГ по Холтеру, радионуклидная сцинтиграфия миокарда с 201Т1), но не сопровождается характерными для ИБС приступами стенокардии напряжения или покоя. Понятие БИМ включает и те случаи подтвержденной ИБС, которые проявляются лишь неспецифическими“застывшими” изменениями на ЭКГ(депрессия сегмента RS-Т и/или инверсия зубца ) Т
и которые ранее нередко трактовались как проявления атеросклеротического диффузного кардиосклероза.
Рабочая классификация ИБС имеет отчетливую клиническую направленность, подчеркивая необходимость выделения среди больных ИБС группы со стабильным и нестабильным течением заболевания, в основе которых лежат различные патогенетические механизмы формирования хронической и острой коронарной недостаточности. Термин острый коронарный синдром(ОКС) получил широкое распространение в последние десять лет. В настоящее время этим термином объединяют нестабильную стенокардию, ИМ без зубца Q, ИМ
с зубцом Q. В эту группу можно отнести и внезапную сердечную смерть, если она обусловлена наличием ИБС. Основанием для объединения различных клинических форм ИБС явились современные исследования, в которых убедительно продемонстрировано, что острое развитие указанных вариантов ИБС происходит в результате разрыва или нарушения целостности атеросклеротической
бляшки с последующим |
формированием |
тромба в поврежденном эндотелии |
КА. |
|
|
Последствия такой |
тромботической |
окклюзии и клинический вариант |
ИБС, зависят от степени и длительности прекращения коронарного кровотока, а также от выраженности коллатерального кровообращения. При различных вариантах нестабильной стенокардии формируется тромбоцитарный(“белый”) тромб, который в большинстве случаев подвергается спонтанному тромболизису. При более длительной коронарной окклюзии(до 1 ч) и наличии коллатералей развивается ИМ без зубцаQ (мелкоочаговый). При быстрой полной и продолжительной окклюзии (более 1 ч) формируется хорошо фиксированный прочный коронарный тромб, полностью прекращается коронарный кровоток и развивается крупноочаговый (трансмуральный) ИМ с зубцом Q. Широкое ис-
пользование термина ОКС в современной кардиологической практике лишь подчеркивает необходимость уделять особое внимание любым клиническим проявлениям нестабильного состояния коронарного кровотока, который может
100
завершиться восстановлением прежнего уровня коронарного кровообращения, либо закончиться развитием ИМ или возникновением внезапной сердечной смерти.
При стабильной стенокардии напряжения, в основе которой лежит медленно прогрессирующее стенозирование проксимальной , КАнеадекватное расширение венечных сосудов в ответ на увеличение потребности миокарда в кислороде и спазм коронарных артерий, риск возникновения ИМ и внезапной смерти существенно более низкий, чем при нестабильной стенокардии. Среди больных со стенокардией следует выделять пациентов со стабильной стенокардией напряжения и больных с нестабильной стенокардией, которые существенно различаются по механизмам развития коронарной недостаточности, степени риска острого ИМ, внезапной смерти.
Понятие ОКС имеет важное практическое значение, поскольку объединяет ряд вариантов (нестабильнуюИБС стенокардию, мелкоочаговый и крупноочаговый ИМ), в большинстве случаев имеющих общую морфологическую основу - разрыв атеросклеротической бляшки и формирование тромба в КА. Это подчеркивает возможность трансформации одной клинической формы заболевания (нестабильной стенокардии) в другую (ИМ или внезапную смерть). Современные методы лабораторно-инструментальной диагностики позволяют выделить среди больных ИБС группу лиц с так называемой спонтанной (вазоспастической, вариантной) стенокардией, безболевой ишемией миокарда и микроваскулярной стенокардией, которые выделены в рабочей классификации в отдельные рубрики.
Любой больной ИБС может соответствовать различным рубрикам клинической классификации. Больной со стабильной стенокардией напряжения может иметь клинические и инструментальные признаки постинфарктного кардиосклероза, сердечной недостаточности, аритмий. В этой главе рассматриваются клиническая картина, методы диагностики и лечения стабильной стенокардии напряжения, безболевой ишемии миокарда, вазоспастической стенокардии Принцметала и микроваскулярной стенокардии. В ряде случаев три последние формы ИБС могут приобретать характер нестабильного течения.
101
Глава IV ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ
4.1. ОПРЕДЕЛЕНИЕ
Внезапная сердечная смерть(ВСС) - это тяжелый, молниеносно протекающий клинический вариант ИБС. К внезапной сердечной смерти относят только те случаи внезапного прекращения сердечной деятельности, которые характеризуются следующими признаками: 1. Смерть наступила в присутствии свидетелей в пределах 1 часа после возникновения первых угрожающих симптомов (в недавнем прошлом этот период ограничивали 6 часами). 2. Перед наступлением смерти состояние больных оценивалось окружающими как - ста бильное и не вызывающее серьезных опасений. 3. Смерть произошла при обстоятельствах, исключающих другие ее причины(насильственная смерть, травмы, другие смертельные заболевания).
ВСША количество ВСС достигает до500 000 за год, принося огромный экономический и социальный ущерб. В настоящее время признано, что ВС является одним из факторов, который приводит к снижению продолжительности жизни населения. В 85-90% случаев причиной внезапной сердечной смерти является ИБС, причем любые ее клинические варианты, включая бессимптомное течение, когда внезапная смерть является первым и последним клиническим проявлением болезни.
Вцелом примерно 25-30% больных верифицированной ИБС умирает внезапно. Наибольшему риску внезапной сердечной смерти подвержены: больные острым ИМ (особенно в первый час развития инфаркта); больные нестабильной стенокардией; пациенты, перенесшие в прошлом ИМ, особенно лица с кардиомегалией и застойной сердечной недостаточностью; больные ИБС с желудочковыми аритмиями высоких градаций; больные ИБС, имеющие несколько основных факторов риска (АГ, ГЛП, курение, нарушения углеводного и жирового обменов).
Внезапная смерть, наступившая в острой фазе ИМ, расценивается как “смерть от инфаркта”. Тем не менее по своим механизмам, клинической картине и комплексу необходимых реанимационных мероприятий она полностью соответствует внезапной сердечной смерти, развивающейся при других формах ИБС. К другим причинам ВСС относятся любые заболевания сердца, сопровождающиеся выраженной гипертрофией миокарда(ГКМП, стеноз устья аорты), застойная сердечная недостаточность любого генеза, кардиогенный шок любого генеза (помимо острого ИМ), тампонада сердца любого генеза (при экссудативном перикардите), тромбоэмболия легочной артерии, синдром удлиненного интервала Q-Т.
102
4.2. ПАТОГЕНЕЗ
У большинства умерших внезапно больных ИБС(85-90%) на аутопсии обнаруживают значительные атеросклеротические изменения КА: сужение их просвета более чем на75% и многососудистое поражение коронарного русла. Только у 10-15% внезапно умерших эти изменения отсутствуют. Атеросклеротические бляшки, расположенные преимущественно в проксимальных участках КА бывают осложненными, с признаками повреждения эндотелия и образованием пристеночных или полностью окклюзирующих просвет сосуда тромбов.
Эти изменения вместе с возможной в этих условиях динамической окклюзией (выраженным спазмом) венечных сосудов и увеличением потребности миокарда в кислороде являются причиной развития острого очагового ишемического повреждения сердечной мышцы, лежащего в основе внезапной сердечной смерти.
На аутопсии у10-15% больных ИБС, умерших внезапно, выявляются макроскопические и/или гистологические признаки острого ИМ. Это объясняется тем, что для формирования таких признаков требуется не менее18-24 ч. Тем не менее результаты электронной микроскопии показывают, что уже через 20-30 мин после прекращения коронарного кровотока начинается процесс -не обратимых изменений клеточных структур миокарда, который завершается уже через 2-3 ч коронарной окклюзии. Возникают выраженные необратимые нарушения метаболизма миокарда, ведущие к электрической нестабильности сердечной мышцы и фатальным нарушениям ритма.
Основными причинами внезапной сердечной смерти являются: фибрилляция желудочков и асистолия сердца. Фибрилляция желудочков - это частое (до 200-500 в мин), но беспорядочное, нерегулярное возбуждение и сокращение отдельных мышечных волокон. В результате такой хаотической активации от-
дельных групп кардиомиоцитов одномоментное синхронное их сокращение становится невозможным. Наступает асистолия желудочков, и кровоток прекращается.
Асистолия сердца - это полное прекращение деятельности сердца, его остановка. Первичная асистолия обусловлена нарушением функции автоматизма СА-узла, а также водителей ритмаII и III порядка (АВ-соединения и волокон Пуркинье). В этих случаях асистолии предшествует так называемая электромеханическая диссоциация сердца, при которой еще сохраняются признаки минимальной электрической активности сердца в виде быстро истощающегося синусового, узлового или редкого идиовентрикулярного ритма, но критически снижается сердечный выброс. Электромеханическая диссоциация достаточно быстро переходит в асистолию сердца. Асистолии сердца часто предшествует также фибрилляция и трепетание желудочков.
103
ВСС может быть следствием различных заболеваний, в том числе массивной тромбоэмболии легочной артерии, разрыва субарахноидальной аневризмы. Чтобы ограничить спектр причин ВС заболеваниями сердца, используется термин «внезапная сердечная смерть» (ВСС). Предлагается выделять «коронарную» и «некоронарную» ВСС. Популяционные исследования показали, что ФР развития ВСС в основном соответствуют ФР коронарного атеросклероза: пожилой возраст, мужской пол, семейный анамнез ИБС, повышение уровня ХС ЛПНП, АГ, курение и СД. В ряде исследований отмечена взаимосвязь ВСС с повышенной ЧСС и значительным злоупотреблением алкоголем.
Главным механизмом повышения риска ВСС считается гипертрофия ЛЖ. В ряде исследований была выявлена ассоциация между депрессией сегментаST или изменениями зубца Т и повышенным риском ВСС. Эти изменения ЭКГ часто указывают на наличие нераспознанной ИБС или гипертрофии ЛЖ. Важным независимым предиктором ВСС является семейная предрасположенность. Причем в семьях, в которых наблюдались случаи ВСС по отцовской и материнской линиям, относительный риск смерти возрастал в9 раз. Чаще всего жертвами ВСС бывают мужчины старше 45 лет; женщины поражаются в более позднем возрасте (65 лет).
Роль нарушений ритма в генезе внезапной смерти велика, но отнюдь не единственна. Кроме них, должна иметься еще и какая-то инвалидизация миокарда, а также необходимо воздействие фактора, непосредственно приводящего к наступлению внезапной смерти. Это способствовало разработке формулы внезапной смерти: Внезапная сердечная смерть= субстрат + триггерный факторы. Субстрат представляет собой анатомические и/или электрические отклонения, связанные с приобретенными или врожденными заболеваниями сердца. Триггерными факторами могут являться механические, метаболические, неврологические, ишемические или ятрогенные воздействия. Определить все переменные в формуле для каждого больного не всегда возможно, днако эта формула может способствовать выявлению больных с повышенным риском развития ВСС.
Анатомический субстрат, лежащий в основе внезапной смерти, чаще всего представляет наличие ИБС или другого заболевания, не связанного с ишемией миокарда. Анатомическим субстратом неишемического генеза могут явиться первичные заболевания миокарда, вторичные поражения миокарда вследствие пороков клапанов, перегрузки давлением или объемом. Будет полезным рассмотреть каждый механизм в отдельности.
Почти у 90 % лиц, умерших внезапно в возрасте 20-64 лет, была констатирована ИБС. У больных с острой тромботической окклюзией основной коронарной артерии при отсутствии перенесенного ИМ в анамнезе наиболее вероятной причиной остановки сердца является фибрилляция желудочков (ФЖ), однако ВВС может быть результатом полной поперечной блокады сердца или аси-
104
столии, особенно при поражении правой коронарной артерии. Хотя ВСС при ИМ обычно связана с аритмией, она может быть обусловлена новым эпизодом ишемии миокарда и/или повторным инфарктом на фоне рубцовых изменений.
Полная поперечная блокада, асистолия или электромеханическая диссоциация могут быть причинами ВСС приблизительно у25% больных. У больных с тяжелой ХСН этот показатель достигает62%. Фремингемское исследование показало, что 50% случаев внезапной смерти у мужчин и 64 % у женщин возникают на фоне бессимптомной ИБС.
Большое значение имеет время суток: наибольшее количество ИМ, нарушений мозгового кровообращения и ВСС происходят в6 часов утра и 12 часов дня. Это связано с циркадными изменениями активности нейрогормональных систем, агрегационной способности тромбоцитов, тяжести желудочковых аритмий (ЖА). В многочисленных исследованиях больных, выживших после ВСС, установлены ее факторы риска: повышение конечного диастолического давления ЛЖ; низкая ФВ ЛЖ (ФВ < 15-20%); большое количество пораженных атеросклерозом коронарных сосудов, плохая проходимость инфарктсвязанной коронарной артерии; проксимальное поражение левой передней нисходящей коронарной артерии; постинфарктная аневризма ЛЖ; ХСН III-IV ФК; частые желудочковые экстрасистолы (> 10 в час) и сложные желудочковые нарушения ритма; мужской пол; продолжительность HV-интервала (скорость проведения по системе ГисаПуркинье); удлинение интервала QT; легкая индукция аритмии ко время электрофизиологического исследования с трудным ее подавлением; снижение вариабельности сердечного ритма и чувствительности барорефлекса.
4.3. СТРАТИФИКАЦИЯ РИСКА
В этой связи после установления диагноза ИБС, должна проводиться стратификация риска ВСС, которая определит необходимость дальнейших мероприятий по ее предотвращению. Особую тревогу должны вызывать больные ИБС с левожелудочковой дисфункцией, выраженным поражением коронарных сосудов, гипертрофией ЛЖ, 3-4 ФК ХСН. Вероятность развития ВСС высока при заболеваниях сердца вследствие первичного поражения миокарда. Гипертрофическая кардиомиопатия (ГКМП), характеризующаяся увеличенной сократимостью и диастолической дисфункцией, может протекать так же тяжело, как и дилатационная, характеризующаяся плохой сократимостью и застойной недостаточностью кровообращения. Различные инфильтративные процессы и поражения миокарда вследствие клапанных пороков сердца тоже необходимо принимать в расчет при рассмотрении причин ВСС.
До открытия ГКМП в качестве ФР ВСС газеты часто печатали репортажи о смерти университетских спортсменов, наступавшей во время соревнований. Самой частой причиной ВСС у молодых людей, в том числе у спортсменов, является ГКМП. ГКМП представляет собой наследственное заболевание сердечной мышцы, которое вызвано мутациями генов, кодирующих белки сердечных
105
саркомеров. Поскольку ГКМП является генетическим заболеванием(аутосомным доминантным с различной степенью пенетрации), после ее выявления требуется осмотр всех членов семьи больного. Больным с ГКМП должно рекомендоваться амбулаторное мониторирование ЭКГ, поскольку выявление нестойкой ЖТ служит признаком высокого риска развития ВСС.
Причины желудочковых аритмий (ЖТ, ФЖ) и ВСС у больных ГКМП: значительно большая частота распространения клеточной дезорганизации ткани (было значительно более выражено в миокарде внезапно умерших больных ГКМП) - условия возникновения re-entry; дегенерация гипертрофированных кардиомиоцитов, что приводит к перегрузке их кальцием и сенсибилизации к катехоламинам; наличие дополнительных проводящих путей у части больных; ишемия миокарда из-за изменения соотношения перфузии мышечной массы, сдавления передней нисходящей коронарной артерии, снижения субэндокардиального кровотока (наличия мышечных мостиков); фиброз миокарда.
Возможны гемодинамические причины ВСС у больных ГКМП. Резкое снижение наполнения ЛЖ из-за резкого снижения его податливости(наполнение еще больше снижается при пароксизме мерцательной аритмии). Полная или почти полная обструкция его выходного тракта что может приводить к развитию гипотензии, отека легких или ИМ. Триггером остановки сердца у больных ГКМП является интенсивная физическая нагрузка. Стратификация риска при ГКМП основывается на нескольких прогностических факторах. Доказан высокий риск развития ВСС у больных с остановкой сердца в анамнезе или устойчивой ЖТ (класс рекомендаций I, уровень доказанности В). Показано прогностическое значение при одновременном наличии нескольких ФР семейного анамнеза ВСС, синкопальных состояний, выраженной гипертрофии миокарда ЛЖ(толщина стенок > 3 см), снижения уровня АД в ответ на физическую нагрузку, нестойкой ЖТ при Холтеровском мониторировании.
ФР смертности больных ДКМП включают в себя: низкую ФВ ЛЖ, мужской пол, пожилой возраст, гипонатриемию, наличие III тона, синусовую тахикардию, повышение давления заклинивания легочной артерии, системную гипотонию, мерцание предсердий. Примерно 30% больных ДКМП умирают внезапно. Причинами ВСС у больных ДКМП, как и у больных с ХСН любой этиологии, могут быть не только ЖА, но и брадикардии, ТЭЛА и электромеханическая диссоциация при далеко зашедших формах заболевания. Определен высокий риск ВСС у больных ДКМП и остановкой сердца или ФЖ в анамнезе и наличием устойчивой ЖТ (класс рекомендаций I, уровень доказанности В). Важным предиктором ВСС у больных ДКМП являются синкопальные состояния(класс рекомендаций Па, уровень доказанности В). Выявлены такие предикторы ВСС, как снижение ФВ ЛЖ, конечный диастолический размер ЛЖ, нестойкая ЖТ и возможность индукции аритмии во время программируемой стимуляции, но предсказательная точность этих факторов по отдельности невысока(класс рекомендаций ПЬ, уровень доказанности В).
106
Заболевание имеет прогрессирующее течение, и у многих больных со временем начинают выявляться желудочковые нарушения ритма сердца. ЖА возникают у 87-96% больных с ДКМП: у 44% пациентов регистрируется бигеминия, в 84% случаев - ЖЭ высоких градаций, у 12% больных - монофокальная ЖЭ, у 49 % больных - пробежки желудочковой тахикардии (ЖТ). Нестойкая ЖТ является чувствительным (80%), но неспецифичным (21%) предиктором ВСС. Однако у больных с ДКМП и выраженным снижением сократительной способности ЛЖ (ФВ < 40%), у которых при Холтеровском мониторировании обнаруживают эпизоды ЖТ (или спаренные желудочковые экстрасистолы), относятся к группе высокого риска развития ВСС. У 75 % внезапно погибших больных с ДКМП по данным мониторного наблюдения имелось более20 спаренных ЖЭ или 20 эпизодов ЖТ в течение суток. Причем подавление бессимптомной нестойкой ЖТ антиаритмическими препаратами не всегда изменяет прогноз. Прогностическое значение поздних потенциалов, дисперсии QT, вариабельности сердечного ритма, альтернации зубца Т и ЧСС не подтверждено.
Аритмогенная правожелудочковая кардиомиопатия(АПЖК, традиционно называемая аритмогенной дисплазией правого желудочка) - заболевание, характеризующееся замещением миокарда ПЖ фиброзно-жировой тканью и клинически проявляющееся желудочковой тахикардией QRSс -комплексами, имеющими морфологию блокады левой ветви пучка Гиса, СН и внезапной ВСС. Когда дисплазия охватывает лишь часть ПЖ, его функциональная способность страдает минимально и ведущими, часто единственными клиническими проявлениями заболевания являются желудочковые аритмии, которые могут приводить к развитию ВС. При достаточной длительности заболевания возникает регионарная, а затем и глобальная дисфункция ПЖ с его недостаточностью, при дальнейшем прогрессировании заболевания поражается ЛЖ и развивается - би вентрикулярная СН. Диагностика болезни общепринятыми методами сложна, поэтому в части случаев болезнь остается нераспознанной вплоть до первого своего проявления - внезапной смерти. Установлено, что 25 % ВСС у молодых людей и спортсменов связано с ранее не диагностированной АПЖК.
В основе АПЖК лежит аномальное развитие в процессе онтогенеза части или всего миокарда ПЖ, когда миокардиальные волокна частично или полностью замещаются жировой или фиброзной тканью; в тяжелых случаях ПЖ истончается до степени «пергаментного листа» с сопутствующими гемодинамическими и электрическими аномалиями. В ряде случаев могут формироваться аневризматические выпячивания стенки ПЖ. В настоящее время заболевание рассматривают как дегенеративный процесс: «дистрофию» или «атрофию».
Основными критериями АПЖК являются: 1) клиническими - рецидивирующие ЖТ с морфологией блокады левой ножки пучка Гиса; 2) ангиографическими -увеличение ПЖ с зонами гипокинезии, аневризматическими выпячиваниями, которые обычно локализуются в области верхушки, выходного отдела и на нижнедиафрагмальной поверхности ПЖ, формируя «треугольник дисплазии»; 3) гис-
107
тологическими - замещение интрамуральных и субэпикардиальных миокардиальных волокон в соответствующих зонах жировой и фиброзной тканью. Чувствительность этой методики низка, так как по соображениям безопасности(опасность перфорации истонченной стенки) биоптаты обычно берут из перегородки, редко вовлекающейся в патологический процесс. Таким образом, распознавание АПЖК сложно, поскольку патогномоничных признаков этого заболевания нет, а характерные изменения ПЖ выявляются лишь при ангиографии и реже при ЭхоКГ.
У 75-90 % пациентов с АПЖК выявляются аномалии ЭКГ. Наиболее частая - инверсия зубца Т в отведенияхV-V3. Она часто сочетается с небольшой элевацией сегмента ST (< 0,1 мВ). Эти изменения реполяризации неспецифичны и являются лишь малыми диагностическими критериями, так как могут быть вариантом нормы у женщин и детей менее 12 лет, могут быть вторичными при БПВПГ, как изолированной, так и при наследственных заболеваниях сердца с перегрузкой ПЖ.
Желудочковые нарушения ритма при этом заболевании разнообразны и неспецифичны - от единичных правожелудочковых экстрасистолий или стойкой ЖТ с морфологией комплексов по типу БЛВПГ до ФЖ, ведущей к ВСС. Направление ЭОС во время ЖТ зависит от места возникновения импульса. При вертикальном направлении ЭОС это выносящий тракт ПЖ, при горизонтальном направлении - нижняя стенка. Для пациентов с развернутой клиникой АПЖК обычно возникновение ЖТ с разной морфологией комплексов, что предполагает наличие нескольких аритмогенных фокусов в ПЖ. Электрическая нестабильность миокарда и прогрессирующая дисфункция желудочков определяют естественное течение АПЖК. Желудочковые аритмии могут приводить к ФЖ и ВС. Доказанный при АПЖК дисбаланс в адренергической иннервации может
играть большую роль в аритмогенезе, потому что при этом увеличивается склонность к ЖТ вследствие дисперсии рефрактерных периодов и генерации отложенных постдеполяризационных импульсов, обычно при физической нагрузке и повышении концентрации катехоламинов.
Наиболее частые причины смерти при АПЖКтяжелая ЖА и прогрессирующая СН. Смертность составляет от 4 до 20% за год. Сведения об оценке риска ВСС у больных с АПЖК ограничены. Предикторами ВСС в небольших исследованиях были показаны диффузная дилатация ПЖ, поражение ЛЖ, дисфункция/дилатация ПЖ+индуцированная устойчивая ЖТ, остановка сердца/ФЖ в анамнезе, ЖТ (класс рекомендаций Па, уровень доказанности С). Также прогностическое значение имеют семейный анамнез ВСС, обмороки, поздние потенциалы + дисфункция ПЖ, программируемая ЭКС (класс рекомендаций lib, уровень доказанности С). Значение дисперсии QT или наличия сложного зубца Т, а также ЖЭ не подтвердилось(класс рекомендаций III, уровень доказанности С).
108
Изучение причин смерти больных с искусственными клапанами сердца в отдаленном послеоперационном периоде показало, что часть из них умирает внезапно. Сведения о случаях ВСС больных в отдаленном периоде после операций протезирования клапанов довольно противоречивы. Результаты операции в течение 5 лет после изолированного аортального (146 больных) и изолированного митрального (79 больных) протезирования и показали, что 23% больных после митрального и 16% после аортального протезирования погибли внезапно.
Имеются две группы больных с искусственными клапанами сердца, погибших внезапно: первая - ВС которых непосредственно связана с дисфункцией протеза (или протезов) клапанов, вторая - не связанная с ними. К ФР, имевшимся у больных второй группы, М. Foppl et al., которые также приводят данные о достаточно высоком проценте ВС после изолированного аортального протезирования (у 599 больных в отдаленные сроки24% причин смерти составила внезапная смерть), относят гипертрофию левого ЛЖ, блокаду ножек пучка Гиса,
ранние желудочковые экстрасистолы на ЭКГ и большой процент коронарных сосудов с гемодинамически незначимыми стенозами, которые не были шунтированы.
Смертность, в том числе от ВС в отдаленном периоде была выше у больных с IV предоперационным ФК и после множественного протезирования (протез St. Jude Medical). Отдельно следует сказать о тяжелых аритмиях, возникающих после операций на открытом сердце. Подавляющее большинство в этой группе составляют больные после радикальной коррекции тетрады Фалло(РКТФ). По данным некоторых авторов, желудочковые нарушения ритма после РКТФ на обычной ЭКГ находят у1/10 части оперированных больных, при Холтеровском мониторировании желудочковая экстрасистолия отмечается у76 % больных. 38% прооперированных больных (8 из 21) умерли внезапно в среднем через3,4 года после операции, причем у всех умерших давление в ПЖ после коррекции порока превышало 70 мм рт. ст.
Частота возникновения нарушений ритма прямо зависела от возраста, в котором была произведена операция. Аритмии, играющие значительную роль в структуре поздней послеоперационной смертности, наблюдаются также у больных с хронической перегрузкой желудочков, оперированных по поводу других врожденных пороков сердца. Формирование нарушений ритма после операций на
открытом сердце прежде всего связано с характером операционного доступа (правая вентрикулотомия при РКТФ), с хронической гипертрофией и дилатацией ПЖ, а также нарушениями внутрижелудочковой проводимости. Эти аритмии возникают по механизму re-entry или триггерной активности.
У другой группы больных с нормальными коронарными артериями и явно с нормальной функцией и левого и правого желудочков может быть миокардит. До 44% случаев ВСС у молодых людей связаны с развитием этого заболевания. Оно может быть обнаружено при миокардиальной биопсии, если игла, к
109
счастью, попадет в нужное место в миокарде, по лимфоцитарной инфильтрации миокарда, характерной для миокардита. Выбор соответствующей терапии остается проблемой.
Наиболее важными ФР ВС у больных с пролапсом митрального клапана являются остановка сердца в анамнезе (класс рекомендаций I, уровень доказанности С), случаи ВСС у родственников в молодом возрасте и миксоматозная дегенерация створок митрального клапана(класс рекомендаций Па, уровень доказанности С). Значение удлинения и дисперсии интервалаQT, частых и сложных ЖА, митральной недостаточности, индуцируемых ЖА и поздних потенциалов желудочков для оценки риска ВС у этих больных окончательно не установлено (класс рекомендаций lib, уровень доказанности С).
Синдром Бругада - аритмогенное заболевание, сопровождающееся высоким риском ВС. Заболевание характеризуется преходящей блокадой правой ножки пучка Гиса (ПНПГ) подъемом ST в V1-V3. Синдром Бругада является аллельным заболеванием по отношению к третьему вариантуCYQT и обусловлен мутациями гена, кодирующего натриевые каналы сердца (SCN5A). Заболевание передается по аутосомно-доминантному типу. Клинические проявления включают обмороки и эпизоды остановки сердца, связанные с развитием полиморфной ЖТ, которые в основном возникают в покое и во время сна. Чаще развивается у мужчин. Вероятность ВСС в течение 3 лет при этом заболевании составляет 30%. ФР ВС при этом заболевании являются мужской пол, возраст 3040 лет, семейный анамнез и обмороки(класс рекомендаций IIа, уровень доказанности С). Значение индуцируемых ЖТ/ФЖ для оценки риска ВСС спорно. Недавно было показано, что программируемая электростимуляция не позволяет идентифицировать больных, у которых высок риск остановки сердца(класс рекомендаций IIб, уровень доказанности С).
Брадиаритмии являются причиной ВС у20% больных. Термин «брадиаритмии» используется для обозначения различных состояний, связанных с нарушением образования и проведения по миокарду электрических импульсов. Брадиаритмии (синусовая брадикардия, эпизоды асистолии, синоатриальная блокада) могут быть проявлением синдрома слабости синусового узла(СССУ).
СССУ может проявляться головокружениями, обмороками и приводить к развитию ВСС. ФР развития ВС у больных с СССУ могут быть обмороки в анамнезе, особенно сопровождающиеся травмой. Постоянная электрокардиостимуляция у больных с СССУ приводит к устранению симптомов и улучшению качества жизни. Однако ее влияние на частоту ВСС неизвестно.
Нарушение проведения возбуждения по миокарду может быть дегенеративного и воспалительного генеза. Чаще дегенеративные заболевания проводящей системы проявляются поражением волокон пучка Гиса или блокадой ветви пучка Гиса и иногда приводят к полной атриовентрикулярной блокаде. Многие больные с полной поперечной блокадой требуют установления постоянного во-
110
дителя ритма, хотя некоторые из них при условии гемодинамической стабильности и наличия выскальзывающего ритма с частотой около50 сокращений в 1 мин хорошо поддаются медикаментозному лечению.
Распространенное воспаление проводящей системы сердца характерно для синдрома Лева, в то время как склеродегенеративные изменения проводящей системы носят название синдрома Ленегра. Кроме того, полная атриовентрикулярная блокада может быть результатом ишемии сердца и возникать на фоне нормальных коронарных сосудов и нормальной функции ЛЖ.
Воспалительные процессы могут поражать нервы сердца в виде ганглионитов, вирусных или врожденных нейропатий или нейротоксических поражений. В редких случаях эти болезни могут также манифестировать ВСС. Врач должен учитывать, что у больного может оказаться более одного заболевания. В этом случае установка постоянного водителя ритма при полной атриовентри-
кулярной блокаде сердца не предотвратит ВСС вследствие желудочковойта хиаритмии. ВСС наступает чаще в минуты напряженной умственной работы, во время стресса после полемики или ссоры, после напряженной физической нагрузки, при управлении автомобилем или в момент передышки после длительного управления, во время сексуальной активности у мужчин средних лет. Во всех этих случаях речь идет об острой ИБС.
Имеет смысл указать на группу лиц, самостоятельно занимающихся физическим тренингом. Исследования показали более высокий риск ВС у этих людей (при снижении риска возникновения ИБС). Показано, что ВС во время физической нагрузки или через короткое время после нее может возникать на любом этапе самостоятельных занятий спортом- в начале занятий, на первом году, но иногда и у лиц, занимающихся самостоятельным тренингом по10-15 лет и более. Всех умерших внезапно среди указанного контингента можно разделить на две группы: менее 30-35 лет и старше этого возраста. В первой возрастной группе преобладают лица, страдающие нераспознанными врожденными аномалиями коронарных артерий, ГКМП, реже пороками соединительной ткани (синдромом Марфана, Эйлерса-Данлоса, при которых нередко бывает разрыв аорты), нераспознанными врожденными и приобретенными пороками сердца.
Среди лиц старше30 лет, умерших внезапно во время физической -на грузки, преобладают люди с бессимптомным атеросклеротическим поражением коронарных сосудов. В связи с этим некоторые авторы предлагают лиц, начинающих самостоятельные занятия физическими нагрузками, считать группой с повышенным риском ВСС. Поэтому они должны подвергаться тщательному обследованию, включающему в себя в указанной последовательности ЭКГ, ЭхоКГ, Холтеровское амбулаторное мониторирование, сцинтиграфию миокарда с 201Т1 и/или радиоизотопную вентрикулографию на высоте физической нагрузки. Метаболические и электрические отклонения, особенно гипокалиемия и
111
гипомагнезиемия, могут быть причиной учащения или утяжеления течения желудочковой аритмии. Больные, которые принимали диуретики без возмещения калия, могут иметь повышенный риск развития ВСС в случае острого ИМ.
Ятрогенные случаи часто связаны с применением антиаритмических препаратов 1-го класса, препаратов дигиталиса или таких агентов, как трициклические антидепрессанты и фенотиазиды, которые удлиняют интервалQT. Уже давно показано, что антиаритмические препараты 1-го класса имеют парадоксальное проаритмическое действие при патологии сердца. Этот феномен, к сожалению, был подтвержден последними исследованиями по программеCAST, в ходе которой было показано, что в группе бессимптомных больных после ИМ с желудочковой эктопией, леченных флекаинидом и энкаинидом, случаи ВС были достоверно чаще, чем в нелеченой группе. Следовательно, никто не может настаивать на этом виде лечения желудочковых аритмий.
4.4. КЛИНИЧЕСКАЯ КАРТИНА
Около 1/4 случаев |
внезапной сердечной смерти наступает молниеносно |
|
||||||
и без видимых предвестников. Как показывает опрос родственников умерших, |
|
|||||||
у остальных больных за1-2 недели до внезапной смерти отмечаются разнооб- |
|
|||||||
разные, не всегда специфичные, продромальные симптомы, свидетельствую- |
|
|||||||
щие об обострении заболевания: учащение болей в сердце, одышка, общая сла- |
|
|||||||
бость и значительное снижение работоспособности и переносимости физиче- |
|
|||||||
ской нагрузки, сердцебиения и перебои в работе сердца. Внезапная сердечная |
|
|||||||
смерть может быть спровоцирована чрезмерным физическим или нервно- |
|
|||||||
психическим напряжением. Может возникнуть в покое, во время сна. |
|
|
|
|||||
Перед наступлением внезапной сердечной смерти у половины больных |
|
|||||||
отмечается болевой ангинозный приступ, сопровождающийся страхом близкой |
|
|||||||
смерти. Большая часть случаев внезапной сердечной смерти(90%) происходит |
|
|||||||
во внебольничных условиях, что определяет наиболее частый фатальный исход |
|
|||||||
этой формы ИБС. Если же больной находится в стационаре диагноз внезапной |
|
|||||||
сердечной |
смерти |
должен |
быть |
поставлен |
в |
считанные |
с |
|
и незамедлительно начаты реанимационные мероприятия. Во время внезапно |
|
|||||||
развивающейся фибрилляции желудочков или асистолии сердца у больного по- |
|
|||||||
являются |
резкая |
слабость, головокружение. |
Через |
несколько |
секунд |
|
||
в результате полного прекращения мозгового кровотока теряется сознание, появляется тоническое сокращение скелетных мышц, шумное дыхание.
При осмотре кожные покровы бледные с сероватым оттенком, холодные на ощупь. Начинают быстро расширяться зрачки. Пульс на сонных артериях не определяется, тоны сердца не выслушиваются. Примерно через 1,5 мин зрачки максимально расширены. Отмечается отсутствие зрачковых и роговичных рефлексов. Дыхание быстро урежается, становится агональным, появляются очень редкие отдельные “судорожные дыхательные движения”. Через 2,5-3 минут
112
дыхание прекращается совсем. Примерно через 3 минуты от момента наступления фибрилляции желудочков или асистолии в клетках коры головного мозга происходят необратимые изменения.
4.5. ДИАГНОСТИКА
Если больной находится на ЭКГ-мониторном наблюдении, в момент наступления внезапной сердечной смерти можно обнаружить следующие изменения: 1. Фибрилляция желудочков - частые (до 200-500 в минуту) и нерегулярные беспорядочные волны, отличающиеся друг от друга различной формой и амплитудой. Постепенно волны фибрилляции становятся низкоамплитудными
ипереходят в прямую изолинию(асистолия). 2. Трепетание желудочков (иногда предшествует фибрилляции желудочков) - частые относительно регулярные
ипочти одинаковые по форме и амплитуде волны трепетания, напоминающие синусоидальную кривую. Выделить на этой кривой комплексыQRS, сегмент RS-Т и зубец Т не представляется возможным. Вскоре амплитуда волн уменьшается, они становятся нерегулярными и разной амплитудытрепетание переходит в фибрилляцию желудочков. 3. Асистолия сердца - полное отсутствие электрической активности сердца. На ЭКГ определяется изолиния. 4. Электромеханическая диссоциация - на ЭКГ регистрируется редкий синусовый или уз-
ловой ритм, переходящий в oчень редкий идиовентрикулярный ритм, а затем
васистолию.
Кпредикторами внезапной смерти у больных ИБС являются: 1. Возникновение желудочковых аритмий высоких градаций у больных с низкой толерантностью к физической нагрузке и положительной велоэргометрической пробой. 2. Выраженная депрессия сегмента RS-Т (более 2 мм), патологическое повышение АД и раннее достижение максимальной ЧСС во время нагрузочного
теста. 3. Наличие на ЭКГ патологических зубцовQ или комплекса QS в сочетании с блокадой левой ножки пучка Гиса и желудочковой экстрасистолией. 4. Наличие у больного основных факторов риска(АГ, ГЛП, курение, сахарный диабет) в сочетании со снижением толерантности к физической нагрузке и положительной велоэргометрической пробой.
4.6. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
При развитии внезапной сердечной смерти проводят сердечно-легочную реанимацию. Она включает восстановление проходимости дыхательных путей, искусственную вентиляцию легких, непрямой массаж сердца, электрическую дефибрилляцию и медикаментозную терапию. Методы сердечно-легочной реанимации более подробно изложены далее.
Выживаемость после внезапной сердечной смерти(ВСС) варьирует от 5 до 60%. Это зависит от возраста, характера имеющейся патологии, а также интервала времени, прошедшего между началом реанимационных мероприятий и дефибрилляцией. Борьба с внезапной смертью должна проводиться в несколь-
113
ких направлениях: обучение медицинских работников, а также родственников больных с высоким риском ВСС, милиционеров, пожарных и охранников первичным реанимационным мероприятиям: методам механической и автоматической внешней дефибрилляции с помощью специальных приборов и непрямого массажа сердца.
Другим направлением борьбы с внезапной смертью(ВС) является ее профилактика. Знание контингентов больных, имеющих высокий риск ВС, позволяет мониторировать этих лиц, назначать им адекватное лечение, которое, возможно, продлит им жизнь. Больных с бессимптомным течением нестойкой желудочковой тахикардии правильней лечить блокаторами(3-адренергических рецепторов, чем антиаритмическими препаратами 1-го класса, которые способны привести к развитию стойкой ЖТ или ФЖ. В последнее время доказана эффективность имплантируемых кардиовертеров-дефибрилляторов(ИКД) для первичной профилактики ВС у больных, перенесших ИМ, с систолической дисфункцией миокарда ЛЖ и бессимптомной ЖТ.
С целью вторичной профилактики ВС больным со спонтанной устойчивой хорошо переносимой мономорфной ЖТ показаныb-адреноблокаторы или амиодарон. Больным со спонтанной устойчивой гемодинамически нестабильной ЖТ показана имплантация ИКД. Если возможности осуществить имплантацию нет, то назначают (3-адреноблокаторы или амиодарон). Для успешной профилактики внезапной смерти постоянно делаются попытки научиться выявлять больных с электрической нестабильностью сердца. У больных, перенесших острый ИМ, сохраняется высокий риск развития ВСС. В качестве первичной профилактики ее развития применяются препараты, не оказывающие прямого действия на электрофизиологические свойства сердца, но показавшие непрямое влияние на улучшение прогноза у соответствующих категорий больных. Такими препаратами являются иАПФ, антагонисты рецепторов альдостерона, статины, полиненасыщенные жирные кислоты, тромболитики и антитромботические препараты. Кроме того, к снижению частоты ВСС может привести реваскуляризация миокарда.
Учитывая ведущую роль желудочковых аритмий в патогенезе ВС, неоднократно предпринимались попытки снизить ее риск с помощью антиаритмических препаратов. В большинстве исследований, касавшихся изучения эффективности антиаритмических препаратов I класса (таких как дифенин, мексителен, токаинид, флекаинид, энкаинид) у больных, перенесших ИМ, смертность среди больных основной группы не отличалась от таковой в контрольной группе или была более высокой. Нет доказательств благоприятного влияния амиодарона на прогноз после острого ИМ у больных с опасными для жизни желудочковыми аритмиями (ЖА). В то же время результаты недавно проведенного контролируемого исследования свидетельствуют о возможной эффективности длительного применения амиодарона у больных с бессимптомными желудочковыми экстрасистолами (ЖЭ) высоких градаций (по Лауну). F. Burkart et al.
114
(1989) изучили прогноз у 312 больных, перенесших ИМ, которые были разделены на три сопоставимые группы: 1-я - получала антиаритмические препараты I класса, 2-я - амиодарон (200-400 мг/с) и 3-я - не получала антиаритмической терапии. В течение 1 года наблюдений умерли 12 из 114 больных 1-й группы (10%), 5 из 98 больных 2-й группы (5%) и 15 из 114 больных контрольной группы (13%).
Смертность среди больных, леченных амиодароном, была достоверно (на 61%) ниже, а число случаев ВСна 76% меньше, чем в контрольной группе. Анализ эффективности амиодарона в зависимости от состояния функции ЛЖ показал, что препарат эффективен только у больных с ФВ ЛЖ40% или больше (достоверное снижение смертности на86%). В другом исследовании было отмечено уменьшение общей смертности на52% и случаев аритмической смерти или ЖТ с успешной реанимацией на57% при терапии амиодароном (в среднем по 179 мг/с) в течение 1 года после ИМ в подгруппе больных с частой ЖЭ или пароксизмами желудочковой тахикардии (ЖТ) при суточном мониторировании ЭКГ.
Таким образом, если не считать(3-блокаторов, амиодарон (кордарон) - единственный из антиаритмических препаратов, способный улучшать прогноз жизни у больных, перенесших ИМ, снижая повышенный риск ВС. У больных с высоким риском ВС амиодарон, по-видимому, столь же эффективен, как пропранолол, однако он значительно чаще, чем b-адреноблокаторы, вызывает серьезные побочные эффекты при длительном назначении. Поэтому применение амиодарона после ИМ рекомендуют ограничить подгруппой больных с ЖА, у которых b-адреноблокаторы либо противопоказаны, либо недостаточно эффективны. В первую очередь это больные СН, а также больные, которые были успешно реанимированы после фибрилляции желудочков (ФЖ)/ЖТ, развившейся во время лечения b-адреноблокаторами.
В последнее время доказана эффективность имплантируемых кардиовер- теров-дефибрилляторов (ИКД) для первичной профилактики ВСС у больных, перенесших ИМ, с систолической дисфункцией миокарда ЛЖ и бессимптомной ЖТ. С целью вторичной профилактики ВСС больным со спонтанной, устойчивой, хорошо переносимой мономорфной ЖТ показаныb-адреноблокаторы или амиодарон. Больным со спонтанной, устойчивой, гемодинамически нестабильной ЖТ показана имплантация ИКД. Если возможности осуществить имплантацию нет, то назначают b-адреноблокаторы или амиодарон.
115
Глава V
СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
5.1. ОПРЕДЕЛЕНИЕ
Стабильная стенокардия напряжения относится к числу наиболее распространенных клинических форм ИБС. Она возникает на фоне стенозирующего коронарного атеросклероза при наличии в крупных эпикардиальных КА“неосложненной” атеросклеротической бляшки, имеющей плотную и прочную соединительнотканную капсулу. В этих случаях возникновение стенокардии напряжения обычно провоцируется повышением потребности миокарда в кислороде, не сопровождающимся адекватным расширением резистивных КА.
К числу факторов, способствующих повышению потребности миокарда в кислороде, относятся: увеличение частоты сердечных сокращений (ЧСС); повышение инотропизма (сократимости) сердечной мышцы, чаще ассоциирующееся с возрастанием активности САС; повышение постнагрузки и систолического давления в полости ЛЖ (при повышении уровня АД); увеличение преднагрузки и конечно-диастолического объема ЛЖ; увеличение массы миокарда ЛЖ (гипертрофия сердечной мышцы).
Стенокардия напряжения провоцируется физической нагрузкой и другими факторами, повышающими потребность миокарда в кислороде: эмоциональным напряжением, стрессом, повышением АД, увеличением венозного притока к сердцу, сердечной недостаточностью (объемная перегрузка ЛЖ), тахикардией любого генеза. В основе болевого синдрома при стенокардии лежит возникновение преходящей кратковременной ишемии миокарда, вызванной аб-
солютным или относительным уменьшением коронарного кровообращения и/или увеличением потребности миокарда в кислороде.
В очаге ишемии происходит высвобождение ряда химических субстанций, обладающих свойствами медиаторов боли. Главными из них являются серотонин, гистамин, брадикинин, источником которых служат тромбоциты, базофильные лейкоциты и тканевые тучные клетки. Если медиаторы боли выделяются в достаточном количестве, происходит возбуждение специфических болевых рецепторов - ноцицепторов. Причем их чувствительность во многом зависит от концентрации в окружающей рецепторы среде ионов К+ и Na+, а также от содержания простагландинов, образующихся в процессе метаболизма арахидоновой кислоты.
Из очага ишемии болевые импульсы переносятся по афферентным волокнам сердечных нервов к паравертебральной цепочке шейных и грудных гангли-
ев, затем по спиноталамическому тракту спинного мозга к заднебоковым и передним ядрам таламуса и к коре головного мозга, где и формируется боле-
116
вое ощущение. Между степенью ишемии миокарда и интенсивностью боли нет прямой зависимости, поскольку на ее восприятие существенное влияние оказывают состояние рецепторного аппарата, индивидуальный порог болевой чувствительности и уровень эндогенных опиоидов в момент возникновения ишемии.
5.2. КЛИНИЧЕСКАЯ КАРТИНА
По данным Фремингемского исследования примерно 40%у мужчин и у 56% женщин ИБС дебютирует стабильной стенокардией напряжения. В этих случаях стенокардия чаще начинается постепенно, ее интенсивность медленно нарастает. Проходит несколько недель или месяцев с момента начала заболевания обычно прежде чем больной обратится к врачу.
Жалобы
Болевой синдром. Боль при стенокардии носит приступообразный характер, появляясь на фоне относительно благополучного состояния больного, что заставляет пациента сразу обратить на нее внимание, нередко вызывая выраженное беспокойство и страх. В типичных случаях боль локализуется за грудиной, обычно в области верхней и средней ее трети. Реже боль возникает в области верхушки сердца, слева от грудины во II–V межреберьях, под левой лопаткой или даже в левой руке, ключице или в левой половине нижней челюсти. Характер болевых ощущений обычно жгучий, сжимающий, давящий. Иногда больные описывают стенокардию как“чувство дискомфорта в грудной
клетке”. Во время приступа стенокардии больные немногослов и локализацию боли указывают кулаком, прижатым к грудине (симптом С. Левина).
Боль нередко иррадиирует в левую руку, плечо, лопатку, ключицу, реже в нижнюю челюсть слева, в эпигастральную область (особенно при ишемии
заднедиафрагмальной стенки ЛЖ) и еще реже- в правую часть грудины и правую руку (атипичная локализация боли). Особенно часто отчетливая иррадиация боли наблюдается при тяжелых приступах стенокардии. Она связана с наличием в спинальных и таламических центрах анатомической близости афферентных путей иннервации сердца и областей, в которые иррадиирует боль. У большинства пациентов с ИБС(около 70%) боль возникает во время выполнения физической нагрузки (быстрая ходьба, бег, подъем по лестнице).
В этих случаях происходит увеличение ЧСС, сократимости миокарда, а также увеличение объема циркулирующей крови(увеличение преднагрузки), что в условиях стенозирующего атеросклероза КА создает условия для возникновения коронарной недостаточности. Стенокардия напряжения может провоцироваться любыми другими факторами, повышающими потребность миокарда в кислороде. При эмоциональном напряжении происходит закономерная активация САС, увеличивается ЧСС, сократимость миокарда, постнагрузка на ЛЖ.
117
При выраженной статической нагрузке, повышении АД резко возрастает ОПСС и увеличивается постнагрузка на ЛЖ. Многие больные ИБС отмечают быстрое возникновение приступа при выходе на улицу в холодную ветреную погоду. В этих случаях воздействие холода также способствует рефлекторному спазму артерий, увеличению ОПСС и возрастанию постнагрузки. Приступы
стенокардии напряжения могут провоцироваться также обильным |
приемом |
|||
пищи, который сопровождается увеличением ОЦК и вязкости крови. В тяжелых |
||||
случаях боль в |
сердце может возникать |
при переходе |
из |
вертикального |
в горизонтальное |
положение. В этих случаях |
увеличивается |
приток крови |
|
к сердцу, возрастают преднагрузка, что вызывает усиление работы сердца. При стабильной стенокардии напряжения продолжительность болевого приступа обычно не превышает 1–5 мин. Боль быстро проходит при прекращении действия провоцирующих факторов, повышающих потребность миокарда в кислороде.
Наиболее доказательным признаком, подтверждающим связь болевого приступа с ИБС, является быстрый антиангинальный эффект нитроглицерина, который купирует боль в течение1–2 мин. Сублингвальный прием одной таблетки или дозы спрея нитроглицерина сопровождается прежде всего быстрой
изначительной дилатацией периферических вен (кожи, скелетных мышц, органов брюшной полости и других сосудистых областей), депонированием крови
иуменьшением ее притока к сердцу(снижение преднагрузки), снижающим работу сердца и потребность миокарда в кислороде. Важно отличать приступы стенокардии, обусловленные ИБС, от многочисленных заболеваний, также сопровождающихся болями в грудной клетке (таблице 10).
Вцелом для некоронарогенных кардиалгий наиболее характерны - сле дующие признаки: продолжительность боли в области сердца обычно превышает 15–20 минут, иногда боль может длиться часами; боль обычно локализу-
ется в области верхушки сердца или слева от грудиныII–воV межреберье и редко иррадиирует в левую руку и лопатку; боли чаще не приступообразные, носят тупой давящий характер; отсутствует закономерная связь между возникновением боли и выполнением пациентом физической нагрузки; нитроглицерин не купирует боль и нередко только ухудшает общее состояние больного.
Учет этих данных во многих случаях помогает провести дифференциальный диагноз между ИБС и некоронарогенными заболеваниями сердца(таблица 11). Полностью ориентироваться на приведенные признаки не всегда представляется возможным.
Таблица 11. Заболевания, сопровождающиеся болью в грудной клетке
Заболевание |
Анамнез |
Физикальные |
Лабораторно- |
|
|
данные |
инструментальные |
|
|
данные |
118

Стабильная |
Факторы |
|
рис- |
|
Часто |
в |
норме. |
Во |
ЭКГ в покое в норме. |
|
|||||||||
стенокардия |
ка ИБС |
|
|
|
время |
|
|
|
приступаВо |
время |
|
приступа- |
|
||||||
напряжения |
|
|
|
|
может |
|
|
появиться“свежие” |
изменения |
|
|||||||||
|
|
|
|
|
|
пресистолический |
на |
|
ЭКГ. |
|
Признаки |
|
|||||||
|
|
|
|
|
|
III |
тон |
«галопа» |
преходящей |
|
ишемии |
|
|||||||
|
|
|
|
|
|
и |
мягкий |
|
систоли- |
миокарда во время на- |
|
||||||||
|
|
|
|
|
|
ческий шум на вер- |
грузочных тестов |
|
|||||||||||
|
|
|
|
|
|
хушке |
|
|
|
|
|
|
|
|
|
|
|
|
|
Расслаивающая |
АГ, ФР ИБС, |
|
Асимметрия |
|
|
илиРентгенография |
груд- |
|
|||||||||||
аневризма |
аор- |
заболевания |
|
отсутствие |
|
пульсаной |
клетки (расшире- |
|
|||||||||||
ты |
|
соединитель- |
|
на руках. Шум аор- |
ние |
|
аорты). ЭхоКГ, |
|
|||||||||||
|
|
ной ткани |
|
|
тальной |
регургита- |
МРТ |
|
или |
|
рентгенов- |
|
|||||||
|
|
|
|
|
|
ции |
при |
|
проксиская КТ, аортография |
|
|||||||||
|
|
|
|
|
|
мальном |
|
|
расслое- |
|
|
|
|
|
|
||||
|
|
|
|
|
|
нии аорты |
|
|
|
|
|
|
|
|
|
|
|
||
Пищеводный |
Преклонный |
|
Ожирение, |
|
часто |
Эндоскопия, |
монито- |
|
|||||||||||
рефлюкс, |
|
возраст, |
куре- |
|
норма |
|
|
|
|
|
ринг |
|
рН, |
исследова- |
|
||||
спазм пищево- |
ние |
|
|
|
|
|
|
|
|
|
|
ние моторики, рентге- |
|
||||||
да |
|
и ожирение |
|
|
|
|
|
|
|
|
нография с барием |
|
|||||||
Разрыв |
пище- |
Рвота |
|
|
|
Подкожная |
|
эмфи- |
Рентгенография |
груд- |
|
||||||||
вода |
|
|
|
|
|
зема |
|
|
|
|
|
ной |
|
клетки (воздух |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
в средостении) |
|
|
||||
Панкреатит |
Алкоголизм, |
|
Пальпаторное |
|
-наПовышенная |
актив- |
|
||||||||||||
|
|
болезни желч- |
|
пряжение |
в |
|
левомность |
амилазы, |
липа- |
|
|||||||||
|
|
ного пузыря |
|
подреберье, |
|
|
|
зы. Лейкоцитоз |
|
|
|||||||||
|
|
|
|
|
|
в эпигастрии |
|
|
|
|
|
|
|
|
|
|
|||
Язвенная |
- |
боВозможно |
ку- |
|
Дискомфорт |
и боли Эндоскопия, |
рентге- |
|
|||||||||||
лезнь |
|
рение |
|
|
|
в эпигастрии |
|
|
|
нография с барием |
|
||||||||
Заболевания |
Остеохондроз |
|
Болезненность |
|
при |
Рентгенография |
груд- |
|
|||||||||||
грудной стенки |
грудного |
|
от- |
|
глубокой пальпации |
ного |
|
отдела |
позво- |
||||||||||
|
|
дела |
|
позво- |
позвоночника, меж- |
ночника |
|
|
|
|
|||||||||
|
|
ночника, |
хро- |
|
реберьев |
или |
изме- |
|
|
|
|
|
|
|
|||||
|
|
нические |
бо- |
|
нении |
|
положения |
|
|
|
|
|
|
||||||
|
|
ли |
в |
спинетла |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
и шее |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Перикардит |
Часто |
“про- |
Шум |
трения |
|
пери- |
Увеличение |
|
СОЭ, |
||||||||||
|
|
студное” |
|
за- |
карда. |
Иногда |
ли- |
лейкоцитоз, |
|
CR- |
|||||||||
|
|
болевание. |
|
|
хорадка |
|
|
|
|
протеин |
|
|
|
|
|||||
|
|
Молодой |
воз- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
раст |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
из |
Herpes zoster |
Преклонный |
Боль может предМазок по Цангу |
|||||||||||||||||
|
|
возраст, |
|
им- |
шествовать |
появле- |
элементов |
|
сыпи. Че- |
||||||||||
|
|
мунодефицит |
нию типичной сыпи |
тырехкратное |
возрас- |
||||||||||||||
|
|
(может |
|
разна 48–72 ч |
|
|
|
|
тание |
титра |
антител |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
119

|
виться |
|
(в острой стадии |
по |
|
в молодом |
|
сравнению со стадией |
|
|
возрасте) |
|
выздоровления) |
|
Толерантность к физической нагрузке. Для характеристики тяжести течения заболевания и величины коронарного резерва у больных со стенокардией напряжения целесообразно количественно оценить толерантность к физической нагрузке. Стабильная стенокардия напряжения обусловлена“фиксированным стенозом” КА, поэтому порог возникновения боли у больных не изменяется в течение достаточно продолжительного времени.
Боль при стабильной стенокардии напряжения возникает при одном и том же, характерном для данного больного, объеме выполненной работы или величине какой-либо другой нагрузки, вызывающей боль. Для точного определения толерантности к физической нагрузке используют различные функциональные нагрузочные тесты (велоэргометрию, тредмил-тест), подробно описанные ниже. Представление о толерантности можно составить, используя классификацию Канадской ассоциации кардиологов (1976), представленную в таблице 12.
Таблица 12. Классификация стабильной стенокардии напряжения
Функциональный |
Условия возникновения стенокардии напряжения |
|
|
||||
класс (ФК) |
|
|
|
|
|
|
|
I ФК |
Приступы стенокардии возникают редко, только при не- |
|
|
||||
|
обычных |
для |
данного |
пациента |
|
физичес |
|
|
и психоэмоциональных нагрузках. Обычная физическая |
|
|
||||
|
активность не ограничена |
|
|
|
|
||
II ФК |
Приступы стенокардии возникают при ходьбе по ровному |
|
|
||||
|
месту более 500 м, подъеме |
по лестнице на2-3 пролета |
|
|
|||
|
этажей. Вероятность приступа увеличивается в холодную |
|
|
||||
|
и ветреную погоду, при эмоциональном возбуждении, |
|
|
||||
|
после еды и в первые часы после пробуждения. Обычная |
|
|
||||
|
физическая активность ограничена незначительно |
|
|
||||
III ФК |
Боли появляются при медленной ходьбе по ровному мес- |
|
|
||||
|
ту в пределах 100–300 м, подъеме на один этаж. Обычная |
|
|
||||
|
физическая активность значительно ограничена |
|
|
||||
IV ФК |
Приступы возникают при малейшей физической нагруз- |
|
|
||||
|
ке. Больной не способен обслуживать себя в пределах |
||||||
|
квартиры. |
Характерны приступы |
стенокардии в покое, |
||||
|
обычно |
в ночное |
время |
в положении больного |
лежа |
||
|
в постели |
|
|
|
|
|
|
При стенокардии IV ФК приступы стенокардии покоя обусловлены увеличением венозного возврата к сердцу и повышением потребности миокарда в кислороде, возникающие в положении лежа. Такие приступы свидетельству-
120
ют об очень низком коронарном резерве, наличии выраженного стенозирующего коронарного атеросклероза. Редкие приступы стенокардии покоя, в том числе в ночное время, не являются обязательным критерием отнесения больного ИБС к IV ФК. В этих случаях речь может идти об особой(вариантной) форме стабильной стенокардии (вазоспастической стенокардии Принцметала), причиной которой является выраженный спазм крупной КА.
При наличии у больных со стабильной стенокардией напряжения постинфарктного кардиосклероза и признаков левожелудочковой недостаточности, болевой синдром может сопровождаться появлением застойных явлений в легких и появлением одышки. В тяжелых случаях пароксизмы одышки, возникающие при физическом или эмоциональном напряжении или в ночное время, являются у больных ИБС своеобразным эквивалентом стенокардии и указывают на возникновение преходящей ишемии миокарда. Иногда приступ стенокардии напряжения сопровождается тахикардией или перебоями в работе сердца, обусловленными экстрасистолией, короткими пароксизмами фибрилляции предсердий или преходящими нарушениями АВ-проводимости.
Анамнез
Для построения полной диагностической концепции и разработки индивидуального плана лечения больного со стабильной стенокардией напряжения важно проанализировать анамнестические данные. Наибольшее значение имеют указания на наличие у пациента факторов риска ИБС(ГЛП, АГ, курения, ожирения, сахарного диабета), перенесенного в прошлом ИМ, признаков ХСН, а также отягощенной наследственности, которые во многом определяют -тя жесть течения заболевания, его прогрессирование, число осложнений и летальность. У женщин важно оценить время наступления менопаузы и/или признаки климактерических расстройств.
Осмотр
При общем осмотре у больных ИБС можно выявить ряд объективных признаков, указывающих на наличие атеросклероза аорты и периферических сосудов, некоторых ФР (ожирение, ГЛП, АГ), иногда симптомов ХСН, хотя во многих случаях, особенно в сравнительно молодом возрасте, эти симптомы могут полностью отсутствовать. Ожирение, или избыточная масса тела (МТ), выявляется более чем у половины больных ИБС (таблица 13). Для количественной оценки степени ожирения в настоящее время рассчитывают индекс массы тела (ИМТ):
ИМТ = Масса тела (кг) / рост (м2).
Таблица 13. Классификация ожирения по индексу массы тела (ВОЗ, 1997)
Классификация |
ИМТ (кг/м2) |
121

Нормальный диапазон массы тела |
18,5–24,9 |
Преожирение |
|
Избыточная масса тела I степени |
25–29,9 |
Ожирение |
|
Избыточная масса тела IIа степени |
30–34,9 |
Избыточная масса тела IIb степени |
35–39,9 |
Избыточная масса тела III степени |
> 40 |
Ксантомы и ксантелазмы обычно свидетельствуют о наличии ГЛП, характерной для многих больных ИБС и атеросклерозом. Отсутствие этих признаков не исключает наличия нарушений липидного обмена. Старческая корнеальная дуга - серовато-белая кайма (дуга) по периферии радужной оболочкитакже относится к проявлениям ГЛП и нередко встречается у больных пожилого и старческого возраста, страдающих атеросклерозом и ИБС. Внешние признаки преждевременного старения, в том числе сравнительно раннее появление седых волос на голове(раннее поседение), снижение тургора кожи, морщины на коже и другие признаки также могут свидетельствовать об атеросклерозе.
Исследование сердечно-сосудистой системы
При осмотре, пальпации и перкуссии сердца у многих больных ИБС, особенно при сопутствующей АГ, выявляется смещение верхушечного толчка и левой границы сердца влево, обусловленное умеренным расширением полости ЛЖ. Нередко границы сердца бывают не изменены. Аускультация сердца в межприступный период в большинстве случаев обнаруживает небольшое ослабление или приглушенность I тона, что объясняется уменьшением скорости сокращения ЛЖ в период изоволюмического сокращения и преобладанием низкочастотных составляющих I тона. Уменьшение скорости сокращения может быть связано не только с наличием систолической дисфункции ЛЖ, но и с его компенсаторной гипертрофией, фиброзными изменениями стенки желудочка и в некоторых случаях- с наличием зон гибернирующего или“оглушенного” миокарда.
Наличие акцента II тона во II межреберье справа от грудины часто выявляется у больных атеросклерозом грудной аорты даже на фоне нормального уровня АД. В этих случаях акцентII тона свидетельствует об уплотнении стенок аорты и створок аортального клапана, закономерно наблюдающихся при атеросклерозе. При исследовании периферических артерий может обнаруживаться их извитость и уплотнение. Уровень АД нередко повышен, хотя в других случаях давление может быть и не изменено.
Исследование во время приступа стенокардии
Во время приступа стенокардии больные неподвижны. Если боль возникла во время ходьбы, больные останавливаются на несколько минут. Если боле-
122
вой приступ развился ночью, больные садятся в постели. Такое положение способствует некоторому уменьшению венозного притока крови к сердцу и снижению потребности миокарда в кислороде. Нередко во время приступа ангинозной боли отмечается испуганное или страдальческое выражение лица, бледность кожных покровов. Артериальное давление иногда повышается, но может оставаться нормальным. В тяжелых случаях наблюдается тахикардия или, наоборот, замедление пульса. При аускультации сердца нередко выявляется значительное приглушение тонов, что отражает кратковременное снижение сократимости миокарда и замедление сокращения ЛЖ, вызванное формированием в сердечной мышце очага ишемии. После купирования приступа гром-
кость I тона довольно быстро восстанавливается до исходного уровня. При тяжелом приступе стенокардии может выслушиваться патологическийIV тон сердца (пресистолический галоп), что указывает на значительное увеличение ригидности ишемизированного миокарда ЛЖ. Если во время приступа усугубляется систолическая дисфункция ЛЖ, на верхушке можно выслушать патологический III тон сердца (протодиастолический ритм галопа).
5.3. ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
В большинстве случаев диагноз ИБС и стабильной стенокардии напряжения может быть установлен уже при расспросе больного. Отсутствие типичных для стенокардии характеристик болевого синдрома не является достаточным основанием для того, чтобы отвергнуть диагноз ИБС. У любого пациента, предъявляющего жалобы на периодически возникающую боль в области сердца, особенно у лиц пожилого и старшего возраста, требуется проведение целого ряда современных лабораторных и инструментальных тестов для того, чтобы объективно подтвердить или отвергнуть диагноз ИБС.
Основные цели такого диагностического поиска следующие:
1.Доказать наличие или отсутствие у больного признаков коронарного атеросклероза и, по возможности, оценить его распространенность и преимущественную локализацию.
2.Оценить величину коронарного резерва, определить толерантность пациента к физической нагрузке.
3.По возможности проанализировать преобладающие механизмы возникновения коронарной недостаточности.
4.Выявить и количественно оценить имеющиеся ФР ИБС.
5.Оценить степень систолической и диастолической дисфункции ЛЖ.
6.Определить наличие признаков перенесенного в прошлом ИМ.
Электрокардиограмма
ЭКГ, зарегистрированная вне приступа стенокардии, примерно у1/3 больных ИБС мало отличается от нормы, особенно у лиц молодого возраста. У другой части больных на ЭКГ можно выявить следующие неспецифические
123
изменения: признаки гипертрофии ЛЖ (даже у пациентов, не страдающих сопутствующей АГ): горизонтальное положение электрической оси сердца, уве-
личение |
амплитуды |
зубцовR в |
левых |
грудных |
отведениях и |
величиныS |
|
в правых |
грудных отведениях, смещение переходной зоны вправо(отведение |
||||||
V2–V3), увеличение |
продолжительности |
интервала |
внутреннего |
отклонения |
|||
в отведении V5, 6 |
больше 0,05 с; признаки рубцовых изменений миокарда, ука- |
||||||
зывающие |
на |
перенесенный |
в прошлом : патологическийИМ |
зубец Q |
|||
в нескольких грудных и/или стандартных или усиленных отведениях от конечностей; различные нарушения ритма и проводимости(внутрижелудочковые блокады, АВ-блокады); умеренное увеличение продолжительности комплекса QRS (до 0,10 с) и интервала Q–Т; неспецифические изменения зубца Т(сглаженность, двухфазность, инверсия Т или, наоборот, высокий гигантский зубец Т) и сегмента RS–Т (чаще небольшое снижение RS–Т ниже изоэлектрической линии).
Указанные изменения зубца Т и сегментаRS-Т, зарегистрированные в покое (вне приступа стенокардии), не специфичны для ИБС и встречаются также при многих заболеваниях, сопровождающихся гипертрофией ЛЖ(АГ, ГКМП, приобретенные и врожденные пороки сердца). Сходные изменения могут возникать на фоне приема ряда лекарственных средств(дигиталис) и при некоторых нарушениях электролитного обмена. Только обнаружение на ЭКГ покоя признаков перенесенного крупноочагового (трансмурального) ИМ (патологический зубец Q) может служить достаточно надежным подтверждением наличия у данного пациента ИБС.
Во время приступа стенокардии можно выявить ЭКГ-признаки преходящей ишемии миокарда, к которым относятся изменения полярности, амплитуды и формы зубца Т, а также положения сегмента RS–Т, которые во многом зависят от локализации ишемизированного участка по отношению к полюсам регистрируемого отведения. Обычно регистрируют снижение (депрессию) сегмента RS–Т ниже изоэлектрической линии, что указывает на возникновение ишемии субэндокардиальных отделов сердечной мышцы. Одновременно появляется сглаженность, двухфазность или инверсия зубцов Т. Если эти изменения фик-
сируются в грудных отведениях, это свидетельствует об ишемии передней стенки ЛЖ, а в отведениях II, III и аVF - об ишемии заднедиафрагмальной области. В последнем случае в грудных отведениях могут выявляться высокие остроконечные и равносторонние зубцы Т, которые также указывают на ишемию задней стенки ЛЖ. Эти изменения, так же как и сам приступ стенокардии, непродолжительны, и уже через4–10 мин после купирования боли обычно происходит полное восстановление ЭКГ. Именно поэтому на практике очень редко удается зафиксировать эти изменения, хотя связь описанных электрокардиографических изменений с типичным болевым приступом и является более достоверным подтверждением диагноза ИБС,. Исключение составляют случаи, когда проводится длительное мониторирование ЭКГ по Холтеру.
124
Функциональные нагрузочные тесты
Для электрокардиографической диагностики ИБС повсеместно используют функциональные нагрузочные тесты. Чаще других применяют пробу с дозированной физической нагрузкой на велоэргометре или тредмиле, дипиридамоловую пробу, чреспищеводную электростимуляцию предсердий и суточное мониторирование ЭКГ по Холтеру.
Пробы с дозированной физической нагрузкой
Пробы с дозированной физической нагрузкой применяются с целью выявления скрытой коронарной недостаточности и для установления индивидуальной толерантности больных к физической нагрузке. Физическая нагрузка оказывает разнообразное действие на сердечно-сосудистую и дыхательную
системы, вызывая |
тахикардию, умеренное повышение АД, |
увеличение работы |
|||||
сердца, потребности миокарда в кислороде. У здорового человека это приводит |
|||||||
к адекватному расширению коронарных сосудов и увеличению сократимости |
|||||||
миокарда. |
В условиях |
лимитированного |
коронарного |
кровообращения |
|||
у больных |
ИБС |
увеличение |
потребности |
миокарда |
в кислороде приводит |
||
к острой коронарной недостаточности, сопровождающейся приступом стено- |
|||||||
кардии или/и изменениями на ЭКГ. Существует несколько методов проведения |
|||||||
пробы с физической нагрузкой, |
среди которых |
наибольшее распространение |
|||||
в клинической практике получили пробы с дозированной физической нагрузкой на велоэргометре или тредмиле (бегущая дорожка).
Велоэргометрия. Является наиболее доступной нагрузочной пробой. Используемый для этой цели велоэргометр позволяет строго дозировать физическую нагрузку и оценивать величину выполненной внешней работы в ваттах (Вт) или килограммометрах (кГм). Для проведения пробы необходим также электрокардиограф (желательно многоканальный), сфигмоманометр для измерения уровня АД и фонендоскоп. Кабинет функциональной диагностики, где проводится исследование, должен быть оснащен дефибриллятором и набором средств для оказания неотложной помощи. Велоэргометрическую пробу проводят обычно в первой половине дня после легкого завтрака или через 2–3 ч после еды.
За сутки до проведения исследования пациент не должен принимать -ле
карственных |
препаратов, оказывающих |
влияние |
на |
результаты |
пробы |
с физической нагрузкой: нитратов пролонгированного действия, блокаторов β- |
|
||||
адренорецепторов, антагонистов кальция, ингибиторов АПФ, сердечных гликозидов, мочегонных средств, некоторых противоаритмических препаратов. ЭКГ регистрируют в 12 общепринятых отведениях. Для удобства проведения исследования электроды от верхних конечностей помещают на грудную клетку в подключичных областях или ниже углов лопаток, а электроды от нижних конечностей - в области поясницы или у нижнего края реберных дуг.
125
|
Применяются различные схемы проведения велоэргометрической пробы. |
|||||
Чаще |
всего нагрузку |
повышают |
ступенеобразно |
каждые3 мин, |
начиная |
|
с мощности 25 или 50 Вт (150–300 кГм/мин). Такое ступенеобразное повыше- |
||||||
ние |
величины |
нагрузки на25 Вт |
можно осуществлять как |
непрерывно |
||
в течение 15–18 мин (у |
относительно |
хорошо тренированных лиц с заведомо |
||||
высокой толерантностью к физической нагрузке), так и с 3-минутными переры- |
||||||
вами для отдыха после каждой ступени нагрузки(у менее тренированных лиц |
||||||
или |
больных |
с |
заболеваниями |
сердца |
и сниженной |
толерантнос |
к физической нагрузке). Наиболее физиологичной считается непрерывная ступенеобразно возрастающая нагрузка.
Велоэргометрическую пробу проводят под постоянным контролем ЭКГ на экране монитора, уровня АД и состояния больного. Запись ЭКГ и измерение АД проводят до начала исследования, в конце каждой минуты пробы, а также на 30-й секунде, 1-й, 2-й, 3-й, 5-й, 7-й и 10-й минутах отдыха.
Тредмил представляет собой движущуюся дорожку, которая может устанавливаться под различным углом. Скорость движения дорожки и угол ее наклона регулируются в зависимости от задаваемой мощности нагрузки и протокола исследования (таблица 14). Пациент, находящийся на движущейся дорожке, шагает или бежит по ней. Развиваемая мощность и величина выполненной работы оцениваются по таблицам, автоматически.
Таблица 14. Изменение скорости, угла подъема дорожки
Ступень |
Скорость |
Угол подъема (%) |
Длительность на- |
|
нагрузки |
миль/ч |
км/ч |
|
грузки (минут) |
1 |
1,7 |
2,7 |
0 |
3 |
2 |
2,5 |
4 |
12 |
3 |
3 |
3,4 |
5,5 |
14 |
3 |
4 |
4,2 |
6,8 |
16 |
3 |
Примечание: угол подъема дорожки принято оценивать в процентах, подъем конца дорожки на 5 см соответствует углу подъема 5% (2,5 град).
Контроль за динамикой ЭКГ, АД и ЧСС осуществляется таким же способом, как и проведение велоэргометрической пробы. Противопоказаниями к проведению велоэргометрии и тредмил-теста являются: 1. Острый ИМ (или подозрение на ИМ). 2. Нестабильная стенокардия (НС). 3. Сердечная недостаточность II–III стадии. 4. Дыхательная недостаточность II–III степени. 5. Острое нарушение мозгового кровообращения или хроническая дисциркуляторная недостаточность II–III степени. 6. Острые инфекционные заболевания, сопровождающиеся лихорадкой. 7. Острый тромбофлебит.
126
Существуют также относительные противопоказания: 1. Выраженная АГ (АД выше 180/100 мм рт. ст.). 2. Тяжелые нарушения ритма и проводимости (АВ-блокада II–III степени, мерцательная аритмия, пароксизмальные тахикардии, БНПГ). 3. Тахикардия неясного генеза (ЧСС выше 100 уд. в мин). 4. Стеноз устья аорты (клапанный, подклапанный). 5. Аневризмы сердца и сосудов. 6. Частые синкопальные состояния в анамнезе. 7. Неврологические и психические заболевания. 8. Заболевания опорно-двигательного аппарата.
Решение вопроса о возможности проведения велоэргометрической пробы должно быть строго индивидуальным и учитывать общее состояние больного, его гемодинамические показатели, целесообразность исследования, а также условия его проведения. В специализированных кардиологических стационарах допускается проведение нагрузочных проб у больных ИМ с целью ранней физической реабилитации (с 2-й недели заболевания). Подобные исследования у больных ИМ и НС могут осуществляться только в специально оснащенных блоках интенсивной терапии или кардиореанимационных отделениях при участии врачей-реаниматологов.
Интерпретация результатов ЭКГ-исследования
При проведении пробы с дозированной физической нагрузкой у больных ИБС врач преследует обычно две основные цели: определить толерантность пациента к физической нагрузке и выявить клинические и электрокардиографические признаки ишемии миокарда, обусловленной коронарной недостаточностью, с целью диагностики ишемической болезни сердца. Толерантность к нагрузке оценивают преимущественно по показателю максимальной(пороговой) мощности работы выполненной пациентом. Используют и другие показатели: общий объем выполненной работы, длительность нагрузки, время возникновения боли в области сердца и депрессии сегмента RS–T и другие.
Различают высокую толерантность, когда максимальная мощность нагрузки в момент ее прекращения равна150 Вт (900 кГм/мин) и выше; среднюю толерантность, когда максимальная мощность нагрузки равна 100–125 Вт (600– 750 кГм/мин);низкую толерантность, когда максимальная мощность нагрузки не превышает 25–75 Вт (150–450 кГм/минуту). Индивидуальная толерантность к физической нагрузке зависит от многих факторов: величины коронарного ре-
зерва, индивидуальной способности к адекватному увеличению коронарного кровотока при физической нагрузке, сократительной способности миокарда, физической тренированности обследуемого, индивидуальной реакции сердеч- но-сосудистой системы на нагрузку в виде подъема или снижения артериального давления.
Критериями прекращения велоэргометрической пробы являются: 1. Достижение пациентом максимальной или субмаксимальной возрастной ЧСС. 2. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS–T на 1
127
мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) 3. Медленное косовосходящее снижение (депрессия) сегмента RS–T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения(j). 4. Подъем сегмента RS–T на 1,0 мм и более от исходного уровня на протяжении 80 мс от точки соединения. 5. Приступ стенокардии, типичный для данного больного. 6. Снижение САД на 20 мм рт. ст. 7. Подъем САД до 220 мм рт. ст. и/или ДАД до 110 мм рт. ст. и выше. 8. Возникновение приступа удушья или выраженной одышки. 9. Появление угрожающих нарушений ритма (частая ЖЭ, политопная ЖЭ, залповая ЖЭ, пароксизм суправентрикулярной или желудочковой тахикардии, пароксизм мерцательной аритмии). 10. Возникновение АВ-блокады или блокады ножек пучка Гиса. 11. Изменение комплекса QRS: углубление и увеличение продолжительности ранее существовавших зубцов Q, переход патологического зубца Q в комплекс QS. 12. Появление резкой общей слабости. 13. Возникновение выраженного головокружения, головной боли, тошноты, нарушений координации движений. 14. Отказ больного от дальнейшего исследования. Изменения зубца Т, нередко возникающие при выполнении физической нагрузки, не являются критериями прекращения нагрузочной пробы.
Таблица 15. Максимальная ЧСС в зависимости от пола и возраста
|
Пол |
|
|
Возраст в годах |
|
|
|
||
|
|
20–29 |
30–39 |
|
40–49 |
|
50–59 |
|
60–69 |
|
Мужчины |
195 |
187 |
|
178 |
|
170 |
162 |
|
|
Женщины |
198 |
189 |
|
179 |
|
171 |
163 |
|
|
Таблица 16. Субмаксимальная ЧСС в зависимости от пола и возраста |
||||||||
|
|
|
|
|
|
|
|
|
|
|
Пол |
|
|
Возраст в годах |
|
|
|
||
|
|
20–29 |
30–39 |
|
40–49 |
|
50–59 |
|
60–69 |
|
Мужчины |
161 |
156 |
|
152 |
|
145 |
|
140 |
|
Женщины |
167 |
160 |
|
154 |
|
145 |
|
142 |
В таблице 15 приведены величины максимальной частоты сердечных сокращений в зависимости от пола и возраста, по достижении которой следует прекратить пробу с нагрузкой у здоровых людей. У больных с установленным диагнозом ишемической болезни сердца часто ограничиваются достижением так называемой субмаксимальной частоты сердечных сокращений, составляющей 75% или 80% от максимальной, так как дальнейшее увеличение нагрузки опасно из-за возможности возникновения осложнений. В таблице 16 указаны величины субмаксимальной (75% от максимальной) ЧСС в зависимости от пола и возраста.
128
Снижение толерантности |
к физической |
нагрузке возможно |
не только |
у больных ишемической болезнью сердца, но и у пациентов с другими органи- |
|||
ческими и функциональными |
заболеваниями |
сердечно-сосудистой |
системы |
и даже у малотренированных здоровых людей. Снижение толерантности не является специфичным признаком наличия ишемической болезни сердца.
При проведении функциональных нагрузочных тестов с целью объективного подтверждения ишемии миокарда могут быть получены следующиере зультаты: 1. Положительная проба. 2. Отрицательная проба. 3. Сомнительная проба. 4. Неинформативная (незавершенная) проба.
Положительная проба. Наиболее достоверными объективными диагностическими критериями ишемии миокарда являются следующие3 электрокардиографических признака. 1. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS–T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее80 мс от точки соединения (j). 2. Медленное косовосходящее снижение (депрессия) сегмента RS– T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее80 мс от точки соединения(j). 3. Подъем сегмента RS–T на 1,0 мм и более от исходного уровня на протяжении80 мс от точки соединения.
Ишемические смещения сегментаRS–T ниже изоэлектрической линии связывают обычно с развитием субэндокардиальной ишемии миокарда. Ишемический подъем сегментаRS–T может свидетельствовать о трансмуральной ишемии миокарда, распространяющейся на все слои стенки ЛЖ, включая и субэпикардиальные ее отделы. Подъем сегмента RS–T может развиться при спазме КА, индуцированном физической нагрузкой, при выраженном стенозировании КА или хронической аневризме ,ЛЖсопровождающихся критическим снижением коронарного кровотока. В этих последних случаях подъем сегмента RS–T часто сочетается с признаками нарушения сегментарной сократимости ЛЖ (дискинезия, акинезия или гипокинезия отдельных сегментов).
Отрицательная проба диагностируется в тех случаях, когда пациент при проведении исследования достиг заданной возрастной ЧСС, однако перечисленные клинические и электрокардиографические признаки ишемии миокарда отсутствуют.
Сомнительная проба диагностируется в следующих случаях: 1. Если в процессе исследования развился типичный для стенокардии или атипичный болевой синдром в грудной клетке, не сопровождающийся объективными ишемическими признаками на ЭКГ. 2. Если наблюдается горизонтальное, косонисходящее или медленно восходящее смещение сегментаRS–T менее 1,0 мм от исходного уровня. 3. Если во время исследования обнаружены нарушения ритма и проводимости (частая или политопная экстрасистолия, преходящие нару-
129
шения атриовентрикулярной или внутрижелудочковой проводимости, появление пароксизмов суправентрикулярной или желудочковой тахикардии). 4. Если на высоте нагрузки произошло падение АД на 20 мм рт. ст. и более от исходного уровня.
Неинформативной (незавершенной) называют такую пробу, которая не была доведена до субмаксимальной возрастной ЧСС и не сопровождалась появлением описанных выше клинических или электрокардиографических признаков ишемии или дисфункции миокарда. Различные изменения морфологии зубца Т, в том числе отрицательные зубцы ,Тнередко наблюдаются во время нагрузки у больных без поражения КА и даже у здоровых людей и не могут служить критерием ишемии. Чувствительность проб с дозированной физической нагрузкой, проводимых с целью диагностики ишемической болезни сердца, колеблется от 62% до 80%, специфичность - от 83% до 96%.
Ложноположительные результаты пробы с физической нагрузкой могут выявляться у17% больных и здоровых лиц без поражения, причемКА у женщин частота ложноположительных результатов пробы значительно выше, чем у мужчин. Причинами ложноположительных результатов пробы являются: 1. Нейроциркуляторная дистония. 2. Заболевания, сопровождающиеся выраженной гипертрофией миокарда ЛЖ. 3. Пролапс митрального клапана. 4. Заболевания и синдромы, сопровождающиеся значительными нарушениями электролитного баланса. 5. Синдромы CLC и WPW. 6. Блокады ножек пучка Гиса. 7. Анемии различного генеза (гипоксия миокарда). 8. Хронические заболевания легких, сопровождающиеся выраженной дыхательной недостаточностью(гипоксия миокарда). 9. Прием сердечных гликозидов, мочегонных, эстрогенов. Частота ложноотрицательных результатов пробы у больных ИБС достигает20– 38%.
Дипиридамоловый тест
Проба с дипиридамолом (курантилом) применяется с целью выявления коронарной недостаточности, особенно в тех случаях, когда по разным причинам невозможно проведение пробы с дозированной физической нагрузкой. Внутривенное относительно быстрое введение больших доз дипиридамола, являющегося мощным вазодилататором, приводит к значительному расширению артериол в зонах непораженных коронарных артерий, тогда как артериолы
вбассейне стенозированных коронарных сосудов расширяются в значительно меньшей степени. Это приводит к патологическому перераспределению крови
вразличных участках сердечной мышцы: усиливается кровоснабжение интактных участков миокарда и уменьшается коронарный кровоток по стенозирован-
ным коронарным артериям(феномен межкоронарного “обкрадывания”). В результате возникают участки ишемии сердечной мышцы, локализация которых соответствует бассейнам кровоснабжения пораженных коронарных сосудов.
130
Перед проведением теста необходимо отменить прием лекарственных препаратов и пищевых продуктов, содержащих ксантиновые производные (эуфиллин, теофиллин, кофе, крепкий чай). Дипиридамол вводят внутривенно
вдозе 0,75 мг на 1 кг массы тела, что составляет обычно 10–12 мл 0,5% раствора. Чаще всего расчетную дозу препарата делят на3 равные части, которые вводят в 3 этапа. В течение первых трех минут вводят первую треть дозы, затем
втечение следующих 3–5 мин - вторую треть. Если к этому времени не появятся клинические или/и электрокардиографические признаки ишемии миокарда, на протяжении следующих 3–5 мин вводят последнюю треть дозы. Дипиридамоловую пробу осуществляют под постоянным ЭКГ-контролем.
При отсутствии признаков ишемии миокарда ЭКГ регистрируют еще через 10, 15 и 20 мин после окончания введения препарата. Исследование завершают внутривенным введением 10 мл 2,4% раствора эуфиллина, который является физиологическим антагонистом дипиридамола. Критерии положительного дипиридамолового теста те же, что и при проведении пробы с дозированной физической нагрузкой: ишемическая депрессия или элевация сегмента RS–T на 1,0 мм и больше от исходного уровня. Введение дипиридамола может сопровождаться небольшой тахикардией, снижением АД, головной болью, тяжестью в нижних конечностях. Чувствительность дипиридамолового теста составляет
60–75%, специфичность - 70–90%.
Проба с добутамином
Является одной из самых информативных функциональных нагрузочных проб, используемых в клинической практике. Добутамин обладает выраженным бета-адреностимулирующим действием. При введении препарата увеличивается ЧСС, повышается АД, значительно увеличивается работа сердца и потребность миокарда в кислороде. В условиях лимитированного коронарного кровоснабжения это приводит к возникновению преходящей ишемии миокарда. Добутамин вводят внутривенно в увеличивающихся дозах (5, 10, 15, 20, 30 мг на 1
кг/массы/мин) с интервалами |
3в мин. |
Введение препарата |
осуществляют |
|
с помощью автоматического инфузомата. Для диагностики преходящей ише- |
||||
мии миокарда |
используют |
те же критерии, что и при проведении проб |
||
с дозированной |
физической |
нагрузкой |
и дипиридамолового |
теста. Чувстви- |
тельность пробы с добутамином изопротеренолом составляет60–70%, специ- |
||||
фичность - 70–90%. Проба |
используется в диагностике |
ИБС у больных, |
||
у которых выполнение интенсивной физической нагрузки невозможно.
Проба с эргометрином
Используется для подтверждения спастического механизма коронарной недостаточности у больных ИБС, когда коронароангиография не обнаруживает стенозирование КА, а клиническая картина заставляет заподозрить вазоспастическую форму стенокардии (стенокардия Принцметала). Проба с эргометрином
131
опасна развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии).
Чреспищеводная электрическая стимуляция сердца
ЧПЭС - неинвазивный метод исследования, который используется для диагностики коронарной недостаточности у больных ИБС, изучения характера и электрофизиологических механизмов нарушений ритма сердца, а также для купирования пароксизмальных наджелудочковых тахиаритмий. Сущность ме-
тода заключается в регулируемом увеличении числа сердечных сокращений (ЧСС) путем навязывания искусственного ритма электрической стимуляцией предсердий. Для проведения ЧПЭС используется гибкий биполярный электродкатетер, который вводится через нос или рот в пищевод на глубину примерно 45 см и устанавливается на уровне предсердий. Для возбуждения предсердий используют силу тока от 20 мА до 30 мА.
Напряжение достигает 30–60 В. Ниже приведена техника ЧПЭС, используемой для выявления скрытой коронарной недостаточности. Регулируемое увеличение ЧСС значительно повышает работу сердца и потребность миокарда
в кислороде, |
что |
в условиях |
лимитированного |
коронарного |
|
кровотока |
|
у больных ИБС может приводить к развитию приступа стенокардии и/или -по |
|||||||
явлению на поверхностной ЭКГ ишемических изменений. |
|
|
|
||||
После регистрации исходной ЭКГ в12 отведениях начинают чреспище- |
|||||||
водную электрическую стимуляцию сердца. По достижении стабильной |
ЧСС |
||||||
в 100 уд/мин, |
ступенеобразно (через |
каждые 1–2 минуты) |
увеличивают |
темп |
|||
навязываемых сердечных сокращений на15–20 уд/мин. При хорошей перено- |
|||||||
симости |
пробы |
и отсутствии ишемических изменений на ЭКГ |
достигают |
||||
ЧСС 160 уд/мин, |
удерживая такой |
темп сердечных сокращений |
в |
течение |
|||
10 мин, |
после |
чего отключают электрокардиостимулятор, |
восстанавливая |
ис- |
|||
ходный синусовый ритм. Естественно, чреспищеводная электростимуляция сердца может быть прекращена“досрочно” при появлении клинических или/и электрокардиографических признаков возникновения ишемии миокарда.
Пробу с ЧПЭС проводят под постоянным контролем ЭКГ на экране -ос циллоскопа, уровня АД и состояния пациента. ЭКГ регистрируют в конце каждой минуты исследования. Оценку результатов исследования проводят по тем же принципам, что и при проведении теста с дозированной физической нагрузкой. Если при 10-минутном навязывании ритма с частотой160 сокращений в минуту отсутствуют клинические и/или электрокардиографические признаки преходящей ишемии миокарда, проба считается отрицательной.
Чувствительность чреспищеводной электростимуляции сердца в диагностике ИБС несколько ниже, чем теста с дозированной физической нагрузкой, поскольку степень увеличения потребности миокарда в кислороде при искусственном навязывании ритма сердечных сокращений существенно меньше, чем
132
при выполнении физической нагрузки. Применение метода ЧПЭС в диагностике ИБС показано в основном в тех случаях, когда проба с дозированной физической нагрузкой не может быть проведена в связи с заболеваниями опорнодвигательного аппарата, выраженной сердечной или дыхательной недостаточностью, наличием тромбофлебита или облитерирующего атеросклероза артерий нижних конечностей, а также у малотренированных больных, у которых невозможно достижение максимальной или субмаксимальной ЧСС при выполнении физической нагрузки. ЧПЭС противопоказана при заболеваниях пищевода, а также при наличии мерцательной аритмии, атриовентрикулярной блокады II– III степени, блокады левой ножки пучка Гиса и синдрома WPW.
Длительное мониторирование ЭКГ по Холтеру
В последнее десятилетие в клинической практике получило широкое распространение длительное мониторирование ЭКГ по Холтеру. Метод применяется в диагностике преходящих нарушений ритма сердца, выявления ишемических изменений ЭКГ у больных ИБС, а также для оценки вариабельности сердечного ритма. Существенным преимуществом метода является возможность длительной (в течение 1–2 суток) регистрации ЭКГ в привычных для пациента условиях.
У большинства больных ИБС метод холтеровского мониторирования ЭКГ позволяет получить дополнительные подтверждения временной преходя-
щей ишемии миокарда в виде депрессии или/и элевации сегментаRS–T, часто сопровождающихся изменениями ЧСС и АД. Важно, что непрерывная запись ЭКГ проводится в условиях обычной для данного пациента активности.
В большинстве случаев это дает возможность изучить взаимосвязь эпизодов ишемических изменений ЭКГ с разнообразными клиническими проявлениями болезни, в том числе и атипичными. Чувствительность и специфичность диагностики ИБС с помощью метода суточного мониторирования ЭКГ по Холтеру зависят прежде всего от выбранных критериев ишемических изменений конечной части желудочкового комплекса.
Обычно используются те же объективные критерии преходящей ишемии миокарда, что и при проведении нагрузочных тестов, а именно: смещение сегмента RS–T ниже или выше изоэлектрической линии на1,0 мм и более при условии сохранения этого смещения на протяжении80 мс от точки соединения
(j). Продолжительность диагностически значимого ишемического смещения сегмента RS–T должна превышать 1 мин.
Сцинтиграфия миокарда с 201Тl
Сцинтиграфия миокарда - это метод визуализации сердечной мышцы, основанный на способности интактного или, наоборот, некротизированного миокарда накапливать некоторые радионуклидные соединения. В клинической практике наиболее широко применяют два метода сцинтиграфии миокарда:
133
201 |
99m |
перфузионную сцинтиграфию с Тl |
и сцинтиграфию с Тс. Исследование |
локальных нарушений перфузии |
201 |
миокарда. Сцинтиграфия миокарда с Тl |
(таллием) используется для выявления локальных нарушений коронарного кровотока у больных ИБС. Метод основан на способности интактного миокарда активно накапливать 201Тl. При нормальном коронарном кровоснабжении около 85–90% введенного внутривенно таллия захватывается миокардом. При нарушении коронарного кровотока у больных ИБС уровень экстракции этого вещества в бассейне стенозированной КА заметно снижается.
Исследования выполняют в специальном помещении, предназначенном для проведения радионуклидных исследований и оборудованном сцинтилляционной гамма-камерой, позволяющей получать изображение сердца в трех стандартных проекциях: передней прямой, левой передней косой(при повороте больного на 45°) и левой боковой (поворот на 90°). В каждой из этих проекций в течение 3–5 мин происходит накопление импульсов гамма-излучения, возникающего при распаде201Тl, захваченного интактным миокардом. Чем лучше перфузия миокарда, тем более высокая степень радиоактивности регистрируется на экране компьютера. Наоборот, при локальном нарушении перфузии миокарда (ишемия, некроз, постинфарктный рубец) на сцинтиграммах выявляются “холодные очаги” снижения или отсутствия радиоактивности.
Проведение исследования в трех проекциях позволяет детально изучить перфузию миокарда в нескольких сегментах ЛЖ: переднесептальном, передне-
боковом, заднедиафрагмальном, верхушечном |
и косвенно установить локали- |
зацию и степень нарушения кровотока в бассейне той или иной КА. Возможно- |
|
сти метода в топической диагностике |
нарушений коронарного кровотока |
у больных ИБС существенно расширяются при регистрации сцинтиграмм на высоте пробы с дозированной физической нагрузкой или во время дипиридамолового теста.
Исследование жизнеспособности миокарда. Метод сцинтиграфии с201Тl позволяет дифференцировать ишемизированную, но сохранившую жизнеспособность сердечную мышцу от рубцовой нежизнеспособной ткани. Вначале исследуют распределение радиофармпрепарата(РФП) на высоте нагрузочного теста. Появление “холодного очага” в одном из сегментов ЛЖ свидетельствует о сниженной перфузии, которая может быть обусловлена наличием здесь как преходящей ишемии миокарда, индуцированной нагрузочным тестом, так и рубцовой тканью. Поскольку ишемизированная мышца, сохранившая свою жизнеспособность, с течением времени все же медленно накапливает РФП, на отсроченных сцинтиграммах, зарегистрированных через 3–4 ч после введения таллия, дефект распределения препарата исчезает.
Рубцовая ткань не может накапливать радиоактивный препарат, и на отсроченных сцинтиграммах дефект перфузии сохраняется. В некоторых случаях, когда речь идет о существовании в ЛЖ участков гибернирующего(“спящего”)
134
и/или оглушенного миокарда, при повторном исследовании через3–4 ч после введения препарата дефект распределения может остаться. В этих случаях рекомендуется повторить исследование через24 ч. Нормализация распределения таллия на таких поздних сцинтиграммах указывает на сохранившуюся жизнеспособность сердечной мышцы (гибернирующий или “оглушенный” миокард). При наличии в сердечной мышце рубцовой ткани“холодный очаг” продолжает фиксироваться даже через 24 ч от начала исследования.
Позитронная эмиссионная томография
ПЭТ - относительно новый и высокоинформативный неинвазивный метод исследования метаболизма сердечной мышцы, поглощения кислорода и коронарной перфузии. Метод основан на регистрации лучевой активности сердца после введения специальных радиоактивных меток, которые включаются в те или иные обменные процессы(гликолиз, окислительное фосфорилирование глюкозы, β-окисление жирных кислот), имитируя “поведение” основных метаболических субстратов (глюкозы, жирных кислот).
У больных ИБС метод ПЭТ позволяет неинвазивным способом изучать региональный миокардиальный кровоток, метаболизм глюкозы и жирных кислот, поглощение кислорода. ПЭТ оказалась незамененимым методом в диагностике жизнеспособности миокарда. Когда нарушение локальной сократимости ЛЖ (гипокинезия, акинезия) обусловлено гибернирующим или оглушенным миокардом, сохранившим свою жизнеспособность, при ПЭТ можно
зарегистрировать метаболическую активность данного участка сердечной мышцы, тогда как при наличии рубца такая активность не выявляется.
Эхокардиография
С помощью ЭхоКГ диагностируют: нарушения локальной сократимости ЛЖ, обусловленные снижением перфузии отдельных сегментов ЛЖ во время нагрузочных тестов (стресс-эхокардиография); жизнеспособность ишемизированного миокарда (диагностика “гибернирующего” и “оглушенного” миокарда); постинфарктный (крупноочаговый) кардиосклероз и аневризму ЛЖ(острую и хроническую); наличие внутрисердечного тромба; наличие систолической и диастолической дисфункции ЛЖ; признаки застоя в венах большого круга кровообращения и(косвенно) - величину ЦВД; признаки легочной артериальной гипертензии; компенсаторную гипертрофию миокарда желудочков; дисфункцию клапанного аппарата(пролабирование митрального клапана, отрыв хорд и папиллярных мышц); изменение некоторых морфометрических параметров (толщины стенок желудочков и размеров камер сердца); нарушение характера кровотока в крупных КА (некоторые современные методики ЭхоКГ). Получение столь обширной информации возможно только при комплексном использовании трех основных режимов эхокардиографии: одномерного (М- режима), двухмерного (В-режима), допплеровского режимов.
135
Оценка систолической функции ЛЖ. Основными гемодинамическими показателями, отражающими систолическую функцию ЛЖ, являются ФВ, УО, МО, СИ, а также конечно-систолический(КСО) и конечно-диастолический (КДО) объемы ЛЖ. Эти показатели получают при исследовании в двухмерном и допплеровском режимах. Как было показано выше, наиболее ранним марке-
ром систолической дисфункции ЛЖ является уменьшение фракции выброса (ФВ) до 40–45% и ниже, которое обычно сочетается с увеличением КСО и КДО, с дилатацией ЛЖ и его объемной перегрузкой. ФВ может уменьшаться при гиповолемии (шок, острая кровопотеря), уменьшении притока крови к правому сердцу, при быстром и резком подъеме уровня АД.
Умеренно выраженная систолическая дисфункция ЛЖ сопровождается снижением ФВ до 40–45% и ниже, увеличением КСО и КДО( наличием умеренной дилатации ЛЖ) и сохранением в течение некоторого времени нормальных значений СИ (2,2–2,7 л/мин/м2). При выраженной систолической дисфункции ЛЖ происходит дальнейшее падение величины ФВ, еще большее увеличение КДО и КСО и уменьшение СИ до 2,2 л/мин/м2 и ниже.
Диастолическую функцию ЛЖ оценивают по результатам исследования трансмитрального диастолического кровотока в импульсном допплеровском режиме. Определяют: 1) максимальную скорость раннего пика диастолического наполнения (Vmax Peak Е); 2) максимальную скорость трансмитрального кровотока во время систолы левого предсердия (Vmax Peak А); 3) площадь под кривой (интеграл скорости) раннего диастолического наполнения (MV VTI Peak Е) и 4) площадь под кривой позднего диастолического наполнения(MV VTI Peak А);
5) отношение максимальных скоростей(или интегралов скорости) раннего и позднего наполнения (Е/А); 6) время изоволюмического расслабления ЛЖIVRT (измеряется при одновременной регистрации аортального и трансмитрального кровотока в постоянно-волновом режиме из апикального доступа); 7) время замедления раннего диастолического наполнения(DT). Наиболее частыми причинами диастолической дисфункции ЛЖ у больных ИБС со стабильной стенокардией являются: атеросклеротический (диффузный) и постинфарктный кардиосклероз; хроническая ишемия миокарда, в том числе “гибернирующий” или “оглушенный” миокард ЛЖ; компенсаторная гипертрофия миокарда, особенно выраженная у больных с сопутствующей АГ.
В большинстве случаев наблюдаются признаки диастолической дисфункции ЛЖ по типу “замедленной релаксации”, для которой свойственно снижение скорости раннего диастолического наполнения желудочка и перераспределение диастолического наполнения в пользу предсердного компонента. Значительная часть диастолического кровотока осуществляется во время активной систолы ЛП. На допплерограммах трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение высоты пика А. Отношение Е/А уменьшается до 1 и ниже. Определяется увеличение времени изоволюмического расслабления ЛЖ (IVRT) до 90–100 мс и более и времени замедления раннего диастоли-
136
ческого наполнения (DТ) - до 220 мс и более. Более выраженные изменения диастолической функции ЛЖ(“рестриктивный” тип) характеризуются значительным ускорением раннего диастолического наполнения желудочка(Peak Е) при одновременном уменьшении скорости кровотока во время систолы предсердия (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8 и более.
Эти изменения сопровождаются укорочением фазы изоволюмического - рас слабления (IVRT) до значений меньше80 мс и времени замедления раннего диастолического наполнения (DT) - меньше 150 мс. “Рестриктивный” тип диастолической дисфункции чаще наблюдается при застойной СН или предшествует ей, свидетельствуя о повышении давления наполнения и КДД ЛЖ.
Оценка нарушений сократимости ЛЖ
Исследование проводится из верхушечного доступа по длинной оси в проекции двух- и четырехкамерного сердца, а также из левого парастернального доступа по длинной и короткой оси. В соответствии с рекомендациями Американской ассоциации эхокардиографии ЛЖ условно делится на 16 сегментов, располагающихся в плоскости трех поперечных сечений сердца, зарегистрированных из левого парастернального доступа по короткой оси. Изображение
6-ти базальных сегментов - переднего (А), переднеперегородочного (AS), заднеперегородочного (IS), заднего (I), заднебокового (IL) и переднебокового (AL) - получают при локации на уровне створок митрального клапана(SAX MV), а средних частей тех же6-ти сегментов - на уровне папиллярных мышц(SAX PL). Изображения 4-х верхушечных сегментов - переднего (А), перегородочного (S), заднего (I) и бокового (L), - получают при локации из парастернального доступа на уровне верхушки сердца (SAX AP).
Общее представление о локальной сократимости этих сегментов хорошо дополняют три продольных “среза” ЛЖ, зарегистрированных из парастернального доступа по длинной оси сердца, а также в верхушечной позиции четырехкамерного и двухкамерного сердца. В каждом из этих сегментов оценивается характер и амплитуда движения миокарда, а также степень его систолического утолщения.
Различают 3 вида локальных нарушений сократительной функции ЛЖ, объединяемых понятием “асинергия”: 1. Акинезия - отсутствие сокращения ограниченной области сердечной мышцы. 2. Гипокинезия - выраженное локальное уменьшение степени сокращения. 3. Дискинезия - парадоксальное расширение (выбухание) ограниченного участка сердечной мышцы во время систолы.
Причинами локальных нарушений сократимости миокарда ЛЖ у больных ИБС являются: острый инфаркт миокарда (ИМ); постинфарктный кардиосклероз; преходящая болевая и безболевая ишемия миокарда, в том числе ишемия, индуцированная функциональными нагрузочными тестами; постоянно действующая ишемия миокарда, еще сохранившего свою жизнеспособность (“гибернирующий миокард”).
137
Наиболее выраженные нарушения локальной сократимости миокарда выявляют при остром ИМ и аневризме ЛЖ. У больных со стабильной стенокардией напряжения, перенесших в прошлом ИМ, можно выявить эхокардиографические признаки крупноочагового или мелкоочагового постинфарктного кардиосклероза.
При крупноочаговом и трансмуральном постинфарктном кардиосклерозе двухмерная и одномерная ЭхоКГ позволяет выявить локальные зоны гипокинезии или акинезии. Мелкоочаговый кардиосклероз или преходящая ишемия миокарда характеризуются появлением зон гипокинезии ЛЖ, которые чаще выявляются при переднеперегородочной локализации ишемического повреждения и реже - при его задней локализации. Нередко признаки мелкоочагового (интрамурального) постинфарктного кардиосклероза при эхокардиографическом исследовании не обнаруживаются. Нарушения локальной сократимости -от
дельных сегментов ЛЖ у больных ИБС принято описывать по пятибалльной шкале: 1 балл - нормальная сократимость; 2 балла - умеренная гипокинезия (незначительное снижение амплитуды систолического движения и утолщения в исследуемой области); 3 балла - выраженная гипокинезия; 4 балла - акинезия (отсутствие движения и утолщения миокарда); 5 баллов - дискинезия (систолическое движение миокарда исследуемого сегмента происходит в направлении, противоположном нормальному). Для такой оценки, помимо традиционного визуального контроля, используется покадровый просмотр изображений, записанных на видеомагнитофоне. Важное прогностическое значение имеет расчет так называемого индекса локальной сократимости (ИЛС), который представля-
ет собой сумму балльной оценки сократимости каждого сегмента(SS), деленную на общее число исследованных сегментов ЛЖ (n): ИЛС = ΣS / n .
Высокие значения этого показателя у больных ИМ или постинфарктным кардиосклерозом нередко ассоциируются с повышенным риском летального исхода. При ЭхоКГ не всегда удается добиться достаточно хорошей визуализации всех 16 сегментов. В этих случаях учитывают только те участки миокарда ЛЖ, которые хорошо выявляются при двухмерной эхокардиографии. Нередко в клинической практике ограничиваются оценкой локальной сократимости6 сегментов ЛЖ: 1) межжелудочковой перегородки (верхней и нижней ее части); 2) верхушки; 3) переднебазального сегмента; 4) бокового сегмента; 5) заднедиафрагмального (нижнего) сегмента; 6) заднебазального сегмента. Стресс- эхокардиография. При хронических формах ИБС исследование локальной сократимости миокарда ЛЖ в покое далеко не всегда бывает информативным.
Возможности ультразвукового метода исследования существенно расширяются при использовании метода стресс-эхокардиографии- регистрации нарушений локальной сократимости миокарда с помощью двухмерной эхокар- диографии во время нагрузки. Чаще используют динамическую физическую нагрузку (тредмил или велоэргометрия в сидячем или лежачем положении), пробы с дипиридамолом, добутамином или чреспищеводную электростимуля-
138
цию сердца (ЧПЭС). Способы проведения нагрузочных тестов и критерии прекращения пробы не отличаются от таковых, используемых при классической электрокардиографии.
Двухмерные эхокардиограммы регистрируют в горизонтальном положении пациента до начала исследования и сразу после окончания нагрузки(60– 90 с). Для выявления нарушений локальной сократимости миокарда используют специальные компьютерные программы, позволяющие оценить степень изменения движения миокарда и его утолщения во время нагрузки(“стресса”) в 16 предварительно визуализированных сегментов ЛЖ. Результаты исследования практически не зависят от вида нагрузки, хотя более удобной является ЧПЭС и дипиридамоловая или добутаминовая пробы, поскольку все исследования проводятся в горизонтальном положении пациента. Чувствительность и специфичность стресс-эхокардиографии в диагностике ИБС достигает80– 90%. Главный недостаток этого метода состоит в том, что результаты исследования существенно зависят от квалификации специалиста, вручную устанавливающего границы эндокарда, которые в дальнейшем и используются для автоматического вычисления локальной сократимости отдельных сегментов.
Определение жизнеспособности миокарда
Эхокардиография, наряду со сцинтиграфией миокарда с 201Т1 и позитронной эмиссионной томографией, широко используется в последнее время для диагностики жизнеспособности “гибернирующего” или “оглушенного” миокарда. С этой целью используют обычно добутаминовый тест. Поскольку даже малые дозы добутамина обладают выраженным положительным инотропным действием, сократимость жизнеспособного миокарда возрастает, что сопровождается временным уменьшением или исчезновением эхокардиографических признаков локальной гипокинезии. Эти данные являются основанием для диагностики “гибернирующего” или “оглушенного” миокарда, что имеет важное прогностическое значение в определении показаний к хирургическому лечению. При более высоких дозах добутамина усугубляются признаки ишемии миокарда и сократимость вновь падает. Во время добутаминового теста можно встретиться с двухфазной реакцией сократительного миокарда на введение положительного инотропного агента.
Коронароангиография
КАГ - это метод рентгенологического исследования коронарных артерий сердца (КА) с помощью селективного заполнения венечных сосудов контрастным веществом. Являясь “золотым стандартом” в диагностике ИБС, коронароангиография позволяет определить характер, локализацию и степень атеросклеротического сужения КА, протяженность патологического процесса, состояние коллатерального кровообращения, а также выявить некоторые врожденные по-
139
роки развития венечных сосудов (аномальное отхождение КА или коронарный артериовенозный свищ).
При выполнении КАГ производят левую вентрикулографию. Это исследование дает возможность оценить важные гемодинамические параметры. Полученные при КАГ данные необходимы при выборе метода хирургической коррекции обструктивных поражений КА.
В соответствии с рекомендациями Европейской ассоциации кардиологов (2004) показаниями для проведения плановой КАГ являются уточнение характера, степени и локализации поражения КА и оценка нарушений сократительной способности ЛЖ у больных ИБС, подлежащих хирургическому лечению, а также больных с хроническими формами ИБС(стабильная стенокардия напряжения III–IV ФК) при неэффективности консервативной антиангинальной терапии; больные стабильной стенокардией напряженияI–II ФК, перенесшие ИМ; больные с постинфарктной аневризмой и прогрессирующей, преимущественно левожелудочковой, сердечной недостаточностью; больные стабильной
стенокардией напряжения с блокадой ножек пучка Гиса в сочетан с признаками ишемии миокарда по данным сцинтиграфии миокарда; больные ИБС в сочетании с аортальными пороками сердца, требующими хирургической коррекции; больные с облитерирующим атеросклерозом артерий нижних -ко нечностей, направляемые на хирургическое лечение; больные ИБС с тяжелыми нарушениями ритма сердца, требующими уточнения генеза и хирургической коррекции.
Вряде случаев плановая КАГ показана для верификации диагноза ИБС
убольных с болями в области сердца и некоторыми другими симптомами, генез которых не удалось установить с помощью неинвазивных методов исследования, включая ЭКГ в 12 отведениях, функциональные нагрузочные пробы, суточное мониторирование ЭКГ по Холтеру Однако в этих случаях врач, направляющий такого пациента в специализированное учреждение для проведения КАГ, должен быть особенно осторожен и учитывать многие факторы, определяющие целесообразность этого исследования и риск его осложнений.
Проведение КАГ противопоказано при наличии лихорадки; тяжелых заболеваниях паренхиматозных органов; ыраженной тотальной (лево- и правожелудочковой) сердечной недостаточности; острых нарушениях мозгового кровообращения; тяжелых нарушениях желудочкового ритма. Методика исследования. Используют главным образом две методики КАГ. Наиболее часто применяется методика Джадкинса, при которой специальный катетер вводят путем чрескожной пункции в бедренную артерию, а затем ретроградно в аорту. В устье правой и левой КА вводят по5–10 мл рентгеноконтрастного вещества и в нескольких проекциях осуществляют рентгеновскую киноили видеосъемку, позволяющую получить динамические изображения коронарного русла. В тех случаях, когда у пациента имеется окклюзия обеих бедренных артерий,
140
используют методику Соунса, при которой катетер вводят в обнаженную плечевую артерию. К числу тяжелых осложнений, которые могут возникнуть при проведении КАГ, относятся: нарушения ритма, в том числе желудочковая тахикардия и фибрилляция желудочков, развитие острого ИМ, внезапная смерть.
Интерпретация результатов
При анализе коронарограмм оценивают несколько признаков, достаточно полно характеризующих изменения коронарного русла при ИБС: 1. Анатомический тип кровоснабжения сердца: правый, левый, сбалансированный (равномерный). 2. Локализация поражений: а) ствол ЛКА; б) ПМЖВ ЛКА; в) ОВ ЛКА; г) передняя диагональная ветвь ЛКА; д) ПКА; е) краевая ветвь ПКА и другие ветви КА. 3. Распространенность поражения: а) локализованная форма (в проксимальной, средней или дистальной трети КА); б) диффузное поражение. 4. Степень сужения просвета: а. I степень - на 50%; б. II степень - от 50 до 75%; в. III степень - более 75%; г. IV степень - окклюзия КА. Левый анатомический тип характеризуется преобладанием кровоснабжения за счет ЛКА. Последняя участвует в васкуляризации всего ЛП и ЛЖ, всей МЖП, задней стенки ПП, большей части задней стенки ПЖ и части передней стенки ПЖ, прилежащей к МЖП. ПКА кровоснабжает при этом типе только часть передней стенки ПЖ, переднюю и боковую стенки ПП.
При правом типе большая часть сердца(все ПП, большая часть передней
ився задняя стенка ПЖ, задние 2/3 МЖП, задняя стенка ЛЖ и ЛП, верхушка сердца) кровоснабжается за счет ПКА и ее ветвей. ЛКА при этом типе кровоснабжает переднюю и боковую стенки ЛЖ, переднюю треть МЖП, переднюю
ибоковую стенки ЛП. Чаще (примерно в 80–85% случаев) встречаются различные варианты сбалансированного (равномерного) типа кровоснабжения сердца, при котором ЛКА кровоснабжает все ЛП, переднюю, боковую и большую часть задней стенки ЛЖ, передние 2/3 МЖП и небольшую часть передней стенки ПЖ, прилегающую к МЖП. ПКА участвует в васкуляризации всего ПП, большей части передней и всей задней стенки ПЖ, задней трети МЖП и небольшой части задней стенки ЛЖ. Во время проведения селективной КАГ контрастное вещество последовательно вводится в ПКА и в ЛКА, что позволяет получить
картину коронарного кровоснабжения раздельно для бассейнов ПКА и ЛКА. У больных ИБС по данным КАГ наиболее часто выявляется атеросклеротическое сужение 2–3-х КА - ПМЖВ, ОВ и ПКА. Поражение этих сосудов имеет очень важное диагностическое и прогностическое значение, поскольку сопровождается возникновением ишемических повреждений значительных участков миокарда.
Степень сужения КА также имеет важное прогностическое значение. Гемодинамически значимым считают сужение просвета венечных артерий на 70% и больше. Стеноз КА до 50% расценивается как гемодинамически незначимый. Клинические проявления ИБС зависят не только от степени сужения ,КАно
141
и от других факторов: от степени развития коллатерального кровотока, состояния системы гемостаза, вегетативной регуляции сосудистого тонуса, склонности к спазму венечных артерий. Даже при относительно малом сужении КА или при его отсутствии (по данным КАГ) при определенных обстоятельствах может развиться обширный острый ИМ. С другой стороны, нередки случаи, когда при хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может не сопровождаться возникновением ИМ. Обычно при значительном и распространенном поражении КА и длительном течении
ИБС при |
КАГ |
выявляется хорошо |
развитая сеть коллатералей, тогда |
как |
||
у больных |
“короткимс” ишемическим |
анамнезом |
и стенозом |
одной |
||
КА коллатеральное кровообращение выражено хуже. Последнее обстоятельст- |
||||||
во имеет особое значение в случаях внезапного тромбоза, сопровождающегося |
||||||
возникновением |
распространенного |
и |
трансмурального |
некроза сердечной |
||
мышцы у молодых больных ИБС.
Влияние обширности поражения коронарных артерий на внутрисосудистую активность тромбоцитов
ВСамарском клиническом кардиологическом диспансере проведено обследование 89 больных ИБС (стенокардия напряжения 2, 3 функциональных классов), которым была выполнена КАГ для оценки распространенности атеросклеротического поражения коронарных артерий.
Всоответствии с количеством пораженных сосудов каждому рассматриваемому случаю был присвоен соответствующий код: 0 – неизмененные коронарные сосуды; 1 – поражение одной коронарной артерии; 2 – поражение двух коронарных артерий; 3 – поражение трех и более коронарных артерий. В качестве объекта исследования были приняты результаты лабораторного обследования больных.
Результаты дисперсионного анализа по гемостазиологическим параметрам представлены в таблице17. Распространенность поражения коронарных сосудов оказывает высоко достоверное влияние на все изученные гемостазиологические показатели. Вклад дополнительного риска при множественном поражении сосудов наиболее выражен по отношению кCRP (84,9%), ТВ (72,1%),
ФГ (68,6%), ПТИ (68,3%), АЧТВ (66,3%), общему количеству Тр(59,9%), Д (58,6%), ТрА (57,6%), числу МА (55,5%) и АФ (53,2%) при р < 0,001.
Размахи дисперсий некоторых из параметров гемостазиограммы(АФ, ФГ) представлены на рисунках 3 и 4. Эти переменные наглядно представляют результаты проведенного дисперсионного анализа. Зависимость дисперсии активных форм тромбоцитов (АФ) от количества пораженных коронарных сосудов характеризовалось значительной вариабельностью при вовлечении в атеро-
142

склеротический процесс одного или двух сосудов(рисунок ). Отсутствие поражения или его множественность характеризовались малой степенью разброса.
Таблица 17. Влияние фактора обширности поражения коронарных артерий на гемостазиологические параметры
|
Сумма квадратов отклоне- |
Степень |
|
|
||
|
ний параметра от среднего |
|
|
|||
|
влияния |
|
|
|||
|
вследствие |
|
|
|
||
Парамет- |
вследствие |
фактора |
F- |
|
||
влияния |
р |
|||||
влияния |
обширности |
|||||
ры |
фактора |
критерий |
||||
всех |
поражения, |
|
||||
|
обширности |
|
|
|||
|
факторов |
% |
|
|
||
|
поражения |
|
|
|||
|
|
|
|
|
||
Д |
149914,8 |
105775,7 |
58,6 |
22,2 |
< 0,001 |
|
ДЭ |
14892,9 |
12468,1 |
54,4 |
18,7 |
< 0,001 |
|
С |
637,2 |
754,8 |
45,8 |
13,2 |
< 0,001 |
|
СЭ |
42,1 |
68,1 |
38,2 |
9,7 |
< 0,001 |
|
АФ |
23128,6 |
20371,8 |
53,2 |
17,8 |
< 0,001 |
|
ТрА |
4972,8 |
3658,6 |
57,6 |
21,3 |
< 0,001 |
|
МА |
749,7 |
601 |
55,5 |
19,5 |
< 0,001 |
|
БА |
22,6 |
27,1 |
44,7 |
12,6 |
< 0,001 |
|
АЧТВ |
14723,9 |
7475,1 |
66,3 |
18,4 |
< 0,001 |
|
ТВ |
7981,96 |
3092,04 |
72,1 |
0,09 |
< 0,001 |
|
ПТИ |
512193,30 |
237217,70 |
68,3 |
53,98 |
< 0,001 |
|
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр – тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ - сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА - малые агрегаты, БА – большие агрегаты.
Аналогичная картина отмечалась при анализе других параметров внутрисосудистой активности тромбоцитов. В то же время вовлечение в процесс одной или двух коронарных артерий сопровождается большой вариативностью изучаемых показателей функциональной активности, что свидетельствовало о их значительных колебаниях при таких объемах поражения.
143
Уровень влияния: F=17,787, p=,00000
60
55
Активные формы тромбоцитов, %
50
45
40
35 |
30 |
25 |
20
15
|
10 |
|
|
|
|
5 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
Количество пораженных сосудов |
|
|
Рисунок 3. Влияние фактора распространенности поражения коронарных арте- |
||||
рий на дисперсию активных форм тромбоцитов. |
|
|
||
Влияние фактора распространенности поражения коронарных артерий на |
||||
дисперсию ФГ характеризуется другой динамикой его дисперсии (рисунок 4). |
||||
|
|
Уровень влияния: F=54,618, p=0,0000 |
|
|
|
8 |
|
|
|
|
7 |
|
|
|
|
6 |
|
|
|
/л |
5 |
|
|
|
, г |
|
|
|
|
Фибриноген |
4 |
|
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
1 |
|
|
|
|
0 |
|
|
|
|
-1 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
Количество пораженных сосудов |
|
|
Рисунок 4. Влияние фактора распространенности поражения коронарных артерий на дисперсию фибриногена
При отсутствии поражения коронарных сосудов дисперсия выражена значительно, однако по мере распространения патологического процесса она уменьшалась. При множественном сосудистом поражении достигала минимальных значений. Аналогичная динамика дисперсий отмечена также для таких параметров, как ПТИ, CRP. Указанные изменения свидетельствовали о наличии
144
устойчивых механизмов формирования нарушений со стороны свертывающей системы крови при распространенном атеросклеротическом поражении коронарных сосудов.
Результаты влияния изучаемого фактора на гематологические показатели представлены в таблице 18. Распространенность поражения коронарного сосудистого русла оказывало наиболее выраженное влияние на распределение тромбоцитов по объемуPDW (66%), средний объем тромбоцитаMPV (66%), тромбоцитокрит PCT (62%), среднюю концентрацию гемоглобина в эритроците
- MCHC (58%), среднее содержание гемоглобина в отдельном эритроцитеМСН (58%), показатель анизоцитоза эритроцитов - RDW (57%).
Таблица 18. Влияние фактора обширности поражения коронарных артерий на гематологические параметры
|
Сумма квадратов отклоне- |
Степень |
|
|
||
|
ний параметра от среднего |
|
|
|||
|
влияния |
|
|
|||
|
вследствие |
|
F- |
|
||
Парамет- |
вследствие |
фактора |
р |
|||
влияния |
||||||
ры |
влияния |
обширности |
критерий |
|||
фактора |
|
|||||
|
всех |
поражения, |
|
|
||
|
обширности |
|
|
|||
|
факторов |
% |
|
|
||
|
поражения |
|
|
|||
|
|
|
|
|
||
МСН |
26065,8 |
18783,5 |
58 |
20,8 |
<< 0,001 |
|
MCHC |
3302571 |
2350460 |
58,4 |
21,1 |
<< 0,001 |
|
СОЭ |
6327,6 |
6889,4 |
47,9 |
15,3 |
<< 0,001 |
|
RDW |
5662,8 |
3176,8 |
57 |
30,3 |
<< 0,001 |
|
PCT |
0,4 |
0,25 |
62,5 |
31,1 |
<< 0,001 |
|
MPV |
1446,3 |
747,8 |
65,9 |
36,1 |
<< 0,001 |
|
PDW |
13565,3 |
6873,2 |
66,4 |
36,8 |
<< 0,001 |
|
Примечание: PDW - распределение тромбоцитов по объему, MPV - средний объем тромбоцита, PCT - тромбоцитокрит, MCHC - средняя концентрация гемоглобина в эритроците, МСН - среднее содержание гемоглобина в отдельном эритроците, RDW - показатель анизоцитоза эритроцитов.
Показатели, отражающие объемные характеристики тромбоцитов, показали наибольшую зависимость от фактора обширности поражения коронарных артерий. Эти изменения характеризовали патогенетическую связь тромбоцитарного звена системы гемостаза и атеросклеротического процесса. Значительное влияние распространенности атеросклеротического процесса оказывало влияние на морфологическое и функциональное состояние эритроцитов. Анализ динамики дисперсий гематологических показателей при различной распространенности поражения коронарных сосудов выявил их полное сходство между собой. В качестве примера мы приводим график влияния фактора распространенности поражения коронарных артерий на дисперсию показателяMPV, характеризующего средний объем тромбоцитов (рисунок 5).
145
Значительный разброс дисперсии отмечался при изолированном поражении одной коронарной артерии, другие варианты характеризовались очень плотным распределением значений вокруг среднего. Такая же зависимость отмечена у PDW и PCT, то есть у тех показателей, которые характеризуют гетерогенность популяции тромбоцитов по размеру.
|
|
Уровень влияния: F=36,102, p=,00000 |
|
|
|
25 |
|
|
|
|
20 |
|
|
|
fl |
|
|
|
|
тромбоцита, |
15 |
|
|
|
10 |
|
|
|
|
|
|
|
|
|
объем |
5 |
|
|
|
0 |
|
|
|
|
Средний |
|
|
|
|
-5 |
|
|
|
|
|
|
|
|
|
|
-10 |
|
|
|
|
-15 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
Количество пораженных сосудов |
|
|
Рисунок 5. Влияние фактора распространенности поражения коронарных артерий на дисперсию распределения тромбоцитов по объему.
По результатам анализа можно судить о существовании устойчивых -за кономерностей, приводящих по мере прогрессирования атеросклеротического процесса к изменениям морфологических, функциональных характеристик тромбоцитов. Величина аддитивного риска при воздействии изучаемого фактора по отношению к показателям липидного спектра представлена в таблице 19.
Таблица 19. Влияние факторов обширности поражения коронарных артерий на липидный профиль больных ИБС
|
Сумма квадратов отклоне- |
Степень |
|
|
||
|
ний параметра от среднего |
|
|
|||
|
влияния |
|
|
|||
|
вследствие |
|
F- |
|
||
Парамет- |
вследствие |
фактора |
р |
|||
влияния |
||||||
ры |
влияния |
обширности |
критерий |
|||
фактора |
|
|||||
|
всех |
поражения, |
|
|
||
|
обширности |
|
|
|||
|
факторов |
% |
|
|
||
|
поражения |
|
|
|||
|
|
|
|
|
||
ХС |
1908555 |
580174 |
76,7 |
52,6 |
< 0,001 |
|
ЛНП |
858831,3 |
315327,2 |
73,1 |
41,7 |
< 0,001 |
|
ЛВП |
64382,1 |
21697,7 |
74,8 |
43,5 |
< 0,001 |
|
ТГ |
1595079 |
1154866 |
58 |
21,2 |
< 0,001 |
|
b-ЛП |
76436,8 |
30420,1 |
71,5 |
32,7 |
< 0,001 |
|
KA |
546,2 |
320,5 |
63 |
23,3 |
< 0,001 |
|
146
Примечание: ХС – общий холестерин, ЛНП – липопротеиды низкой плотности, ЛВП – липопротеиды высокой плотности, ТГ – триглицериды, b-ЛП – бетталипопротеиды, КА - коронарные артерии.
Из представленных в таблице 18 результатов следует, что все показатели, характеризующие липидный профиль у больных ИБС, подвержены воздействию фактора обширности поражения коронарных сосудов, причем уровень этого влияния значительно выражен – он превышает 50% для всех переменных при высоком уровне достоверности (р < 0,001).
Для демонстрации выявленных закономерностей представлены графические изображения для двух показателей липидного спектра– ЛВП и ТГ (рисунок 6, 7). Определяется разнонаправленная динамика их средних значений по мере прогрессирования атеросклеротического процесса, снижение дисперсий вышеназванных параметров липидного профиля при увеличении числа пораженных сосудов.
|
|
Уровень влияния: F=43,519, p=,00000 |
|
|
|
65 |
|
|
|
mg/dl |
60 |
|
|
|
55 |
|
|
|
|
плотности, |
|
|
|
|
50 |
|
|
|
|
45 |
|
|
|
|
высокой |
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
Липиды |
35 |
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
25 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
Количество пораженных сосудов |
|
|
Рисунок 6. Влияние фактора распространенности поражения коронарных артерий на дисперсию ЛВП.
147
|
|
Уровень влияния: F=21,178, p=,00000 |
|
|
|
300 |
|
|
|
|
250 |
|
|
|
, mg/dl |
200 |
|
|
|
150 |
|
|
|
|
Триглицериды |
|
|
|
|
100 |
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
-50 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
Количество пораженных сосудов |
|
|
Рисунок 7. Влияние фактора распространенности поражения коронарных артерий на дисперсию триглицеридов.
Таким образом, по данным исследования выявлена значительное влияние фактора множественности поражения коронарных артерий на большинство гемостазиологических, гематологических, липидных показателей у больных стабильной стенокардией 2, 3 ФК.
Селективная ангиокардиография ЛЖ
Является частью протокола инвазивного исследования больных ИБС, направляемых на операцию реваскуляризации миокарда. Она дополняет результаты КАГ и позволяет провести количественную оценку органических и функциональных нарушений ЛЖ. С помощью левой вентрикулографии можно: обнаружить региональные нарушения функции ЛЖ в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии; диагностировать аневризму ЛЖ и оценить ее локализацию и размеры; выявить внутриполостные образования (пристеночные тромбы и опухоли); объективно оценить систолическую функцию ЛЖ на основании инвазивного определения важнейших гемодинамических показателей (ФВ, КСО, КДО, УО, МО, СИ, УИ, среднюю скорость кругового укорочения волокон); оценить состояние клапанного аппарата сердца, в том числе врожденные и приобретенные патологические изменения аортального и митрального клапанов, которые могут повлиять на результаты хирургической реваскуляризации миокарда.
5.4. КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
148
Лечение больных со стабильной стенокардией напряжения должно быть направлено на устранение или уменьшение симптомов заболевания(в первую очередь – приступов стенокардии), повышение толерантности к физической нагрузке, улучшение прогноза заболевания и предупреждение возникновения нестабильной стенокардии, ИМ и внезапной смерти.
Для |
достижения |
этих |
целей |
применяется |
|
комплекс- |
лече |
||||||
профилактических мероприятий (немедикаментозное, медикаментозное и, при |
|
||||||||||||
необходимости, хирургическое лечение) и предусматривающий активное воз- |
|
||||||||||||
действие на |
основные |
звенья |
патогенеза ИБС: антитромбоцитарная терапия |
|
|||||||||
(профилактика агрегации тромбоцитов и пристеночного тромбообразования); |
|
||||||||||||
антиангинальные |
(антиишемические) |
ЛС (нитраты |
и |
молсидомин, β- |
|
||||||||
адреноблокаторы, блокаторы медленных кальциевых каналов); применение ци- |
|
||||||||||||
топротекторов; лечение и профилактика прогрессирования дисфункции ЛЖ; |
|
||||||||||||
медикаментозная и немедикаментозная коррекция основных ФР ИБС (ГЛП, АГ, |
|
||||||||||||
курения, ожирения, нарушений углеводного обмена); при необходимости - ле- |
|
||||||||||||
чение и профилактика нарушений ритма и проводимости; радикальное хирур- |
|
||||||||||||
гическое устранение обструкции КА(реваскуляризация миокарда). В настоя- |
|
||||||||||||
щее время доказано положительное влияние большинства из перечисленных |
|
||||||||||||
направлений и способов лечения на прогноз ИБС и частоту возникновения не- |
|
||||||||||||
стабильной стенокардии, ИМ и внезапной смерти. |
|
|
|
|
|
||||||||
Антитромбоцитарная терапия |
|
|
|
|
|
|
|
||||||
Проводится для профилактики “обострений” ИБС, возникновения неста- |
|
||||||||||||
бильной стенокардии и ИМ. Она направлена на предотвращение пристеночного |
|
||||||||||||
тромбообразования и, в известной степени, на сохранение целостности фиброз- |
|
||||||||||||
ной оболочки атеросклеротической бляшки. Выше неоднократно упоминалось |
|
||||||||||||
о том, |
что в основе “обострений” ИБС |
и возникновения нестабильной стено- |
|
||||||||||
кардии |
(НС) |
или |
ИМ |
|
лежит |
разрыв |
атеросклеротической |
бляшки в |
КА |
||||
с формированием |
на |
ее |
поверхности |
вначале |
тромбоцитарного(“белого”), |
|
|||||||
азатем фибринового (“красного”) пристеночного тромба.
Врезультате разрыва атеросклеротической бляшки обнажаются субэндотелиальные тканевые структуры и липидное ядро бляшек, содержимое которого попадает на поверхность разрыва и в просвет сосуда. Обнажившиеся компоненты соединительнотканного матрикса(коллаген, фактор Виллебранда, фибронектин, лиминин, витронектин), а также детрит липидного ядра, содержащий тканевой тромбопластин, активируют тромбоциты.
Последние с помощью гликопротеидных рецепторов (Iа, Ib), расположенных на поверхности тромбоцитов, и фактора Виллебранда прилипают(адгезируют) к поверхности поврежденной бляшки, образуя здесь монослой тромбоцитов, рыхло связанных с поврежденным эндотелием. Активированные и изменившие свою форму тромбоциты высвобождают индукторы последую-
149
щей взрывной самоускоряющейся |
агрегации: АДФ, серотонин, фактор 3 |
и фактор 4 тромбоцитов, тромбоксан, |
адреналин (“реакция высвобождения”). |
Одновременно активируется метаболизм арахидоновой кислоты и при участии ферментов циклооксигеназы и тромбоксансинтетазы образуется тромбоксан А2, который также обладает мощным агрегирующим, а также вазоконстрикторным действием.
Врезультате возникает вторая волна агрегации тромбоцитов и образуется тромбоцитарный агрегат (“белый” тромб). В процессе этой стадии агрегации тромбоциты плотно связываются друг с другом с помощью молекул фибриногена, которые, взаимодействуя с рецепторамиIIb/IIIа тромбоцитов, плотно “сшивают” кровяные пластинки между собой. Одновременно с помощью фактора Виллебранда тромбоциты прикрепляются к подлежащему субэндотелию.
Вдальнейшем активируется система коагуляции гемостаза и образуется фибриновый тромб. Адгезия и агрегация тромбоцитовэто первый начальный этап тромбообразования, важнейшими звеньями которого являются: функционирование специфических рецепторов тромбоцитов(Iа, Ib, IIb/IIIа ), обеспечивающих адгезию и окончательную агрегацию кровяных пластинок, и активация метаболизма арахидоновой кислоты.
Действие тромбоксана А (ТхА ) и простациклина на агрегацию тромбо-
2 2
цитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ: тромбоксан А2 ингибирует это превращение, а простациклин - активирует. Высокие концентрации цАМФ угнетают агрегацию тромбоцитов, тогда как уменьшение концентрации, наоборот, способствует агрегации. Именно поэтому простациклин, активирующий аденилатциклазу и увеличивающий содержание цАМФ, ингибирует адгезию, агрегацию и реакцию высвобождения тромбоцитов, а тромбоксан А2, наоборот, угнетая аденилатциклазу, замедляет переход АТФ в цАМФ. В результате уменьшается концентрация цАМФ, что способствует усилению адгезии и агрегации тромбоцитов.
Большое значение имеют дальнейшие превращения цАМФ и : АТФ цАМФ инактивируется (уменьшая свою концентрацию в клетке) адениловой фосфодиэстеразой. АТФ “распадается” под действием АТФ-азы на фосфорную кислоту и аденозин, инактивация которых осуществляется под действием аденозиндезаминазы.
При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы приводит к снижению концентрации аденози и преобладанию вазоконстрикторных эффектов. Описанные схемы тромбоци- тарно-сосудистого гемостаза, а также метаболизма арахидоновой кислоты сле-
150

дует учитывать при назначении тех или иных ЛС, обладающих антитромбоцитарным эффектом.
В настоящее время наиболее широкое распространение в клинической практике получили следующие антитромбоцитарные препараты: аспирин (ацетилсалициловая кислота); тиклопидин (тиклид); клопидогрель; курантил (дипиридамол).
Ацетилсалициловая кислота
В 1899 году F. Hoffmann и A. Bayer из фармацевтической компании «Bayer» синтезировали ацетилсалициловую кислоту (АСК) и назвали ее аспирином. Первые сообщения о возможности применения АСК при ССЗ стали публиковаться в 50-х годах XX века. L. Craven отметил геморрагические проявления после применения ASA и использовал эффект снижения свертываемости крови для профилактики ИМ у 8000 пациентов, получив успешные результаты.
Антитромбоцитарное действие аспирина было установленоH.J. Weiss, L.M. Aledort в 1967 году. Спустя четыре годаJ.R. Vane выявил способность АСК ингибировать синтез простациклина. В 1975 году G.J. Roth и P.W. Majerus установили присущее АСК свойство ацетилировать циклооксигеназу.
Ингибирование циклооксигеназы тромбоцитов сопровождается уменьше-
нием образования тромбоксана А и, следовательно, уменьшением агрегации
2
тромбоцитов и вазоконстрикторного действия тромбоксана. Угнетение циклооксигеназы сосудистого эндотелия приводит к уменьшению образования простациклина. Это способствует уменьшению его вазодилатирующего и антиагрегантного действия (рисунок 8).
Тромбоцит |
|
Эндотелиоцит |
АА |
|
АА |
< 300 мг/сут |
|
> 300 мг/сут |
COX |
АСК |
COX |
ТхА2 |
|
PgI2 |
Агрегация |
|
Дезагрегация |
Вазоконстрикция |
|
Вазодилатация |
Рисунок 8. Механизм действия ацетилсалициловой кислоты  трансформация,
трансформация,  ингибиция
ингибиция
151
Циклооксигеназа тромбоцитов чувствительна даже к малым дозам аспирина (75–160 мг в сутки), тогда как нежелательное угнетение образования простациклина происходит только при сравнительно высоких суточных дозах этого ЛС. Поэтому больным ИБС рекомендуют обычно прием малых доз препарата, не превышающих 75–160 мг в сутки.
Действие аспирина на циклооксигеназу тромбоцитов необратимо и -эф фект препарата сохраняется на протяжении всей жизни тромбоцита, в течение 8–10 дней. По данным международного многоцентрового широкомасштабного исследования (Second International Study of Infarct Survival, ISIS-2, 1990), при-
менение аспирина снижало летальность больных от сердечно-сосудистых причин на 23% по сравнению с плацебо.
Согласно Рекомендациям VII конференции Американской коллегии торакальных врачей по антитромботической и тромболитической терапии(2004) достаточной для длительного применения у пациентов высокого риска развития сосудистых осложнений признана доза АСК75-100 мг/сутки (таблица 20). Применение АСК в низких дозах обеспечивает выраженный противотромботический эффект и позволяет свести к минимуму риск побочных реакций.
При неотложных клинических состояниях, таких как острый коронарный синдром (ОКС) или острый ишемический инсульт, когда необходимо быстрое и
полное ингибирование ТхА-зависимой агрегации тромбоцитов, показано ис-
2
пользование нагрузочной дозы АСК (≥ 160 мг).
Таблица 20. Сердечно-сосудистые заболевания, при которых установлена эффективность аспирина и его минимальная эффективная доза
|
Состояния |
|
Минимальная эффективная доза, |
|
|
|
|
|
мг/сутки |
Острый инфаркт миокарда |
|
|
160 |
|
Острый ишемический инсульт * |
|
|
160 |
|
Мужчины группы высокого риска ССЗ |
|
75 |
||
Артериальная гипертензия |
|
|
75 |
|
Стабильная стенокардия |
|
|
75 |
|
Нестабильная стенокардия * |
|
|
75 |
|
Транзиторная |
ишемическая |
атака |
или |
50 |
ишемический инсульт * |
|
|
|
|
Выраженный стеноз сонных артерий * |
|
75 |
||
Примечание: * - назначение большей дозы не обеспечивало снижения риска.
Применение аспирина у больных ИБС и АГ уменьшало частоту летальных и нелетальных ИМ на36%, а летальность от коронарных осложненийна
15% (Hypertension Optimal Treatment, HOT, включившее 26000 пациентов). Эф-
фективность малых (менее 160 мг в сутки), средних (160–325 мг в сутки)
152
и высоких (500–1500 мг в сутки) доз аспирина оказалась примерно одинаковой. Это позволяет рекомендовать аспирин в суточной дозе50-160 мг в сутки для длительного лечения больных ИБС. Обычно используют дозы75-150 мг в сутки. Лечение аспирином должно проводиться в течение всей жизни больного.
При использовании малых доз препарата серьезные побочные эффекты, требующие отмены препарата, развиваются сравнительно редко. Следует учитывать возможность возникновения следующих нежелательных явлений: небольшие болевые ощущения в эпигастрии(20–30%); диспептические явления:
тошнота, диарея, изредка рвота; желудочно-кишечные и другие кровотечения (5–8%); бронхоспазм; гиперчувствительность к препарату. Риск возникновения побочных эффектов при приеме аспирина можно уменьшить, если использовать минимальные дозы препарата или его новые лекарственные формы(аспиринкардио).
Назначение АСК противопоказано в следующих случаях: при обострении язвенной болезни желудка и двенадцатиперстной кишки; при геморрагическом диатезе; в возрасте до 12 лет; при беременности (последний триместр); при повышенной чувствительности к салицилатам. Надо с осторожностью применять аспирин у больных, страдающих бронхиальной астмой, при неконтролируемой АГ, при одновременной терапии антикоагулянтами, наличии язвенной болезни желудка и двенадцатиперстной кишки в анамнезе, в первом и втором триместрах беременности.
У отдельных лиц отмечается резистентность к АСК, встречающаяся в 1545% случаев. Этот эффект отмечается исходно или через несколько месяцев лечения АСК. С клинической точки зрения под резистентностью к АСК подразумевается развитие тромботических осложнений на фоне регулярного ее приема. Возможными механизмами устойчивости к АСК могут быть: низкая приверженность к лечению (non-compliance), неадекватная доза препарата, низкая абсорбция препарата (АСК в энтеральной оболочке), усиленное образование тромбоцитов, повышенная чувствительность кровяных пластинок к АДФ и
коллагену, неполное подавление образования ТхА, полиморфизмы генов ре-
2
цепторов GPIIb-IIIa, COX-1, COX-2, ТхА2, стресс-индуцированная экспрессия COX-2 в тромбоцитах, курение, гиперлипидемия, физическая нагрузка, стресс.
Осуществляются попытки оценивать эффективность АСК и прогнозировать ее клиническую активность с использованием лабораторных методов. Контроль чувствительности к АСК можно проводить с помощью агрегометров
по динамике снижения функциональной активности тромбоцитов на фоне приема препарата. Критерием эффективности считается снижение показателей агрегатограммы в 3-4 раза от исходного уровня. В последние годы для оценки чувствительности к антитромбоцитарному действию АСК используют определение концентрации в моче 11-дегидротромбоксана (В2-метаболита ТхА2).
153
При достаточной чувствительности к АСК количество11дегидротромбоксана В2 в моче снижается. По данным рандомизированного исследования НОРЕ (2001) у АСК-резистентных больных его содержание увеличено в 1,8 раза. Однако ни один из этих методов в настоящее время не рекомендован Европейским обществом кардиологов для оценки эффекта АСК.
С целью мониторирования эффективности АСК-терапии успешно применяется метод оценки внутрисосудистой активации тромбоцитов(ВАТ), характеризующий их внутрисосудистую активацию и агрегацию. Это позволяет оценивать чувствительность к АСК и индивидуально подбирать эффективную дозу препарата. Метод показал большую специфичность в выявлении функциональной активности тромбоцитов по сравнению с фотометрическим методом регистрации индуцированной агрегации кровяных пластинок и методом визуальной оценки агрегации ex vivo.
В нашем исследовании использовалась оценка АТ в контроле эффективности дезагрегантной терапии. Для определения эффекта медикаментозной терапии с применением ацетилсалициловой кислоты проведено сравнение параметров активности тромбоцитов у89 больных ИБС, не принимавших АСК и у 54 больных ИБС, принимающих кардиомагнил по 75 мг/сутки (таблица 21).
Из полученных данных следует, что значения большинства показателей различаются. На фоне приема АСК параметры активности тромбоцитов достоверно ниже, чем без ее приема. Исключением является показатель МА, который даже несколько выше, чем у лиц, не принимавших АСК. Однако это отличие не достоверно.
Таблица 21. Сравнение параметров активности тромбоцитов у больных ИБС, принимавших и не принимавших кардиомагнил
Показатель |
Средние значения переменных М ± m |
t-критерий |
||||
ИБС без приема АСК |
ИБС на фоне приема АСК |
|||||
Стьюдента |
||||||
|
M |
m |
M |
m |
||
|
|
|||||
Тр × 109/л |
204,4 |
6,9 |
208,4 |
10,7 |
0,2 |
|
Д, % |
72,2 |
1,1 |
80,8 |
2,2 |
-16,4 |
|
ДЭ, % |
21,8 |
0,9 |
15,7 |
1,7 |
13,4 |
|
С, % |
4,4 |
0,3 |
2,9 |
0,7 |
13,5 |
|
СЭ, % |
1 |
0,1 |
0,6 |
0,2 |
6,8 |
|
АФ, % |
27,5 |
1,1 |
19,9 |
2,2 |
15,3 |
|
ТрА, % |
12,4 |
0,5 |
10 |
1,6 |
5,1 |
|
МА, % |
5 |
0,3 |
6 |
0,9 |
1,7 |
|
БА, % |
0,8 |
0,08 |
0,2 |
0,1 |
8,4 |
|
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр – тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ - сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА - малые агрегаты, БА – большие агрегаты.
154
Наименьшее влияние прием кардиомагнила оказывал на МА. Показатель МА увеличивался на фоне лечения, а число БА и интегральный показатель агрегатообразования (ТрА) уменьшался (рисунок 9). Вследствие воздействия кардиомагнила происходило снижение способности тромбоцитов образовывать агрегаты, в первую очередь, за счет уменьшения числа БА.
Эти изменения являлись признаками эффективности проводимого лечения. Однако вследствие сохраняющейся активации, кровяные пластинки продолжали агрегировать. Образующиеся малые агрегаты не объединялись в большие агрегаты. Этим обусловлено повышение числа МА на фоне лечения кардиомагнилом.
Обращает на себя внимание значительное увеличение на фоне применения АСК дисперсии всех показателей, характеризующей размах отклонений от среднего. Этот факт свидетельствует о том, что при общем уменьшении активности тромбоцитов у части пациентов сохранялись высокие ее показатели.
Отмечалась разная чувствительность больных к проводимому лечению, что, вероятно, обусловлено резистентностью отдельных лиц к АСК. Для определения частоты встречаемости этого состояния среди наших пациентов проведено сравнение степеней активности изучаемых показателей до применения АСК и на фоне ее приема. Доля больных ИБС, устойчивых к проводимому лечению, составила 33,3%.
Тромбоциты в агрегатах, ст.а.
Уровень влияния: F=38,243, p=,00000
4,0
3,5
3,0
2,5
2,0
1,5
1,0
0,5
0 |
1 |
Лечение АСК
Рисунок 9. Влияние лечения кардиомагнилом на дисперсию тромбоцитов в агрегатах.
Тиклопидин
Тиклопидин (тиклид) является производным тиенопиридина и обладает отчетливыми антитромбоцитарными свойствами. Под действием тиклопидина
155
блокируются АДФ-рецепторы тромбоцитов, подавляется адгезия кровяных пластинок, а также уменьшается связывание фибриногена сIIb/IIIа рецепторами тромбоцитов на заключительном этапе агрегации. Хотя эффект тиклопидина сопоставим с таковым аспирина, а по некоторым данным(исследования CATS, TASS) превышает его, он редко применяется для длительного лечения больных ИБС в связи с возможными побочными явлениями в виде развития нейтропении, панцитопении и повышения содержания ЛНП, ЛОНП.
Тиклопидин используют в кардиохирургической практике в виде коротких (1–2 месяца) курсов антитромбоцитарной терапии после операции аортокоронарного шунтирования или чрескожной транслюминальной баллонной -ан гиопластики. Препарат назначают в дозе 500 мг в сутки в 2 приема. Терапевтический эффект наступает только через3–5 дней после начала лечения и сохраняется в течение10 дней после отмены препарата. Необходим контроль анализа крови каждые 2 недели, по крайней мере, в течение первых 3-х месяцев лечения.
Побочные эффекты при приеме тиклопидина: диспептические расстройства; крапивница; эритематозные сыпи; геморрагические осложнения; лейкопения, агранулоцитоз, панцитопения; повышение содержания ЛНП и ЛОНП. Прием тиклопидина противопоказан в следующих клинических ситуациях: геморрагические диатезы, в том числе геморрагические инсульты; язвенная болезнь желудка и двенадцатиперстной кишки; лейкопения, тромбоцитопения, агранулоцитоз в анамнезе; тяжелые поражения печени; гиперчувствительность к препарату; беременность и кормление грудью.
Клопидогрель
Клопидогрель также является производным тиенопиридина и по механизму действия мало отличается от тиклопидина. Его эффективность выше, а риск возникновения нейтропении, тромбоцитопении, панцитопении, геморрагий и диспептических расстройств меньше. Препарат принимают однократно в дозе 75 мг в сутки. Побочные эффекты и противопоказания к применению те же, что и у тиклопидина.
In vivo клопидогрель трансформируется печенью в ингибитор тромбоцитов, вызывающий дефект в их белковых структурах. Этот дефект можно устранен после полной замены кровяных пластинок, что обосновывает однократный прием препарата, несмотря на короткий период полувыведения. При ежедневном приеме 50-100 мг клопидогреля угнетение агрегации происходит на2-й день и достигает устойчивого уровня после4-7 дней лечения. Наши исследования также подтверждают эти данные.
Согласно данным З.С. Баркагана с соавт. (2005) при длительном использовании клопидогреля с антиагрегантной целью у большинства больных ИБС возможно применение половинной и четвертной суточной дозы препарата. Это
156
обусловлено увеличением активности в плазме физиологического антикоагулянта АТIII, которое связывают с противовоспалительным действием клопидогреля и его способностью устранять проявления эндотелиоза. Есть данные о снижении чувствительности тромбоцитов к клопидогрелю при сочетанном лечении с гиполипидемическими препаратами.
Учитывая разные механизмы антитромбоцитарного действия клопидогреля и АСК, возможно комбинированное применение этих препаратов. Исследование CURE (2001) показало, что использование комбинации клопидогреля с АСК рекомендовано всем больным с острым коронарным синдромом (ОКС) без подъема сегмента ST на ЭКГ как в случае проведения чрескожного вмешательства на коронарных артериях (ЧТКА), так и без планируемой реваскуляризации миокарда.
При этом доза АСК в комбинации с клопидогрелем не должна превышать 100 мг/сутки. Длительное применение клопидогреля и АСК(до 1 года) приводит к значительному снижению риска неблагоприятных сердечно-сосудистых исходов после коронарной ангиопластики. Однако на фоне комбинированной терапии частота серьезных кровотечений возрастает и четко зависит от дозы АСК.
Малочувствительным к действию АСК больным(9 человек) назначен плавикс (75 мг/сутки), препарат из группы тиенопиридинов. Для оценки влияния антитромбоцитарной терапии с использованием клопидогреля на показатели тромбоцитарной активности, применялся дисперсионный анализ. На рисунке 10 представлена динамика средних значений и размах отклонений интегрального показателя агрегатообразования (ТрА).
Отмечается выраженное снижение среднего значения этого параметра. Однако размах отклонений увеличивается, что свидетельствует о наличии у больных ИБС, устойчивых к проведению антитромбоцитарной терапии. Подобная динамика зарегистрирована на графиках, описывающих все параметры тромбоцитарной активности.
157
Тромбоцты в агрегатах,ст.а.
Уровень влияния: F=5,8238, p=,00813
4,5
4,0
3,5
3,0
2,5
2,0
1,5
1,0
0,5
0,0 -0,5 -1,0 -1,5
0 |
1 |
2 |
Лечение
Рисунок 10. Влияние лечения антитромбоцитарными препаратами на дисперсию числа тромбоцитов в агрегатах. Примечание: 0 – без лечения, 1 – на фоне лечения АСК, 2 – на фоне лечения клопидогрелем.
По нашим данным10-25% больных ИБС, принимающих клопидогрель, были устойчивы к его действию. У одного пациента на фоне приема клопидогреля значения изучаемых показателей тромбоцитарной активности оставались значительно выше нормальных. Именно эти «выскакивающие» величины и давали выраженную дисперсию, зафиксированную на графиках, описывающих результаты дисперсионного анализа.
Таким образом, устойчивость к антитромбоцитарному действию клопидогреля была выявлена у одного пациента, что составило 11%. Учитывая малое число наблюдений, делать статистически значимые выводы не представляется возможным и требует проведения дополнительных клинических исследований.
Применение ASA у больных ИБС
Назначение антитромбоцитарных препаратов в терапии клинических проявлений атеротромбоза является общепризнанным. В качестве основных лекарственных средств используют ацетилсалициловую кислоту, тиенопиридины, блокаторы рецепторов GPIIb-IIIa. Последние редко применяются вследствие своей дороговизны. Наиболее доступным и широко применяемым антитромбоцитарным препаратом является ASA.
По данным метаанализа около100 рандомизированных клинических исследований, проведенных у больных групп высокого риска, терапия ASA приводит к снижению риска сосудистой смертности примерно на15% и нефатальных сосудистых осложнений на 30%.
158
В настоящее время доминирует точка зрения, согласно которой все больные ИБС независимо от наличия в анамнезе инфаркта миокарда(ИМ) должны принимать ASA с целью профилактики развития сердечно-сосудистых осложнений при отсутствии противопоказаний (Аронов Д.М., Лупанов В.П., 2004). В литературе нет данных исследований, оценивающих параметры внутрисосудистой активации тромбоцитов у пациентов, перенесших инфаркт миокарда, в сравнении с больными ИБС, не отмечавших его в анамнезе.
Мы изучили показатели функциональной активности тромбоцитов у пациентов этих двух групп в сравнительном аспекте для определения необходимости проведения дезагрегантной терапии в зависимости от наличия в анамнезе указаний на перенесенный ИМ. В зависимости от кардиологического анамнеза пациентов было две группы больных. Пациенты, входящие в первую группу, указывали на перенесенный ИМ в анамнезе.
Длительность ИБС у них составляла 5,3 ± 0,2 года. Пациенты второй группы отрицали наличие ИМ в анамнезе. Длительность заболевания в этой группе больных составляла 4,8 ± 0,47 года. Все пациенты в течение 10 дней до исследования параметров внутрисосудистой активности кровяных пластинок не принимали антитромбоцитарные препараты. Результаты сравнения функциональной активности тромбоцитов в этих двух группах представлены в таблице 22.
Показатели тромбоцитарной активности у пациентов сравниваемых групп практически не различались. С целью выявления сложных нелинейных взаимосвязей между изучаемыми параметрами, характеризующими функциональную активность тромбоцитов и фактом перенесенного ИМ, использовали дисперсионный анализ. Однако этот вариант анализа с высокой достоверностью показал отсутствие различий в сравниваемых группах (р < 0,001).
Таблица 22. Сравнение показателей активности тромбоцитов у больных ИМ и без ИМ в анамнезе
|
Средние значения переменных М ± m |
t-критерий |
|||||
Переменная |
ИМ в анамнезе |
ИМ нет в анамнезе |
|||||
|
(n = 38) |
|
(n = 51) |
Стьюдента |
|||
|
|
|
|||||
|
M |
|
m |
M |
|
m |
|
Д, % |
71,8 |
|
1,42 |
72,7 |
|
1,42 |
-0,41 |
ДЭ, % |
21,8 |
|
1,12 |
21,7 |
|
1,24 |
0,04 |
С, % |
4,57 |
|
0,36 |
4,4 |
|
0,48 |
0,23 |
СЭ, % |
1,1 |
|
0,17 |
0,9 |
|
0,21 |
0,91 |
АФ, % |
27,7 |
|
1,40 |
27,3 |
|
1,42 |
0,17 |
ТрА, % |
12,9 |
|
0,56 |
11,6 |
|
0,96 |
1,23 |
МА, % |
5,08 |
|
0,32 |
4,7 |
|
0,47 |
0,74 |
БА, % |
0,82 |
|
0,09 |
0,73 |
|
0,12 |
0,39 |
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр – тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ - сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА - малые агрегаты, БА – большие агрегаты.
159
В качестве примера приводим графическое изображение результатов -од нофакторного дисперсионного анализа по интегральному показателю тромбоцитарной активности – общему числу активных форм тромбоцитов АФ(рисунок 11), на котором четко видно отсутствие различий средних значений изученных показателей.
Однако дисперсия этого показателя при наличии в анамнезе ИМ имеет меньший размах, что указывает на более плотное распределение значений и меньшую их вариативность у пациентов, перенесших ИМ. Этот факт свидетельствует о стабилизации повышенного уровня тромбоцитарной активности и минимальном «разбросе» значений вокруг среднего, то есть о формировании устойчивой гиперреактивности кровяных пластинок после перенесенного ИМ.
Активные формы тромбоцитов,%
Уровень влияния: F=5,8261, p=,01903
45
40
35
30
25
20
15
10
0 |
1 |
Иифаркт миокарда
Рисунок 11. Влияние фактора перенесенного ИМ на дисперсию активных форм тромбоцитов. Примечание: 0 –ИМ в анамнезе нет, 1 – ИМ в анамнезе
Таким образом, отсутствие у пациента в анамнезе перенесенного ИМ не может являться основанием для отсутствия в схеме лечения ИБС препаратов антитромбоцитарного действия, что согласуется с современными тенденциями
в лечении CCЗ, связанных с атеросклерозом.
Курантил
Курантил (дипиридамол) является высокоэффективным антитромбоцитарным препаратом, обладающим выраженными вазодилатирующими свойствами. Его эффект связан с конкурентным ингибированием адениловой фосфодиэстеразы и с повышением содержания цАМФ в тромбоцитах, что способствует снижению их способности к агрегации. Препарат угнетает активность аденозиндезаминазы, что приводит к увеличению содержания аденозинаэффективного вазодилатирующего биологического агента. Это объясняет наличие выраженного вазодилатирующего эффекта, проявляющегося преимущественно
160
на уровне резистивных сосудов (артериол). Имеются данные о положительном влиянии курантила на эндотелиальную функцию.
Такое сочетание делает препарат незаменимым при длительном лечении больных со стабильной стенокардией. С этой целью курантил назначают в дозе 225 мг в сутки (75 мг 3 раза в день). Теофиллин и некоторые пищевые продукты, содержащие производные ксантинов (кофе, крепкий чай), являясь антагонистами курантила, значительно снижают его эффективность. По данным масштабных плацебо-контролируемых исследований длительный прием курантила в дозе 225 мг/сутки позволяет снизить число ИМ и внезапной сердечной смерти на 24–30%, смертность от сердечно-сосудистых заболеванийна 15%. Терапевтический эффект курантила сопоставим с эффектом аспирина, но число геморрагических осложнений существенно меньше.
Нежелательные эффекты при длительном приеме курантила встречаются относительно редко, в основном при назначении дозы препарата, превышающей 200 мг в сутки. Они связаны с вазодилатирующим эффектом курантила: головные боли, головокружения, шум в ушах, гиперемия кожи лица, небольшая тахикардия. Возможны также диспептические явления(тошнота, диарея, боли в эпигастральной области). Противопоказания: острый ИМ или нестабильная стенокардия; стабильная стенокардия IV ФК; субаортальный стеноз; тяжелая почечная и сердечная недостаточность; выраженные нарушения сердечного ритма; выраженный геморрагический синдром; повышенная чувствительность к препарату.
Антиангинальные средства
Антиангинальные ЛС - препараты, обладающие свойством предупреждать или купировать приступы стенокардии и уменьшать другие проявления преходящей ишемии миокарда. Это основная группа ЛС, которые используются для лечения больных ИБС со стабильной стенокардией напряжения. Дейст-
вие всех антиангинальных ЛС при ИБС основано на гемодинамической - раз грузке миокарда и изменении соотношения потребления миокардом кислорода и реальным коронарным кровообращением. В клинической практике обычно используют 3 группы антиангинальных ЛС: 1. Нитраты и молсидомин. 2. β- адреноблокаторы. 3. Блокаторы медленных кальциевых каналов(антагонисты кальция).
Нитраты и молсидомин
Нитраты являются в настоящее время основными ЛС, которые используются для купирования и профилактики приступов стенокардии. Впервые эта уникальная способность нитроглицерина была продемонстрированаW. Murrel (1879). Механизм действия нитратов на гладкомышечные клетки сосудистой стенки тесно связан с функцией эндотелия. В сосудах здорового человека любое воздействие на эндотелий вызывает эндотелийзависимую релаксацию сосу-
161
да, в основе которой |
лежит |
усиленная продукция расслабляющих |
факторов, |
в первую очередь, оксида азота (NO). |
|
||
Последний не |
только |
предотвращает сосудистый спазм, но |
и вместе |
с простациклином ингибирует процесс адгезии и агрегации тромбоцитов, выполняя важную защитную роль и участвуя в регуляции местного сосудистого тонуса, пристеночной агрегации тромбоцитов.
У больных ИБС резко снижена продукция эндотелиального расслабляющего фактора (NО) и других дилатирующих факторов и, наоборот, повышена продукция вазоконстрикторных субстанций. Это один из главных факторов, способствующих нарушению коронарного кровотока и прогрессированию -за болевания. Органические нитраты (эфиры фосфорной кислоты) при парентеральном введении или сублингвальном применении быстро проникают внутрь сосудистого эндотелия и гладкомышечной клетки, являясь источником экзогенного оксида азота (NО). Включаясь в клеточный метаболизм, они обеспечивают релаксацию сосудов и в известной степени угнетают процесс агрегации тромбоцитов. Для внутриклеточного превращения органических нитратов в оксид азота (NО) требуются соединения, содержащие сульфгидрильные (SH) группы (цистеин).
Под действием нитратов происходит умеренная дилатация артерий
иартериол, снижение ОПСС, постнагрузки. Однако этот эффект достигается при более высоких концентрациях нитратов, чем при венодилатирующем эффекте: максимальное расширение вен происходит уже после сублингвального применения 0,1–0,2 мг нитроглицерина, тогда как расширение артериолпри приеме 0,4–0,6 мг нитроглицерина. Непосредственное коронарорасширяющее действие нитратов в дозах, используемых в клинике, выражено незначительно
ине имеет определяющего значения в формировании антиангинального действия.
Прием нитратов сопровождается увеличением коронарного кровотока за счет уменьшения КДО и КДД ЛЖ, что сопровождается уменьшением диастолического напряжения стенки желудочка, увеличением градиента давления, величины коронарного кровотока. Когда имеется выраженное повышение тонуса КА (спазм), нитроглицерин и другие нитраты способны активно воздействовать на стенку крупной КА в месте ее сужения. Этот эффект приобретает особенно важное значение у больных вазоспастической стенокардией Принцметала. Нитраты обладают умеренно выраженным антитромбоцитарным действием.
Для лечения больных ИБС широко используются три группы нитратов: нитроглицерин, изосорбида динитрата, изосорбида 5-мононитрат. С практической точки зрения целесообразно условное деление всех нитратов и их лекарственных форм в зависимости от продолжительности их действия: 1. Нитраты короткого действия (длительность эффекта до 1 часа). 2. Нитраты умеренно про-
162
лонгированного действия (длительность эффекта от 1 ч до 6 ч). 3. Нитраты значительно пролонгированного действия (длительность эффекта от 6 ч до 24 ч).
Механизм действия всех нитратов практически одинаков. Они отличаются в основном по своим фармакокинетическим свойствам и по биодоступности, величине и скорости наступления антиангинального эффекта, продолжительности действия и некоторым другим параметрам (таблица 23).
Таблица 23. Антиангинальное действие нитратов и молсидомина
Путь введения |
Лекарственные |
Начало |
Время на- |
Продолжительность |
|
формы |
действия |
ступления |
действия |
|
|
|
макс. эф- |
|
|
|
|
фекта |
|
|
Нитроглицерин (НГ) |
|
||
Сублингвально |
Табл., 0,5 мг |
1–3 мин |
5–6 мин |
10–20 мин |
Перорально |
Аэрозоль |
1–2 мин |
3–5 мин |
20 мин |
Буккально |
Полимерные |
2–3 мин |
30– |
3–5 ч |
|
пленки |
|
60 мин |
|
Трансдермально |
Мази |
15– |
1–2 ч |
3–4 ч (до 6 ч) |
|
|
60 мин |
|
|
Пластырь |
ТТС |
30 мин |
3–4 ч |
7–8 ч (до 20 ч) |
Внутрь |
Табл.депо-НГ, |
20– |
1 ч |
3–4 ч |
|
6,4 мг |
30 мин |
|
|
|
Изосорбида |
динитрат |
(ИДН) |
|
Перорально |
Аэрозоль |
1–2 мин |
2–5 мин |
1 ч |
Сублингвал. |
Табл., 10 мг |
2,5– |
20– |
1–2 ч |
|
|
10 мин |
40 мин |
|
Внутрь |
Табл., 10 мг, |
20– |
1 ч |
3–4 ч |
|
20 мг |
40 мин |
|
|
Внутрь |
Табл.-ретард, |
30– |
2–3 ч |
4–6 ч (до 7–8 ч) |
|
20мг, 40мг |
40 мин |
|
|
Внутрь |
Табл.-ретард, |
30– |
3–5 ч |
12–15 ч |
|
60 мг, 120 мг |
50 мин |
|
|
|
Изосорбид- |
5-мононитрат |
(ИМН) |
|
Внутрь |
Табл., 20 мг |
30– |
2–3 ч |
4–6 ч |
|
|
50 мин |
|
|
Внутрь |
Табл., 40 мг |
30– |
2–3 ч |
6–8 ч |
|
|
50 мин |
|
|
Внутрь |
Табл.-ретард, |
30– |
2–3 ч |
8–12 ч (до 24 ч) |
|
50–100 мг |
50 мин |
|
|
|
|
Молсидомин |
|
|
Внутрь |
Табл. 2 мг, 4 |
20 мин |
30– |
4–6 ч |
|
мг, 8 мг |
|
60 мин |
|
163
Таблетки депо-нитроглицерина, содержащие микрокапсулы с активным веществом, постепенно растворяющиеся в кишечнике(сустак-форте, нитронгфорте), отличаются весьма умеренным антиангинальным эффектом. Это связано с тем, что большая часть нитроглицерина при энтеральном способе введения
(около 80–90%) инактивируется ферментными системами печени и в системный кровоток попадает лишь малая часть принятой внутрь дозы препарата. Антиангинальное действие препаратов депо-нитроглицерина, содержащих от 2,5 мг до 5 мг активного вещества (сустак-мите, нитронг-мите), не отличается от эффекта плацебо. Поэтому эти препараты не должны использоваться в лечении больных ИБС.
Препараты изосорбида динитрата (ИДН) являются одними из самых распространенных антиангинальных ЛС(нитросорбид, изо мак, изодинит, изокет, кардикет). При приеме внутрь они практически полностью абсорбируются в кишечнике, однако в системный кровоток попадает всего10–20%. Остальная часть элиминируется в печени. При деградации изосорбида динитрата образуются его активные метаболиты, в том числе изосорбид-5-мононитрат, который обладает самостоятельными вазодилатирующими свойствами.
Лечение препаратами изосорбида динитрата рекомендуют начинать с разовой дозы 10 мг, которая по эффективности сопоставима с действием сус- така-форте или нитронга-форте. Поэтому после некоторого периода применения препарата в дозе 10 мг следует перевести больного на прием более эффективных разовых доз ИДН по20 мг или ИДН-ретард по40 мг. Продолжительность действия этих ЛС колеблется от3–4 ч (разовая доза 10 мг) до 4–6 ч (ретардные таблетки 40 мг). В последние годы используются две ретардные формы изосорбида динитрата, которые содержат 60 мг и 120 мг активного вещества. Продолжительность их антиангинального эффекта достигает12–15 ч. Препараты изосорбида-5-мононитрата (имдур, оликард, эфокс-лонг), синтезированные в последние годы, находят все большее распространение в клинической практике. Они отличаются существенными преимуществами, особенно замет-
ными при лечении тяжелых больных со стенокардией напряжения III–IV ФК.
Препараты изосорбида 5-мононитрата (ИМН) не подвергаются разрушению в печени и, следовательно, отличаются высокой биоусвояемостью (около 90%) и продолжительным действием Эффект этих препаратов является более стабильным и предсказуемым, чем изосорбида динитрата. Продолжительность антиангинального действия обычных таблеток изосорбида-5-мононитрата (10 мг, 20 мг и 40 мг) на 1,5–2 ч больше, чем у аналогичных препаратов изосорбида динитрата, а у ретардных форм (50–100 мг) достигает 10–12 ч и даже 24 ч. Препараты особенно хорошо переносятся больными, редко приводя к побочным явлениям. Благодаря своим положительным свойствам, препараты изосорбида 5-мононитрата с успехом применяются в лечении больных со стенокардией III–IV ФК.
164
Молсидомин почти полностью идентичен нитратам по механизму антиангинального действия. В печени молсидомин трансформируется в активный метаболит SIN–1А, который выделяет оксид азота(NО), что сопровождается отчетливым вазодилатирующим и умеренным антиагрегантным эффектом. В отличие от органических нитратов, молсидомин стимулирует образование оксида азота без участия SH-групп. Это объясняет, по-видимому, тот факт, что при лечении молсидомином гораздо реже, чем при применении нитратов, развивается толерантность. Препараты молсидомина (корватон и сиднофарм) отличаются умеренно пролонгированным действием (около 4–6 ч) и поэтому могут использоваться для профилактики приступов стенокардии.
Абсолютными противопоказаниями к использованию нитратов являются: артериальная гипотензия (АД ниже 100/60 мм рт. ст.); гиповолемия (ЦВД ниже 4 мм рт. ст.); шок; тампонада сердца; ИМ правого желудочка; левожелудочковая недостаточность с низким давлением наполнения; гиперчувствительность к нитратам. Относительные противопоказания: повышенное внутричерепное давление; гипертрофическая кардиомиопатия (ГКМП); выраженный стеноз устья аорты и митральный стеноз; склонность к ортостатической артериальной гипотензии; закрытоугольная глаукома.
Тактика лечения нитратами, молсидомином
|
Купирование приступа стенокардии. Для купирования приступа стено- |
|
||||||
кардии обычно используют короткодействующие лекарственные формы нитро- |
|
|||||||
глицерина и изосорбида динитрата. Наиболее популярным способом купирова- |
|
|||||||
ния стенокардии является сублингвальный прием таблетки нитроглицерина (0,5 |
|
|||||||
мг). Его купирующий эффект наступает в течение1–3 мин, естественно, при |
|
|||||||
условии прекращения действия любых факторов, спровоцировавших приступ |
|
|||||||
стенокардии. Максимальный эффект наступает через 5–6 мин, а общая продол- |
|
|||||||
жительность действия при таком способе применения нитроглицерина не пре- |
|
|||||||
вышает 10–20 мин. При отсутствии эффекта через 5 мин можно повторить при- |
|
|||||||
ем |
препарата. Сублингвальное |
применение |
нитроглицерина |
приводит |
|
|||
к быстрому всасыванию активного вещества через слизистую полости рта. От- |
|
|||||||
сутствует феномен |
первого прохождения через |
печень, препарат попадает |
|
|||||
в системный кровоток. |
|
|
|
|
|
|
|
|
|
При первом применении нитроглицерина, развиваются побочные эффек- |
|
||||||
ты, |
обусловленные |
выраженной |
дилатацией |
интракраниальных |
ве |
|||
и затруднением оттока крови от головного мозга. В результате повышается |
|
|||||||
внутричерепное давление и появляются “пульсирующие” головные боли, ощу- |
|
|||||||
щение распирания в голове, шум в ушах, покраснение лица, тахикардия. По- |
|
|||||||
следний симптом связан с рефлекторной активацией САС в ответ на чрезмер- |
|
|||||||
ное снижение ударного объема. Эти явления обычно быстро проходят, как только заканчивается действие нитроглицерина. В более редких случаях может развиться артериальная гипотензия, ортостатический коллапс, которым обычно
165
предшествует выраженная тахикардия. В связи с возможностью резкого снижения АД рекомендуют в течение 15 мин не принимать больше 2 таблеток нитроглицерина. Если приступ не купируется в течение15–20 мин после повторного приема препарата, возрастает вероятность развития острого коронарного синдрома (нестабильной стенокардии или ИМ), что может потребовать срочной госпитализации больного и проведения соответствующих неотложных мероприятий.
Ингаляционные лекарственные формы нитратов(аэрозоли) отличаются еще более быстрым и выраженным купирующим эффектом. Выпускаемые промышленностью дозируемые аэрозоли нитроглицерина и изосорбида динитрата более удобны в применении и, в отличие от таблеток нитроглицерина, сохраняют свою активность в течение длительного времени. Для купирования приступа аэрозоль распыляют в полости рта. Для получения быстрого эффекта обычно достаточно 1–2-х доз аэрозоля, каждая из которых содержит от0,2 мг до 0,4 мг нитрата.
Буккальные формы нитроглицерина также с успехом могут использоваться для купирования стенокардии. Это лекарственная форма нитроглицерина в виде тонких полимерных биорастворимых пластинок, которые содержат различные дозы препарата (1 мг, 2 мг, 4 мг). Пластины накладывают на верхнюю десну. Эффект наступает обычно через 2–3 мин и продолжается в течение3–5 ч. Это свойство буккальных форм нитроглицерина позволяет использовать пластинки тринитролонга не только для купирования, но и для профилактики приступов стенокардии. С этой целью пластинки тринитролонга обычно применя-
ют непосредственно перед предстоящей физической или эмоциональной - на грузкой.
5.5. ПРОФИЛАКТИКА ПРИСТУПОВ СТЕНОКАРДИИ
Профилактический прием нитратов показан у большинства больных ИБС со стабильным течением с целью предупреждения приступов стенокардии и повышения толерантности к физической нагрузке. Существенно изменилось отношение к выбору препаратов и самой методике их назначения. В настоящее время доказано, что классическая методика лечения приводит к быстрому развитию толерантности к нитратам и ослаблению или полной потере эффективности этих препаратов. Наиболее часто толерантность развивается при внутривенном капельном введении нитроглицерина или изосорбида динитрата, а также при применении мазевых лекарственных форм. Феномен толерантности может развиться при применении любых нитратов, особенно если используются препараты продолжительного действия. В некоторых случаях развивается так называемая тахифилаксия - толерантность, развившаяся очень быстро, после приема больным нескольких доз нитратов. Механизмы возникновения феномена толерантности до сих пор остаются невыясненными. Попытки предупрежде-
166
ния толерантности к нитратам в клинике с помощью донаторовSH-групп или ингибиторов АПФ пока выглядят малоубедительными.
Надежным способом профилактики является прерывистый режим приема нитратов, когда в течение дня остаются достаточно продолжительные периоды (не меньше 8–10 ч), свободные от действия нитратов. С этой целью короткодействующие лекарственные формы нитратов рекомендуют назначать не чаще 2-х или, в крайнем случае, 3-х раз в сутки, но “асимметрично” утром и днем, оставляя вечерние и ночные часы без действия препарата. При необходимости прием нитратов “смещают” в другое время суток. Нитраты умеренно пролонгированного действия (длительность антиангинального эффекта 3–6 ч) назначают не чаще 2 раз в сутки (утром и днем), а препараты значительно пролонгированного действия (длительность эффекта 6–12 ч) - не больше 1 раза в сутки.
Больным со стенокардией напряженияI и II ФК, у которых возникновение приступов стенокардии, связанной с физической нагрузкой, в большинстве случаев вполне предсказуемо, рекомендуют так называемый спорадический прием нитратов, их применение только в период физической активности пациента, непосредственно перед выполнением нагрузки. В этих случаях обычно используют нитраты короткого или умеренно пролонгированного действия.
Указанная методика применения препаратов пригодна не для всех больных ИБС. У пациентов с тяжелым течением болезни, когда приступы стенокардии возникают при малых физических нагрузках и даже в покое, методика прерывистого и, тем более, спорадического применения нитратов неприемлема, поскольку отмена препарата на относительно длительный срок в течение суток может сама по себе вызвать ухудшение состояния (синдром отмены, рикошета).
В этих случаях приходится назначать нитраты умеренно или значительно пролонгированного действия, чтобы обеспечить их антиангинальный эффект в течение суток.
Основные принципы оптимального режима приема нитратов в зависимости от функционального класса стенокардии представлены в таблице24. Для большинства больных со стенокардией I ФК целесообразно предусмотреть спорадический режим приема нитратов. ФК II предполагает применение либо спорадического, либо (при необходимости) прерывистого режима приема нитратов, но не более 2 раз в сутки, асимметрично. Обычно назначаются препараты умеренно пролонгированного действия. Стенокардия III ФК требует прерывистого приема нитратов с использованием препаратов умеренно и значительно пролонгированного действия, которые должны приниматься 3–4 раза и 1–2 раза
всутки.
Убольных ФК IV целесообразен постоянный режим дозирования нитратов либо умеренно пролонгированного действия(4–6 раз в день), либо значительно пролонгированного действия (2–3 раза в сутки). Подобный режим применения нитратов позволяет поддерживать антиангинальный эффект в течение
167

всего дня. При лечении больных III-IV ФК ИБС следует иметь в виду возможность ухудшения состояния больных при резкой отмене нитратов.
Таблица 24. Прием нитратов и ФК стенокардии напряжения
Функциональный |
Препараты и ле- |
Продолжительность |
Кратность |
|
|||
класс |
карственные |
|
действия |
приема |
|
||
|
формы |
|
|
|
|
|
|
ФК I |
|
Спорадический режим приема |
|
|
|||
|
|
Короткодействующие нитраты |
|
|
|||
|
Табл. НГ, 0,5 мг, |
|
20 мин |
За 5–10 или 15– |
|
||
|
сублингвально |
|
|
20 мин |
|
до |
|
|
Аэрозоль |
, |
НГ |
20 мин |
предполагаемой |
|
|
|
орошение |
полости |
|
|
нагрузки |
|
|
|
рта |
|
|
|
|
|
|
|
Аэрозоль |
ИДН, |
1 ч |
|
|
|
|
|
орошение |
полости |
|
|
|
|
|
|
рта |
|
|
|
|
|
|
|
Табл., ИДН, 10 мг, |
|
1–2 ч |
|
|
|
|
|
сублингвально |
|
|
|
|
|
|
ФК II |
|
Спорадический режим приема |
|
|
|||
|
|
Короткодействующие нитраты |
|
|
|||
|
Табл. НГ, 0,5 мг, |
|
20 мин |
За |
5–10 мин |
|
|
|
сублингвально |
|
|
или 15–20 мин |
|
||
|
Аэрозоль |
, |
НГ |
20 мин |
до |
предпола- |
|
|
орошение |
полости |
|
|
гаемой |
нагруз- |
|
|
рта |
|
|
|
ки |
|
|
|
Аэрозоль |
ИДН, |
1 ч |
|
|
|
|
|
орошение |
полости |
|
|
|
|
|
|
рта |
|
|
|
|
|
|
|
Табл., ИДН, 10 мг, |
|
1–2 ч |
|
|
|
|
|
сублингвально |
|
|
|
|
|
|
|
|
Прерывистый режим приема |
|
|
|||
|
Нитраты умеренно пролонгированного действия |
|
|||||
|
Полимерные |
|
3–5 ч |
2 раза |
в сутки, |
|
|
|
пленки |
НГ, бук- |
|
|
асимметрично |
|
|
|
кально |
|
|
|
|
|
|
|
Мази НГ, транс- |
|
3–4 ч |
|
|
|
|
|
дерм. |
|
|
|
|
|
|
|
Табл. депо-НГ, 6,4 |
|
3–4 ч |
|
|
|
|
|
мг, внутрь |
|
|
|
|
|
|
|
Табл. ИДН, 10 мг, |
|
3–4 ч |
|
|
|
|
|
20 мг, внутрь |
|
|
|
|
|
|
168
|
Табл. ИДН-ретард, |
|
4–6 ч |
|
|
||
|
20 мг, 40 мг, 60 |
|
|
|
|
||
|
мг, внутрь |
|
|
|
|
|
|
|
Табл. ИМН, 20 мг, |
|
4–6 ч |
|
|
||
|
внутрь |
|
|
|
|
|
|
|
Табл. |
молсидо- |
|
4–6 ч |
|
|
|
|
мин, 2 мг, 4 мг, 8 |
|
|
|
|
||
|
мг, внутрь |
|
|
|
|
|
|
ФК III |
|
|
Прерывистый режим приема |
|
|||
|
Нитраты умеренно пролонгированного действия |
||||||
|
Полимерные |
|
|
3–5 ч |
3–4 |
раза |
|
|
пленки |
НГ, |
бук- |
|
|
в сутки, |
асим- |
|
кально |
|
|
|
|
метрично |
|
|
Мази |
НГ, транс- |
|
3–4 ч |
|
|
|
|
дерм. |
|
|
|
|
|
|
|
Табл.депо-НГ, 6,4 |
|
3–4 ч |
|
|
||
|
мг, внутрь |
|
|
|
|
|
|
|
Табл. ИДН, 10 мг, |
|
3–4 ч |
|
|
||
|
20 мг, внутрь |
|
|
|
|
|
|
|
Табл. ИДН-ретард, |
|
4–6 ч |
|
|
||
|
20 мг, 40 мг, 60 |
|
|
|
|
||
|
мг, внутрь |
|
|
|
|
|
|
|
Табл. ИМН, 20 мг, |
|
4–6 ч |
|
|
||
|
внутрь |
|
|
|
|
|
|
|
Табл. молсидоми- |
|
4–6 ч |
|
|
||
|
на, 2 мг, 4 мг, 8 мг, |
|
|
|
|
||
|
внутрь |
|
|
|
|
|
|
|
Нитраты значительно пролонгированного действия |
||||||
|
Пластырь |
, |
НГ |
7–8 ч |
1–2 |
|
|
|
трансдерм. |
|
|
|
|
|
|
|
Табл. ИДН-ретард, |
|
12–15 ч |
1 |
|
||
|
120 мг |
|
|
|
|
|
|
|
Табл. ИМН, 40 мг |
|
6–8 ч |
1–2 |
|
||
|
Табл. |
ИМН- |
8–12 ч (до 20 ч) |
1 |
|
||
|
ретард, 50–100 мг |
|
|
|
|
||
ФК IV |
|
|
Постоянный режим приема |
|
|||
|
Нитраты умеренно пролонгированного действия |
||||||
|
Полимерные |
|
|
3–5 ч |
4–6 раз |
в сутки |
|
|
пленки |
НГ, |
бук- |
|
|
(в том числе на |
|
|
кально |
|
|
|
|
ночь) |
|
|
Мази |
НГ, транс- |
|
3–4 ч |
|
|
|
|
дерм. |
|
|
|
|
|
|
|
Табл. депо-НГ, 6,4 |
|
3–4 ч |
|
|
||
|
мг, внутрь |
|
|
|
|
|
|
169
|
Табл. ИДН, 10 мг, |
|
3–4 ч |
|
|
|
20 мг, внутрь |
|
|
|
|
|
Табл. ИДН-ретард, |
|
4–6 ч |
|
|
|
20 мг, 40 мг, 60 |
|
|
|
|
|
мг, внутрь |
|
|
|
|
|
Табл. ИМН, 20 мг, |
|
4–6 ч |
|
|
|
внутрь |
|
|
|
|
|
Табл. молсидоми- |
|
4–6 ч |
|
|
|
на, 2 мг, 4 мг, 8 мг, |
|
|
|
|
|
внутрь |
|
|
|
|
|
Нитраты значительно пролонгированного действия |
||||
|
Пластырь |
, |
НГ |
7–8 ч |
2–3 раза в сутки |
|
трансдерм. |
|
|
|
(в том числе на |
|
Табл. ИДН-ретард, |
|
12–15 ч |
ночь) |
|
|
120 мг |
|
|
|
|
|
Табл. ИМН, 40 мг |
|
6–8 ч |
|
|
|
Табл. |
ИМН- |
8–12 ч (до 20 ч) |
|
|
|
ретард, 50-100 мг |
|
|
|
|
Примечание: НГ - нитроглицерин; ИДН - изосорбида динитрат; ИМН - изосорбид-5-мононитрат.
β-адреноблокаторы
Механизм их действия убольных ИБС связан с их отрицательным инотропным (хронотропным) эффектом, в результате которого снижается потребность миокарда в кислороде и уменьшается риск возникновения ишемии миокарда во время нагрузки. Имеет значение увеличение продолжительности диастолы, что способствует увеличению коронарного кровотока. Поскольку β- адреноблокаторы препятствуют взаимодействию катехоламинов ссоответствующими рецепторами клеток, их эффект в большей степени проявляется при высокой исходной активности САС при наличии синусовой тахикардии, при физической нагрузке.
Длительное применение β-адреноблокаторов способствует снижению активности САС и РААС и ограничению отрицательных эффектов гиперактивации этих систем. В первую очередь, речь идет о снижении (нормализации) АД (у больных с сопутствующей АГ), ремоделированию гипертрофанного миокарда ЛЖ, уменьшении скорости прогрессирования фибропластических процессов в сердечной мышце.
По данным нескольких многоцентровых, рандомизированных клинических исследований β-адреноблокаторы достоверно увеличивали выживаемость больных ИБС, перенесших ИМ. Общая летальность и частота повторных фатальных ИМ при длительном(около 5 лет) применении β-адреноблокаторов
170
уменьшаются на 25%, а частота внезапной сердечной смертина 30%. Эти данные подтверждают необходимость применения β-адреноблокаторов у всех больных ИБС (при отсутствии противопоказаний). β-адреноблокаторы при длительном приеме могут спровоцировать бронхоспазм(преимущественно неселективные β-адреноблокаторы); усилить синусовую брадикардию или вызвать блокады сердца; усугубляют гиперлипопротеинемии (ГЛП), увеличивая содержание общего ХС и ХС ЛНП; утяжеляют сердечную недостаточность (за счет угнетения сократительной способности миокарда); могут маскировать симптомы гипогликемии у больных с сопутствующим сахарным диабетом; могут спровоцировать спазм КА или усугубить симптомы облитерирующего заболевания периферических артерий.
Стимуляция β-адренорецепторов (β2-рецепторов) сопровождается расши-
рением КА и периферических сосудов скелетных мышц. Стимуляция α-
1
адренорецепторов вызывает отчетливый вазоконстрикторный эффект. Блокада β-адренорецепторов может оставить α-адренергические эффекты -без β адренергического “противодействия”, что усугубляет симптоматику поражения периферических артерий и может спровоцировать спазм КА. Понятно, что та-
кими |
свойствами |
в |
большей |
степени |
обладают |
неселективные- |
адреноблокаторы, воздействующие как |
на 1β-, так и на β2-адренорецепторы. |
|||||
Особенно опасно назначать β-адреноблокаторы больным с отчетливо выраженным спазмом КА, пациентам с вазоспастической стенокардией Принцметала.
Хотя практически все β-адреноблокаторы обладают примерно одинаковым антиангинальным (антиишемическим) эффектом, выбор препарата для длительного лечения больных ИБС должен учитывать исходное состояние сер- дечно-сосудистой системы, склонность больных к синусовой тахикардии или брадикардии, наличие сопутствующих АГ, ХСН, сахарного диабета, ГЛП. Особое внимание следует обращать на подбор адекватной дозы ЛС и их фармакологические свойства (селективность, внутренняя симпатомиметическая активность, липофильность).
Следует стремиться к назначению β-селективных блокаторов (метопро-
1
лол, бисопролол, атенолол ), поскольку неселективные β -адреноблокаторы
1,2
могут усугублять вазоконстрикторные реакции со стороны и периферических сосудов. Неселективные β-адреноблокаторы могут спровоцировать бронхоспазм, особенно у больных с обструктивными заболеваниями легких.
Селективность β-адреноблокаторов относительна. При лечении малыми дозами этих препаратов селективность выражена в большей степени, тогда как при назначении больших доз свойства селективности во многом теряются. У больных ИБС с сопутствующим хроническим обструктивным бронхитом до-
зы высокоселективных β-адреноблокаторов (бетаксолола, бисопролола, неби-
1
валола) должны быть снижены. При сопутствующей бронхиальной астме эти
171
препараты противопоказаны. В последние годы получили распространение -β адреноблокаторы, обладающие вазодилатирующими свойствами, обусловленными дополнительной блокадой a-адренорецепторов (лабетолол, карведилол). Эти препараты особенно показаны больным ИБС с сопутствующей АГ или/и ХСН, пациентам с признаками периферического атеросклероза.
В лечении больных хронической ИБС целесообразно использовать- β адреноблокаторы без ВСА, которая снижает эффективность препаратов. Исключение составляют пациенты с исходной склонностью к синусовой брадикардии. В этих случаях назначение β-адреноблокаторов с ВСА не сопровождается брадикардией в покое, но во время нагрузки, когда активность САС возрастает, эти препараты способны ограничивать ЧСС, обеспечивая лишь умеренное повышение потребности миокарда в кислороде. Липофильность β- адреноблокаторов. Липофильные (жирорастворимые) препараты хорошо про-
никают через гематоэнцефалический барьер и способны воздействовать на ЦНС.
Существует мнение, что кардиопротекторные антиишемические свойства наиболее выражены у липофильных β-адреноблокаторов (метопролол, тимолол, пропранолол, ацебутолол), которые достоверно снижают частоту фибрилляции желудочков, внезапной смерти и повторных ИМ. Эта особенность липофильных β-адреноблокаторов обусловлена их блокирующим эффектом центральных β1-адренорецепторов, что сопровождается повышением активности парасимпатической нервной системы (“вагуса”).
Подбор дозы β-адреноблокаторов имеет особо важное значение. Только применение адекватных доз этих ЛС сопровождается отчетливым антиишемическим эффектом и положительно влияет на прогноз заболевания. Единственным объективным критерием эффективности β-адреноблокаторов могут служить результаты повторных нагрузочных тестов и динамика толерантности к физической нагрузке. Врачи в большинстве случаев лишены такой возможности и вынуждены ориентироваться на уменьшение ЧСС в покое. На фоне приема β-адреноблокаторов ЧСС, зарегистрированная в покое, должна составлять не более 55–60 ударов. У больных со стенокардией III–IV ФК рекомендуется снижать ЧСС до 50 ударов, если такая брадикардия не сопровождается неприятными ощущениями (головокружение, слабость), не развиваются нарушения проводимости.
Даже такое снижение ЧСС, обусловленное отрицательным хронотропным действием препарата, не гарантирует желательного отрицательного инотропного эффекта, который и лежит в основе антиишемического действия- β блокаторов. Это связано с тем, что β-адренорецепторы СА-узла оказываются более чувствительными к β-адреноблокаторам, чем миокард желудочков.
172

Наибольшее снижение ЧСС приходится на начальные небольшие дозы этих ЛС, когда их антиишемический эффект еще слабо выражен. Дальнейшее повышение разовых доз препарата существенного дополнительного уменьшения ЧСС уже не вызывает, хотя антиангинальный эффект продолжает нарастать. Дозы β-адреноблокаторов, не вызывающие синусовой брадикардии не оказывают и должного антиишемического эффекта. В таблице 25 приведены дозы β-адреноблокаторов, рекомендуемые для лечения больных со стабильной стенокардией напряжения. При подборе эффективной дозы β-адреноблокаторов соблюдают принцип “титрования” дозы.
Таблица 25. Дозы β-адреноблокаторов в лечении стабильной стенокардии
Препарат |
Ориентировочные дозы (мг) и кратность приема |
||||
|
суточные |
|
разовые |
|
кратность |
|
|
|
|||
|
|
|
|
|
приема |
Пропранолол |
60–160 |
|
20–40 |
|
3–4 |
Метопролол |
75–225 |
|
25–75 |
|
3 |
Атенолол |
50–200 |
|
50–100 |
|
1–2 |
Талинолол |
100–200 |
|
100–200 |
|
1 |
Бисопролол |
5–20 |
|
5–20 |
|
1 |
Пиндолол |
15–40 |
|
5–10 |
|
3–4 |
Надолол |
40–80 |
|
40–80 |
|
1 |
Бетаксолол |
10–20 |
|
10–20 |
|
1 |
Прекращение приема β-адреноблокаторов после их длительного применения сопровождается тахикардией, головными болями, возбуждением, тремором. Чтобы не допустить развития синдрома отмены, рекомендуется постепенное, в течение нескольких дней, снижение дозы этих ЛС.
Блокаторы медленных кальциевых каналов
Блокаторы медленных кальциевых каналов(антагонисты кальция) - большая группа ЛС, общим свойством которых является способность тормозить медленный ток кальция в клетку через медленные кальциевые каналы,
2+
в конечном счете уменьшая концентрацию внутриклеточного Са. Антагонисты кальция воздействуют на гладкомышечные клетки сосудов, кардиомиоциты и клетки проводящей системы сердца. В зависимости от химической структуры антагонисты кальция делят на3 большие группы, каждая из которых отличается преимущественным воздействием на те или иные клеточные структуры.
Важными свойствами, которые определяют терапевтический эффект антагонистов кальция, являются: 1. Отрицательное инотропное действие. 2. Отрицательное хронотропное действие (угнетение автоматизма СА-узла). 3. Сис-
173
темная вазодилатация, которая приводит к снижению ОПСС и величины постнагрузки. 4. Дилатация КА и/или предотвращение коронароспазма. Перечисленные свойства неодинаково выражены у представителей различных групп антагонистов кальция. В сравнении сb-адреноблокаторами антагонисты кальция обладают некоторыми дополнительными преимуществами. К ним относится возможность использования этих препаратов: при бронхоспазме; при заболеваниях периферических сосудов (периферическом атеросклерозе, системных васкулитах, синдроме Рейно); при тяжелом сахарном диабете; при вазоспастической стенокардии Принцметала. Большинство антагонистов кальция не влияют на липидный спектр (некоторые из них даже снижают содержание ЛНП в крови и повышают содержание ЛВП) и обладают антиагрегантными свойствами.
Свойством системной вазодилатации и расширения КА обладают представители всех трех групп антагонистов кальция. Основные отличия заключаются в выраженности влияния на СА-узел, АВ-проводимость и сократимость миокарда. Производные дифенилалкиламина (верапамила) угнетают функцию СА-узла, проводимость по АВ-узлу и обладают отчетливым отрицательным инотропным действием. Эти свойства сближают их с β-адреноблокаторами и дают возможность использовать верапамил у больных ИБС преимущественно в следующих клинических ситуациях: при гиперактивации САС (синусовая тахикардия); при стенокардии напряжения; при наджелудочкоых нарушениях ритма. Эти же особенности верапамила и его производных могут усугублять застойную сердечную недостаточность, синусовую брадикардию и АВ-блокаду и противопоказаны при наличии этих состояний у больных ИБС.
Производные дигидропиридина (группа нифедипина) практически не влияют на функцию СА-узла, АВ-проводимость и сократимость миокарда желудочков и в большей степени проявляют свойства артериолярных вазодилататоров. Поэтому их предпочтительно использовать в следующих клинических ситуациях: при склонности больных к синусовой брадикардии; при выраженной АГ; при застойной сердечной недостаточности; при наличии признаков АВ-блокады; при вазоспастической стенокардии Принцметала. Благодаря выраженному вазодилатирующему эффекту прием нифедипина и других представителей этой группы сопровождается признаками рефлекторной тахикардии, артериальной гипотензии, головокружением, ощущением “приливов” к голове Частым побочным эффектом представителей этой группы являются периферические отеки. Производные бензотиазепина (дилтиазем) сочетают в себе свойства верапамила и нифедипина.
Показаниями для блокаторов медленных кальциевых каналов в лечении больных хронической ИБС являются: сочетание стенокардии напряжения с синусовой брадикардией, СССУ, АВ-блокадой I степени, умеренными проявлениями сердечной недостаточности(дигидропиридины пролонгированного действия); сочетание стенокардии напряжения и АГ, особенно на фоне гиперактивации САС и склонности к синусовой тахикардии(верапамил); стенокар-
174

дия напряжения у лиц пожилого и старческого возраста; вазоспастическая стенокардия Принцметала; сочетание стенокардии напряжения и обструктивных заболеваний легких; сочетание стенокардии напряжения и облитерирующего атеросклероза сосудов ног; сочетание стенокардии напряжения с метаболическими нарушениями (ГЛП, сахарный диабет).
Антиангинальный эффект выше у верапамила и дилтиазема, чем у производных дигидропиридина. Применение антагонистов кальция в лечении помогает контролировать симптомы заболевания, уменьшать количество приступов стенокардии, стабилизировать уровень АД, улучшая качество жизни больных. Короткодействующие формы нифедипина в дозе более40 мг в сутки не рекомендуют для лечения больных со стабильной стенокардией напряжения, в связи с появившимися недавно сообщениями об их отрицательном влиянии на прогноз ИБС и возможностью непредсказуемого снижения АД, развития рефлекторной тахикардии и провоцирования приступов стенокардии при резком изменении гемодинамики. В клинике в настоящее время применяют дигидропиридиновые препараты только пролонгированного действия. В таблице 26 представлены терапевтические дозы блокаторов медленных кальциевых каналов, рекомендуемые для лечения больных ИБС со стабильной стенокардией напряжения.
Таблица 26. Дозы блокаторов медленных кальциевых каналов
Препарат |
Разовые дозы, мг |
Кратность приема |
Верапамил |
80–120 |
2–3 |
Нифедипин-ретард |
20 |
1–2 |
Амлодипин |
5–10 |
1 |
Фелодипин |
5–10 |
1 |
Дилтиазем-ретард |
90–180 |
1 |
Цитопротекторы
В последние годы возрос интерес к так называемой метаболической терапии ИБС, направленной на оптимизацию обменных процессов в кардиомиоцитах, функционирующих в условиях хронической ишемии. Все предлагавшиеся ранее средства воздействия на метаболизм ишемизированного миокарда оказались недостаточно эффективными. Исключение составляет недавно синтезированный препарат метаболического действиятриметазидин (предуктал). Как показали специальные исследования, триметазидин обладает прямым цитопротекторным эффектом, реализуемым на уровне кардиомиоцита и субклеточных структур. Он оптимизирует использование кислорода ишемизированной клеткой, приводя к сдвигу внутрикл точных обменных процессов в сторону окисления глюкозы.
175
Предуктал ингибирует β-окисление ЖК, способствует увеличению интенсивности окислительного фосфорилирования. В результате улучшается сопряжение анаэробного гликолиза и окислительного фосфорилирования, уменьша-
+ |
+ |
2+ |
ется образование лактата и накопления в клетке Н, Nа |
|
и Са . Триметазидин |
обладает отчетливым антиишемическим эффектом, это |
действие не связано |
|
с изменением параметров гемодинамики. Поэтому при его применении побочные явления встречаются крайне редко. Препарат не изменяет ЧСС, систолическое и диастолическое АД, конечно-диастолическое давление в ЛЖ, величину СИ. Это позволяет использовать его для лечения даже в тех случаях, когда другие антиангинальные средства противопоказаны.
Триметазидин (предуктал) рекомендован Европейской ассоциацией кардиологов для лечения стенокардии. Его противоишемический и антиангинальный эффекты подтверждены в рандомизированных контролируемых исследованиях. На фоне монотерапии триметазидином у больных ИБС наблюдается достоверное снижение числа приступов стенокардии(25%), увеличение продолжительности нагрузки на велоэргометре (43%), уменьшение максимального отклонения сегмента RS–T (39%), улучшение сегментарной сократимости за счет восстановления функции жизнеспособных асинергичных сегментов ЛЖ. Применяется курсовое лечение (1–3 месяца) по 20 мг 3 раза в день. Лучшие результаты получают при комбинированном назначении тримезидина и одного из “гемодинамических” антиангинальных средств.
Ингибиторы АПФ
В |
современных условиях ингибиторы |
АПФ широко |
используются |
в лечении |
для профилактики дисфункции ЛЖ. Они |
особенно показаны |
боль- |
ным, перенесшим ИМ и имеющим признаки снижения насосной функции сердца. В этих случаях ингибиторы АПФ прежде всего оказывают влияние на гемодинамику. Они способствуют нормализации(оптимизации) АД, уменьшают преднагрузку и постнагрузку, в известной степени устраняют констрикцию коронарных сосудов, повышают экскрецию натрия и воды, уменьшая продукцию альдостерона, устраняют прямое токсическое действие ангиотензинаII и катехоламинов на миокард. Помимо этого, ЛС ограничивают влияние ангиотензина II на процесс атерогенеза, миграцию и пролиферацию гладкомышечных клеток, гиперплазию сосудистой интимы, улучшают функцию эндотелия, повышая продукцию оксида азота. Способствуют стабилизации атеросклеротической бляшки и уменьшению частоты возникновения ОКС. По данным не-
скольких широкомасштабных |
контролируемых клинических исследований |
(SAVE, АIRЕ, ТRAZU, ХЕАRТ, |
SОLVD), применение ингибиторов АПФ |
у больных, перенесших ИМ, приводит к достоверному уменьшению числа повторных ИМ и эпизодов нестабильной стенокардии, частоты развития сердечной недостаточности и общей летальности больных.
176
В настоящее время определены показания и тактика применения ингибиторов АПФ у больных, перенесших ИМ: при наличии клинических признаков сердечной недостаточности; при ФВ ЛЖ меньше40%; при переднем ИМ; при повышенном риске возникновения повторного ИМ(у лиц старше 65 лет, а также у пациентов, перенесших обширные ИМ с величиной зоны акинезии, определяемой при ЭхоКГ, более 20%); при сохранении стабильной окклюзии КА в зоне инфаркта.
Комбинированное лечение антиангинальными средствами
Положительный эффект лечения больных стабильной стенокардией -со ставляет 70–75%. При неэффективности или недостаточной эффективности монотерапии рекомендуется комбинированное лечение2-3 антиангинальными препаратами. Нередко это позволяет снизить дозы каждого из назначаемых препаратов и уменьшить тем самым риск возникновения побочных эффектов. Оптимальными комбинациями антиангинальных ЛС считают следующие их
сочетания: 1. β-адреноблокатор + нитраты. |
Сочетание нитратов и - |
β |
|||
адреноблокаторов особенно показано больным ИБС со стенокардией напряже- |
|
||||
ния III-IV ФК, в том числе пациентам, перенесшим ИМ. 2. β1-адреноблокатор + |
из |
||||
блокатор |
медленных |
кальциевых каналов |
пролонгированного |
действия |
|
группы нифедипина. β1-адреноблокаторы (метопролол, атенолол) нивелируют |
|
||||
отрицательные эффекты рефлекторной активации САС, возникающей на фоне |
|
||||
лечения |
препаратами |
дигидропиридинового |
ряда. 3. Верапамил + |
нитраты. |
|
Комбинация особенно показана в случае возникновения суправентрикулярных нарушений сердечного ритма.
При рефрактерности больных к монотерапии и комбинированному лечению двумя антиангинальными препаратами возможна попытка назначения трех ЛС, обладающих соответствующим действием. Можно использовать комбинацию b-адреноблокатор + препараты изосорбида динитрата или изосорбида мононитрата + дилтиазем. Однако назначение препаратов, относящихся к трем различным группам антиангинальных ЛС, не всегда приводит к усилению их суммарного эффекта. При неэффективности лекарственной терапии решается вопрос о целесообразности хирургической реваскуляризации миокарда.
Гиполипидемическая терапия
Гиполипидемическая терапия является обязательной составной частью комбинированного лечения больных со стабильной стенокардией напряжения. Уменьшение летальности от осложнений ИБС и частоты развития ИМ происходит пропорционально снижению уровня ХС и ХС ЛНП. Успешная коррекция нарушений липидного обмена существенно улучшает результаты антиангинальной терапии, заметно улучшает качество жизни больных ИБС. В лечении больных ИБС со стабильной стенокардией необходимо придерживаться общепринятых принципов.
177
5.6. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
В экономически развитых странах кардиохирургическое лечение получило достаточно широкое распространение. Реваскуляризация улучшает выживаемость больных с тяжелым течением и/или серьезным прогнозом заболевания. В клинике чаще используют два метода: чрескожную транслюминальную коронарную ангиопластику (ЧТКА) и аортокоронарное шунтирование (АКШ).
Показаниями к проведению реваскуляризации являются ангиографические и клинические признаки, указывающие на высокий риск развития ИМ и внезапной сердечной смерти: трехсосудистое поражение КА; 2-3-х сосудистое поражение КА в сочетании с дисфункцией ЛЖ; поражение ствола ЛКА; ФВ ЛЖ меньше 30%.
Частым показанием к проведению КАГ и хирургическому вмешательству у больных со стабильной стенокардией напряжения является неэффективность медикаментозной терапии и сохранение выраженных симптомов заболевания, резко ограничивающих физическую активность пациентов. Однако в этих случаях имеется угрожающее поражение коронарного русла, присутствуют ангиографические показания к проведению реваскуляризации. Выбор между двумя методами хирургической реваскуляризации (ЧТКА и АКШ) до сих пор является предметом дискуссий. Полагают, что при одно-двухсосудистом стенозе проксимальных участков КА (за исключением поражения ствола ЛКА) и удовлетворительной функции ЛЖ целесообразно проведение ЧТКА. Эта процедура является предпочтительной у лиц пожилого возраста или при наличии противопоказаний к оперативному вмешательству на сердце. При многососудистом стенозировании КА или поражении ствола ЛКА, сочетающихся со снижением ФВ ЛЖ и/или наличием сахарного диабета, предпочтительнее операция АКШ.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА)
Показанием для ЧТКА является выраженная стенокардия при поражении одной или более коронарных артерий, плохо поддающаяся антиангинальной терапии, а неинвазивные тесты указывают на неблагоприятный прогноз естественного течения болезни. При определении сроков вмешательства следует учитывать профессию и пожелания больного. Стенозы должны быть доступны для катетерной технологии, а окклюзии иметь давность < 3 месяцев. При выраженном поражении основного ствола левой коронарной артерии предпочтительно хирургическое лечение, хотя в ряде случаев возможны ЧТКА и стентирование пораженной артерии. При сравнении результатов медикаментозного лечения и ЧТКА, последняя имеет преимущество по эффективности в ближайшие сроки после процедуры. При длительных сроках наблюдения различия исчезают.
Операция заключается в механическом расширении стенозированного участка КА путем раздувания специального баллончика, введенного в артерию.
С этой целью осуществляют катетеризацию бедренной или плечевой артерии.
178
Катетер с баллончиком на конце проводят ретроградно через аорту в устье стенозированной КА. Когда баллончик оказывается на уровне стеноза, его несколько раз раздувают под давлением в несколько атмосфер и оставляют в надутом состоянии около 20-30 секунд. Обычно в результате механического растяжения просвет артерии увеличивается на50-80%. Во время всей операции осуществляют ангиографический контроль. Смертность при проведении процедуры ангиопластики не превышает0,2-0,6%, острый инфаркт миокарда развивается в 1-2% случаев.
У 3% больных возникает необходимость в экстренной операции аортокоронарного шунтирования. Первичный эффект (достижение желательной дилатации КА) отмечается в 85-90% случаев, однако в течение ближайших 6-12 месяцев после проведения ангиопластики у30-40% больных развиваются рестенозы. Чаще они возникают у пациентов, которые были оперированы в период “обострения” ИБС, у больных с нестабильной стенокардией. Для того чтобы уменьшить количество рестенозов в последние годы все чаще осуществляют так называемое стентирование - имплантацию в КА, подвергшуюся дилатации, специальных проволочных каркасов-стентов.
Непосредственная клиническая эффективность ЧТКА достаточно высока - прекращаются приступы стенокардии, улучшается сократительная функция ЛЖ. Однако до сих пор остается нерешенным вопрос о предотвращении рецидива болезни в результате развития рестеноза, который возникает у 32-40% пациентов в течение 6 месяцев после вмешательства.
Аортокоронарное шунтирование (АКШ)
АКШ с использованием венозных и артериальных трансплантатов получило достаточно широкое распространение. Низкие показатели смертности, высокая клиническая эффективность и увеличение продолжительности жизни больных свидетельствуют о преимуществе КШ перед медикаментозным лечением, особенно при многососудистых поражениях. Операция АКШ заключается в наложении обходных анастомозов между аортой и пораженной КА -дис тальнее места ее сужения. Для создания анастомоза обычно используют трансплантат подкожной вены бедра или левой внутренней грудной артерии. Положительный эффект операции АКШ наблюдается в80-90% случаев, причем бо-
лее чем у половины оперированных больных на время полностью исчезают клинические проявления болезни. Интраоперационная, послеоперационная летальность зависит от квалификации хирургических бригад и в среднем не превышает 1-3%.
Объем реваскуляризации миокарда определяется количеством пораженных артерий, снабжающих кровью жизнеспособный миокард. Каждая ишемизированная зона миокарда должна быть реваскуляризирована. Восстанавливать кровоснабжение в зоне постинфарктного кардиосклероза нецелесообразно. В
179
настоящее время наметилась определенная тенденция к шунтированию максимально возможного числа коронарных артерий с помощью аутоартерий. С этой целью используют внутренние грудные артерии, лучевые артерии, правую же- лудочно-сальниковую и нижнюю надчревную артерии.
Несмотря на вполне удовлетворительные результаты АКШ, у 20-25% больных в течение8-10 лет стенокардия возвращается. Такие пациенты рассматриваются как кандидаты для реоперации. Чаще возврат стенокардии обусловлен прогрессированием коронаросклероза и поражением аутовенозных шунтов, что ведет к стенозу и облитерации их просвета. Этому процессу особенно подвержены шунты у больных с наличием нескольких факторов риска: артериальная гипертония, сахарный диабет, гиперхолестеринемия, курение, ожирение.
Показаниями к АКШ являются: тяжелая инвалидизирующая или изменяющая КЖ стенокардия (III-IV ФК), не поддающаяся максимальной лекарственной терапии; результаты неинвазивных исследований, при которых присутствуют низкая толерантность к ФН и выраженная ишемическая реакция на ЭКГ, при наличии функционально значимых(> 70%) стенозов одной и более коронарных артерий; стеноз основного ствола левой коронарной артери>и 50%. Показания к АКШ определяются только на основании результатов КАГ и вентрикулографии с учетом данных клинического обследования. Шунтированию подлежат магистральные коронарные артерии и их крупные ветви первого порядка. Перенесенный ИМ не является противопоказанием к операции, и при сохраняющейся постинфарктной стенокардии рекомендуется выполнять вмешательство, не дожидаясь 4-6 месяцев, как это принято при благоприятном течении постинфарктного периода.
Для принятия решения об операции важное значение имеют: наличие и тяжесть сопутствующих заболеваний, возраст, социальная активность пациента и его настроенность на хирургическое лечение. Сообщения последних лет об успешном оперативном лечении ИБС у пациентов с почечной недостаточностью, онкологическими заболеваниями, тяжелым СД показали, что в подобных
ситуациях в каждом случае необходимо тщательно сопоставлять возможный риск и ожидаемую эффективность операции.
Преклонный возраст сам по себе не является противопоказанием к операциям, однако пожилые пациенты с комплексом сопутствующих заболеваний подвержены существенно большему риску. Многие социальные и психологические факторы могут стать причиной категорического отказа больных от операции. После АКШ большая летальность регистрируется у лиц старше 70 лет, при поражении ствола ЛКА, а также у больных, оперированных по экстренным показаниям в связи с развитием нестабильной стенокардии. У 4-5% больных в послеоперационном периоде развивается ИМ. При использовании венозных трансплантатов в течение 5 лет окклюзия анастомозов развивается в20% слу-
180
чаев; через 10 лет их количество достигает41%. Применение артериальных трансплантатов обеспечивает сохранение проходимости анастомозов в течение 10 лет у 90% оперированных больных.
При сравнении ЧТКА и АКШ отмечаются идентичные клинические -ре зультаты, однако хирургический метод имеет преимущество у больных СД и у лиц с серьезными нарушениями сердечного ритма. ЧТКА не может быть выполнена в ряде случаев из-за ограничения технических возможностей и анатомических особенностей - протяженные окклюзии артерии, выраженный кальциноз. Дифференцированный подход к назначению того или иного метода лечения позволяет добиться лучших конечных результатов. В целом хирургический метод реваскуляризации миокарда остается наиболее радикальным и эффективным методом лечения больных ИБС. Прогноз у больных стабильной стенокардией напряжения в целом относительно благоприятный. При отсутствии стеноза ствола ЛКА смертность составляет в среднем около3% в год. Количество приступов стенокардии в неделю не коррелирует с прогнозом до тех пор, пока приступы являются кратковременными и возникают только при физической нагрузке.
Значительное нарушение сократительной способности ЛЖ(ФВ < 35%), конечного диастолического давления в ЛЖ(> 25 мм. рт.ст.), при наличии клинически манифестированной СН существенно ухудшают прогноз хирургического лечения, однако в настоящее время не рассматриваются абсолютными противопоказаниями к хирургическому вмешательству. К факторам, ухудшающим прогноз стабильной стенокардии, являются: распространенность коронарного атеросклероза: при однососудистом поражении ежегодная смертность составляет 2-3%, при двухсосудистом - 4-5%, а при трехсосудистом поражении коронарного русла - 7-10%; выраженный (более 70% просвета) стеноз ствола ЛКА (смертность достигает 30-40%); низкая толерантность к физической нагрузке: ежегодная смертность составляет 6-10%, тогда как при высокой толерантности она не превышает1%; снижение систолической функции ЛЖ; возраст больных; наличие сопутствующей АГ и/или сахарного диабета.
Даже при успешной реваскуляризации и исчезновении признаков коронарной недостаточности необходимо постоянное лечение с целью предотвратить прогрессирование атеросклероза и развитие тромбоза. Пациенты после реваскуляризации должны пожизненно соблюдать гиполипидемическую диету, принимать холестерин-снижающие препараты, антиагреганты, беттаблокаторы, ингибиторы АПФ, 2-3 раза в неделю по30-45 минут заниматься физическими тренировками на субмаксимальном уровне (60-80% от максимального).
181
Глава VI ОСОБЫЕ ФОРМЫ
ИШЕМИЧЕСКОЙ БОЛЕЗНИ СНЕРДЦА
6.1. СПОНТАННАЯ (ВАРИАНТНАЯ) СТЕНОКАРДИЯ
ОПРЕДЕЛЕНИЕ
Спонтанная (вариантная, вазоспастическая, Принцметала) стенокардия впервые описана М. Принцметалом в 1959 г. Это особая форма стенокардии покоя, которая возникает внезапно, без действия провоцирующих факторов, характеризующаяся спазмом КА, тяжелым болевым ангинозным приступом и значительным преходящим подъемом сегментаRS-Т на ЭКГ. В основе вариантной стенокардии лежит выраженный спазм КА, ведущий к ее кратковременной динамической окклюзии. Прекращение или резкое уменьшение коронарного кровообращения приводит к глубокой, часто трансмуральной, ишемии миокарда, снижению локальной сократимости ЛЖ, асинергии сокращений и значительной электрической нестабильности миокарда, проявляющейся нарушением ритма и проводимости.
Морфологические изменения венечных сосудов у больных со стабильной стенокардией весьма вариабельны. В одних случаях имеется более или менее выраженный фиксированный стеноз проксимальной КА, обусловленный атеросклеротической бляшкой, суживающей просвет артерии. В других случаях атеросклеротическое сужение крупных КА по данным КАГ может быть минимальным или даже отсутствовать совсем. Спазм КА происходит на уровне мелких интрамуральных венечных сосудов, морфологические изменения которых обычно не фиксируются при КАГ.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления спонтанной(вариантной) стенокардии Принцметала имеют некоторые особенности, отличающие ее от типичной стенокардии напряжения. Интенсивные болевые приступы возникают в покое, чаще ночью во время сна, или в ранние утренние часы (от 4 до 6 ч утра). Болевым приступам обычно не предшествуют какие-либо явные провоцирующие факторы,
втом числе те, которые сопровождаются повышением потребности миокарда
вкислороде (увеличение ЧСС, подъем уровня АД). Боли локализуются за грудиной, иррадиируют в левую руку, плечо, лопатку. Продолжительность боли может быть различной(от 5-10 до 20-30 минут). Нередко на фоне болевого приступа возникает брадикардия. Тахикардия может появиться на высоте при-
ступа или в конце его, но лишь как следствие рефлекторной активации САС в ответ на боль, пробуждение или прием нитроглицерина.
182
Боли могут сопровождаться одышкой, слабостью, потливостью, головокружением, что указывает на снижение сократимости ЛЖ и выраженные вегетативные расстройства. Прием нитроглицерина не всегда купирует боль и облегчает состояние больного. Хороший эффект получают от применения блокаторов медленных кальциевых каналов группы нифедипина. Другими частыми проявлениями вариантной стенокардии являются нарушения ритма и проводимости, возникающие во время ангинозного приступа и обусловленные выраженной электрической нестабильностью ишемизированной сердечной мышцы
изамедлением проводимости.
Убольного во время приступа вариантной стенокардии могут развиться преходящие внутрижелудочковые и атриовентрикулярные блокады, частая же-
лудочковая экстрасистолия высоких градаций, пароксизмальная тахикардия или даже фибрилляция желудочков. Внезапное формирование АВ-блокадыII или III степени, остановка синусового узла могут сопровождаться синкопальными состояниями.
Есть два клинических варианта течения ИБС у больных со стенокардией Принцметала. У половины больных с наличием фиксированного стеноза КА ночные приступы спонтанной стенокардии сочетаются с типичной стенокардией напряжения, обусловленной фиксированным стенозом КА и повышением потребности миокарда в кислороде. В этих случаях приступы стенокардии напряжения возникают в дневные часы и обычно провоцируются физической нагрузкой, психоэмоциональным напряжением, подъемом АД, тогда как приступы вариантной стенокардии, обусловленные спазмом КА, возникают спонтанно ночью или под утро. Толерантность к физической нагрузке у таких больных может быть существенно снижена из-за наличия стеноза КА.
Пристального внимания заслуживают случаи, когда у больного, страдающего стенокардией напряжения, впервые появляются описанные приступы спонтанной стенокардии, что обычно указывает на обострение ИБС, вызванное формированием осложненной атеросклеротической бляшки(нестабильная стенокардия).
У лиц молодого возраста, отсутствует гемодинамически значимое сужение КА, поэтому спонтанная вазоспастическая стенокардия может быть единственным клиническим проявлением ИБС, а стенокардия напряжения отсутствует. Характерна сравнительно хорошая переносимость физических нагрузок.
Физикальные данные у больных вазоспастической стенокардией могут быть самыми разнообразными. Нередко они напоминают таковые при стабильной стенокардии напряжения. Прогноз при спонтанной стенокардии определяется степенью выраженности коронарного стеноза(Rovai D. et al., 1997). У этих больных несколько чаще развиваются инфаркт миокарда, аритмии и внезапная смерть (Mayer S., Hillis L.D., 1998), особенно при учащении приступов (Малая Л.Т., Бабаджан В.Д., 2005). При лечении прогноз благоприятный.
183
ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Электрокардиография
Типичным ЭКГ-признаком спонтанной стенокардии является подъем сегмента RS-Т выше изолинии, свидетельствующий о наличии выраженной трансмуральной ишемии миокарда, обусловленной преходящей динамической окклюзией КА. В редких случаях наблюдается ишемическая депрессия сегмен-
та RS-Т ниже изолинии, что указывает на возникновение субэндокардиальной ишемии, обусловленной неполным перекрытием крупной КА или спазмом более мелких интрамуральных венечных сосудов(мелких артерий и артериол) при развитии коллатералей. После купирования приступа вазоспатической стенокардии сегмент RS-Т возвращается к изоэлектрической линии.
Приводим собственное наблюдение. Больной Т., 36 лет доставлен в городской кардиологический центр Самары с диагнозом ИМ. В отделении интенсивной терапии и реанимации на фоне проведения тромболитической терапии, инфузии нитратов, введения β-адреноблокаторов ангинозные боли длительностью до 30 минуту рецидивировали 4 раза.
Рисунок 12. ЭКГ больного Т., 46 лет. Диагноз: ИБС. Вариантная стенокардия (М.А. Качковский)
На ЭКГ во время каждого приступа отмечался подъем сегментаST в отведениях V1-V6, достигающий 9 мм (рисунок 12). После приступа ЭКГ приходила к норме. Кардиоспецифические ферменты в сыворотке крови не повышались. Диагностирована вариантная стенокардия. Проведение терапии антагонистами кальция дало быстрый эффект и прекратило рецидивы ангинозной боли.
Суточное мониторирование ЭКГ по Холтеру
Важное значение в диагностике вазоспастической стенокардии Принцметала имеет холтеровское длительное ЭКГ-мониторирование. На ЭКГ во время приступов стенокардии наблюдается внезапный подъем сегментаRS-T выше изолинии (трансмуральная ишемия). Эти изменения сегмента RS-T, так же как и приступы стенокардии, развиваются в покое, чаще ночью, и не сопровождаются увеличением ЧСС более чем на5 ударов в минуту. Это принципиально отличает вазоспастическую стенокардию от приступов стенокардии напряжения, обусловленных повышением потребности миокарда в кислороде. Приступ вазоспастической стенокардии и ЭКГ-признаки ишемии миокарда могут исчезнуть, несмотря на увеличение ЧСС, обусловленное рефлекторной реакцией на боль, пробуждение и/или прием нитроглицерина (феномен “прохождения через боль”). Непрерывная запись ЭКГ позволяет выявить еще один важный отличительный признак: смещение сегмента RS-T в начале приступа происходит очень быстро, скачкообразно и так же быстро исчезает после окончания спастической реакции.
184
Функциональные нагрузочные тесты
У значительного числа больных пробы с дозированной физической - на грузкой оказываются отрицательными. Это связано с отсутствием гемодинамически значимого органического сужения просвета венечных сосудов, а также с тем, что физическая нагрузка и увеличение ЧСС достаточно редко могут спровоцировать приступ вариантной стенокардии, сопровождающейся выраженным спазмом КА. Только у больных на высоте нагрузки удается спровоцировать приступ вазоспастической стенокардии и/или подъем сегментаRS-Т. Характерным является постоянное колебание толерантности к физической нагрузке, быстрое изменение степени коронарного резерва. Такие изменения обусловлены меняющимся тонусом КА, степенью динамической обструкции просвета сосуда.
Функциональные пробы
Холодовая проба. Руку пациента до середины предплечья помещают на 3- 5 мин в воду, охлажденную до температуры+ 4°С. ЭКГ регистрируют в течение 10 мин после окончания холодового воздействия. Проба отличается низкой чувствительностью, поскольку ишемические изменения сегментаRS-Т выявляются примерно у 15-20% больных вазоспастической стенокардией.
Пробу с эргометрином считают наиболее адекватной для выявления -ва зоспастических реакций у больных ИБС, у которых во время коронароангиографии не обнаруживается стенозирование КА. Проба с эргометрином опасна развитием тяжелых осложнений(ИМ, внезапная смерть, желудочковые аритмии), поэтому она используется в диагностике ИБС в условиях специализированных научно-исследовательских учреждений.
ЛЕЧЕНИЕ
Основой медикаментозной терапии являются блокаторы медленных кальциевых каналов. Эффективными могут оказаться любые препараты группы верапамила, нифедипина или дилтиазема, в том числе их сочетание. Предпочтительно использовать антагонисты кальция пролонгированного действия(ретардные формы). Приступы ночной стенокардии покоя обычно купируются приемом нитроглицерина. В этих случаях нитроглицерин выступает как артериолярный вазодилататор, устраняющий спазм КА. Для профилактики приступов вазоспастической стенокардии Принцметала используют нитраты пролонгированного действия. В большинстве случаев необходимо предусмотреть прием нитратов в вечернее время, а не утром и днем, как при стабильной стенокардии напряжения. Возможна комбинация ретардных форм нитратов с одним или даже двумя блокаторами медленных кальциевых каналов: нитраты + нифедипин + верапамил или нитраты + нифедипин + дилтиазем.
185
Иногда |
целесообразно |
применение |
блокаторовa-адренорецепторов. |
В отличие |
от больных стабильной стенокардией напряжения, у пациентов |
||
с вазоспастической стенокардией применение b-адреноблокаторов может резко ухудшить состояние. Для профилактики ОКС у данной категории больных целесообразно использовать курантил, обладающий не только мощным антитромбоцитарным эффектом, но и выраженными вазодилатационными свойствами. Препарат принимают в дозе 225 мг в сутки. Хирургическое лечение больных со стенокардией Принцметала неэффективно. Склонные к спазму КА очень чувствительны к различным механическим манипуляциям. Поэтому у таких пациентов любое оперативное вмешательство может привести к развитию ИМ и жизнеопасных желудочковых аритмий.
Прогноз определяется двумя основными факторами: степенью фиксированной коронарной обструкции; наличием или отсутствием осложненной атеросклеротической бляшки в КА, ведущей к дестабилизации ИБС и повышению риска развития ИМ и внезапной сердечной смерти. Если у больного имеют место тяжелые, длительные или впервые возникшие и повторяющиеся приступы стенокардии Принцметала, которые могут быть отнесены к нестабильной стенокардии, прогноз достаточно серьезен: у 20-25% больных в течение 3-х месяцев развивается ИМ или наступает внезапная сердечная смерть. При стабильном характере вариантной стенокардии редкие и легко купирующиеся болевые приступы под влиянием лечения прекращаются, иногда на многие годы, и прогноз определяется степенью коронарной обструкции и числом пораженных КА. Семилетняя выживаемость больных - 97%.
6.2. БЕЗБОЛЕВАЯ ИШЕМИЯ МИОКАРДА
ОПРЕДЕЛЕНИЕ
Безболевая ишемия миокарда (БИМ) - это эпизоды транзиторной кратковременной ишемии сердечной мышцы, объективно выявляемые с помощью некоторых инструментальных методов исследования, но не сопровождающиеся приступами стенокардии или ее эквивалентами. Феномен БИМ обнаруживается не менее чем у 2/3 больных ИБС со стабильной и нестабильной стенокардией и у 1/3 больных с постинфарктным кардиосклерозом. В большинстве случаев
у одного и того же больного наблюдается сочетание как безболевой ишемии миокарда, так и болевых ангинозных приступов (стенокардии).
Причем, лишь небольшая часть эпизодов преходящей ишемии сопровождаются приступами стенокардии (не более чем 20-25% от общего числа эпизодов ишемии), тогда как на долю БИМ приходится около75-80%. У некоторых пациентов, страдающих ИБС, в течение длительного времени заболевание может протекатт бессимптомно, приступы стенокардии отсутствуют. Эпизоды безболевой ишемии миокарда являются единственным проявлением заболева-
186
ния. БИМ относится к числу не менее распространенных, чем стенокардия, проявлений коронарной недостаточности.
ПАТОГЕНЕЗ
Механизмы возникновения недостаточности коронарного кровообращения во время доказанных эпизодов БИМ аналогичны таковым у больных со стабильной или вазоспастической стенокардией: повышение потребности миокарда в кислороде, сопровождающее любое увеличение ЧСС, подъем АД, физическую нагрузку; динамический стеноз (спазм) коронарной артерии; повы-
шение агрегации тромбоцитов с образованием нестойких микроагрегатов и пристеночных тромбов (нестабильная стенокардия).
Причины отсутствия болевого синдрома во время преходящей ишемии миокарда до сих пор не совсем ясны. У больных с эпизодами БИМ, вероятнее всего, имеет значение повышенное содержание опиоидных субстанций, снижение чувствительности болевых рецепторов (ноцицепторов) и повышение порога болевой чувствительности. В основе болевого синдрома при стенокардии лежит возникновение преходящей кратковременной ишемии миокарда, вызванной аб-
солютным или относительным уменьшением коронарного кровообращения и/или увеличением потребности миокарда в кислороде. В очаге ишемии происходит высвобождение химических субстанций, обладающих свойствами медиаторов боли. Главными из них являются серотонин, гистамин, брадикинин, источником которых служат тромбоциты, базофильные лейкоциты и тучные клетки.
Если медиаторы боли выделяются в достаточном количестве, происходит возбуждение специфических болевых рецепторовноцицепторов. Причем их чувствительность во многом зависит от концентрации в окружающей рецепторы среде ионов К+ и Н+, а также от содержания простагландинов, образующихся в процессе активированного усиления метаболизма арахидоновой кислоты. Считают, что простагландины являются своеобразными модуляторами освобождения и функционирования медиаторов боли в ноцицепторах. Из очага ишемии болевые импульсы переносятся по афферентным волокнам сердечных нервов к паравертебральной цепочке шейных и грудных ганглиев. Затем перено-
сятся по спиноталамическому тракту спинног к заднебоковым, передним ядрам таламуса и к коре головного мозга, где формируется болевое ощущение.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления ИБС у лиц с доказанными эпизодами БИМ мало отличаются от выявляемых у пациентов со стабильной стенокардией напряжения. Преобладание БИМ прогностически является весьма неблагоприятным фактором у больных со всеми формами ИБС. Увеличение частоты эпизодов
БИМ и их суммарной продолжительности ассоциируется с более высоким
187
функциональным классом стенокардии, с более частым многососудистым поражением коронарного русла, с нарушениями ритма сердца, а также с наличием ряда ФР атеросклероза(АГ, ГЛП, сахарный диабет, курение). У пациентов с доказанными эпизодами БИМ при клиническом обследовании несколько чаще можно выявить признаки: застойной СН; дилатации и гипертрофии ЛЖ; повышение АД; нарушения ритма и проводимости; лабораторные и клинические признаки ГЛП (повышение содержания общего холестерина, ХС ЛНП, триглицеридов) и нарушений углеводного обмена; сахарный диабет II типа; рентгенологические признаки расширения и уплотнения стенки аорты; ЭхоКГ-признаки диастолической и систолической дисфункции ЛЖ, а также увеличения массы миокарда ЛЖ.
Современными инструментальными методами неинвазивной диагностики, позволяющими доказать наличие у больных ИБС эпизодов БИМ, являются: 1. Суточное мониторирование ЭКГ по Холтеру. 2. Функциональные нагрузочные тесты (тредмил, велоэргометрия, добутаминовый тест). 3. Стресс- эхокардиография. 4. Нагрузочная сцинтиграфия миокарда с 201Тl. Чувствительность и специфичность каждого из этих методов в выявлении БИМ не одинакова (таблица 27).
Таблица 27. Чувствительность, специфичность диагностики БИМ
Методы |
Чувствительность, % |
Специфичность, % |
||
Нагрузочные тесты |
|
62 |
75 |
|
Холтеровское |
мониториро- |
|
75 |
80 |
вание ЭКГ |
|
|
|
|
Стресс-эхокардиография |
|
85 |
80 |
|
Сцинтиграфия |
миокарда |
с |
90 |
85 |
201Тl |
|
|
|
|
Суточное мониторирование ЭКГ по Холтеру позволяет оценить изменения электрической активности миокарда в повседневной жизни на протяжении длительного времени. Критерием БИМ считается горизонтальное или косонисходящее смещение сегмента RS-Т ниже изоэлектрической линии более чем на 1 мм на протяжении 80 мс от точки соединения (J), которое не сопровождается появлением болевого приступа.
В этих случаях можно думать о наличии преходящей безболевой субэндокардиальной ишемии миокарда, индуцированной физической нагрузкой, стрессом, обильным приемом пищи, курением и другими факторами, повышающими потребность миокарда в кислороде и способствующими активации САС. Подъем RS-Т рассматривается как результат трансмуральной безболевой ишемии миокарда, чаще возникающей в результате динамической окклюзии проксимальной КА, обусловленной ее спазмом. Большая часть эпизодов БИМ возникает в 6 - 9 часов, в 10% случаев - в ночное время. Чувствительность вы-
188
явления БИМ с помощью холтеровского мониторирования ЭКГ достигает75%, специфичность - 85%.
Учитывают количество, общую продолжительность зарегистрированных эпизодов ишемии, соотношение числа болевых и безболевых эпизодов ишемии, число аритмий, возникающих в течение суток, суточные колебания ЧСС. Следует обращать внимание на наличие пароксизмов бессимптомной ишемии миокарда, потому что у некоторых больных, прошедших курс лечения, наблюдается уменьшение или даже исчезновение приступов стенокардии. Однко сохраняются признаки безболевой ишемии сердечной мышцы. Повторные исследования с помощью холтеровского мониторирования ЭКГ особенно целесообразны при назначении и подборе дозы блокаторов β-адренорецепторов, влияющихна ЧСС и проводимость, поскольку индивидуальную реакцию на эти препараты трудно предсказать и не всегда легко выявить с помощью традиционного клинического и электрокардиографического методов исследования.
Функциональные нагрузочные пробы. Используют в диагностике болевой и безболевой ишемии миокарда. В диагностике БИМ используют те же критерии ишемии миокарда, что и при холтеровском мониторировании(депрессия или подъем сегмента RS-Т на 1,0 мм и больше на протяжении80 мс от точки соединения - J). Чувствительность метода составляет62%, специфичность - 80%. Стресс-эхокардиография. У большинства больных ИБС с эпизодами БИМ на высоте функционального нагрузочного теста удается выявить локальные нарушения сократимости ЛЖ, чаще в виде гипокинезии миокарда. Методика стресс-эхокардиографии позволяет также оценить изменения глобальной систолической функции ЛЖ, возникающие во время нагрузочного теста. Уменьшение ФВ на высоте нагрузки является важным диагностическим признаком, указывающим на возникновение ишемии миокарда.
201
Нагрузочная сцинтиграфия миокарда с Тl. Является наиболее точным неинвазивным методом диагностики преходящих нарушений коронарного кровообращения. Методика проведения исследования ничем не отличается от -та ковой у больных стабильной стенокардией напряжения. При возникновении БИМ на фоне физической нагрузки или во время проведения дипиридамолово-
201
го теста на сцинтиграммах выявляются локальные дефекты накопления Тl. Чувствительность метода - 90%, специфичность - 85%. Для полной оценки состояния коронарного кровообращения у больных с БИМ целесообразно использовать комплекс описанных неинвазивных методов исследования. Каждый из этих методов, помимо объективного установления факта болевой или безболевой ишемии миокарда, дает возможность описать некоторые индивидульные особенности возникновения ишемии миокарда.
Велоэргометрия, тредмил-тест позволяют получить дополнительную информацию о толерантности к физической нагрузке, величине коронарного резерва и косвенно о степени стеноза КА. Длительное мониторирование ЭКГ по
189
Холтеру дает возможность оценить суммарную продолжительность ишемии миокарда, соотношение болевых и безболевых эпизодов ишемии. Холтеровское мониторирование ЭКГ позволяет зарегистрировать эпизоды БИМ, возникаю-
щие в покое, |
нередко |
обусловленные |
выраженным |
преходящим спазмом |
||
КА (кратковременный |
подъем |
сегментаRS-Т). С помощью |
стресс-ЭхоКГ |
|||
и нагрузочной |
сцинтиграфии |
миокарда |
201 |
описать |
локализацию |
|
с Тl удается |
||||||
и распространенность ишемического повреждения миокарда.
ЛЕЧЕНИЕ
Весь комплекс немедикаментозного и медикаментозного лечения, включая применение антиагрегантов, антиангинальных средств, цитопротекторов, коррекцию ФР ИБС. В клинических практике лечение больных БИМ осуществить гораздо сложнее, поскольку отсутствует основной критерий эффектауменьшение приступов стенокардии. Это существенно повышает роль дополнительных методов диагностики(нагрузочных тестов, холтеровского мониторирования ЭКГ) в осуществлении контроля за эффектом лечения. У 1/3 больных с БИМ в дальнейшем развивается типичная стенокардия, ИМ или наступает внезапная смерть. Наличие безболевой ишемии миокарда повышает риск внезапной смерти в 5-6 раз, аритмий - в 2 раза, развитие ИМ и ХСН - в 1,5 раза по сравнению с риском у больных стабильной стенокардией напряжения. Летальность этих больных достигает 2,7 - 9% в год.
6.3. КАРДИАЛЬНЫЙ СИНДРОМ Х
ОПРЕДЕЛЕНИЕ
Кардиальный синдром Х - это особая форма ИБС, которая встречается в 10-15% случаев и характеризуется отсутствием типичных атеросклеротических изменений крупных (эпикардиальных) КА, наличием функциональных и морфологических расстройств дистальных венечных артерий.
ПАТОГЕНЕЗ
При микроваскулярной стенокардии основные морфологические и функциональные изменения происходят на уровне преартериол, поэтому эти изменения не выявляются при коронароангиографии. Морфологические изменения преартериол характеризуются значительным сужением их просвета за счет гипертрофии и гиперплазии гладкомышечных клеток, а также выраженного фиброза медии. В результате в коронарном русле повышается сосудистое сопротивление и нарушается кровоток. Преартериолы теряют способность расширяться в ответ на увеличение потребности миокарда в кислороде. Характерна значительная неравномерность описанных морфологических изменений в преартериолах различных участков сердечной мышцы. Возникновению описанной дисфункции микроциркуляторного сосудистого русла способствует повышение агрегации тромбоцитов, ухудшаютсяч реологические свойства крови. Данный
190
симптомокомплекс в настоящее время принято расценивать как одну из форм ИБС.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Микроваскулярная стенокардия чаще развивается у женщин в пременопаузальном периоде. Развивается атипичный болевой синдром, отличающийся от типичных приступов стенокардии напряжения. Боль провоцируется эмоциональным напряжением, тогда как толерантность к физической нагрузке остается высокой. Боли развиваются в покое и продолжаются больше20-30 минут.
Нитроглицерин не всегда полностью купирует приступы микроваскулярной стенокардии. Нередко болевой синдром сочетается с признаками тревожномнительного состояния, эмоциональной лабильностью, раздражительностью.
Электрокардиография
На ЭКГ покоя могут определяться неспецифические изменения зубца ,Т небольшая депрессия сегмента RS-T, не превышающая 0,5-1 мм. При регистрации суточной ЭКГ по Холтеру определяются эпизоды болевой и безболевой ишемии миокарда в виде диагностически значимой депрессии сегментаRS-Т. Тесты с физической нагрузкой положительны не более чем в20% случаев. Толерантность к физической нагрузке существенно ,вышечем у больных со стенокардией напряжения. Тесты с предсердной стимуляцией (ЧПЭС) по некоторым данным положительны более чем 2/3у больных микроваскулярной стенокардией. Возникновение ишемии миокарда в половине случаев сопровождается увеличением содержания лактата в крови, взятой из коронарного синуса во время катетеризации сердца. Это подтверждает наличие ишемического очага в сердечной мышце.
Фармакологические нагрузочные тесты
Дипиридамоловая проба, проба с эргометрином в большинстве случаев бывают положительными. Положительные результаты дипиридамолового теста свидетельствуют о возникновении синдрома межкоронарного“обкрадывания”, а пробы с эргометрином- о склонности коронарных сосудов к спастическим реакциям. В отличие от вазоспастической стенокардии Принцметала, при которой введение эргометрина вызывает спазм крупной КА и подъем сегментаRS-
Т, при микроваскулярной стенокардии эргометрин вызывает депрессию -сег мента RS-Т, свидетельствуя о возникновении субэндокардиальной ишемии миокарда. В неясных случаях преходящая ишемия миокарда может быть подтверждена при проведении нагрузочной сцинтиграфии миокарда с 201Тl.
Коронароангиография
Главной находкой, выявляемой при селективной КАГ, является отсутствие атеросклеротического сужения проксимальных(эпикардиальных) КА. По-
191
ложительные результаты тестов с физической нагрузкой, дипиридамолом и эргометрином, а также нагрузочной сцинтиграфии миокарда с 201Тl позволяют достоверно подтвердить диагноз микроваскулярной стенокардии только тогда,
когда при проведении КАГ не обнаруживают типичных атеросклеротических изменений крупных КА.
ЛЕЧЕНИЕ
Лечение не отличается от терапии других форм ИБС стабильного течения. Должны быть предусмотрены коррекция ФР ИБС, применение антитромбоцитарных ЛС, нитратов, β-адреноблокаторов, блокаторов медленных каль-
циевых каналов, цитопротекторов, при |
необходимости ингибиторов АПФ |
и статинов. Особое значение в лечении |
приобретает терапия антиагрегантами |
(аспирин, клопидогрель) и цитопротекторами (триметазидин). Требуется контроль уровня АД и коррекция нарушений углеводного и липидного обмена. Прогноз при микроваскулярной стенокардии в целом весьма благоприятный.
Семилетняя выживаемость составляет96%. Заболевание редко приводит к инвалидизации.
192
Глава VII НЕСТАБИЛЬНАЯ СТЕНОКАРДИЯ
7.1. ЭТИОЛОГИЯ
Ишемическая болезнь сердца в большинстве случаев протекает с периодами стабильного течения заболевания и обострения. Периоды стабильного течения характеризуются постепенным увеличением размеров атеросклеротических бляшек, суживающих просвет КА, медленным прогрессированием фиброза сердечной мышцы и компенсаторной гипертрофии кардиомиоцитов. Клинически в этот период наблюдается стабильная стенокардия напряжения или другие формы транзиторной болевой или безболевой ишемии миокарда, а в части случаев - медленное прогрессирование сердечной недостаточности и нарушений сердечного ритма и проводимости.
Периоды обострения ИБС характеризуются сравнительно быстрым формированием так называемой “осложненной” атеросклеротической бляшки с нарушением целостности ее фиброзной оболочки(разрывы, эрозии) и образованием на месте повреждений пристеночного или окклюзирующего просвет сосуда тромба. В зависимости от скорости формирования и размеров тромба, продолжительности его существования в просвете сосуда, степени ограничения коронарного кровотока, выраженности коллатерального кровотока и других факторов клинически обострение ИБС проявляется: нестабильной стенокардией, развитием ИМ без зубца Q, развитием ИМ с зубцом Q или внезапной сердечной смертью.
При нестабильной стенокардии (НС) в КА формируется пристеночный тромбоцитарный (“белый”) тромб, который спонтанно или под влиянием лечения подвергается тромболизису. Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время(до 1 часа), развивается нетрансмуральный ИМ без зубца Q.
Если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q. В основе всех клинических проявлений обострения ИБС(НС, ИМ, внезапной смерти) лежит единый патофизиологический механизм острого нарушения коронарного кровообращения, а именно: тромбоз КА, развивающийся на фоне осложненной атеросклеротической бляшки с надрывами и изъязвлениями ее фиброзной оболочки, выпадением содержимого липидного ядра в просвет сосуда и/или повреждением эндотелия. В связи с этим в последние го-
ды принято объединять различные клинические проявления обострения ИБС понятием “острый коронарный синдром”.
193
7.2. ПАТОГЕНЕЗ
Образование тромба в области разрыва или эрозии атеросклеротической бляшки является решающим событием в общей последовательности формирования ОКС. Процесс образования тромба претерпевает несколько стадий. Обнажение субэндокардиальных структур в области атеросклеротической бляшки (коллагена, фактора Виллебранда, фибронектина, ламинина) способствует усиленной адгезии и агрегации тромбоцитов с образованием на поверхности -по врежденной эрозированной атеросклеротической бляшки“белого” тромбоцитарного тромба.
Основными факторами, определяющими процесс агрегации кровяных пластинок являются: тромбоксан А2 (активация метаболизма арахидоновой кислоты в тромбоцитах); тромбин; АДФ; серотонин; гликопротеиновые Iа, Ib рецепторы тромбоцитов, обеспечивающие адгезию и первоначальную агрегацию кровяных пластинок; гликопротеиновые IIb/IIIа рецепторы тромбоцитов, взаимодействие которых с фибриногеном на заключительном этапе агрегации тромбоцитов приводит к формированию относительно плотного тромбоцитарного тромба.
Коагуляционный гемостаз обеспечивает плотную закупорку поврежденных сосудов так называемым“красным” тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (таблица 28).
Таблица 28. Факторы свертывания крови (ФС)
ФС |
|
Название |
|
Свойства |
|
I |
Фибриноген |
|
|
Белок |
|
II |
Протромбин |
|
|
α1-глобулин |
|
III |
Тканевой тромбопластин |
|
|
Фосфолипопротеиды |
|
IV |
Ионы Са2+ |
|
|
|
|
V |
Проакцелерин |
|
|
β-глобулин |
|
VII |
Проконвертин |
|
|
α-глобулин |
|
VIII |
Антигемофильный |
глобулин |
(АГГА) |
β2-глобулин |
|
|
в комплексе с фактором Виллебранда |
|
|
||
IX |
Фактор |
Кристмаса |
|
|
α1-глобулин |
Х |
Фактор |
Стюарта-Прауэра |
|
|
α1-глобулин |
ХI |
Плазменный предшественник тромбопластина |
γ-глобулин |
|||
|
(ППТ) |
|
|
|
|
ХII |
Фактор Хагемана |
|
|
β-глобулин |
|
ХIII |
Фибринстабилизирующий фактор |
|
β-глобулин |
||
|
Прекалликреин (ПК), фактор Флетчера |
|
β-глобулин |
||
|
Высокомолекулярный кининоген (ВМК), фак- |
α1-глобулин |
|||
|
тор Фитцжеральда |
|
|
|
|
194
Процесс свертывания крови, протекающий с участием специфических факторов свертывания, разделяют на две основные фазы: 1. Фаза активации - многоступенчатый этап свертывания, завершающийся активизацией протромбина (фактор II) с превращением его в активный фермент тромбин(фактор IIа). 2. Фаза коагуляции - конечный этап свертывания, в результате которого под влиянием тромбина фибриноген (фактор I) превращается в фибрин.
Центральным звеном сложных химических превращений фаза активации является образование “активатора протромбина”, который представляет собой ферментный комплекс, состоящий из активизированных факторов свертывания Ха, Va, ионов Са2+ и фосфолипопротеинов. Источником могут быть: фосфолипопротеины, высвобождающиеся при повреждении тканей эндотелия сосудов или соединительной ткани (тканевой тромбопластин - фактор III); фосфолипопротеины мембран тромбоцитов, выходящие в плазму при их разрушении (тромбоцитарный фактор 3). Формирование ключевого ферментного комплекса этой фазы - “активатора протромбина” - происходит двумя путями, в соответствие с которыми различают две системы свертывания.
В течение фазы коагуляции происходит образование фибрина из его предшественника фибриногена. Процесс этот протекает в два этапа. На первом из них фибриноген расщепляется тромбином на четыре растворимых мономера фибрина (по два пептида А и В), у каждого из которых имеется по 4 свободные связи. На втором этапе мономеры соединяются друг с другом, формируя полимеры, из которых строятся волокна фибрина. Процесс необратимой полимеризации фибрина происходит с участием фибриностабилизирующего фактора XIII
в присутствии ионов Са2+.
На этой стадии трехмерная сеть волокон фибрина, которая содержит эритроциты, тромбоциты и другие клетки крови, все еще относительно рыхлая. Свою окончательную форму она принимает после ретракции сгустка, возникающей при активном сокращении волокон фибрина и выдавливании сыворотки. Благодаря ретракции сгустка он становится более плотным и стягивает края раны. Нередко в клинической практике наблюдаются исключения из этого правила. У 1/4 больных нетрансмуральным ИМ без зубцаQ при ангиографии выявляется полная окклюзия КА, а перфузия миокарда, относящегося к бассейну окклюзированной КА, осуществляется через хорошо развитые коллатерали. Пристеночный тромбоз, формирование которого сопровождается выраженным и длительным спазмом КА, может привести к развитию трансмурального ИМ с зубцом Q, если коллатеpали не выражены
7.3. КЛИНИЧЕСКАЯ КАРТИНА
Термин “нестабильная стенокардия” (НС) используется для обозначения наиболее тяжелого периода течения ИБС, для которого специфично быстрое прогрессирование коронарной недостаточности, высокий риск ИМ, внезапной
195
сердечной смерти (15-20% в течение 1 года). Выделение этой формы ИБС имеет большое практическое значение, потому что нацеливает врача на раннюю диагностику и интенсивное лечение больных с высоким риском фатальных осложнений.
К нестабильной стенокардии относят клинические формы: 1. Впервые возникшая стенокардия нестабильного течения(в течение 1 мес после возникновения первого приступа стенокардии). 2. Прогрессирующая стенокардия напряжения (внезапное увеличение частоты, тяжести, продолжительности приступов стенокардии напряжения в ответ на обычную для данного больного физическую нагрузку, снижение эффективности нитроглицерина и других лекарственных средств, ранее с успехом применявшихся пациентом). 3. Тяжелые и продолжительные приступы стенокардии покоя (более 15-20 мин), в том числе тяжелые случаи спонтанной(вариантной) стенокардии. 4. Ранняя постинфарктная и послеоперационная (после аортокоронарного шунтирования, транс-
люминальной ангиопластики) стенокардия. К НС могут быть отнесены
идругие формы ИБС: БИМ и микроваскулярная форма стенокардии, тяжелые
ипродолжительные приступы вазоспастической стенокардии Принцметала.
КНС относятся несколько клинических форм ИБС, каждая из которых отличается существенными клиническими особенностями. Примерно у2/3 больных НС наблюдаются затяжные приступы стенокардии покоя. На долю прогрессирующей стенокардии напряжения и впервые возникшей стенокардии приходится оставшаяся 1/3 случаев.
Впервые возникшая стенокардия
Впервые возникшая стенокардия (ВВС) диагностируется в тех случаях, когда приступы стенокардии напряжения и/или покоя впервые появились у пациента не более 1 месяца назад. Поначалу приступы могут напоминать боли при стабильной стенокардии напряжения. В типичных случаях приступы болей возникают на фоне физической или психоэмоциональной нагрузки, особенно в холодную и ветреную погоду, локализуются за грудиной, иррадиируют в левую руку, лопатку, плечо. Длительность боли не превышает1-5 мин. Боль
купируется нитроглицерином и/или прекращением действия провоцирующих факторов.
Приступы ангинозных болей повторяются все чаще, становятся более ин-
тенсивными |
и продолжительными. На протяжении 1-4 недель они приводят |
к снижению |
толерантности к физической нагрузке. Иногда боли появляются |
в покое и сопровождаются чувством нехватки воздуха, резкой слабостью, потливостью, головокружением. Каждый такой ангинозный приступ у больных с описанным нестабильным течением ВВС может закончиться развитием ИМ или даже внезапной смертью.
196
ВВС не является синонимом НС и не всегда может быть связана с осложненной атеросклеротической бляшкой. В этих случаях ВВС характеризуется более “спокойным” стабильным течением: приступы стенокардии, хотя и рецидивируют, но провоцируются обычно значительным физическим или психоэмоциональным напряжением, толерантность больных длительное время не снижается. С самого начала имеет место медленно формирующийся стеноз КА, который на определенном этапе становится лишь гемодинамически значимым и проявляется впервые возникшей стенокардией напряжения, которая сразу носит стабильный характер. Через 1-1,5 месяца от начала заболевания такое течение ИБС расценивается как стабильная стенокардия напряжения.
Характер дальнейшего течения ВВС у пациента с недавно появившимися ангинозными приступами предсказать очень трудно. Поэтому каждый такой случай требует от врача самого пристального внимания к развитию всех симптомов болезни. Каждый больной с ВВС должен наблюдаться в кардиологическом стационаре, где ему может быть оказана своевременная медицинская помощь и проведено соответствующее. Рассматривая особенности болевого синдрома при ВВС следует иметь в виду сравнительно высокую частоту возникновения у лиц молодого возраста атипичной стенокардии.
Боли в области сердца могут иметь значительную продолжительность, нередко локализуются не за грудиной, а в области верхушки сердца, слева от грудины или в эпигастрии, часто провоцируются не физической нагрузкой, а возникают как бы спонтанно. Это подчеркивает значение динамической окклюзии коронарной артерии, обусловленной ее спазмом.
Прогрессирующая стенокардия напряжения
Прогрессирующая стенокардия напряжения(ПС) всегда расценивается как НС. Она возникает у больных с более или менее длительным анамнезом стабильной стенокардии напряжения, свидетельствуя об “обострении” заболевания. В диагностике ПС ориентируются на изменившийся характер болевого синдрома: 1. У больных происходит значительное учащение и увеличение длительности и интенсивности приступов стенокардии напряжения. 2. Болевые приступы провоцируются все меньшей физической или психоэмоциональной нагрузкой, свидетельствуя об изменении функционального класса стенокардии (III ФК). 3. К стенокардии напряжения присоединяются приступы стенокардии покоя (IV ФК). 4. Заметно снижается эффективность нитроглицерина и других антиангинальных препаратов, ранее использовавшихся больными для купирования или профилактики стенокардии.
Стенокардия покоя
Тяжелые и продолжительные приступы стенокардии покоя представляют собой один из наиболее опасных в прогностическом отношении клинических вариантов НС. По некоторым данным, частота развития ИМ в течение1-2 ме-
197
сяцев от момента возникновения первых таких ангинозных приступов достигает 40-50%, а летальность - 11-15%. По сути эта форма может выявляться как у больных с прогрессирующей стенокардией напряжения(в тех случаях, когда к стенокардии напряжения присоединяются приступы стенокардии покоя), так и у пациентов с ВВС и стенокардией Принцметала. Возможно также внезапное появление подобных болевых приступов на фоне относительно стабильного те-
чения |
заболевания. |
Эта |
форма |
НС |
клинически |
проявляется |
повторными |
||
и тяжелыми приступами |
стенокардии |
покоя |
продолжительностью |
более15- |
|||||
20 минут. |
|
|
|
|
|
|
|
|
|
|
Интенсивная загрудинная боль нередко сопровождается остро наступаю- |
||||||||
щей |
слабостью, потливостью, |
одышкой, преходящими |
нарушениями |
ритма |
|||||
и проводимости и/или внезапным снижением АД. Боль появляется в покое, без |
|||||||||
предшествующих |
нагрузок, |
и |
становится |
все |
более |
рефрактерной |
|||
к нитроглицерину. Для ее купирования нередко требуется применение нарко- |
|||||||||
тических анальгетиков. Толерантность |
к физической нагрузке резко падает. |
||||||||
Тяжелые и частые приступы спонтанной(вариантной) стенокардии Принцметала также относятся к прогностически весьма неблагоприятной форме НС. У 1/4 - 1/2 больных со спонтанной вариантной стенокардией в течение ближайших 2-3 месяцев развивается ИМ или внезапная сердечная смерть.
Ранняя постинфарктная стенокардия
Ранняя постинфарктная стенокардия, возникающая в период от 48 ч до 2 недель от начала острого ИМ, по своему прогностическому значению также относится к НС. Возобновление ангинозных приступов в раннем постинфарктном периоде существенно ухудшает как ближайший, так и отдаленный прогноз ИМ: к концу первого года частота рецедивов ИМ достигает50%, а летальность -
17%. Свидетельствует |
о неполном тромболизисе в окклюзированной КА |
и о продолжающемся |
формировании тромба, в том числе и в других сосуди- |
стых областях, если имеет место многососудистое поражение КА.
Клинически ангинозная боль у этих больных мало чем отличается от обычной стенокардии. Встречаются случаи тяжелой стенокардии покоя и/или при малых нагрузках, рефрактерных к антиангинальной терапии. Во всех случаях раннее возобновление стенокардии у больного с ИМ расценивается как НС. Тщательный анализ основных характеристик болевого синдрома и других анамнестических данных позволяет выделить среди больных ИБС пациентов с нестабильным течением заболевания.
7.4. КЛАССИФИКАЦИЯ
С целью оценки прогностической значимости симптомов НС и выделения группы лиц с особенно неблагоприятным течением заболеванияE. Braunwald в 1989 г. была предложена классификация НС, модифицированная в 2000 г. (C.W.
Hamm, E. Braunwald), в которой НС делится на классы и формы в зависимости
198

от |
тяжести клинической |
картины заболевания и условий |
возникновения |
ОКС |
||||||||
(таблица 29). |
|
|
|
|
|
|
|
|
|
|
||
|
|
Таблица 29. Классификация нестабильной стенокардии |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Формы НС |
|
|
|
|
|
|
|
|
|
А - |
развивается |
В - развивается без |
С - |
возникает |
|
|||
|
|
|
|
в присутствии |
экстракардиальных |
в пределах 2-х |
|
|||||
|
Классы НС |
|
экстракардиаль- |
факторов |
недель |
после |
||||||
|
|
ных |
|
факторов, |
|
ИМ |
|
|
|
|
||
|
|
|
|
которые |
усили- |
Первичная НС |
Постинфарктная |
|||||
|
|
|
|
вают |
|
ишемию |
||||||
|
|
|
|
миокарда |
Вто- |
стенокардия |
|
|
|
|||
|
|
|
|
ричная НС |
|
|
|
|
|
|
|
|
I - Первое появле- |
|
IА |
|
IВ |
|
IС |
|
|
|
|||
ние |
тяжелой |
сте- |
|
|
|
|
|
|
|
|
||
нокардии или |
про- |
|
|
|
|
|
|
|
|
|||
грессирующая |
сте- |
|
|
|
|
|
|
|
|
|||
нокардия напряже- |
|
|
|
|
|
|
|
|
||||
ния |
|
|
|
|
|
|
|
|
|
|
|
|
(без стенокардии |
|
|
|
|
|
|
|
|
||||
покоя) |
|
|
|
|
|
|
|
|
|
|
|
|
II |
- |
Стенокардия |
IIА |
|
IIВ |
|
IIС |
|
|
|
||
покоя |
|
|
|
|
|
|
|
|
|
|
|
|
в предшествующий |
|
|
|
|
|
|
|
|
||||
месяц, |
но |
|
не |
|
|
|
|
|
|
|
|
|
в ближайшие 48 ч |
|
|
|
|
|
|
|
|
||||
(стенокардия |
-по |
|
|
|
|
|
|
|
|
|||
коя, подострая) |
|
|
|
|
|
|
|
|
|
|
||
III |
- |
Стенокардия |
IIIА |
|
IIIВ |
|
IIIС |
|
|
|
||
покоя |
предшест- |
|
|
IIIВ - тропонин - |
|
|
|
|
|
|||
вующие 48 ч (сте- |
|
|
|
|
|
|
|
|||||
нокардия |
покоя, |
|
|
IIIВ - тропонин |
|
|
|
|
|
|||
острая) |
|
|
|
|
|
|
|
|
|
|||
В основу этой классификации положены характер и сроки появления болевого синдрома. Наиболее серьезным в прогностическом отношении является III класс НС, при котором стенокардия покоя наблюдалась в течение последних 2-х суток перед обращением к врачу. Именно у этой категории больных НС риск развития ИМ или внезапной сердечной смерти является наиболее высоким. Важным представляется также выделение различных форм заболевания в зависимости от условий возникновения острого коронарного синдрома.
Срьезный прогноз у больных с первичной IIIНСкласса, особенно у пациентов с положительными маркерами некроза миокарда. Приведенная
199

классификация широко используется в научных исследованиях, однако в клинической практике более удобной представляется оценка кратковременно-
го риска тех или иных осложнений НС на основании клинических критериев (таблица 30). Оценка кратковременного риска НС необходима для выбора оптимального метода лечения больных.
Таблица 30. Китерии кратковременного риска у больных нестабильной стенокардией (E. Braunwald, 2001)
Группа высокого риска* |
Группа промежуточного |
|
Группа низкого рис- |
|
|||||||
|
|
|
|
|
риска** |
|
|
ка*** |
|
||
Стенокардия покоя бо- |
Стенокардия |
|
|
покояУвеличение |
частоты |
||||||
лее 20 мин |
|
|
в момент осмотра купи- |
|
и продолжительности |
||||||
|
|
|
|
рована, |
но |
сохраняется |
стенокардии |
|
|
||
|
|
|
|
возможность |
ее |
возоб- |
|
|
|
|
|
|
|
|
|
новления |
|
|
|
|
|
|
|
Отек легких |
|
|
Стенокардия, |
сопровож- |
|
Снижение |
порога воз- |
||||
|
|
|
|
дающаяся |
динамиче- |
никновения стенокардии |
|||||
|
|
|
|
скими |
|
изменениями |
|
|
|||
|
|
|
|
зубца Т |
|
|
|
|
|
|
|
Появление или усиление |
Ночная стенокардия |
|
|
Появление |
стенокардии |
|
|||||
шума |
митральной - |
ре |
|
|
|
|
в течение последних 2-х |
||||
гургитации |
|
|
|
|
|
|
|
недель - 2-х месяцев |
|||
Стенокардия |
|
покПоявление в течение 2-х |
Отсутствие |
изменений |
|
||||||
с транзиторными |
смепоследних |
недель |
сте- |
на ЭКГ |
|
|
|||||
щениями сегмента RS-T |
нокардии |
напряжения |
|
|
|||||||
не менее 1 мм |
|
|
III или IV ФК |
|
|
|
|
|
|
||
Стенокардия, |
сопровож- |
Наличие |
патологиче- |
|
|
||||||
дающаяся |
появлениемских зубцов Q или |
де- |
|
|
|
||||||
патологического III тона |
прессии |
сегмента RS-T |
|
|
|
||||||
сердца |
|
|
|
более 1 мм в нескольких |
|
|
|
||||
|
|
|
|
отведениях |
|
|
|
|
|
|
|
Появление |
|
влажныхВозраст более 65 лет |
|
|
|
|
|
||||
хрипов в легких |
|
|
|
|
|
|
|
|
|
||
Стенокардия, |
сопровож- |
|
|
|
|
|
|
|
|
||
дающаяся артериальной |
|
|
|
|
|
|
|
|
|||
гипотензией |
|
|
|
|
|
|
|
|
|
|
|
Повышенный |
|
уровень |
|
|
|
|
|
|
|
||
тропонинов в крови (или |
|
|
|
|
|
|
|
|
|||
других |
маркеров |
некро- |
|
|
|
|
|
|
|
|
|
за миокарда) |
|
|
|
|
|
|
|
|
|
|
|
Примечание: * - высокий риск диагностируется при наличии хотя бы одного из нижеперечисленных критериев; ** - принадлежность к группе промежуточного риска диагностируется при отсутствии критериев высокого риска
200
и наличии хотя бы одного из нижеперечисленных критериев; *** - принадлежность к группе низкого риска диагностируется при отсутствии критериев высокого и промежуточного риска и наличии хотя бы одного из нижеперечисленных критериев.
7.5. ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Все больные с НС должны быть госпитализированы в блок интенсивной терапии. Чем меньше времени прошло от начала дестабилизации состояния больного, тем выше риск развития ИМ или внезапной сердечной смерти и тем больше показана срочная госпитализация. Этот вопрос должен решаться при таких вариантах НС, как ВВС прогрессирующего течения, спонтанная (вариантная) стенокардия Принцметала и тяжелые и длительные приступы стенокардии покоя. Правилом для врача должна быть обязательная госпитализация в специализированный стационар всех больных ВВС, если симптомы болезни возникли менее 1 месяца назад. Это связано со сложностью прогнозирования дальнейшего развития симптомов болезни даже у больных с относительно стабильным течением ВВС и с необходимостью более детального обследования
этих |
пациентов с целью |
уточнения |
диагноза, морфологической |
основы |
и патогенетических механизмов коронарной недостаточности и |
проведения |
|||
дифференциальной диагностики с некоронарогенными кардиалгиями. |
|
|||
|
Диагностический поиск в блоке кардиореанимации преследует следую- |
|||
щие |
цели: 1. Подтверждение |
диагноза |
НС и ее клинического варианта |
|
и проведение дифференциального диагноза с острым ИМ. 2. Уточнение преобладающих патогенетических механизмов, лежащих в основе обострения коронарной недостаточности у данного больного. 3. Оценка характера и степени повреждения миокарда ЛЖ. 4. Выделение среди больных НС лиц с высоким риском развития острого ИМ и/или внезапной сердечной смерти. Для решения этих задач необходимо оценить динамику болевого синдрома на фоне проведения интенсивной антиангинальной терапии; динамику ЭКГ; результаты суточного мониторирования ЭКГ по Холтеру; динамику концентрации тропонина Т (МВ КФК, миоглобина); данные ЭхоКГ, коронароангиографии; состояние системы гемостаза.
Электрокардиография
Исследование ЭКГ в межприступном периоде имеет ограниченное значение, особенно у больных с ВВС и спонтанной стенокардией Принцметала. Лишь при глубокой и распространенной ишемии с очагами повреждения миокарда и иногда микронекрозами кардиомиоцитов на ЭКГ в течение1-4 дней могут регистрироваться преходящие изменения конечной части желудочкового комплекса. Чаще наблюдается депрессия сегментаRS-T (более 1 мм) горизонтального или косонисходящего типа, которая в большинстве случаев сочетается с соответствующими измененями зубцов Т- их сглаженностью или формиро-
201
ванием отрицательных равносторонних и остроконечных(“коронарных”) зубцов Т (больше 1 мм). В других случаях отрицательная динамика Т является единственным, хотя и неспецифическим, электрокардиографическим подтверждением развившейся ишемии миокарда. Сохранение этих изменений в течение нескольких дней после начала дестабилизации ИБС указывает на более глубокое, чем при стабильной стенокардии, ишемическое повреждение миокарда ЛЖ.
Отрицательная динамика ЭКГ может выявляться и в случаях прогрессирования безболевой ишемии миокарда, у пациентов, у которых отсутствует болевой синдром. Следовательно, любая более или менее стойкая отрицательная динамика ЭКГ у больного ИБС, даже если она не сопровождается болевыми ангинозными приступами, требует углубленного обследования на предмет наличия или отсутствия других признаков дестабилизации заболевания. Подъем сегмента RS-T указывает на трансмуральную ишемию миокарда, развившуюся вследствие окклюзии КА. Стойкий подъем сегмента RS-T характерен для развивающегося ИМ (ИМ “в ходу”).
Преходящий подъем сегмента RS-T может быть выявлен во время приступа вазоспастической стенокардии Принцметала. Длительное мониторирование ЭКГ по Холтеру является наиболее информативным методом изучения электрической активности сердечной мышцы у больных НС. Холтеровское мониторирование ЭКГ позволяет выявить: ишемические изменения ЭКГ во время спонтанных приступов стенокардии; частоту и продолжительность эпизодов болевой и безболевой ишемии; преходящие нарушения ритма и проводимости.
У большинства больных НС при суточном мониторировании выявляются транзиторные ишемические изменения сегментаRS-T, в том числе эпизоды безболевой ишемии. Чаще наблюдается смещение сегмента RS-Т ниже изоэлектрической линии (на 1 мм и более), что свидетельствует о возникновении субэндокардиальной ишемии миокарда. У больных с нестабильным течением спонтанной формы стенокардии во время ангинозного приступа, сопровождающегосядинамической окклюзией КА(или выраженным спазмом), можно обнаружить подъем сегмента RS-Т выше изолинии, указывающий на наличие преходящей трансмуральной ишемии миокарда.
В группе больных НС существенно чаще, чем у больных со стабильным течением заболевания, обнаруживаются суточные колебания сегментаRS-T и преходящие желудочковые аритмии высоких градаций. Особенно неблагоприятным признаком является безболевая ишемия миокарда, не сопровождающаяся возникновением приступа стенокардии. Наличие безболевой ишемии
миокарда существенно повышает риск внезапной сердечной смерти и острого ИМ. Прогноз остается неблагоприятным даже в тех случаях, когда под влиянием антиангинальной терапии уменьшается количество спонтанных болевых
202
приступов стенокардии, но число эпизодов безболевой ишемии сохраняется прежним.
Функциональные нагрузочные тесты
У больных НС с низким риском ИМ и внезапной смерти непосредственно перед выпиской из стационара и не раньше чем через7-10 дней после приступа ангинозной боли, проводят тесты с физической нагрузкой (фармакологические) с целью объективной оценки степени риска заболевания. Главным условием их проведения является отсутствие повторных эпизодов болевой, безболевой ишемии миокарда по данным ЭКГ или холтеровского мониторирования. Низ-
кая толерантность к нагрузке и выраженные ишемические изменения ЭКГ во время проведения теста служат показанием для осуществления коронароангиографии и решения вопроса о целесообразности реваскуляризации.
Лабораторные тесты
Биохимический анализ крови у больных НС дает возможность: оценить
активность кардиоспецифических ферментов и |
других |
маркеров некроза |
с целью дифференциальной диагностики НС и острого ИМ; оценить выражен- |
||
ность и характер нарушений липидного, углеводного |
и других |
видов обмена. |
Активность кардиоспецифических ферментов (тропонин Т, МВ КФК) при НС в большинстве случаев не отличается от нормы. Лишь изредка при тяжелом течении заболевания на фоне длительной и необратимой ишемии миокарда может произойти некротизация отдельных кардиомиоцитов. В этих случаях наблюдается небольшое повышение активности указанных ферментов, но не более чем на 40% от верхней границы нормы. Определение маркеров некроза (тропонины I и Т) имеет важное значение в выделении группы больных НС с высоким рис-
ком ИМ и внезапной смерти. В настоящее время уровень тропонинов в сыворотке крови считается наиболее специфичным лабораторным тестом в
диагностике некроза кардиомиоцитов и дифференциальной |
диагностике НС |
и острого ИМ. |
|
Нарушения углеводного и инсулинового обмена |
могут значительно |
ухудшать ближайший и отдаленный прогноз НС, так как существенно повышают риск возникновения ИМ и внезапной сердечной смерти. Гиперлипидемия выявляется у значительной части больных НС. Имеется определенная зависимость между уровнем общего ХС, ХС ЛНП и количеством пораженных КА, толерантностью к физической нагрузке и глобальной систолической функцией ЛЖ.
Нарушения системы гемостаза, закономерно выявляющиеся у больных НС, играют важную роль в дестабилизации ИБС и в определении исходов НС. Поэтому целесообразно более тщательно изучить состояние звеньев этой системы: 1) сосудисто-тромбоцитарного гемостаза; 2) системы коагуляционного гемостаза; 3) системы фибринолиза. Необходимо определение следующих по-
203
казателей: активированное время рекальцификации (АВР); активированное частичное тромбопластиновое время (АЧТВ); фибриноген плазмы; фибринолитическая активность крови; свободный гепарин крови; адгезивность и агрегация тромбоцитов, агрегация эритроцитов; протромбиновый индекс; антитромбин III; аутокоагуляционный тест; время свертывания цельной крови; тромбиновое время; показатели вязкости крови; тромбоэластограммы.
Базисные методы определения состояния системы свертывания крови позволяют оценить следующие признаки гиперкоагуляции у больных НС. 1. Укорочение времени свертывания цельной крови(меньше 5 мин). 2. Укорочение времени рекальцификации плазмы (менее 60-120 с при использовании кальция хлорида и менее 50-70 с - при использовании каолина). 3. Уменьшение активированного частичного тромбопластинового времени(АЧТВ) - кефалинкаолиновое время меньше 35-50 с. 4. Увеличение протромбинового индекса более 100% (или уменьшение протромбинового времени). 5. Изменение основных показателей тромбоэластограммы: укорочение времени реакции (R) и времени коагуляции (К) и увеличение максимальной амплитуды(Мa) тромбоэластограммы. 6. Дефицит антитромбина III - важнейшего физиологического антикоагулянта. 7. Повышение адгезии и агрегации тромбоцитов. 8. Увеличение концентрации фибриногена (более 2-4 г/л). 9. Появление в плазме растворенных фибрин-мономерных комплексов с фибриногеном(РФМК). 10. Повышение продуктов деградации фибрина (ПДФ) - более 0,015 г/л. Увеличение последних двух показателей - признак усиливающегося свертывания крови, сопровождающегося активацией фибринолитической системы. В клинической практике достаточно определения времени АЧТВ, которое служит в качестве контрольного теста при лечении больных антитромбиновыми препаратами.
Эхокардиография
Эхокардиографическое исследование у больных НС дает возможность количественно оценить степень систолической и диастолической дисфункции ЛЖ, выявить признаки нарушения локальной сократимости, обусловленные как острым ишемическим повреждением кардиомиоцитов, так и наличием у некоторых больных НС постинфарктного кардиосклероза. Нарушения глобальной систолической функции ЛЖ оцениваются по величине ,ФВстепени укорочения переднезаднего размера ЛЖ в систолу (%DS) и другим показателям (КДО, КСО, МО, СИ, размеры ЛП).
Прогностическое значение имеет снижение ФВ меньше 40%, которое выявляется более чем у половины больных НС, чаще у пациентов с длительным анамнезом ИБС и больных, перенесших в прошлом ИМ. У молодых пациентов с ВВС в1/4-1/3 случаев обнаружено снижение систолической функции ЛЖ, обусловленное ишемическим повреждением миокарда. Под влиянием лечения, направленного на восстановление перфузии миокарда, происходит уменьшение
204
признаков систолической дисфункции ЛЖ, что подтверждает ишемический генез снижения сократимости ЛЖ.
Выявление у больных НС локальных нарушений сократимости ЛЖ с помощью двухмерной ЭхоКГ имеет особое диагностическое и прогностическое значение. Асинергия ЛЖ у больных ИБС может быть обусловлена 4 основными причинами: 1) острым ИМ; 2) постинфарктным кардиосклерозом; 3) кратковременной преходящей болевой или безболевой ишемией миокарда4) постоянно действующей ишемией жизнеспособного миокарда(гибернирующий миокард), а также существованием так называемого“оглушенного” миокарда. При остром трансмуральном ИМ с зубцомQ или постинфарктном кардиосклерозе эхокардиографические признаки локальных нарушений сократимости ЛЖ(чаще акинезия или дискинезия) сохраняются длительное время и соответствуют электрокардиографическим маркерам острого или перенесенного ИМ(патологический зубец Q или комплекс QS).
Участки гипокинезии ЛЖ, обнаруживаемые у больных с кратковременной преходящей ишемией миокарда, вызванной очередным приступом стабильной стенокардии или индуцированной функциональным нагрузочным тестом (велоэргометрия, тредмил-тест, фармакологические пробы) через несколько минут после прекращения нагрузки или купирования приступа стенокардии не выявляются. На этом основана диагностика ИБС с помощью метода стресс- эхокардиографии. Более чем у половины больных с НС гипокинезия ЛЖ может сохраняться от одного до нескольких дней после купирования болевого -при ступа, свидетельствуя о более серьезных нарушениях коронарного кровообращения и более глубоком ишемическом повреждении миокарда. Это является важным диагностическим признаком НС, отличающим эту форму ИБС от приступов стабильной стенокардии.
Причиной локальных нарушений сократимости ,ЛЖсохраняющихся у больных НС в течение нескольких дней от начала дестабилизации болезни,
могут являться дистрофические изменения и даже некрозы кардиомиоцитов в ограниченных участках сердечной мышцы, расположенных в бассейне нарушенного коронарного кровообращения. Два возможных механизма снижения сократимости ЛЖ, которые чаще наблюдаются у больных НС: феномен гибернирующего (“спящего”) миокарда, находящегося в условиях хронического снижения коронарной перфузии; феномен “оглушения”, выявляющийся после восстановления исходной перфузии тканей (реперфузии).
Феномен гибернации (hybernatio - спячка) миокарда заключается в нарушении локальной сократимости ЛЖ, возникающем при выраженном и продолжительном снижении его перфузии и не сопровождающемся иными признаками ишемии. Феномен гибернации является своеобразной формой клеточного анабиоза, обеспечивающего выживаемость кардиомиоцитов в условиях дефицита кислорода. Гибернирующий миокард реагирует на введение катехолами-
205
нов под влиянием малых доз добутамина временно восстанавливается сократимость миокарда. Это доказывает его жизнеспособность. Феномен “оглушенного” миокарда (stunning) - это преходящее постишемическое нарушение локальной сократимости ЛЖ, возникающее после восстановления исходного коронарного кровообращения (реперфузии) и прекращения действия ишемии. Оба феномена очень характерны для больных с“обострением” ИБС, в том числе для пациентов с НС, хотя встречаются и при стабильном течении заболевания.
Нарушения локальной |
сократимости в |
области |
заднедиафрагмальной |
стенки ЛЖ свидетельствуют |
о стенозировании |
правой |
коронарной артерии, |
а повреждения переднеперегородочной и верхушечной локализацииоб ограничении коронарного кровотока в бассейне ЛКА. Если у больных НС нарастают симптомы коронарной недостаточности и сохраняется высокий риск -воз никновения ИМ и ВCС, необходимо решать вопрос о хирургической реваскуляризации в специализированном кардиохирургическом центре.
Сцинтиграфия миокарда
Сцинтиграфия миокарда 201Т1 позволяет выявить дефекты накопления радиопрепарата в зонах нарушенной перфузии миокарда, оценить их локализацию и распространенность. Чем меньше времени прошло с момента ангинозного приступа, тем больше шансов обнаружить эти дефекты. Если перфузия миокарда полностью восстановлена, “холодные” зоны локального снижения радиоактивности на сцинтиграммах больше не выявляются. При остром ИМ или постинфарктном кардиосклерозе “холодные” зоны снижения, отсутствия радиоактивности обнаруживаются в течение длительного времени. У части больных НС сцинтиграфия миокарда201Т1 позволяет определить распространенность и локализацию зон локального снижения перфузии миокарда.
Коронароангиография (КАГ)
КАГ у больных НС определяет локализацию, распространенность и характер поражения коронарного русла, оценивает выраженность коллатерального кровообращения. Эти данные необходимы для решения вопроса о целесообразности чрескожной коронарной ангиопластики больным с повторными эпизодами ишемии миокарда (рецидивы боли, отрицательная динамика сегмента RS-T); больным с повышенным содержанием в сыворотке крови тропонинов или МВ КФК; пациентам с нестабильной гемодинамикой(артериальная гипотензия, прогрессирующая СН); больным с угрожающими нарушениями ритма (повторные эпизоды ЖТ, ФЖ); пациентам с ранней постинфарктной стенокардией. Сужение КА обнаруживают примерно у 85-90% больных НС, из них примерно в 40% случаев на КАГ, зарегистрированных в первые сутки заболевания, можно обнаружить тромбы в КА. У 10-15% больных сужение крупных венечных сосудов является гемодинамически незначимым или артерии остаются интактными, несмотря на наличие типичных клинических, электрокардиографи-
206
ческих, сцинтиграфических признаков локального нарушения перфузии миокарда.
У 2/3 больных НС выявляется гемодинамически значимый стеноз КА (сужение более 75%), а еще у 1/4 - полная окклюзия одной из 3-х КА, в том
числе у больных, перенесших в прошлом ИМ. Однососудистое поражение об- |
|
||||
наруживают примерно у30% больных НС, причем чаще у пациентов относи- |
|
||||
тельно молодого возраста с впервые возникшей стенокардией. Двухсосудистое |
|
||||
поражение коронарного русла встречается у 25-30%, трехсосудистое - у 15-20% |
|
||||
больных. Атеросклеротическое сужение трех |
крупных ветвей (КАПМЖВ, |
|
|||
ПКА и ОВ) наблюдается у больных, длительно страдающих ИБС и перенесших |
|
||||
ИМ. Независимо от клинического варианта НС чаще |
всего поражается |
||||
ПМЖВ ЛКА. |
|
|
|
|
|
Главным |
отличием |
морфологических |
изменений коронарного |
русла |
|
у больных |
стабильной |
и нестабильной |
стенокардией |
является |
наличие |
у последних ангиографических признаков “осложненной” атеросклеротической бляшки. У большинства больных НС на коронарных ангиограммах можно выявить эксцентрическое (асимметричное) сужение просвета сосуда с неровной зазубренной кромкой. Такую неровность поверхности атеросклеротической бляшки объясняют ее разрывом или изъязвлением с формированием пристеночного тромба, расположенного в области этого повреждения. Иногда пристеночный тромб, неполностью закрывающий просвет сосуда, выглядит на коронарограммах как дефект наполнения, который как бы отделен от стенки сосуда.
У больного со стабильной стенокардией в месте сужения КА кромка обычно ровная и незазубренная, что отражает наличие “неосложненной” атеросклеротической бляшки, суживающей просвет КА. Значительно реже выявляется эксцентрический характер сужения венечного сосуда. Важное прогностическое значение у больных НС имеет ангиографическая оценка коллатерального кровообращения.
При хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время не сопровождается развитием ИМ. При значительном и распространенном поражении КА, длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей. У больных с“коротким” ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Это обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося возникновением трансмурального некроза сердечной мышцы у молодых больных. Больным НС присуща повышенная констрикторная активность в области“осложненной” атеросклеротической бляшки, суживающей просвет венечного сосуда. Поэтому на КАГ можно выявить заметную спастическую реакцию стенозированной КА.
7.6. КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
207
Основной целью лечения больных ОКС без стойкого подъема сегмента RS-T, который в дальнейшем трансформируется в НС, является снижение риска возникновения ИМ и внезапной смерти, уменьшение последствий острой распространенной ишемии миокарда ЛЖ. Согласно рекомендациям Европейской ассоциации кардиологов (2004), Российским рекомендациям экспертов ВНОК (2005) могут использоваться следующие медикаментозные и немедикаментозные воздействия.
1. Антиишемические (антиангинальные) ЛС: β-адреноблокаторы; нитраты; блокаторы медленных кальциевых каналов. 2. Антитромбиновые препараты: гепарины (нефракционированный, низкомолекулярные); прямые ингибиторы тромбина. 3. Антитромбоцитарные агенты: аспирин; антагонисты рецепторов к аденозиндифосфату(тиенопиридины); блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов. 4. Коронарная реваскуляризация: транслюминальная коронарная ангиопластика; аорто-коронарное шунтирование.
Лечение больных указанными методами должно быть начато незамедлительно. При возобновлении приступов болей показан прием нитроглицерина, включая его внутривенное введение, а при необходимости - применение внутривенных инфузий β-адреноблокаторов и наркотических анальгетиков. При ОКС без стойкого подъема сегмента RS-T, у подавляющего большинства больных НС, не рекомендуется применение тромболитической терапии, поскольку, увеличивая риск геморрагических осложнений, этот метод лечения не снижает смертность и частоту развития ИМ, а по некоторым данным даже увеличивает их.
β-адреноблокаторы
При отсутствии противопоказаний β-адреноблокаторы рекомендуется на-
значать всем больным НС. Положительный эффект |
от применения |
этих |
||
ЛС обусловлен |
преимущественно |
их |
отрицательным |
инотроп |
и хронотропным |
действием. Снижение |
потребности |
миокарда в кислороде |
|
и урежение сердечных сокращений, вызванное β-адреноблокаторами, обычно сопровождается отчетливым антиишемическим эффектом и примерно на13% уменьшает риск последующего развития ИМ. Поскольку отсутствуют доказательства большей эффективности того или иного β-адреноблокатора в лечении НС, выбор конкретного препарата должен основываться, прежде всего, на учете индивидуальной клинической ситуации: наличии сопутствующих заболеваний (АГ или артериальной гипотонии, сахарного диабета, заболеваний легких), имеющихся у больного признаков дисфункции ЛЖ, наличии синусовой тахикардии или брадикардии.
При лечении больных НС необходимо избегать назначенияадреноблокаторов при тяжелой острой СН, сопутствующей бронхиальной астме, выраженной артериальной гипотонии, синусовой брадикардии (< 50-55 уд.
208
в минуту) и АВ блокадах II, III и I степени (по крайней мере, при Р-Q(R) > 0,24 с). С осторожностью препараты применяются при хронических заболеваниях легких; в этих случаях целесообразно использовать короткодействующие кар-
диоселективные β-адреноблокаторы в меньших дозах. Больным с высоким
1
риском развития ИМ и внезапной смерти показано внутривенное капельное введение β-адреноблокаторов с последующим переводом их на пероральный прием этих ЛС. У больных со склонностью к спазму КА β-адреноблокаторы необходимо применять с большой осторожностью, а при вазоспастической стенокардии Принцметала они противопоказаны. Исключение составляют - β адреноблокаторы, обладающие дополнительными вазодилатирующими свойствами (карведилол).
Нитраты
Применяются у больных НС с целью гемодинамической разгрузки ЛЖ и уменьшения или купирования симптомов. В последнем случае нитраты назначают парентерально, постепенно наращивая дозы вплоть до купирования симптомов заболевания или появления побочных эффектов (головные боли, артериальная гипотензия). Начальная скорость внутривенной инфузии раствора нитроглицерина составляет 10 мкг/мин. Затем она увеличивается на 10 мкг/мин каждые 3-5 мин до появления реакции АД или изменения симптоматики. Если боль в сердце и другие признаки ишемии уменьшаются или исчезают, о скорость наращивания дозы препарата не увеличивают.
Если возникает соответствующая реакция АД, а симптоматика острой ишемии миокарда сохраняется, то скорость введения препарата наращивают с большими временными интервалами и под постоянным контролем АД. Особой осторожности требует ситуация, когда систолическое АД становится ниже 110 мм рт. ст. или у больного с артериальной гипертензиейна 25% ниже исходного уровня. Если на протяжении 12 часов и более другие признаки ишемии миокарда не возникают, необходимо уменьшить дозу и начинать переход на применение других лекарственных форм нитратов.
Блокаторы медленных кальциевых каналов
Назначаются больным НС с симптоматической целью, поскольку они не предотвращают развитие острого ИМ, не снижают смертность больных НС. Особенно показаны антагонисты кальция у пациентов с вариантной вазоспастической стенокардией Принцметала, а также при наличии противопоказаний к назначению β-адреноблокаторов (при сопутствующей бронхиальной астме). Верапамил и дилтиазем показаны при наличии у больных признаков гиперактивации САС, синусовой тахикардии и необходимости уменьшить потребность миокарда в кислороде. Препараты группы нифедипина, обладающие наиболее выраженным сосудорасширяющим действием, показаны при сопутствующей АГ и вазоспастической стенокардии Принцметала. При применении антагони-
209
стов кальция группы нифедипина надлежит использовать препараты, обладающие пролонгированным эффектом, поскольку имеются данные о том, что систематическое применение короткодействующих препаратов нифедипина может сопровождаться увеличением смертности больных ИБС.
Антитромботические лекарственные средства
Главной целью лечения больных НС является предотвращение дальнейшего прогрессирования тромбоза венечных сосудов и развития острого .ИМ В настоящее время с этой целью используют несколько групп ,ЛСвоздействующих на узловые звенья процесса тромбообразования: 1. Антитромбоцитарные препараты: аспирин; антагонисты рецепторов к аденозиндифосфату(тиенопиридины); блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов. 2. Антитромбиновые препараты: непрямые ингибиторы тромбина (нефракционированный и низкомолекулярные гепaрины); прямые ингибиторы тромбина (гирудин).
Антитромбоцитарные препараты
Аспирин. Всем больным НС рекомендуется назначение аспирина, который является “золотым стандартом” антитромбоцитарной терапии. Как и при стабильных формах ИБС, целесообразно назначать малые дозы аспирина(75325 мг в сутки), поскольку именно в такой дозировке аспирин ингибирует цик-
лооксигеназу тромбоцитов и, препятствуя образованию тромбоксана А, почти
2
не оказывает действия на метаболизм арахидоновой кислоты в сосудистом эндотелии и не снижает продукции простациклина. Больным острым коронарным синдромом целесообразно раньше начать прием аспирина. При первом контакте врача скорой помощи с больным и поступлении в стационар больному рекомендуют разжевать 1 таблетку аспирина, не покрытую оболочкой (250-500 мг). В последующем переходят на прием аспирина внутрь 1 раз в сутки (75-325 мг).
Тиенопиридины. При непереносимости аспирина больным НС могут быть назначены тиклопидин (тиклид) или клопидогрель, эффективно угнетающие адгезию и агрегацию тромбоцитов. Они проявляют свойства антагонистов АДФ-рецепторов тромбоцитов и по некоторым данным угнетают активность IIb/IIIа рецепторов. Поскольку тиклопидин отличается большим количеством побочных эффектов, включая возникновение нейтропении и тромбоцитопении, предпочтительно применение клопидогреля, прием которого сопровождается значительно меньшим количеством нежелательных явлений. Терапевтический эффект тиклопидина и клопидогреля наступает не сразу. Рекомендуют в начале лечения нагрузочные дозы этих ЛС, для клопидогреля - 300 мг в сутки однократно с последующим приемом 75 мг в сутки.
Поскольку механизмы действия аспирина и клопидогреля различны, возможно сочетание этих двух ЛС, которое у больных НС отличается большей эффективностью в отношении предупреждения ИМ и внезапной смерти по
210
сравнению с приемом одного аспирина. При отсутствии противопоказаний у больных НС с первых дней заболевания рекомендуется использовать именно такое сочетание аспирина и клопидогреля. Курантил (дипиридамол), также обладающий выраженным антиагрегантным действием, рекомендуют использовать у больных со стабильной стенокардией напряжения I-II ФК.
Пациентам с НС и ИМ курантил обычно не назначают, хотя имеются сообщения об успешном применении этого препарата у некоторых больных НС. Блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитовэто относительно новая группа антитромбоцитарных препаратов, которые предотвращают образование тромбоцитарного тромба на конечном этапе этого процесса. Активированные IIb/IIIа рецепторы тромбоцитов взаимодействуют с молекулой фибриногена, способствуя образованию плотного тромбоцитарного сгустка.
Блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов оказались весьма преспективными для лечения больных НС и ИМ. В отличие от других антиагрегантов, каждый из которых ингибирует в основном какой-либо один путь активации тромбоцитов(тромбоксановый, аденозиндифосфатный, тромбиновый), блокаторы IIb/IIIа рецепторов тромбоцитов подавляют конечную стадию агрегации кровяных пластинок, индуцируемую всеми агонистами этого процесса (тромбоксаном А2, АДФ, тромбином, серотонином).
Это свойство делает их особенно эффективными в лечении больных острыми коронарными синдромами. Блокаторы IIb/IIIа рецепторов тромбоцитов не действуют на факторы свертывания, активируемые на поверхности тромбоцитов и субэндотелия поврежденной атеросклеротической бляшки, а также в результате выпадения атероматозного детрита в просвет сосуда. Эти ЛС не
блокируют |
полностью процесс свертывания крови, поэтому их можно приме- |
|
нять совместно |
с препаратами антитромбинового действия. На практике |
|
у больных |
ОКС |
используют тройную комбинированную терапию: блокатор |
IIb/IIIа рецепторов тромбоцитов + гепарин + аспирин.
Всесторонние клинические испытания прошли три препарата, относящиеся к данному классу антитромбоцитарных ЛС: абциксимаб (моноклональные антитела к гликопротеиновым IIb/IIIа рецепторам тромбоцитов; эптифибатид (синтетический циклический пептид); тирофибатид (непептидный селективный блокатор IIb/IIIа рецепторов тромбоцитов). Все три препарата вводят внутривенно капельно.
Созданы также блокаторы IIb/IIIа рецепторов тромбоцитов для перорального применения (орбофибан, сиброфибан). Клинические испытания инфузионных блокаторов IIb/IIIа рецепторов тромбоцитов показали, что добавление этих препаратов к терапии гепарином у больных НС снижает риск возникновения ИМ и смертность от сердечно-сосудистых причин. Их применение показано при проведении коронарной ангиопластики и АКШ.
211
Антитромбиновые средства
У всех больных ОКС(НС), возникает необходимость применения антитромбиновых препаратов. К ним относятся: непрямые ингибиторы тромбина (нефракционированный и низкомолекулярные гепарины); прямые ингибиторы тромбина (гирудин). Нефракционированный гепарин в течение многих лет успешно применяется для лечения больных острым ИМ. Оказалось, что его применение показано и у пациентов с НС. Гепарин - естественный противосвертывающий фактор организма, вырабатываемый тучными клетками.
Гепарин оказывает антикоагулянтное действие главным образом благодаря связыванию с антитромбиномIII, являющимся естественным ингибитором тромбина. При соединении с гепарином активность антитромбина III возрастает в 700 раз, и он ингибирует некоторые ключевые активированные факторы свертывания крови: IIа, VIIа, Ха, ХIа, ХIIа. Гепарин повышает также активность липопротеинлипазы, снижает концентрацию холестерина и ЛНП, оказывает противовоспалительное, иммуносупрессивное, гипогликемическое и диуретическое действие.
При НС гепарин применяется для предотвращения тромбоза КА. Согласно рекомендациям Европейской ассоциации кардиологов(2004) и экспертов ВНОК (2006), у больных ОКС нефракционированный гепарин вводится только
внутривенно - вначале струйно, |
в виде болюса |
в дозе60-80 ЕД/кг (не более |
5000 ЕД), а затем с помощью |
длительной(48-72 |
ч) внутривенной инфузии |
в дозе 12-18 ЕД/кг/ч (не более 1250 ЕД/кг/ч). |
|
|
Средством контроля должен служить показатель АЧТВ. Дозы гепарина корректируют для того, чтобы через 6 ч после начала введения АЧТВ в1,5-2,5 раза превышало нормальный показатель данной лаборатории и удерживалось
на этом “терапевтическом” уровне. Если указанный уровень АЧТВ определяется в 2-х последовательных измерениях, следующее измерение можно проводить через 24 ч.
При применении нефракционированного гепарина могут развиться - по бочные эффекты: 1. Кровотечения, в том числе в головной мозг(0,5-2,8%). 2. Геморрагии в местах инъекции. 3. Тромбоцитопения. 4. Остеопороз (при длительном применении). Лечение нефракционированным гепарином противопоказано в следующих клинических ситуациях: 1. Наличие сопутствующих заболеваний, сопровождающихся геморрагическим синдромом(гемофилия, тромбоцитопения, геморроидальные кровотечения). 2. Геморрагический инсульт. 3. Язвенная болезнь желудка и двенадцатиперстной кишки. 4. Тяжелая артериальная гипертензия. 5. Черепно-мозговая травма. 6. Инфекционный эндокардит. 7. Тяжелая почечная, печеночная недостаточность. 8. Непереносимость гепарина. Требуется осторожность при применении гепарина у больных с подозрением на злокачественные новообразования желудочно-кишечного тракта, у лиц пожи-
212
лого возраста. Выраженное кровотечение из желудка или кишечника, проявляющееся рвотой “кофейной гущей”, внутричерепное кровоизлияние требуют применения антагониста гепарина - протаминсульфата, который нейтрализует анти-IIа активность нефракционированного гепарина. Протаминсульфат вводят внутривенно капельно из расчета 1 мг препарата на 100 ЕД введенного гепарина. Отмена гепарина и применение протаминсульфата увеличивают риск тромбоза КА.
Низкомолекулярные гепарины
Низкомолекулярные гепарины, которые получают путем ферментативной или химической деполимеризации обычного гепарина, имеют значительные преимущества перед нефракционированным гепарином. Если обычный гепарин в равной степени ингибирует факторы свертыванияII (тромбин) и Ха в соотношении 1:1, то низкомолекуляные гепарины в большей степени воздействуют на фактор Ха, и соотношение “анти-IIа”:“анти-Ха” колеблется от 1:2 до 1:6. Эти ЛС воздействуют на процесс свертывания крови на более ранних стадиях коагуляционного гемостаза и ингибируют процесс образования тромбина.
Важным достоинством низкомолекулярных гепаринов является простота их введения. Обычно используют подкожное введение, дозируя их по массе тела и не проводя постоянного лабораторного контроля. Действие препаратов более предсказуемо, чем действие обычного гепарина. Результаты клинических испытаний низкомолекулярных гепаринов(дельтапарина, эноксапарина, надропарина) свидетельствуют об их большой эффективности в лечении больных ОКС (таблица 31).
Таблица 31. |
Лечение низкомолекулярными гепаринами (ВНОК, 2006) |
||
|
|
|
|
Препарат |
|
Дозы и схемы введения |
|
Эноксапарин |
|
Подкожно 100 МЕ/кг (1 мг/кг) каждые 12 ч в течение 2-8 |
|
|
|
суток. Первой подкожной инъекции может предшество- |
|
|
|
вать внутривенное струйное введение(болюс) 30 мг пре- |
|
|
|
парата |
|
Дальтепарин |
|
Подкожно 120 МЕ/кг (максимально 10 000 МЕ) каждые 12 |
|
|
|
ч в течение 5-8 суток |
|
Надропарин |
|
Внутривенно струйно (болюс) 86 МЕ/кг; Подкожно 86 |
|
|
|
МЕ/кг каждые 12 ч в течение 2-8 суток |
|
При применении этих ЛС в течение 8 суток в острую фазу болезни удается достичь максимального эффекта. Более длительное лечение не сопровождается возрастанием их эффективности в отношении развития ИМ и смертности больных острым коронарным синдромом.
Прямые ингибиторы тромбина
213
Механизм действия непрямого ингибитора тромбинагепарина - заключается в увеличении активности естественного физиологического антикоагулянта антитромбина III. Для реализации антикоагулянтного эффекта гепарина необходимо присутствие в плазме крови антитромбинаIII. В отличие от этого механизм действия прямых ингибиторов тромбина заключается в связывании с активными центрами самого тромбина, что блокирует его коагуляционные свойства.
Прямые ингибиторы тромбина проявляют свою активность не только по отношению к “свободному” циркулирующему тромбину, но и к тромбину, связанному с фибрином и находящемуся на поверхности тромбоцитов, которые входят в состав “белого” тромбоцитарного тромба. Имеется несколько сообщений о высокой эффективности прямых ингибиторов тромбина, несколько превышающей эффективность нефракционированного гепарина. Применение этих препаратов сопровождается в1,5-2 раза большей частотой развития малых и больших кровотечений. Прямые ингибиторы тромбина целесообразно применять в лечении больных с тромбоцитопенией, вызванной гепарином (ВНОК, 2005).
7.7. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Коронарная реваскуляризация
При отсутствии эффекта от медикаментозной терапии и сохранении признаков рецидивирующей ишемии миокарда показано проведение коронарной реваскуляризации: чрескожной транслюминальной коронарной ангиопластики (ЧТКА) или аорто-коронарного шунтирования (АКШ). Основными показаниями к проведению экстренной коронарной реваскуляризации являются: 1. Повторные эпизоды ишемии миокарда(рецидивы боли или/и отрицательная динамика сегмента RS-T). 2. Повышение содержания в сыворотке крови тропонина Т или МВ КФК. 3. Нестабильность гемодинамики (артериальная гипотензия или прогрессирующая сердечная недостаточность). 4. Угрожающие нарушения ритма (повторные эпизоды ЖТ или ФЖ). 5. Ранняя постинфарктная стенокардия.
Чрескожная транслюминальная коронарная ангиопластика
Выбор метода коронарной реваскуляризации определяется характером, степенью и распространенностью поражения КА, которые выявляются при проведении КАГ. При поражении одной КА в большинстве случаев проводят ЧТКА, в том числе с установлением стента, что способствует механической стабилизации поврежденной атеросклеротической бляшки и меньшей частоте рестенозов после баллонной дилатации сосуда. Результаты баллонной ангиопластики, проведенной у больных НС по экстренным показаниям, несколько хуже, чем на фоне стабильного течения ИБС. Это связано с тем, что механическое растяжение (сдавление) поврежденной атеросклеротической бляшки уве-
214
личивает разрывы фиброзной оболочки и ее тромбогенность. Частота развития ИМ во время инвазивной процедуры экстренной баллонной ангиопластики составляет около 5%, меньше чем при применении консервативной терапии (около 10%). Смертность, связанная с самим инвазивным вмешательством, сравнительно низка.
Для предупреждения рестенозов после ЧТКА целесообразно еще до начала процедуры баллонной ангиопластики начать применение блокаторов гликопротеиновых IIb/IIIа рецепторов тромбоцитов или тиклопидина. Лечение этими ЛС продолжают в течение еще12-24 ч после инвазивного вмешательства.
В последующем рекомендуется прием в течение месяца аспирина в сочетании с клопидогрелем или тиклопидином.
Аорто-коронарное шунтирование
Чаще проводят при трехсосудистом поражении КА, при стенозе ствола ЛКА, при однососудистом сужении, если при КАГ выявляется выраженная извитость или изогнутость венечных сосудов, что не позволяет безопасно провес-
ти коронарную |
ангиопластику. Летальность во время экстренной |
операции |
АКШ у больных |
НС в последние годы снизилась и составляет |
около4-8%, |
а риск развития ИМ - около 10%. У больных с тяжелым течением заболевания или ранней постинфарктной стенокардией риск возникновения ИМ более высокий. Существенной проблемой коронарной реваскуляризации остается высокая частота рестенозов КА: при проведении ангиопластики она достигает40%, а при АКШ - 5-10%.
После выписки из стационара всем больным, перенесшим эпизоды НС, показано активное воздействие на ФР атеросклероза: курение, ожирение, АГ, гиперлипидемии. Особое значение придается в настоящее время применению гиполипидемической терапии ингибиторами ГМГ-КоА редуктазы(статинами), которые существенно снижают смертность и частоту осложнений у больных с высоким и средним уровнями ХС ЛНП. Согласно рекомендациям экспертов ВНОК (2007) гиполипидемическую терапию начинают еще в стационаре, ориентируясь на уровни липидов в пробах крови, взятых при поступлении. При отсутствии противопоказаний применяют: β-адреноблокаторы; антитромбоцитарные препараты; гиполипидемические средства; нитраты. У больных с клиническими или эхокардиографическими признаками дисфункции ЛЖ показано длительное применение ингибиторов АПФ.
Ближайший прогноз НС оценивается как неблагоприятный10у-20% больных НС. В течение первых трех месяцев развивается острый ИМ или новые эпизоды НС, летальные исходы составляют 4-10%. Основными признаками неблагоприятного варианта течения НС являются: сохранение или прогрессирование болевого синдрома и неэффективность антиангинальной терапии; приступы стенокардии покоя длительностью более20 мин; частые и длительные
215
эпизоды смещения сегмента RS-T при суточном мониторировании ЭКГ, сохранение эпизодов безболевой ишемии; выявление при холтеровском мониторировании ЭКГ преходящих желудочковых аритмий высоких градаций; выраженное снижение толерантности больных НС к нагрузкам; перенесенные ранее ИМ, операция реваскуляризации.
216
Глава VIII ИНФАРКТ МИОКАРДА
8.1. ОПРЕДЕЛЕНИЕ
Инфаркт миокарда (ИМ) - это ишемический некроз сердечной мышцы, развивающийся в результате острой недостаточности коронарного кровообращения. ИМ является одной из самых распространенных причин смертности
иинвалидизации населения экономически развитых стран. В РФ ежегодно ИМ развивается у 0,9-1,4% мужчин в возрасте от 40 до 59 лет.
Умужчин старшей возрастной группы(60-64 г) заболеваемость ИМ еще выше и достигает 1,7% в год. Женщины заболевают ИМ в2,5-5 раз реже мужчин, особенно в молодом и среднем возрасте, что связывают обычно с более поздним (примерно на 10 лет) развитием у них атеросклероза. После наступления менопаузы (в возрасте старше 55-60 лет) разница в заболеваемости мужчин
иженщин существенно уменьшается.
Впоследние годы отмечается рост заболеваемости ИМ, особенно среди лиц молодого и среднего возраста. Несмотря на повсеместное снижение госпитальной летальности от ИМ, общая смертность от этого заболевания остается высокой, достигая 30-50% от общего числа заболевших. Около трети больных инфарктом миокарда погибают в течение первых суток, в основном до госпитализации. Смертность в специализированном отделении составляет достигает 10%. Еще 10% больных умирают в течение первового года.
8.2. КЛАССИФИКАЦИЯ
Современная классификация ИМ предусматривает его деление по величине и глубине поражения сердечной мышцы, характеру течения заболевания, локализации ИМ, стадии заболевания, наличию осложнений ИМ.
1. По величине и глубине поражения сердечной мышцы различают трансмуральный и нетрансмуральный ИМ. При трансмуральном ИМ (инфаркте миокарда с зубцомQ) очаг некроза захватывает либо всю толщу сердечной мышцы от субэндокардиальных до субэпикардиальных слоев миокарда, либо большую его часть, что находит свое отражение на поверхностной ЭКГ в виде формирования патологического зубца Q или комплекса QS в нескольких электрокардиографических отведениях. Отсюда и синоним трансмурального ИМ- “инфаркт миокарда с зубцомQ”. Как правило, такое повреждение сердечной мышцы достаточно обширно и очаг некроза распространяется на2 и больше сегментов ЛЖ (крупноочаговый ИМ). При нетрансмуральном ИМ(инфаркте миокарда без зубцаQ) очаг некроза захватывает только субэндокардиальные
217
или интрамуральные отделы ЛЖ и не сопровождается патологическими изменениями комплекса QRS (“инфаркт миокарда без зубца Q”). В течение длительного времени в отечественной литературе для обозначения ИМ без зубцаQ использовался терминуту “мелкоочаговый ИМ”. В большинстве случаев ИМ без зубца Q существенно меньше по протяженности, чем трансмуральный инфаркт, хотя нередко встречаются случаи обширного субэндокардиального ИМ, распространяющегося на несколько сегментов ЛЖ, но затрагивающего только субэндокардиальные слои миокарда.
2.Различают первичный, повторный и рецидивирующий ИМ. Первичный ИМ диагностируется при отсутствии анамнестических и инструментальных признаков перенесенного в прошлом ИМ. Повторный ИМ диагностируется в тех случаях, когда у больного, у которого имеются документированные сведения о перенесенном в прошлом ИМ, появляются достоверные признаки нового очага некроза, чаще формирующегося в бассейне других КА в сроки, превышающие 28 дней с момента возникновения предыдущего инфаркта. При рецидивирующем ИМ клинико-лабораторные и инструментальные признаки формирования новых очагов некроза появляются в сроки от72 часов (3 суток) до 28 дней после развития ИМ, до окончания основных процессов его рубцевания.
3.По локализации ИМ выделяют: переднесептальный (переднеперегородочный); передневерхушечный; переднебоковой; переднебазальный (высокий передний); распространенный передний (септальный, верхушечный и боковой); заднедиафрагмальный (нижний); заднебоковой; заднебазальный; распространенный задний; ИМ правого желудочка. ИМ чаще локализуется в ЛЖ, поражая его переднюю, заднюю, боковую стенки или/и межжелудочковую перегородку (МЖП), что зависит от местоположения критического стеноза или окклюзии той или иной КА.
Нарушение кровообращения по ПМЖВ ЛКА может привести к развитию ИМ переднеперегородочной области, верхушки и гораздо реже - заднедиафрагмальной (нижней) стенки ЛЖ. Прекращение кровотока по ОВ ЛКА сопровождается возникновением переднебазального, бокового или заднебазального ИМ (при окклюзии дистальных отделов ОВ ЛКА). При нарушении кровообращения в бассейне ПКА может развиться заднедиафрагмальный(при поражении проксимальных отделов ПКА) или заднебазальный ИМ (при окклюзии дистальных отделов ПКА). Изолированный инфаркт правого желудочка встречается сравнительно редко. Часто имеется сочетание ИМ различной локализации.
4. По стадии течения заболевания различают: острейший период - до 2 ч от начала ИМ; острый период - до 10 дней от начала ИМ; подострый период – с 10 дня до конца 4-8 недели; постинфарктный период - обычно после 4-8 недели. Иногда выделяют продромальный период (“предынфарктное состояние”), который в известной степени соответствует понятию нестабильной стенокардии, осложнившейся развитием ИМ. Этот период можно выделить ретроспективно,
218
после состоявшегося ИМ, поскольку при возникновении клинической картины НС, хотя и возрастает риск развития острого ИМ или внезапной смерти, все же никогда нельзя с уверенностью сказать, завершится ли ОКС развитием ИМ или нет.
5. К числу наиболее распространенных осложнений ИМ относятся: острая левожелудочковая недостаточность (отек легких); кардиогенный шок; желудочковые и наджелудочковые нарушения ритма; нарушения проводимости (СА-блокады, АВ-блокады, блокады ножек пучка Гиса); острая аневризма ЛЖ; внешние и внутренние разрывы миокарда, тампонада сердца; асептический перикардит (эпистенокардитический); тромбоэмболии.
Вновых рекомендациях по диагностике и лечению ИМ, разработанных рабочей группой Европейского общества кардиологов(European Heart Journal, 2007), предложена новая классификация заболевания(таблица 32). При этом термин ИМ должен быть использован, когда есть свидетельства некроза миокарда в клинической ситуации, соответствующей ишемии миокарда.
Вэтих случаях хотя бы один из перечисленных ниже критериев достаточен в диагностике ИМ:
1-й критерий - выявление повышения и/или снижения сердечных биомаркеров (сердечного тропонина Т, I) с одним повышением более 99-го персентиля эталонной контрольной группы в качестве верхего разделительного уров-
ня в сочетании с хотя бы с одним из перечисленных свидетельств ишемии (симптомы ишемии; изменения ЭКГ, свидетельствующие о новой ишемии; развитие нового патологического зубца Q на ЭКГ; визуализационные свидетельст-
ва);
2-й критерий - внезапная сердечная смерть, в сочетании с новыми подъемами сегмента ST или новой полной блокады ЛНПГ и/или свидетельствами присутствия тромба при ангиографии и/или аутопсии, при условии, что смерть наступила до получения образцов крови или во время, когда биомаркеры еще не повышены;
3-й критерий - в случае ЧКВ у больных с нормальным исходным уровнем тропонинов повышение сердечных биомаркеров, превышающее разделительный уровень в 3 раза;
4-й критерий - в случае КШ у больных с нормальным исходным уровнем тропонинов повышение сердечных биомаркеров, превышающее разделительный уровень в 5 раз, считается выявляющим ИМ при наличии: нового зубца Q, окклюзии артерии или шунта при КАГ; визулизационного свидетельства;
5-й критерий - свидетельства ИМ, выявленные при аутопсии.
219

Необходимо помнить, что повышение сердечных тропонинов возможно при отсутсвии ухудшения ИБС: ушиб сердца или другая травма, включая хирургическую, кардиостимуляция; сердечная недостаточность – острая или хроническая; расслоение аорты; заболевания клапана аорты; гипертрофическая кардиомиопатия; тахи- и брадиаритмия или блокады проводящей системы; апикальный баллонирующий синдром; рабдомиолиз с вовлечением миокарда; тромбоэболия сосудов легких, тяжелая легочная гипертензия; почечная недостаточность; острые неврологические заболевания, включая инсульт и субарахноидальное кровоизлияние; инфильтративные заболевания (амилоидоз, гемохроматоз, саркоидоз, склеродермия); воспалительные заболевания миокарда или вовлечение миокарда при пери/эндокардитах; токсичные лекарства или токсины; критическое состояние больного, особенно при сопутствующей дыхательной недостаточности или сепсис; ожоги боле 30% поверхности тела; большая физическая нагрузка.
|
Таблица 32. Классификация ИМ (ESC, 2007) |
|
|
|
|
Тип 1 |
Спонтанный инфаркт миокарда связанный с ишемией из-за пер- |
|
|
вичного коронарного события, такого как эрозия бляшки и/или ее |
|
|
разрыв, ее трещина или расслоение |
|
|
|
|
Тип 2 |
Инфаркт миокарда вторичный по отношению к ишемии или из-за |
|
|
повышения потребности в кислороде или из-за снижения его дос- |
|
|
тавки из-за спазма коронарной артерии, коронарной эмболии, |
|
|
анемии, гипертонии или гипотонии |
|
|
|
|
Тип 3 |
Неожиданная внезапная смерть, включающая остановку сердц, |
|
|
часто с симптомами, свидетельствующими об ишемии миокарда, |
|
|
сопровождающимися предположительно новыми подъемами сег- |
|
|
мента ST, или новой ПБ ЛНПГ, или предположительно новой вы- |
|
|
раженной обструкцией, выявляемой ангиографией или аутопсией. |
|
|
Однако смерть наступила случилась до взятия анализа крови, или |
|
|
до момента их повышения биомаркеров в крови |
|
|
|
|
Тип 4А |
Инфаркт миокарда связанный с ЧКВ. |
|
|
|
|
Тип 4В |
Инфаркт миокарда связанный с тромбозом стента, документиро- |
|
|
ванный ангиографией ангиографией или аутопсией |
|
|
|
|
Тип 5 |
Инфаркт миокарда связанный с АКШ |
|
|
|
|
220
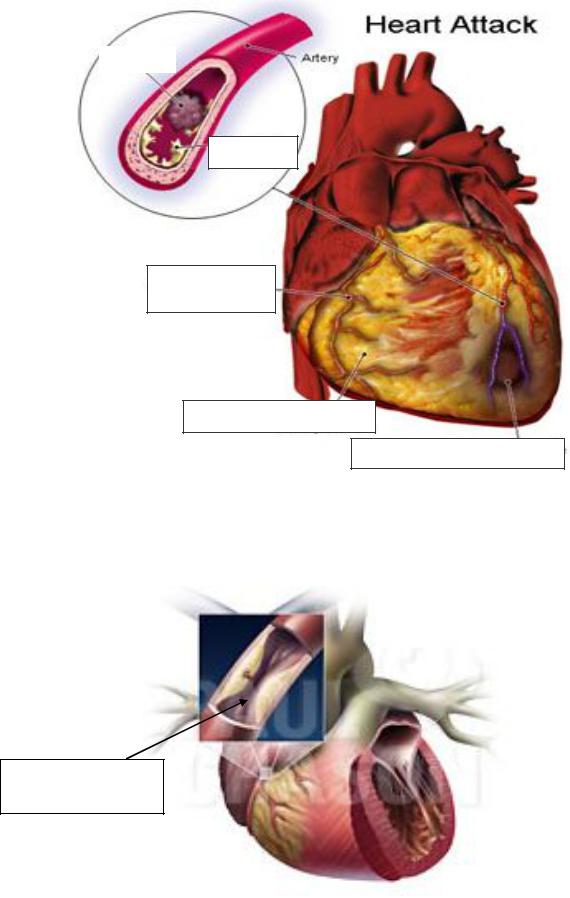
|
|
|
|
|
Тромб |
|
Коронарная артерия |
|
|
|
|
|||
Бляшка
Коронарная
артерия
Сохранный участок
Участок некроза миокарда
Рисунок 12. Первый тип ИМ - спонтанный, связанный с ишемией из-за первичного коронарного события: эрозиИ бляшки и/или ее разрыва, ее трещины, расслоения (Е.Н. Николаевский).
Выраженный коронарный стеноз
221
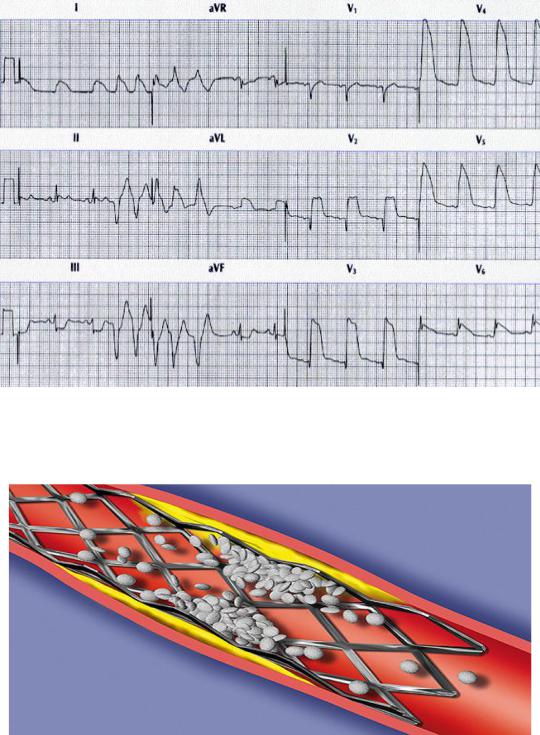
Рисунок 13. Второй тип ИМ - вторичный по отношению к ишемии из-за повышения потребности в кислороде при снижении его доставки: спазм коронарной артерии, коронарной эмболии, анемии, гипертонии, гипотонии (Е.Н. Николаевский).
Рисунок 14. Третий тип ИМ – с симптомами, свидетельствующими об ишемии миокарда, сопровождающимися новыми подъемами сегмента ST, или новой полной блокадой ЛНПГ (Е.Н. Николаевский).
Рисунок 15. Четвертый В тип ИМ– ИМ, связанный с тромбозом стента, документированный ангиографией или аутопсией.
Рецидив ИМ должен подозреваться в случае возникновения у больных нового зубца Q или подъемов сегмента ST ≥ 0,1 мВ (1 мм) у имевших ранее меньшую степень таких подъемов, особенно, если это связано с симптомами
222
ишемии. Снижения сегмента ST или полной блокадой ЛНПГ не должны рассматриваться как однозначные критерии рецидива инфаркта миокарда. У больных с подозрением на рецидив инфаркта на основании клинических признаков, возникших после возникновения первого инфаркта, рекомендуется немедленное определение уровня сердечного тропонина Т. Второе определение производится через 3-6 ч. Рецидив ИМ диагностируется в случае, если нарастание содержания маркера во втором образце составляет 20 и более процентов.
8.3. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основной причиной развития ИМ является атеросклероз КА(95%). У 3- 5% больных ИМ может развиться в результате эмболии КА (инфекционный эндокардит, внутрижелудочковые тромбы), врожденных дефектов развития венечных сосудов и других поражений КА(коронарииты при системной красной волчанке, ревматизме, ревматоидном артрите). Однако в этих случаях ИМ расценивается не как клиническая форма ИБС, а как осложнение одного из перечисленных заболеваний. В большинстве случаев прекращение или резкое ограничение коронарного кровотока наступает в результате тромбоза КА, который обычно развивается в области“осложненной” атеросклеротической бляшки, истонченная капсула которой оказывается поврежденной (надрыв, изъязвление, обнажение липидного ядра бляшки). Это способствует активации тромбоцитарных и плазменных факторов свертывания крови тканевым тромбопластином и коллагеном. ИМ может возникать в результате спазма венечной артерии на фоне атеросклероза или при выраженном стрессе, употреблении кокаина, амфетаминутуов. Причинами развития ИМ могут быть врожденные аномалии коронарных артерий, тромбозы при артериите и травмах сердца, расслоение венечной артерии и аорты. У молодых женщин ИМ чаще развивается при сочетании табакокурения и использовании гормональных контрацептивов.
Вначале образуется тромбоцитарный “белый” пристеночный тромб. Одновременно в этой области выделяется ряд биологически активных веществ, обладающих мощным вазоконстрикторным действием(эндотелин, серотонин, тромбин, антитромбин А2). В результате возникает выраженный спазм стенозированной КА, еще больше ограничивающий кровоток по венечной артерии.
Мелкие тромбоцитарные агрегаты могут эмболизировать венечные сосуды на микроциркуляторном уровне, что еще больше ограничивает коронарный кровоток. Постепенно размеры пристеночного тромба увеличиваются и, если не происходит его спонтанного лизиса в результате естественной активации собственной фибринолитической системы или не проводится тромболитическая -те рапия, тромб полностью окклюзирует просвет сосуда и развивается трансмуральный ИМ (инфаркт с зубцом Q).
Когда по разным причинам полной окклюзии КА не происходит или возникает спонтанный лизис тромба, может развиться субэндокардиальный или интрамуральный ИМ (инфаркт без зубца Q). Последний может развиться и при
223
полной окклюзии КА, если хорошо выражены коллатерали. В 75% случаев процесс формирования тотального тромба, полностью перекрывающего просвет крупной КА, может занимать от 2-х дней до 2-3 недель. В этот период кли-
ническая картина прогрессирующего ухудшения коронарного кровотока в целом соответствует симптоматике нестабильной стенокардии(предынфарктный синдром). У 1/4 больных ИМ процесс формирования тотального, полностью окклюзирующего тромба, протекает молниеносно. В этих случаях в клинической картине заболевания отсутствует симптоматика продромального периода.
Быстрому формированию очага некроза в сердечной мышце могут способствовать 3 дополнительных фактора: выраженный спазм КА; слабое развитие коллатеральных сосудов; выраженное увеличение потребности миокарда в кислороде в результате физического или психоэмоционального напряжения, подъема АД и других причин. Все три фактора ведут к увеличению скорости формирования очага некроза и его объема. В условиях хорошо развитого коллатерального кровообращения даже полная, но постепенная, окклюзия КА в отдельных случаях может не сопровождаться развитием ИМ.
Морфологические данные
Самые ранние морфологические изменения в миокарде при ИМ можно выявить при использовании электронной микроскопии. Уже через 15-20 минутуут после коронарной окклюзии обнаруживают набухание митохондрий и истощение гликогена. Через 60 минутуут после прекращения коронарного кровообращения выявляется необратимое ишемическое повреждение клетки в виде распада хроматина ядер и выраженной контрактуры саркомеров. При использовании световой микроскопии первые изменения в очаге ИМ обнаруживаются только через 12-18 часа от начала инфаркта. Наблюдается расширение капилляров, отек мышечных волокон. Через 24 часа выявляется фрагментация мышечных волокон и инфильтрация полиморфно-ядерными лейкоцитами. Макроскопически картина ИМ начинает выявляться только через 18-24 часов от начала заболевания. Очаг некроза выглядит бледным и отечным, а через 48 часа зона некроза приобретает серый оттенок и становится дряблой. При неосложненном течении процесс формирования рубца завершается примерно через6 недель от начала ИМ.
При формировании ИМ происходит нарушение диастолической и систолической функций ЛЖ, начинается процесс его ремоделирования. Одновременно наблюдаются значительные изменения функционального состояния других органов и систем. Диастолическая дисфункция ЛЖ является одним из первых проявлений ишемии и развивающегося ИМ. Диастолическая дисфункция обусловлена повышением ригидности (снижением податливости) сердечной мышцы во время диастолы. Начальные стадии диастолической дисфункции характеризуются снижением скорости диастолического расслабления и объема раннего
224
диастолического наполнения (в фазу быстрого наполнения желудочка). Увеличивается объем кровотока в систолу ЛП. Значительная часть диастолического наполнения ЛЖ осуществляется только в конце диастолы, во время систолы ЛП. Дальнейшее ухудшение диастолической функции ЛЖ приводит к росту КДД в ЛЖ, давления наполнения и среднего давления в ЛП и венах малого круга кровообращения, что существенно повышает риск возникновения застоя крови в легких.
Систолическая дисфункция ЛЖ проявляет себя в нарушении региональной сократимости ЛЖ и в появлении признаков глобальной систолической дисфункции ЛЖ. Нарушения локальной сократимости ЛЖ при ИМ развиваются очень рано. Вначале они напоминутуают таковые, обнаруживаемые у больных стабильной стенокардией во время проведения нагрузочных тестов или у пациентов НС после ангинозного приступа. Однако уже через сутки от начала ИМ гипокинезия некротизирующегося участка сердечной мышцы, отражающая функцию гибернирующего (“спящего” в условиях выраженной ишемии) миокарда, сменяется ее акинезией - отсутствием во время систолы сокращения некротизированного участка сердечной мышцы. Наиболее серьезным нарушением локальной сократимости является дискинезия - парадоксальное выбухание участка некроза в момент систолы. В области неповрежденной сердечной мышцы нередко наблюдается увеличение сократимости интактных участков ЛЖ, компенсаторного характера.
Снижение глобальной систолической функции ЛЖ при ИМ заключается в уменьшении ФВ, УО, СИ, МО, АД; в повышении КДД и КДО ЛЖ; в появлении клинических признаков левожелудочковой недостаточности и застоя крови в малом круге кровообращения; в появлении признаков системных расстройств периферического кровообращения, в том числе на микроциркуляторном уровне. Насосная функция ЛЖ при ИМ определяется распространенностью очага некроза. В каждом случае такая зависимость может существенно нарушаться,
поскольку еще большее ухудшение гемодинамики может быть связано с развитием острой аневризмы ЛЖ, появлением митральной регургитации при инфаркте сосочковых мышц или перфорацией МЖП, выраженной гипертрофии миокарда, наличием диастолической дисфункции сердечной мышцы, состоянием соседних с инфарктом участков миокарда, не вовлеченных в процесс инфарцирования.
Ремоделирование ЛЖ при ИМэто совокупность изменений структуры и функции ЛЖ, обусловленных формированием в сердечной мышце ИМ. Наиболее существенные изменения происходят при трансмуральном ИМ. Форми-
рующийся в стенке ЛЖ обширный очаг некроза испытывает на себе высокое внутрижелудочковое давление, создаваемое интактным миокардом желудочка во время систолы. Ремоделирование ЛЖ больше выражено у больных с обширным передним трансмуральным ИМ. В этих случаях ремоделирование
225
начинается уже через 24 часа от начала инфаркта и продолжается в течение длительного времени (недели и месяцы).
На выраженность процесса ремоделирования влияют несколько факторов: 1. Размеры ИМ (чем больше площадь инфаркта, тем более выраженными оказываются структурные изменения в ЛЖ). 2. Размер периинфарктной зоны (области ишемизированного или гибернирующего миокарда, непосредственно граничащей с зоной некроза). 3. Механические свойства зоны некроза. 4. Величина постнагрузки, в том числе уровень АД, ОПСС, размеры полости ЛЖ 5. Величина преднагрузки (объем венозного возврата крови к сердцу). 6. Гиперактивация САС. 7. Гиперактивация РААС, в том числе тканевых РАС. 8. Гиперпродукция эндотелина и других вазоконстрикторных субстанций. Последние три фактора имеют особое значение для формирования компенсаторной гипертрофии интактного миокарда, развития кардиофиброза и дилатации ЛЖ. Поэтому ограничение активности САС, РААС и тканевых РАС с помощью- β адреноблокаторов, ингибиторов АПФ и некоторых других ЛС способно снизить выраженность процесса ремоделирования. Ремоделирование ЛЖ у больных трансмуральным ИМ приводит к повышению смертности больных, быстрому прогрессированию сердечной недостаточности, частому формированию аневризмы ЛЖ и повышению риска разрыва миокарда.
Функциональные и морфологические изменения других органов и систем определяются несколькими основными факторами: гипоксией органов, связанной с их гипоперфузией, обусловленной нарушениями насосной функции сердца (снижение сердечного выброса, ОЦК, системного АД); повышением давления в малом и венозном русле большого круга кровообращения, обусловленным левожелудочковой или правожелудочковой недостаточностью; активацией симпатико-адреналовой системы, РААС и тканевых РАС; активацией системы свертывания крови и агрегации тромбоцитов; системными нарушениями микроциркуляции.
Повышение давления в легочных венах и легочных капиллярах, обусловленное систолической и диастолической дисфункцией ЛЖ, ведет к увеличению объема внесосудистой жидкости, нарушениям легочной вентиляции и газообмена и развитию интерстициального отека легких. Снижение перфузии головного мозга сопровождается рядом неврологических проявлений, вплоть до развития ишемического инсульта. Нарушения перфузии почек при ИМ нередко сопровождаются протеинурией, микрогематурией, цилиндрурией. При кардиогенном шоке развивается острая почечная недостаточность.
Повышенная активность системы свертывания крови, характерная для больных ИМ, сопровождается выраженными гематологическими сдвигами, которые имеют значение не только для формирования тромбоза КА, но и для образования тромбоцитарных агрегатов в микроциркуляторном сосудистом русле. Чрезмерная активация САС, возникающая при ИМ, способствует усилению пе-
226
риферической вазоконстрикции и развитию тяжелых нарушений сердечного ритма.
8.4. КЛИНИЧЕСКАЯ КАРТИНА
В течении трансмурального ИМ (инфаркта с зубцом Q) принято выделять 5 периодов: продромальный; острейший; острый; подострый и постинфарктный периоды. Клиническая картина каждого из них складывается: изтипичных клинических проявлений неосложненного течения ИМ; клинической симптоматики многочисленных осложнений. Неосложненный ИМ - это условное понятие, поскольку в большинстве случаев трудно представить себе трансмуральное поражение ЛЖ, которое не сопровождалось минутуимальными признаками левожелудочковой недостаточности, нарушениями ритма сердца, рефлекторным коллапсом.
Продромальный период (предынфарктное состояние)
У большинства больных ИМ с зубцом Q (70-80%) процесс формирования тотальной тромботической окклюзии может занимать от2-х до 18 дней. В это время коронарное кровообращение характеризуется крайней нестабильностью и напоминутуает впервые возникшую стенокардию(нестабильного и быстро прогрессирующего течения); прогрессирующую стенокардию напряжения; спонтанные ангинозные приступы стенокардии покоя. Неверно полностью отождествлять симптоматику этого периода инфаркта с клинической картиной НС, поскольку только у 15-20% таких больных развивается ИМ.
Из всех проявлений НС особую настороженность должны вызывать следующие признаки: 1. Небольшое время (несколько часов или сутки), прошедшее с момента начала дестабилизации коронарного кровообращения. Именно
в этих случаях риск возникновения ИМ и/или внезапной сердечной смерти очень велик. Если нестабильная стенокардия продолжается2-3 недели, то менее вероятно, что эта клиническая картина относится к проявлениям предынфарктного состояния. 2. Чрезвычайно быстро прогрессирующая стенокардия
напряжения, |
сопровождающаяся |
резким |
снижением |
толерантности |
к физической нагрузке. 3. Тяжелые повторные ангинозные приступы стенокар- |
||||
дии покоя |
продолжительностью |
более20-30 минуту, сопровождающиеся |
||
одышкой, слабостью, потливостью, снижением АД 4. Результаты холтеровского мониторирования ЭКГ: увеличение частоты и общей длительности эпизодов преходящей болевой и безболевой депрессии сегмента RS-Т, а также появление
этих изменений при обычной для данного больного физической нагрузке и в покое. 5. Отрицательная динамика ЭКГ, зарегистрированной в покое, в виде депрессии сегмента RS-Т и/или инверсии зубца Т.
Острейший период
227
Это время от появления первых клинических и/или электрокардиографических признаков острой ишемии миокарда до начала формирования очага некроза (около 2-3 часов). На протяжении этого периода морфологические изменения в сердечной мышце еще обратимы, при своевременном применении тромболитических средств сохраняется возможность восстановления коронарного кровотока и предупреждения образования некроза миокарда. Первые клинические проявления ИМ связаны с завершением процесса полной тромботической окклюзии КА или с внезапным ее развитием(при отсутствии у больного признаков продромального периода). Различают несколько клинических вариантов начала ИМ: болевой (ангинозный) вариант начала (status anginosus); астматический вариант (status asthmaticus); абдоминутуальный вариант (status aβdominalis); аритмический вариант; цереброваскулярный вариант; малосимптомное (бессимптомное) начало ИМ. Астматический, абдоминутуальный, аритмический и цереброваскулярный варианты являются осложненной формой ИМ. Ниже приведена клиническая картина наиболее распространенного варианта начала ИМ - ангинозного, который наблюдается в80-95% всех случаев ИМ.
Жалобы
Приступ интенсивных болей в сердце является наиболее характерным клиническим признаком начала ИМ. Боль локализуется за грудиной, нередко распространяясь на всю прекардиальную область слева и справа от грудины. В большинстве случаев боль иррадиирует в левую руку, левое плечо, лопатку, шею, реже - в межлопаточное пространство, нижнюю челюсть, в обе руки. Интенсивность и характер боли обычно отличаются от приступа стенокардии: больные ИМ характеризуют ее как необычно сильную, мучительную, “жестокую” боль сжимающего, давящего, распирающего или жгучего характера, нередко сопровождающуюся страхом смерти. Боль возникает внезапно, быстро достигая максимальной интенсивности. Она не купируется при сублингвальном приеме нитроглицерина или изосорбида динитрата. Часто боль купируется только после применения наркотических анальгетиков(“предельная” или “морфинная” боль). Продолжительность боли в типичных случаях достигает 40-60 минуту, иногда сохраняясь часы и сутки, оправдывая свое название - status anginosus.
Боль при ИМ иногда может пройти самостоятельно, даже если больному не была оказана соответствующая медицинская помощь. Гораздо реже болевой синдром при ИМ может быть не столь интенсивным и продолжительным. В этих случаях боли могут быть вполне“терпимыми”, их продолжительность не превышает 15-20-30 минуту, иногда боли могут купироваться после приема нескольких таблеток нитроглицерина.
У большинства больных трансмуральным ИМ возникновение интенсивного болевого приступа сопровождается признаками болевого шока. Больные
228
жалуются на внезапно появившуюся резкую слабость, головокружение, выраженную потливость, сердцебиения (тахикардию), похолодание конечностей. Появляется апатия и адинамия, а в некоторых случаях даже кратковременное затемнение сознания. Отмечается снижение уровня АД. Описанные клинические признаки указывают на возникновение острой сосудистой недостаточности, развивающейся на высоте болевого синдрома. В результате рефлекторного расширения вен органов брюшной полости и скелетных мышц происходит депонирование крови в этих сосудистых областях, уменьшение притока крови к сердцу. Развивается гиповолемия, снижение АД и гипоперфузия головного мозга. Эта клиническая картина острой сосудистой недостаточности напоминутуает начальные клинические проявления истинного кардиогенного шока. Признаки рефлекторного болевого шока кратковременны, быстро, в течение нескольких минутуут, проходят самостоятельно или при применении лекарственных средств, повышающих сосудистый тонус.
Субъективные проявления острой левожелудочковой недостаточности наблюдаются более чем у половины больных трансмуральным ИМ, в том числе у пациентов с болевым(ангинозным) вариантом инфаркта. На фоне продолжающегося болевого приступа или после его купирования появляется ощущение нехватки воздуха, дыхательный дискомфорт, одышка, которые усиливаются в горизонтальном положении больного с низким изголовьем.
Эти признаки связаны с быстро развивающейся на фоне выраженной ишемии миокарда диастолической и систолической дисфункцией ЛЖ, повышением КДД в желудочке, среднего давления в ЛП и венах малого круга кровообращения и венозным застоем в легких. У большинства больных трансмуральным ИМ (до 90%) при мониторном наблюдении можно выявить разнообразные нарушения ритма и проводимости, в том числе возникающие в самый ранний период заболевания. Большинство из них сопровождаются жалобами больных на сердцебиения и перебои в работе сердца.
При астматическом варианте ИМ ведущей жалобой является приступ одышки, удушья, нехватки воздуха. Симптоматика обусловлена развитием острой левожелудочковой недостаточности (сердечной астмы или отека легких). Болевой синдром может быть не выражен. Отмечается цианоз, тахикардия. В легких выраженные застойные явления(жесткое дыхание, обилие мелко- и среднепузырчатых влажных хрипов). Этот вариант болезни чаще наблюдается при обширных и повторных ИМ, на фоне существующей недостаточности кровообращения, у больных пожилого и старческого возраста. Подобная форма встречается примерно у 20 % больных. Больной может воспринимать кашель и одышку как простудное заболевание и, не считая свое состояние опасным, вовремя не обращается за медицинской помощью.
Абдоминутуальный вариант заболевания чаще наблюдается при заднедиафрагмальном (нижнем) инфаркте. Для него характерны боли в верхней час-
229
ти живота, которые могут иррадиировать в лопатки, вдоль грудины, диспепсические явления - тошнота, рвота, метеоризм, а в ряде случаев понос или парез желудочно-кишечного тракта. При пальпации живота брюшная стенка болезненна и обычно напряжена. При абдоминутуальной форме ИМ клиническая картина очень напоминутуает острое заболевание пищеварительного тракта (пищевая токсикоинфекция, перфоративная язва желудка или двенадцатиперстной кишки, печеночная колика, острый панкреатит и др.). Неправильно поставленный диагноз бывает причиной ошибочной лечебной тактики(промывание желудка, операции). Правильной диагностике помогает запись и оценка электрокардиограммы.
Нарушения сердечного ритма возникают почти у всех больных инфарктом миокарда. Когда же в клинической картине заболевания они явно превалируют жалобы, связанные с нарушениями ритма и проводимости, говорят об аритмическом варианте ИМ. Наиболее часто этот вариант протекает в виде пароксизмальной тахиаритмии или полной атриовентрикулярной блокады. Заболевание сопровождается артериальной гипотонией, вплоть до аритмогенного шока. Развитие атриовентрикулярной блокады сопровождается брадикардией, может возникать потеря сознания(синдром Морганьи-Адамса-Стокса). Боли в области сердца при этом варианте могут отсутствовать.
Цереброваскулярный вариант ИМ характеризуется преобладанием симптомов нарушения мозгового кровообращения. Чаще всего речь идет об обмороке, головокружении, тошноте, рвоте (центрального генеза), а также очаговой неврологической симптоматике. Значительно реже, чем ишемия мозга возникают стойкие симптомы органической очаговой церебральной патологии. Подобное течение заболевания отмечается у лиц с резким атеросклерозом мозговых артерий. Развитие в результате инфаркта миокарда ишемии мозга может давать симптоматику, характерную для инсульта. Больные в этом случае госпитализируются в неврологическое отделение, а правильный диагноз устанавливают при развитии выраженных осложнений инфаркта миокарда.
Безболевые ИМ протекают как малосимптомные, бессимптомные, с развитием недостаточности кровообращения, аритмий. При тщательном опросе таких больных нередко можно установить, что боли небольшой интенсивности в области сердца были. Нередко безболевые ИМ выявляются случайно при электрокардиографическом исследовании. Причинами, нарушающими рецепцию боли являются атеросклероз церебральных сосудов, алкогольное опьянение, наркоз при оперативных вмешательствах. У больных ИМ с сопутствующим сахарным диабетом безболевой ИМ встречается примерно в11% случаев, при отсутствии нарушения углеводного обмена– в 2% (Качковский М.А., 1996). Проявлениями заболевания у этих больных могут быть общая слабость, ухудшение самочувствия. Иногда ИМ протекает под маской пневмонии, гриппа, развитием которых объясняется снижение артериального давления.
230
Атипичными формами ИМ являются случаи с необычной локализацией болей (в правой половине грудной клетки, спине или руках), которые не сопровождаются болями за грудиной или в области сердца.
Анамнез
В анамнезе у подавляющего большинства больных острым ИМ имеются указания на клинические проявления ИБС(стенокардия напряжения или покоя), а также на наличие тех или иных факторов риска, отягощающих течение инфаркта (АГ, ГЛП, курение, сахарный диабет, ожирение, отягощенная наследственность). Подробно следует расспросить больного или родственников о периоде, непосредственно предшествующем развитию ИМ(продромальном периоде), а также о факторах спровоцировавших развитие ИМ(чрезмерная физическая нагрузка, психоэмоциональное напряжение, инфекции).
Физикальное исследование
Целью физикального исследования больного ИМ является не столько установление диагноза ИМ, который подтверждается в основном данными лабораторногого и ЭКГ-исследования, сколько оценка функционального состояния сердечно-сосудистой системы и своевременная диагностика тяжелых осложнений инфаркта.
Осмотр. При общем осмотре обращает на себя внимание выраженное возбуждение и двигательное беспокойство больных, испытывающих в это время сильную боль. Они пытаются менять позу, иногда даже ходить по комнате, садиться в кресло, ложиться в постель в поисках положения, облегчающего страдания. Этот признак, характерный для больных ИМ, отличает их от пациентов со стенокардией, которые во время болевого приступа как бы застывают на месте. После купирования болевого синдрома возбуждение больных с развивающимся ИМ проходит.
Исключение составляют случаи прогрессирующей левожелудочковой недостаточности, сопровождающейся внезапно появившейся и быстро нарастающей одышкой и удушьем. При осмотре отмечаются бледность кожи, похолодание и выраженная потливость, указывающие на возможное развитие острой со-
судистой недостаточности и начальные клинические проявления истинного кардиогенного шока. В большинстве случаев определяется цианоз губ. Выраженный цианоз, положение ортопноэ в сочетании с влажными мелкопузырчатыми хрипами в нижних отделах легких и увеличением частоты дыхательных движений свидетельствуют о наличии острой левожелудочковой недостаточности.
Пальпация и перкуссия сердца. При пальпации сердца может отмечаться локальная болезненность в левой прекардиальной области. При перкуссии сколько-нибудь заметного расширения полости ЛЖ в острейший период забо-
231
левания выявить не . удаетсяИсключение составляют больные с предшествующими инфаркту заболеваниями, сопровождающимися дилатацией ЛЖ (АГ, атеросклеротический и постинфарктный кардиосклероз).
Аускультация сердца. В острейшем периоде ИМ у больных можно -вы явить несколько аускультативных феноменов: 1. Ослабление и приглушенность
I тона на верхушке, связанные с уменьшением сократимости ишемизированного миокарда ЛЖ. 2. Ослабление II тона, обусловленное замедлением раннего диастолического расслабления ЛЖ или снижением давления в аорте. При повышении давления в легочной артерии, обусловленном венозным застоем в малом круге кровообращения, определяется акцент II тона на легочной артерии.
У некоторых больных ИМ с выраженным атеросклеротическим уплотнением аорты можно выслушать акцент II тона на аорте. 3. Синусовая тахикардия, которая в первые2-3 ч от начала ИМ свидетельствует, скорее, не о наличии сердечной недостаточности, а о выраженной активации САС, происходящей на фоне болевого стресса. 4. Синусовая брадикардия, иногда выявляемая у больных ИМ, связана, наоборот, с преобладанием активности парасимпатической нервной системы и угнетением автоматизма СА-узла, что особенно часто наблюдается при ИМ заднедиафрагмальной области ЛЖ. В более редких случаях брадикардия может быть обусловлена СА-блокадой или АВ-блокадой II и даже III степени.
Артериальный пульс и АД. Артериальное давление в первые часы ИМ может возрастать. Это нередко связано с повышенной активностью САС, повышенной концентрацией катехоламинутуов в , кровипоявляющимися в результате болевого и психоэмоционального стресса. При развитии острой сосудистой недостаточности АД снижается за счет систолического АД. Одновременно наблюдается уменьшение наполнения, напряжения и величины артериального пульса, а также его учащение.
Острый период
Острый период ИМ соответствует времени формирования очага некроза и возникновения так называемого резорбционно-некротического синдрома, связанного с общей реакцией организма на всасывание (резорбцию) некротических масс в кровь. В этот период начинается также сложный процесс ремоделирования ЛЖ, сопровождающийся нарушением функционального состояния сердеч-
но-сосудистой системы. При неосложненном течении ИМ острый период обычно продолжается около 7-10 дней.
Жалобы. Боль в области сердца. При отсутствии осложнений боли в области сердца в этот период обычно не возникают. Сохранение болевого синдрома в течение нескольких дней от начала заболевания может свидетельствовать о дальнейшем распространении тромботического процесса в коронарной
232
системе и расширении зоны ишемического поражения сердечной мышцы или о вовлечении в патологический процесс перикарда. Лихорадка. На 2-3-й день заболевания повышается температура тела до 37,2-38°С и выше, что является одним из первых клинических признаков резорбционно-некротического синдрома. Лихорадка сохраняется обычно 3-4 дня, редко около 1 недели. Более длительное повышение температуры тела может указывать на развитие осложнений ИМ: пневмонии, тромбоэндокардита, инфаркта легкого Одышка и некоторые другие признаки левожелудочковой недостаточности нередко наблюдаются в остром периоде трансмурального ИМ, свидетельствуя о дисфункции ЛЖ. Чувство нехватки воздуха, небольшая тахикардия в течение короткого времени могут выявляться даже в тех случаях, которые расцениваются в целом как неосложненное течение инфаркта. В более тяжелых случаях может развиться интерстициальный или альвеолярный отек легких, который расценивают как очень серьезное осложнение ИМ. Аритмии. В остром периоде заболевания со-
храняется высокий риск возникновения разнообразных нарушений ритма и проводимости, в том числе пароксизмальной ЖТ и ФЖ. При неосложненном течении ИМ у больных могут сохраняться умеренно выраженная синусовая тахикардия или брадикардия, единичные экстрасистолы.
Физикальное исследование
Осмотр. Неосложненное течение острого периода ИМ не сопровождается какими-нибудь специфическими изменениями, выявляемыми при общем осмотре. При исследовании сердечно-сосудистой системы в этот период можно выявить небольшое снижение уровня систолического АД. Нередко выявляется умеренная синусовая тахикардия, обусловленная СН или связанная с наличием лихорадки. При перкуссии сердца можно выявить небольшое смещение влево левой границы относительной тупости, что может указывать на начавшееся ремоделирование ЛЖ, его дилатацию и снижение сократимости. При аускультации сердца I тон ослаблен, иногда значительно, что связано с резким снижением сократительной способности миокарда ЛЖ, его дилатацией или возникновением относительной недостаточности митрального клапана в результате поражения папиллярных мышц. В последнем случае ослаблениеI тона нередко сочетается с систолическим шумом на верхушке, проводящимся в левую подмышечную область.
Примерно у 1/3 больных ИМ в остром периоде можно выслушать протодиастолический или пресистолический ритмы галопа. Протодиастолический ритм галопа, обусловленный появлением патологического III тона сердца, свидетельствует о прогрессирующем падении сократимости ЛЖ и его объемной перегрузке. Диагностическое значение этого аускультативного феномена -по вышается при наличии других признаков левожелудочковой недостаточности (одышка, цианоз, влажные хрипы в легких). Иногда на верхушке сердца можно выслушать пресистолический ритм галопа, связанный с появлением патологического IV тона сердца, обусловленного повышением конечно-диастолического
233
давления в ЛЖ и выраженной диастолической ригидностью ишемизированного миокарда. На 2-4 сутки заболевания при аускультации можно выслушать шум трения перикарда, обусловленный вовлечением в патологический процесс листков перикарда (асептический перикардит), что рассматривается как осложнение ИМ. В более редких случаях на верхушке может появляться систолический шум, сочетающийся с ослаблением I тона, обусловленный поражением папиллярных мышц и развитием относительной недостаточности митрального клапана. Максимум шума определяется на верхушке. Шум проводится в левую подмышечную область.
Подострый период
Вподостром периоде ИМ постепенно формируется соединительнотканный рубец, замещающий некротические массы. Продолжается также процесс ремоделирования ЛЖ. Продолжительность подострого периода колеблется в широких пределах и зависит, прежде всего, от объема очага некроза, состояния окружающего миокарда, не вовлеченного в некротический процесс, степени развития коллатералей, наличия сопутствующих заболеваний и осложнений ИМ. Продолжительность подострого периода составляет 4-6 недель. Этот период протекает более спокойно и благоприятно, чем два предыдущих периода. Состояние больных постепенно стабилизируется. При неосложненном течении заболевания боли в сердце и тяжелые жизнеопасные нарушения ритма отсутствуют. Уменьшается частота возникновения экстрасистолии, синусовой тахикардии и других аритмий. У больных с признаками АВ-блокадI и II степени, развившимися в остром периоде, нередко восстанавливается атриовентрикулярная проводимость. Уменьшаются проявления сердечной недостаточности (одышка, тахикардия), если они имели место в остром периоде. При обширном поражении миокарда признаки застойной СН могут прогрессировать, особенно на фоне активизации режима больного. Нарастают одышка, тахикардия, отеки на ногах, увеличивается печень, сохраняются влажные хрипы в нижних отделах легких.
Вподостром периоде определяется тенденция к нормализации АД, но нередко уровень систолического АД оказывается ниже, чем до ИМ. При аускультации обычно сохраняется приглушенностьI тона на верхушке, протодиасто-
лический и пресистолический ритмы галопа выслушиваются реже. У больных с относительной недостаточностью митрального клапана, обусловленной дисфункцией клапанного аппарата(папиллярных мышц) продолжает выслушиваться систолический шум на верхушке. Шум трения перикарда отсутствует.
Постинфарктный период
В ближайшем постинфарктном периоде в области рубца увеличивается количество коллагена и завершается его уплотнение (консолидация рубца). Одновременно продолжается формирование ряда компенсаторных механизмов,
234
направленных на поддержание гемодинамики на должном уровне(гиперфункция и гипертрофия неповрежденного миокарда, умеренная дилатация ЛЖ, способствующая, согласно механизму Старлинга, некоторому увеличению сердечного выброса). Клиническая картина постинфарктного периода зависит от влияния многих факторов: объема постинфарктного рубца; функционального состояния окружающего миокарда; формирования компенсаторных механизмов сердечной деятельности; скорости дальнейшего прогрессирования коронарного атеросклероза. Если первые три фактора, по сути, определяют степень гемодинамических нарушений на протяжении2 - 6 мес. после ИМ, то в отдаленном постинфарктном периоде все большее значение приобретает дальнейшее прогрессирование коронарного атеросклероза, ведущего к новым нарушениям коронарного кровообращения (эпизодам нестабильной стенокардии, повторным ИМ, внезапной сердечной смерти).
В ближайшем постинфарктном периоде возможно возобновление стенокардии. Относительно редкие приступы стабильной стенокардии напряжения обычно возникают при многососудистом поражении коронарного русла и обусловлены преходящими нарушениями перфузии миокарда в бассейне так называемой “инфаркт-несвязанной КА”. Если же в этот период появляются частые ангинозные приступы, возникающие у больного при малейшей физической нагрузке, психоэмоциональном напряжении или в покое, это расценивают как один из вариантов нестабильной стенокардии(ранняя постинфарктная стенокардия), требующей неотложной терапии. Вторая группа субъективных симптомов, наблюдающихся у части больных в послеинфарктном периоде, связана с прогрессированием хронической сердечной недостаточности(одышка, тахикардия, отеки ног, нарастающая слабость, утомляемость). В постинфарктном
периоде сохраняется повышенный риск возникновения различных нарушений ритма и проводимости.
Данные объективного исследования, проведенного в постинфарктном периоде, нередко подтверждают ту или иную степень нарушения гемодинамики (влажные хрипы в легких, отеки, увеличение печени, цианоз, дилатация ЛЖ). Клиническая картина ИМ без зубцаQ (нетрансмурального) в целом соответствует описанным выше клиническим проявлениям острых коронарных синдромов. Основным клиническим проявлением ИМ без зубцаQ является болевой синдром. Боли носят характер затянувшихся более20-30 минуту приступов стенокардии покоя, плохо купирующихся нитроглицерином. Как правило, ангинозные приступы не достигают интенсивности, свойственной формирующемуся трансмуральному ИМ с зубцом Q, и больше напоминутуают стенокардию покоя, характерную для части больных НС.
Иногда загрудинная боль может сопровождаться остро наступающей слабостью, потливостью, одышкой, преходящими нарушениями ритма и проводимости и/или внезапными снижением АД. Реже ИМ без зубца Q манифестирует менее интенсивными, но более частыми приступами стенокардии напряжения,
235
быстрым снижением толерантности к физической нагрузке, больше напоминутуает симптоматику прогрессирующей НС. Во всех случаях отсутствие стойкого подъема сегментаRS-Т на фоне болевых приступов заставляет проводить дифференциальную диагностику между НС и ИМ без зубца Q.
Физикальное исследование дает мало информации, подтверждающей диагноз нетрансмурального ИМ, за исключением преходящего ослабления основных тонов сердца и появления дополнительных тонов (III или IV) во время возникновения ангинозного приступа. Иногда можно выявить преходящие нарушения сердечного ритма и различные изменения АД. Анализ клинических данных позволяет предположить развитие у больного ИБС острого коронарного синдрома. Однако для того, чтобы подтвердить или опровергнуть наличие ИМ без зубца Q, необходимо целенаправленное лабораторно-инструментальное исследование.
8.5. ЛАБОРАТОРНО - ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Основными клинико-лабораторными признаками, отражающими эти процессы, являются: 1. Повышение температуры тела (от субфебрильных цифр до 38,5-39°С). 2. Лейкоцитоз, не превышающий обычно 12-15х109/л. 3. Анэозинофилия. 4. Небольшой палочкоядерный сдвиг формулы крови влево. 5. Увеличение СОЭ. Выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Лейкоцитоз наблюдается не у всех больных ИМ. Это обусловлено различной реактивностью организма. По данным Л.Т. Малой и соавт. (1992) возможны нормореактивные ИМ, гипо- и гиперреактивные. При гипореактивном ИМ лейкоциты не достигают8х1012/л. По нашим данным (Качковский М.А., 1996), у этих больных медленно протекают репаративные процессы, часто формируется аневризма сердца. При сопутствующем сахарном диабете ИМ протекает как гипореактивный в73% случаев. Гиперреактивный ИМ проявляется значительным лейкоцитозом – 15х1012/л и более. Для него характерны развитие тяжелых осложнений: разрыв сердца, кардиогенный шок, сердечная астма; отёк лёгких.
Маркеры некроза миокарда
Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является повышение концентрации тропонина, Твходящего в состав тропомиозинового комплекса сократительного миокарда. В норме кардиоспецифические тропонины в крови не определяются или их концентрация не превышает самых минутуимальных значений, устанавливаемых отдельно для каж-
236

дой клинической лаборатории. Некроз кардиомиоцитов сопровождается сравнительно быстрым и значительным увеличением концентрации тропонина, Т концентрация которого начинает превышать верхнюю границу нормы уже через 2-4 ч после ангинозного приступа и сохраняется высоким в течение1-2 недель от начала инфаркта.
Очень чувствительным, но малоспецифичным маркером некроза является концентрация миоглобина в крови. Его повышение наблюдается через 2-4 часа после ангинозного приступа и сохраняется в течение24-48 часов после него.
Выход миоглобина из сердечной мышцы и повышение его концентрации в крови происходит еще до формирования очага некроза, на стадии выраженного ишемического повреждения сердечной мышцы. Увеличение концентрации миоглобина в крови может быть обусловлено и другими причинами(кроме инфаркта): болезнями и травмами скелетных мышц, большой физической нагрузкой, алкоголизмом, почечной недостаточностью. Изменения содержания миоглобина и тропонина при остром ИМ представлено в таблице 33.
Таблица 33. |
Изменение миоглобина, тропонина при остром инфаркте миокарда |
|||
|
|
|
|
|
Белок |
|
Начало повышения |
Пик увеличения |
Возвращение к |
|
|
концентрации, ч |
концентрации, ч |
норме, сутки |
Миоглобин |
|
2-4 |
4-8 |
2 |
Тропонин Т |
|
2-4 |
24-48 |
7-14 |
Не все клиники имеют возможность лабораторного определения концентрации тропонина Т и миоглобина в крови. Поэтому на практике сохраняет свое значение определение других, менее чувствительных и специфичных, маркеров некроза миокарда. Наиболее ценными в диагностике острого ИМ является МВфракция креатинфосфокиназы (МВ КФК). Основной причиной повышения активности ферментов в сыворотке крови является разрушение миокардиальных клеток и выход высвобождающихся клеточных ферментов в кровь. Динамика активности этих ферментов при остром ИМ представлена в таблице 34.
Таблица 34. Активность ферментов при остром инфаркте миокарда
Фермент |
Начало повыше- |
Пик увеличения |
Возвращение к |
|
ния активности, ч |
активности, ч |
норме, сутки |
МВ-фракция |
4-6 |
12-18 |
2-3 |
КФК |
|
|
|
КФК |
4-8 |
12-24 |
3-4 |
Специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ КФК). Ее активность начинает возрастать уже через 4-6 ч, достигает максимума через 12-18 часов и возвращается к исходным цифрам через 48-72 ч от начала ангинозного приступа. Особое значение придается ди-
237
намике активности фермента: достоверными признаками острого ИМ считают нарастание активности МВ КФК на25% в двух пробах, взятых с 4-х часовым интервалом или постепенное нарастание активности фермента на протяжении 24 часов. Информативным является повышение активности МВ КФК более1013 ЕД/л. Активность общей КФК при ИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в3-20 раз превышает норму, а через 3- 4 суток от начала заболевания возвращается к исходным значениям.
КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций(Беленков Ю.Н., Оганов Р.Г., 2007 и др.): 1. При внутримышечных инъекциях. 2. При тяжелой физической нагрузке. 3. После любого хирургического вмешательства. 4. У больных мышечной дистрофией, полимиозитом, миопатией. 5. При повреждениях скелетных мышц, при травмах, судорожном синдроме, длительной иммобилизации. 6. При инсультах и других повреждениях ткани головного мозга. 7. При гипотиреозе, акромегалии. 8. При пароксизмальных тахиаритмиях. 9. При миокардите. 10. При тромбоэмболии легочной артерии. 11. После проведения коронароангиографии. 12. После электроимпульсной терапии (кардиоверсии).
Повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию сопровождаются кратковременным подъемом активности МВ-фракции КФК. Повышение МВ КФК возможно при тяжелой пароксизмальной тахиаритмии, миокардитах, продолжительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
Степень повышения активности МВ КФК в крови коррелирует с размером ИМ. Чем больше объем поражения сердечной мышцы, тем выше активность МВ КФК. При обширном ИМ вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя площадь под кривой“концентрация - время” остается одинаковой. Эти данные послужили основанием для разработки методики неинвазивного определения массы некроза как функции площади под кривой изменения концентрации МВ КФК во времени. Активность этого фермента при остром ИМ нарастает медленнее, чем КФК и МВ КФК, дольше остается повышенной. Пик активности наступает обычно на 2-3 сутки от начала инфаркта, а возвращение к исходному уровню - только к 8-14 суткам.
238
В ряде случаев у больных ИМ не выявляется повышение активности ферментов сыворотки крови. Чаще это встречается у больных пожилого возраста с повторным ИМ при ухудшении оттока крови из зоны некроза через участки рубцовой ткани, имеющей плохое кровоснабжение. Ложноотрицательные результаты ферментной диагностики могут быть связаны со слишком быстрым однократным взятием крови до повышения уровня ферментов, так и с запоздалым проведением исследования через несколько суток. Наличие в сыворотке крови следов гепарина снижает активность МВ КФК. Хранение образцов крови также приводит к снижению активности ферментов. Ложноположительные ре-
зультаты могут быть обусловлены использование гемолизированной крови (выход ферментов из клеток крови), разведение сыворотки и плазмы крови вызывает повышение активности ферментов.
Инфаркт миокарда с зубцом Q
Нарушение |
коронарного |
кровообращения |
при |
ИМ |
прив |
к формированию трех зон патологических изменений: вокруг участка некроза |
|
||||
располагаются зоны ишемического повреждения и ишемии. В отведениях, ак- |
|
||||
тивный электрод которых расположен непосредствено над областью ИМ, каж- |
|
||||
дая из этих зон участвует в формировании следующих ЭКГ-изменений. 1. Зона |
|
||||
некроза - патологический зубец Q (продолжительностью больше 30 мс) и рез- |
|
||||
кое уменьшение амплитуды зубцаR или комплекс QS. 2. Зона ишемического |
|
||||
повреждения - смещение сегмента RS-T выше (при трансмуральном ИМ) или |
|
||||
ниже изолинии (при субэндокардиальном поражении сердечной мышцы). 3. Зо- |
|
||||
на ишемии - “коронарный” (равносторонний и остроконечный) зубец Т (высо- |
|
||||
кий положительный при субэндокардиальном ИМ, отрицательный - при транс- |
|
||||
муральном ИМ). ЭКГ изменяется в зависимости от времени, прошедшего от |
|
||||
начала формирования ИМ. |
|
|
|
|
|
Острейшая стадия (до 2 часов от начала ИМ). В течение нескольких ми- |
|
||||
нутуут после прекращения коронарного кровотока и возникновения ангинозно- |
|
||||
го приступа в сердечной мышце обычно выявляется зона субэндокардиальной |
|
||||
ишемии, для которой |
свойственно |
появление высоких |
коронарных |
зубцов |
Т |
и смещение сегмента RS-Т ниже изоэлектрической линии. На практике эти изменения по понятным причинам регистрируются достаточно редко, и врач имеет дело с более поздними электрокардиографическими признаками острейшей стадии ИМ. Когда зона ишемического повреждения распространяется до эпикарда, на ЭКГ фиксируется смещение сегмента RS-Т выше изолинии (трансмуральное ишемическое повреждение). Сегмент RS-Т сливается с положительным зубцом Т, образуя монофазную кривую, напоминутуающую по форме ТМПД.
Острая стадия характеризуется быстрым, в течение 1-2 суток, формированием патологического зубца Q или комплекса QS и снижением амплитуды зубца R, что указывает на образование и расширение зоны некроза. Одновременно в течение нескольких дней сохраняется смещение сегментаRS-T выше
239
изолинии и сливающегося с ним вначале положительного, а затем отрицательного зубца Т. Через несколько дней сегмент RS-T приближается к изолинии, а к концу 1-й недели или в начале 2-й недели заболевания становится изоэлектричным, что свидетельствует об уменьшении зоны ишемического повреждения. Отрицательный коронарный зубец Т резко углубляется и становится симметричным и заостренным (повторная инверсия зубца Т). В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20-25-х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS-T расположен на изолинии.
Рубцовая стадия ИМ характеризуется сохранением в течение многих лет патологического зубца Q или комплекса QS и наличием отрицательного, сглаженного или положительного зубца Т. Основными признаками острой стадии ИМ с зубцом Q являются: патологический зубец Q (или комплекс QS); элевация (подъем) сегмента RS-T и отрицательный (коронарный) зубец Т. В зависимости от локализации ИМ и его распространенности эти изменения обнаруживаются в различных ЭКГ-отведениях (таблица 35).
Таблица 35. ЭКГ-признаки инфаркта миокарда с зубцом Q
|
Отведения, где обнаруживают признаки ИМ |
|
Локализация ИМ |
Прямые признаки: пато- |
Реципрокные призна- |
логический Q (QS); эле- |
ки: депрессия RS-T; |
|
|
вация RS-T; отрицатель- |
высокий положитель- |
|
ный коронарный Т |
ный ;Т высокий R |
|
|
(при задних ИМ) |
Инфаркт |
миокарда передней стенки |
ЛЖ |
Переднеперегородочный |
V1 - V3 |
|
Передневерхушечный |
V3, V4 |
|
Переднебоковой |
I, aVL, V5, V6 |
|
Переднебазальный (высо- |
V24-V26 и/или V34-V36 |
|
кий передний) |
|
|
Распространенный перед- |
I, aVL, V1 - V6 |
III, aVF, II |
ний |
|
|
Инфаркт |
миокарда задней стенки |
ЛЖ |
Заднедиафрагмальный |
III, aVF, II |
|
(нижний) |
|
|
Заднебазальный |
V7 - V9 |
V1 - V3 |
Заднебоковой |
V5, V6, III, aVF |
|
Распространенный задний |
III, aVF, II, V5, V6, V7- |
V1 - V3 |
|
V9 |
|
Диагностика высоких передних ИМ возможна при использовании дополнительных отведений V24 - V26 и/или V34 - V36, электроды которых располагают
240
на 1-2 межреберья выше обычного уровняV4 - V6. При распространенном переднем ИМ в отведенияхIII и aVF нередко встречаются реципрокные изменения ЭКГ: депрессия сегмента RS-T и высокий положительный остроконечный и симметричный (коронарный) зубец Т. При заднебазальном ИМ типичные изменения можно выявить лишь в дополнительных отведениях V7 - V9 (не всегда).
Предположение о наличии заднебазального ИМ возникает при регистрации в обычных грудных отведениях V1 - V3 реципрокных изменений ЭКГ: увеличения амплитуды зубцов R, выраженной депрессии сегмента RS-T и формировании высоких положительных зубцов Т. Реципрокные изменения ЭКГ в грудных отведениях V1 - V3 нередко встречаются и при других локализациях ИМ задней стенки ЛЖ (особенно при распространенном заднем ИМ).
Инфаркт миокарда без зубца Q
Характеризуется развитием в миокарде нетрансмуральных очагов некроза, локализующихся субэндокардиально или интрамурально. В отличие от трансмурального ИМ эти очаги некроза не нарушают процесс распространения по сердцу волны деполяризации, поэтому патологический зубецQ или комплекс QS отсутствуют. Значительные нарушения обнаруживаются в период формирования сегмента RS-T и во время фазы конечной реполяризации желудочков (зубец Т).
Типичными ЭКГ-признаками: смещение сегмента RS-T ниже изолинии (в редких случаях возможна элевация сегмента RS-Т); разнообразные патологические изменения зубца Т(чаще отрицательный симметричный и заостренный коронарный зубец Т); появление этих изменений на ЭКГ после длительного и интенсивного болевого приступа и их сохранение в течение2-5 недель. Диагностика локализации ИМ без зубцаQ основана на тех же принципах, что и трансмурального ИМ. Всем больным ИМ, госпитализированным в реанимационное отделение, проводится мониторный контроль ЭКГ, ЧСС, АД и других гемодинамических параметров. Используют современные системы автоматического мониторного контроля за состоянием сердечно-сосудистой системы, снабженные специальными сигнальными устройствами, срабатывающими при возникновении критических ситуаций и осложнений, жизнеопасных аритмий.
Эхокардиография относится к числу обязательных методов исследования, которые используются в диагностике острого ИМ, для оценки гемодинамических и структурных нарушений. Применение двухмерной, одномерной и допплер-эхокардиографии при ИМ позволяет выявить локальные нарушения сократимости ЛЖ; количественно оценить систолическую и диастолическую функции ЛЖ; выявить признаки ремоделирования ЛЖ и признаки аневризмы ЛЖ; оценить состояние клапанного аппарата и наличие относительной недостаточности митрального клапана или дефекта МЖП; оценить уровень давления в ЛА и признаки легочной гипертензии; выявить морфологические изменения
241
перикарда и наличие внутрисердечных тромбов; оценить морфологические и функциональные изменения магистральных и периферических артерий и вен.
Выявление нарушений локальной сократимости ЛЖ является надежным способом топической диагностики ИМ с зубцомQ. Признаки гипокинезии, акинезии или дискинезии обнаруживают у95% больных трансмуральным ИМ и несколько реже при ИМ без зубцаQ. В последнем случае обычно выявляется гипокинезия одного или нескольких сегментов ЛЖ. Отсутствие признаков на-
рушения региональной сократимости ЛЖ практически исключает наличие у больного трансмурального инфаркта миокарда (инфаркта с зубцом Q).
Причинами локальных нарушений сократимости ЛЖ, помимо острого ИМ, могут быть: постинфарктный кардиосклероз; преходящая болевая или безболевая ишемия миокарда ЛЖ, в том числе у больных с хроническими формами ИБС; гибернирующий и“оглушенный” миокард; дилатационная кардиомиопатия (ДКМП); гипертрофическая кардиомиопатия (ГКМП). Результаты ЭхоКГ следует оценивать в динамике, сопоставляя с клинической картиной и данными других инструментальных исследований.
Эхокардиографическая оценка систолической функции ЛЖ проводится с использованием нескольких методов. Наиболее приемлемыми из них считаются метод дисков (по Simpson), метод “площадь-длина”, а также метод доп- плер-ЭхоКГ. Снижение ФВ до 40% и менее расценивается как один из важных критериев неблагоприятного прогноза ИМ. Диастолическая функция ЛЖ. Нарушения диастолической функции ЛЖ выявляются практически у всех больных ИМ с зубцом Q и у части пациентов с нетрансмуральным ИМ. В основе диастолической дисфункции ЛЖ при ИМ лежит увеличение ригидности(снижение растяжимости) ишемизированного и некротизированного миокарда желудочка. Оценку диастолической функции ЛЖ проводят с использованием допплерэхокардиографии по методике, описанной ранее.
Изучают отдельные показатели трансмитрального диастолического потока крови. При ИМ часто наблюдаются признаки диастолической дисфункцииI типа (тип замедленной релаксации ЛЖ), которая характеризуется снижением скорости изоволюмического расслабления и объема раннего диастолического наполнения (Рeak Е). Увеличиваются скорость и объем кровотока во время систолы предсердия (Рeak А). На допплер-кардиограммах трансмитрального кровотока определяются снижение амплитуды пика Е, увеличение высоты пика А.
Это свидетельствует о том, что бульшая часть диастолического кровотока вследствие нарушения податливости стенки ЛЖ осуществляется во время -ак тивной систолы ЛП.
Допплер-эхокардиографические признаки диастолической дисфункции ЛЖ при остром ИМ ассоциируются с более высоким риском возникновения застоя крови в малом круге кровообращения. Регистрация допплер-
242
эхокардиограмм систолического потока крови в выносящем тракте левого и правого желудочков позволяет неинвазивно определять величину сердечного выброса, ФВ и уровень давления в легочной артерии. Для диагностики аневризмы ЛЖ, перикардита, острой недостаточности митрального клапана и других осложнений чаще используют эхокардиографию.
Сцинтиграфия миокарда с 99mТс-пирофосфатом применяется для визуализации очагов инфаркта миокарда, поскольку это радиоактивное вещество избирательно накапливается в некротизированной ткани сердечной мышцы в том случае, если в зоне поражения сохраняется10-40% кровотока, необходимого для доставки технеция к очагу некроза. Сцинтиграммы регистрируют в трех cтандартных проекциях через 90 минуту после внутривенного введения индикатора. Это время необходимо для очищения крови от индикатора за счет -по глощения его костной и некротизированной тканью.
Анализ сцинтиграмм проводят после процедуры накопления импульсов излучения и процедуры вычитания фона. Очаг острого инфаркта миокарда выявляется с помощью этой методики уже через24 ч от начала заболевания. При обычном течении инфаркта очаг некроза визуализируется вплоть до8-10 дня болезни. Если же технеций продолжает накапливаться в сердечной мышце на 2- 3-й неделе от начала заболевания, это свидетельствует о замедлении репаративных процессов, затяжном течении инфаркта или развитии постинфарктной аневризмы.
У больных ИМ с зубцомQ, |
госпитализированных в кардиореанимацион- |
ное отделение, рентгенография |
органов грудной клетки осуществляется |
с целью своевременной диагностики интерстициального отека легких и других осложнений заболевания (пневмонии, инфаркта легкого, гидроторакса, выпота
вперикард). Исследование проводится с помощью специальных портативных рентгеновских аппаратов непосредственно в кардиореанимационном отделении
вположении больного лежа на спине.
Селективную коронароангиографию (КАГ) у больных острым ИМ осуществляют в тех случаях, когда предполагается оперативное вмешательство на коронарных сосудах - чрескожная транслюминутуальная ангиопластика или аор- то-коронарное шунтирование. Полученные при КАГ данные очень важны при выборе метода хирургической коррекции обструктивных поражений КА. Поскольку при выполнении КАГ производят левую вентрикулографию, это позво-
ляет оценить также ряд важных гемодинамических пар и верифицировать некоторые тяжелые осложнения ИМ(аневризму ЛЖ, разрыв МЖП).
Показаниями к экстренной КАГ с последующей хирургической коррекцией у больных острым ИМ являются: кардиогенный шок; тяжелая левожелудочковая недостаточность, особенно если она сочетается с острой митральной
243
недостаточностью или разрывом межжелудочковой перегородки; повторные эпизоды угрожающих жизни желудочковых аритмий(желудочковая тахикардия, фибрилляция желудочков); ранняя постинфарктная стенокардия. В последние годы в крупных кардиологических центрах существенно расширены показания для проведения экстренной КАГ. Исследование осуществляется теперь многим больным острым ИМ, госпитализированным в ранние сроки от начала заболевания (4-6 часа), с целью восстановления коронарного кровотока или ограничения зоны некроза с помощью селективного интракоронарного введения тромболитиков или хирургической коррекции кровообращения в КА.
8.6. ЛЕЧЕНИЕ
Современная лечебная программа больных ИМ включает: специализированные кардиологические бригады скорой помощи (догоспитальный этап), оказывающие первую врачебную помощь; кардиологические отделения с блоком интенсивной терапии или отделением кардиореанимации; специализированные реабилитационные центры; кардиологические консультативно-диагностические центры и кардиологические кабинеты поликлиник(диспансеризация больных,
перенесших |
ИМ). |
Основными |
целями |
лечения больных |
на догоспитальном |
и госпитальном этапах являются: 1. Ранняя реперфузия миокарда или коронар- |
|||||
ная реваскуляризация, а также предотвращение дальнейшего тромбообразова- |
|||||
ния. 2. Ограничение очага |
некроза |
и периинфарктной |
ишемической зоны |
||
с помощью гемодинамической и метаболической разгрузки сердца. 3. Преду- |
|||||
преждение |
или |
скорейшее |
устранение осложнений. |
4ИМ. Физическая |
|
и психологическая реабилитация больных ИМ. |
|
||||
Все больные с подозрением на наличие формирующегося ИМ с зубцом Q, пациенты с острым коронарным синдромом и стойким подъемом сегментаRS- Т, должны быть незамедлительно госпитализированы в блок интенсивной терапии специализированных кардиологических отделений. Базисная терапия, которая осуществляется у всех больных ИМ с зубцомQ, независимо от наличия или отсутствия тех или иных осложнений, включает следующие мероприятия: купирование боли (анальгезия); тромболитическая терапия (естественно, с учетом индивидуальных показаний и противопоказаний); антитромботическая и антиагрегантная терапия; оксигенотерапия; применение антиишемических ЛС; применение ингибиторов АПФ и антагонистов рецепторов к ангиотензину II. Основные принципы базисной терапии ИМ с зубцомQ (терапии неосложненного ИМ) напоминутуают таковые у больных НС.
Купирование боли
Купирование ангинозного приступа является обязательным условием всех дальнейших лечебных мероприятий. Сохраняющася ангинозная боль поддерживает гиперактивацию САС, которая сопровождается тахикардией, поло-
жительным |
инотропным действием, увеличением потребности миокарда |
в кислороде |
и приводит, в конечном счете, к увеличению зоны инфаркта. На |
фоне активации САС понижается порог фибрилляции желудочков, что само по
244
себе может иметь фатальные последствия. Если отсутствуют признаки резкого падения сердечного выброса и АД (удовлетворительное наполнение артериального пульса и приемлемые цифры АД), больному рекомендуют повторный прием нитроглицерина сублингвально или ингаляционное орошение слизистой полости рта аэрозолем нитроглицерина или изосорбида динитрата. Эти простые мероприятия должны быть проведены при первом контакте больного с врачом, еще до регистрации ЭКГ.
Классическим средством купирования боли у больных ИМ является применение наркотических анальгетиков. Морфин, являющийся агонистом опиоидных рецепторов, помимо быстрого купирования боли, уменьшает венозный тонус и, следовательно, снижает венозный возврат крови к сердцу, величину преднагрузки и потребность миокарда в кислороде. Морфин обладает также выраженным седативным эффектом, оказывает выраженное ваготоническое действие, вызывает синусовую брадикардию и артериальную гипотонию.
У больных с острым коронарным синдромом морфин вводится внутривенно в первоначальной дозе2-4 мг, а затем по 2-6 мг каждые 10-15 минуту (суммарно не более 20-30 мг) вплоть до купирования боли или появления побочных эффектов: тошноты, рвоты, синусовой брадикардии; артериальной гипотензии; признаков угнетения дыхательного центра. Ваготонические побочные эффекты сравнительно легко устраняются внутривенным введением(0,5- 1,0 мл) 0,1% раствора атропина сульфата, а признаки угнетения дыхательного центра - внутривенным введением 0,1-0,2 мг налоксона. При отсутствии эффекта от применения морфина и сохранении болевого синдрома показано внутри-
венное капельное введение растворов нитроглицерина - и/или адреноблокаторов, которые способствуют гемодинамической разгрузке сердца и уменьшению потребности миокарда в кислороде. Нитроглицерин (0,1% раствор) вводят внутривенно капельно. Начальная скорость внутривенной инфузии раствора нитроглицерина составляет 10 мкг/минуту. Затем она увеличивается
на 10 мкг/минуту каждые 3-5 минуту до появления реакции АД или изменения |
|
симптоматики. Систолическое АД не должно |
быть ниже110 мм. рт. ст. или |
у больного с артериальной гипертензией - на 25% |
ниже исходного уровня. |
β-адреноблокаторы. Внутривенное введение β-адреноблокаторов в ост-
рейшем периоде |
ИМ |
может способствовать купированию болевого синдрома |
и ограничению |
зоны |
некроза. β-адреноблокаторы уменьшают сократимость |
и потребность миокарда в кислороде, ослабляют влияние катехоламинутуов на сердце, снижают ЧСС, АД, повышают порог фибрилляции желудочков и предупреждают возникновение суправентрикулярных нарушений ритма. Рекомен-
дуется использовать кардиоселективные β -адреноблокаторы (метопролол, ате-
1
нолол). Метопролол вводят внутривенно в дозе 5 мг с 5-минутуутным интервалом (до 3 раз, если ЧСС сохраняется не ниже55-60 уд. в минуту и систолическое АД выше100 мм рт. ст.). В последующем целесообразно перейти на пероральный прием метопролола в дозе50 мг 2 раза в день в течение
245
первых 48 ч, а затем по 100 мг 2 раза в сутки. Атенолол вводят внутривенно медленно в дозе 5 мг в течение 5 минуту. При необходимости через 10 минуту возможно повторное внутривенное введение5 мг атенолола, если отсутствует уменьшение ЧСС и АД. Еще через 10 минуту атенолол назначают внутрь в дозе 50 мг. В последующем препарат принимают внутрь в дозе50-100 мг 1-2 раза в сутки.
Противопоказания к применению β-адреноблокаторов у больных ИМ: наличие признаков застойной сердечной недостаточности(в том числе влажных хрипов в нижних отделах легких); ЧСС менее 60 в минуту; АВ-блокада II, III и I степени при Р-Q(R) более 0,24 с; систолическое АД меньше 90 мм рт. ст.; наличие сопутствующей бронхиальной астмы; хронический обструктивный бронхит при наличии сухих свистящих хрипов в легких(один из признаков бронхиальной обструкции).
Оксигенотерапия
Оксигенотерапия показана всем больным ИМ с зубцомQ. Применение кислорода через маску или интраназальный катетер позволяет увеличить насыщение артериальной крови кислородом(SаO2) выше 90%, что приводит к увеличению его диффузии в область ишемизированного миокарда из близлежащих интактных участков сердечной мышцы, способствуя уменьшению размеров зоны ишемического повреждения(периинфарктной зоны). Оксигенотерапия показана больным ИМ по меньшей мере на протяжении первых 1-2 суток после госпитализации в блок интенсивной терапии. В последующем кислород используется у пациентов с осложненным течением ИМ при наличии признаков застойной сердечной недостаточности, при кардиогенном шоке, рецидивирующих приступах ангинозных болей.
Антитромбоцитарные средства
Обязательным условием ведения больных ИМ является назначение антитромбоцитарных ЛС. Чаще всего назначают аспирин в дозе не выше325 мг в сутки. При первом же контакте с больным рекомендуют разжевать таблетку аспирина без оболочки (250-325 мг), если этого не было сделано раньше. При наличии противопоказаний к его применению возможно использование тиклопидина или клопидогреля, являющихся ингибиторами АДФ-рецепторов тромбоцитов. Эффективным является также сочетание приема аспирина и клопидогреля. В нескольких клинических исследованиях продемонстрирована эффективность внутривенного введения блокаторов гликопротеиновыхIIβ/IIIа рецепторов тромбоцитов, особенно у тех пациентов, у которых по экстренным показаниям проводится тромболитическая терапия, коронарная ангиопластика или аорто-коронарное шунтирование.
Гепарин. Является эффективным непрямым ингибитором тромбина, оказывающим свое антитромботическое действие благодаря активации физиологи-
246
ческого антикоагулянта - антитромбина III. Назначение гепарина при остром коронарном синдроме с подъемом сегмента RS-Т, в том числе при ИМ с зубцом Q, оправдано прежде всего как средства, препятствующего дальнейшему тромбообразованию в КА и уменьшающего частоту венозного и внутрижелудочкового пристеночного тромбоза с последующим развитием тромбоэмболических осложнений. Методика применения, побочные эффекты и противопоказания к лечению нефракционированным и низкомолекулярными гепаринами подробно изложены далее.
Антиишемические препараты. Антиишемические препараты широко применяют при лечении больных ИМ с зубцомQ. Благодаря эффективной гемодинамической разгрузке сердца, они способствуют ограничению размеров ИМ, в первую очередь, размеров периинфарктной зоны. Последняя представляет собой участки сохранившего свою жизнеспособность миокарда, которые непосредственно граничат с зоной некроза. Наиболее целесообразно назначение больным ИМ двух групп ЛС, обладающих свойством ограничивать периинфарктную зону: β-адреноблокаторов и нитратов.
β-адреноблокаторы. При отсутствии противопоказанийадреноблокаторы рекомендуется назначать всем больным ИМ. Положительное действие этих препаратов при ИМ связано с их отрицательным инотропным и хронотропным действием, сопровождающимся снижением потребности миокарда в кислороде и урежением сердечных сокращений. Это до некоторой степени дает возможность поддерживать жизнеспособность миокарда периинфарктной зоны , итем самым, ограничивать площадь инфаркта. β- адреноблокаторы повышают порог фибрилляции, что уменьшает риск возникновения фатальных нарушений сердечного ритма.
Воздействие β-адреноблокаторов на активность САС и РААС сопровождается замедлением процесса ремоделирования ЛЖ и оказывает существенное влияние на выживаемость больных в ближайшем и отдаленном периодах ИМ. Выбор β-адреноблокатора, оптимальных суточных доз основан на тех же принципах, которые используются при лечении больных НС.
Нитраты. Применяются у больных ИМ с целью гемодинамической разгрузки ЛЖ и уменьшения потребности миокарда в кислороде. Доказано положительное действие нитратов на величину периинфарктной зоны и уменьшение или купирование болей в области сердца, одышки и других признаков левожелудочковой недостаточности. После внутривенной инфузии раствора нитроглицерина показан переход на применение других лекарственных форм нитратов. Используют таблетированные формы короткодействующих и пролонгированных, нитратов, предусматривая ежедневно 8-10-часовой “безнитратный” период для снижения толерантности к этим препаратам.
Метаболические препараты
247
Применение у больных ИБС препаратов, обладающих свойством оптимизировать энергетический обмен ишемизированной сердечной мышцы, оказывает существенное влияние на сохранение жизнеспособности миокарда, находящегося в условиях дефицита кислорода и основных энергетических субстратов. В настоящее время у больных ИМ используют два способа активного воздействия на метаболизм миокарда: применение триметазидина (предуктала) и внутривенное капельное введение глюкозо-инсулино-калиевой смеси. Триметазидин обладает прямым цитопротекторным эффектом, реализуемым на уровне кардиомиоцита и субклеточных структур. При ХИБС происходит увеличение интенсивности β-окисления ЖК, уменьшается интенсивность окислительного фосфорилирования. Это сопровождается отчетливым антиишемическим эффектом. Триметазидин назначают в обычной терапевтической дозе по1 таблетке 3 раза в день.
Ингибиторы АПФ
В последнее время ингибиторы АПФ все шире используют для лечения больных острым ИМ и пациентов с постинфарктным кардиосклерозом, в первую очередь, с целью профилактики прогрессирования дисфункции ЛЖ. Помимо оптимизации уровня АД, величины постнагрузки и преднагрузки, уменьшения продукции альдостерона и задержки натрия и воды, ингибиторы АПФ способны ограничивать неблагоприятные последствия быстрого ремоделирования сердца у больных ИМ. Ингибиторы АПФ уменьшают влияние тканевого ангиотензина II на процессы гипертрофии кардиомиоцитов, интерстициального фиброза, улучшают функцию эндотелия, повышая продукцию вазодилатирующих субстанций и способствуя увеличению коронарного резерва. Ин-
гибиторы АПФ способствуют стабилизации атеросклеротической бляшки и уменьшению частоты возникновения повторного ОКС.
По данным нескольких кооперативных исследований, применение ингибиторов АПФ у больных, перенесших ИМ, приводит к достоверному уменьшению (на 11-27%) числа повторных ИМ и эпизодов нестабильной стенокардии, частоты развития сердечной недостаточности и общей летальности больных. Показано, что наилучшие результаты лечения ингибиторами АПФ наблюдаются у больных “высокого риска”, а именно: при наличии клинических признаков сердечной недостаточности; при значительной дилатации ЛЖ; при ФВ ЛЖ меньше 40% (независимо от наличия или отсутствия клинических признаков СН); при переднем ИМ; при обширном ИМ любой локализации, если зона акинезии (по данным ЭхоКГ) превышает 20%. Именно у этих больных наиболее показано раннее назначение ингибиторов АПФ - на 3-й день от начала инфаркта. Методика лечения ингибиторами АПФ, побочные эффекты и противопоказания подробно описаны ранее.
Тромболитическая терапия
248
Тромболитическая терапия является основным методом восстановления коронарного кровотока (реперфузии) у больных острым коронарным синдромом со стойким подъемом сегментаRS-Т. Многочисленные широкомасштаб-
ные рандомизированные исследования продемонстрировали существенное снижение летальности больных ИМ(до 20%). Причем тромболизис оказался наиболее эффективным в ранние сроки ИМ, особенно в течение первого часа
смомента возникновения ангинозного приступа(исследование GISSI, 2003). Раннее внутривенное введение различных фибринолитических препаратов, обладающих способностью растворять фибриновый тромб, позволяет эффективно восстанавливать коронарный кровоток у большинства больных ИМ. Наилучшие результаты получают у больных первичным ИМ передней локализации. При повторном ИМ снижение летальности в результате внутривенного тромболизиса менее заметно (GISSI, 2003). Важно еще раз подчеркнуть, что у больных
склинической картиной острого коронарного синдрома без стойкого подъема сегмента RS-Т (при депрессии сегмента или/и инверсии зубцов) наТ фоне тромболизиса выявляется тенденция к повышению смертности. Поэтому таким больным тромболизис в настоящее время не проводят.
Ворганизме больного ИБС происходит внутрисосудистая агрегация тромбоцитов и “запускается” процесс тромбообразования. Этот процесс находится под контролем сложной фибринолитической системы, системы физиологических антикоагулянтов, что в большинстве случаев прерывает этот процесс на его ранних стадиях. Это доказывается результатами коронароангиографиче-
ских исследований у больных трансмуральным ИМ с зубцомQ. Если КАГ про-
водят в течение первых4-х часов от начала заболевания, окклюзия КА обнаруживается почти у 90% больных. При обследовании в период от 12 до 24 ч эта цифра снижается до 65%. Механизм активации фибринолиза осуществляется с помощью тканевых активаторов плазминутуогена, содержащихся в сосудистом эндотелии, эритроцитах, тромбоцитах, лейкоцитах, моче (урокиназа, образующаяся в юкстагломерулярном аппарате почек), желчи, слюне. Основным внешним активатором плазминутуогена является активатор тканевого типа (тканевой активатор плазминутуогенаТАП), который синтезируется в сосудистом эндотелии при любом повреждении сосуда, его закупорке тромбом, при интенсивном сжатии, а также под влиянием вазоактивных веществ и некоторых лекарственных препаратов(адреналина, норадреналина, никотиновой кислоты).
Внешними активаторами плазминутуогена могут служить также урокиназа, стрептокиназа и другие аналогичные вещества, вводимые парентерально при лечении больных с тромбозами и тромбоэмболиями. Активация фибринолитической системы в подавляющем большинстве случаев вторична и возникает как следствие тромбозов, тромбоэмболий или ДВС-синдрома. Помимо активаторов фибринолиза существуют и ингибиторы превращения плазминутуогена в плазминуту, к которым относятся быстродействующийa2-антиплазминуту, антитрипсин, a2-макроглобулин, Cl-эстеразный ингибитор. Мощным ингибито-
249
ром фибринолиза является синтетическая e-аминокапроновая кислота. Все препараты, используемые в настоящее время для тромболизиса у больных ИМ, относятся к активаторам эндогенного плазминогена.
Стрептокиназа - непрямой активатор плазминутуогена, получаемый из культуры β-гемолитического стрептококка группы С. Стрептокиназа образует в крови ковалентную связь с плазминутуогеном, активируя его превращение в плазминуту. Стрептокиназа, помимо воздействия на фибрин тромба, оказывает выраженное системное фибринолитическое действие. Урокиназа - фермент, непосредственно активирующий превращение плазминогена в плазмин. Препарат получают из культуры почек человеческого эмбриона. Алтеплаза - представляет собой тканевой активатор плазминутуогена(ТАП), который продуцируетсяэндотелиальными клетками сосудов. Активация ТАП в сосудистом русле происходит под действием плазминутуа, трипсина, калликреина или активированного фактора Х свертывающей системы крови. В отличие от стрептокиназы обладает сродством к фибрину, поэтому избирательно действует в области фибринного тромба, проявляя свойства фибриноселективности или фибриноспецифичности. Это положительное свойство алтеплазы объясняет высокую эффективность препарата.
Показания и противопоказания к тромболизису
Ранняя реперфузия миокарда, проведенная в пределах 4-6 ч от начала заболевания, существенно увеличивает выживаемость больных ИМ. Принимая решение о целесообразности проведения тромболизиса, необходимо оценить риск от тромболитической терапии. Максимальный эффект может быть достигнут у пациентов с высоким риском летального исхода при обычном течении ИМ.
К числу таких больных относятся: пациенты с передним трансмуральным ИМ, если имеется значительный подъем сегментаRS-Т в грудных отведениях; пациенты с нижним трансмуральным ИМ, если имеется значительный подъем RS-Т в отведениях III, aVF, II в сочетании с реципрокной депрессией сегмента RS-Т в грудных отведениях; пациенты с острым ИМ и“новой” блокадой левой ножки пучка Гиса. Несколько клинических ситуаций увеличивают риск летального исхода при обычном течении ИМ и делают целесообразным проведение тромболитической терапии: прогрессирующая сердечная недостаточность с признаками застоя в легких; отек легких; кардиогенный шок; перенесенный ранее ИМ; ИМ правого желудочка; наличие сахарного диабета.
Основанием для такого решения в большинстве случаев являются клинические данные, выраженный подъем сегмента RS-Т на ЭКГ, зарегистрированной у вновь поступившего больного с болями в сердце. Как правило, в этот момент еще отсутствует патологический зубецQ. В этих случаях не следует дожидаться лабораторного подтверждения диагноза ИМ или появления патологи-
250

ческого зубца Q на ЭКГ, поскольку это ведет к непростительной потере времени и быстро уменьшает шансы положительного эффекта реперфузионной терапии.
Раннее появление на ЭКГ патологического зубцаQ у больного с распространенной ишемией может свидетельствовать о резком падении электрической активности ишемизированного участка сердечной мышцы, обусловленном наличием в этой области гибернирующего миокарда, который сохранил свою жизнеспособность. В таблице 36 представлены противопоказания к назначению тромболитической терапии.
Таблица 36. Противопоказания к тромболитической терапии
Абсолютные противопоказания
Продолжающееся внутреннее кровотечение
Мозговой инсульт в анамнезе
Недавняя (менее 2-х мес назад) внутричерепная или внутриспинальная травма или хирургическое вмешательство
Внутричерепная опухоль, артериовенозные шунты или аневризма
Определенный геморрагический диатез
Тяжелая неконтролируемая АГ
Относительные противопоказания
Недавнее (не более 10 дней назад) “большое” хирургическое вмешательство (АКШ, акушерское пособие, биопсия органов)
Церебрососудистая болезнь головного мозга Недавнее желудочно-кишечное кровотечение или генитально-урологическое кровотечение (менее 10 дней назад)
Недавняя травма (менее 10 дней назад)
Артериальная гипертензия: систолическое АД не менее 180 мм рт. ст. и/или диастолическое АД не менее 110 мм рт. ст.
Высокая вероятность наличия тромбоза (стеноз левого атриовентрикулярного отверстия или наличие мерцательной аритмии)
Острый перикардит
Подострый инфекционный эндокардит
Дефекты системы гемостаза, включая те из них, которые связаны с тяжелой дисфункцией печени или почек
Выраженная печеночная недостаточность
Беременность
Диабетическая геморрагическая ретинопатия или иные геморрагические офтальмологические состояния
Септический тромбофлебит или тромбированный атриовентрикулярный катетер в области с высоким риском инфицирования
Возраст старше 75 лет
Продолжающаяся пероральная терапия антикоагулянтами (варфарином)
251

Любое другое состояние, при котором кровотечение представляет собой серьезную угрозу или может стать особенно сложным для диагностики
илечения по причине локализации своего источника
Убольного с высоким риском летального исхода и наличием одного из относительных противопоказаний тромболитическая терапия не исключается полностью. Если польза от такой терапии превышает риск кровотечения или
кровоизлияния, то в |
ряде случаев целесообразно использовать имеющийся |
шанс спасти больного. |
|
Тромболизис
Проводится не позднее 12 ч от начала заболевания. Стрептокиназу вводят внутривенно капельно в дозе 1,5 млн ЕД в 100 мл 0,9% раствора натрия хлорида в течение 30-60 минуту. Стрептокиназа - хорошо изученный и относительно недорогой препарат. Отличается сравнительно низким риском кровоизлияния в мозг и реокклюзии. При применении стрептокиназы отмечается более медленный и менее полный лизис тромба. Введение стрептокиназы сопровождается артериальной гипотензией, аллергическими реакциями. Стрептокиназа может повторно вводиться не раньше чем через 6 месяев.
Алтеплаза отличается более высокой эффективностью тромболизиса, что связано с быстрым и полным тромболизисом, не вызывает аллергических реакций и снижения уровня АД. Ее применение сопровождается кровоизлиянием в мозг и ассоциируется с повышенным риском реокклюзии КА(в 1,5-2 раза). Алтеплазу вводят внутривенно болюсно в дозе15 мг, после чего продолжают внутривенную инфузию препарата, вначале (в течение 30 минуту) в дозе 0,75 мг на 1 кг массы тела, а затем (в течение еще 60 минуту) в дозе 0,5 мг на 1 кг массы тела.
Эффективность урокиназы не отличается от эффективности стрептокина-
зы. Урокиназа |
отличается |
относительно |
низким |
риском |
реокклюзии |
||
и кровоизлияний |
в мозг. Применяют в дозе 2 |
млн |
ЕД внутривенно |
болюсно. |
|||
Возможно первоначальное внутривенное |
болюсное введение1,5 |
млн |
ЕД |
||||
с последующим внутривенным капельным введением препарата в течение1 ч в дозе еще 1,5 млн ЕД.
Критериями эффективности тромболитической терапии: данные КАГ, проведенной после завершения процедуры тромболизиса; быстрое снижение сегмента RS-Т; значительный и скачкообразный подъем уровня МВ КФК в сыворотке крови, связанный с эффективной реканализацией КА и вымыванием ферментов в общий кровоток; исчезновение ангинозной боли, если она сохранялась в момент начала тромболитической терапии.
Осложнения реперфузионной терапии
252
Кровотечения, в том числе геморрагические инсульты, встречаются примерно в 0,5-1% случаев. Риск мозгового геморрагического инсульта повышен у лиц пожилого и старческого возраста. В возрасте до 65 лет геморрагии при проведении тромболизиса встречаются в 0,8% случаев, в возрасте старше 65 лет - в 2,1% и в возрасте 75-84 года - у 3,4% больных. Геморрагии в целом несколько чаще возникают при применении препаратов ТАП(алтеплазы) и реже - при использовании стрептокиназы. Кровотечения связывают с системным действием тромболитиков на циркулирующий плазминутуоген.
При возникновении кровотечений с осторожностью назначают ингибиторы фибринолиза: ε-аминутуокапроновая кислота - 5% раствор внутривенно капельно 100 мл в течение 30 минутуут. Инфузия может быть продолжена со скоростью 1 г/час вплоть до остановки кровотечения; трасилол (контрикал) - внутривенно капельно по 300000 МЕ; транексамовая кислота (френолиз, экзацил) внутривенно капельно по 1-1,5 г до 3 раз в день. Гемостатический эффект может быть получен при переливании свежезамороженной плазмы. Проведение гемостатической терапии у больного ИМ требует особой осторожности, так как может спровоцировать повторное тромбообразование.
Быстрое восстановление коронарного кровотока в некоторых случаях приводит к дополнительному реперфузионному повреждению сердечной мышцы в виде формирования зоны так называемого“оглушенного” миокарда с резко сниженной сократимостью, восстановление которой происходит в течение нескольких недель. Феномен “отсутствия кровотока” выявляется при КАГ, проведенной вскоре после реканализации магистральной артерии, когда на ангиограммах определяется резкое замедление дистального кровотока.
На КАГ происходит медленное вымывание контрастного вещества из реканализованной артерии и области ИМ. Феномен “отсутствия кровотока” объясняют плохо обратимым поражением микрососудов, проявляющимся выраженным нарушением эндотелиальной функции и потерей микрососудами способности к вазодилатации.
Быстрое восстановление коронарного кровотока иногда сопровождается развитием ускоренного идиовентрикулярного ритма, в основе которого лежит патологический автоматизм эктопического очага. В большинстве случаев этот вид желудочковой аритмии не переходит в ФЖ, поскольку механизм фибрилляции (re-entry) существенно отличается от механизма медленной идиовентрикулярной тахикардии.
В некоторых случаях развиваются более серьезные нарушения желудочкового ритма, в том числе ЖТ и ФЖ, лечение которых при ИМ описано ниже. Повторная окклюзия КА(реокклюзия) после успешного тромболизиса происходит у значительной части больных. В течение 1 недели после успешного
253
тромболизиса повторная окклюзия наступает в 12,4% случаев. В срок от 48 ч до 3-х месяцев эта цифра достигает 29%.
У половины больных реокклюзия КА развивается бессимптомно, без повторной ангинозной боли. Это объясняется повреждением болевых рецепторов сердца, возникающим вслед за транзиторной ишемией. Причиной повторных тромбозов КА после проведения реперфузии является значительная активация тромбоцитов, возникающая в результате лизиса тромба. Поэтому во время и после реперфузии важна адекватная антитромбоцитарная и антитромбиновая терапия.
Лечение после тромболизиса
После лизиса тромбин контактирует с кровью и вновь“запускает” процесс тромбообразования. Процедура фибринолиза может сама иметь парадоксальный прокоагулянтный эффект, который требует соответствующей коррекции. Поэтому после тромболизиса показано обязательное применение современных антитромбоцитарных и антитромбиновых ЛС: аспирина; тиклопидина или клопидогреля; нефракционированного или низкомолекулярных гепаринов, блокаторов гликопротеиновых IIβ/IIIа рецепторов тромбоцитов.
Исход болезни улучшается даже при слабом антитромбоцитарном действии аспирина. При применении блокаторов IIβ/IIIа гликопротеиновых рецепторов тромбоцитов в сочетании с низкими дозами ТАП было продемонстрировано даже более быстрое и полное восстановление коронарного кровотока, что делает эти препараты средством выбора при проведении тромболизиса.
Оценка реваскуляризации после тромболизиса
После тромболизиса проводят коронароангиографию для объективной оценки состояния коронарного русла, результатов тромболитической терапии.
В тех случаях, когда выявляется выраженный стеноз или окклюзия инфарктассоциированной артерии, принимается решение о проведении реваскуляризации. Первичная транслюминутуальная коронарная ангиопластика осуществляется также при наличии противопоказаний к проведению тромболитической терапии. Эффективность этого метода лечения больных ИМ сопоставима с таковой при тромболитической терапии или даже превышает ее в тех случаях, когда реваскуляризация осуществляется в первые 60 минуту от начала заболевания.
8.7. КАЧЕСТВО ЖИЗНИ БОЛЬНЫХ ИНФАРКТОМ МИОКАРДА
В последние годы улучшение качества жизни(КЖ) больных относят к целям лечения и используют для всесторонней оценки течения и прогноза сер- дечно-сосудистых заболеваний. По определению ВОЗ (1996), КЖ - восприятие человеком своего положения в жизни в контексте культурных и ценностных систем, в которых они живут, и относительно их целей, ожиданий, стандартов и
254
интересов. Это - обширное понятие, которое сложным способом затрагивает физическое здоровье человека, психологическое состояние, личные верования, социальные связи и их отношения к существенным условиям окружающей среды.
Существующие методики оценки КЖ разделяют на общие, частные и специальные. Общие опросники содержат шкалы, с помощью которых можно оценить общее состояние, психологический статус, социальную функцию и работоспособность. К наиболее универсальным из них относятWHO Quality of Life (WHOQOL-100), The Medical Outcomes Study 36 - Item Short-Form Health Survey (SF-36), European Quality of Life (EUROQOL), Nottingham Health Profil и
др. Частные методики служат для оценки отдельных аспектов КЖ, например шкала Activities of Daily Living (ADL) позволяет оценить повседневную активность больных.
Специальные опросники разработаны для отдельных нозологических
форм. Например, КЖ при ИМ можно исследовать |
с помощью опросника |
Quality of Life after Myocardial Infarction (QLMI), при сердечной недостаточно- |
|
сти - Minnesota Living with Heart Failure Questionnaire. Поскольку специальные |
|
опросники сфокусированы на конкретной нозологической форме, они позволя- |
|
ют уловить минутуимальные изменения КЖ пациентов. |
|
На КЖ больных ИМ оказывают большее влияние тяжесть основного и |
|
сопутствующих заболеваний, психологические факторы, |
проводимое лечение |
(Крюков Н.Н. и соавт., 2007). Исследование КЖ у больных ИМ(Крюков Н.Н., Качковский М.А., 2005) показало, что степень влияния различных синдромов сердечной патологии на показатели КЖ неодинакова. Возрастание с I до IV ФК ХСН сопровождается повышением суммарного баллаQLMI соответственно с 32 до 81 баллов, то есть в 2,5 раза.
У больных ИМ, не отмечавших загрудинной боли в остром периоде заболевания, суммарный балл QLMI составил 36. У пациентов с ежедневными тяжелыми приступами стенокардии данный показатель повышался в 2 раза и достигал 73 балла, свидетельствуя о значительном ухудшении их КЖ. Наиболее выраженные изменения КЖ обусловлены ухудшением состояния психологического статуса.
Больные неосложненн ым ИМ указывают на возрастание в связи с проявлениями ХСН потребности в госпитализациях(р < 0,001), тревожности (p < 0,001), чувства усталости (p = 0,002), материальных затрат на лечение(p = 0,009), чувство обузы для членов семьи (p = 0,005).
Полученные результаты исследования указали на значительное ухудшение КЖ больных ИМ при осложненном течении заболевания. По всем Минуту-
несотского опросника КЖ больных ХСН(Minnesota Living with Heart Failure
255
Questionnaire - MLHFQ) выявлены достоверно более высокие баллы по сравнению с контролем, что указывает на снижение уровня КЖ.
Вместе с тем при осложненном течении ИМ выраженные различия по многим параметрам отмечались и в отношении показателей у больных с неосложненным ИМ. На первый план выступили ухудшение функционального статуса: затруднения при ходьбе (p < 0,001), потребность в отдыхе (p < 0,001). Бо-
лее выраженными были проявления симптоматики ХСН: отеки на ногах(p < 0,001), ощущение нехватки воздуха (p < 0,001). Нарастало чувство тревоги (p = 0,003) и депрессия (p = 0,008). При этом выраженность тревожных расстройств достигала 2,28 ± 0,12 балла, в то время, как депрессии всего 1,68 ± 0,12 балла. Это свидетельствует о большей выраженности тревожных расстройств по сравнению с депрессией в острой и подострой стадии ИМ.
Снижение показателей КЖ у больных с неосложненным ИМ в связи с приступами стенокардии было небольшим. Это объясняется активным проведением антиангинальной терапии в острой стадии заболевания. При неосложненном течении ИМ суммарный балл опросника«Качество жизни больных стенокардией» лишь незначительно отличался от контроля (p = 0,083). Вместе с тем, у них выявлено существенное ограничение физических нагрузок(p = 0,002), нарушения ночного сна (p = 0,022), и чувство тревоги из-за приступов стенокардии (p = 0,002).
Выраженность нарушения КЖ у больных с осложненным течением ИМ была значительно выше. Боли в сердце значительно ограничивали физические нагрузки (2,73 ± 0,14 балла), даже по сравнению с неосложненным течением заболевания (2,33 ± 0,12; p=0,023). Также более существенные ограничения больные отмечали в отношении возможности ходьбы и подъема по лестнице(2,82 ± 0,13 балла; p = 0,003).
При осложненном течении ИМ сильнее беспокоило чувство нехватки воздуха (p = 0,002), повысился уровень тревоги (p = 0,038). В целом суммарный показатель КЖ в этой группе ухудшался в1,2 раза (p = 0,004) по сравнению с показателями у больных со стабильным течением заболевания.
Рецидивирующее течение ИМ сопровождается явной тенденцией ухудшения КЖ больных. К числу важных прогностических показателей у больных ИМ относят развитие острой сердечной недостаточности(СН), которая по классификации Киллипа соответствует III классу. Сердечная астма и отек легких диагностированы у 25 пациентов (6%). При этом, клинические проявления острой СН свидетельствует о выраженном снижении КЖ больных ИМ (рисунок
16).
256

4,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
|
|
|
|
Киллип I-II |
Киллип III |
|
|
|
|
|
|
|||||
Рисунок 16. Показатели качества жизни по Минутунесотскому опроснику |
|||||||||||||||||||
больных с инфарктом миокарда, осложненном острой сердечной недостаточно- |
|||||||||||||||||||
стью (М.А. Качковский). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Как видно из рисунка, у больных III класса по классификации Киллипа отмечается существенное ухудшение показателей КЖ, по сравнению с пациентами I-II классов, практически по всем пунктам опросникаMLHFQ. Сильно воздействовало на больных снижение толерантности к физической нагрузке: затруднения при ходьбе и подъеме по лестнице(3-й пункт - 4,00 ± 0,27), затруднения при работе по дому (4-й пункт - 3,88 ± 0,21) и поездками вне дома (5- й пункт - 3,75 ± 0,27), чувство слабости (14-й пункт - 3,63 ± 0,27).
Значительное воздействие оказывали тревога (19-й пункт - 3,17 ± 0,32; p = 0,001 в сравнении с больными имеющимиI-II класс по Киллипу) и депрессия (21-й пункт - 2,33 ± 0,32; p = 0,002). Повседневная активность по шкале ADL у больных ИМ с I-II классом Киллипа оценивалась в 2,62 ± 0,05.
При развитии острой левожелудочковой недостаточности снижение -ак тивности достигало 3,42 ± 0,17 баллов (p < 0,001) по пятибалльной шкале. Развитие сердечной астмы и отека легких приводило к достоверному ухудшению (p < 0,001) суммарных баллов по всем шкалам КЖ опросникаQLMI (рисунок
17).
257
Баллы
45 
40 
35 
30 

25 
20 |
|
|
|
|
|
Killip I-II |
15 |
|
|
|
|
|
Killip III |
10 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
0 |
Ф |
С |
СМ |
ОГ |
УВ |
СУ |
Э |
||||||
|
|
|
Шкалы QLMI |
|
|
|
Рисунок 17. Показатели качества жизни больных инфарктом миокарда, осложненным острой левожелудочковой недостаточностью по шкалам опросника QLMI (М.А. Качковский). Примечание: шкала Э – эмоциональная, шкала Ф – физическая, шкала С – социальная, шкала СМ – симптомы, шкала ОГ – ограничения, шкала УВ – уверенность, шкала СУ – самоуважение, шкала ЭС – эмоциональное состояние.
Наиболее выраженное снижение КЖ у больных с острой СН было обусловлено ухудшением эмоционального состояния и функциональных способностей пациентов и нарушениями в эмоциональной сфере. Дискриминутуантный анализ показал, что ХСН и стенокардия в большей степени снижают КЖ больных ИМ, чем другие проявления сердечно-сосудистой патологии (рисунок 18).
0 |
|
|
-0,2 |
|
|
-0,4 |
|
|
-0,6 |
Артериальна |
Аритмия |
|
||
я гипертония |
|
|
|
|
|
-0,8 |
Стенокардия |
|
|
|
|
-1 |
ХСН |
|
|
|
|
-1,2 |
|
|
Рисунок 18. Сравнительная оценка влияния сердечно-сосудистой патологии на |
||
качество жизни больных инфарктом миокарда (М.А. Качковский). |
||
258
Пошаговый регрессионный анализ КЖ больных через2 месяца от начала развития ИМ позволил выделить наиболее значимые модифицируемые факторы с целью их коррекции. В качестве зависимого показателя принят суммарный показатель КЖ по опросникуQLMI. Высокие регрессионные коэффициенты функционального класса ХСН (13,6), стенокардии (2,7) и депрессии (7,8) свидетельствуют об их наиболее неблагоприятном воздействии на КЖ больных ИМ.
Лечение больных ИМ с ХСН и/или АГ должно осуществляться с применением ингибиторов АПФ, b-адреноблокаторов или их комбинации, что будет способствовать снижению выраженности ХСН и повышению уровня КЖ. Наиболее выраженное положительное воздействие на КЖ больных ИМ оказывало лечение сопутствующей депрессии антидепрессантом тианептином (коаксилом).
Динамика уровня КЖ у обследованных нами больных после ИМ имела различную направленность. Через 2 месяца после развития заболевания у139 человек (37%) суммарный показатель опросника QLMI улучшился, у 209 пациентов (55,7%) его изменения были небольшие, а у 27 человек (7,2%) – состояние КЖ ухудшилось, несмотря на проведение адекватной медикаментозной терапии. Установлено, что повышение значения суммарного показателя опросни-
ка QLMI через 2 месяца после начала ИМ является предиктором ухудшения КЖ через один год от начала развития заболевания. Данные пациенты должны направляться на плановую консультацию кардиохирурга для решения вопроса о проведении кардиохирургического лечения.
8.8. ИНФАРКТ МИОКАРДА ПРАВОГО ЖЕЛУДОЧКА
В последнее десятилетие у25% больных с заднедиафрагмальным трансмуральным ИМ ЛЖ некроз распространяется на область ПЖ. Поражение ПЖ в этих случаях определяет некоторые важные особенности нарушения гемодинамики, которые необходимо учитывать при лечении больных ИМ.
Особенности клинической картины
Начальные клинические проявления ИМ ПЖ, динамика гиперферментемии и признаков резорбционно-некротического синдрома в целом соответствуют таковым, характерным для инфаркта задней стенки ЛЖ. Некроз миокарда ПЖ быстро приводит к снижению его сократимости и появлению отдельных признаков или развернутой клинической картины острой правожелудочковой недостаточности сопровождающейся также артериальной гипотонией.
При физикальном исследовании следующие клинические симптомы: 1. Набухание шейных вен, обусловленное застойными явлениями в венозном русле большого круга кровообращения. Нередко набухание вен увеличивается на вдохе (симптом Куссмауля), обусловленного присасывающим действием отрицательного давления грудной клетки во время вдоха. У здорового человека такое инспираторное увеличение притока крови к правому сердцу( величение
259
преднагрузки на ПЖ) сопровождается адекватным увеличением УО ПЖ(механизм Старлинга), и весь объем крови поступает в систему легочной артерии. Поэтому в норме во время вдоха шейные вены не набухают, а спадаются. При резком снижении систолической функции ПЖ его инспираторная объемная перегрузка сопровождается не увеличением, а заметным уменьшением УО ПЖ, связанным с неспособностью ПЖ “протолкнуть” этот дополнительный объем в легочную артерию. В результате происходит инспираторное набухание шейных вен.
2.Гепатомегалия, быстрое развитие которой при острой правожелудочковой недостаточности сопровождается болями в правом подреберье и болезненностью при пальпации печени.
3.Перкуторные признаки расширения полости ПЖ(смещение правой границы сердца вправо и расширение абсолютной тупости сердца), что подтверждается при рентгенографии и эхокардиографическом исследовании.
4.Правожелудочковый протодиастолический ритм галопа(патологический III тон сердца) выслушивается в нижней трети грудины. Здесь же иногда можно выслушать систолический шум относительной недостаточности трехстворчатого клапана.
5.Отсутствие клинических признаков острой левожелудочковой недостаточности и застоя крови в малом круге кровообращения(одышки, удушья, влажных хрипов в легких), что связано с уменьшением количества крови, выбрасываемой ПЖ в легочную артерию и снижением уровня ДЗЛА инаполнения ЛЖ.
6.Артериальная гипотония связана не с угнетением насосной функции ЛЖ, а со снижением систолической функции ПЖ и уменьшением количества крови, поступающей в левые отделы сердца из малого круга кровообращения (уменьшение преднагрузки ЛЖ). Другой причиной артериальной гипотензии могут служить различные брадиаритмии (чаще СССУ, АВ-блокады), характерные для ишемического поражения ПЖ, что связано с окклюзией ПКА, участвующей в кровоснабжении СА-узла и АВ-соединения.
7.Парадоксальный артериальный пульс - снижение во время вдоха систолического АД больше 10-12 мм рт. ст. и инспираторное уменьшение наполне-
ния пульсовой волны. Этот признак обусловлен теми же причинами, что и увеличение набухания вен шеи на вдохе(симптом Куссмауля): снижением УО ПЖ и наполнения левых отделов сердца. Имеет значение также инспираторное парадоксальное движение МЖП в сторону ЛЖ.
8. Клинические признаки нарушений сердечного ритма и проводимости, наиболее частыми из которых являются фибрилляция предсердий - и АВ блокады.
260
Классической триадой ИМ правого желудочка считают: артериальную гипотензию; увеличение давления в яремных венах и правом предсердии; отсутствие хрипов при аускультации легких. Диагноз инфаркта ПЖ подтверждается с помощью инструментальных методов исследования.
Электрокардиография
ИМ правого желудочка сочетается с заднедиафрагмальным (нижним) ИМ левого желудочка. Чаще поражается задняя стенка ПЖ, реже - его боковая или передняя стенки. При обычной регистрации ЭКГ в12 отведениях ИМ задней стенки ПЖ лишь иногда проявляется подъемом сегментаRS-Т в правых грудных отведениях (V1-V2), что не является специфическим признаком ИМ ПЖ. Большей информативностью обладают дополнительные отведения с правой половины грудной клетки V3R - V4R. При ИМ ПЖ в этих отведениях появляется патологический зубец Q или комплекс QS и подъем сегмента RS-Т (в острейшей и острой стадиях заболевания). Иногда изменения ограничиваются только подъемом сегмента RS-Т и формированием отрицательного зубца .ТДля ИМ задней стенки ПЖ (частая локализация инфаркта ПЖ) характерны наличие патологического зубца Q и/или подъем сегмента RS-Т в дополнительных отведениях с правой половины грудной клетки V3R и V4R при отсутствии этих изменений в отведениях V1 и V2. Нередко на ЭКГ выявляются также фибрилляция предсердий и АВ-блокады.
Эхокардиография
ЭхоКГ, зарегистрированная в двухмерном и допплеровском режимах, позволяет выявить ряд признаков поражения ПЖ и снижение его систолической функции. Расширение полости ПЖ. Признаки гипокинезии или акинезии задней, боковой или передней стенки .ПЖПарадоксальное движение МЖП в сторону ЛЖ, что объясняется выраженной объемной перегрузкой ПЖ и его неспособностью “протолкнуть” кровь в систему малого круга кровообращения. Расширение нижней полой вены с ее недостаточным спадением(коллабированием) на высоте глубокого вдоха, что указывает на повышение ЦВД. Исследование транстрикуспидального диастолического потока крови в допплеровском
режиме иногда позволяет выявить признаки трикуспидальной регургитации крови из ПЖ в ПП, обусловленной дисфункцией клапанного аппарата, возникающей в результате дилатации и снижения сократимости ПЖ.
Катетеризация сердца и коронароангиография
Катетеризацию правых отделов сердца и легочной артерии катетером Свана-Ганца проводят для подтверждения диагноза и разработки адекватной тактики лечения больных. Типичными изменениями гемодинамики, выявляемыми у больных ИМ ПЖ, являются: увеличение среднего давления в ПП (выше 10 мм. рт. ст.), которое иногда достигает уровня диастолического давления в легочной артерии или ДЗЛА. Это объясняет наличие застоя крови в венах
261
большого круга кровообращения и отсутствие застоя крови в легких; систолическое давление в легочной артерии нормально или даже несколько снижено, что частично объясняет сравнительно низкие значения давления наполнения ЛЖ и системного АД. Коронароангиография позволяет выявить окклюзию или критическое сужение ПКА, кровоснабжающей заднюю стенку левого и правого
желудочков. При левом типе кровоснабжения сердца поражение ОВ ЛКА встречается реже.
Лечение
Основные принципы лечения: 1. При наличии артериальной гипотонии, вызванной недостаточностью насосной функции ПЖ и уменьшением ОЦК, необходимо внутривенное капельное введение растворов, способствующих увеличению циркулирующего объема крови: 0,9% раствора натрия хлорида (1-1,5 л со скоростью 200 мл/ч), декстрана, коллоидных растворов, реополиглюкина.
Введение жидкости проводится под постоянным контролем гемодинамических показателей до тех пор, пока ЦВД (давление в ПП) не достигнет уровня 14-15 мм рт. ст. или несколько выше. 2. Если после введения жидкостей сохраняется артериальная гипотония, целесообразно прибегнуть к введению инотропных лекарственных средств (добутаминутуа или/и допaминутуа). 3. При отсутствии эффекта показана коронарная баллонная ангиопластика. 4. Тромболитическая терапия достаточно успешно устраняет основные клинические проявления ИМ ПЖ. 5. При возникновении фибрилляции предсердий необходимо купирование ее по схемам, описанным выше. 6. При появлении синусовой брадикардии и других проявлений СССУ и АВ-блокады II степени II типа Мобитца показана временная ЭКС.
8.9. ОСЛОЖНЕНИЯ ИНФАРТКА МИОКАРДА
Прогноз больных ИМ определяется осложнениями, которые развиваются на ранних и поздних этапах течения заболевания. Ранние осложнения развиваются в остерейшем и остром периоде ИМ. К поздним осложнениям обычно относят осложнения, развивающиеся в подостром и постинфарктном периодах течения заболевания. К ранним осложнениям ИМ относятся:
•острая сердечная недостаточность;
•нарушения ритма и проводимости сердца;
•ранняя постинфарктная стенокардия;
•рецидив ИМ;
•острая аневризма сердца;
•разрыв миокарда;
•фибринозный (эпистенокардитический) перикардит;
•тромбоэмболические осложнения;
•острые эрозии и язвы желудочно-кишечного тракта;
•ишемический инсульт (первые 48 ч после ТЛТ).
262
Поздние осложнения ИМ развиваются в подострый и постинфарктный период:
•хроническая сердечная недостаточность;
•нарушения ритма сердца;
•хроническая аневризма сердца;
•тромбоз левого желудочка;
•тромбоэндокардит (в первые 10 сут);
•тромбоэмболические осложнения (ТЭЛА, тромбозы глубоких вен);
•постинфарктный синдром (синдром Дресслера);
•психические нарушения и т.д.
ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
ОСН является наиболее частой причиной смерти больных ИМ с зубцом
Q.Чаще всего речь идет об острой левожелудочковой недостаточности. Острая правожелудочковая недостаточность встречается значительно режепри вовлечении в патологический процесс правого желудочка(ПЖ). Острая левожелудочковая недостаточность обычно развивается в первые часы или дни ИМ, что связано с внезапным уменьшением массы сократительного миокарда.
Факторами, способствующими возникновению острой левожелудочковой недостаточности являются: 1. Значительная величина зоны некроза(более 2530% от общей массы желудочка). 2. Выраженные нарушения сократимости миокарда ЛЖ в так называемой периинфарктной зонеобласти, непосредственно граничащей с очагом некроза и также находящейся в состоянии хронической ишемии (гибернирующий миокард). 3. Снижение сократимости интактного миокарда, обусловленное уменьшением его коронарной перфузии (при многососудистом поражении коронарной системы), наличием в нем рубцов, гипертрофией миокарда, нарушениями метаболизма кардиомиоцитов. 4. Ремоделирование ЛЖ, в том числе его дилатация, асинергия сокращения, наличие аневризмы ЛЖ. 5. Внезапное развитие относительной митральной недостаточности вследствие дисфункции папиллярных мышц (ишемия, некроз, отрыв папиллярной мышцы). 6. Внезапный разрыв МЖП. 7. Подъем уровня АД(увеличение постнагрузки). 8. Возникновение аритмий.
В результате воздействия этих факторов происходит критическое падение систолической функции ЛЖ, величины сердечного выброса и возрастает КДД в ЛЖ. Повышается давление наполнения ЛЖ, среднее давление в ЛП и венах малого круга кровообращения. Это затрудняет венозный кровоток в малом круге и приводит к застою крови в легких. Высокое давление в легочных венах гидравлически передается на капилляры и легочную артерию. Развивается “пассивная” венозная легочная гипертензия. Если давление в ЛП и легочных венах превышает 25-30 мм рт. ст., возникает рефлекторный спазм легочных артериол (рефлекс Китаева), в результате которого, хотя и уменьшается приток крови к легочным капиллярам из ПЖ, но одновременно резко возрастает давле-
263
ние в легочной артерии, развивается “активная” легочная артериальная гипертензия. Переполнение кровью легочных капилляров и повышение давления в них выше коллоидно-осмотического давления плазмы сопровождается нарушением проницаемости сосудистой стенки и приводит к пропотеванию плазмы вначале в интерстициальное пространство, а затем в просвет альвеол.
Сопутствующая гипертрофия миокарда ЛЖ и/или нарушения диастолического расслабления ишемизированного и некротизированного миокарда (диастолическая дисфункция), резкое увеличение предили постнагрузки или увеличение размеров полости ЛЖ также способствуют росту КДД в ЛЖ и давления наполнения ЛЖ, повышая риск возникновения отека легких. Количественная оценка давления наполнения ЛЖ, МО, СИ и некоторых других гемоди-
намических параметров лежит в основе дифференцированного подхода к лечению ИМ, осложненного левожелудочковой недостаточностью.
Клиническая картина
Острая левожелудочковая недостаточность у больных ИМ может протекать в виде трех клинических вариантов: 1. Сердечная астма возникает в результате интерстициального отека легких, не сопровождающегося значительным выходом транссудата в просвет альвеол. 2. Альвеолярный отек легких характеризуется не только гемодинамическим отеком паренхимы легких, но и выходом плазмы и эритроцитов в просвет альвеол, а затем - дыхательных путей. 3. Кардиогенный шок - крайняя степень левожелудочковой недостаточности, когда внезапное резкое снижение сердечного выброса сопровождается выраженным и часто необратимым нарушением периферического кровообращения и прогрессирующим снижением АД. Кардиогенный шок нередко сочетается с альвеолярным отеком легких.
Сердечная астма
Приступ сердечной астмы начинается внезапно с ощущения нехватки воздуха, одышки, которая быстро переходит в удушье. Больной возбужден, стремится занять возвышенное сидячее положение в постели(ортопноэ), что несколько облегчает его состояние, создавая условия для уменьшения притока крови к правому сердцу и некоторой разгрузке малого круга кровообращения. При осмотре отмечается испуганное, страдальческое выражение лица. Кожные покровы влажные. Быстро нарастает цианоз, приобретающий своеобразный сероватый оттенок, характерный для прогрессирующей дыхательной недостаточности. Слизистые оболочки также синюшны. Дыхание учащенное, с несколько затрудненным вдохом (преимущественно инспираторная одышка). Иногда можно заметить участие в акте дыхания вспомогательной мускулатуры, выраженное втяжение межреберных промежутков и надключичных ямок во время вдоха. В легких на фоне ослабленного везикулярного или жесткого дыхания могут выслушиваються влажные мелкопузырчатые незвучные хрипы в нижних
264
отделах легких. Часто выслушиваются сухие хрипы. Определяется усиление и раздвоение II тона над легочной артерией.
При перкуссии нередко можно выявить умеренное смещение влево левой границы относительной тупости сердца, обусловленное дилатацией ЛЖ. Тоны сердца глухие, иногда ЧСС увеличена до 100-110 ударов в минуту. На верхушке часто определяется протодиастолический ритм галопа. Артериальное давление чаще имеет тенденцию к снижению, хотя возможен и подъем уровня АД. Продолжительность приступа от получаса до нескольких часов.
Альвеолярный отек легких
При альвеолярном отеке легких присоединяется шумное частое дыхание, слышимые на расстоянии влажные крупнопузырчатые хрипы(клокочущее дыхание). У больного появляется кашель с отделением жидкой пенистой(серозной) мокроты розоватового цвета за счет начавшегося пропотевания эритроцитов в просвет альвеол. В легких на фоне ослабленного везикулярного дыхания быстро нарастает количество влажных хрипов мелко- и среднепузырчатых, а затем и крупнопузырчатых.
Хрипы вначале выслушиваются в задненижних отделах легких, постепенно распространяясь по всей поверхности легких сзади и спереди. Тоны сердца становятся еще более глухими. На верхушке выслушивается протодиастолический или пресистолический ритмы галопа. АД продолжает снижаться. Пульс на лучевой артерии учащенный, иногда аритмичный, малого наполнения и напряжения. Рентгенологически выявляются симметричное гомогенное затенение в центральных отделах полей - типа "крылья бабочки"; ограниченные или сливные затемнения округлой формы в долях легкого, нередко двусторонние различной интенсивности диффузные тени (рисунок 19).
265
Рисунок 19. Отек легких у больного Н., 54 лет с диагнозом распространенный трансмуральный инфаркт миокарда (М.А. Качковский).
Нередко клиническая картина не позволяет строго разграничить приступ сердечной астмы и начинающийся альвеолярный отек легких, хотя относительно быстрое прекращение удушья после купирования болевого синдрома, приема нескольких таблеток нитроглицерина говорит в пользу диагностики сердечной астмы. Продолжительность отека легких от нескольких часов до нескольких суток. Pентгенологические изменения могут сохpаняться даже спустя2448 часов и более после купиpования клинических признаков отека легких.
КАРДИОГЕННЫЙ ШОК
Тяжелое фатальное осложнение ИМ(65-90%). В большинстве случаев кардиогенный шок развивается в первые часы или в первые1-2 суток от начала ИМ, когда критически снижается насосная функция ЛЖ. Частота этого осложнения в настоящее время составляет 5-8% от всех случаев ИМ с зубцом Q. Факторами риска кардиогенного шока являются: 1. Распространенный ИМ передней стенки с массой некротизированного миокарда ЛЖ более40%. 2. Выраженные ишемические изменения миокарда, окружающего зону некроза. 3. Наличие старых рубцов после перенесенного ИМ. Величина “свежего” ИМ может не достигать 40% от общей массы ЛЖ. 4. Снижение ФВ ЛЖ ниже 40%. 5. Пожилой и старческий возраст больного. 6. Разрыв МЖП. 7. Дисфункция или разрыв папиллярных мышц, вовлеченных в некротический процесс, что способствует развитию острой недостаточности митрального клапана и внезапному падению УО и МО. 8. Наличие сопутствующего сахарного диабета; 9. Инфаркт миокарда ПЖ.
Патогенез кардиогенного шока, обусловленного острой левожелудочковой недостаточностью, представляется следующим образом. В результате значительного уменьшения насосной функции ЛЖ и падения АД компенсаторно повышается общее периферическое сопротивление и возникает резко выраженный спазм артериол, вызывающий гипоперфузию внутренних органов. На этом фоне достаточно быстро развивается тканевая гипоксия, метаболический ацидоз. Последние способствуют дилатации артериол, в то время как менее чувствительные к этим воздействиям венулы остаются в спазмированном состоянии.
Происходит переполнение периферических капилляров кровью, и часть жидкой части крови перемещается в тканевые интерстициальные пространства. В капиллярном русле периферических органов возникает стаз крови, образуются микротромбы, чему способствует повышение агрегации тромбоцитов, свертываемости и вязкости крови, свойственное для больных ИМ и кардиогенным шоком. Это еще больше нарушает циркуляцию крови по микрососудам.
В результате уменьшается приток крови к сердцу, снижаются сердечный выброс, АД и перфузия внутренних органов, существенно нарушается их функ-
266
ция. Снижаются перфузия почек и уровень АД(ниже 100 мм рт. ст.), что приводит к ишемии почек, нарушению клубочковой фильтрации, некрозу канальцев и развитию острой почечной недостаточности. Происходит поражение ЦНС, что сопровождается признаками дисциркуляторной энцефалопатии. Снижение кровообращения в печени ведет к нарушению ее функции. В желудочнокишечном тракте образуются острые трофические расстройства вплоть до образования язв слизистой.
При кардиогенном шоке одновременно со снижением сердечного выброса, уровня АД и перфузии периферических органов и тканей наблюдается рост давления наполнения ЛЖ выше20 мм. рт. ст., что способствует венозному застою крови в малом круге кровообращения и возникновению отека легких. Исключение составляет так называемая гиповолемическая форма кардиогенного шока, при которой наблюдается снижение ОЦК за счет депонирования крови в
периферических сосудах и перехода части плазмы в интерстициальное -про странство. Отмечают снижение сердечного выброса, КДД в ЛЖ и давления наполнения ЛЖ.
Клиническая картина
Жалобы больных с кардиогенным шоком неспецифичны и связаны с основным заболеванием (загрудинная боль, перебои, сердцебиения), с застоем крови в малом круге кровообращения(одышка, удушье), со снижением АД и нарушением функции внутренних органов(слабость, головокружение, выраженная потливость, похолодание конечностей, олигурия или анурия).
При осмотре обращает на себя внимание тяжелое состояние больного. В самом начале развития кардиогенного шока возможно кратковременное психомоторное возбуждение (эректильная фаза шока). Однако вскоре больной становится вялым, адинамичным, почти не реагирует на окружающее, что указывает на быстрое прогрессирование гипоксии, ацидоза, снижение мозгового кровотока (торпидная фаза). Сознание в это время может быть угнетено, вплоть до комы. Кожные покровы бледные с выраженным цианотическим оттенком. Отмечается профузный пот, конечности холодные на ощупь. Пульс на лучевых артериях малого наполнения и напряжения, нитевидный (pulsus filiformis), иногда вообще отсутствует. Артериальное давление резко снижено, систолическое АД меньше 80 мм рт. ст., хотя кардиогенный шок может развиться и при более высоком АД (90-100 мм рт. ст.), если у больного в прошлом имела место АГ.
Для кардиогенного шока типично резкое уменьшение уровня пульсового АД (менее 30 мм рт. ст., в редких случаях - менее 10 мм рт.ст.). При определении АД слышны очень глухие тоны. В тяжелых случаях тоны Короткова исчезают, АД не определяется аускультативным методом.
При исследовании легких выявляется частое поверхностное дыхание, а в терминутуальной стадии - апериодическое дыхание Чейна-Стокса. В легких
267
выслушиваются влажные хрипы, что указывает на признаки застоя крови в малом круге кровообращения и развивающийся отек легких. При аускультации тоны сердца глухие, часто аритмичные, может выслушиваться протодиастолический ритм галопа, систолический шум. Одним из наиболее надежных клинических признаков кардиогенного шока является олиго- и анурия (диурез меньше 20 мл/ч), свидетельствующая о гипоперфузии почек, которая является весьма неблагоприятным прогностическим признаком. Довольно часто терминуту “кардиогенный шок” используют для обозначения еще двух патологических состояний, сопровождающихся снижением сердечного выброса и уровня АД, но существенно отличающихся от истинного кардиогенного шока по механизмам развития и прогнозу.
1.Рефлекторная форма шока(болевой рефлекторный шок) является формой острой сосудистой недостаточности, которая в большинстве случаев развивается на высоте болевого приступа. Рефлекторная форма шока обусловлена внезапным уменьшением тонуса вен и депонированием значительной части крови в венах органов брюшной полости и скелетных мышц. Значительно уменьшается приток крови к сердцу, снижается сердечный выброс, происходит кратковременное нарушение перфузии головного мозга. Это определяет клиническую картину рефлекторного шока(коллапса). Болевой рефлекторный коллапс обычно продолжается недолго, легко купируется самостоятельно или после применения сосудистых препаратов, быстро повышающих венозный тонус
ивосстанавливающих исходную гемодинамику. Рефлекторный коллапс наблюдается у многих больных ИМ с зубцом Q в самом начале заболевания и практически не оказывает влияния на прогноз ИМ. Развитие рефлекторной формы шока свидетельствует о тяжести и стойкости нарушений и требует энергичного проведения противошоковых мероприятий.
2.Аритмический шок обусловлен резким падением насосной функции ЛЖ и АД в результате возникновения пароксизмальной тахикардии или полной АВ-блокады. Купирование пароксизма тахикардии или применение электрокардиостимуляции сердца при АВ-блокаде приводит обычно к быстрому восстановлению сердечного выброса и нормализации АД. Наличие у больного клинической картины шока и тяжелых нарушений ритма и проводимости еще не означает, что речь идет именно об аритмическом шоке, поскольку истинный кардиогенный шок также может сопровождаться тяжелыми аритмиями. Окончательное суждение о генезе шока можно сделать только после купирования нарушений ритма и проводимости: при истинном кардиогенном шоке устранение аритмии не оказывает влияния на насосную функцию ЛЖ, и клинические признаки шока сохраняются.
3.Кардиогенный шок с низким ОЦКвозникает при выраженной вазодилатации. Его весьма сложно диагностировать. Наблюдаются запавшие черты лица. Эффект от проводимой иноторопной поддержки недостаточный, более значимый при проведении инфузионной терапии. Рекомендуется провеедние
268

инфузионной терапии при ЦВД ниже5 см водного ст. или ДЗЛА ниже 12 мм рт.ст.
4. Истинный кардиогенный шокявляется наиболее тяжелой формой шока при ИМ. Характеризуется резким падением сократительной функции сердца. Падение минутуутного объема достигает критически низких значений и не компенсируется повышением периферического сосудистого сопротивления (Мартынов И.В., Груздев А.К., 2003).
Для клинической оценки выраженности острой левожелудочковой недостаточности у больных ИМ используют классификацию. ТKillip и J. Kimβall (1969), основанную на количественной характеристике некоторых клинических проявлений сердечной недостаточности (таблица 37). Наличие у больного клинической картины шока и тяжелых нарушений ритма и проводимости еще не означает, что речь идет именно об аритмическом шоке, поскольку истинный кардиогенный шок может сопровождаться тяжелыми аритмиями.
Окончательное суждение о генезе шока можно сделать только после купирования нарушений ритма и проводимости. При истинном кардиогенном шоке устранение аритмии не оказывает влияния на насосную функцию ЛЖ, и клинические признаки шока сохраняются.
Таблица 37. Классификация острой левожелудочковой недостаточности
Класс |
Клинические критерии |
|
Удельный вес |
Госпитальная |
||
|
|
|
|
больных среди |
летальность, |
|
|
|
|
|
поступающих в |
% |
|
|
|
|
|
|
ОРИТ, % |
|
I |
Отсутствие влажных хрипов в лег- |
|
30-40 |
8 |
||
|
ких и патологического III тона |
|
|
|
||
II |
Застойные |
влажные |
хрипы |
|
на 30-50 |
30 |
|
площади менее 50% легочных по- |
|
|
|
||
|
лей и/или патологический III тон |
|
|
|
||
III |
Влажные хрипы на площади более |
5-10 |
44 |
|||
|
50% легочных полей в сочетании с |
|
|
|||
|
патологическим III тоном |
|
|
|
|
|
IV |
Признаки |
кардиогенного |
шока |
10 |
80-100 |
|
|
Для количественной и качественной оценки гемодинамических наруше- |
|||||
ний, |
лежащих |
в |
основе |
острой |
левожелудочковой |
недостаточност |
и кардиогенного шока у больных ИМ, используются: 1. Рентгенография орга- |
||||||
нов |
грудной |
клетки. |
2. Катетеризация |
левых и правых отделов сердца |
||
с измерением давления в камерах сердца и легочной артерии. 3. Прямые методы определения сердечного выброса. 4. Радионуклидная вентрикулография. 5. Коронароангиография с левой вентрикулографией. 6. Эхокардиография. Рент-
269
генография органов грудной клетки позволяет объективизировать признаки венозного застоя крови в малом круге кровообращения, а катетеризация полостей сердца и легочной артерии - оценить уровень КДД в ЛЖ, давление наполнения ЛЖ, центральное венозное давление (ЦВД), УО, МО, СИ.
Рентгенография органов грудной клетки
Является доступным методом исследования, который позволяет оценить у больных ИМ кровообращение в малом круге и выявить признаки развивающегося отека легких, причем до появления отчетливых клинических проявлений этого осложнения. При рентгенографии венозный застой крови в легких
характеризуется затемнением корней и периферических отделовле ких, значительным расширением легочных вен. На начальной стадии гемодинамических нарушений наблюдается снижение пульсации корней легких, выявляемой при рентгеноскопии, и отсутствие расширения легочной артерии, ее крупных ветвей.
При присоединении к венозному застою признаков легочной артериальной гипертензии, обусловленной рефлекторным спазмом легочных артериол и мелких артерий (рефлекс Китаева) в ответ на повышение давления в левом предсердии выше 18 мм. рт. ст., выявляются следующие рентгенологические признаки: 1. Интенсивное гомогенное затемнение корней легких и их значительное расширение и нерезкость очертаний. 2. Обеднение легочного сосудистого рисунка на периферии обоих легких за счет выраженного сужения мелких артерий, дистальные отделы которых как бы “обрываются”. Это один из наиболее характерных рентгенологических признаков сочетания венозного полнокровия и легочной артериальной гипертензии, которое лежит в основе возникновения клинической картины гемодинамического отека легких. 3. Появление на рентгенограммах легких “перегородочных” линий Керли типа В, образующихся вследствие накопления жидкости в междольковых прегородках. 4. Расширение и усиленная пульсация ствола легочной артерии(рентгенологический признак легочной артериальной гипертензии). Перечисленные рентгенологиче-
ские признаки интерстициального отека у половины больных появляются раньше, чем описанные выше клинические симптомы острой левожелудочковой недостаточности.
Гемодинамический мониторинг
Всем больным ИМ с признаками острой СН показана оценка в динамике пяти гемодинамических показателей: сердечного индекса (СИ); фракции выброса ЛЖ (ФВ); центрального венозного давления (ЦВД); давления заклинивания легочной артерии (ДЗЛА); уровня систолического и диастолического АД. Сведения о динамике этих показателей необходимы для объективной оценки типа гемодинамических нарушений, выбора оптимальной тактики ведения больных и контроля за лечением. Для определения этих показателей использу-
270
ют инвазивные методы исследования: катетеризацию правых отделов сердца (определение ДЗЛА, ЦВД) и метод термодилюции (УО, МО, УИ, СИ, ФВ). Для оценки СИ и ФВ можно использовать эхокардиографию. Во всех случаях необходим контроль диуреза, причем при кардиогенном шоке - почасовой контроль с помощью постоянного мочевого катетера.
Катетеризация сердца и сосудов
Катетеризацию правых и левых камер сердца и магистральных сосудов должен выполнять высококвалифицированный медицинский персонал в отделениях реанимации и интенсивной терапии, специализированных ангиографических отделениях. Для проведения катетеризации правых отделов сердца пунктируют бедренную вену, основную вену плеча или подключичную вену. Чаще используют последний доступ. Больного укладывают на операционный стол на спину.
Пациент занимает положение с низким изголовьем; ежду лопатками кладут валик. Кожу правой подключичной области обрабатывают антисептическими средствами, а саму область отграничивают стерильными салфетками. Иглой диаметром около 0,5 мм в области, расположенной примерно на 2 см латеральнее большого пальца и чуть ниже ключицы, делают прокол и вводят 1% раствор лидокаина, осуществляя анестезию кожи, подкожной клетчатки, надкостницы ключицы. После того как подключичная область инфильтрирована анестетиком, ее пунктируют иглой Сельдингера, подсоединенной к стерильному шприцу.
Игла располагается почти горизонтально и медленно продвигается под ключицу по направлению к указательному пальцу оператора. Срез иглы должен быть повернут вниз. Если в шприце появилась темная венозная кровь, это указывает на то, что игла вошла в вену. Шприц отсоединяют и в просвет иглы вводят проводник, удерживая иглу в том же положении. После того как проводник попал в просвет вены, иглу извлекают, а на проводник надевают жесткий дилататор и вводят его по проводнику на3-4 см. Он используется для расширения подкожных тканей. Затем расширитель удаляют и в проводник вводят -цен тральный венозный катетер - на 15 см вглубь.
После этого проводник удаляют, аспирируют кровь из катетера и начинают струйное введение стерильного изотонического раствора натрия хлорида. Катетер фиксируют к коже швами. Часто при зондировании правых отделов сердца используют доступ через бедренную вену. Техника пункции вены и введения катетера соотвествует при подключичном доступе. Пунктируют бедренную вену медиальнее области, в которой была обнаружена пульсация бедренной артерии.
271
Помимо описанного чрескожного введения центрального катетераис пользуют венесекцию. В зависимости от цели исследования используют различные виды катетеров. Для контроля центральной гемодинамики применяют “плавающий” катетер Свана-Ганца, на конце которого расположен небольшой баллончик, раздуваемый газом. Катетер медленно вводят примерно до уровня правого предсердия, после чего баллончик раздувают. Катетер с раздутым баллончиком приобретает повышенную “плавучесть” и практически не оказывает механического воздействия на внутреннюю поверхность правых отделов сердца, что предупреждает возникновение нарушений сердечного ритма. Катетер вводят в правое предсердие, правый желудочек и в легочную артерию, регистрируя кривые давления в этих отделах сердца.
Затем газ из баллончика эвакуируют и продвигают конец катетера в одно из разветвлений легочной артерии второго и третьего порядка. После этого вновь раздувают баллончик, который обтурирует (“заклинивает”) сосуд, что позволяет зарегистрировать так называемое легочно-капиллярное давление или, точнее, передаточное давление из ЛП, называемое “давлением заклинивания легочной артерии” (ДЗЛА). На рисунке видно, что в момент “заклинивания” легочной артерии характер кривой давления резко меняется.
Для катетеризации левых отделов сердца и аорты чаще используют ретроградную артериальную катетеризацию аорты и левого желудочка и транссептальный доступ. Чаще применяют ретроградный артериальный доступ. В этом случае специальный катетер вводят чрескожно в бедренную артерию или через небольшой разрез в плечевую артерию.
Введение |
катетера |
в аорту и затем в левый желудочек контролируют |
с помощью рентгенотелеустановки. Транссептальный доступ обычно исполь- |
||
зуют в тех случаях, когда по каким-то причинам ретроградная артериальная ка- |
||
тетеризация оказывается |
технически сложной из-за выраженного сужения |
|
кольца аортального клапана, наличия гипертрофической кардиомиопатии или |
||
механического |
протеза |
клапана. Катетер вводят в правую бедренную вену |
и продвигают его в направлении сердца.
Когда катетер достигает правого предсердия, через него вводят длинную иглу с закругленным концом, пунктируют ею межпредсердную перегородку в области овального отверстия. После этого катетер вводят по игле в левое предсердие, затем в левый желудочек и, при необходимости, в аорту и регистрируют кривые давления.
Катетеризация правых и левых отделов сердца позволяет получить - ин формацию о динамике внутрижелудочкового и внутрипредсердного давления и давления в крупных магистральных сосудах(аорте и легочной артерии). Нормальные величины давления в полостях сердца и магистральных сосудах представлены в таблице 38.
272
Таблица 38. Нормальное давление в полостях сердца, магистральных сосудах
Камеры сердца и |
Максимальное сис- |
Конечно- |
Среднее |
магистральные |
толическое давле- |
диастолическое |
давление, |
сосуды |
ние, мм. рт. ст. |
давление, мм. рт. ст |
мм. рт. ст. |
Правое предсердие |
- |
- |
4-5 |
Правый желудочек |
25-30 |
4-6 |
- |
Легочная артерия |
25-30 |
10-12 |
- |
Левое предсердие |
- |
- |
8-12 |
Левый желудочек |
120-145 |
10-12 |
- |
Аорта |
120-145 |
70 |
- |
Практическое значение имеет определение конечно-диастолического давления в левом желудочке (КДДЛЖ), величина которого используется для оценки
функции левого желудочка. Данные о величине КДД можно получить при
ЛЖ
катетеризации левых отделов сердца. На практике КДД чаще оценивают по
ЛЖ
величине “давления заклинивания” легочной артерии (ДЗЛА), что существенно
упрощает процедуру исследования. В большинстве случаев ДЗЛА и КДД
ЛЖ
почти совпадают.
Повышение КДД в левом желудочке является одним из важнейших признаков снижения сократительной способности сердцалевожелудочковой сердечной недостаточности. Нередко этот признак появляется задолго до уменьшения величины сердечного выброса(МО). При нарушении систолической функции повышение КДД сочетается с компенсаторным увеличением конечнодиастолического объема ЛЖ и его дилатацией. Другой важный механизм повышения КДД - увеличение жесткости стенки ЛЖ, что чаще наблюдается у больных с выраженной гипертрофией миокарда, кардиосклерозом, распространенной ишемией или острым ИМ.
Снижение КДД в левом желудочке у больных ИМ является указанием на наличие гиповолемии, сопровождающейся уменьшением конечнодиастолического объема левого желудочка(гиповолемический кардиогенный шок, длительный пароксизм наджелудочковой или желудочковой тахикардии). Сердечный выброс - это количество крови, выбрасываемой правым и левым желудочком в единицу времени (1 минуту). Наиболее точными методами определения сердечного выброса (или минутуутного объема крови - МО) являются прямые методы Фика и методы разведения.
Прямой метод Фика является наиболее точным методом определения сердечного выброса. Несмотря на необходимость проведения пункции или катетеризации артериального участка системы кровообращения, метод в последние годы достаточно широко применяется в кардиологической практике, преимущественно у больных осложненным острым ИМ.
273
Методы разведения индикаторов являются своеобразной модификацией метода Фика и основаны на быстром одномоментном введении непосредственно в кровеносное русло определенного количества какого-либо индикатора (красителя, радиоактивного вещества, охлажденной жидкости). Концентрацию индикатора определяют в пробах крови, взятых из участков, расположенных ниже по ходу кровотока (С1). Кровь извлекают из артерии (аорты) с постоянной скоростью с помощью автоматических насосов. Для определения концентрации индикатора чаще используют специальные проточные(кюветные) денситометры, через которые пропускают артериальную кровь. Денситометры снабжены источником света и фотоэлектрическим датчиком, измеряющим интенсивность светового потока, проходящего через исследуемую кровь
Кривая изменения концентрации индикатора во времени регистрируется ниже места его введения в артериальной системе. Через некоторое время (Т) после одномоментного (болюсом) введения индикатора в локтевую вену или правое предсердие его концентрация в месте забора крови начинает повышаться, достигает первого максимума (пика), а затем начинает экспоненциально падать. Нисходящая часть кривой первой(основной) волны обычно деформирована дополнительными волнами рециркуляции (повторного поступления индикатора из различных сосудистых областей). Для определения так называемой первичной кривой разведения, лишенной пиков рециркуляции, необходимо экстраполировать ее нисходящую часть, изобразив ее в логарифмическом масштабе.
Нисходящая часть превращается в прямую линию. Продолжая ее до пересечения с осью абсцисс, получают первичную кривую, кривую, которая была бы записана в отсутствии рециркуляции. Время от начала кривой разведения до этой точки соответствует общему времени пассажа индикатора(Т). Площадь под первичной кривой разведения (S) отражает суммарную концентрацию красителя, зарегистрированную в артерии (аорте) во время первого пассажа индикатора. Для определения этой площади необходимо знать калибровочный индекс (К), зависимость между концентрацией индикатора в мг/л и показаниями денситометра в миллиметрах. Простым и распространенным способом определения цены деления записывающего устройства денситометра является способ Y.W. Nicholson, основанный на пропускании через денситометр нескольких проб крови обследуемого с известной концентрацией индикатора.
При определении сердечного выброса в качестве индикатора может быть использован метод термодилюции охлажденным изотоническим раствором натрия хлорида или 5% раствором глюкозы. Стандартное количество охлажденной жидкости вводят в правое предсердие и с помощью термистора, расположенного в легочной артерии, регистрируют кривую снижения температуры крови. В современных системах для этой цели используют многопросветные баллонные катетеры. Через один просвет катетера с отверстием на уровне правого предсердия вводят термоиндикатор; через другой - провод термистора, на-
274
ходящегося в легочной артерии. Для вычисления МО определяют площадь под кривой разведения в градусах и разность температуры индикатора и крови. Формула расчета МО:
МО = -V (t1 - t2) х 60 х 1,08 / S,
где V - объем введенного индикатора; t1 - температура крови; t2 - температура индикатора; 1,08 - коэффициент, учитывающий удельную плотность и теплоемкость крови и индикатора; S - площадь под кривой разведения. Метод термодилюции отличается рядом преимуществ: отсутствует необходимость применения артериального катетера; существует возможность многократного повторного определения сердечного выброса(до 2-3 раз в минуту); на кривой разведения отсутствуют волны рециркуляции, что упрощает исследование; сердечный выброс (МО) определяется с высокой точностью. Помимо МО крови в клинической практике рассчитывают и другие показатели, являющиеся производными МО:
1. Ударный объем (УО):
УО = МО/ ЧСС (л).
2. Сердечный индекс (СИ), который представляет собой отношение МО крови к площади поверхности тела (S, м2). СИ вычисляют по формуле:
СИ = МО/ S (л/минуту/м2).
Площадь поверхности тела (S) определяют по специальной номограмме или рассчитывают по формулам.
3. Ударный индекс (УИ) - отношение ударного объема к площади -по верхности тела (S, м2). УИ вычисляют по формуле:
УИ = УО/ S (л/м2).
4. Фракция выброса - отношение УО к величине КДО ЛЖ.
Селективная ангиокардиография левого желудочка(левая вентрикулография) имеет особое значение в диагностике органических и функциональных нарушений левого желудочка у больных ИМ. В этих случаях левая вентрикулография позволяет обнаружить регионарные нарушения функции левого желудочка в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии; диагностировать аневризму левого желудочка и оценить ее локализацию и размеры; рассчитать важные и информативные показатели гемодинамики (КСО, КДО, УО, МО, СИ, УИ, ФВ, среднюю скорость кругового укорочения волокон). Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрирован-
275
ных в одной из проекций в конце систолы и диастолы. Вначале планиметрически определяют площадь полости левого желудочка(S) и длину его большой оси (L), соединяющей основание и верхушку. Расчетный диаметр по малой оси полости желудочка (D) определяются по формуле:
D = 4S / π х L,
после чего рассчитывают объем левого желудочка(V), используя геометрическую модель эллипсоида:
V = π х D2 х L / 6,
где V - объем левого желудочка; D - расчетный диаметр по малой оси; L - длина большой оси. Зная конечно-диастолический (КДО) и конечносистолический (КСО) объемы левого желудочка, легко можно рассчитать его ударный объем (УО):
УО = КДО - КСО.
Фракцию выброса (ФВ), отражающую процент укорочения миокарда левого желудочка во время его сокращения, вычисляют следующим образом:
ФВ = УО / КДО х 100%,
где: ФВ - фракция выброса; УО - ударный объем; КДО - конечнодиастолический объем желудочка.
Другой информативный показатель сократительной способности миокарда левого желудочка - среднюю скорость кругового укорочения волоконвы- числяют, рассчитывая величину диаметра по малой оси желудочка(D) в конце систолы и диастолы (конечно-систолический и конечно-диастолический размеры левого желудочка, КСР и КДР), общую продолжительность изгнания крови
(Т):
Vср = КДР - КСР / КДР х Т,
где: КДР и КСР - конечно-диастолический и конечно-систолический размеры (диаметры) левого желудочка; Т - время изгнания. Некоторые параметры гемодинамики могут быть определены с помощью эхокардиографии. В этих случаях целесообразно использовать метод дисков(по Simpson), метод “пло- щадь-длина” или допплер-эхокардиографическое определение параметров гемодинамики. Для характеристики нарушений кровообращения при ИМ используют 4 гемодинамических показателя: ДЗЛА, ЦВД, СИ и АД. Давление заклинивания легочной артерии (ДЗЛА). Основным гемодинамическим параметром, определяющим возникновение застоя крови в малом круге кровообращения, является давление заклинивания легочной артерии(ДЗЛА), которое
276

в большинстве случаев соответствует давлению наполнения ЛЖ. Чем выше ДЗЛА, тем больше выражен застой крови в легких.
Центральное венозное давление(ЦВД) зависит от величины венозного притока крови к правому сердцу, диастолического давления в ПЖ. Диастолическое давление в ПЖ может увеличиваться при легочной артериальной гипертензии; при поражении ПЖ. Повышение ЦВД (давления в ПП) у больных ИМ может наблюдаться как при застое крови в легких, вызванном острой левожелудочковой недостаточностью, так и при инфаркте самого ПЖ. Уменьшение ЦВД связано с ограничением венозного притока крови к сердцу, наблюдается при коллапсе и шоке, приеме нитратов, гиповолемии.
Сердечный индекс (СИ) - это третий гемодинамический показатель, используемый для характеристики нарушений кровообращения при ИМ. Он характеризует насосную функцию сердца. Величина СИ является главным показателем тяжести состояния больных ИМ: при снижении СИ с2,7 л/минуту/м2 (при неосложненном течении инфаркта) до 1,6 л/минуту/м2 (при отеке легких и кардиогенном шоке) госпитальная летальность увеличивается с 2,2% до 55,5%.
Таблица 38. Типы гемодинамики у больных ИМ
Тип |
гемодинамики |
,СИ |
ДЗЛА, |
|
ЦВД, |
|
АД, |
|
Примечания |
|
|||
|
|
л/мину |
мм |
|
мм |
|
мм |
|
|
|
|
|
|
|
|
ту/м2 |
рт. ст. |
рт. ст. |
рт. ст. |
|
|
|
|
|
|
||
Эукинетический |
Норма |
Норма |
|
Норма |
|
Норма |
|
Нет |
признаков |
|
|||
(нормокинетиче- |
(2,7-3) |
(8-12) |
|
(4-5) |
|
или γ λ |
|
острой |
левоже- |
|
|||
ский) |
|
|
|
|
|
|
|
|
лудочковой |
|
не- |
|
|
Гиперкинетический |
λ > 3,0 |
Норма |
|
Норма |
|
Норма |
достаточности |
|
|||||
|
|
|
или γ |
|
|
|
или |
|
или КШ |
|
|
|
|
Застойный |
Норма |
λ> 18 |
|
Норма |
|
Норма |
|
Отек легких |
|
|
|||
|
|
|
|
|
или |
|
или γ |
|
|
|
|
|
|
Гипокинетический |
λ < 2 |
λ > 20 |
|
λλ |
|
γγ |
|
Отек |
легких |
или |
|
||
|
|
|
|
|
|
|
|
|
КШ |
|
|
|
|
Гиповолемический |
λ < 2 |
γ < 9 |
|
γ |
|
γγ |
|
КШ |
(гиповоле- |
|
|||
|
|
|
|
|
|
|
|
|
мический |
|
вари- |
|
|
|
|
|
|
|
|
|
|
|
ант) |
или |
терми- |
|
|
|
|
|
|
|
|
|
|
|
нутуальная |
|
ста- |
|
|
|
|
|
|
|
|
|
|
|
дия |
любого |
-ва |
||
|
|
|
|
|
|
|
|
|
рианта КШ |
|
|
|
|
В |
таблице 38 представленны пять |
типов |
изменений |
гемодинамики при |
|||||||||
ИМ. Три из них характерны для острой левожелудочковой недостаточности и кардиогенного шока: застойный, гипокинетический, гиповолемический. Застойный тип гемодинамики характеризуется повышением ДЗЛА больше18 мм рт. ст. и ЦВД при почти нормальных значениях СИ. Нередко застойный тип ге-
277
модинамики предшествует появлению клинических признаков острой левожелудочковой недостаточности (сердечной астмы и альвеолярного отека легких). Этот тип гемодинамических нарушений свидетельствует о наличии венозного застоя в легких, что обычно подтверждается при проведении рентгенографии органов грудной клетки. Отсутствие в этих случаях существенного уменьшения СИ обеспечивается в основном компенсаторным механизмом Старлинга: увеличением силы сокращения неповрежденных кардиомиоцитов в результате их умеренного растяжения за счет дилатации ЛЖ. Обнаружение застойного типа
гемодинамики при ИМ является показанием для терапии диуретиками и венозными вазодилататорами.
Гипокинетический тип гемодинамики при ИМ характеризуется повышением ДЗЛА (выше 20-22 мм. рт. ст.) и ЦВД, снижением СИ (меньше 2 л/минуту/м2). Этот тип гемодинамики свидетельствует о критическом падении насосной функции ЛЖ и усугублении венозного застоя в легких, требует применения препаратов инотропного действия. Гиповолемический тип обусловлен значительным нарушением венозного возврата крови к сердцу, что сопровождается резким снижением ЦВД (меньше 5 мм рт. ст.), ДЗЛА и диастолического давления в легочной артерии(меньше 9 мм рт. ст.) и СИ(ниже 1,8- 2 л/минуту/м2), а также систолического АД (меньше 90 мм рт. ст.) и пульсового давления (меньше 30 мм рт. ст.). Гиповолемический шок может быть обусловлен повторной рвотой, выраженной потливостью, лихорадкой, избыточным
приемом мочегонных средств и усугубляется при введении растворов натрия
нитропруссида |
и применении |
наркотических |
анальгетиков - или |
адреноблокаторов. |
|
|
|
У части больных ИМ в острейшем периоде величина сердечного выброса сохраняется на должном уровне благодаря действию нескольких компенсаторных механизмов, в том числе умеренному повышению давления наполнения ЛЖ до 15-18 мм рт. ст. (норма 5-12 мм рт. ст.). Это обеспечивает достаточное
диастолическое наполнение |
ЛЖ, стенка |
которого благодаря |
выраженному |
|||
и распространенному |
ишемическому |
повреждению |
становится |
упругой |
||
и малорастяжимой (“жесткой”). |
|
|
|
|
||
Может наблюдаться умеренная дилатация ЛЖ, которая по механизму |
||||||
Старлинга сопровождается |
увеличением |
силы сокращения |
кардиомиоцитов |
|||
и поддержанием сердечного выброса на относительно нормальных значениях |
||||||
СИ. Ограничение венозного притока крови к сердцу |
и снижение величины |
|||||
ДЗЛА приводят к значительному уменьшению заполнения ЛЖ кровью во время |
|
|||||
диастолы и падению сердечного выброса. |
|
|
|
|
||
Лечение острой левожелудочковой недостаточности,
кардиогенного шока
278
Лечение больных ИМ, осложненным острой левожелудочковой недостаточностью, должно проводиться под постоянным контролем клинических, лабораторных, электрокардиографических данных, показателей гемодинамики.
Интенсивная терапия этих больных требует проведения максимально полного гемодинамического мониторинга с определением ДЗЛА, ЦВД, СИ, АД, ФВ. С этой целью может быть использована катетеризация правых отделов сердца катетером Свана-Ганца. При стойкой артериальной гипотензии показана установка артериального катетера. При отсутствии такой возможности приходится ориентироваться на тяжесть состояния больного, ЧДД, ЧСС, аускультативные признаки застоя крови в легких и проявления периферической гипоперфузии; величину системного АД; значения ЦВД; результаты динамического эхокардиографического исследования; значения почасового диуреза.
Лечение отека легких
Лечение больных с отеком легких должно быть направлено на коррекцию ДЗЛА, признаков застоя крови в малом круге кровообращения и нормализацию сердечного индекса. Выбор тактики лечения зависит от гемодинамического типа острой левожелудочковой недостаточности.
Если у больного с острой левожелудочковой недостаточностью систолическое АД нормально или умеренно снижено(выше 100-110 мм. рт. ст.), диа-
столическое |
давление |
в |
легочной артер(или ДЗЛА) составляет 18- |
20 мм. рт. ст. |
(норма 8-12 |
мм. |
рт. ст.), наблюдается удушье и влажные хрипы |
в легких, а СИ и ЦВД практически не изменены и отсутствуют признаки периферической гипоперфузии, показано применение следующих лечебных мероприятий.
Фуросемид (лазикс) вводят внутривенно в дозе 40-80 мг однократно или несколько раз в день. При необходимости разовые дозы введения препарата могут быть увеличены (максимальная суточная доза - 2000 мг). Фуросемид, обладающий мощным диуретическим действием, уменьшает ОЦК, АД, величину постнагрузки и преднагрузки, а также ДЗЛА, что сопровождается уменьшением или исчезновением одышки и влажных хрипов в легких. Гемодинамическая разгрузка малого круга кровообращения начинается уже через несколько минутуут после введения препарата, задолго до начала его диуретического действия (около 30 минуту). Внутривенное введение фуросемида целесообразно продолжать еще в течение 2-3 дней, а затем при необходимости перейти на пероральный прием препарата по40-80 мг в сутки (однократно). При лечении фуросемидом возможно нежелательное снижение систолического АД ниже90 мм рт. ст. и уменьшение СИ, что сопровождается уменьшением коронарной перфузии и расширением зоны некроза, а также развитием гипокалиемии (угроза появления аритмий). Поэтому лечение требует постоянного гемодинамического контроля за эффектами препарата.
279
Вазодилататоры (нитроглицерин) являются основными лекарственными средствами, которые используют для лечения отека легких у больных ИМ(при условии систолического АД не ниже90 мм рт. ст.). Нитроглицерин обладает выраженными венодилатирующими свойствами, что позволяет значительно и быстро уменьшить приток крови к сердцу, величину преднагрузки и давление наполнения ЛЖ и признаки застоя в малом круге кровообращения. Нитрогли-
церин, снижая тонус артериолярных |
сосудов, способствует уменьшению |
|
ОПСС, величины постнагрузки |
на ЛЖ и увеличению коронарной перфузии. |
|
Натрия нитропруссид в большей |
степени, |
чем нитроглицерин, оказывает влия- |
ние на артериолы. Поэтому у больных ИМ, осложненном отеком легких с сопутствующей АГ, более целесообразно назначение натрия нитропруссида. Нитроглицерин (1% спиртовой раствор) вводят внутривенно капельно на 0,9% растворе натрия хлорида, начиная с 5-10 мг в минуту с постепенным увеличением скорости каждые 10 минуту. Инфузию нитроглицерина прекращают: при достижении желаемого гемодинамического эффекта - уменьшении диастолического давления в легочной артерии (или ДЗЛА) до 15-17 мм. рт. ст. или при снижении систолического АД на 10-15% (но не ниже 90 мм. рт. ст.) или при появления побочных эффектов. В дальнейшем в течение 24-72 ч проводят “поддерживающие” инфузии раствора нитроглицерина, обеспечивающие оптимальный уровень давления заклинивая (ДЗЛА), и затем переходят к пероральному приему нитратов в обычных дозах (изосорбида динитрат, изосорбида мононитрат).
У больных АГ и отеком легких необходимо проведение внутривенных инфузий натрия нитропруссида, что обеспечивает снижение ДЗЛА и системного АД. Морфин подавляет избыточную активность дыхательного центра, устраняя тахипноэ. Морфин обладает периферическим вазодилатирующим действием, способствующим уменьшению венозного возврата крови к сердцу, снижению ДЗЛА и величины преднагрузки. Морфин вводят внутривенно струйно в дозе 2-5 мг. Оксигенотерапия показана практически во всех случаях отека легких. Использование ингаляций увлажняющего кислорода через носовые катетеры или подача100% кислорода с помощью маски со скоростью6-12
л/минуту позволяет уменьшить признаки гипоксии ЦНС и метаболического ацидоза, улучшить механические свойства самих легких. Повышение концентрации кислорода приводит к снижению афферентной импульсации с синокаротидных и других хеморецепторов и уменьшению тахипноэ.
Эффективными мерами, направленными на ограничение преднагрузки, могут быть введение моpфина гидpохлоpид 1 % 1 мл подкожно, внутримышечно или внутривенно, его аналогов (фентанил от 1-2 до 10 мл 0,005 %). Действенной мерой при проведении интенсивной терапии у данной категории больных является введение дpопеpидола в дозе 2-4 мл 0,25 % раствора.
При альвеолярном отеке легких необходимо использование пеногасителей (паров спирта). Наличие выраженных клинических признаков отека легких, соответствующих III классу по Т. Killip и J. Kimβall (1986), быстрое прогресси-
280
рование дыхательной недостаточности (спутанное сознание, выраженный цианозо или землистый цвет кожи, изменение величины зрачков, активное участие в дыхании вспомогательной мускулатуры на фоне выраженной одышки) являются показанием для интубации трахеи и проведения аппаратной искусственной вентиляции легких (ИВЛ) с положительным давлением в конце выдоха.
Более высокое внутриальвеолярное и внутрибронхиальное давление, создаваемое ИВЛ, способствует увеличению растяжимости легких, расправлению ателектазов и улучшению вентиляционно-перфузионных соотношений и газообмена. Повышенное внутригрудное давление нарушает венозный возврат крови к сердцу и способствует снижению ДЗЛА и разгрузке малого круга кровообращения. Гипокинетический тип гемодинамики. Если у больного с клинической картиной отека легких имеет место не только значительное повышение ДЗЛА (выше 20 мм. рт. ст.) и ЦВД, но и снижение СИ(меньше 2 л/минуту/м2)
и систолического АД, речь идет о выраженном нарушении насосной функции ЛЖ, которое нередко сочетается с признаками периферической гипоперфузии (олигурия, похолодание конечностей, артериальная гипотония), с начальными проявлениями кардиогенного шока. В этих случаях активное воздействие на ДЗЛА и застой крови в легких с использованием вазодилататоров должно сочетаться с обязательным применением препаратов, обладающих инотропным действием.
Добутамин (добутрекс) является селективным стимулятором1- β адренергических рецепторов с выраженным инотропным действием. Он мало влияет на ЧСС, снижает ОПСС и легочное сосудистое сопротивление, давление наполнения ЛЖ (ДЗЛА). Системное АД практически не изменяется. Добутамин вводят внутривенно капельно со скоростью2,5-10 мкг/кг/минуту. Допамин является агонистом допаминовых рецепторов и в относительно высоких дозах вызывает возбуждение α- и β-адренорецепторов, усиливая выделение норадреналина в синаптическую щель. Допамин увеличивает сократительную способность миокарда, сердечный выброс и оказывает заметное хронотропное действие на сердце, увеличивая ЧСС. В отличие от добутамина, допамин оказывает влияние на сосудистый тонус (α-адренорецепторы), повышает ОПСС и АД. Допамин применяют при тяжелой левожелудочковой недостаточности, сочетающейся с артериальной гипотензией. Препарат вводится внутривенно капельно со скоростью 5-10 мкг/кг/минуту. При отсутствии эффекта проводят инфузию допамина и добутамина в максимально переносимых дозировках.
Применение любых симпатомиметиков, обладающих мощным кардиостимулирующим действием, сопровождается увеличением потребности миокарда в кислороде. Поэтому при их передозировке у больных ИМ может усугубляться ишемия миокарда. В результате еще больше снижается сердечный выброс, повышается ДЗЛА, увеличиваются признаки застоя в легких. В связи с этим введение этих лекарственных средств больным ИМ должно проводиться под строгим контролем гемодинамических показателей. Норадреналин - адре-
281
номиметик, действующий преимущественно на α- и α -адренорецепторы и, в
1 2
меньшей степени, на β-адренорецепторы. Норадреналин обладает наиболее
1
выраженным прессорным эффектом, существенно повышает ОПСС и системное АД, увеличивая риск возникновения аритмий. Эти свойства норадреналина делают его малопригодным для лечения острой левожелудочковой недостаточности у больных ИМ, поскольку при его применении может усугубляться ишемия миокарда и возрастает риск возникновения аритмий.
Монотерапия норадреналином рассматривается в настоящее время как вынужденная мера при отсутствии других симпатомиметиков. Применение в качестве инотропного ЛС дигоксина не показано у больных ,ИМпоскольку часто сопровождается возникновением гликозидной интоксикации. При стабилизации состояния больных и нормализации АД переходят к инфузии вазодилататоров. Нередко введение нитроглицерина и симпатомиметиков осуществляют параллельно. Для коррекции микроциркуляторных нарушений и предотвращения дальнейшего тромбозирования коронарных сосудов у больных с -тя желыми проявлениями отека легких особенно целесообразно применение гепаринов и антиагрегантов (клопидогрель, блокаторы IIβ/IIIа рецепторов тромбоцитов, аспирина).
Лечение кардиогенного шока
Начиная терапию кардиогенного шока, следует определить форму этого осложнения. К числу таких патологических состояний относятся: 1. Рефлекторный (болевой) шок. 2. Аритмический шок. 3. Гиповолемия, вызванная обезвоживанием организма и уменьшением венозного притока крови к сердцу. 4. Истинный кардиогенный шок. Рефлекторный шок легко поддается лечению препаратами, купирующими болевой ангинозный приступ. Изредка требуется введение симпатомиметических аминутуов, которые быстро нормализуют системное АД.
Аритмический шок. Клинические проявления аритмического шока, вызванного падением сердечного выброса в результате возникновения тяжелых нарушений сердечного ритма и проводимости(пароксизмальная ЖТ, фибрилляция желудочков, АВ-блокады II-III степени), также сравнительно быстро купируются, если удается восстановить сердечный ритм с помощью электроимпульсной терапии (ЭИТ), ЭКС или антиаритмических средств. Гиповолемический шок. Лечение больных с гиповолемическим шоком имеет некоторые особенности. По понятным причинам, у этих больных, по крайней мере, на начальном этапе лечения не должны использоваться вазодилататоры(нитроглицерин и натрия нитропруссид), мочегонные средства, наркотические анальгетики.
Введение симпатомиметиков (добутаминуту, допаминуту, норадреналин) также противопоказано больным с выраженной гиповолемией. Лечение боль-
282
ных с гиповолемическим шоком должно быть направлено, прежде всего, на увеличение венозного возврата к сердцу, достижение оптимального уровня ДЗЛА (15-18 мм рт. ст.) и восстановление насосной функции ЛЖ преимущественно за счет увеличение преднагрузки и включения механизма Старлинга.
С этой целью больным с гиповолемией назначают инфузии 0,9% раствора натрия хлорида или низкомолекулярных декстранов реополиглюкина или декстрана 40. Последние не только эффективно возмещают внутрисосудистый объем крови, но и улучшают реологические свойства крови и микроциркуляцию. Лечение проводят под контролем ЦВД, ДЗЛА, СИ и АД. Введение жидкости прекращают при повышении систолического АД до100 мм. рт. ст. и выше и/или при повышении ДЗЛА(или диастолического давления в легочной артерии) до 18-20 мм. рт. ст., при появлении одышки и влажных хрипов в легких, повышении ЦВД.
После прекращения введения жидкости оценивают все гемодинамические показатели. При необходимости переходят к лечению острой левожелудочковой недостаточности. Введение симпатомиметиков, вазодилататоров, наркотических анальгетиков проводят с особой осторожностью под гемодинамическим контролем. Истинный кардиогенный шок. Лечение истинного кардиогенного шока до сих пор представляет чрезвычайно сложную задачу, летальность достигает 65-90%. Смертность от кардиогенного шока удается снизить до30-40% при своевременном кардиохирургическом вмешательстве, направленном на восстановление коронарного кровообращения в инфарктсвязанной КА(ЧТКА, АКШ).
Лечение кардиогенного шока включает: 1.Общие мероприятия: обезболивание; оксигенотерапию; тромболитическую терапию; гемодинамический мониторинг. 2. Внутривенное введение жидкости (при отсутствии противопоказаний). 3. Применение периферических вазодилататоров. 4. Применение инотропных средств. 5. Применение ЭИТ или ЭКС (при возникновении сердечных аритмий или нарушений проводимости). 6. Внутриаортальная баллонная контрпульсация. 7. Хирургическое лечение: БКА экстренная; КШ экстренная; оперативное лечение острого разрыва МЖП, разрыва или дисфункции папиллярных мышц.
После катетеризации правых отделов сердца и установки плавающего катетера Свана-Ганца в легочной артерии оценивают показатели центральной гемодинамики, клинические данные.
1. Если значения СИ ниже2,2 л/минуту/м2, величина диастолического давления в легочной артерии(или ДЗЛА) меньше 15 мм рт. ст., а рентгенологические и клинические признаки застоя крови в легких отсутствуют, лечение целесообразно начать с внутривенного введения0,9% раствора натрия хлорида или реополиглюкина. Введение жидкости продолжают до тех
283
пор, пока ДЗЛА не достигнет 18-20 мм рт. ст., а ЦВД - 15-20 мм рт. ст. При этих значения ДЗЛА и ЦВД дальнейшее введение жидкости противопоказано
2.Если диастолическое давление в легочной артерии(или ДЗЛА) изначально находится в пределах18-20 мм рт. ст. и имеются признаки умеренного застоя крови в легких (влажные хрипы), лечение начинают с симпатомиметиков
-добутаминутуа или/и допаминутуа.
3.Если ДЗЛА превышает 20 мм рт. ст. и имеются признаки легочного застоя и проявления отека легких, лечение инотропными средствами (добутаминуту или/и допаминуту) обязательно сочетают с внутривенным капельным введением раствора нитроглицерина или натрия нитропруссида. Проводится коррекция микроциркуляторных нарушений (гепарин, трентал, аспирин в обычных дозах), а также метаболического ацидоза и нарушений электролитного баланса.
4.При отсутствии эффекта и сохранении артериальной гипотонии показано проведение внутриаортальной баллонной контрпульсации. Используя артериальный доступ, в грудной отдел аорты вводят баллон, соединенный со специальным устройством, которое позволяет синхронизировать раздувание баллона с фазами сердечной деятельности: в систолу он спадается, а в диастолу - раздувается. Раздувание внутриаортального баллона в диастолу сопровождается увеличением диастолического давления в аорте. В результате возрастает перфузионное давление в коронарных сосудах, кровоток по которым осуществляется в диастолу, увеличивается кровоснабжение неповрежденного миокарда. Во время проведения внутриаортальной баллонной контрпульсации сердечный выброс увеличивается в среднем на40%, а КДД в ЛЖ снижается примерно на
20%, что нередко значительно улучшает перфузию периферических органов и тканей и состояние больного. После прекращения процедуры контрпульсации этот эффект полностью исчезает. Поэтому внутриаортальная контрпульсация у больных ИМ и кардиогенным шоком используетсядля того, чтобы выиграть время для проведения КАГ и подготовки к экстренному хирургическому вмешательству с целью ранней реваскуляризации ИМ.
Экстренная чрескожная транслюминутуальная ангиопластика и аортокоронарное шунтирование - наиболее распространенные оперативные вмешательства, направленные на реваскуляризацию миокарда у больных ИМ. Показаниями к экстренным хирургическим вмешательствам при ИМ являются: кардиогенный шок (не позже чем 12-18 ч от начала осложнения); тяжелая левожелудочковая недостаточность, обусловленная разрывом МЖП или острой митральной недостаточностью. В этих случаях АКШ сочетают с протезированием митрального клапана или закрытием дефекта МЖП. Повторные эпизоды жизнеопасных желудочковых аритмий(ЖТ, ФЖ), рефрактерных к ЭИТ и медикаментозной терапии. В этих случаях АКЩ сочетают с иссечением зоны инфаркта или аневризмэктомией.
284
НАРУШЕНИЯ РИТМА И ПРОВОДИМОСТИ
Разнообразные аритмии являются самыми частыми осложнениями ИМ. В первые часы и дни от начала заболевания они выявляются при мониторном ЭКГ-наблюдении у 90-95% больных ИМ. Некоторые из аритмий могут быть причиной тяжелых расстройств гемодинамики и летальных исходов. Причем 2/3 случаев аритмической смерти приходятся на первые 6 ч после развития ИМ.
По своему прогностическому значению все аритмии, встречающиеся при ИМ, делят на 4 группы (Сыркин А.Л., 2005): 1. Жизнеопасные аритмии - аритмии, являющиеся непосредственными причинами смерти: фибрилляция желудочков (ФЖ); асистолия; желудочковые тахикардии (ЖТ); АВ-блокада III степени (полная). 2. Аритмии, усугубляющие сердечную недостаточность и гипоперфузию жизненно важных органов: выраженная брадикардия любого происхождения (ЧСС < 50); выраженная синусовая тахикардия (ЧСС > 100 в минуту); пароксизмы трепетания и фибрилляции предсердий; пароксизмы наджелудочковой тахикардии. 3. Аритмии - предвестники жизнеопасных нарушений сердечного ритма: короткие пароксизмы (“пробежки”) желудочковой тахикардии; АВблокада II степени II типа по Мобитцу; прогрессирующие внутрижелудочковые блокады; частые, парные, ранние, полиморфные (политопные) ЖЭ. 4. Аритмии - “спутники” острого ИМ: умеренная синусовая тахикардия; наджелудочковые ЭС; редкие ЖЭ; медленный и ускоренный узловой ритм; АВ-блокады I и II степени (I типа по Мобитцу).
Все жизнеопасные аритмии (1-я группа) требуют проведения экстренных лечебных мероприятий, направленных на их купирование. Тактика ведения больных с аритмиями, относящимися ко 2-й и 3-й группам, должна быть чрезвычайно взвешенной и учитывать индивидуальный характер и тяжесть аритмий, их воздействие на гемодинамику и перфузию миокарда, возможность самостоятельного купирования аритмий при лечении основного заболевания, возможные неблагоприятные последствия противоаритмической терапии. Аритмии, относящиеся к IV группе, не требуют специального противоаритмического лечения.
Патогенез аритмий при инфаркте миокарда
Электрофизиологические механизмы возникновения аритмий у больных острым ИМ: патологический автоматизм и триггерная активность ишемизированных, но не подвергшихся некрозу субэндокардиальных волокон Пуркинье и кардиомиоцитов; формирование повторного входа (re-entry) и патологическая циркуляция волны возбуждения; нарушение функции проводимости; снижение функции автоматизма СА-узла. Основными факторами, способствующими формированию этих механизмов аритмий, являются локальное очаговое замедление и фрагментация волны возбуждения, распространяющейся в электрически неоднородной среде, отдельные участки которой отличаются различной длительностью ПД и рефрактерных периодов, скоростью спонтанной диасто-
285
лической деполяризации. Большое значение имеет также механическое растяжение волокон миокарда в результате дилатации камер сердца, наличие гипертрофии сердечной мышцы, а также нарушения нейрогуморальной регуляции сердечного ритма, электролитного обмена, кислотно-основного состояния, гиперкатехоламинутуемия.
Синусовые нарушения ритма
Синусовая брадикардия - урежение сердечных сокращений (< 60 в минуту) вследствие снижения автоматизма СА-узла. Синусовая брадикардия возникает при инфарктах заднедиафрагмальной области, поскольку именно в этих случаях происходит тромбоз ПКА, участвующей в кровоснабжении СА-узла. Нередко синусовая брадикардия у больных с нижним ИМ может явиться следствием ваготонической реакции по типу рефлекса Бецольда-Яриша, т к как в заднедиафрагмальной (нижней) стенке ЛЖ богато представлены афферентные
рецепторы n. vagi. В этих случаях синусовая брадикардия часто сочетается с выраженной артериальной гипотонией, болями в эпигастральной области(в первые часы ИМ), тошнотой и рвотой.
Для купирования брадикардии внутривенно струйно вводят0,5-1,0 мг атропина сульфата. Если ЧСС не увеличивается, через несколько минутуут атропин вводят повторно в тех же дозах. Если эффект все же отсутствует
иЧСС не превышает 40-50 ударов в минуту, сохраняется низкое АД, падает СИ
ипоявляются признаки периферической гипоперфузии тканей и органов, показана временная ЭКС. Синусовая брадикардия, не сопровождающаяся ухудшением состояния больного, специального лечения не требует. Синусовая тахикардия - увеличение ЧСС > 100 ударов встречается у 1/4 - 1/3 больных ИМ, чаще передней локализации. Наиболее частыми причинами синусовой тахикардии у больных ИМ являются: активация САС и гиперкатехоламинутуемия (стресс, боль, страх смерти в первые часы заболевания); острая сердечная недостаточность; гиповолемия; сопутствующий перикардит; лихорадка; застойная
сердечная |
недостаточность (в поздние |
сроки );ИМострые желудочно- |
кишечные |
кровотечения и другие причины. |
Хотя синусовая тахикардия ведет |
к увеличению потребности миокарда в кислороде и в условиях острого тромбоза КА может способствовать расширению зоны некроза, в большинстве случаев она не требует специального лечения, поскольку при устранении указанных
причин |
аритмии |
купируется |
и сама |
синусовая . тахикардияКогда |
ЧСС превышает 110-120 ударов, показано |
дополнительное назначение малых |
|||
доз β-адреноблокаторов. |
|
|
|
|
Наджелудочковые нарушения ритма
Наджелудочковая экстрасистолия (предсердная, узловая) регистрируется у 20-25% больных ИМ. В большинстве случаев ее появление не требует специального противоаритмического лечения. Фибрилляция предсердий встречается
286
примерно у 10-15% больных ИМ, в том числе у больных ИМ правого желудочка. Ее возникновение связано, в первую очередь, с растяжением стенок предсердия при повышении в нем давления при острой сердечной недостаточности или с распространением ишемического повреждения на миокард предсердий.
Возникновение тахисистолической формы фибрилляции предсердий может способствовать нарушению перфузии миокарда и усугублению признаков сердечной недостаточности. Решение вопроса о необходимости экстренного купирования пароксизма мерцательной аритмии у больных ИМ должно быть взвешенным. При нормосистолической или брадисистолической форме мерцательной аритмии лечения не требуется, так как у многих больных ИМ через -не сколько дней синусовый ритм восстанавливается самостоятельно.
Тахисистолическая форма фибрилляции предсердий при плохой ее переносимости больным и/или при нарастании признаков сердечной недостаточности требует купирования пароксизма. С этой целью лучше использовать амиодарон (300-450 мг внутривенно капельно) или ЭИТ. Предварительно необходимо оценить, насколько эффективным может оказаться купирование пароксизма мерцательной аритмии, насколько высока вероятность рецидива фибрилляции предсердий. Пароксизмальная наджелудочковая тахикардия(предсердная или из АВ-соединения) характеризуется очень высоким ритмом желудочков(до 120-250 в минуту), что, несомненно, оказывает выраженное отрицательное влияние на функциональное состояние ЛЖ и перфузию миокарда. Купирование пароксизма наджелудочковой тахикардии целесообразно начинать сбыстрого болюсного внутривенного введения 6-12 мг аденозина (АТФ). При отсутствии эффекта введение АТФ повторяют или вводят новокаинамид, аймалин или другой противоаритмический препарат.
Желудочковые нарушения ритма
Желудочковую экстрасистолию (ЖЭ) обнаруживают почти у всех больных ИМ. Сами по себе ЖЭ не оказывают сколько-нибудь существенного влияния на гемодинамику и перфузию миокарда. Некоторые из них свидетельствуют о наличии выраженной негомогенности миокарда ЛЖ, которая может являться причиной других, жизнеопасных, аритмий: желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ). К прогностически неблагоприятным ЖЭ, которые ассоциируются с высоким риском возникновения ЖТ и ФЖ, традиционно относят: частые ЖЭ (более 30 в час); политопные и полиморфные ЖЭ; ранние ЖЭ (типа “R на Т”); парные ЖЭ; групповые и “залповые” ЖЭ. Эти виды ЖЭ расцениваются как своеобразные предвестники ЖТ и ФЖ.
В последние годы убедительно показано, что и другие виды ЖЭ (поздние ЖЭ) нередко предшествуют ФЖ. Перечисленные виды “угрожающих” ЖЭ иногда выявляются у молодых здоровых лиц. Это свидетельствует о том, что вопрос о прогностическом значении желудочковой экстрасистолии у больных ИМ далек от своего разрешения. Появление любой желудочковой эктопической ак-
287
тивности у больного ИМ, особенно в первые часы заболевания, должно служить поводом для особой настороженности врача в отношении возможности ФЖ. ЖЭ не является поводом для немедленного профилактического назначения антиаритмических препаратов(лидокаина), как это считалось совсем недавно, поскольку неоправданное применение этих препаратов у больных ИМ повышает риск развития асистолии желудочков и внезапной сердечной смерти.
С профилактической целью могут использоваться β-адреноблокаторы.
Короткие эпизоды (“пробежки”) желудочковой тахикардии (ЖТ), состоящие из нескольких следующих друг за другом ЖЭ, не оказывают влияния на гемодинамику, уровень АД и коронарный кровоток и нередко остаются незамеченными больными. Как правило, они выявляются при мониторном наблюдении ЭКГ и не требуют специального антиаритмического лечения, за исключением возможного назначения β-адреноблокаторов. Стойкая ЖТ с частотой ритма 160-220 в минуту может приводить к расширению зоны некроза и ишемии миокарда, снижению насосной функции сердца и периферической гипоперфузии. Неблагоприятными исходами такой формы ЖТ являются: отек легких; аритмический шок; развитие ФЖ; синкопальные состояния (обмороки) вплоть до возникновения типичных приступов Морганьи-Адамса-Стокса с потерей сознания и судорогами. При стойкой ЖТ необходимо экстренное купирование пароксизма.
Можно использовать следующую последовательность лечебных мероприятий: 1. Удар кулаком в грудь. Этот прием нередко позволяет прервать патологическую циркуляцию волны возбуждения. 2. Медикаментозное купирование пароксизма. Лидокаин вводят внутривенно струйно в дозе50 мг. При отсутствии эффекта через2 минуту возможно повторное введение препарата в той же дозе. После купирования пароксизма ЖТ назначают внутривенно медленно инфузию лидокаина в дозе100-150 мг. 3. При отсутствии эффeкта от введения лидокаина проводят электрическую кардиоверсию. Иногда приступы ЖТ можно купировать с помощью учащающей программированной электрической стимуляции сердца.
Фибрилляция желудочков (ФЖ) характеризуется внезапной потерей сознания, отсутствием тонов сердца и артериального пульса, АД не определяется. Возникает агональное дыхание, которое вскоре прекращается совсем (клиническая смерть). Различают первичную фибрилляцию, которая развивается в первые минутууты и часы ИМ. На долю первичной ФЖ приходится около 80% всех случаев этого осложнения. Вторичную ФЖ, которая возникает через несколько дней от начала ИМ и сочетается с острой левожелудочковой недостаточностью и/или кардиогенным шоком; позднюю ФЖ, которая развивается на 2-6-й неделе заболевания. Наиболее неблагоприятной в прогностическом от-
ношении является вторичная ФЖ. Риск рецидива ФЖ и внезапной смерти у больных, перенесших кардиоверсию, чрезвычайно велик.
288
Нарушения АВ-проводимости
АВ-блокада I степени не требует специального лечения, хотя при ее возникновении необходимо отменить β-адреноблокаторы. АВ-бокада II степени I типа Мобитца характеризуется постепенным удлинением интервала-Q(R)Р с периодическим выпадением желудочкового комплексаQRST. Этот вид АВблокады обычно носит преходящий характер и сохраняется в течение первых3- х дней от начала ИМ. Блокада вызвана обычно ишемией АВ-узла, связанной с окклюзией ПКА при заднедиафрагмальном ИМ. В возникновении этого типа блокады нередко имеет значение рефлекторное повышение тонуса блуждающего нерва. Лечение включает атропин подкожно0,5-1 мг или в вену- 0,3-0,5 мг 2-3 раза в сутки. Общая суточная доза не должна превышать 3 мл 0,1% раствора атропина. При падении АД, показателей гемодинамики или кардиогенном шоке целесообразно применение ЭКС. АВ-блокада II степени II типа Мобитца на ЭКГ представлена постоянным (нормальным или удлиненным) интервалом Р- Q(R) и периодическими выпадениями желудочкового комплекса. Этот тип блокады обусловлен необратимым проведением возбуждения в нижней части пучка Гиса, нередко в сочетании с блокадой левой передней, левой задней или правой ветви пучка Гиса.
АВ-блокада II степени II типа Мобитца при ИМ имеет весьма неблагоприятный прогноз, нередко внезапно переходит в АВ-блокадуIII степени (полную). Поэтому во всех случаях АВ-блокадыII степени II типа целесообразно применение временной ЭКС. АВ-блокада III степени (полная) может развиться
впервые часы и дни ИМ. В целом это нарушение предсердно-желудочкового проведения имеет неблагоприятный прогноз, хотя многое зависит от локализации нарушенного проведения и характера замещающего ритма. При проксимальной АВ-блокаде III степени эктопический водитель ритма располагается обычно в АВ-соединении ниже места блокады. На ЭКГ регистрируют полное разобщение предсердного и желудочкового ритмов, ЧСС превышает 40 ударов
вминуту, а желудочковые комплексы QRS не изменены (“узкие”). Подобная блокада часто сочетается с заднедиафрагмальным ИМ и высоким тонусом блуждающего нерва. В большинстве случаев она исчезает через несколько дней от начала заболевания, мало осложняя прогноз ИМ.
АНЕВРИЗМА ЛЕВОГО ЖЕЛУДОЧКА
Аневризма левого желудочка - это ограниченное выбухание истонченного и не сокращающегося участка стенки ЛЖ, состоящего из некротизированной или рубцовой ткани. Аневризма развивается при обширных трансмуральных ИМ, преимущественно в области верхушки и передней стенки ЛЖ. Аневризма ПЖ встречается крайне редко. Ограниченное выпячивание некротизированной стенки желудочка во время его систолы (дискинезия) наблюдается в остром периоде заболевания практически у всех больных ИМ с зубцомQ. Это динамическая аневризма ЛЖважный признак трансмурального ИМ. Со временем в
289
этой области происходит формирование полноценного плотного рубца, локальное систолическое выпячивание стенки желудочка (дискинезия) у большинства больных исчезает, и в этой зоне остаются лишь эхокардиографические признаки локальной акинезии(отсутствия движения стенки желудочка). В 15-20% случаев трансмурального ИМ аневризма сохраняется. Основными факторами, способствующими образованию истинной аневризмы ЛЖ, являются: обширное трансмуральное поражение ЛЖ; сопутствующая АГ; повышение внутрижелудочкового давления любого генеза; повышенная физическая активность больного в острой и подострой стадиях ИМ, нарушения постельного режима; нарушения процесса консолидации (уплотнения) рубца.
Формирование аневризмы ЛЖ может иметь ряд неблагоприятныхпо следствий: 1. Увеличение и деформация полости ЛЖ, согласно закону Лапласа, сопровождаются ростом внутримиокардиального напряжения неповрежденных участков сердечной мышцы, увеличивая тем самым общую потребность миокарда в кислороде и способствуя возрастанию признаков коронарной недоста-
точности. 2. При аневризме еще больше усугубляются систолическая и диастолическая дисфункции ЛЖ, снижается сердечный выброс, возрастает КДД ЛЖ и давление наполнения желудочка. Это повышает риск возникновения застоя крови в малом круге кровообращения и других признаков сердечной недостаточности. 3. В области аневризмы формируется пристеночный тромб, что может приводить к развитию тромбоэмболических осложнений. Наличие аневризмы способствует формированию повторного входа и патологической цирку-
ляции волны возбуждения (macro-re-entry) с развитием жизнеопасных желудочковых нарушений ритма (пароксизмальной ЖТ и ФЖ). Летальность больных трансмуральным ИМ, осложненным аневризмой ЛЖ, в 4-5 раз выше, чем больных без аневризмы.
Диагностика
Диагностика аневризмы ЛЖ основывается на выявлении следующих клинических и инструментальных признаков: 1. Отмечается прогрессирующая сердечная недостаточность, рефрактерная к медикаментозной терапии. Обнаружение при пальпации сердца отчетливой локальной прекардиальной пульсации
вIII-IV межреберье слева от грудины или появление ранее отсутствовавшей пульсации в области верхушечного толчка. В этом последнем случае (аневризма верхушки) часто пальпируется так называемый“двойной” верхушечный толчок, отражающий пассивное движение тонкой аневризматической стенки во время систолы желудочка, в период систолы левого предсердия. Это бывает хорошо видно на кривой верхушечной кардиограммы(апекскардиограммы), отражающей механическое движение верхушки сердца во время сердечного цикла. I тон над верхушкой ослаблен. Часто выслушиваются добавочные III или IV тоны. При аускультации сердца в этих случаях часто определяется ритм галопа. Характерны систолический и др. шумы над верхушкой ввидузавихрения крови
ваневризматическом мешке, недостаточности митрального клапана. Нередко
290
определяется симптом Казем-Бека- верхушечный толчок усилен(пульсация аневризмы), а пульс слабого наполнения и напряжения.
2.Отсутствие типичной динамики ЭКГ в остром, подостром и постинфарктном периодах (“застывшая” ЭКГ). На ЭКГ выявляются признаки обширного трансмурального ИМ (патологический QS или Qr) с подъемом сегмента RS-Т, сохраняющимся более 2-3 недель от начала заболевания. Последний признак является наиболее надежным для диагностики аневризмы, свидетельствуя
оналичии вокруг аневризмы обширной зоны повреждения тканей, вызванного постоянным механическим растяжением этих участков миокарда, возникающим при каждом сокращении сердца и выбухании стенки аневризмы.
3.Эхокардиографические признаки локального ограниченного выбухания
(дискинезии) и истончения стенки ЛЖ. При двухмерной ЭхоКГ у больных с трансмуральным ИМ динамическая аневризма ЛЖ проявляется дискинезией миокарда в виде локальной деформации(выбухания) внутреннего контура ЛЖ только во время систолы желудочка. В отличие от этого истинная аневризма ЛЖ проявляется стойкой систолической и диастолической деформацией внутреннего контура и наличием резко выраженной демаркационной линии на границе с интактными сегментами (рисунок 20).
Рисунок 20. Острая аневризма левого желудочка у больного П., 66 лет с повтоным обширным трансмуральным инфарктом миокарда, формированием внутрисердечного тромба (Г.А. Пичко).
4. Рентгенологически можно обнаружить лишь обширные аневризмы, захватывающие верхушку и переднебоковую стенку ЛЖ. В зависимости от периода ИМ, в котором обнаруживаются перечисленные признаки, различают острую и хроническую аневризму ЛЖ.
291
Лечение
Эффективное лечение аневризмы ЛЖ заключается в иссечении аневризматического мешка. Аневризмэктомия показана при быстром прогрессировании сердечной недостаточности, возникновении тяжелых повторных желудочковых нарушений ритма, рефрактерных к консервативной терапии, при повторных тромбоэмболиях из пристеночного тромба, располагающегося в области аневризмы. Консервативная терапия заключается в лечении ХСН и использовании антиагрегантов для профилактики развития внутрисердечного тромбоза.
РАЗРЫВ СЕРДЦА
Разрывы сердца относятся к ранним, фатальным осложнениям трансмурального ИМ. В большинстве случаев происходят в первые3-5 дней от начала заболевания. После 2-х недель инфаркта разрывы встречаются очень редко, поскольку к этому времени в области инфаркта начинает формироваться плотный рубец, препятствующий возникновению разрывов. Различают внешние и внутренние разрывы сердца. При внешних разрывах кровь из полости ЛЖ быстро проникает в полость перикарда и развивается тампонада сердца, веду-
щая к его остановке. К внутренним разрывам относят разрывы МЖП и сосочковых мышц, что также приводит к тяжелым гемодинамическим нарушениям, резко ухудшающим прогноз ИМ. По данным Американской ассоциации сердца (2004) разрывы стенки желудочка осложняют течение ИМ с зубцом
Q в 3-6% случаев и наблюдаются преимущественно при передней локализации ИМ, у больных старше 50-60 лет, у женщин, особенно при наличии сопутствующей АГ, а также использование глюкокортикостероидов или нестероидных противовоспалительных препаратов. Преобладают внешние разрывы ЛЖ. Разрывы ПЖ встречаются крайне редко.
Внешние разрывы
Разрыв свободной стенки ЛЖ часто протекает молниеносно. Кровь из полости ЛЖ изливается в полость перикарда и возникает гемотампонада, приводящая к остановке сердца и мгновенной смерти. В других случаях быстро на-
растающие клинические проявления разрыва сердца можно наблюдать в течение нескольких минутуут, реже часов. У больного внезапно появляются интенсивные упорные боли за грудиной, в области сердца, не купирующиеся наркотическими анальгетиками. Определяется острое расширение границ сердца АД резко снижается или вовсе не определяется. Развивается кардиогенный шок. Артериальный пульс становится нитевидным и исчезает совсем. Больной теряет сознание. С трудом прослушиваются тоны сердца. Появляется выраженный цианоз, быстро набухают шейные вены. Возникающая брадикардия позволяет заподозрить развитие тампонады сердца. Отмечается рефрактерность к реанимационным мероприятиям.
292
На ЭКГ-мониторе в течение короткого времени продолжает определяться синусовый или эктопический ритм. Сердце сокращается, но кровь в аорту практически не поступает, а попадает в полость перикарда. Подобное несоответствие между продолжающейся электрической активностью сердца и отсутствием насосной функции получило название“электромеханическая диссоциация”. При развитии тампонады сердца она очень быстро переходит в асистолию желудочков. В еще более редких случаях наблюдается подострый разрыв свободной стенки ЛЖ. Размеры такого надрыва стенки не столь велики, и он может даже частично тромбироваться. Поэтому кровь сравнительно медленно заполняет полость перикарда, и клиническая картина гемотампонады нарастает постепенно. Часто при таком варианте развития тампонады на первый план выступает болевой синдром, возникающий за часы до развития тампонады, связанный с постепенно распространяющимся в толще миокарда надрывом стенки сердца и пропитыванием ее кровью.
Интенсивная боль за грудиной, быстрое падение АД, вновь выявляемый подъем сегмента RS-Т в нескольких отведениях ЭКГ очень напоминутуают клинику рецидивирующего ИМ, осложненного кардиогенным шоком. В этих условиях по понятным причинам очень опасно применение антикоагулянтов, тромболитической терапии или инотропных средств. Поэтому столь важна своевременная диагностика гемотампонады. Она может быть основана на данных экстренной ЭхоКГ(выявление жидкости в полости перикарда)
и результатах гемодинамического мониторинга(быстрое повышение ЦВД при сниженных величинах ДЗЛА). В этих случаях иногда удается направить больного на экстренную кардиохирургическую операцию.
Разрыв межжелудочковой перегородки
Разрыв МЖП также возникает в течение первых7 дней, редко - на протяжении 2-х недель от начала ИМ. При перфорации МЖП часть ударного объема ЛЖ выбрасывается в ПЖ, что приводит к значительным гемодинамическим нарушениям. Объемная перегрузка ПЖ может сопровождаться признаками быстро нарастающей правожелудочковой недостаточности. Увеличение нагрузки на
ЛЖ и снижение эффективного сердечного выброса в аорту сопровождаются усугублением признаков левожелудочковой недостаточностиотека легких и кардиогенного шока. Если не проводится хирургическая коррекция дефекта, более половины больных с разрывом МЖП умирают в течение ближайшей недели.
Клиническая картина разрыва МЖП складывается из нескольких признаков: 1.Внезапное ухудшение состояния больных: появление и быстрое нарастание признаков правожелудочковой недостаточности (цианоз, отеки, увеличение печени, набухание шейных вен, рост ЦВД); усугубление признаков острой левожелудочковой недостаточности и отека легких(одышка и удушье, влажные хрипы в легких, рост ДЗЛА); появление признаков кардиогенного шока (СИ <
293
1,8-2,0 л/минуту/м2, систолическое АД < 90 мм. рт. ст., признаки периферической гипоперфузии, олигурия). 2. Внезапное появление над всей прекардиальной областью грубого пансистолического шума с максимумом вIII-IV межреберье по левому краю грудины. Шум может проводиться в межлопаточное пространство и часто сопровождается признаками дилатации ПЖ. Внезапное появление прекардиального систолического дрожания, выявляемого при пальпации области сердца
Для верификации разрыва МЖП чаще всего используют два инструментальных метода исследования: 1. Катетеризация правых отделов сердца и легочной артерии с определением концентрации кислорода в правых камерах сердца. В норме содержание кислорода в ПП и ПЖ примерно одинаковое, тогда как при перфорации МЖП часть артериальной крови с богатым содержанием кислорода попадает в ПЖ. Поэтому РО2 в ПЖ оказывается существенно выше, чем в ПП, что подтверждает диагноз разрыва МЖП. 2. Метод допплер-ЭхоКГ, который позволяет обнаружить систолический поток крови из ЛЖ в ПЖ через дефект МЖП. При подтверждении диагноза разрыва МЖП больной должен быть направлен на экстренное хирургическое лечение, которое является единственным способом лечения таких больных. Целесообразна предварительная стабилизация нарушенной гемодинамики с использованием внутриаортальной баллонной контрпульсации и внутривенного капельного введения растворов нитроглицерина и натрия нитропруссида.
Разрыв сосочковых мышц
Разрыв сосочковых мышц осложняет течение трансмурального ИМ в1% случаев. Чаще поражается задняя сосочковая мышца в связи с тем, что она кровоснабжается хуже, чем переднебоковая. В результате нарушается функция митрального клапана: во время систолы желудочка одна из створок провисает в полость ЛП. Несмыкание створок митрального клапана приводит к тяжелой относительной митральной недостаточности, острое возникновение которой способствует резкой объемной перегрузке ЛЖ и ЛП. В результате быстро развивается тяжелая левожелудочковая недостаточность и отек легких. Клиническими признаками разрыва сосочковой мышцы являются: 1. Внезапное развитие острой левожелудочковой недостаточности(отека легких). 2. Систолический шум на верхушке, проводящийся в левую подмышечную область. Шум нередко сопровождается дилатацией ЛП и ЛЖ(по данным перкуссии сердца и ЭхоКГ - исследования), а также ослаблением I тона на верхушке. 3. Главным признаком разрыва сосочковой мышцы является“молотящая” створка митрального клапана (по данным двухмерной ЭхоКГ), которая провисает во время систолы желудочков в полость ЛП. 4. При допплеровском режиме исследования обнаруживается эксцентрически расположенная струя регургитации, распространяющаяся в левое предсердие в сторону от пораженной створки. При разрыве передней папиллярной мышцы струя направлена в сторону заднебоковой стенки ЛП, а при разрыве задней сосочковой мышцы - в сторону МЖП.
294
Лечение разрывов сосочковой мышцы только хирургическое. Перед операцией необходима стабилизация гемодинамики и состояния больного, в связи с чем используют внутривенные инфузии нитроглицерина и натрия нитропруссида, а также внутриаортальную баллонную контрпульсацию. Если эти предварительные лечебные мероприятия имеют успех, целесообразно отложить проведение радикальной операции на 4-6 недель после инфаркта. Если же состояние больного не улучшается, показано экстренное оперативное вмешательство.
Относительная недостаточность митрального клапана у больных ИМ может развиться не только в результате разрыва сосочковой мышцы, но и при их выраженной дисфункции, которая наблюдается у большинства больных ИМ с зубцом Q в течение 1-й недели заболевания. Дисфункция сосочковых мышц
в этих случаях обусловлена их ишемией или вовлечением в некротический процесс. Определенное значение может иметь изменение размеров и формы ЛЖ, обусловленное его ремоделированием и снижением сократимости. Клинически определяется систолический шум на верхушке, проводящийся в левую подмышечную область, признаки систолической регургитации крови в ЛП при допплер-ЭхоКГ. Однако в этих случаях отсутствует основной признак разрыва сосочковой мышцы - “молотящая” створка митрального клапана и выявляется лишь небольшое пролабирование одной из створок клапана. Дисфункция сосочковой мышцы не требует специального лечения: в большинстве случаев на фоне интенсивной терапии ИМ признаки дисфункции уменьшаются.
Проведение тромболитической терапии и других методов ранней реваскуляризации миокарда позволяет уменьшить зону некроза, существенно снизить риск формрования разрыва миокарда. Большое внимание необходимо уделять соблюдению строгого постельного режима в первые несколько дней от развития ИМ. Развивающийся у некоторых больных ИМ запор также может расцениваться фактором риска развития разрыва миокарда. Приводим наблюдение. Больная Б., 62 лет на третьи сутки ИМ была переведена из отделения реанимации в палату кардиологического отделения. Пошла в сопровождении родственницы в туалет, где внезапно потеряла сознание. Проведение реанимационных мероприятий было безуспешным. На вскрытии подтверждено развитие внешнего разрыва сердца.
ПЕРИКАРДИТ
У большинства больных трансмуральным ИМ на2-4-е сутки болезни может развиться реактивный фибринозный или серозно-фибринозный перикардит с небольшим объемом выпота в перикарде. В клинической практике перикардит обнаруживают только у5-10% больных ИМ, что связано со сложностями его диагностики.
Клиническая картина
295
Перикардит у больного ИМ с зубцомQ можно заподозрить по следующим клинико-инструментальным признакам. Необъяснимое возобновление болей в области сердца на2-4-й день болезни, которое нередко трактуют как рецидив ИМ, расширение зоны некроза. Однако боль в области сердца при перикардите отличается от типичного ангинозного приступа, характерного для ИМ.
Она носит постоянный, тупой характер, интенсивность боли усиливается при глубоком дыхании, кашле, глотании. Интенсивность боли меняется в зависимости от положения тела больного, чаще усиливаясь в положении лежа на спине и уменьшаясь - в положении сидя.
2.Шум трения перикарда выслушивается при сухом перикардите, но только при поражении передней стенки ЛЖ и верхушки сердца. Шум трения выслушивается на ограниченном участке, обычно в области верхушки или абсолютной тупости сердца, лучше - в положении сидя. Шум сохраняется очень непродолжительное время (от нескольких часов до2-3 суток). При появлении выпота в полости перикарда шум трения исчезает.
3.Развитие перикардита может сопровождаться повышением температуры тела до субфебрильных цифр.
4.Инструментальная диагностика перикардита нередко затруднена. Типичные ЭКГ-признаки перикардита(снижение вольтажа желудочкового комплекса, однонаправленный конкордантный подъем сегмента RS-Т в нескольких отведениях) часто нивелируются на фоне выраженных инфарктных изменений комплекса QRSТ. К характерным признакам перикардита перикардита относят депрессия сегмента PR, элевацию точки J с вогнутой вниз косовосходящей элевацией ST.
5.Эхокардиография может оказать существенную помощь в диагностике только при выпотных перикардитах. В этих случаях на ЭхоКГ выявляется сепарация париетального и висцерального листков перикарда. При незначительном количестве жидкости расхождение листов перикарда выявляется только за задней стенкой ЛЖ в систолу и немного диастолу.
Лечение
В большинстве случаев специального лечения эпистенокардического перикардита не требуется. При появлении отчетливых признаков острого перикардита (упорные боли в области сердца, шум трения перикарда) назначают ацетилсалициловую кислоту (150-350 мг 4 раза в сутки) или другие НПВС (ортофен, ибупрофен, диклофенак, мовалис) в обычных терапевтических дозах. В отдельных случаях возможно парентеральное назначение глюкокортикоидов (преднизолон, метипред).
ТРОМБОЭМБОЛИИ
296
Тромбоэмболические осложнения существенно ухудшают прогноз больных ИМ. В связи с широким внедрением в лечении ИМ тромболитических препаратов, антикоагулянтов и дезагрегантов частота тромбоэмболических осложнений ИМ снизилась до 5-10%. Источником тромбоэмболий артерий являются: пристеночные тромбы в полости ЛЖ и тромбы в левом предсердии, формирующиеся при фибрилляции предсердий. Особенно большую опасность представляют подвижные тромбы. Отрываясь от места их образования, тромбы или их частицы окклюзируют артериальное сосудистое русло, вызывая ишемию и некроз органов.
Тромбоэмболия сосудов головного мозга сопровождается внезапно возникающей неврологической симптоматикой, чаще всего - признаками нарушения мозгового кровообращения (гемипарез, гемиплегия, дизартрия, потеря сознания, расстройства функции тазовых органов). Тромбоэмболия мезентериальных артерий является причиной некроза кишечника и развития перитонита.
Внезапно у больных появляются очень интенсивные и быстро нарастающие жгучие и нестерпимые боли в животе, которые не купируются ни спазмолитиками, ни наркотическими анальгетиками. Быстро развивается парез кишечника и появляются симптомы острого перитонита и нарастающей интоксикации.
В крови определяется выраженный лейкоцитоз и значительный сдвиг лейкоцитарной формулы влево. Тромбоэмболия артерий конечностей проявляется несколькими внезапно наступающими симптомами: резкой нестерпимой болью в конечности; побледнением и похолоданием конечности; отсутствием артериального пульса ниже места окклюзии.
Быстро развиваются трофические изменения и гангрена конечности. Тромбоэмболия почечной артерии приводит к развитию инфаркта почек. Внезапно появляются боли в поясничной области и в левом или в правом подреберье, гематурия, олигурия. Обычно отмечается подъем АД, обусловленный ишемией почки. Тромбоэмболия легочной артерии (ТЭЛА) развивается гораздо чаще, чем эмболии артерий большого круга кровообращения, Источником ТЭЛА в большинстве случаев являются тромбы в глубоких венах нижних конечностей.
Профилактика тромбоэмболических осложнений включает: 1. Своевременную диагностику внутрисердечных тромбов и тромбов в глубоких венах нижних конечностей у всех больных трансмуральным ИМ. Наилучшим способом неинвазивной диагностики служит эхокардиография и дуплексное ультразвуковое исследование вен нижних конечностей. 2. При обнаружении подвижных тромбов в полости ЛЖ целесообразно назначение антикоагулянтов: нефракционированного или низкомолекулярных гепаринов с последующим переводом больных на прием непрямых антикоагулянтов(варфарин, фенилин)
в течение длительного времени(3-6 месяцев). 3. Для профилактики тромбоза глубоких вен ног рекомендуется ранняя активизация больных, занятия лечебной физкультурой.
297
СИНДРОМ ДРЕССЛЕРА
Постинфарктный синдром - это аутоиммунное поражение перикарда, плевры и легких, возникающее обычно на 2-6-й неделе от начала ИМ. Типичная триада, характерная для постинфарктного синдрома(перикардит, плеврит, пневмонит), иногда сочетается с аутоиммунным поражением синовиальных оболочек суставов. Постинфарктный синдром связывают с обнаружением в организме больных ИМ аутоантител к миокардиальным и перикардиальным антигенам.
Клиническая картина постинфарктного синдрома различается у разных больных в зависимости от преимущественного поражения перечисленных -се розных оболочек и легких. Однако обязательным является асептический аутоиммунный процесс в перикарде - перикардит. Перикардит при синдроме Дресслера обычно протекает нетяжело. На 2-6-й неделе заболевания появляются боли в области сердца, которые носят постоянный, неострый характер и не купиру-
ются |
нитроглицерином. |
Их продолжительность |
достигает30-40 минуту |
и больше. Одновременно |
повышается температура |
тела до субфебрильных |
|
цифр, появляется слабость. Болевой синдром и лихорадка исчезают через несколько дней. Количество экссудата, накапливающегося в полости перикарда, невелико и не приводит к нарушениям гемодинамики. Изменения ЭКГ обычно мало выражены. При двухмерной ЭхоКГ можно обнаружить уплотнение листков перикарда и их небольшую сепарацию.
Плеврит при постинфарктном синдроме может быть как односторонним, так и двусторонним. В начале заболевания появляются боли в грудной клетке,
усиливающиеся |
при дыхании, выслушивается шум трения плевры. Когда |
в плевральной |
полости накапливается экссудат, боли прекращаются, и шум |
трения не выслушивается. При объективном исследовании обнаруживают небольшое притупление перкуторного звука и ослабление дыхания на стороне поражения. При развитии междолевого плеврита физикальные изменения в легких могут быть очень скудными. Диагноз подтверждается только при рентгенологическом исследовании. Аутоиммунный пневмонит при постинфарктном синдроме выявляется несколько реже, чем перикардит и плеврит. Субъективно пневмонит проявляется усугублением одышки, что нередко расценивается как признак левожелудочковой недостаточности.
Однако назначение диуретиков или инотропных лекарственных средств не приносит облегчения. При объективном исследовании в легких выявляется ограниченный участок, в котором на фоне несколько ослабленного дыхания на высоте вдоха выслушивается крепитация. Иногда могут появляться мелкопузырчатые влажные хрипы. Лишь изредка, если очаг иммунного воспаления достаточно велик, можно выявить небольшое притупление перкуторного звука. В остальных случаях над легкими определяется ясный легочный звук.
298
Лечение постинфарктного синдрома заключается в назначении нестероидных противовоспалительных средств, а в более тяжелых случаях - глюкокортикоидов. Глюкокортикоиды оказывают выраженный и быстрый эффект в связи с аутоиммунным генезом данного осложнения. Преднизолон назначают внутрь в дозе 20-30 мг в сутки, постепенно снижая дозу, примерно на 2,5-5 мг в неделю. При рецидивирующем течении постинфарктного синдрома лечение продолжают в течение нескольких недель. НПВС достаточно эффективны при постинфарктном синдроме, особенно при нетяжелых клинических проявлениях синдрома Дресслера.
Назначают ацетилсалициловую кислоту, индометацин, ибупрофен, диклофенак, мовалис в обычных терапевтических дозах. При назначении глюкокортикоидов и НПВС в остром и подостром периодах ИМ следует учитывать, что эти препараты могут нарушать процессы рубцевания инфаркта, повышая риск разрывов сердца. При синдроме Дресслера антикоагулянты должны быть отменены.
8.10. ДЕПРЕССИЯ У БОЛЬНЫХ ИНФАРКТОМ МИОКАРДА
В последние десятилетия установлено, что депрессивные и тревожные расстройства увеличивают риск развития ИМ (Todaro J.F. et al., 2003). В многоцентровом рандомизированном исследованииGISSI-2 установлено, что 40% больных в предшествующие 3 месяца до развития ИМ испытывали депрессивное настроение. Другие исследователи сообщают, что депрессия развивается как результат и осложнение ИМ (Honig A. et al., 2000).
Диагностика депрессии у больных ИМ остается неудовлетворительной, а соответствующая терапия, как правило, вообще не назначается (Guck T.P. et al., 2001). Множество исследований продемонстрировало, что депрессия повышает в 2-6 раз уровень смертности у больных ИМ независимо от тяжести поражения сердца, и это воздействие прослеживается в течение не менее5 лет (FrasureSmith N. et al., 2000).
Распространенность депрессии у больных ИМ колеблется от13,6% до
45% и более (Смулевич А.Б., 2003; Mayou R.A. et al., 2000; Aβen I. et al., 2003).
В проведенном нами исследовании(Качковский М.А., Крюков Н.Н., 2005) получены аналогичные результаты. Из 416 обследованных больных ИМ(253 мужчины и 163 женщины) в возрасте от 35 до 89 лет депрессия диагностирована у 113 больных ИМ (27%).
Нами были проанализированы некоторые причины развития депрессии у 59 больных ИМ (рисунок 21). Установлено, что у 69,5% обследованных пациентов неблагоприятные психосоциальные факторы предшествовали развитию ИМ. Многие пациенты (34%) связывали свое плохое настроение с одиноким проживанием. У 29% отмечена утрата супруга, ребенка или близкого человека. Немаловажное значение в плане развития депрессивных расстройств имели тя-
299
желые болезни родных, особенно онкологические заболевания, алкоголизм, |
|||||
психическая патология. |
|
|
|
||
|
50 |
|
|
|
|
|
45 |
|
|
|
|
|
40 |
|
|
|
|
|
35 |
45,8 |
|
|
|
|
30 |
33,9 |
|
|
|
% |
25 |
28,8 |
|
|
|
|
20 |
|
25,4 |
32,2 |
|
|
|
|
|||
|
15 |
|
|
|
|
|
10 |
|
|
|
|
|
5 |
|
|
|
|
|
0 |
Заболевание Одиночество |
Смерть |
Тяжелые |
Сочетание |
|
|
||||
|
|
|
родных |
болезни |
причин |
|
|
|
|
родных |
|
Рисунок 21. Причины развития депрессии у больных ИМ (М.А. Качковский). |
|||||
Таим образом, более чем у половины больных депрессия предшествовала ИМ и могла вызывать или способствовать его развитию. Около половины больных (46%) связывали возникновение депрессии с развитием инфаркта миокарда и его осложнениями. Лишь четвертая часть из них также указывала на влияние вышеперечисленных психосоциальных факторов. 32% пациентов отмечали одновременное воздействие нескольких факторов, вызывающих у них ухудшение настроения. При изучении причин развития депрессии у больных ИМ с помощью факторного анализа выделено 5 наиболее значимых причин.
Наибольшее влияние на развитие депрессии у больных ИМ оказывает снижение качества жизни и функциональных возможностей пациентов. Далее следуют возраст больных и заболевания, которые обычно связывают с возрастной патологией: атеросклероз сосудов головного мозга и артериальная гипертония. Значительное влияние на формирование депрессии оказывает тревога. Четвертая группа причин депрессии у больных ИМ была обусловлена выраженностью сердечной патологии: размером инфаркта миокарда, аритмиями сердца, развитием отека легких. Фактор 5 формирования депрессии у больных ИМ имел связь с тяжестью органических поражений внутренних органов: повторным инфарктом миокарда, инвалидностью пациентов, наличием аневризмы сердца, сахарным диабетом.
Установлено, что у больных с повторным ИМ депрессия развивалась достоверно чаще (p = 0,015). При этом отношение шансов(ОШ) возникновения депрессии по сравнению с впервые развившимся ИМ составило1,808 при 95% доверительном интервале 1,145-2,855. Значительное возрастание частоты раз-
300
вития депрессии у больных инфарктом миокарда отмечается у пациентов старших возрастных групп (рисунок 22).
У пациентов до 40 лет клинически значимое снижение настроения выявлено у 27,3% больных ИМ. Высокая частота депрессивных расстройств у больных ИМ молодого возраста, по мнению А.Н. Гладкова и соавт. (2005), объясняется тем, что молодыми людьми угроза инвалидности воспринимается как катастрофа.
90 |
|
|
|
|
|
80 |
|
|
|
|
|
70 |
|
|
|
|
|
60 |
|
|
|
|
|
50 |
|
|
|
|
|
% |
|
|
|
|
|
40 |
|
|
|
|
|
30 |
|
|
|
47,1 |
|
20 |
|
|
31 |
|
|
|
|
|
28,6 |
||
27,3 |
|
18,3 |
|
|
|
10 |
10,9 |
|
|
|
|
0 |
|
|
|
|
|
До 40 |
40-49 |
50-59 |
60-69 |
70-79 |
80-89 |
|
Возраст |
|
Норма |
Депрессия |
|
Рисунок 22. Распространенность депрессии у больных инфарктом миокарда различных возрастных групп (М.А. Качковский).
В возрастной группе 40-49 лет распространенность депрессии быламину-
туимальной и составила 11%. С 60 лет распространенность депрессии у больных ИМ неуклонно растет, достигая у пациентов старше 70 лет 47,8%. В острой стадии ИМ депрессия была диагностирована у19% мужчин, а у женщин- в 40%, то есть в 2,1 раза чаще (p < 0,001).
В наших наблюдениях преобладали пациенты с легкой депрессией(69%), меньше было больных с депрессией средней тяжести(25,7%) и тяжелой депрессией (5,3%). Лишь у 62,8% пациентов угнетенное настроение возникало значительную часть времени или все время. У остальных имела место маскированная депрессия с преобладанием соматических симптомов (похудание, запор, учащенное сердцебиение, нарушения сна).
Наиболее информативными признаками депрессии оказались чувство угнетенности (78% больных), потеря жизненных интересов, усталость без причины (82%), ухудшение самочувствия утром. У 25,6% больных часто возникали суицидальные мысли. Депрессия приводила к прогрессированию когнитивных нарушений в виде ухудшения памяти, снижения внимания. В период стацио-
301
нарного лечения по поводу ИМ депрессия диагностирована у113 пациентов из
417(27%).
Кконцу завершения заболевания депрессивные расстройства выявлены у
42из 375 больных (11,2%). Через год от начала развития заболевания депрессия установлена у 37 человек из 353 обследованных (10,5%), не достигая уровня контрольной группы (6,8%) (рисунок 23). При этом следует учитывать, что половина пациентов ИМ с депрессией получала лечение антидепрессантом.
30 |
|
|
25 |
|
|
20 |
|
|
% 15 |
|
|
10 |
|
|
5 |
|
|
0 |
|
|
ИМ |
Через 2 мес |
Через год |

 Тяжелая депрессия
Тяжелая депрессия
 Средней тяжести
Средней тяжести 
 Легкая
Легкая
Рисунок 23. Динамика распространенности и степени тяжести депрессии у больных инфарктом миокарда (М.А. Качковский).
Лечение депрессии
Многие антидепрессанты имеют ряд побочных эффектов и могут быть опасны у пациентов после ИМ. Трициклические антидепрессанты демонстрируют высокую эффективность при лечении депрессии, но плохую переносимость. Они снижают вариабельность сердечного ритма из-за их антихолинергического действия, вызывают нарушения ритма и проводимости сердца, повышение частоты сердечных сокращений, а также ортостатическую гипотонию (Guck T.P. et al., 2001). В последние десятилетия разработаны новые антидепрессанты. Селективные ингибиторы обратного захвата серотонина(флуоксетин, сертралин, пароксетин) показали эффективность и безопасность лечения депрессии у больных в постинфарктном периоде.
Снижение агрегации тромбоцитов, вызываемое антидепрессантами этой группы, может обеспечить дополнительное преимущество при лечении больных ИБС. В частности, использование препарата пароксетина у больных ИМ вызывало редукцию депрессивной симптоматики и более благоприятное тече-
302
ние постинфарктного периода; кроме того, отмечалось отчетливое повышение парасимпатических влияний, что снижает риск возникновения угрожающих жизни желудочковых нарушений ритма (Трофимова О.В. и соавт., 2003).
Однако ингибиторы обратного захвата серотонина, как и трициклические антидепрессанты, взаимодействуют с ферментной системой цитохромаP450 в печени, что повышает риск побочных эффектов при их взаимодействии с кардиологическими препаратами (Davies, S.J. et al., 2004). В частности, это вызывает пятикратное повышение риска развития неблагоприятных эффектов в период лечения метопрололом (Wuttke H. et al., 2002). Селективный стимулятор обратного захвата серотонина тианептин(коаксил) является эффективным антидепрессантом при лечении различных форм депрессии. Он сравним по эффективности и безопасности с флуоксетином, сертралином и пароксетином.
Тианептин проявляет отчетливый тимоаналептический и анксиолитический эффекты и вызывает лишь легкое седативное действие, поэтому его относят к группе антидепрессантов сбалансированного действия. В терапевтических дозировках тианептин не вызывает нарушения функций сердечно-сосудистой системы. При этом отсутствует изменение частоты сердечных сокращений, не отмечено снижения АД и изменений на ЭКГ, не выявлено нарушений функции желудочков (Иванов С.В., 2001). Даже на фоне передозировки препарата у14 пациентов не выявлено признаков серьезных кардиоваскулярных осложнений.
В проведенном нами исследовании(Качковский М.А., Крюков Н.Н., 2006) на фоне лечения антидепрессантом тианептином(коаксилом) в дозе по 12,5 мг три раза в день, начиная с 3-7 дня, отмечены уменьшение чувства угнетенности, подавленности, улучшение настроения от общения с людьми, снижение чувства беспокойства, уменьшение раздражительности, и тенденция в улучшении сна. Столь быстрый терапевтический эффект можно объяснить анксиолитическим действием препарата.
Через 2 месяца у пациентов, получающих лечение тианептином (рисунок 4), распространенность депрессии снизилась до9,4% (5 из 53 больных). При этом, не было выявлено случаев тяжелой депрессии и лишь у одного пациента имелась депрессия средней тяжести. Все пациенты продолжали прием препарата, не отмечая каких-либо побочных эффектов. У больных с депрессией, не принимающих антидепрессантов, легкая депрессия выявлена у 17 человек из 52 (32,7%), расстройство средней степени тяжести– у 10 пациентов (19,2%) и тяжелая депрессия – в 2 случаях (3,8%). Через год от начала наблюдения среди пациентов получающих лечение антидепрессантом, в 7 случаях из 51 (13,7%) выявлено депрессивное расстройство легкой степени. В 3 из этих случаев диагностировано рекуррентное депрессивное расстройство. Среди пациентов с депрессией, не получавших лечение антидепрессантами, динамика психоэмоционального состояния была менее благоприятной. В этой группе пациентов депрессия обнаружена в 16 из 50 случаев (32%). У 10 больных (20%) диагности-
303
рована легкая депрессия, у 5 (10%) – средней тяжести и у одного(2%) – тяжелая депрессия.
При этом лишь в одном из указанных случаев с уверенностью можно было утверждать о развитии рекуррентного депрессивного расстройства. В остальных 15 случаях заболевание было и за10 месяцев до этого, что позволяет предполагать у них развитие затяжных и хронических форм депрессии. Лечение тианептином хорошо переносилось больными независимо от возраста. При сочетании препарата с приемом сердечно-сосудистых лекарственных средств побочных эффектов не выявлено. Лечение депрессии тианептином привело к ее устранению у 90,6% больных и улучшению состояния у3,8%. Депрессия легкой степени сохранялась только у3 человек (5,7%), чему способствовали психотравмирующие факторы, такие как смерть близких, одиночество (рисунок
24).
Количество больных
60 |
|
|
|
|
|
50 |
|
|
|
|
|
40 |
|
|
|
|
Тяжелая |
|
|
|
|
депрессия |
|
30 |
|
|
|
|
Средней |
|
|
|
|
|
тяжести |
20 |
|
|
|
|
Легкая |
10 |
|
|
|
|
|
0 |
|
|
|
|
|
ИМ |
2 мес |
1 год |
ИМ |
2 мес |
1 год |
|
Контроль |
Тианептин |
|
||
Рисунок 24. Динамика распространенности и степени тяжести депрессии у больных инфарктом миокарда на фоне лечения тианептином(М.А. Качковский).
При этом лишь в одном из указанных случаев с уверенностью можно было утверждать о развитии рекуррентного депрессивного расстройства. В остальных 15 случаях заболевание было и за10 месяцев до этого, что позволяет предполагать у них развитие затяжных и хронических форм депрессии. Лечение тианептином хорошо переносилось больными независимо от возраста. При сочетании препарата с приемом сердечно-сосудистых лекарственных средств побочных эффектов не выявлено. Лечение депрессии тианептином привело к ее устранению у 90,6% больных и улучшению состояния у3,8%. Депрессия легкой степени сохранялась только у3 человек (5,7%), чему способствовали психотравмирующие факторы, такие как смерть близких, одиночество.
304
Через 2 месяца лечения тианептином уменьшение выраженности депрессивной симптоматики сопровождалось улучшением суммарного показателя Минутунесотского опросника качества жизни, как по отношению периоду лечения в стационаре (p < 0,001), так и по отношению к группе больных ИМ с депрессией не получавшей тианептин (p = 0,014).
На фоне лечения антидепрессантом пациенты меньше ощущали чувство слабости (p = 0,049). Их меньше беспокоили снижение заработка, оплата лечения, побочное действие лекарств. Отмечалась тенденция улучшения социальных контактов (p = 0,081). Этих пациентов меньше беспокоили проблемы с необходимостью госпитализаций (p = 0,013), поскольку у них отмечалось не только улучшение психического статуса, но и тенденция в снижении выраженности патологических симптомов.
Депрессивная симптоматика способствует ограничению физических возможностей пациентов в постинфарктном периоде, затрудняет активное проведение сердечной реабилитации. Исследование показало, что активное лечение депрессии способствует улучшению качества жизни пациентов, повышает их трудоспособность, способствует снижению числа госпитализаций.
305
Глава IX
ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ
9.1. ОПРЕДЕЛЕНИЕ
Ишемическая болезнь сердца, как и любое хроническое заболевание протекает с периодами стабильного течения и обострения. Именно острые формы ИБС и определяют основной уровень смертности в группе заболеваний системы кровообращения.
Ишемическая болезнь сердца включает в себя широкий спектр клинических синдромов. Клиническими проявлениями ИБС являются стабильная стенокардия, безболевая ишемия миокарда, нестабильная стенокардия, инфаркт миокарда, сердечная недостаточность и внезапная смерть. В зависимости от клинических проявлений и особенно от исходов разнообразные формы ИБС можно разделить на две основные группы– острые коронарные синдромы и стабильные формы ишемической болезни сердца.
Период обострения ИБС обозначают как острый коронарный синдром. Термин "острый коронарный синдром" (ОКС) был предложен новозеландским клиницистом Harvey White в 1996–1997 гг. Это было сделано им для того, чтобы показать трудности диагностики и точного прогнозирования течения острых ишемий миокарда, непосредственно угрожающих жизни больного человека, так как на первых этапах обследования они весьма трудны для дифференциации.
Термин острый коронарный синдром(ОКС) был введен в клиническую практику, когда выяснилось, что вопрос о применении некоторых активных методов лечения, в частности тромболитической терапии или чрезкожных хирургических вмешательств, должен решаться до установления окончательного диагноза - наличия или отсутствия крупноочагового инфаркта миокарда. И принципиально разделяется на две основные формы: ОКС с подъёмом сегмента ST и ОКС без подъёма сегмента ST.
9.2. ПАТОГЕНЕЗ
К настоящему времени доказана патогенетическая общность всех острых проявлений коронарной болезни сердца(нестабильная стенокардия, инфаркт миокарда с зубцом Q и без зубца Q): в их основе лежит единый патоморфологический механизм - разрыв атеросклеротической бляшки в коронарной артерии с формированием на поверхности разрыва в начале тромбоцитарного, а затем и фибринного пристеночного тромба, обусловливающего весь симптомокомплекс клинических проявлений.
Именно от эволюции возникшего тромба зависит картина обострения ИБС. При этом полная окклюзия коронарной артерии, как правило, приводит к возникновению крупноочагового ИМ, особенно если предшествующими приступами стенокардии или безболевой ишемии не были сформированы достаточные коллатеральные пути кровоснабжения неблагополучной зоны или метаболическая перестройка кардиомиоцитов к условиям гипоксии. То есть не было созданы условия для достаточного ишемического прекондиционирования. А
306

при образовании пристеночного тромба последний не приводит к полной окклюзии поражённой артерии, либо достаточно быстро спонтанно лизируется, что клинически проявляется НС, либо ИМ без зубца Q.
9.3. ДИАГНОСТИКА ОСТРОГО КОРОНАРНОГО СИНДРОМА
Как уже было сказано ранее, появление термина ОКС было связано со сложностью дифференциальной диагностики ишемических изменений при остро развивающихся состояниях у больных ИБС и необходимостью выбирать лечебную тактику до окончательного диагноза. Этот термин используется при
первичном контакте с пациентом и подразумевает необходимость активной тактики ведения больных с ИМ и НС.
Несмотря на общность патогенетических механизмов развития этих двух состояний на практике они требуют различных методов ведения. В частности, вопрос о проведении тромболитической терапии должен решаться до установления наличия или отсутствия крупноочагового ИМ. Безусловно, всем известны три диагностических критерия ОИМ: клиническая картина, прежде всего связанная с типичными характеристиками болевого синдрома; характерные изменения ЭКГ; повышение кардиоспецифических ферментов.
Однако на основании клинических данных и данных ЭКГ во многих случаях при первичном контакте с больным не представляется возможным четко дифференцировать НС и ИМ. Поэтому, в зависимости от изменений на ЭКГ, все острые коронарные синдромы были разделены на сопровождающиеся и не сопровождающиеся подъёмом сегментаST. Уровень кардиоспецифических ферментов из-за ограничений в специфичности и чувствительности их изменений и более позднего повышения в плазме крови также трудно использовать при интерпретации полученных результатов при первичном осмотре больного (таблица 40).
Изменение кардиальных маркеров при остром ИМ |
Таблица 40 |
|||||||||
|
|
|
||||||||
Показатель |
|
Мг |
КФК |
КФК-МВ |
Тн-Т |
Тн-I |
|
|||
|
|
нг/мл |
Ед/л |
Ед/л |
нг/мл |
нг/мл |
|
|||
Диапазон |
-нор < 90 |
24 - 160 |
10 |
- 25 |
< 0,1 |
< 0,5 |
|
|||
мальных значений |
|
|
|
|
|
|
|
|
|
|
Время подъёма, ч. |
0,5 – 2 |
3 – 8 |
3 |
- 8 |
3 |
- 6 |
3 |
– 6 |
|
|
Пик, ч. |
|
5 – 12 |
10 - 36 |
9 - 30 |
10 |
- 24 |
14 |
– 20 |
|
|
Снижение |
|
18до – 30 |
72 - 96 |
48 |
- 72 |
10 – 15 |
5 – 7 дн. |
|
||
нормы, ч. |
|
|
|
|
|
дн. |
|
|
|
|
Чувствительность |
50 - 100 |
50 - 75 |
17 |
- 62 |
50 |
- 59 |
6 – 44 |
|
||
0 – 6 ч., % |
|
|
|
|
|
|
|
|
|
|
Специфичность |
|
77 – 95 |
80 - 98 |
92 - 100 |
74 |
- 96 |
93 |
– 99 |
|
|
0 – 6 ч., % |
|
|
|
|
|
|
|
|
|
|
Абсолютно специфичных маркеров повреждения кардиомиоцитов не найдено. Также большую роль играет временной фактор. Зачастую в стационар
307
может быть доставлен пациент с текущим болевым синдромом первые часы, и в анализах крови уровень кардиоспецифических ферментов остаётся в пределах нормальных величин. Таким образом, однократное определение миокардиальных маркеров у больных с ОКС и подозрением на ОИМ является неприемлемым и практически полностью обесценивает диагностическую значимость данного метода исследования.
9.4. ВИЗУАЛИЗАЦИОННЫЕ МЕТОДИКИ В ДИАГНОСТИКЕ ОКС
Ультразвуковое исследование сердца (эхокардиография – ЭхоКГ) играет важную роль в клинической практике у пациентов с ОКС. К несомненным достоинствам методики относятся неинвазивность и безопасность для больного, а так же возможность повторных динамических исследований. Важнейшей диагностической характеристикой ИМ являются нарушения локальной сократимости левого желудочка, их выраженность и распространенность. Степень нарушения сегментарной сократимости описывают как гипокинезия, акинезия, дискинезия и гиперкинезия. Кроме нарушения локальной сократимости ЭхоКГ по-
зволяет оценить объемные показатели левого желудочка и определить его фракцию выброса. Доплерография трансмитрального потока позволяет оценить диастолическую функцию левого желудочка, нарушения которой отмечается как при крупноочаговом, так и при мелкоочаговом ИМ.
«Золотым стандартом» диагностики в настоящее время остаётся коронароангиография. Это инвазивный метод рентгенографической визуализации венечных артерий сердца, их просвета после селективного интракоронарного введения контрастного вещества. С помощью данного исследования возможно определить наличие, степень сужений просвета коронарных артерий, их точную локализацию, протяжённость и диаметр просвета, так же можно определить наличие и выраженность коллатерального кровотока.
Однако, данная методика позволяет получить информацию лишь о наличии сужения венечной артерии, ни в коем случае не характеризуя перфузию и метаболические процессы в сердечной мышце и, следовательно, нарушения её основных функций, прежде всего сократительной. А учитывая рост количества коронарных реваскуляризаций, особое место занимает проблема оценки жизнеспособности миокарда, то есть определения характера его повреждения и возможности сохранения его функций.
Радиологические методы диагностики при ОКС. Сцинтиграфия миокарда относится к методам оценки перфузии миокарда. Принцип ее заключается в том, что пациенту внутривенно вводится радиофармацевтический препарат (РФП), который накапливается в миокарде пропорционально объему коронарного кровотока. Таким образом, участки миокарда, кровоснабжаемые стенозированными коронарными артериями накапливают РФП в меньшей степени, чем участки, кровоснабжаемые интактным сосудом.
Метод перфузионной сцинтиграфии миокарда позволяет выявлять области миокарда с нормальным и редуцированным кровоснабжением. Для выявления жизнеспособного миокарда наиболее часто используют пробы с физической нагрузкой, фармакологические пробы с препаратами, вызывающими вазо-
308
дилатацию (аденозин, дипиридамол) и препаратами инотропного действия (добутамин). Жизнеспособность миокарда определяется по динамике дефекта перфузии.
В зависимости от клинической ситуации(сохраняющийся болевой синдром в рамках ОКС, тяжёлая сердечная недостаточность) имеются ограничения в использовании функциональных проб. В этом случае могут использоваться методика оценки перфузии в покое. Для оценки качества терапии, прогноза и исхода могут применяться парные исследования при поступлении и через некоторое время на фоне терапии.
9.5. СТРАТИФИКАЦИЯ РИСКА РАЗВИТИЯ ВНЕЗАПНОЙ СМЕРТИ И КРУПНООЧАГОВОГО ИНФАРКТА МИОКАРДА У ПАЦИЕНТОВ С ОКС
В диагностике ОКС важным моментом является стратификация риска развития острого крупноочагового инфаркта миокарда и внезапной смерти. Именно от степени риска зависит в каждом конкретном случае тактика ведения пациента.
Риск смерти и развития ИМ определяется несколькими факторами. Неблагоприятный прогноз связан с мужским полом, возрастом, предшествующими проявлениями ИБС (длительный анамнез и высокий класс стенокардии напряжения, перенесенный ИМ). Неблагоприятными прогностическими факторами также являются: дисфункция левого желудочка, застойная сердечная недостаточность, артериальная гипертензия, сахарный диабет.
Важную роль играет оценка клинических данных, времени от начала болевого синдрома, длительность болей, наличие стенокардии покоя и ответ на медикаментозное лечение. Эти признаки вместе с концентрацией сердечных тропонинов используются в классификации, предложенной C.W. Hamm и E. Braunwald (2001), в которой степень риска развития крупноочагового инфаркта миокарда и смерти возрастает сверху вниз и слева направо (таблица 41).
Таблица 41
Классификация нестабильной стенокардии
(C.W. Hamm и E. Braunwald, 2000)
|
А – |
В – |
С – |
|
Развивается в при- |
Развивается без |
Возникает в пре- |
|
сутствии экстракар- |
экстракардиальных |
делах 2-х недель |
|
диальных факторов, |
факторов. |
после инфаркта |
|
которые усиливают |
Первичная НС |
миокарда. |
|
ишемию миокарда. |
|
Постинфарктная |
|
Вторичная НС |
|
НС |
I - Первое появление |
|
|
|
тяжелой стенокар- |
IA |
IB |
IC |
дии, прогрессирую- |
|||
щая стенокардия; |
|
|
|
без стенокардии по- |
|
|
|
коя |
|
|
|
309

II - Стенокардия по- |
|
|
|
коя |
IIA |
IIB |
IIC |
в предшествующий |
|||
месяц, но не в бли- |
|
|
|
жайшие 48 час; |
|
|
|
(стенокардия покоя, |
|
|
|
подострая) |
|
|
|
III – Стенокардия |
|
IIIB |
|
покоя в предшест- |
IIIA |
IIIB – Тропонин - |
IIIC |
вующие 48 час; |
|
IIIB – Тропонин + |
|
(стенокардия покоя, |
|
|
|
острая) |
|
|
|
У больных с повышенным уровнем тропонинов и других кардиоспецифичных ферментов краткосрочный и отдалённый прогнозы менее благоприятны по сравнению с больными, не имеющими такого повышения. Риск новых коронарных событий коррелируют со степенью повышения ферментов.
В качестве экспресс оценки риска развития осложнений при ОКС предложен ряд систем(шкал), учитывающих независимые предикторы основных коронарных событий (смерть, крупноочаговый ИМ), выявленные в результате наблюдения больных в крупных испытаний различных методов лечения(TIMI, PURSUIT, FRISC - 2). В отечественных рекомендациях для оценки риска использовалась шкала TIMI (таблица 42).
Таблица 42 Оценка риска неблагоприятных событий (смерти, реинфаркта миокарда,
повторяющейся тяжелой ишемии), требующих инвазивного вмешательства у больных ОКС без подъема сегмента ST (система TIMI)
Показатель |
Баллы |
|
|
|
|
Возраст старше 65 лет |
1 |
|
|
|
|
Больше 3-х коронарных факторов риска |
1 |
|
|
|
|
Стеноз(ы) коронарных артерий на выполненной ранее ан- |
1 |
|
гиограмме |
||
|
||
Наличие смещений сегмента ST |
1 |
|
|
|
|
Более 2-х приступов стенокардии в предшествующие 24 ч |
1 |
|
|
|
|
Применение аспирина в предшествующие 7 дней |
1 |
|
|
|
|
Повышение уровня(ей) «сердечных маркеров» |
1 |
|
|
|
|
Максимальное число баллов |
7 |
|
|
|
К больным высокого риска следует отнести тех, у кого сумма баллов по системе TIMI превышает 4. Согласно отечественным рекомендациям по диагностике и лечению острого коронарного синдрома без подъёма сегментаST выделяют две группы риска. Больные с высоким непосредственным риском смерти или развития инфаркта миокарда по результатам начального наблюдения (8-12 часов). К этой категории относятся больные, у которых в период на-
310
блюдения (8-12 часов) выявлены следующие характеристики повышенного риска: а) повторные эпизоды ишемии миокарда (либо повторяющаяся боль, либо динамика сегмента ST, особенно депрессии или преходящие подъемы сегмента ST); б) ранняя постинфарктная стенокардия; в) повышение содержания тропонинов (I или T) или МВ КФК в крови; г) развитие гемодинамической нестабильности (гипотензия, признаки застойной сердечной недостаточности) за период наблюдения; д) серьезные нарушения ритма (повторные эпизоды желудочковой тахикардии, фибрилляция желудочков); з) изменения ЭКГ, которые не позволяют оценить (выявить) отклонения сегмента ST; е) сахарный диабет.
Больные с низким риском смерти или развития инфаркта миокарда в ближайшее время. К этой категории относятся больные со следующими характеристиками: а) без повторных болей в грудной клетке за период наблюдения; б) без повышения уровней тропонинов или других биохимических маркеров некроза миокарда при первичном и повторном (через 6-12 часов) определениях;
в) без депрессий или подъемов сегментаST на ЭКГ, но с наличием инверсии зубца Т, сглаженного зубца Т или нормальной ЭКГ; г) сумма баллов по системе TIMI не превышает 4. Данная система оценки позволяет оценит прогноз на ближайшее время, первые часы и сутки от момента заболевания.
9.6. ПРИНЦИПЫ ЛЕЧЕНИЯ ОСТРОГО КОРОНАРНОГО СИНДРОМА
В лечении неосложнённого ОКС без стойкого подъёма сегментаST целесообразно выделение следующих направлений в терапии: воздействия, направленные на предотвращение и торможение развития нарастающего пристеночного тромбоза - антитромботическая терапия (антиагреганты, антикоагулянты); традиционная антиангинальная терапия препаратами с гемодинамическим типом действия; антиангинальная терапия препаратами с метаболическим типом действия миокардиальная цитопротекция; воздействия, направленные на стабилизацию и предотвращение атеросклеротической бляшки.
Антитромботические средства. Антитромботические средства предназначены для предупреждения или ограничения тромбообразования, а также разрушения образовавшегося тромба. Их можно разделить на 3 большие группы: антитромбоцитарные (антиагреганты) средства, антикоагулянты и тромболитики.
Антиагреганты. Роль тромбоцитов в патогенезе ИБС не ограничивается формированием внутрикоронарного тромба. Кровяные пластинки участвуют в развитии самой атеросклеротической бляшки путем стимуляции пролиферации гладкомышечных клеток (тромбоцитарный фактор роста), а также возникновения интрамуральных тромбов. Поэтому антитромбоцитарные средства необходимы не только для профилактики внутрисосудистого тромбоза, но и для замедления прогрессирования атеросклероза. Эти лекарства доказали свою эффективность при поражении как венечных, так и церебральных и периферических артерий. Данные средства уменьшают функциональную активность тромбоцитов, в первую очередьих способность к агрегации. Блокада агрегации
может быть достигнута за счет ингибирования эффектов тромбоксана А (аспи-
2
311
рин), АДФ (тиенопиридины) или нейтрализацией самих IIb/IIIa гликопротеиновых рецепторов тромбоцитов (абциксимаб и пр.).
В комплексном лечении ОКС активно используют следующий перечень антитромбоцитарных средств: это ингибитор циклооксигеназы - ацетилсалициловая кислота, блокаторы АДФ-рецепторов тиенопиридиныклопидогрель и тиклопидин, а также антагонисты IIв/IIIа гликопротеиновых рецепторов - абциксимаб, эптифибатид и тирофибан.
Существует ряд принципов назначения антитромбоцитарных средств: антиагреганты являются обязательным компонентом терапии ОКС; их следует назначать как можно раньше начиная с нагрузочных доз; аспирин назначают всем пациентам с ОКС при отсутствии противопоказаний; в случае непереносимости аспирина его заменяют на клопидогрель; антиагреганты, как правило, сочетают с введением гепарина или его низкомолекулярных фракций; при консервативной тактике введения ОКС целесообразно комбинировать антиагреганты с разным механизмом действия, хотя это и сопряжено с большим риском геморрагических осложнений; активность антиагрегантной терапии определяется тяжестью прогноза больного при обязательном учете возможного риска кровотечений.
Антикоагулянты. Предназначение антикоагулянтной терапии - ингибирование плазменных факторов свертывания крови с целью профилактики образования или ограничения распространения тромбов. Эти средства включают антикоагулянты прямого и непрямого действия. Первые действуют путем непосредственного ингибирования тромбина и других факторов свертывания, вторые - нарушают синтез факторов коагуляции, в результате чего последние теряют свою активность.
Несмотря на большое количество препаратов в лечении ОКС используется ограниченное число лекарственных средств группы антикоагулянтов, в частности, обязательное использование нефракционированного гепарина и низкомолекулярного гепарина – эноксапарина.
Принципы назначения антикоагулянтов при ОКС: антикоагулянты прямого действия, в первую очередь гепарины, являются обязательными элементами в лечении ОКС; нефракционированный гепарин при терапии коронарного тромбоза применяют внутривенно для поддержания устойчивой его концентрации в крови под контролем АЧТВ; вместо нефракционированного гепарина при ОКС без подъема ST можно использовать низкомолекулярный гепаринэноксапарин подкожно; наиболее опасные осложнения лечения гепаринами - кровотечения и тромбоцитопения; отмену гепаринов целесообразно выполнять постепенно для предупреждения возможного синдрома отмены(реактивной гиперкоагуляции); непрямые антикоагулянты из-за медленного наступления эффекта при ОКС назначают в основном по специальным показаниям(сопутствующая мерцательная аритмия, имплантированные искусственные клапаны сердца) после стабилизации состояния больных для профилактики тромбозов и эмболий.
Антиангинальная терапия препаратами с гемодинамическим типом действия. Основными классами антиангинальных препаратов(ААП) являются
312
препараты выбора первой линии– нитраты, β-адреноблокаторы (БАБ), блока- |
|
||||
торы кальциевых каналов (БКК). |
|
|
|
|
|
Нитраты |
были |
первыми |
антиангинальными |
, |
сре |
применяющимися |
при ИБС как |
для купирования |
болевого синдрома, так и |
в |
|
комплексной терапии. По выраженности антиишемического эффекта нитраты в среднем не уступают или даже оказываются лучше препаратов других групп.
Механизм |
антиангинального |
эффекта |
нитратов |
основан |
на |
действ |
|
высвобождающегося из этих соединений оксида азота, который расслабляет |
|
||||||
гладкую мускулатуру сосудистой стенки и обуславливает вазодилатацию. |
|||||||
Следствием этого являются снижение венозного возврата, преднагрузки, |
|
||||||
уменьшение |
конечного |
диастолического |
давления в левом желудочке и |
||||
снижение потребности миокарда в кислороде. Важную роль в антиангинальном |
|
||||||
эффекте играет прямое |
дилатирующее |
действие нитратов на |
коронарные |
||||
артерии и перераспределение кровотока эпикардиальных артерий в пользу эндокарда.
Нитраты |
расширяют |
как |
пораженные |
атеросклерозом |
коронарные |
сосуды, так |
и интактные, при |
этом отсутствует синдром |
коронарного |
||
обкрадывания. Они могут увеличивать просвет коронарных артерий в месте атеросклеротического сужения. Предполагают, что нитраты расширяют просвет субэпикардиальных артерий в основном в месте эксцентрических стенозов, где частично сохранена гладкая мускулатура, но не оказывают существенного
влияния |
на |
стенозы, обусловленные |
концентрически |
расположенными |
||
атеросклеротическими бляшками. Также улучшение коронарного кровотока |
||||||
происходит за счёт расширения коллатеральных сосудов. |
|
|
||||
Нитраты, в |
отличие |
от БАБ |
и , БККне обладают никаким |
иным |
||
действием, кроме антиангинального, поэтому единственным показанием для |
||||||
назначения нитратов является наличие приступов стенокардии у больного. |
|
|||||
Противоишемический |
эффект |
БАБ |
объясняют |
следую |
||
механизмами: уменьшение потребности миокарда в кислороде вследствие
снижения |
ЧСС, |
АД, сократимости |
миокарда |
и увеличение |
коронарного |
|||||||
кровотока |
в |
|
связи |
с |
удлинением |
времени |
диастолической , перфуз |
|||||
перераспределением кровотока в зоны ишемии миокарда. |
|
|
|
|
||||||||
В качестве эталонного представителя БАБ представляется возможным |
||||||||||||
рассматривать |
метопролол – кардиоселективный |
препарат |
без |
собственной |
||||||||
симпатомиметической активности с высоким антиангинальным |
эффектом. |
|||||||||||
Данный препарат широко используется в |
клинической |
практике, является |
||||||||||
одним из наиболее часто назначаемых врачами БАБ. |
|
|
|
|
|
|||||||
Широко |
|
используются |
препараты |
группы |
блокаторов |
кальциевых |
||||||
каналов (БКК) |
в |
лечении |
ИБС. Среди |
этой |
обширной |
группы |
наибольшая |
|||||
антиангинальная эффективность отмечена у производных дигидропиридина. Дигидропиридиновые БКК длительного действия положительно влияют на дисбаланс между потребностью и снабжением миокарда кислородом путём
уменьшения |
периферического |
сопротивления |
и |
увеличения |
доставк |
|||
кислорода. |
При |
длительном |
их |
применении |
за |
счёт |
уменьш |
|
периферического сопротивления снижается конечное диастолическое давление |
|
|||||||
313
в полости ЛЖ, что улучшает перфузию миокарда.
Антиангинальная терапия препаратами с метаболическим типом действиямиокардиальная цитопротекция. Очевидно, что воздействие на центральную гемодинамику – уменьшение кислородной потребности миокарда и улучшение перфузии сердечной мышцы не до конца охватывает патогенетические звенья
проявлений коронарной недостаточности. Клинически развёрнутый ангинозный |
|
||||||||||||
приступ является лишь«верхушкой айсберга», в основании которого лежат |
|
||||||||||||
нарушения метаболизма миокарда. Последовательность биохимических процессов |
|
||||||||||||
с формированием |
клинической |
картины |
получило |
название«ишемического |
|
||||||||
каскада». |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, изменения метаболизма кардиомиоцитов при ишемии могут |
|
|||||||||||
рассматриваться |
как |
точка |
приложения |
медикаментозного |
воздействия, |
|
|||||||
частности с помощью препаратов, способных прямо воздействовать на клеточный |
|
||||||||||||
метаболизм. В настоящее время создан целый ряд антиангинальных препаратов, |
|
||||||||||||
прямо |
воздействующих |
|
на |
метаболические |
процессы |
|
в |
кардиомиоцитах, |
|||||
получивших название "миокардиальные цитопротекторы". К ним относятся |
|
||||||||||||
триметазидин, |
ранолазин, |
этомоксир, |
дихлорацетат, |
L-карнитин, |
|
||||||||
оксиметилэтилпиридина сукцинат. Однако данная группа препаратов не может |
|
||||||||||||
использоваться |
|
в |
качестве |
монотерапии |
у |
пациентов |
с |
коро |
|||||
недостаточностью, а являются дополнительной вспомогательной группой для |
|
||||||||||||
использования |
|
в |
|
комбинации |
с |
|
антиишемическими |
пре |
|||||
гемодинамического действия. |
|
|
|
|
|
|
|
|
|
||||
|
Воздействия, направленные на стабилизацию и предотвращение разрыва |
|
|||||||||||
атеросклеротической бляшки. Все выше перечисленные группы препаратов в той |
|
||||||||||||
или |
иной |
мере |
вносят |
свой вклад |
в |
стабилизацию |
|
атеросклеротическог |
|||||
поражения. В последних исследованиях уделяется немалая роль изучению плейотропных действий препаратов группы статинов, которые оказывают целый ряд дополнительных эффектов, в частности направленных на стабилизацию атеросклеротической бляшки.
|
Хирургические методы лечения ОКС. К хирургическим методам лечения |
||||
ОКС |
относятся чрескожные коронарные вмешательства(ЧКВ) |
– |
баллонная |
||
ангиопластика и стентирование, и |
аорто-коронарное |
коронарное |
шунтирование |
||
(АКШ). Больным с поражением одного сосуда как правило следует проводить |
|||||
ЧКВ |
с постановкой стента |
с назначением |
блокаторов |
гликопротеиновы |
|
рецепторов IIb/IIIа. Шунтирование сосудов у таких больных целесообразно, если анатомия коронарных артерий (выраженная извитость или изогнутость сосудов) не позволяет безопасно выполнить ЧКВ.
Больным с поражением ствола левой коронарной артерии или3-сосудистым поражением, особенно при нарушенной функции левого желудочка, показано АКШ. У больных с2-сосудистым поражением или3-сосудистым со стенозом, подходящим для имплантации стентов, показания АКШ или ЧКВ оценивают индивидуально. Существенно, что реваскуляризация миокарда не решает проблему лечения ИБС в целом, поскольку в основе этой болезни лежит атеросклероз, а реваскуляризация не оказывает влияния на процесс атерогенеза и не предотвращает его. Поэтому и после проведения АКШ возможно как образование новых бляшек в коронарных артериях, так и рестеноз шунтов.
314

9.7. АЛГОРИТМЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ БОЛЬНЫХ ОКС
ВСПЕЦИАЛИЗИРОВАННОМ КАРДИОЛОГИЧЕСКОМ СТАЦИОНАРЕ
ВСамарском областном клиническом кардиологическом диспансере ОКС
подразделяется на ОКС с подъемом сегмента ST и без подъема ST. Включает в себя острый ИМ, ИМ с подъемом ST (ST+), ИМ без подъема ST(ST-) и НС (таблица 43). Диагноз нестабильной стенокардии ставится преимущественно на основании клинических признаков, ЭКГ на высоте приступа (депрессии сегмента ST более 1 мм в двух и более смежных отведениях, инверсия зубца Т более 1 мм), биохимические маркеры некроза миокарда как правило отрицательны. ЭхоКГ малоинформативна (выполняется в плановом порядке). Нестабильная стенокардия определяется как ангинозный приступ (или его эквиваленты) в присутствии хотя бы одного из перечисленных ниже признаков: приступ возникает в покое и длится не менее1520 минут; впервые возникшая стенокардия как минимумIII функционального класса (ФК); свежее возрастание интенсивности стенокардии как минимум на I ФК и как минимум до III ФК; постинфарктная стенокардия.
Диагноз ИМ с ST(+) и ST(-) устанавливается на основании клинических данных (ангинозный приступ или его эквиваленты), ЭКГ критериев. изменений биохимических маркеров (тропонин Т - при поступлении, но не ранее чем через 6 часов после последнего ангинального приступа и через 6-12 часов, миоглобин (МГБ)
– при поступлении (при наличии возможности его определения); плановое определение - лактатдегидрогеназы (ЛДГ), МВ – фракции креатинфосфокиназы (МВ КФК), α – гидроксибутиратдегидрогеназы (α - ГБД), С – реактивного белка, ЭхоКГ-критериев (выполняется в плановом порядке).
Таблица 43
Соотношение патологии и клиники ОКС
Эрозия с заживлением |
Стабильная или нестабильная |
|
|
стенокардия |
|
|
|
|
Изъязвление с подкапсульным |
кроНестабильная стенокардия |
|
воизлиянием |
|
|
Неокклюзирующий тромбоз |
Нестабильная стенокардия или ИМ без |
|
|
Q-зубца |
|
Атероэмболия |
ИМ без Q-зубца |
|
|
|
|
Окклюзирующий тромбоз |
ИМ с Q-зубцом |
|
Вариантная стенокардия
Спазм сосудов (вазоконстрикция)
Критериями ST(+) ИМ являются наличие типичных биохимических изменений, характерных для некроза миокарда, сочетании с изменениями на ЭКГ:
315
подъем сегмента ST на 1мм и более в 2 и более смежных отведениях; наличие Q-зубцов длительностью более 0,03 с и глубиной равной и более 1 мм в 2 и более смежных отведениях; наличие «новой» (впервые возникшей или предположительно впервые возникшей) блокады левой ножки пучка Гиса.
Критериями ST(-) ИМ являются наличие типичных биохимических изменений, характерных для некроза миокарда, в сочетании с депрессией сегмента ST или изменения Т-волны, симптомами ишемии при наличии или отсутствии дискомфорта в грудной клетке, включающие: необъяснимую тошноту и рвоту (при отсутствии диареи) или повышенное потоотделение; сохраняющаяся
одышка как проявление недостаточности ЛЖ; необъяснимая слабость, голово- |
|
|||||
кружение, пресинкопальные и синкопальные состояния. |
|
|
||||
Условия проведения ЧТКА: больные с полисом ОМС, поступившие в ра- |
|
|||||
бочее время (8.30 – 17.00), возраст не старше 60 лет (старше 60 лет - работаю- |
|
|||||
щие); больные |
с полисом ДМС в рамках договоров |
заключенных |
между |
|||
СОККД и страховой компанией (круглосуточно без ограничения возраста). Ме- |
|
|||||
дикаментозная терапия ОКС включает: купирование болевого синдрома – нар- |
|
|||||
котические анальгетики (морфин 5-10 мг внутривенно); введение антитромбо- |
|
|||||
тических препаратов; введение антиагрегантов - аспирин назначается в дозе 325 |
|
|||||
- 500 мг (первая доза), затем по 75-325 мг, 1 раз в сутки. |
|
|
||||
Антикоагулянты. Введение нефракционированного гепарина: внутривен- |
|
|||||
но болюсно 60-70 Ед/кг (максимально 5000 Ед), далее постоянная инфузия |
с |
|||||
начальной скоростью 12-15 Ед/кг/мин (максимально 1000 Ед/ч). В последую- |
|
|||||
щем скорость инфузии подбирается под контролем АЧТВ(желаемые значения |
||||||
должны превышать нормальные для конкретного используемого реактива в 1,5- |
|
|||||
2,5 раза). Длительность лечения 2-7 суток. Для подбора дозы используют номо- |
|
|||||
граммы (таблица 44). |
|
|
|
|
|
|
Введение низкомолекулярного гепарина. Эноксапарин (клексан) п/к 100 |
|
|||||
МЕ/кг (1 мг/кг) каждые 12 ч в течение 2 (минимум) 8 суток. Первой п/к инъек- |
|
|||||
ции может предшествовать внутривенно болюсное введение30 мг препаратов. |
|
|||||
Надропарин (фраксипарин): |
внутривенно болюсно 86 МЕ/кг, далее п/к 86 |
|
||||
МЕ/кг каждые 12 часов в течение 4-8 суток или только п/к введение. |
|
|||||
|
Подбор дозы нефракционированного гепарина |
Таблица 44 |
|
|||
|
|
|
||||
Вес |
|
|
Вводимый объем |
|
|
|
больного |
Начальный |
Подкожная инъекция |
|
Эквивалент IU |
|
|
(кг) |
внутривенно |
|
|
|||
каждые 12 часов |
|
анти Ха |
|
|||
|
болюс |
|
|
|
||
|
|
|
|
|
|
|
50 * |
0,4 мл |
|
0,4 мл |
|
3800 |
|
50 – 59 |
0,5 мл |
|
0,5 мл |
|
4750 |
|
60 – 69 |
0,6 мл |
|
0,6 мл |
|
5700 |
|
70 – 79 |
0,7 мл |
|
0,7 мл |
|
6650 |
|
80 – 89 |
0,8 мл |
|
0,8 мл |
|
7600 |
|
90 – 99 |
0,9 мл |
|
0,9 мл |
|
8550 |
|
> 100 |
1 мл |
|
1 мл |
|
9500 |
|
316
b-адреноблокаторы. Следует стремиться использовать у всех больных, не имеющих абсолютных противопоказаний. Пропраналол (обзидан): начальная доза внутривенно 0,5 – 1,0 мг в течении 1 мин, при необходимости повторно (с интервалами как минимум 2 мин) до общей дозы 10 мг. Уже через 1 ч можно начать прием внутрь в дозе 40 – 80 мг каждые 4 ч, при необходимости доза может быть увеличена до360 – 400 мг/сутки. Метопролол: начальная доза внутривенно 5 мг за 1-2 минут, с повторением каждые 5 минут до общей дозы 15 мг, через 15 минут после последнего внутривенно введения начать прием внутрь, 50 мг каждые 6 ч в течении 48 часов, затем интервалы между приемами могут быть увеличены. Обычная поддерживающая доза 100 мг 2 раза в сутки, однако возможно использование и более высоких дозировок в зависимости от динамики симптомов и ЧСС.
Нитраты. При неэффективном сублингвальном приеме нитроглицерина (ангинальные боли не купированы), целесообразно начать внутривенно инфузию нитроглицерина или изосорбида динитрата. Начальная скорость введения нитроглицерина – 10 мкг/минуту. Доза увеличивается на 10 мкг/минуту каждые 3-5 минут до появления реакции АД или изменения симптоматики. Если нет реакции на 20 мг/минуту, то ступени можно увеличить до 10 мкг/минуту и даже 20 мкг/минуту.
Антагонисты кальция. Дилтиазем и верапамил могут быть назначены при противопоказаниях к b-адреноблокатором и отсутствии сократительной дисфункции левого желудочка. Антагонисты кальция, относящиеся к группе дигидропиридинов, можно использовать в сочетании bс -адреноблокаторами и нитратами у больных с тяжелой стенокардией, рефрактерной к медикаментозному лечению. При этом следует избегать назначения коротко действующих производных дигидропиридины. Особым показанием к применению антагонистов кальция являются случаи явной вазоспастической стенокардии(как диагностическое средство ex juvantibus).
Тромболитическая терапия (ТЛТ): введение стрептокиназы внутривенно 1500000 МЕ в течение30-60 минут. Обязательным является контроль АЧТВ, тромбоцитов каждые 4-6 часов после окончания тромболитиков для того, чтобы определить время начала введения гепарина, введение гепарина (без болюса) начинается после достижения АЧТВ в 2 раза превышающее контрольное.
Критерии адекватности медикаментозной терапии. В-адреноблокаторы. Снижение ЧСС до 50-60 в 1 минуту. Прекратить увеличение дозы и при необходимости уменьшить ее следует при снижении ЧСС до50 в 1 мин, систолического АД менее 100 мм рт. ст. или снижение уровня АД сопровождается ухудшением клинического состояния, при появлении или усугублении нарушений внутрисердечной проводимости, симптомов сердечной недостаточности а также возникновением бронхоспазма(в последнем случае препарат надо отменить).
Нитраты. Исчезновение клинических симптомов или снижение АД(среднего АД на 10% у нормотоников, на 30% у гипертоников, но не ниже 90 мм. рт. ст. систолического АД). Принципы подбора дозировки нефракционированного гепарина представлены в таблице 45.
317

|
Таблица 45 |
|
Номограмма введения гепарина c использованием относительных |
||
изменений АЧТВ (по отношению к контрольной величине) |
||
Начальная доза |
80 Ед/кг болюс, затем 18 Ед/кг/час |
|
АЧТВ < 1,2 контрольной величины |
80 Ед/кг болюс и увеличить скорость |
|
|
инфузии на 4 Ед/кг/час |
|
АЧТВ < 1,2-1,5 контрольной величи- |
40 Ед/кг болюс и увеличить скорость |
|
ны |
инфузии на 2 Ед/кг/час |
|
АЧТВ < 1,5-2,3 контрольной величи- |
Без изменений |
|
ны |
|
|
АЧТВ < 2,3-3 контрольной величины |
Уменьшить скорость инфузии на2 |
|
|
Ед/кг/час |
|
АЧТВ > 3 контрольной величины |
Остановить введение на1 ч, затем |
|
|
продолжить его, уменьшить скорость |
|
|
введения на 3 Ед/кг/час |
|
Примечание: не следует превышать дозы 5000 (при болюсном введении) и 250 Ед/час – при внутривенной инфузии.
Начальная доза 5000 Ед внутривенно струйно (болюс), затем постоянная инфузия, начальная скорость введения из расчета32000 Ед за 24 часа (концентрация 40 Ед/мл). Первое определение АЧТВ – через 6 часов после болюса с последующей коррекций скорости введения в соответствии с номограммой (таблица 46).
Таблица 46 Коррекция скорости введения гепарина в зависимости от АЧТВ
АЧТВ |
Повторить |
Прекратить |
Изменить |
Время |
|
|
болюс |
инфузию |
скорость |
следующего |
|
|
(единиц) |
(мин) |
инфузии |
измерения |
|
|
|
|
мл/ч (Ед/ч) |
АЧТВ |
|
< 50 |
5000 |
0 |
+3 |
(+120) |
6 ч |
50 – 59 |
0 |
0 |
+3 |
(+120) |
6 ч |
60 – 85 |
0 |
0 |
|
0 (0) |
Следующее |
86 – 95 |
0 |
0 |
-2 (80) |
утро |
|
96 – 120 |
0 |
30 |
-2 (-80) |
6 ч |
|
> 120 |
0 |
60 |
-4 |
(-160) |
6 ч. |
Примечание: нормальное АЧТВ (реагенты Dade Actin FS) – 27-35 с.
Противопоказания для введения препаратов. 1. В-адреноблокаторы. К относительным противопоказаниям относят ЧСС менее 60 в 1 мин, систолическое АД менее 100 мм рт. ст., умеренную и тяжелую левожелудочковую недостаточность, наличие признаков периферической гипоперфузии, длительность интервала P-Q более 0,24 с, АВ-блокаду II и III степени, ХОБЛ, БА в анамнезе, тяжелые стенозирующие заболевания периферических сосудов и инсулиноза-
318
