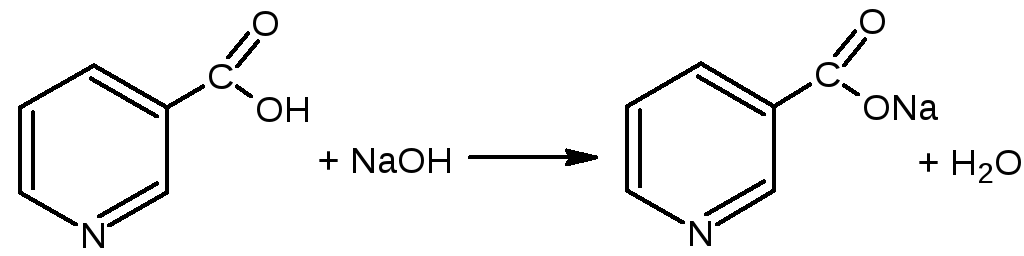
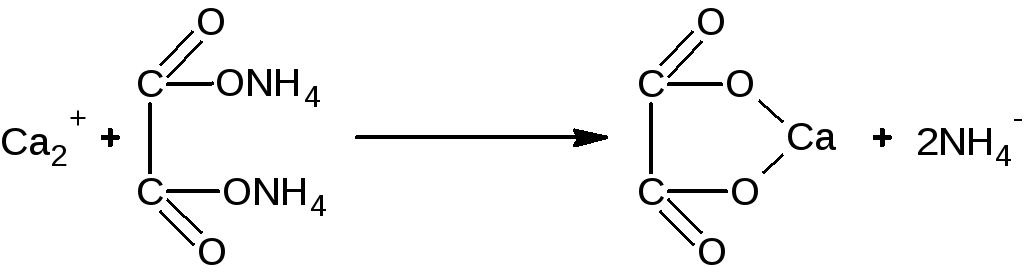
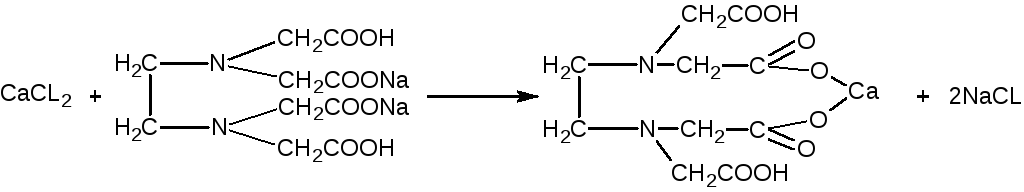
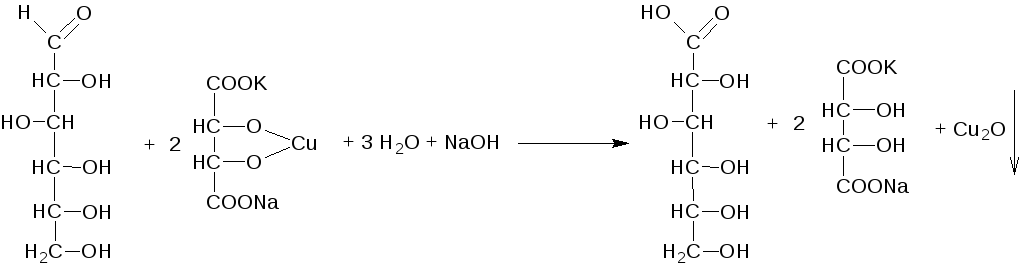
5.Анализ глазных лекарственных форм:
|
Наименование препарата |
Химизм, расчёты, расчётные формулы, результаты анализа. |
Примечание |
|
KI 3% - 10 мл
|
Определение подлинности: Определение ионов К+
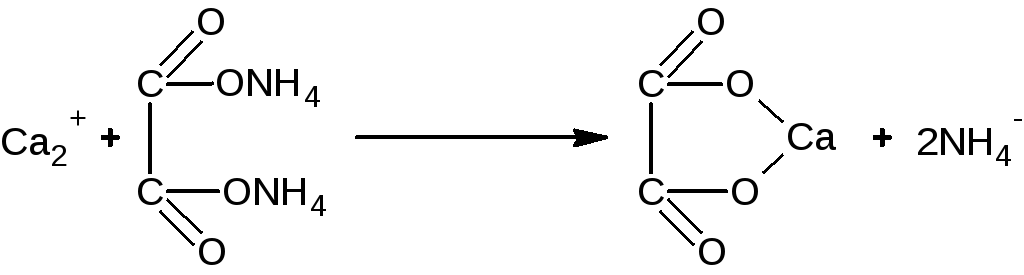
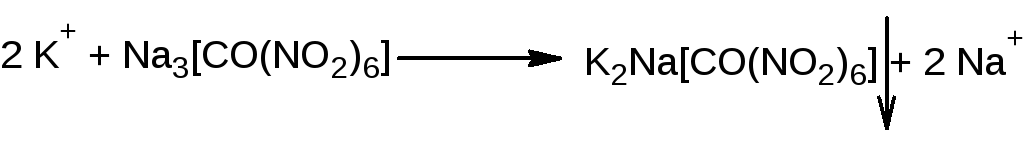
Методика анализа: 3 - 4 капли раствора препарата помещаем в пробирку, прокаливаем, добавляем 2 капли CH3COOH кислоты и 1 каплю раствора Na3[Co(NO2)]6. Образуется желтый кристаллический осадок.
Определение ионов I-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется жёлтый осадок (помутнение) который не растворяется в избытке аммиака.
Количественное определение: Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=166,01
Vнавески = 0,5 мл
1)Содержание лв. в навеске: 100мл - 3г Х = 1.5/100=0,015г 0,5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,015 - 100% Х = 0,0012г Х - 8% От 0,0138 до 0,0162г 3)Расход титранта От 0,83 до 0,97 мл Методика анализа: 0,5 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,0012 Относительное
отклонение -
Допустимое отклонение 8% Заключение: Лекарственная форма соответствует прописи. |
|
|
Протаргола 2% -20мл
|
Определение протаргола имеет особенности. Необходимо провести предварительную обработку для того, что бы перевести серебро в ионое состояние. Для этого проводят мокрую минерализацию – нагревание с раствором HNO3. Определение подлинности: Определение ионов Ag+
Методика анализа: К 2 – 3 каплям препарата прибавляем 5 мл раствора HNO3, нагреваем до обесцвечивания. Добавляем 2 – 3 капли раствора HCL образуется белая муть. Методика определение белка: 2 – 3 капли препарата сжигаем в тигле на плитке. Появляется запах жженого рога.
Количественное определение: Метод тиоцианатометрия. Реакция лежащая в основе метода:
Fэкв = ММ=107,87
Пересчёт на титр по производному 100г протаргола - 8г Ag Х - 0,010787 Х= 0,1348 0,1 Н раствор Х= 0,02697 0,02 Н раствор NH4CNS Vнавески = 0,5 мл 1)Содержание лв. в навеске: 100мл - 2г Х = 2/100=0,02г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,02 - 100% Х = 0,002г Х - 10% От 0,018 до 0,022г 3)Расход титранта От 0,13 до 0,16 мл От 0,66 до 0,81 мл Методика анализа: 1 мл препарата помещаем в пенициллиновый флакон, добавляем 2 мл HNO3 концентрированной и 10 капель Fe(NH4)2SO4. Нагреваем на водяной бане до обесцвечивания раствора и титруем 0,02 Н раствором NH4CNS до кроваво-красной окраски.
Абсолютное отклонение – 0,01 Относительное
отклонение -
Допустимое отклонение 10% Заключение: Лекарственная форма соответствует прописи. |
|
7.Анализ стерильных лекарственных форм:
Особенности контроля качества инъекционных препаратов:
1 Подвергаются полному химическому анализу.
2 Контроль до стерилизации по следующим параметрам: Определение подлинности
Количественное содержание
Ph
Изотонирующие и стабилизирующие вещества
Механические включения
После стерилизации проводят контроль по тем же параметрам за исключением изотонирующие и стабилизирующие веществ.
|
Наименование препарата |
Химизм, расчёты, расчётные формулы, результаты анализа. |
Примечание |
|
NaCL 0.9% -40000мл
|
Определение подлинности: Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание. Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака. Количественное определение: Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=58,44
Vнавески = 1 мл 1)Содержание лв. в навеске: 100мл - 0,9г Х = 0.9/100=0,009г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,009 - 100% Х = 0,00027г Х - 3% От 0,00873 до 0,00927г 3)Расход титранта От 1,49 до 1,58 мл Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,012 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи. |
|
|
Раствор Рингера: NaCL 9.0г CaCL KCL NaHCOпо 0,2 г Воды до 1000мл
|
Определение подлинности: Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание.
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Определение ионов К+
Методика анализа: 3 - 4 капли раствора препарата помещаем в пробирку, прокаливаем, добавляем 2 капли CH3COOH кислоты и 1 каплю раствора Na3[Co(NO2)]6. Образуется желтый кристаллический осадок.
Определение НСО3
Методика анализа: На предметное стекло наносим 2 - 3 капли препарата, 1 каплю HCL. Наблюдается выделение пузырьков газа. Определение ионов Са2+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю оксалата аммония. Образуется белый осадок (помутнение).
Количественное определение: Определение Са2+ - комплексонометрия Сумма хлоридов - аргентометрия, вариант Мора NaHCO3 – ацидиметрия Определение Са2+: Реакция лежащая в основе метода:
Fэкв = ММ= 111.08
Vнавески = 5 мл 1)Содержание лв. в навеске: 100мл - 0,02г Х = 0.1/100=0,001г 5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,001 - 100% Х = 0,0001г Х - 10% От 0,0009 до 0,0011 г 3)Расход титранта От 0,16 до 0,0019 мл От 0,8 до 0,99 мл - 0,01 Н раствора трилона Б
Методика анализа: 5 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 мл аммиачного буфера и несколько кристаллов индикатора хромоген черного и титруем 0,01 Н раствором трилона Б до синей окраски.
Абсолютное отклонение – 0,001 Относительное
отклонение -
Допустимое отклонение 10%.
Определение NaHCO3 Реакция лежащая в основе метода:
Fэкв = ММ= 84,01
Vнавески = 2мл 1)Содержание лв. в навеске: 100мл - 0,02г Х = 0.04/100=0,0004г 2мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,0004 - 100% Х = 0,00004г Х - 10% От 0,00036 до 0,00044г 3)Расход титранта От 0,042 до 0,052 мл От 0,42 до 0,52 мл 0,01 Н раствора кислоты хлористоводородной Методика анализа: 2 мл препарата переносим в пенициллиновый флакон, добавляем 2 – 3 капли индикатора метиловый красный и титруем 0,01 Н раствором кислоты хлористоводородной до красной окраски индикатора.
Абсолютное отклонение – 0,0016 Относительное
отклонение -
Допустимое отклонение 10%
Определение суммы хлоридов Реакция лежащая в основе метода:
Vнавески = 1 мл 1)Содержание лв. в навеске: 100мл - 0,94г Х = 0.94/100=0,0094г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,0094 - 100% Х = 0,000282г Х - 3% От 0,009118 до 0,009682г 3)Расход титранта От 1,53 до 1,6 мл Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 1 – 2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,15 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи. |
|
|
Фурацилин 1:5000 - 40000 мл Состав: Фурацилина 8 г NaCL 360 г |
Определение подлинности:
Методика анализа: 2 - 3 мл препарата переносим в пробирку, добавляем 2 мл NaOH, нагреваем. Образуется оранжево-красное окрашивание и выделяется аммиак который можно обнаружить по запаху или изменению окраски влажной лакмусовой бумажки.
Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание.
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение:
Fэкв = ММ/4 = 49,535
Vнавески = 5 мл 1)Содержание лв. в навеске: 100мл - 0,02г Х = 0.1/100=0,001г 5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,001 - 100% Х = 0,00003г Х - 3% От 0,00097 до 0,00103 г 3)Расход титранта От 0,19 до 0,2 мл От 1,96 до 2,08 мл 0,01 Н раствор Методика анализа: 5 мл препарата переносим в колбу с притертой пробкой, прибавляем 0,5 мл раствора NaOH и 5 мл 0,01Н раствора I2, закрываем колбу и оставляем в тёмном месте на 10 минут. Через 10 минут прибавляем 2 мл раствора H2SO4 , 2 – 3 капли раствора крахмала и титруем не прореагировавший I2 0,01 раствором N2S2O3 до исчезновения синей окраски. Параллельно проводят контрольный опыт. 5 мл препарата переносим в колбу для титрования, прибавляем 5 мл 0,01 Н раствора I2, 2 – 3 капли раствора крахмала и сразу же титруем 0,01 Н раствором N2S2O3 до светло-желтой окраски.
Абсолютное отклонение – 0,15 Относительное
отклонение -
Допустимое отклонение 3%
Определение NaCL Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=58,44
Vнавески = 1 мл
1)Содержание лв. в навеске: 100мл - 0,9г Х = 0.9/100=0,009г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,009 - 100% Х = 0,00027г Х - 3% От 0,00873 до 0,00927г 3)Расход титранта От 1,49 до 1,58 мл Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,012 Относительное
отклонение -
Заключение: Лекарственная форма соответствует прописи. |
|
|
KCL 3% - 1000мл |
Определение подлинности: Определение ионов К+
Методика анализа: 3 - 4 капли раствора препарата помещаем в пробирку, прокаливаем, добавляем 2 капли CH3COOH кислоты и 1 каплю раствора Na3[Co(NO2)]6. Образуется желтый кристаллический осадок.
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение: Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=74,56
Vнавески = 0,5 мл 1)Содержание лв. в навеске: 100мл - 3г Х = 1,5/100=0,015г 0,5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,015 - 100% Х = 0,00045г Х - 3% От 0,01455 до 0,01545г 3)Расход титранта От 1,95 до 2,0 мл Методика анализа: 0,5 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,48 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи.
|
|
|
Новокаин 0,25% - 40000 мл Состав: Новокаина -100 г HCL - 120 мл |
Определение подлинности: Определение новокаина
Методика анализа: 1 каплю препарата наносим на полоску газетной бумаги и 1 каплю HCL. Образуется жёлтое окрашивание. Определение HCL Т.К. содержание кислоты хлористоводородной слишком мало, то её наличие устанавливаем по изменению окраски индикатора метилового красного с желтой на красную. Методика анализа: 1 каплю раствора препарата наносим на полоску газетной бумаги, подсушиваем и наносим 1 каплю кислоты хлористоводородной. Полоска бумаги окрашивается в желтый цвет.
Количественное определение: Метод нитритометрия Реакция лежащая в основе метода:
Fэкв = ММ = 236,31
Vнавески = 1 мл 1)Содержание лв. в навеске: 100мл - 0,25г Х = 0.25/100=0,0025г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,0025 - 100% Х = 0,000075г Х - 3% От 0,002425 до 0,002575 г 3)Расход титранта От 0,1 до 0,11 мл От 1,02 до 1,09 мл 0,01 Н раствора NaOH Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 0,1 мл HCL разведенной, 0,2 г KBr, раствор охлаждаем до 5 – 10 и титруем 0,01 Н раствором NaNO2 до голубоватой окраски. Индикатор Тропеолин 00 и метиленовый синий.
Абсолютное отклонение – 0,76 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи. |
|
|
Раствор Натрия гидрокарбоната 8,4% Состав: NaHCO3 - 84 г Трилона Б - 0,2 Воды до 1000мл |
Определение подлинности: Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание.
Определение НСО3
Методика анализа: На предметное стекло наносим 2 - 3 капли препарата, 1 каплю HCL. Наблюдается выделение пузырьков газа.
Количественное определение: Реакция лежащая в основе метода:
Fэкв = ММ= 84,01
Vнавески = 5мл 1)Содержание лв. в навеске: 100мл - 8,4г Х = 42/100=0,42г 5мл - Хг 2)Содержание л.в. в аликвоте. 0,42 - 100 мл Х = 0,0084 Х - 2 мл 3) Пределы содержания с учетом допустимых норм отклонений: 0,0084 - 100% Х = 0,000252г Х - 3% От 0,008148 до 0,008652г 4)Расход титранта От 0,97 до 1,0 мл Методика анализа: 5 мл препарата переносим в мерную колбу на 100 мл, доводим водой до метки, перемешиваем. Аликвотную часть раствора 2 мл переносим в пенициллиновый флакон, добавляем 2 – 3 капли индикатора метиловый красный и титруем 0,1 Н раствором кислоты хлористоводородной до красной окраски индикатора.
Абсолютное отклонение – 1,7 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи. |
|
|
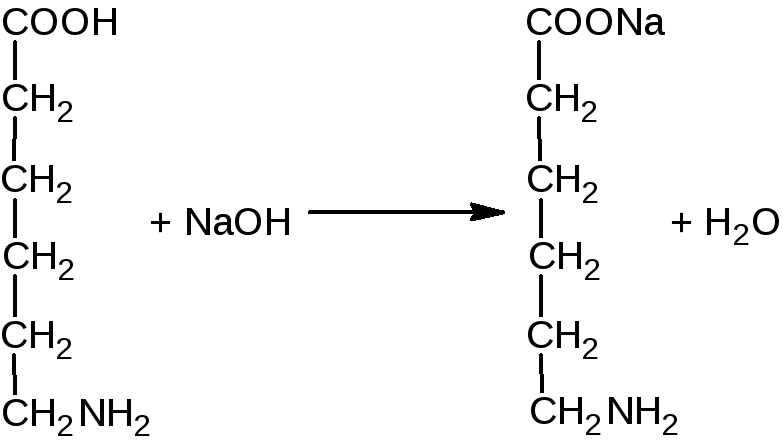
Кислота аминокапроновая 5% - 1000 мл Состав: Кислота аминокапроновая 50 г NaCL 9 г |
Определение подлинности:
Методика анализа: 2 мл раствора помещаем в пробирку, добавляем 1 каплю ф.ф. 2-3 капли NaOH и 5 – 6 капель нингидрина. Нагреваем. Раствор приобретает сине-фиолетовую окраску.
Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание.
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение: Реакция лежащая в основе метода:
Fэкв = ММ= 131,2
Vнавески = 0,5мл 1)Содержание лв. в навеске: 100мл - 5г Х = 2,5/100=0,025г 0,5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,025 - 100% Х = 0,00075г Х - 3% От 0,02425 до 0,02575г 3)Расход титранта От 1,85 до 1,96 мл Методика анализа: 0,5 мл препарата переносим в пенициллиновый флакон, добавляем 5 мл формальной смеси предварительно нейтрализованной по фенолфталеину, добавляем 1 каплю фенолфталеина и титруем 0,1 н раствором NaOH до малиновой окраски индикатора.
Абсолютное отклонение – 0,144 Относительное
отклонение -
Допустимое отклонение 3%
Определение NaCL: Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=58,44
Vнавески = 1 мл 1)Содержание лв. в навеске: 100мл - 0,9г Х = 0.9/100=0,009г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,009 - 100% Х = 0,00027г Х - 3% От 0,00873 до 0,00927г 3)Расход титранта От 1,49 до 1,58 мл Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,0003 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи.
|
|
|
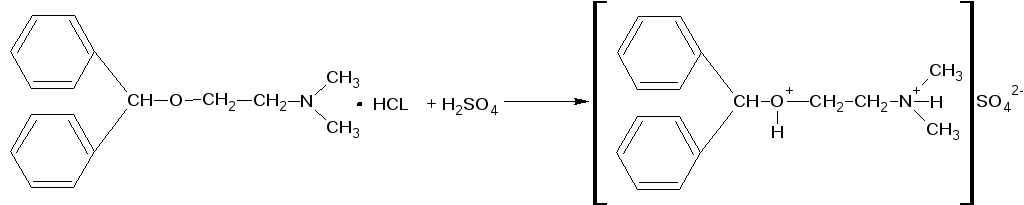
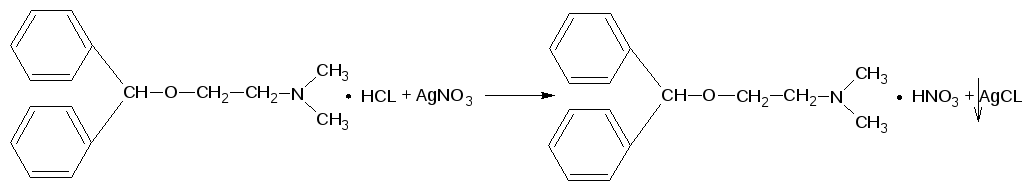
Раствор димедрола 1% - 100мл
|
Определение подлинности:
Методика анализа: На предметное стекло наносим 1 - 2 капли препарата, 1 каплю H2SO4. Образуется ярко желтое окрашивание переходящее в кирпично-красное.
Количественное определение: Метод аргентометрия, вариант Фаянса. Реакция лежащая в основе метода:
Vнавески = 2 мл 1)Содержание лв. в навеске: 100мл - 1г Х = 2/100=0,02г 2мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,02 - 100% Х = 0,0012г Х - 6% От 0,0188 до 0,0212 г 3)Расход титранта От 0,64 до 0,72 мл Методика анализа: 2 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора бромфеноловый синий, по каплям CH3COOH до жёлтой окраски индикатора и титруем 0,1 Н раствором AgNO3 до фиолетовой окраски индикатора.
Абсолютное отклонение – 0,01 Относительное
отклонение -
Допустимое отклонение 6% Заключение: Лекарственная форма соответствует прописи.
|
|
|
Кислота никотиновая 1% - 500мл
|
Определение подлинности:
Методика анализа: На предметное стекло наносим 1 - 2 капли препарата, 1 каплю CuSO4. Образуется осадок синего цвета. При добавлении NH4CNS синяя окраска переходит в зелёную.
Количественное определение: Метод алкалиметрия. Реакция лежащая в основе метода:
Fэкв = ММ = 123,11
Vнавески = 1 мл 1)Содержание лв. в навеске: 100мл - 1г Х = 1/100=0,01г 1мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,01 - 100% Х = 0,0004г Х - 4% От 0,0096 до 0,0104 г 3)Расход титранта От 0,78 до 0,85 мл Методика анализа: 1 мл препарата переносим в пенициллиновый флакон, добавляем 1-2 капли индикатора фенолфталеина и титруем 0,1 Н раствором NaOH до малиновой окраски индикатора.
Абсолютное отклонение – 0,076 Относительное
отклонение -
Допустимое отклонение 4% Заключение: Лекарственная форма соответствует прописи.
|
|
|
Кальция хлорид 1% - 200мл
|
Определение подлинности: Определение ионов Са2+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю оксалата аммония. Образуется белый осадок (помутнение).
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение: Определение Са2+ Метод комплексонометрия Реакция лежащая в основе метода:
Fэкв = ММ= 111.08
Vнавески = 0,5 мл 1)Содержание лв. в навеске: 100мл - 1г Х = 0,5/100=0,005г 0,5мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,005 - 100% Х = 0,00025г Х - 5% От 0,00475 до 0,00525г 3)Расход титранта От 0,85 до 0,94 мл Методика анализа: 0,5 мл раствора препарата переносим в пенициллиновый флакон, добавляем 1-2 мл аммиачного буфера и несколько кристаллов индикатора хромоген черного и титруем 0,05 Н раствором трилона Б до синей окраски.
Абсолютное отклонение – 0,01 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи.
|
|
Рефрактометрия
Метод анализа основанный на изменении показателя преломления света исследуемым веществом. Определение показателя преломления
производят с помощью рефрактометра, обычно при температуре 20 С и длине волны 589,3 нм. На практике из-за значительных объемов
работ для более точного определения количественного содержания веществ в растворе учитывают изменение показателя преломления
воды очищенной при различной температуре: 19 1,3332
20 1,3330
21 1,3329
Для растворов, содержащих одно растворенное вещество, расчет концентрации ведут по формуле:
![]()
n1 - показатель преломления раствора
n0 - показатель преломления воды
C - Концентрация в %
F - фактор равный величине фактора преломления при увеличении концентрации в %.
Рефрактометрия рекомендуется для определения веществ, если их концентрация в растворе не менее 5%. При меньшей концентрации не
соблюдается зависимость между показателем преломления и концентрацией.
|
Наименование препарата |
Химизм, расчёты, расчётные формулы, результаты анализа. |
Примечание |
|
Глюкоза 5% - 40000мл Состав: Глюкозы б/в 2000 г NaCL 10,4 г HCL разв. 8,8 мл Воды до 40000 |
Определение подлинности:
Методика анализа: 1 мл перпарата переносим в пробирку, добавляем 10 мл реактива Фелинга, нагреваем пробирку. Выделяется осадок оксида меди ( I ) желтого или красного цвета.
Определение ионов Na+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю CH3COOH и 1 каплю Zn(UO2)3(CH3COO)8. Образуется желтое окрашивание.
Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение: Так как вещества 5% то количественное содержание определяют рефрактометрическим методом. Методика анализа: 2 – 3 капли воды наносим на призму рефрактометра. Измеряем показатель преломления (n0 ). Далее призму тщательно протираем и наносим 2 – 3 капли испытуемого раствора, измеряем показатель преломления ( n1 ). Содержание вещества устанавливаем по формуле:
Определение HCL Метод алкалиметрия Реакция лежащая в основе метода:
Fэкв = ММ=36,458
Пересчёт на титр по производному 100 мл - 8,3 г HCL Х - 0,003645 Х= 0,04391 0,1 Н раствор NaOH Х= 0,008784 0,01 Н раствор NaOH
Vнавески = 10 мл 1)Содержание лв. в навеске: 100мл - 0,022 г Х = 0.22/100=0,0022г 10мл - Х г 2) Пределы содержания с учетом допустимых норм отклонений: 0,0022 - 100% Х = 0,000066 г Х - 3% От 0,002134 до 0,002266г 3)Расход титранта От 0,049 до 0,005 мл От 0,24 до 0,25 мл Методика анализа: 10 мл раствора препарата переносим в колбу для титрования, добавляем 2 капли индикатора метиловый красный и титруем 0.02 Н раствором NaOH до желтой окраски индикатора.
Абсолютное отклонение – 0,016 Относительное
отклонение -
Допустимое отклонение 3%
Определение NaCL Метод аргентометрия, вариант Мора. Реакция лежащая в основе метода:
Fэкв = ММ=58,44
Vнавески = 10 мл 1)Содержание лв. в навеске: 100мл - 0,026г Х = 0.026/100=0,0026г 10мл - Хг 2) Пределы содержания с учетом допустимых норм отклонений: 0,0026 - 100% Х = 0,000078г Х - 3% От 0,0002522 до 0,002678г 3)Расход титранта От 0,43 до 0,49 мл Методика анализа: К 10 мл раствора препарата после определения HCL, добавляем 1-2 капли индикатора KCrO4 и титруем 0,1 Н раствором AgNO3 до красной окраски индикатора.
Абсолютное отклонение – 0,12 Относительное
отклонение -
Допустимое отклонение 3% Заключение: Лекарственная форма соответствует прописи. |
|
|
Кальция хлорид 5% - 1000мл
|
Определение подлинности: Определение ионов Са2+
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю оксалата аммония. Образуется белый осадок (помутнение). Определение ионов CL-
Методика анализа: На предметное стекло наносим 1 каплю препарата, 1 каплю HNO3 и1 каплю AgNO3. Образуется белый осадок (помутнение) которое исчезает при добавлении 1 капли аммиака.
Количественное определение: Так как вещества 5% то количественное содержание определяют рефрактометрическим методом. Методика анализа: 2 – 3 капли воды наносим на призму рефрактометра. Измеряем показатель преломления (n0 ). Далее призму тщательно протираем и наносим 2 – 3 капли испытуемого раствора, измеряем показатель преломления ( n1 ). Содержание вещества устанавливаем по формуле:
Заключение: Лекарственная форма соответствует прописи. |
|
|
Новокаин 5% - 1000 мл
|
Определение подлинности: Определение новокаина
Методика анализа: 1 каплю препарата наносим на полоску газетной бумаги и 1 каплю HCL. Образуется жёлтое окрашивание.
Определение HCL Т.К. содержание кислоты хлористоводородной слишком мало, то её наличие устанавливаем по изменению окраски индикатора метилового красного с желтой на красную.
Количественное определение: Методика анализа: Так как вещества 5% то количественное содержание определяют рефрактометрическим методом. 2 – 3 капли воды наносим на призму рефрактометра. Измеряем показатель преломления ( n0 ). Далее призму тщательно протираем и наносим 2 – 3 капли испытуемого раствора, измеряем показатель преломления ( n1 ). Содержание вещества устанавливаем по формуле:
Заключение: Лекарственная форма соответствует прописи. |
|
АНАЛИЗ ВОДЫ ОЧИЩЕННОЙ
Получение и хранение воды очищенной производится в специально оборудованном для этой цели помещении. Получение воды для инъекций осуществляется в помещении дистилляционной асептического блока, где выполняются работы, связанные только с перегонкой воды.
Воду очищенную используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойства воды и защищающих ее от инородных частиц и микробиологических загрязнений, не более 3 суток.
Воду для инъекций используют свежеприготовленной или хранят при температуре от 5˚ С до 10˚ С или от 80˚ С до 95˚ С в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих ее от попадания механических включений и микробиологических загрязнений, не более 24 часов.
Вода очищенная, вода для инъекций ежедневно проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода, предназначенная для изготовления стерильных растворов, кроме указанных выше испытаний должна быть проверена на отсутствие восстанавливающих веществ, солей аммония и углерода диоксида в соответствии с требованиями действующей Государственной Фармакопеи.
Результаты анализа отражаются в «Журнале регистрации результатов контроля воды очищенной и воды для инъекций».
Ежеквартально вода очищенная должна направляться в территориальную контрольно - аналитическую лабораторию для полного химического анализа.

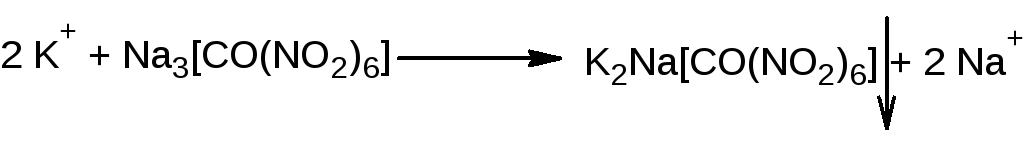
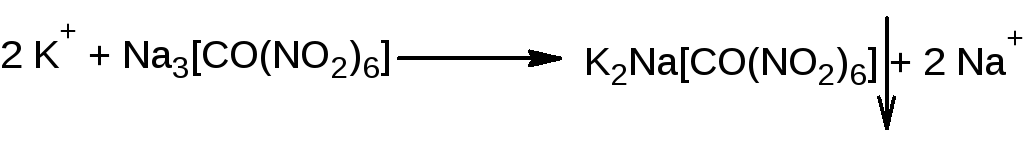



 Fэкв
= ММ = 291,82
Fэкв
= ММ = 291,82