
13
.docxЭкзаменационный билет по общей химии №13
-
Приведите классификацию окислительно-восстановительных реакций с примерами
1.Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ.
KM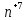 O4
+ H3
O4
+ H3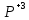 O3
+ H2SO4
M
O3
+ H2SO4
M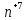 SO4
+ H3
SO4
+ H3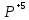 O4
+ K2SO4
+ H2O
O4
+ K2SO4
+ H2O
2. Внутримолекулярные окислительно-восстановительные реакции, при которых степень окисления изменяют атомы разных элементов одного и того же вещества.
+5 2 +4 0
Pb(NO3)2 PbO + NO2 + O2
3.Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации). В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционирования характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента.
+6 +7 +4
K2MnO4 + H2O KMnO4 + MnO2 + KOH.
4.Внутримолекулярные реакции окисления-восстановления, в которых происходит выравнивание степеней окисления атомов одного и того же элемента (то есть обратные ранее рассмотренным), являются процессами контрдиспропорционирования (коммутации), например
3 + 3 0
NH4NO2 N2 + 2H2O.
5.Восстановительно-окислительная среда
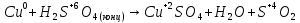
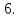 Два
окислителя или два восстановителя.
Два
окислителя или два восстановителя.
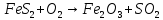
-
Перечислите методы защиты металлов и полимеров от коррозии
Повышение химического сопротивления конструкционных материалов, изоляция поверхности металла от агрессивной среды, понижение агрессивности производственной среды, снижение коррозии наложением внешнего тока (электрохимическая защита).
-
Дайте определение понятию «молекула». Молекулой называется мельчайшая частица вещества, способная к самостоятельному существованию и обладающая всеми его химическими свойствами.
-
Рассчитайте число моль СО2, содержащегося в сосуде объемом 10 л при температуре 45оС под давление 0,3 МПа.
Дано: V=10л, t=45 C(Т=318 К), P=0.3 МПа=300000 Па.Решение: по закону Менделеева-Клайперона (PV/T=nR) 300000*10/318=n*8.3 n=300000*10/(318*8.3) n=1136.62. Ответ: n=1136.62.
-
Сколько граммов щелочи ( 1,4г/мл, N 0.3) потребуется для нейтрализации 100 мл 0,8н H2SO4?
Дано:
V(H2SO4)=100мл=0.1л,
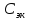 (H2SO4)=0,8н
, (
щелочи)
1,4г/мл=1400г/л,
N
0.3.
Решение:
NaOH+
H2SO4=
(H2SO4)=0,8н
, (
щелочи)
1,4г/мл=1400г/л,
N
0.3.
Решение:
NaOH+
H2SO4=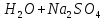
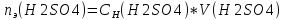
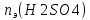 =0.1*0.8=0.08моль-экв
V(NaOH)=0.08/0.3=0.27л
m(NaOH)==0.27л*1400г/л
=378г Ответ: m(NaOH)=
=378г
=0.1*0.8=0.08моль-экв
V(NaOH)=0.08/0.3=0.27л
m(NaOH)==0.27л*1400г/л
=378г Ответ: m(NaOH)=
=378г
