
- •Спектроскопические методы – 7 семестр (сэ-091, нм-091)
- •3.6 Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5. Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6. Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7. Явление зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 3. Молекулярная спектроскопия
- •Тема 9. Разделение энергии молекулы на части и основные типы спектров
- •Характеристики переходов и интенсивности в случае спектров поглощения и испускания
Тема 4. Электронные оболочки атомов и периодическая система
элементов.
4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
В сложном атоме, содержащем 2 и более электронов, эти электроны взаимодействуют между собой, и поэтому, нельзя считать, что всякий электрон двигается в поле ядра независимо от всех остальных. Однако приближенно действие всех остальных электронов на данный электрон можно заменить некоторым усредненным, эффективным полем, обладающем сферической симметрией и убывающем с увеличением расстояния r рассматриваемого электрона от ядра. Дополнительная потенциальная энергия электрона Uдоп в этом поле будет функцией от r, и полная потенциальная энергия электрона в поле ядра и остальных электронов запишется в виде:
![]() (4.1)
(4.1)
С
точки зрения наглядных представлений
все остальные электроны образуют
сферически симметричное электронное
облако, и на электрон, находящийся на
расстоянии r
от ядра, действует, наряду с зарядом
ядра z,
заряд
![]() всех
электронов, расположенных внутри сферы
радиусаr,
что приводит к экранированию
ядра электронами.
всех
электронов, расположенных внутри сферы
радиусаr,
что приводит к экранированию
ядра электронами.
Потенциал
![]() можно представить:
можно представить:
![]() , (4.2)
, (4.2)
где
![]() -
функция расстояния, характеризующая
экранирование ядра электронами. С
помощью (6.2) формула (6.1) запишется в виде:
-
функция расстояния, характеризующая
экранирование ядра электронами. С
помощью (6.2) формула (6.1) запишется в виде:
![]() (4.3)
(4.3)
где
![]() - эффективный
заряд ядра, действующий на электрон на
расстоянии r.
!!Это такой заряд ядра, при котором для
силы, обратно пропорциональной квадрату
расстояния (кулоновской силы), потенциал
на данном расстоянии r
равен U(r).
- эффективный
заряд ядра, действующий на электрон на
расстоянии r.
!!Это такой заряд ядра, при котором для
силы, обратно пропорциональной квадрату
расстояния (кулоновской силы), потенциал
на данном расстоянии r
равен U(r).
!!
Функция экранирования
![]() с
расстоянием возрастает от
с
расстоянием возрастает от
![]() приr
= 0 до постоянного значения на бесконечности.
При r
приr
= 0 до постоянного значения на бесконечности.
При r
![]() на
электрон будет действовать поле ядра
за вычетом поля всех электронов, кроме
одного, и для нейтрального атома
на
электрон будет действовать поле ядра
за вычетом поля всех электронов, кроме
одного, и для нейтрального атома
![]() .
.
Электрон в сферически симметричном поле можно характеризовать набором квантовых чисел:
![]()
![]()
![]()
![]()
!!Рассмотренное приближение (внешний электрон + атомный остаток) называют одноэлектронным приближением.
Очень
важен вопросе о зависимости энергии
электрона от квантовых чисел.
Энергия будет теперь зависеть не только
от n,
но и от
![]() .
.
!!
Для поля типа (4.3), убывающего с расстоянием
более быстро, чем кулоновское (с
увеличением r
одновременно уменьшается Z(r),
стоящее в числителе), энергия
электрона тем меньше при заданном n,
чем меньше
![]() .
.
Физическая
причина подобной зависимости
состоит в том, что электроны с меньшим
![]() подходят ближе к ядру, где
подходят ближе к ядру, где
![]() Z(r)
больше, что увеличивает их энергию
связи. Подробно мы рассмотрим этот
вопрос дальше.
Z(r)
больше, что увеличивает их энергию
связи. Подробно мы рассмотрим этот
вопрос дальше.
Энергию
электрона как функцию n
и
![]() можно представить в виде:
можно представить в виде:
![]() (4.4)
(4.4)
где
введён
![]() - эффективный заряд.
Как правило,
- эффективный заряд.
Как правило,
![]() <
Z
и его записывают в виде:
<
Z
и его записывают в виде:
![]() (4.5)
(4.5)
где
![]() –постоянная
экранирования,
являющаяся
функцией от n
и от
–постоянная
экранирования,
являющаяся
функцией от n
и от
![]() .
.
Рассмотрим теперь сложный атом с числом электронов N. Его состояние в одноэлектронном приближении будет характеризоваться совокупностью квантовых чисел:
![]() ;
;
![]() ;
… ;
;
… ;![]() .
.
Если атом содержит 1 электрон, этот электрон может находиться в любом состоянии, для которого:
n=1,2,3…;
![]() =0,1,2…n-1;
=0,1,2…n-1;
![]() =
=![]() ,
,![]() -1,…,-
-1,…,-
![]() ;
;
![]() .
.
Для атома, содержащего два и более электронов, возможные состояния отдельных электронов определяются правилом Паули:
в
атоме не может быть двух электронов в
одинаковых состояниях, т.е. не может
быть двух электронов, характеризуемых
одинаковыми наборами квантовых чисел
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Любые два электрона должны отличаться значением хотя бы одного из четырех квантовых чисел.
Принцип Паули позволяет определить возможное число электронов в атоме, обладающих заданными значениями определённых квантовых чисел:
Если задано значение n и
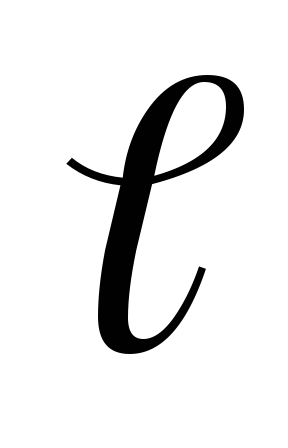 ,
то согласно (5.1), возможны 2(2
,
то согласно (5.1), возможны 2(2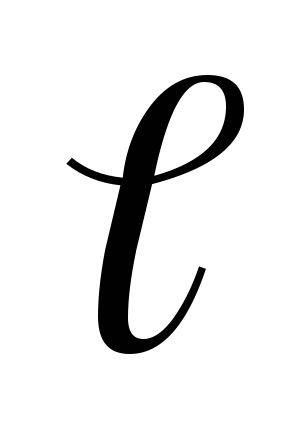 +1)
состояний, отличающихся значениями
+1)
состояний, отличающихся значениями
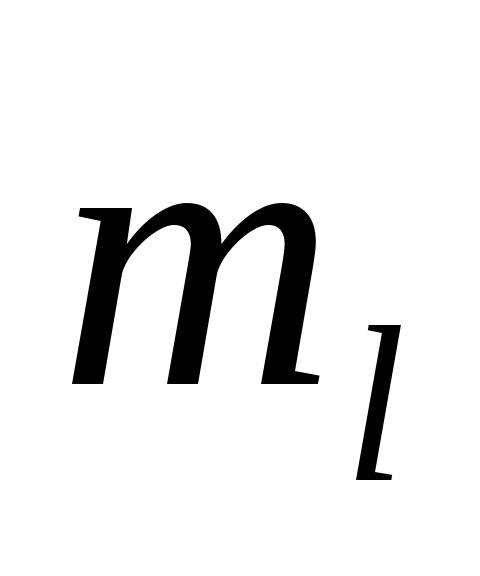 и
и
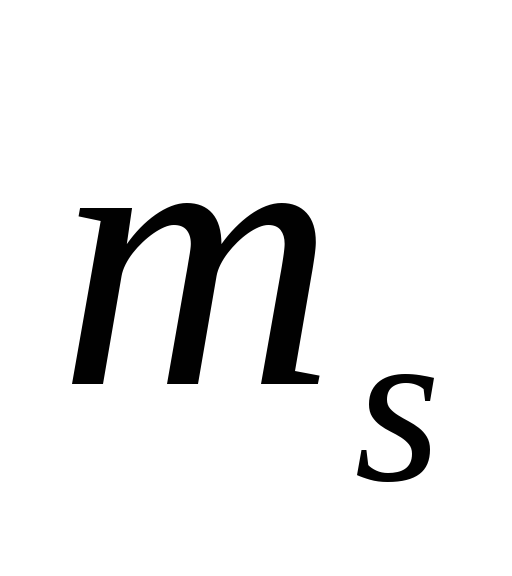 .
Следовательно, в
атоме может быть не более
.
Следовательно, в
атоме может быть не более
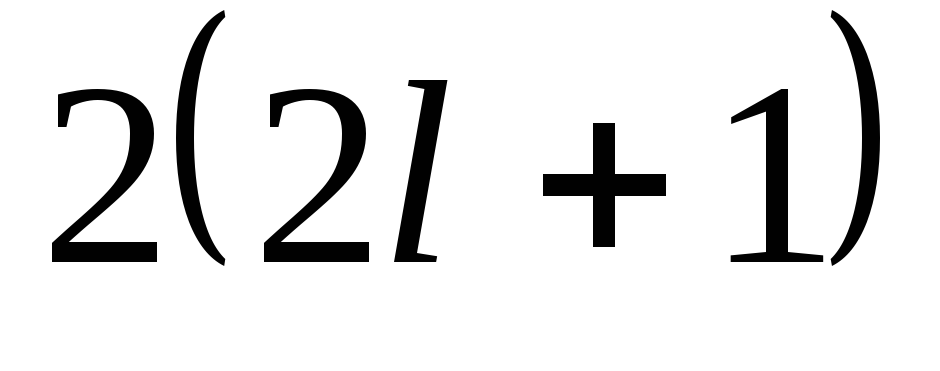 электронов с заданными
электронов с заданными
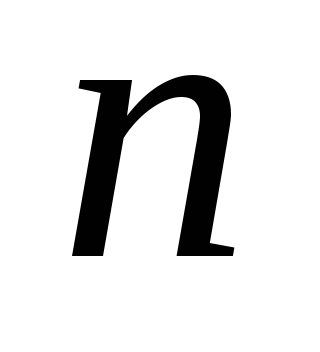 и
и
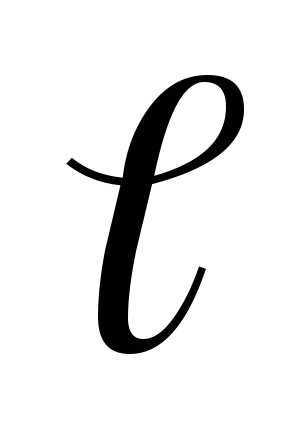 .
.
Таким
образом, при заданном
![]() в атоме может иметься:
в атоме может иметься:
2(2.0+1)=2
S-электрона
(![]() =0),
=0),
2(2.1+1)=6
P-электронов
(![]() =1)
и т.д.
=1)
и т.д.
Если задано значение
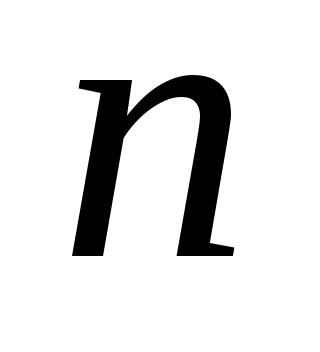 ,
то возможны
,
то возможны
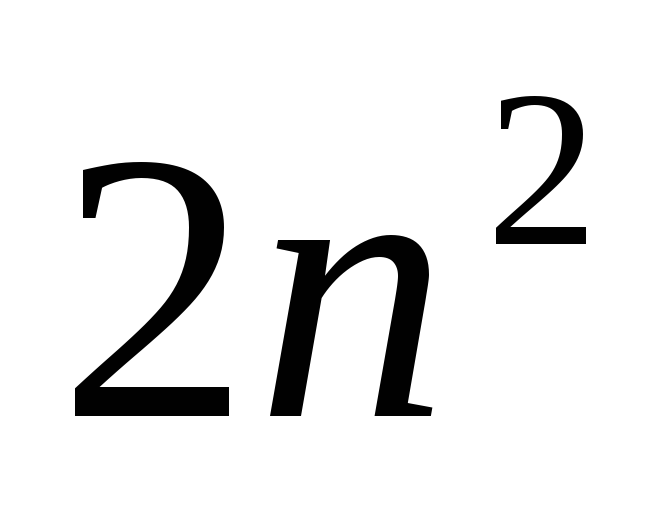 состояний, отличающихся значениями
состояний, отличающихся значениями
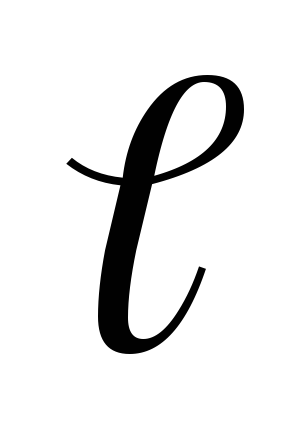 ,
,
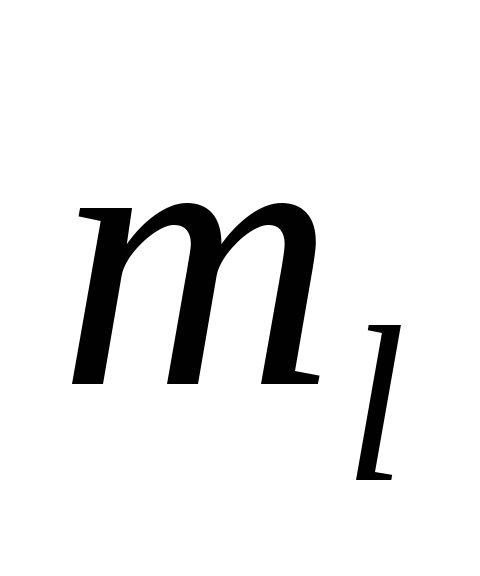 и
и
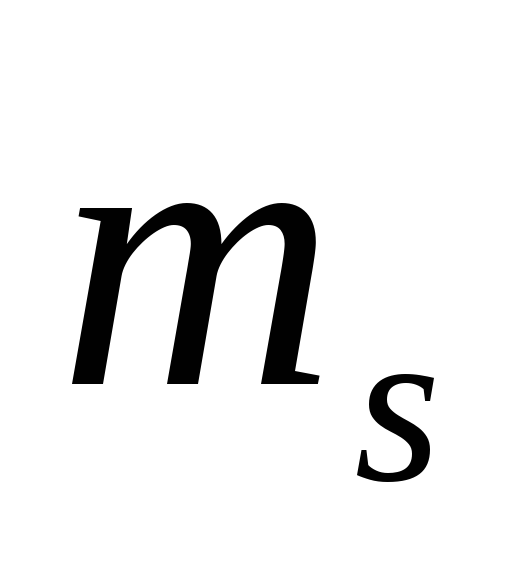 ,
следовательно, в
атоме может быть не более
,
следовательно, в
атоме может быть не более
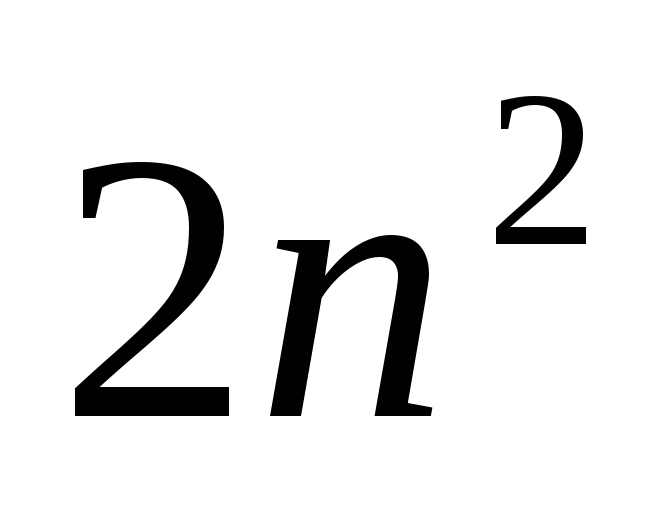 электронов с заданным n,
т.е. может
иметься 2, 8, 18, 32… электронов с n=1,
2, 3, 4…
электронов с заданным n,
т.е. может
иметься 2, 8, 18, 32… электронов с n=1,
2, 3, 4…
ОПРЕДЕЛЕНИЕ. Электроны
с одинаковыми n и
![]() называютсяэквивалентными электронами.
называютсяэквивалентными электронами.
Их обозначают символами
ns, np, nd, nf…для
![]() =0,
1, 2, 3…и указывают число таких электронов
в виде показателя у символа, например,
=0,
1, 2, 3…и указывают число таких электронов
в виде показателя у символа, например,![]() …
…
Возможные числа эквивалентных электронов в таблице 3.1
Таблица 3.1
-
n=1
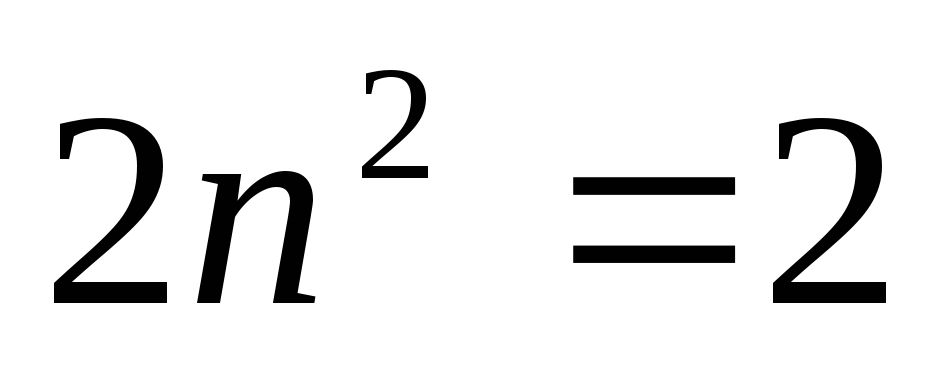
n=2
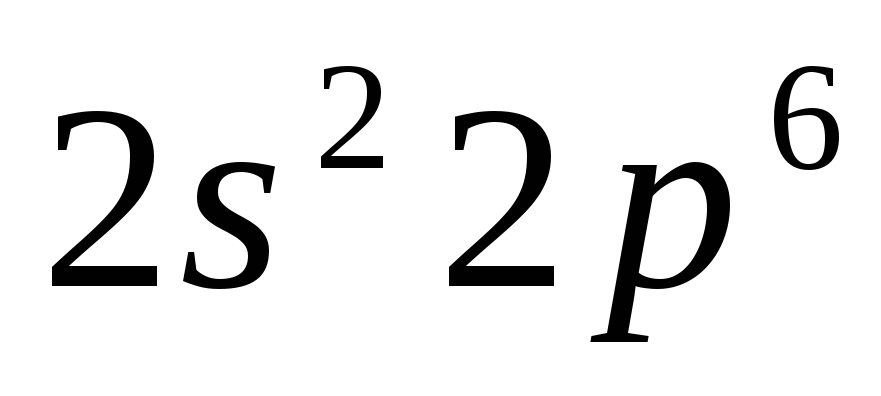
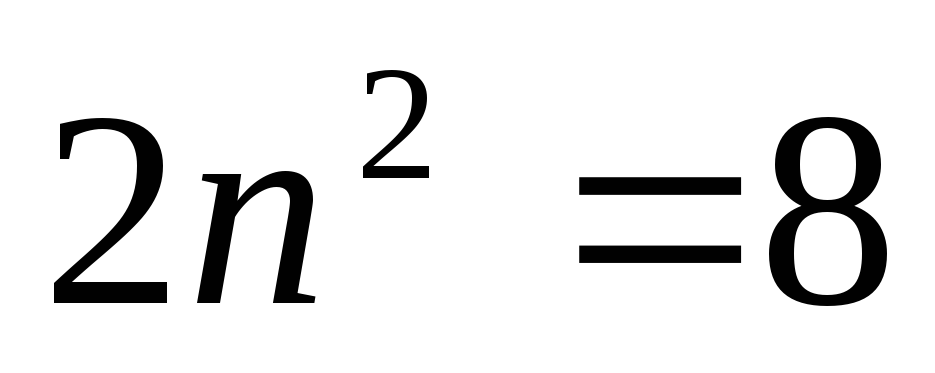
n=3

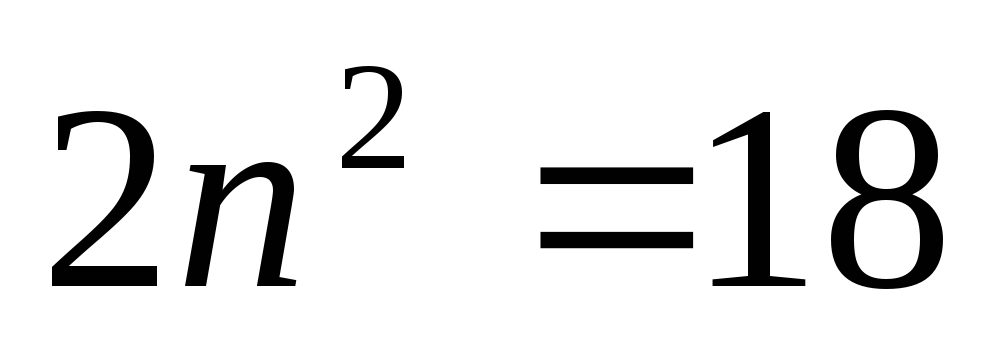
n=4
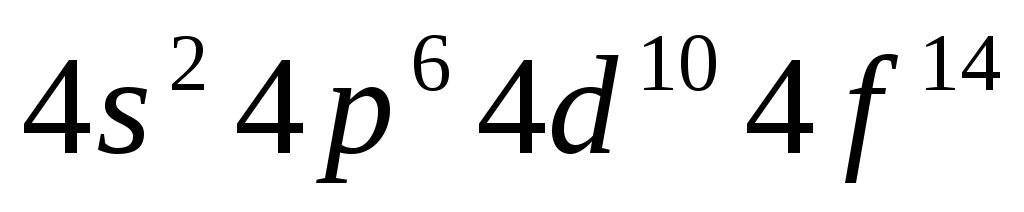
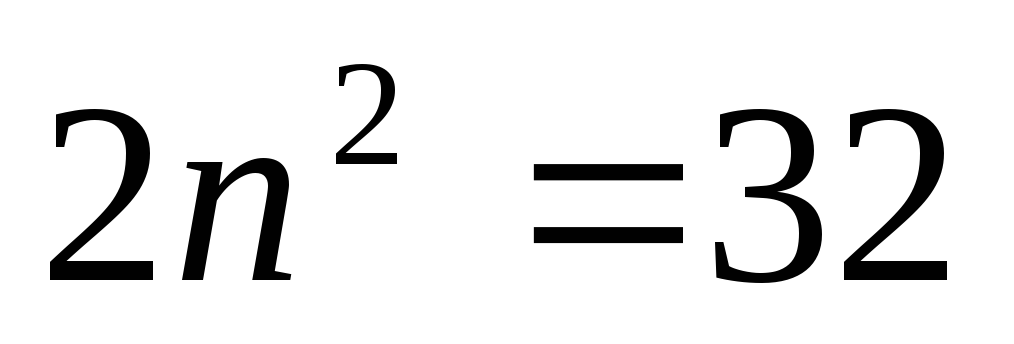
n=5

…
…
…
Сумма
показателей в горизонтальном ряду даёт
полное число электронов
![]() ,
т.е. 2, 8, 18…
,
т.е. 2, 8, 18…
!!
Совокупность значений n
и
![]() для всех N
электронов в атоме
для всех N
электронов в атоме
![]()
![]() ,
,
![]()
![]() ,
…,
,
…,![]()
![]() характеризует
электронную
конфигурацию.
характеризует
электронную
конфигурацию.
