Интернет-курс Ёршикова С.М. / 1 / 1
.6.doc|
Раздел 1.6 |
Примеры обучающих задач и методы их решения |
|
|
|
|
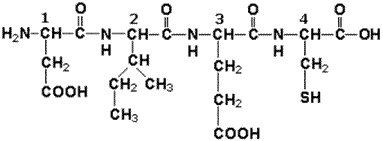
Задача 1.1. Анализ структуры и свойств пептида. При частичном гидролизе ферментного белка был получен следующий тетрапептид:
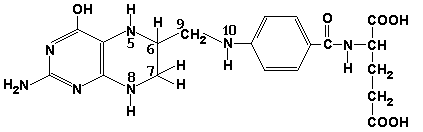
Проанализируйте структуру и свойства пептида, ответив на следующие вопросы: 1. Дайте полное название пептида. 2. Определите полярность и укажите наличие и знак электрического заряда радикала при рН 7,0 для 1-го аминокислотного остатка в данном пептиде. 3. Определите полярность и укажите наличие и знак электрического заряда радикала при рН 7,0 для 2-го аминокислотного остатка в данном пептиде. 4. Определите полярность и укажите наличие и знак электрического заряда радикала при рН 7,0 для 3-го аминокислотного остатка в данном пептиде. 5. Определите полярность и укажите наличие и знак электрического заряда радикала при рН 7,0 для 4-го аминокислотного остатка в данном пептиде. 6. Какая цветная реакция может быть использована для обнаружения α-аминокислот? Приведите пример её практического использования. 7. Сравните растворимость пептида в воде и органических растворителях, ответ обоснуйте. 8. В какой среде (кислой, щелочной, нейтральной) находится pI данного пептида (ответ обоснуйте)? 9. В каком направлении (к катоду, к аноду) будет двигаться этот пептид в электрическом поле при рН 7,0 или останется в точке старта (ответ обоснуйте)? 10. Может ли этот фрагмент белковой молекулы участвовать в образовании α-спирали (ответ обоснуйте)? 11. Какие связи, стабилизирующие третичную структуру белка, могут образовывать радикалы аминокислот данного пептида (укажите отдельно для каждого радикала)? 12. Как изменятся растворимость в воде и суммарный заряд пептида при рН 7,0 после замены 3-го аминокислотного остатка на остаток аргинина? Ответ: 1. аспартил-изолейцил-глутамил-цистеин. 2. Полярный, отрицательно заряженный радикал. 3. Неполярный радикал. 4. Полярный, отрицательно заряженный радикал. 5. Полярный, незаряженный радикал. 6. Нингидриновая реакция, используется для обнаружения аминокислот на хроматограммах. 7. В состав пептида входит 3 полярных (гидрофильных) радикала и 1 неполярный (гидрофобный), поэтому пептид лучше растворяется в воде, чем в органических растворителях. 8. В состав пептида входит 2 отрицательно заряженных при pH 7.0 радикала и ни одного положительно заряженного, поэтому pI пептида находится в кислой среде. 9. По той же причине в электрическом поле пептид будет двигаться к аноду. 10. Одноимённо заряженные радикалы аминокислот, расположенные рядом, препятствуют образованию α-спирали. 11. 1 - ионные, 2 - гидрофобные, 3 - ионные, 4 - дисульфидные. 12. Растворимость пептида в воде, по-видимому, существенно не изменится (обе аминокислоты полярные), суммарный электрический заряд будет равен нулю (замена одного отрицательно заряженного радикала на положительно заряженный). Задача 1.2. Характеристика кофермента. Рассмотрите формулу кофермента и ответьте на поставленные вопросы.
1. Дайте полное название кофермента. 2. Укажите буквенное обозначение и название витамина в составе кофермента. 3. Из каких структурных единиц состоит молекула кофермента? 4. Укажите тип реакций, в которых принимает участие данный кофермент. 5. Приведите примеры аминокислот, участвующих в этих реакциях. 6. Укажите номера атомов в составе кофермента,с которыми связана его биологическая роль. Ответ: 1. Тетрагидрофолиевая кислота. 2. Является производным витамина Bc (фолиевой кислоты). 3. Тетрагидроптеридин, пара-аминобензойная кислота, глутаминовая кислота. 4. Реакции переноса одноуглеродных групп (метильной, метиленовой, метенильной, формильной). 5. Источниками одноуглеродных групп являются аминокислоты глицин и серин. 6. Атомы азота 5 и 10, водород у которых может замещаться на одноуглеродные группы. |
|