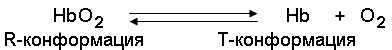Введение в курс биохимии / 3 неделя
.docx|
3-я неделя |
Структура и функции миоглобина и гемоглобина. Структура нуклеотидов и нуклеиновых кислот. |
|
|
|
|
Содержание |
Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков - гемоглобина и миоглобина. Строение нуклеиновых кислот. Связи, формирующие первичную структуру ДНК и РНК. Нуклеотидный состав и вторичная структура ДНК и РНК. Типы РНК. |
|
|
|
|
Цели |
После изучения данной темы студент должен:
|
|
|
|
|
План занятия |
|
|
Раздел 3.1 |
Понятие о простых и сложных белках. Классификация сложных белков. |
|
Раздел 3.2 |
Миоглобин и гемоглобин: сходство и различия структуры и функции. |
|
Раздел 3.3 |
Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
|
Раздел 3.4 |
Особенности строения белковой и небелковой части нуклеопротеинов. Нуклеотидный состав ДНК и РНК и их функции в клетке. |
|
Раздел 3.5 |
Примеры обучающих задач и методы их решения |
|
|
|
|
План работы |
|
|
1. |
Изучить теоретический материал данного занятия. |
|
2. |
Просмотреть внутрикурсовую почту. Задать вопросы тьютору. |
|
3. |
Познакомиться с примерами обучающих задач и методикой их решения. |
|
4. |
Самостоятельно выполнить задания по данной теме. |
|
|
Пройдите тест на знание теоретического материала 'Строение и функции хромопротеинов и нуклеопротеинов (10)' |
|
|
|
|
|
|
|
© С.М.Ершиков, 2009. Все права защищены |
|
|
Раздел 3.1 |
Понятие о простых и сложных белках. Классификация сложных белков. |
||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки - белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) - белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка - простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) .
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков - представителей других классов будет рассмотрена позднее. |
|||||||||||||||||||||||||
|
© С.М.Ершиков, 2009. Все права защищены |
|||||||||||||||||||||||||
|
Раздел 3.2 |
Миоглобин и гемоглобин: сходство и различия структуры и функции. |
|
|
|
|
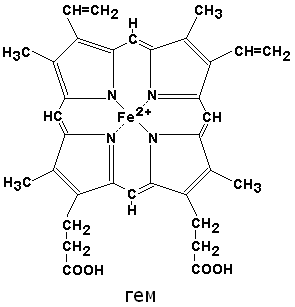
3.2.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина - витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.2.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.2.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
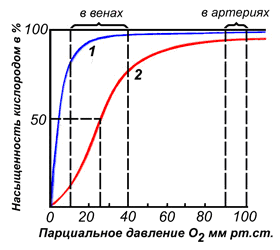
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 4. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. |
|
|
© С.М.Ершиков, 2009. Все права защищены |
|
|
Раздел 3.3 |
Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
|
|
|
|
3.3.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN—, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. Эта реакция лежит в основе метода лечения отравления цианидами. Кроме того, образование цианметгемоглобина in vitro используется при определении содержания гемоглобина в крови. 3.3.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. |
|
|
© С.М.Ершиков, 2009. Все права защищены |
|
|
Раздел 3.4 |
Особенности строения белковой и небелковой части нуклеопротеинов. Нуклеотидный состав ДНК и РНК и их функции в клетке. |
|
|
|
|
3.4.1. Как уже было сказано (3.1.1), нуклеопротеины - сложные белки, простетические группы которых представлены нуклеиновыми кислотами. Известно две разновидности нуклеопротеинов:
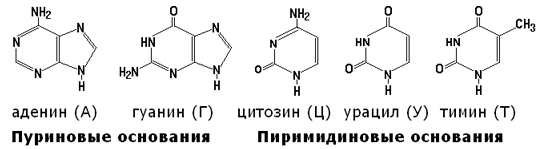
Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков (например, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином) . Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.4.2. Нуклеиновыми кислотами или полинуклеотидами называются высокомолекулярные вещества, состоящие из нуклеотидов, соединённых в цепь 3', 5'-фосфодиэфирными связями. Каждый нуклеотид состоит из азотистого основания, углевода (пентозы) и остатка фосфорной кислоты. Азотистые основания, входящие в состав нуклеотидов, имеют следующее строение:
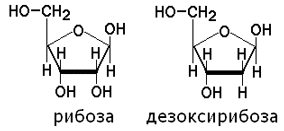
Углеводы представлены рибозой и дезоксирибозой:
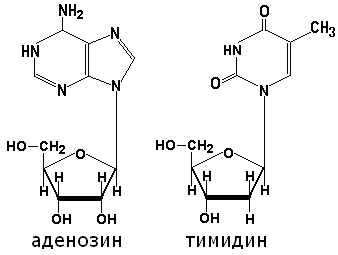
Азотистое основание и пентоза, соединённые N-гликозидной связью, образуют нуклеозид. Если в качестве пентозы в нуклеозиде присутствует рибоза, то это рибонуклеозид, а если дезоксирибоза - то это дезоксирибонуклеозид. Примеры нуклеозидов:
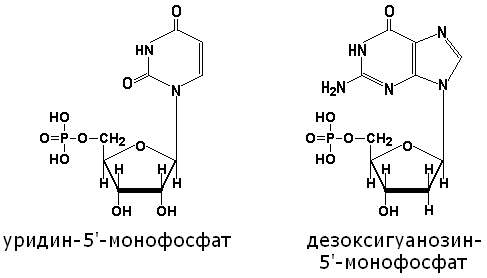
Нуклеотиды представляют собой фосфорилированные нуклеозиды. Остаток фосфорной кислоты, как правило, присоединяется к гидроксильной группе пентозы в 5'-положении при помощи сложноэфирной связи. Примеры:
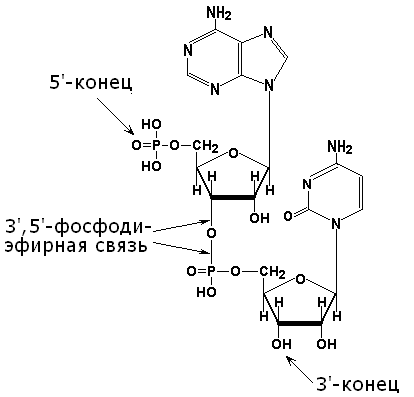
В клетках встречаются также нуклеозиддифосфаты и нуклеозидтрифосфаты, содержащие соответственно два и три остатка фосфорной кислоты. Биологическая роль этих соединений будет рассматриваться в дальнейшем. Выучите формулы нуклеотидов и научитесь давать им правильные названия (таблица 3.3). Кроме перечисленных, известны минорные нуклеотиды (редко встречающиеся) . Они содержат, как правило, метилированные производные вышеприведённых главных азотистых оснований. Минорные основания присутствуют в составе некоторых разновидностей рибонуклеиновых кислот. Роль этих оснований заключается, очевидно, в защите молекулы нуклеиновой кислоты от действия гидролитических ферментов. 3.4.3. Первичной структурой нуклеиновых кислот называется последовательность расположения мононуклеотидов в цепи ДНК или РНК. Первичная структура нуклеиновых кислот стабилизируется 3',5'-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3'-положении пентозного остатка каждого нуклеотида с фосфатной группой соседнего нуклеотида (рисунок 3.2), Таким образом, на одном конце полинуклеотидной цепи имеется свободная 5'-фосфатная группа (5'-конец), а на другом - свободная гидроксильная группа в 3'-положении (3'-конец). Нуклеотидные последовательности принято записывать в направлении от 5'-конца к 3'-концу.
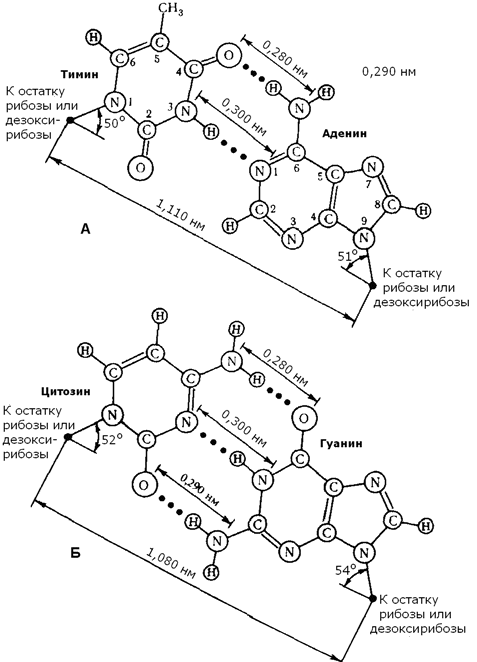
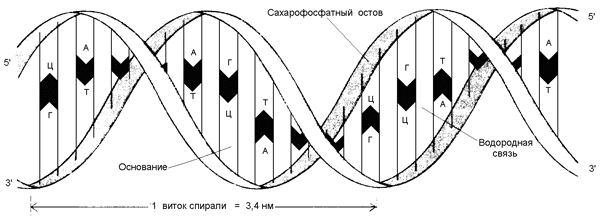
Рисунок 3.2. Структура динуклеотида, в состав которого входят аденозин-5'-монофосфат и цитидин-5'-монофосфат. 3.4.4. ДНК (дезоксирибонуклеиновая кислота) содержится в клеточном ядре и имеет молекулярную массу порядка 1011 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, тимин, углевод дезоксирибоза и остатки фосфорной кислоты. Содержание азотистых оснований в молекуле ДНК определяют правила Чаргаффа: 1) количество пуриновых оснований равно количеству пиримидиновых (А + Г = Ц + Т) ; 2) количество аденина и цитозина равно количеству тимина и гуанина соответственно (А = Т; Ц = Г) ; 3) ДНК, выделенные из клеток различных биологических видов, отличаются друг от друга величиной коэффициента специфичности: (Г + Ц) /(А + Т) Эти закономерности в строении ДНК объясняются следующими особенностями её вторичной структуры: 1) молекула ДНК построена из двух полинуклеотидных цепей, связанных между собой водородными связями и ориентированных антипараллельно (то есть 3'-конец одной цепи расположен напротив 5'-конца другой цепи и наоборот); 2) водородные связи образуются между комплементарными парами азотистых оснований. Аденину комплементарен тимин; эта пара стабилизируется двумя водородными связями. Гуанину комплементарен цитозин; эта пара стабилизируется тремя водородными связями (см. рисунок б) . Чем больше в молекуле ДНК пар Г-Ц, тем больше её устойчивость к действию высоких температур и ионизирующего излучения;
Рисунок 3.3. Водородные связи между комплементарными азотистыми основаниями. 3) обе цепи ДНК закручены в спираль, имеющую общую ось. Азотистые основания обращены внутрь спирали; кроме водородных, между ними возникают также гидрофобные взаимодействия. Рибозофосфатные части расположены по периферии, образуя остов спирали (см. рисунок 3.4).
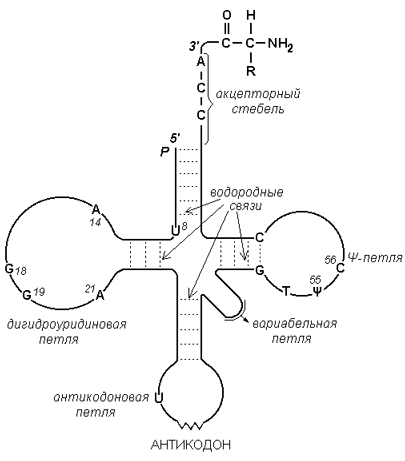
Рисунок 3.4. Схема строения ДНК. 3.4.5. РНК (рибонуклеиновая кислота) содержится преимущественно в цитоплазме клетки и имеет молекулярную массу в пределах 104 - 106 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, урацил, углевод рибоза и остатки фосфорной кислоты. В отличие от ДНК, молекулы РНК построены из одной полинуклеотидной цепи, в которой могут находиться комплементарные друг другу участки (рисунок 3.5). Эти участки могут взаимодействовать между собой, образуя двойные спирали, чередующиеся с неспирализованными участками.
Рисунок 3.5. Схема строения транспортной РНК. По особенностям структуры и функции различают три основных типа РНК: 1) матричные (информационные) РНК (мРНК) передают информацию о структуре белка из клеточного ядра на рибосомы; 2) транспортные РНК (тРНК) осуществляют транспорт аминокислот к месту синтеза белка; 3) рибосомальные РНК (рРНК) входят в состав рибосом, участвуют в синтезе белка. |
|
|
© С.М.Ершиков, 2009. Все права защищены |
|
|
Раздел 3.5 |
Примеры обучающих задач и методы их решения |
|
|
|
|
3.5.1. Задачи. 1. В гидролизате сложного белка обнаружена фосфорная кислота. Можно ли с достаточной уверенностью сказать, к какому классу относится изучаемый белок? 2. Сравните растворимость простетической группы гемоглобина в воде и органических растворителях. 3. У альпиниста через 2 дня после подъёма на высоту 4000 м над уровнем моря содержание 2,3-дифосфоглицерата в эритроцитах составляет 6,5 ммоль/л (в норме - 4,5 ммоль/л) . Как это отразится на сродстве гемоглобина к кислороду? Какое значение для организма имеет такое изменение? 4. В молекуле ДНК адениловый нуклеотид составляет 35% от общего содержания нуклеотидов. Рассчитайте (в %) количество каждого из остальных нуклеотидов. 5. В препаратах ДНК, выделенных из двух видов микроорганизмов, содержание тимина составляет соответственно 29 и 16% от общего содержания оснований. Рассчитайте процентное содержание аденина, гуанина и цитозина в этих препаратах ДНК. Какая из ДНК будет более устойчивой к действию высоких температур? 3.5.2. Эталоны решения. 1. Как видно из таблицы 3.1, фосфорная кислота является простетической группой белков класса фосфопротеинов. Известно также, что фосфат входит в состав нуклеиновых кислот, которые могут выступать в качестве простетической группы нуклеопротеинов. Поэтому фосфорная кислота может быть обнаружена в гидролизате как фосфопротеина, так и нуклеопротеина. Для уточнения класса гидролизованного белка нужно провести с гидролизатом качественные реакции на азотистые основания и пентозы (см. 3.1.). 2. Растворимость вещества в воде или органических растворителях зависит от того, какие функциональные группы преобладают в молекуле. Простетическая группа гемоглобина - гем - содержит только две полярные группировки (две карбоксильные группы), остальная часть молекулы неполярна (равномерное распределение электронной плотности). Поэтому гем хорошо растворяется в органических растворителях и не растворяется в воде (см. 3.2.). 3. 2, 3-Дифосфоглицерат (ДФГ) является аллостерическим регулятором, понижающим сродство гемоглобина к кислороду. Поэтому при увеличении содержания ДФГ в эритроцитах равновесие в уравнении диссоциации HbO2 смещается вправо. Увеличение отдачи кислорода оксигемоглобином имеет компенсаторное значение для организма, так как восполняет недостаточное поступление кислорода из атмосферы (см. 3.2.). 4. Согласно правилам Чаргаффа, количество аденина в ДНК равно количеству тимина. Поэтому содержание тимидилового нуклеотида также составляет 35%. На долю остальных нуклеотидов приходится 100% - (35 x 2)% = 30%. Количество гуанина в ДНК равняется количеству цитозина, поэтому содержание каждого из них - 30% : 2 = 15%. Итак, А = 35%, Г = 15%, Ц = 15%, Т = 35% (см. 3.4.). 5. Согласно правилам Чаргаффа, содержание оснований в первом препарате ДНК составляет: А = 29%, Г = 21%, Ц = 21%; во втором препарате - А = 16%, Г = 34%, Ц = 34%, очевидно, что содержание пар Г - Ц во втором препарате значительно выше. Поэтому данная молекула ДНК более устойчива к действию температуры (см. 3.4.). |
|
|
© С.М.Ершиков, 2009. Все права защищены |
|