
411-obschaya-himiya-6mb
.pdfЭнтальпией растворения называют изменение энтальпии при растворении 1 моль вещества в избытке растворителя. Энтальпия растворения бромида меди (II) в воде составляет −34,5 кДж/моль. Схема процесса растворения:
CuBr2 (к) |
→ |
CuBr2 (р-р), |
H° = −34,5 кДж. |
1 моль |
|
1 моль |
|
Рассмотрим примеры задач, иллюстрирующих вычисление эн- тальпии в зависимости от количества вещества.
Пример 2.1
Термохимическое уравнение процесса получения азотной кислоты:
4NO2(г) + O2(г) + 2H2O(ж) = 4HNO3(ж), H° = −256 кДж.
Рассчитайте изменение энтальпии процесса, если объем (при н.у.) прореагировавшего диоксида азота составил 11,2 л.
Решение. Подпишем под формулами реагентов значения количе- ства вещества:
4NO2(г) |
+ O2(г) |
+ 2H2O(ж) = |
4HNO3(ж), H° = −256 кДж. |
||
4 моль |
1 моль |
|
2 моль |
4 моль |
|
Рассчитаем количество вещества NO2 в 11,2 л при н.у.: |
|||||
|
|
11,2 |
моль |
|
|
|
nNO2 |
= |
|
|
= 0,5 моль. |
|
22,4 л |
моль−1 |
|||
Составим пропорцию и вычислим изменение энтальпии, если в реак- цию вступает 0,5 моль NO2:
4 моль NO2 |
–––––––– |
−256 кДж |
0,5 моль NO2 |
–––––––– |
x |
Находим, что x = −32 кДж. Это и есть искомая величина изменения энтальпии.
Пример 2.2
При растворении бромида меди (II) в воде выделилось 13,8 кДж теплоты. Найдите массу растворившейся соли, если энтальпия рас- творения составляет –34,5 кДж/моль.
Решение. Составим пропорцию учитывая, что изменение энталь- пии при растворении соли составило –13,8 кДж:
1 моль CuBr2 |
–––––––– |
−34,5 кДж |
x моль CuBr2 |
–––––––– |
−13,8 кДж |
31
Получаем, что x = nCuBr2 = 0,4 моль.
Находим массу CuBr2: m = n·M = 0,4 · 224 = 89,6 г.
Пример 2.3
При реакции хлорида железа (II) с хлором было получено 6 моль хлорида железа (III), что сопровождалось выделением 330 кДж теп- лоты. Вычислите энтальпию реакции (кДж/моль Cl2).
Решение. Составим уравнение реакции, указав агрегатные состоя- ния веществ, и подписав ниже значения количества вещества, равные коэффициентам перед формулами реагентов:
2FeCl2(к) |
+ |
Cl2(г) |
= |
2FeCl3(к). |
2 моль |
|
1 моль |
|
2 моль |
Переход к термохимическому уравнению состоит в вычислении энтальпии реакции, если в ней образуется 2 моль FeCl3. Составим пропорцию:
6 моль FeCl3 |
–––––––– |
−330 кДж |
2 моль FeCl3 |
–––––––– |
x кДж |
Находим, что x = −110 кДж. Термохимическое уравнение приобретает вид
2FeCl2(к) + Cl2(г) = 2FeCl3(к), H° = −110 кДж.
Данное уравнение включает 1 моль хлора, и, следовательно, эн- тальпия реакции равна −110 кДж/моль Cl2.
Энтальпия прямого и обратного процессов
При решении некоторых задач полезно использовать правило:
энтальпия обратного процесса равна по величине и противоположна по знаку энтальпии прямого процесса.
Например, по энтальпии реакции получения азотной кислоты (см. пример 2.1), можно определить энтальпию реакции ее разложения:
4HNO3(ж) = 4NO2(г) + O2(г) + 2H2O(ж) , H° = 256 кДж.
Зная энтальпию процесса испарения ртути (см.выше), можно най- ти энтальпию обратного процесса − конденсации паров ртути:
Hg(г) → Hg(ж), H° = − 59,3 кДж.
Использование этого правила дано в примере 2.4 и в задаче 4 про- граммированного контроля (п. 2.3).
32
Понятие стандартной энтальпии образования вещества
Абсолютное значение энтальпии, как и внутренней энергии системы, определить нельзя. Можно измерять только изменение энтальпии в ре- зультате химической реакции или физического процесса, т.е. измерять тепловой эффект. Соответственно, мы не можем знать абсолютное зна- чение энтальпии данного количества какого-либо вещества. Тем не ме- нее удобно приписать одному молю каждого вещества некое значение энтальпии и использовать эти значения в расчете энтальпии процессов. Поэтому и ввели понятие стандартной энтальпии образования вещества.
Стандартная энтальпия образования вещества – это энтальпия реакции получения одного моля данного вещества из простых веществ (реакция осуществляется при стандартных условиях, а простые веще- ства взяты в их наиболее устойчивых при стандартных условиях со- стояниях). Стандартная энтальпия образования обозначается fH° (formation – образование). Принято также обозначение H°обр.
Наиболее устойчивым состоянием ртути при стандартных усло- виях является жидкая ртуть. А чему будет равен тепловой эффект процесса получения одного моля жидкой ртути из одного моля жид- кой ртути? Ясно, что ничему, т.е. нулю: fH°(Hg(ж)) = 0. Следова- тельно, энтальпия образования простых веществ в их наиболее ус- тойчивых, стандартных состояниях равна нулю. Энтальпия образо- вания газообразной ртути равна энтальпии получения одного моля газообразной ртути из жидкой ртути, иначе говоря, энтальпии испа- рения ртути. В соответствии с приведенными выше данными
fH°(Hg(г)) = 59,3 кДж/моль.
В примере 2.3 приводилось термохимическое уравнение получения хлорида железа (III) из хлорида железа (II) и хлора, а в примере 2.1 – термохимическое уравнение получения азотной кислоты из диоксида азота, кислорода и воды. Энтальпия указанных реакций, даже если ее
привести к одному молю продукта, не соответствует определению энтальпии образования, поскольку все исходные вещества должны быть простыми.
Значения стандартной энтальпии образования хлорида железа (III) и азотной кислоты соответствуют следующим реакциям:
|
Fe(к) + |
3 |
Cl2(г) = FeCl3(к), H° = −397 кДж; |
||||
|
|
||||||
|
|
|
2 |
|
|
|
|
1 |
H2(г) + |
3 |
O2(г) + |
1 |
N2(г) = HNO3(ж), H° = −174 кДж. |
||
2 |
|
|
|||||
2 |
|
|
2 |
|
|||
33
Следовательно, энтальпии образования:
fH°(FeCl3(к)) = −397 кДж/моль; fH°(HNO3(ж)) = −174 кДж/моль.
Значения стандартной энтальпии образования химических ве- ществ приводятся в справочниках [12, 13, 15]; величины fH° для некоторых веществ можно найти в приложении 4.
При решении задач кроме четкого знания, что такое энтальпия образования, необходимо умение пересчитывать энтальпию процесса на данное число молей вещества. В некоторых задачах нужно также использовать соотношение между энтальпией прямого и обратного процессов.
Пример 2.4
При термическом разложении оксида серебра образовалось 4 моль серебра, 1 моль кислорода и поглотилось 62 кДж тепла. Найдите стандартную энтальпию образования оксида серебра.
Решение. На 4 моль атомов серебра в оксиде приходится 2 моль атомов кислорода (образуется 1 моль молекул O2). Число атомов се- ребра в оксиде в два раза больше, чем число атомов кислорода, т.е. формула оксида Ag2O.
Напишем уравнение реакции:
2Ag2O(к) = 4Ag(к) + O2(г).
Теперь можно составить термохимическое уравнение, просто допи- сав изменение энтальпии, равное 62 кДж, так как оно соответствует образованию в ходе реакции 4 моль серебра, 1 моль кислорода, что совпадает с коэффициентами уравнения:
2Ag2O(к) = 4Ag(к) + O2(г), H° = 62 кДж.
Для обратной реакции термохимическое уравнение имеет сле- дующий вид:
4Ag(к) + O2(г) = 2Ag2O(к), H° = −62 кДж.
Энтальпия образования оксида серебра – это энтальпия реакции получения 1 моль Ag2O из простых веществ. При получении 2 моль Ag2O изменение энтальпии равно −62 кДж, следовательно, измене- ние энтальпии при получении 1 моль равно −31 кДж. Энтальпия об- разования оксида серебра fH°(Ag2O(к)), = −31 кДж/моль. Это значе- ние соответствует уравнению
34
2Ag(к) + |
1 |
O2(г) = Ag2O(к), H° = −31 кДж. |
|
||
2 |
|
|
Отметим, что решение этой задачи имеет реальную практическую ценность, так как оксид серебра окислением серебра не получается, а может быть получен только косвенным путем. Данные об энтальпии разложения оксида серебра и являются источником определения эн- тальпии образования этого вещества.
Вычисление энтальпии образования рассмотрено также в задаче 2 программированного контроля (п. 2.3).
Вычисление энтальпии реакции по значениям энтальпии образования участников реакции (применение следствия закона Гесса)
Использование закона Гесса чаще всего сводится к применению следствия из этого закона, которое позволяет рассчитать энтальпию реакции по известным значениям энтальпии образования веществ.
Энтальпия реакции равна разности между значениями энтальпии образования продуктов реакции и энтальпии образования исходных веществ с учетом коэффициентов уравнения. Например, для реакции
aA + bB = cC + dD,
где a, b, c и d – коэффициенты перед формулами веществ A, B, C и D, стандартная энтальпия реакции рассчитывается как:
H ° = c f H °C + d f H °D − a f H °A − b f H °B .
Значения стандартной энтальпии образования веществ внесены в справочники. Справочные данные и следствие из закона Гесса по- зволяют составить термохимическое уравнение для любой химиче- ской реакции, проводимой в лаборатории или в промышленности. После этого нужно провести пересчет энтальпии для реально исполь- зуемых масс веществ (для промышленных процессов это тонны) и определить тепловой эффект конкретного процесса. Пример вычис- ления энтальпии реакции с последующим пересчетом на определен- ное число молей одного из веществ дан в задаче 3 программирован- ного контроля (п. 2.3).
Приведем пример задачи, в которой также используется данное следствие из закона Гесса.
Пример 2.5
Найдите стандартную энтальпию образования сульфида цинка, если при обжиге 679 г этого вещества выделилось 3073 кДж теплоты,
35

а стандартная энтальпия образования оксида цинка и сернистого газа соответственно равны –351 и –297 кДж/моль.
Решение. Составим уравнение реакции. Отметим, что вы можете составить уравнение реакции, внимательно прочитав задачу, даже ес- ли не знаете, что это за реакция – обжиг сульфида. Значения энталь- пии образования даны для ZnO и SO2; одним из исходных веществ является ZnS, поэтому нетрудно догадаться, что это реакция с кисло- родом. Составим уравнение реакции и подберем коэффициенты:
2ZnS + 3O2 = 2ZnO + 2SO2.
Для перехода к термохимическому уравнению нужно вписать значение энтальпии реакции, когда в ней участвует 2 моль ZnS.
Зная массу участвующего в реакции ZnS и его молярную массу, найдем количество вещества:
nZnS = m = 679 = 7 моль. M 97
Составим пропорцию:
7 моль ZnS |
–––––––– |
выделяется 3073 кДж; |
2 моль ZnS |
–––––––– |
» x. |
Определяем, что x = 878 кДж. Следовательно, изменение энтальпии в ходе реакции, в которой участвует 2 моль ZnS, равно −878 кДж.
Запишем термохимическое уравнение и под формулами веществ подпишем значения энтальпии образования. Стандартная энтальпия образования кислорода равна нулю, стандартную энтальпию образо- вания ZnS обозначим через x:
fH°, кДж/моль |
2ZnS (к) + |
3O2 (г) = |
2ZnO (к) + |
2SO2(г), |
H° = −878 кДж |
x |
0 |
−351 |
−297 |
|
Составим уравнение в соответствии со следствием закона Гесса:
−878 = 2(−351) + 2(−297) − 2x.
Решив уравнение, находим, x = −209, или fH°(ZnS) = −209 кДж/моль.
Составление схемы по закону Гесса (непосредственное применение закона Гесса)
Существует ряд задач, в которых удобно непосредственно ис- пользовать закон Гесса, составив схему, включающую начальное, конечное и промежуточное состояния системы. Сюда прежде всего
36
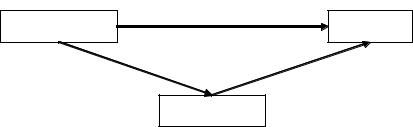
относятся задачи, в которых рассматривается энтальпия растворения безводных солей и различных кристаллогидратов в воде.
Пример 2.6
Энтальпия растворения моногидрата сульфата цинка ZnSO4·H2O и гептагидрата сульфата цинка ZnSO4·7H2O в воде соответственно рав- на −41,6 и 17,8 кДж/моль. Найдите энтальпию гидратации моногид- рата до гептагидрата.
Решение. Кристаллогидраты солей – твердые при стандартных ус- ловиях вещества, в состав которых входит вода. В качестве исходно- го состояния выберем ZnSO4·H2O, а в качестве конечного – водный раствор ZnSO4, в качестве промежуточного состояния − ZnSO4·7H2O. Ясно, что при большом количестве воды свойства раствора не зави- сят от того, получается ли он растворением в воде ZnSO4·H2O или
ZnSO4·7H2O.
Переходы от исходного состояния к конечному иллюстрирует следующая схема:
|
|
° |
|
|
ZnSO4 H2O |
|
H1°1 |
|
ZnSO4(р-р) |
|
|
|
||
H° |
H ° |
|
||
H3 |
° |
3 |
||
2 |
2 |
|
|
|
ZnSO4 7H2O
Прямой переход их исходного состояния в конечное − это растворе- ние моногидрата в воде, характеризующееся энтальпией растворения
H1° = −41,6 кДж. Другой путь перехода состоит в первоначальной гид-
ратации моногидрата до гептагидрата, т.е. в присоединении к каждой молекуле ZnSO4·H2O шести молекул воды и последующем растворении
ZnSO4·7H2O. Энтальпия последнего процесса |
H ° равна 17,8 кДж, эн- |
||||
|
|
|
|
|
3 |
тальпию процесса гидратации |
H ° требуется определить. |
||||
|
|
|
2 |
|
|
По закону Гесса: |
H ° = |
H ° + |
H ° . |
|
|
|
1 |
|
2 |
3 |
|
Отсюда: H ° = |
H ° − |
H ° = −41,6 − 17,8 = −59, 4 кДж. |
|||
2 |
1 |
|
3 |
|
|
Энтальпия гидратации –59,4 кДж/моль.
Приведем еще одну задачу, которая может быть решена анало- гичным образом.
37
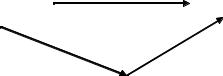
Пример 2.7
При образовании 1 моль BCl3(ж) из кристаллического бора и газо- образного хлора выделяется 426,4 кДж теплоты. Рассчитайте энталь- пию образования BCl3(г), если энтальпия испарения этого вещества составляет 25,1 кДж/моль.
Решение. Составим схему:
|
1 |
|
B(к); |
|
|
|
|
H1°1 |
|
|
|
|
|
|
|
|
|
|
моль |
|
|
|
|
° |
|
|
|
|
|
BCl3(г) |
|
||
|
3/2 моль Cl2(г) |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H ° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
H ° |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H °3 3 |
|
|
|
||||||
|
|
|
|
|
H2°2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BCl3(ж) |
|
|
|
|
|
|
||||
На схеме: |
H ° |
– энтальпия образования BCl3(г), |
H ° – энтальпия |
|||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
образования |
BCl3(ж), H 3° |
– энтальпия |
испарения |
BCl3(ж). Можно |
||||||||||||
сначала из простых веществ получить BCl3(ж), а потом его перевести в газообразное состояние – мы получим BCl3(г), а можно сразу полу- чить BCl3(г) из простых веществ.
По закону Гесса: H ° = |
H ° + |
H ° = –426,4 + 25,1 = –401,3 кДж. |
1 |
2 |
3 |
Энтальпия образования BCl3(г) равна −401,3 кДж/моль.
Сложение термохимических уравнений (применение следствия закона Гесса)
По следствию из закона Гесса термохимические уравнения можно складывать, умножив на некоторое число. Таким образом, комбини- руя несколько известных термохимических уравнений, можно полу- чить новое уравнение.
Приведем пример решения задачи методом суммирования термо- химических уравнений.
Пример 2.8
Найдите энтальпию реакции MnO(к) с кислородом (кДж/моль O2), идущей с образованием MnO2(к), если энтальпия реакций окисления MnO(к) до Mn2O3(к) и Mn2O3(к) до MnO2(к) соответственно равна −376 и −164 кДж/моль O2.
Решение. Запишем термохимические уравнения процессов с из- вестными значениями энтальпии и проведем их суммирование:
38
4MnO(к) + O2(г) = 2Mn2O3(к), |
H1° = − 376 кДж |
+ |
|
2Mn2O3(к) + O2(г) = 4MnO2(к), |
H° = −164 кДж |
2
__________________________________
4MnO(к) + 2O2(г) + 2Mn2O3(к), = 2Mn2O3(к), + 4MnO2(к), H ° =
3
= (−376 − 164) кДж .
Сократив в левой и правой частях уравнения 2Mn2O3(к) и умножив полученное уравнение на 1/2, приходим к искомому термохимиче- скому уравнению
2MnO(к) + O2(г) = 2MnO2(к), H ° = −270 кДж |
|
3 |
. |
|
(Это уравнение соответствует участию в реакции 1 моль O2.) Отметим, что эту задачу можно было бы решить методом состав-
ления схемы по закону Гесса, а задачи в примерах 2.6 и 2.7 – сумми- рованием уравнений.
Расчет изменения температуры
Как известно из курса физики, изменение температуры вещества, которому сообщена теплота, прямо пропорционально количеству теплоты и обратно пропорционально произведению массы вещества на его теплоемкость.
Теплота, выделяющаяся в реакциях, проходящих в водных рас- творах, идет на нагревание самого раствора. В этом случае теплота, сообщенная раствору, равна энтальпии экзотермической реакции, и согласно термодинамической системе знаков H < 0, в то время как температура раствора повышается и T > 0. Если реакция эндотер- мическая, то раствор отдает теплоту, и температура раствора пони- жается, т.е. H > 0 и T < 0. То же относится и к процессу растворе- ния вещества в воде. Следовательно, изменение температуры раство- ра можно вычислить с помощью формулы
T = − H ,
Cm
где m – масса раствора, С – удельная теплоемкость, которая обычно принимается равной удельной теплоемкости воды.
Пример использования данной формулы дан в задаче 5 програм- мированного контроля (п. 2.3).
39
2.2. Пояснения к лабораторной работе «Определение энтальпии реакции»
В лабораторной работе вы знакомитесь с методом эксперименталь- ного определения энтальпии, или теплоты реакции. Саму теплоту мы непосредственно не измеряем, а измеряем ее «интенсивность» – тем- пературу. Все методы измерения тепловых эффектов основаны на том, что выделяющаяся в процессе теплота идет на нагревание вещества определенной массы и с известной теплоемкостью. Часто таким ве- ществом является вода. Естественно, надо создать условия, препят- ствующие потерям тепла, поэтому измерения проводят в специаль- ных приборах – калориметрах. Например, энтальпию сгорания эти- лового спирта можно измерить, если с помощью спиртовки нагре- вать стакан с водой известной массы и измерять повышение темпе- ратуры. Энтальпию вычисляют с помощью приведенной выше фор- мулы
H = −Сm T.
В лабораторной работе измеряется теплота процессов, проходя- щих в водном растворе, – реакции нейтрализации кислоты едким на- тром, реакции магния с разбавленной серной кислотой, процесса рас- творения сульфата магния. Как уже отмечалось, теплота, выделяю- щаяся в этих процессах, идет на нагревание самого раствора, в кото- ром этот процесс и осуществляется. Тогда в формуле расчета m – масса раствора. Затем, для того чтобы привести тепловой эффект к одному молю реагента, теплоту делят на число молей реагента.
Таким образом, в этой лабораторной работе вы на практике зна- комитесь с методом определения энтальпии. Немаловажно, что T определяется не просто как разность двух чисел, а по графику зави- симости температуры от времени, т.е. вы знакомитесь с графически- ми методами обработки данных. Кроме того, выполнение работы требует измерения объема растворов с помощью мерной посуды, взвешивания, проведения точных измерений температуры во време- ни при непрерывном перемешивании раствора в калориметре.
2.3. Вариант программированного контроля по теме «Термохимия»
1. Какое из перечисленных веществ не находится в стандартном термодинамическом состоянии: Ar(г), Au(к), C(алмаз), I2(к) S(ромб). В ответе укажите порядковый номер элемента в Периодической системе.
40
