
411-obschaya-himiya-6mb
.pdf
Применение уравнения Клапейрона позволяет использовать рас- смотренную выше схему решения задач для случаев, когда объем газа измерен при условиях, отличных от нормальных.
Пример 1.3
Найдите массу гелия, занимающего при 730 мм рт.ст. и 27 °C объ- ем 35 л.
Решение. Вычислим, какой объем займет гелий при нормальных условиях. В данном случае объем можно оставить в литрах, а давле- ние − в миллиметрах ртутного столба. Термодинамическая температура T = 27 + 273 = 300 К. Оценивая конечный результат, можно предполо- жить, что объем при нормальных условиях получится немного меньше, поскольку нормальным условиям соответствует меньшая температура и большее давление.
V |
= |
PVT0 |
= |
730 мм рт.ст. 35 л 273 К |
= 30,6 л. |
|
|
||||
0 |
|
TP0 |
|
300 К 760 мм рт.ст. |
|
|
|
|
|||
Зная объем при нормальных условиях, с помощью рассмотренной выше схемы найдем количество вещества и массу гелия:
nHe = 30,6 =1,37 моль ; mHe = 1,37 4 = 5,48 г.
22,4
Преимущество такого пошагового решения задачи состоит в воз- можности контролировать результат на каждом этапе.
Использование уравнения Клапейрона – Менделеева
Уравнение Клапейрона – Менделеева является наиболее общим соотношением, из которого несложно вывести все остальные газовые законы. Однако часто при решении задач легче использовать не рас- чет по этому уравнению, а другие способы решения, так как это сни- жает вероятность ошибок, связанных с переводом размерностей.
При расчете по уравнению Клапейрона – Менделеева
PV = m RT
M
нужно иметь в виду, что при использовании универсальной газовой постоянной R, равной 8,31 Дж/(моль·К), давление должно быть вы- ражено в паскалях, объем – в метрах кубических. Молярная масса обычно выражается в граммах на моль, и тогда масса будет выраже- на в граммах.
11
Проведем расчет по уравнению Клапейрона – Менделеева для решения такой же задачи, как и в примере 1.3.
Пример 1.4
Найдите массу гелия, занимающего при 730 мм рт.ст. и 27 °C объ- ем 35 л.
Решение. Переведем объем в метры кубические (1 м3 = 1000 л): V = 35·10−3 м3. Для того чтобы выразить давление в паскалях, составим пропорцию, опираясь на значения нормального давления.
760 мм рт.ст. |
|
–––––––– |
1,01·105 Па; |
||||
730 мм рт.ст. |
|
–––––––– |
x |
||||
Находим, что P = 0,97·105 Па. |
|
|
|||||
Рассчитаем массу гелия: |
|
|
|||||
|
|
PVM |
|
0,97 105 Па 35 10−3 м3 4 г моль-1 |
|||
m |
= |
|
|
= |
|
|
= 5,45 г. |
RT |
|
|
|||||
He |
|
8,31 Дж моль-1 К-1 300 К |
|||||
Расхождение в значениях массы гелия, вычисленной в примерах 1.4 и 1.3, составляет менее 1 % и связано с округлением чисел.
Относительная плотность газа
Относительной плотностью одного газа по другому газу называют отношение массы одного газа к массе другого при условии, что они занимают равные объемы при одних и тех же температуре и давлении. Определение относительной плотности иллюстрируется формулой
D = m1 . m2
В знаменателе – масса того газа, относительно которого опреде- ляется плотность.
Применение закона Авогадро, согласно которому и первый, и второй газ в данных условиях содержат одинаковое число молекул, приводит к важному соотношению:
D = Mr1 .
Mr2
Следовательно, относительную плотность можно вычислить на осно- ве молекулярных масс. Чаще всего относительная плотность рассчитыва- ется либо по наиболее легкому газу – водороду ( Mr (H2 ) ≈ 2 ), либо по
воздуху [средняя молекулярная масса воздуха M r (возд) = 29 ].
12

Одновременно это соотношение служит для определения молеку- лярной массы газа, если измерена относительная плотность его по газу с известной молекулярной массой. Данный способ пригоден не только для газообразных веществ при нормальных условиях, но и для жидких и твердых веществ, переходящих в газообразное состоя- ние при повышенной температуре.
Рассмотрим пример решения задачи, в которой требуется не толь- ко вычислить молекулярную массу простого вещества, но и опреде- лить число атомов в его молекуле.
Пример 1.5
Определите число атомов в молекуле парообразного фосфора, ес- ли относительная плотность паров фосфора по воздуху 4,28.
Решение. Запишем формулу простого вещества – фосфора Px (x – это число атомов в молекуле фосфора). Используя соотношение для относительной плотности газа, найдем относительную молекуляр- ную массу паров фосфора:
|
= |
|
Mr |
(Px ) |
||
Dвозд |
|
|
|
|
; |
|
|
|
|
|
|||
|
|
|
||||
|
|
Mr (возд) |
||||
Mr (Px ) = Dвозд Mr (возд) = 4,28 29 ≈124 .
Учитывая, что при расчете молекулярной массы относительная атомная масса фосфора умножается на число атомов в молекуле [Mr (Px ) = xAr (P)], вычислим x:
x = Mr (Px ) = 124 = 4 . Ar (P) 31
Мы нашли, что молекула фосфора состоит из четырех атомов, что соответствует формуле P4.
Определение массовых долей элементов по формуле вещества
Массовая доля элемента в соединении – это отношение массы данного элемента к массе всего вещества.
Пример 1.6
Рассчитайте массовую долю фтора во фториде кальция. Решение. Относительная молекулярная масса CaF2
13

Mr (CaF2 ) = Ar (Ca) + 2 Ar (F) = 40 + 2 19 = 78.
В одной молекуле (формульной единице) фторида кальция два атома фтора, на них приходится масса, равная 38. Таким образом, массовая доля фтора
wF = 38: 78 = 0,487 .
Массовая доля фтора, выраженная в процентах, составляет 48,7 %. Отметим, что массовая доля фтора меньше 50 %, хотя на фтор
приходится 2/3 от общего числа атомов в CaF2.
Определение формулы вещества по массовым долям элементов
Массовые доли элементов в соединении можно найти экспери- ментально и по этим данным определить формулу вещества.
Пример 1.7
Определите формулу оксида марганца, содержащего 69,6 % марганца. Решение. Эту задачу удобно решать следующим образом. Возь- мем 100 г данного оксида, формулу которого обозначим как MnxOy. Тогда в нем будет содержаться 69,6 г марганца и 30,4 г кислорода. Рассчитаем количество вещества марганца и кислорода в 100 г окси-
да и найдем отношение x к y:
x : y = nMn : nO = 69,6 : 30,4 =1,27 :1,9 . 55 16
Из полученного отношения нужно получить целочисленные зна- чения x и y. Отметим, что на данном этапе нецелесообразно прово- дить грубое округление чисел, так как это может привести к получе- нию неверной формулы (неправильным будет, например, написать,
что x : y = 1,27 :1,9 ≈ 1: 2) .
Поделим каждое из чисел 1,27 и 1,9 на меньшее из них, т.е. на
1,27. Тогда
x : y = |
1, |
27 |
: |
1,9 |
=1:1,5 . |
|
27 |
|
|||
1, |
1,27 |
|
|||
Поскольку в этой задаче на данном этапе мы не получили отно- шение целых чисел, увеличим каждое из чисел в два раза:
x : y = (2 1) : (2 1,5) = 2 : 3.
Искомая формула оксида марганца – Mn2O3.
14
Расчет по уравнению реакции
Расчет по уравнению реакции заключается в определении количе- ственных величин для одного из участников реакции – исходного вещества или продукта – по известным данным для какого-либо дру- гого участника этой реакции. Такой расчет основан на том, что ко- эффициенты в уравнении реакции показывают соотношение между количеством вещества реагентов. Рассмотрим пример.
Пример 1.8
Определите объем (н.у.) углекислого газа, полученного при сжи- гании 3,08 кг пропана.
Решение. В условии дана масса пропана, вступившего в реакцию. Приведем другие варианты формулировки этой же задачи:
–при взаимодействии 3,08 кг пропана с эквивалентным количест- вом кислорода (имеется в виду, что кислорода взято ровно столько, сколько нужно для реакции, т.е. весь пропан прореагировал);
–при взаимодействии 3,08 кг пропана с избытком кислорода (опять же, весь пропан прореагировал, а кислорода взято даже боль- ше, чем нужно).
Составим уравнение реакции и под формулой каждого из участ- ников реакции подпишем число молей в соответствии с коэффициен- тами уравнения:
C3H8 |
+ |
5O2 |
= 3CO2 |
+ 4H2O. |
1 моль |
|
5 моль |
3 моль |
4 моль |
По уравнению реакции одна молекула пропана реагирует с пятью молекулами кислорода, образуются три молекулы углекислого газа и четыре молекулы воды. Следовательно, когда один моль молекул C3H8 реагирует, образуется три моля молекул CO2.
Зная массу прореагировавшего пропана и его молярную массу, найдем количество вещества пропана:
n(C3H8 ) = |
|
3080 г |
= 70 моль. |
||
44 г моль−1 |
|||||
|
|
|
|||
Составив пропорцию, определим n(CO2): |
|
||||
1 моль C3H8 |
–––––––– |
3 моль CO2 |
|||
70 моль C3H8 |
–––––––– |
x моль CO2 |
|||
Количество вещества CO2 составляет 210 моль.
15
И, наконец, определим, какой объем при нормальных условиях занимают 210 моль углекислого газа:
V0 = 210 моль 22,4 л моль−1 = 4704 л ≈ 4,7 м3 .
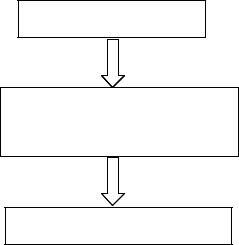
В общем виде решение задачи, когда для некоторой реакции тре- буется определить информацию для реагента В, если дана информа- ция для реагента А, описывается приведенной ниже схемой:
По информации, данной для реагента A, находим nA
Составляем пропорцию, используя коэффициенты перед формулами веществ A и B в уравнении реакции, и по известному nA,вычисляем nB
Зная nB, определяем необходимую информацию для реагента B
Приведенная схема отражает центральный, ключевой момент всех расчетов по уравнению реакции, однако часто решение задач требует проведения дополнительных вычислений.
Расчет по уравнению реакции, если дана информация для двух исходных веществ
Рассмотрим важный тип задач, решение которых включает до- полнительные действия, помимо представленных в ключевой схеме.
Мы видели, что для вычисления числа молей любого из участни- ков реакции достаточно знать число молей какого-либо одного ее участника. Если в задаче дана информация для одного из исходных веществ, то считается, что оно прореагировало полностью.
Если в задаче дана количественная информация не для одного, а для двух исходных веществ, то следует проверить, взяты ли они в эквивалентных количествах, или одно из них взято в избытке. Тогда
16

последующий расчет надо проводить по тому веществу, которое прореагирует полностью. Рассмотрим два примера.
Пример 1.9
Прогрели смесь, состоящую из 10 г железных опилок и 10 г серы. Определите массу полученного сульфида железа (II). Каков состав смеси после реакции?
Решение. Составим уравнение реакции:
Fe |
+ |
S |
= |
FeS |
1 моль |
|
1 моль |
|
1 моль |
Железо и сера имеют одинаковую массу; посмотрим, как соотно- сятся количества вещества.
nFe = |
10 г |
= 0,18 моль; |
|
56 г моль−1 |
|||
|
|
10 г
S32 г моль−1 0,31 моль.
Всоответствии с уравнением реакции на 1 моль железа приходит- ся 1 моль серы, значит, на взаимодействие 0,18 моль железа требует- ся 0,18 моль серы. В нашем распоряжении 0,31 моль серы, следова- тельно, все железо прореагирует, а сера взята в избытке.
Только теперь, определив, какое из веществ прореагирует полно- стью, можно проводить расчет по ключевой схеме. Если 0,18 моль
железа прореагирует, то образуется 0,18 моль сульфида. Учитывая, что молярная масса FeS равна 88 г/моль, вычислим массу FeS:= =
mFeS = 0,18 моль 88 г моль−1 =15,8 г.
Учитывая, что общая масса смеси после прохождения реакции не изменилась и также равна 20 г, получим, что смесь содержала 15,8 г FeS и 4,2 г непрореагировавшей серы.
Пример 1.10
Определите массу осадка, который образуется при сливании 200 мл раствора сульфата алюминия с концентрацией 0,5 моль/л и 200 мл раствора хлорида бария с концентрацией 1 моль/л.
Решение. Составим уравнение реакции обмена. Используя таблицу растворимости, определяем, что образуется осадок сульфата бария:
Al2(SO4)3 + |
3BaCl2 = 3BaSO4↓ |
+ 2AlCl3. |
|
1 моль |
3 моль |
3 моль |
2 моль |
17
Оба исходных вещества растворены в воде, и количественная ин- формация для них представлена в виде данных по растворам. Рассчи- таем число молей исходных веществ, учитывая, что молярная концен- трация показывает количество вещества в 1 л, или в 1000 мл раствора. Составим пропорцию и найдем количество вещества Al2(SO4)3:
в 1000 мл раствора |
содержится |
0,5 моль Al2(SO4)3; |
в 200 мл раствора |
» |
x моль Al2(SO4)3. |
Получаем, n(Al2 (SO4 )3 ) = x = 0,1 моль. Аналогично находим, что n(BaCl2 ) = 0,2 моль.
По уравнению реакции на проведение реакции с 1 моль Al2(SO4)3 требуется 3 моль BaCl2, следовательно, на проведение реакции с 0,1 моль Al2(SO4)3 требуется 0,3 моль BaCl2. Так как в наличии толь- ко 0,2 моль BaCl2, то не весь сульфат алюминия прореагирует, он взят в избытке.
Из уравнения реакции видно, что количества вещества BaSO4 и BaCl2 одинаковы. Вычислим массу BaSO4:
mBaSO4 = 0,2 моль 233 г моль−1 = 46,6 г.
Данный пример интересен тем, что он демонстрирует роль разли- чий в коэффициентах уравнения: в избытке оказался тот из двух реа- гентов, исходное число молей которого в два раза меньше.
Отметим, что приведенный в данном разделе метод определения ве- щества, взятого в избытке, и вещества, которое полностью реагирует, пригоден для случаев, когда взаимодействие между исходными вещест- вами описывается единственно возможным уравнением реакции.
Расчет по уравнению реакции, когда состав продуктов зависит от количественного соотношения исходных веществ
Примером таких реакций являются, в частности, реакции, в кото- рых могут образовываться кислые или основные соли.
Например, взаимодействие хлорида кобальта (II) с гидроксидом натрия может идти как с образованием гидроксида кобальта (II) (ре- акция полного обмена), так и с образованием основной соли − хло- рида гидроксокобальта (II):
CoCl2 |
+ 2NaOH = Co(OH)2↓ + |
2NaCl; |
(1.1) |
|
1 моль |
2 моль |
1 моль |
2 моль |
|
18
CoCl2 |
+ NaOH |
= CoOHCl↓ + |
NaCl. |
(1.2) |
1 моль |
1 моль |
1 моль |
1 моль |
|
Поэтому, если на 1 моль CoCl2 приходится не 2 моль NaOH, как это требуется по реакции (1.1), а только 1 моль, то в данном случае это не означает, что CoCl2 взят в избытке. Это означает, что исходные веще- ства взяты в эквивалентных количествах в соответствии с реакцией (1.2), т.е. они прореагируют полностью, и единственным кобальтсо- держащим продуктом взаимодействия будет основная соль.
Аналогичные рассуждения приводятся в задаче 5 программиро- ванного контроля (см. п. 1.4).
1.2. Закон эквивалентов
Основные определения
Использование понятия «эквивалент» облегчает проведение рас- четов в тех случаях, когда нет достаточной информации для состав- ления химической формулы или уравнения реакции или составление уравнения реакции требует значительного времени. Отметим, что это понятие возникло раньше, чем понятие «моль» и восходит к тому этапу развития химии, когда химические формулы веществ еще не были точно установлены. Понятие «эквивалент» в разное время трактовалось по-разному.
В настоящее время в соответствии с рекомендациями Междуна- родного союза теоретической и прикладной химии – ИЮПАК1 приня- ты следующие определения эквивалента и связанных с ним величин:
Эквивалент – это реальная или условная частица вещества, рав- ноценная одному иону водорода в обменных реакциях и одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности f показывает, какая доля молекулы или формульной единицы вещества равноценна одному иону водо- рода или одному электрону.
Эквивалентное число z показывает, сколько эквивалентов услов- но содержится в одной молекуле или формульной единице данного вещества(z = 1/f).
Количество вещества эквивалента nэкв измеряется в молях.
Один моль содержит 6,02·1023 эквивалентов вещества. Число молей
_________
1 Irving H.M.N.H. Recommendations on the usage of the terms «equivalent» and «normal» // IUPAC – Analytical chemistry division. – Oxford; N.Y.; P.; Frankfurt: Pergamon Press, 1978. Vol. 50, Р. 325–338.
19

эквивалента, содержащееся в некоторой массе вещества, в z раз больше числа молей данного вещества:
nэкв = nz.
Молярная масса эквивалента1 Mэкв – масса одного моля эквива-
лента; единица измерения – г/моль. Молярная масса эквивалента ве- щества в z раз меньше молярной массы данного вещества:
Mэкв = M .
z
Эквивалентный объем Vэкв – объем одного моля эквивалента га- зообразного вещества. Эквивалентный объем меньше молярного объема газа в z раз:
Vэкв = Vm .
z
Примеры определения эквивалента
вразличных реакциях
1.Эквивалент простого вещества в реакции. Атом элемента, со-
ставляющего простое вещество, приобретая или теряя несколько элек- тронов, меняет степень окисления от нуля до соответствующего значе- ния в образующемся сложном веществе. При этом каждому атому в ре- акции эквивалентно число электронов, равное его степени окисления.
Следовательно, эквивалентом простого вещества является 1/z часть атома элемента, составляющего простое вещество, где эквивалентное число z – взятое по абсолютной величине значение степени окисления.
В реакциях с участием водорода имеет место переход из степени окисления ноль либо в степень окисления +I, либо в −I, поэтому эк- вивалент водорода соответствует одному атому. Молярная масса эк- вивалента водорода
Mэкв (H2 ) = M (H) =1 г/моль. 1
Для кислорода чаще всего имеет место переход O0 + 2e O−II, поэто-
му эквивалент кислорода – это условная частица – 1/2 атома кислорода:
_________
1 Раннее эквивалент определялся не как частица вещества, а как число единиц массы вещества, соединяющегося с одной единицей массы водорода, либо с восемью единица- ми массы кислорода или замещающего эти количества в реакциях. Аналогом современ- ного понятия «молярная масса эквивалента» являлось понятие «грамм-эквивалент», а понятия «количество вещества эквивалента» – «число грамм-эквивалентов».
20
