Коллоидные системы.
Методы получения и очистки золей.
Электрокинетические явления.
Двойной электрический слой.
Строение мицеллы гидрофобного золя.
Оптические свойства коллоидов.
Устойчивость коллоидных систем.
Изменение состояния золей.
Механизм коагуляции электролитами.
Перезарядка золей.
Кинетика коагуляции.
Стабилизация золей.
Пептизация. Тиксотропия.
1. Методы получения.
вещество может быть получено в коллоидном состоянии при следующих условиях:
1. Приведение размеров частиц данного вещества r0 коллоидных размеров.
а) Дробление – дисперсные методы.
б) Укрепление – конденсационные методы.
2. Присутствие стабилизаторов (электролиты, образующие ионно-гидратную оболочку, препятствующую слипанию коллоидных частиц).
3) Коллоидные частицы должны обладать плохой растворимостью в дисперсной среде.
При соблюдении этих условий коллоидные частицы приобретают электрический заряд и гидратную оболочку, что препятствует выпадению их в осадок.
Дисперсные методы:
1) Механическое методы.
2) Ультразвуковой метод – дробления ультразвуком.
3)Химическое диспергирование – переход из геля в золь под действием пептизаторов.
Конденсационные методы:
1) Метод окисления (2НS+O22H2O+2S-золь).
2) Метод восстановления (2НАuCl4+3H2O22Au +8HCl+3O2).
3) Метод гидролиза (FeCl3 + 3H2O Fe(OH)3 + 3HCl; Fe(OH)3 + HCl FeOCl + 2H2O.
4) Замена растворителя- вещество хорошо растворимое в первом растворителе, выделяется в виде высокоподвижной фазы во втором.
5) Электрический метод - испарение металла с электрода в электрической дуге и переход их в раствор где они конденсируются r0 коллоидных размеров.
Методы очистки коллоидов.
Гидрофобные золи и растворы ВМС при их образовании почти всегда "загрязняются" различными примесями, чаще всего электролитами. Часто в системе присутствует исходный электролит. Для повышения устойчивости коллоидных растворов необходимо удалить из них эти примеси.
Основные методы очистки золей и ВМС:
Диализ – это процесс очистки коллоидов от примеси способных проникать через полупроницаемые мембраны (Частицы золя значительно крупнее, чем молекулы и ионы примесей, поэтому через поры не проходят) (рисунок 1).
|
|
|
Рис. 1диализатор |
2) Электродиализ – это ускоренный вариант Диализа, с применением электрического тока (Ускоренное направление движение ионов к соответствующим электродам) (рисунок 2).
|
|
|
Рис 2.электродиализатор |
3) Ультрафильтрация – фильтрование растворов, через полупроницаемые мембраны, укрепленные в специальных ультрафильтрах (срисунок 3).

Рис. 3. Устройство и внешний вид половолоконного ультрафильтрационного модуля.
4) Электроультрафильтрация – совмещение ультрафильтрации и электродиализа.
2. Электрокинетические явления в коллоидных системах и связанные с этими явлениями наличие электрических зарядов у коллоидов открыл Ф. Рейсс. Он провел следующий опыт
(Рис. 4):
|
|
В кусок влажной глины (1) были вставлены две стеклянные трубки (2 и 3). В цилиндры насыпали кварцевый песок (4) и налили в них до одинакового уровня воду. Опустив в воду электроды и подав на них электрический ток, через некоторое время под влиянием электрического поля частицы глины отрываясь от поверхности, будут проходить через песок и двигается к положительному полюсу образуя хорошо заметную муть (суспензию) (5), следовательно частицы глины заряжена отрицательно. Одновременно в цилиндре с (-) электродом (катодом) уровень воды поднялся, а в цилиндре с (+) полюсом опустился, что свидетельствует о положительном заряде воды. |
Дальнейшие изучение этих явлений показало, что они характерны для всех коллоидных систем. Движение частиц дисперсной фазы в электрическом поле к противоположно заряженному электроду получило название электрофореза.
Для определения причины поднятия воды в цилиндре с (-) полюсом, был поставлен следующий опыт. (рисунок 5).
|
|
Через U-образную трубку (1), средняя часть которой была заполнена кварцевым песком (2), пропускали электрический ток. После включения тока в колене с (-) электродом уровень воды поднялся, а в колене с (+) опустился. Это продолжалось до тех пор, пока разность уровней не достигла определенного значения. Причем количество перенесенной жидкости находится в прямой зависимости от приложенной разности потенциалов и диэлектрической проницаемости и обратно пропорционально вязкости этой среды. Процесс переноса жидкости через пористые диафрагмы и узкие капилляры получил названии электроосмос.
|
Позднее были открыты еще два электрокинетических явлений, противоположных выше указанным.
Первое явление: При механическом проталкивании воды через пористую диафрагму или через капилляр, на противоположных сторонах диафрагмы (капилляра) появляется разность потенциалов, препятствующая протеканию жидкости. Это явление носит название эффект протекания, а разность потенциалов на диафрагме – потенциал протекания.
Другое явление заключается в возникновении скачка потенциала, при механическом передвижении твердой части в жидкой фазе. Указанное явление (обратное электрофорезу) получило название эффекта седиментации, а скачек потенциала – потенциалом седиментации.
Таким образом электрокинетические явления можно обобщить следующим образом: а) э.д.с приложена извне:
1) Электрофорез – твердая фаза движется по отношению жидкой неподвижной;
2) Электроосмос – жидкая фаза движется относительно твердой неподвижной.
Б) Передвижение вызывает э.д.с:
1) Потенциал седиментации – твердая движется относительно жидкой.
2) Потенциал протекания – жидкая движется относительно твердой.
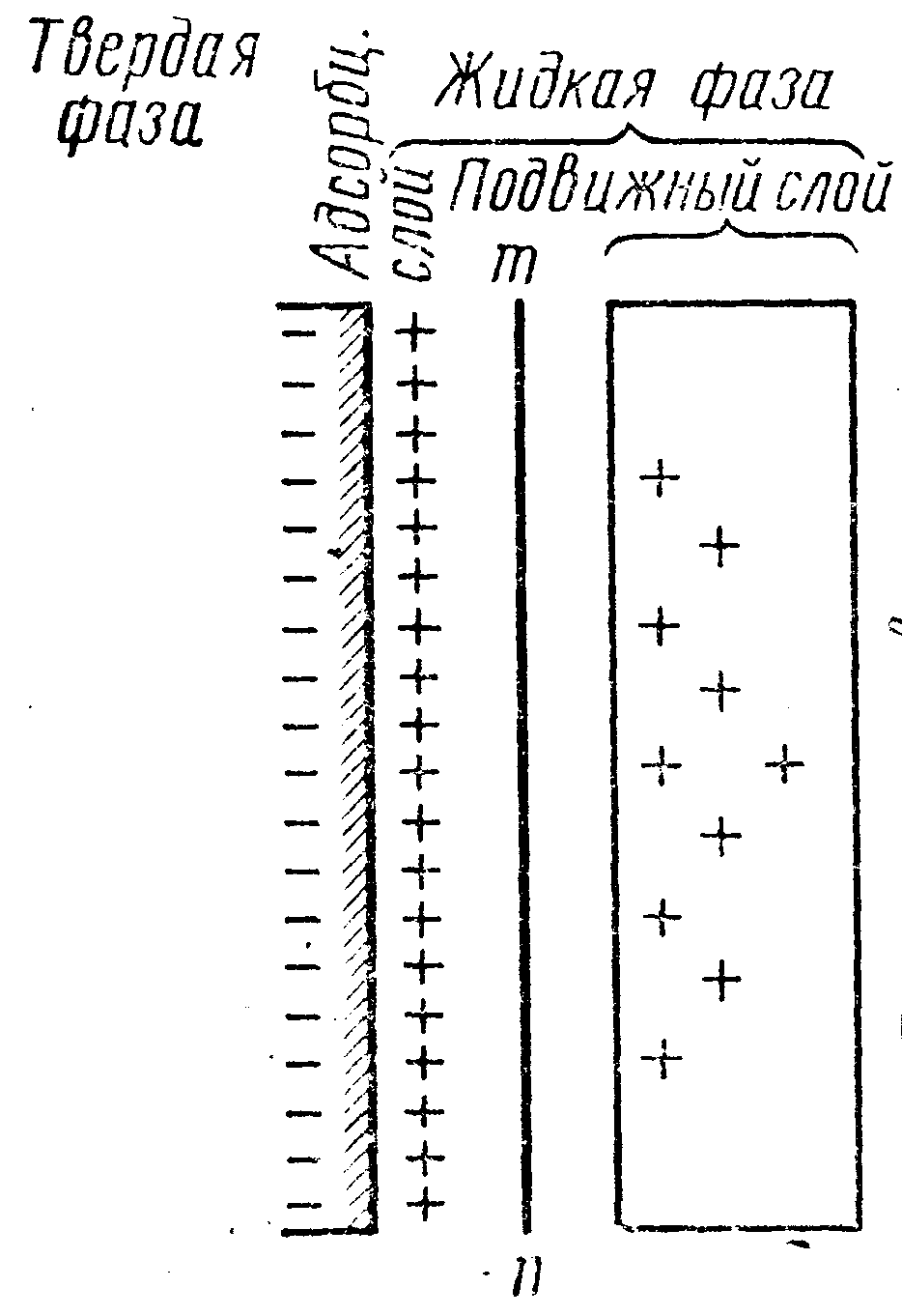
3. На основе изучения электрокинетического явления в коллоидных системах было установлено, что у поверхности коллоидных частиц на границе раздела фаз образуется двойной электрический слой и возникает скачек потенциала. Это обусловлено тем, что ионы одного знака необменно абсорбируются на поверхности абсорбента, а ионы противоположного знака в силу электростатического притяжения располагаются около нее. Знак заряда поверхности зависят от природы твердых частиц и от природы жидкости. Кроме того, заряд может возникнуть в результате диссоциации молекул поверхности частицы, ионы одного знака остаются фиксированными на поверхности, а другого уходят в раствор. Схема двойного электрического слоя рис. 6.
|
Рис. 6. |
Согласно теории двойного электрического слоя можно объяснить электрокинетические явления: движение твердой фазы к одному (+) полюсу происходит с адсорбционным слоем (до линии mn), т.е. твердая фаза имеет (-) заряд. К другому (-) полюсу движется жидкость с частью противоионов (правее линии mn) жидкость имеет (+) заряд. Разность потенциалов между подвижной и неподвижной частями двойного электрического слоя называют электрокинетическим потенциалом ().
Вычисление
проводят пользуясь данными электрофореза
и проводят по формуле:
|
где: К- const, зависит от формы коллоидных частиц(сферы К = 6; цилиндры К = 4); вязкость среды; D- диэл-я постоянная; Е- градиент напряжения поля; U- средняя скорость движения частиц под действием электрического поля.
4. Для описания строения коллоидных частиц на основе двойного элнктрического слоя была создана мицелярная теория строения, она применила в основном только для гидрофобных золей.
Основные положения мицелярной теории:
- Каждый гидрофобный коллоидный раствор состоит из мицелл и интермицелярной жидкости.
- Мицеллы это отдельные коллойднные частицы, которые составляют дисперсную фазу золя.
- Интермицелярная жидкость – это дисперсионная среда того же золя, включающая в себя помимо растворителя и другие вещества (растворенные) входящие в состав мицеллы.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь, состоящую из двух слоев (двух ионных сфер).
Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов или нейтральных молекул. Общее число входящих в состав ядра атомов или молекул огромно и зависит от степени дисперсности золя и от размеров самих атомов или молекул.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев – адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует многозарядный ион – катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоинов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоинов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ионы тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси.
Пример строения мицеллы приведен на рисунке 7.

Строение мицеллы принято выражать мицеллярными формулами:
- Положительно заряженная мицелла (n[ядро] m[Kat]+(m-x)[An]-)х+ х[An]-
- Отрицательно заряженная мицелла (n[ядро] m[An]-(m-x)[Kat]+)х- х[Kat]+
Мицеллярная формула коллоидного раствора полученного по реакции:
KI + AgNO3 ® AgI + KNO3
Может иметь вид
Если [KI] > [AgNO3]: [nAgI mI- (m-x)K+]x- xK+
Если [KI] < [AgNO3]: [nAgI mAg+ (m-x)NO3-]x+ xNO3-
Если [KI] = [AgNO3]: [nAgI mNO3- mK+]0
Исключения:
гидрозоль железа, полученного гидролизом FeCl3:
FeCl3 + H2O ® Fe(OH)3 + 3H2O или
FeCl3 + H2O ® FeOCl + 2H2O –
[nFe(OH)3 mFeO+(m-x)Cl-]x+ xCl- или
[nFe(OH)3 mFe3+ 3(m-x)Cl-]3x+ 3xCl- или
[nFe(OH)3 mH+ (m-x)Cl-]x+ xCl- .
строение золя кремневой кислоты: [nH2SiO3 mSiO32-2(m-x)H+]2x- 2xH+.
золя золота полученный реакцией восстановления:
2KAuO2 + 3HCHO + K2CO3 ® 2Au + 3HCOOK + KHCO3 + H2O –
[nAu mAuO2- (m-x)K+]x- xK+
золя серы полученный по реакции: 2H2S + O2 ® 2S + 2H2O –
[nS mS5O62- 2(m-x)H+]2x- 2H+.
5. По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ. Наиболее характерными оптическими свойствами коллоидных систем являются опалесценция, эффект Фарадея-Тиндаля и окраска.