6.При взаимодействии каких веществ можно получить следующее вещество:
|
O |
.А |
оксид углерода (IV) |
СН2—O—С |
|
|
|
| |
СН3 |
.Б |
метанол |
| |
| |
O |
. |
глицерин |
СН—O—С |
? |
В |
| |
СН3 |
|
|
| |
.Г |
уксусная кислота |
| |
O |
СН2—O—С |
СН3 |
.Д |
этаналь |
|
|
|
|
§10.2. Фенолы
•Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп
уатомов углерода бензольного кольца.
(Сравните положение ОН-групп в молекулах фенолов и ароматических спиртов.)
Фенолы
Одноатомные |
Двухатомные |
Трехатомные |
(аренолы АrОН, |
(арендиолы) |
(арентриолы) |
где Аr — арил, |
|
|
т. е. одновалентный |
|
|
Номенклатура и изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Многие фенолы имеют тривиальные названия.
Простейшие одноатомные фенолы:
С6Н5ОН Фенол (гидроксибензол)
СН3С6Н4ОН — Крезолы (метилфенолы, гидрокситолуолы)
о-Крезол |
м-Крезол |
п-Крезол |
(о-гидрокситолуол) |
(м-гидрокситолуол) |
(п-гидрокситолуол) |
Простейшие двухатомные фенолы:
С6Н4(ОН)2 — дигидроксибензолы
Пирокатехин |
Резорцин |
Гидрохинон |
(1,2-дигидрокси- |
(1,3-дигидрокси- |
(1,4-дигидрокси- |
бензол) |
бензол) |
бензол) |
В русской химической литературе для обозначения группы —ОН часто используется вместо приставки «гидрокси» приставка «окси», что не совсем правильно, так как «окси» — это просто кислород.
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа —ОН — положительным. Дипольный момент направлен в сторону бензольного кольца:

Как известно (см. § 9.8), гидроксильная группа —ОН является заместителем I рода, т. е. она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподеленных пар электронов атома кислорода ОНгруппы вступает в сопряжение с π-системой бензольного кольца. Смещение неподеленной пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи О—Н.
Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается на свойствах фенола.
Во-первых, повышается способность к замещению атомов водорода в о- и п-положениях бензольного ядра, и в результате реакций замещения обычно образуются три замещенные производные фенола (см. ниже).
Во-вторых, увеличение полярности связи О—Н под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу:
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые, как было рассмотрено в предыдущей теме, являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, t °плавл = 43 °С, t °кип = 182 °С, на
воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы — ОН и бензольного кольца.
I. Реакции с участием гидроксильной группы
Кислотные свойства
1)Диссоциация в водных растворах с образованием фено- лят-ионов и ионов водорода (см. выше).
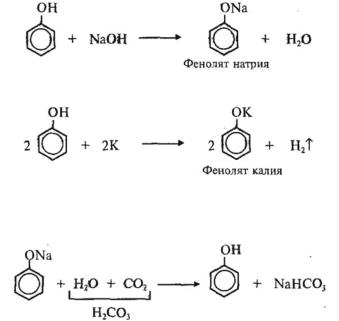
2)Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
3)Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):
Образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов (следовательно, фенол — еще более слабая кислота, чем угольная):
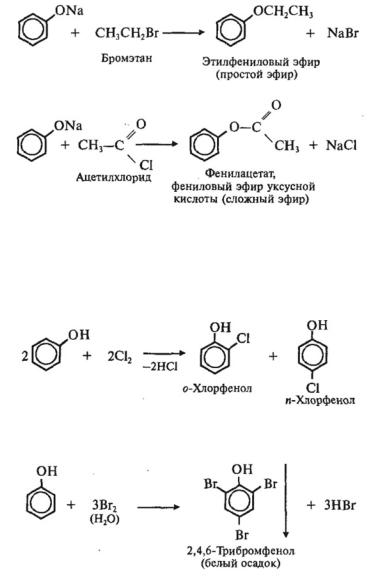
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола:
II. Реакции с участием бензольного кольца
1. Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1) Галогенирование
Особенно легко происходит бромироваиие в водных растворах, при этом сразу образуется 2, 4, 6-трибромфенол:
2) Нитрование
3) Сульфирование Соотношение о- и п-изомеров определяется температурой
реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t°= 100 °C — пара-изомер.
2. Реакции присоединения
Гидрирование
III.Качественные реакции на фенолы
Вводных растворах одноатомные фенолы взаимодей-
ствуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты.
Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
С6Н5ОН + NaOH C6H5ONa + Н2О
Фенолят натрия (промежуточный продукт)
C6H5ONa + H2SO4 C6H5OH + NaHSO4
Фенол
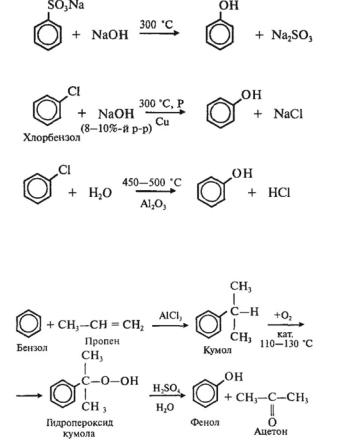
2.Сплавление солей аренсульфокислот со щелочью:
3.Взаимодействие галогенпроизводных ароматических УВ со щелочами:
или с водяным паром:
4.Кумольный способ.
Вкачестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:

|
В результате этих процессов получают два ценных продук- |
|
та — фенол и ацетон. |
|
|
|
Применение фенола |
|
Синтетические смолы |
|
Антисептик — 3—5 %-й |
|
и пластмассы |
|
раствор используется |
|
|
С6Н5ОН |
для дезинфекции |
|
Красители |
Синтез лекарственных |
|
|
|
|
|
препаратов |
|
Взрывчатые вещества |
Вопросы для контроля
1.Что такое фенолы? Чем фенолы отличаются от ароматических спиртов по химическому строению?
2.Как классифицируют фенолы?
3.Какие типы изомерии возможны для фенолов?
4.Приведите примеры одно- и двухатомных фенолов.
5.Объясните взаимное влияние атомов в молекуле фенола. Чем отличаются фенолы от спиртов по свойствам?
6.В каких реакциях проявляются слабокислотные свойства фенола?
7.Какие реакции характерны для бензольного ядра в молекуле фенола?
8.Какими способами можно получать фенолы?
Задачи и упражнения для самостоятельной работы
1. Назовите следующие соединения:
Какие из этих соединений относятся к фенолам и какие — к ароматическим спиртам?
2.Напишите структурные формулы изомерных фенолов и ароматических спиртов состава C8H10O.
3.Напишите структурные формулы следующих соединений: а) п-нит- рофенол; б) м-бромфенол; в) о-крезол; г) 1-фенилпропанол-1; д) 2,6-диметилфенол; е) 1,2,4-тригидроксибензол; ж) гидрохинон.

4.Напишите уравнения реакций щелочного гидролиза следующих соединений: а) хлорбензол; б) о-нитрохлорбензол; в) 2,4,6-тринитро- хлорбензол. Назовите продукты реакций.
5.Напишите уравнения реакций получения пикриновой кислоты из бензола.
6.Напишите уравнения реакций следующих превращений:
а)
б)
в)
г)
7.Напишите уравнения реакций получения из бензола: а) пирокатехина; б) гидрохинона.
8.Напишите уравнения реакций получения из бензола следующих соединений: а) о-крезол; б) 2,6-динитрофенол; в) трибромфенол; г) метоксибензол.
9.В трех пробирках находятся бутанол-1, этиленгликоль и раствор фенола в бензоле. При помощи каких химических реакций можно различить эти вещества? Напишите уравнения соответствующих
реакций.
10.На нейтрализацию смеси фенола с этанолом затратили раствор объемом 50 мл с массовой долей гидроксида натрия 18 % и плотностью 1,2 г/мл. Такая же масса смеси прореагировала с металлическим натрием массой 9,2 г. Определите массовые доли фенола и этанола в смеси.
11.14 г смеси ароматического углеводорода, являющегося гомологом бензола, и фенола обработали бромной водой, при этом выпало 33,1 г осадка (растворимостью пренебречь). Определить структурную формулу ароматического углеводорода, если известно, что его в исходной смеси находилось 0,05 моль.
§ 10.3. Альдегиды
Альдегиды являются представителями карбонильных соединений.
• Карбонильные соединения (оксосоединения) — это производные УВ, содержащие в молекуле карбонильную
группу С=О.
|
Оксосоединения |
Альдегиды |
Кетоны |
R = предельные, непредельные |
R, R’ = предельные, непре- |
или ароматические УВ радикалы |
дельные или ароматические УВ |
(как исключение: атом водорода –Н). |
радикалы. |
|
O |
|
Группа —С |
входящая в состав альдегидов, называется |
H
альдегидной группой.
• Альдегиды — это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Общая формула |
Класс альдегидов |
Примеры |
|
|
|
|
|
|
O |
Предельные |
O |
|
СnН2n+1–С |
|
(насыщенные) |
Н–С |
Метаналь |
(п 0) |
H |
|
H |
|
|
|
|
|
O |
|
|
|
СН3–СН2–С |
Пропаналь |
|
|
|
|
Н |
|
|
|
|
|