Кроме прямой гидратации этилена, существует также сернокислотная гидратация, протекающая в две стадии:
— на первой стадии этилен поглощается серной кислотой:
t°
Н2С=СН2 + H2SO4 — CH3—CH2—OSO3H;
—на второй стадии этилсерная кислота гидролизуется
собразованием этилового спирта и серной кислоты:
t°
CH3—CH2—OSO3H + Н2О — СН3—СН2—ОН + H2SO4
При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:
СН3—СН=СН2 |
H2SO4, t° |
+ Н2О ——— СН3—СН—СН3 |
Пропен |
| |
|
ОН |
|
Пропанол-2 |
|
(вторичный спирт) |
2. Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
t°
C2H5Cl + NaOH — С2Н5ОН + NaCl
Хлорэтан (водн. р-р) |
Этанол |
Обратите внимание, что при действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена (см. способы получения алкенов).
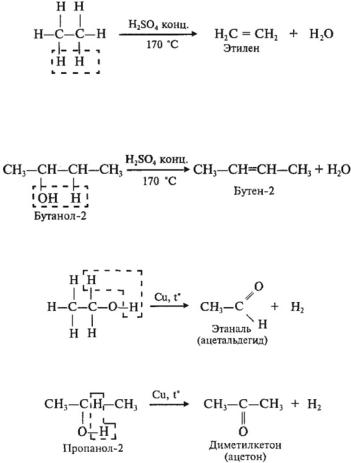
3. Гидрирование альдегидов и кетонов
Как уже было отмечено выше, дегидрирование спиртов по своей химической сущности является окислением. Обратная
реакция — гидрирование альдегидов и кетонов — является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Co) альдегиды восстанавливаются до первичных спиртов, а кетоны — до вторичных спиртов: