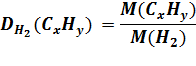CuO CuSo4 Cu CuO Cu(no3)2
-
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+
+ SO42–
→ Cu2+
+ SO42–
+ H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
-
CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
-
2Cu + O2 → 2CuO
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
-
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ +
2NO3–
→ Cu2+
+ 2NO3–
+ H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
|
Дано: |
Решение: |
|
mобр(CaC2) = 100 г ωприм = 15% |
85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л
mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л
|
|
V(C2H2) – ? |
Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2 Fe(oh)2 FeSo4 FeCl2
0 +1 –1 +2 –1 0
-
Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
-
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ +
2Cl–
+ 2K+
+ 2OH– →
Fe(OH)2↓
+ 2K+
+ 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
-
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2
+ 2H+
+ SO42–
→ Fe2+
+ SO42–
+ 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
-
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+
+ SO42–
+ Ba2+
+ 2Cl–
→ Fe2+
+ 2Cl–
+ BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
|
Дано: |
Решение: |
|
m(CH3COOH) = 120 г m(NaOH) = 60 г |
1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль
M(CH3COOH) = 60 г/моль M(NaOH) = 40 г/моль
m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
|
m(CH3COONa) – ? |
Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
|
Дано: |
Решение: |
|
m(CaC2) = 38,4 г |
38,4 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л
|
|
V(C2H2) – ? |
Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
|
Дано: |
Решение: |
|
m (HCl) = 73 г ω(NaOH) = 4% |
2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль
m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г
|
|
mр-ра(NaOH) – ? |
Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу вещества, содержащего 80% углерода и 20% водорода, если плотность по водороду равна 15.
|
Дано: |
Решение: |
|
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% |
M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль
m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г
ν(C) : ν(H)
= M(C2H6) = 24 + 6 = 30 г/моль |
|
CxHy – ? |
Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4
![]() CH3Cl
CH3Cl
![]() C2H6
C2H6
![]() C2H4
C2H4
![]() C2H5OH
C2H5OH
-
CH4 + Cl2
 CH3Cl
+ HCl
CH3Cl
+ HCl -
2CH3Cl + 2Na
 CH3–CH3
+ 2NaCl
CH3–CH3
+ 2NaCl -
CH3–CH3
 CH2=CH2
+ H2
CH2=CH2
+ H2 -
CH2=CH2 + H2O
 CH3–CH2OH
CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2
![]() CH3–CH3
CH3–CH3
![]() CH3CH2Cl
CH3CH2Cl
![]() CH3CH2OH
CH3CH2OH
![]() CH2=CH2
CH2=CH2
-
CH2=CH2 + H2
 CH3–CH3
CH3–CH3 -
CH3–CH3 + Cl2
 CH3CH2Cl
+ HCl
CH3CH2Cl
+ HCl -
CH3CH2Cl + KOH(водный р-р) → CH3CH2OH + KCl
-
CH3CH2OH
 CH2=CH2
+ H2O
CH2=CH2
+ H2O
19. Оксид кальция, полученный при прокаливании 20г карбоната кальция, обработали водой. Вычислите массу полученного продукта.
Дано: 20 г t X г
CaCO3 → CaO + CO2
m(CaCO3) = 20г 1 моль 1 моль
100г 56г
m (Ca(OH)2)
- ?
(Ca(OH)2)
- ?
x = 20 г * 56 г = 11,2г
100г
11,2г Yг
CaO + H2O → Ca(OH)2
1 моль 1 моль
56г 84г
 y
= 11,2г * 84г = 16,8г
y
= 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
 y
= 11,2г * 84г = 16,8г
y
= 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
20. Относительная плотность паров органического соединения по водороду равна 71. При сжигании 2,84г этого вещества образуется 4,48л углекислого газа и 3,96г воды. Выведите молекулярную формулу этого соединения.

Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г

CxHy - ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л

 C CO2
x = 12г *
4,48л = 2,4г
C CO2
x = 12г *
4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г

 2Н Н2О y = 2г
* 36г =0,44г
2Н Н2О y = 2г
* 36г =0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г

 V(С) :V(H)
= 2,4г : 0,44г = 0,2 : 0,44= 10 :22
V(С) :V(H)
= 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22)=120+22=142 г/моль
Ответ: C10H22



 =
2 моль в избытке
=
2 моль в избытке =
1,5 моль в недостатке
=
1,5 моль в недостатке