
- •Государственное бюджетное образовательное учреждение
- •Предисловие
- •Тематические разделы дисциплины «Химия»
- •1. 1. Растворы. Способы выражения концентрации растворов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.2. Введение в титриметрический анализ. Метод нейтрализации
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.3. Оксидиметрия. Перманганатометрия.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.4. Элементы химической термодинамики
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.5. Энергетика химических процессов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.6. Коллигативные свойства растворов. Осмос.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.7. Водородный показатель среды растворов – pH.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.8. Буферные системы
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.9. Электрохимия. Потенциометрия.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.10. Окислительно-восстановительные потенциалы и электроды
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.11. Комплексные соединения
- •Контрольные вопрросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.12. Поверхностные явления. Способы получения и свойства коллоидных растворов.
- •Контрольные вопросы
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.13. Свойства растворов высокомолекулярных веществ (вмв)
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.14. Биогенные элементы
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Темы рефератов
- •Литература
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •2.5. Требования безопасности по окончании работы
- •3. Кодификатор зачетной работы дисциплины «Химия» для студентов I курса специальностей
- •060101- Лечебное дело; 060103-педиатрия
- •Характеристика зачетной работы и инструкция по ее выполнению
- •Часть 2
- •Часть 3
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Приложения
- •1. Основные физико-химические константы
- •2. Важнейшие единицы си и их соотношение с единицами других систем
- •3. Приставки для дольных и кратных единиц си
Контрольные вопросы
Термодинамика. Основные понятия и термины. Система. Фаза. Классификация систем. Термодинамические параметры. Стандартные термодинамические параметры.
Термодинамические функции состояния системы. Внутренняя энергия. Первый закон термодинамики, формулировка, математическое выражение, философское значение, применение к биологическим системам.
Термодинамические функции состояния системы. Энтальпия. Энтропия. Энергия Гиббса. Химический потенциал.
Термохимия. Термохимические уравнения, их особенности. Закон Гесса. Энтальпии образования и сгорания. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса, формулировки, математические выражения, примеры.
Понятие о коэффициенте калорийности пищи. Коэффициенты калорийности основных компонентов пищи: белков, жиров и углеводов.
Типовые задачи
Задача 1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
Решение
1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»:
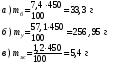
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 · 16,5 + 5,4 · 37,7 = 4992,705 кДж
Ответ: К = 4992,705 кДж.
Задача 2. Определить изменение энтальпии химической реакции:
2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж) , используя следующие данные:
Н0сгор С2Н5ОН(ж) = –1370,00 кДж·моль-1
Н0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1
Н0сгор Н2О(ж) = 0 кДж·моль-1
Решение:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем:
Н0р-я = Н0сгор. реагентов – Н0сгор. продуктов
Применительно к этой реакции:
Н0р-я = 2Н0сгорС2Н5ОН(ж) – Н0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) =
-2740,00 + 2720,04 = –19,96 кДж·моль-1.
Ответ: Н0р-я = –19,96 кДж·моль-1.
Задача 3. Определить стандартную энтальпию образования оксида меди (II) CuO(к), используя следующие данные:
1) 3CuO(к) + 2NH3(г) = 3Cu(к) + N2(г) + 3H2O(ж), H10 = –299,53 кДж·моль-1
2) 1/2N2(г) + 3/2H2(г) = NH3(г), H20 = –46,19 кДж·моль-1
3) H2(г) + 1/2О2(г) = H2О(ж), H30 = –285,838 кДж·моль-1
Решение:
Поскольку необходимо определить стандартную энтальпию образования оксида меди (II), то используя I-ое следствие из закона Гесса запишем:
Н0р-я = Н0обр. продуктов – Н0обр. реагентов
Применительно к 1-ой реакции:
Н0р-я = 3Н0обрCu(к) + Н0обрN2(г) + 3Н0обрН2О(ж) – (3Н0обрCuО(к) – 2Н0обрNH3(г)).
Учитывая, что в термохимии энтальпии образования простых веществ азота N2(г) и меди Cu(к) приняты равными нулю и раскрыв скобки, получаем следующее уравнение:
Н0р-я = 3Н0обрН2О(ж) – 3Н0обрCuО(к) – 2Н0обрNH3(г).
Переносим в левую часть уравнения Н0обрCuО(к) с обратным знаком и получаем:
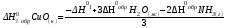
Подставим
числовые значения указанных параметров: 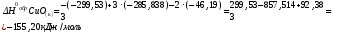
Ответ: Н0обр CuО(к) = - 155,20 кДж·моль-1.
Задача 4. Рассчитать величину стандартного изобарно-изотермического потенциала для следующей реакции: 2C4H10(г) + 5О2(г) → 4CH3COOH(ж) + 2Н2О(ж), используя следующие данные:
Н0р-я = –2267,94 кДж·моль-1
S0р-я = –866,30 Дж·моль-1
Решение:
Поскольку даны значения энтальпийного и энтропийного факторов, то для расчета стандартного изобарно-изотермического потенциала используем следующее уравнение:
G0р-я = Н0 – Т·S0
Прежде, чем подставить в это уравнение значения указанных параметров, необходимо перевести величину энтропийного фактора в кДж·моль-1. Это будет составлять –0,866 кДж·моль-1.
Подставляем цифровые значения указанных величин в приведенное уравнение. При этом учитываем, что стандартная температура составляет 298 К:
G0р-я= –2267,94 – 298 · (–0,866) = –2009,782 кДж·моль-1
Ответ: G0р-я= –2009,782 кДж·моль-1
