
- •Введение
- •Задание на проектирование
- •1 Материальный баланс процесса получения инвертного сиропа
- •1.1 Приготовление инвертного сиропа
- •1.2 Приготовление сахарного раствора
- •1.3 Определение объёма 10 % – ной соляной кислоты для проведения гидролиза
- •1.4 Определение количества 10 %-го раствора бикарбоната натрия для нейтрализации соляной кислоты
- •2 Тепловой баланс процесса получения инвертного сиропа
- •2.1 Тепловой баланс при нагревании сахарного раствора. Определение тепловой нагрузки и массового расхода теплоносителя
- •2.2 Тепловой баланс при охлаждении инвертного сиропа водой. Определение тепловой нагрузки, количества хладоагента и его массового расхода
- •3 Тепловые расчёты
- •3.1 Определение коэффициентов теплоотдачи и теплопередачи при обогреве реактора насыщенным водяным паром
- •3.1.1 Теплоотдача при механическом перемешивании
- •3.1.2 Теплоотдача при пленочной конденсации насыщенного пара
- •3.2 Определение коэффициентов теплоотдачи и теплопередачи при охлаждении реактора водой
- •3.2.1 Теплоотдача при механическом перемешивании
- •3.2.2 Теплоотдача при охлаждении реактора водой, проходящей через гладкую цилиндрическую рубашку корпуса к стенкам корпуса
- •4 Определение поверхности теплообмена и размеров рубашки, змеевика или трубчатки
- •4.1 Расчёт необходимой площади поверхности теплообмена при нагревании сахарного сиропа в емкостном реакторе
- •4.2 Расчёт необходимой площади поверхности теплообмена при охлаждении инвертного сиропа в емкостном реакторе
- •5 Технологический расчёт мешалки
- •6 Расчёт и выбор рамного фильтр-пресса
- •7 Расчёт пластинчатого насоса
- •8 Расчёт объёма и размеров ёмкостей
- •9 Автоматизированное управление процессом получения инвертного сиропа
- •Список литературы
- •МетодиЧні вказівки до виконання куросвого проекту «Розрахунок та автоматизація місткисного реактора з механічним перемішуючим пристроєм для виготовлення інвертного сиропа»
1.2 Приготовление сахарного раствора
Рассчитываем массу сахарного раствора mр-ра заданной концентрации при приготовлении его из 100 кг сахара по пропорции, кг [1]:
 , (1.1)
, (1.1)

Определяем количество воды mв , кг:
 , (1.2)
, (1.2)
 ,
,
Определяем объём воды V, м3:
 , (1.3)
, (1.3)
где
 –
плотность воды при заданной температуре,
кг/м3
[6].
–
плотность воды при заданной температуре,
кг/м3
[6].
 м3
м3
1.3 Определение объёма 10 % – ной соляной кислоты для проведения гидролиза
Для
гидролиза 62,5 кг сахарного раствора
рекомендовано взять 15 г HCl. Тогда для
проведения гидролиза 143 кг сахарного
раствора рассчитаем массу соляной
кислоты,
 ,
г,
по пропорции:
,
г,
по пропорции:
 , (1.4)
, (1.4)

Рассчитаем необходимое количество 10 %-го раствора соляной кислоты, необходимое для проведения гидролиза по формуле, г:
 , (1.5)
, (1.5)

Определим объём 10 %-го раствора соляной кислоты, л:
 , (1.6)
, (1.6)
где
 – плотность
10 %-го
раствора соляной кислоты при 20 С,
кг/м3
[1].
– плотность
10 %-го
раствора соляной кислоты при 20 С,
кг/м3
[1].

1.4 Определение количества 10 %-го раствора бикарбоната натрия для нейтрализации соляной кислоты
Реакция нейтрализации:
HCl + NaHCO3 = NaCl + H2O + CO2
Для нейтрализации 160 г соляной кислоты, зная молекулярную массу, по пропорции определим необходимое количество бикарбоната натрия, г.
 , (1.7)
, (1.7)

Тогда
количество 10 %-го
раствора бикарбоната натрия, г:  , (1.8)
, (1.8)

Определим объём 10 %-го раствора бикарбоната натрия, л:
 , (1.9)
, (1.9)
где
 – плотность
10 %-го
раствора бикарбоната натрия при 20 С,
кг/м3
[1].
– плотность
10 %-го
раствора бикарбоната натрия при 20 С,
кг/м3
[1].
 .
.
Результаты материального расчёта сводятся в таблицы.
Таблица 1.1 – Приход по материальному балансу процесса получения инвертного сиропа
|
Наименование сырья |
Приход | |||
|
Масса, G, кг |
Плотность, , кг/м3 |
Объем, V , л | ||
|
Вода |
226,67 |
998 |
938,5** |
267 |
|
Сахар |
400 |
1600, 900* | ||
|
10 %-й раствор соляной кислоты |
1,6 |
1048 |
1,53 | |
|
10 %-й раствор бикарбоната натрия |
3,55 |
1073 |
3,31 | |
|
Итого |
671,82 |
|
207,84 | |
|
Примечание: * – насыпная плотность, кг/м3; **– плотность 70%-го раствора сахара при 50°С. | ||||
Таблица 1.2 – Расход по материальному балансу процесса получения инвертного сиропа
|
Наименование сырья |
Расход | ||
|
Масса, G, кг |
Плотность, , кг/м3 |
Объем, V , л | |
|
Инвертный сироп |
671,82 |
958,5 |
271,84 |
|
Итого |
671,82 |
|
271,84 |
2 Тепловой баланс процесса получения инвертного сиропа
Химические процессы проводятся при строго определенных заданных температурных условиях и требуют подвода или отвода теплоты. Тепловой расчёт сводится в основном к составлению теплового баланса процесса, определению количества подводимой или отводимой теплоты, определению расхода теплоносителей или хладоагентов и вычислению площади поверхности теплообмена [3, 4].
2.1 Тепловой баланс при нагревании сахарного раствора. Определение тепловой нагрузки и массового расхода теплоносителя
Уравнение, выражающее тепловой баланс химического процесса, проходящего при нагревании глухим паром, может быть представлено в следующей форме:
 , (2.1)
, (2.1)
где
Q – тепловая
нагрузка, Дж;
 – теплота,
вносимая в аппарат с исходным сахарным
раствором, Дж;
– теплота,
вносимая в аппарат с исходным сахарным
раствором, Дж; – теплота,
отдаваемая теплоносителем исходному
сахарному раствору, Дж;
– теплота,
отдаваемая теплоносителем исходному
сахарному раствору, Дж; – теплота,
уносимая из аппаратасахарным
раствором, Дж;
– теплота,
уносимая из аппаратасахарным
раствором, Дж;
 – теплота
сконденсированного пара, Дж;
– теплота
сконденсированного пара, Дж;
 – тепловой
эффект реакции (принимаем равным нулю);
– тепловой
эффект реакции (принимаем равным нулю);
 ,
= 5 %
,
= 5 %
 .
.
Тепло, затраченное на нагрев исходного сахарного раствора, определяется по формуле:
 , (2.2)
, (2.2)

где
 – масса
сахарного раствора, кг;
– масса
сахарного раствора, кг; – удельная
теплоемкость сахарного раствора,
Дж/(кг
– удельная
теплоемкость сахарного раствора,
Дж/(кг К);
К); и
и  – соответственно
начальная и конечная температуры
сахарного раствора, °С.
– соответственно
начальная и конечная температуры
сахарного раствора, °С.
 , (2.3)
, (2.3)
 , (2.4)
, (2.4)
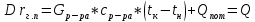 . (2.5)
. (2.5)
где

 и
и
 – соответственно энтальпии греющего
пара и конденсата, Дж/кг;
– соответственно энтальпии греющего
пара и конденсата, Дж/кг;
 – удельная
теплота парообразования при заданномPг.п
– удельная
теплота парообразования при заданномPг.п ,
Дж/кг [6]
,
Дж/кг [6] .
.
Определим тепловую
нагрузку 
 ,
Дж, необходимую для нагревания сахарного
раствора глухим насыщенным водяным
паром при
,
Дж, необходимую для нагревания сахарного
раствора глухим насыщенным водяным
паром при

 :
:
 . (2.6)
. (2.6)

Для этого рассчитаем

 по формуле (2.2), предварительно определив
удельную теплоемкость сахарного
раствора, Дж/(кг
по формуле (2.2), предварительно определив
удельную теплоемкость сахарного
раствора, Дж/(кг К)[7].
К)[7].
Для концентрированных двухкомпонентных водных растворов (а > 0,2, где а массовая доля растворенного компонента) расчёт ведут по формуле:
 , (2.7)
, (2.7)
где

 – удельная теплоемкость безводного
растворенного вещества (сахара),
Дж/(кг
– удельная теплоемкость безводного
растворенного вещества (сахара),
Дж/(кг К);
К);
 – массовая
доля сахара в смеси.
– массовая
доля сахара в смеси.
 ,
,
 ,
,
 .
.
Зная время
растворения сахара, в секундах
(заданная величина) определим тепловую
нагрузку 
 ,
Вт:
,
Вт:
 .
.
Определим количество греющего пара G, необходимого для нагревания сахарного сиропа до 80 С, кг:
 , (2.8)
, (2.8)
где

 – тепловая
нагрузка, Дж;
– тепловая
нагрузка, Дж;
 – удельная
теплота парообразования при заданномPг.п
– удельная
теплота парообразования при заданномPг.п ,
Дж/кг
(табл. 60. [6]).
,
Дж/кг
(табл. 60. [6]).
 .
.
Зная время растворения сахара, определим расход греющего пара D, кг/с:
 , (2.9)
, (2.9)
 .
.
